有关二氢黄酮的质谱裂解问题,数据如下: MS: 316(100) 298(9) 283(10) 269(3) 255(3) 196(34) 181(25) 170(34) 153(10) 这是全部的裂解数据。 化合物的结构式在附件里面,希望谁能帮我分析下怎么脱去一分子水和一个甲基,谢谢啦!
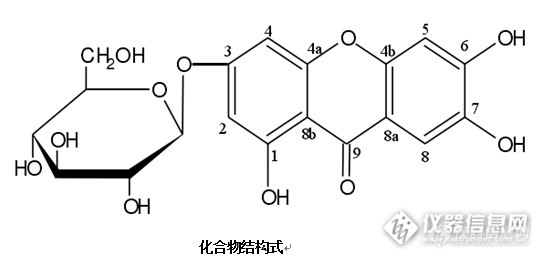
核磁共振波谱对一个黄酮化合物的结构分析与鉴定淡黄色粉末,mp 220~222℃。20D:-33.6(c,0.10,CH3OH);AlCl3反应呈阳性,提示该化合物为黄酮类化合物。ESI-MS谱给出准分子离子(m/z):421-;HRESI-MS给出+峰m/z:423.09159(计算值:423.09219),分子量为 422.08492,分子式为C19H18O11,不饱和度为 11.IR谱显示有酚羟基(3 356.9),羰基(1 649.4),苯环(1 602.2,1 472.7),碳氧键(1 288.4);http://ng1.17img.cn/bbsfiles/images/2014/10/201410301101_520798_2672081_3.png1H-NMR谱中,5.05(1H,d,J=7.5Hz)有一糖端基氢信号,δ 3.16~3.71 有糖上其它氢信号.http://ng1.17img.cn/bbsfiles/images/2014/10/201410301103_520799_2672081_3.png13C-NMR谱中,δ60~100 有一组糖信号,TLC原位酸水解检出葡萄糖,说明该化合物含有一分子葡萄糖。13C-NMR谱中,δ90~180芳香区有 14 个碳信号,减去一个葡萄糖端基碳,还有 13 个碳信号,根据有关文献,推断该化合物母核为黄酮类化合物。http://ng1.17img.cn/bbsfiles/images/2014/10/201410301104_520800_2672081_3.pngDEPT谱表明该化合物含有 1 个亚甲基,9 个次甲基,9个季碳,扣除葡萄糖的 1 个亚甲基,5 个次甲基,剩下 4 个次甲基,9 个季碳,表明该酮有四个芳氢被取代。δ179.1 为羰基碳信号,δ162.2,163.4,154.5,144.0,156.9,151.2 应为与氧相连的碳信号,除母核上两个连氧碳外,剩余四个碳应连有含氧基团。http://ng1.17img.cn/bbsfiles/images/2014/10/201410301105_520801_2672081_3.png13C-NMR谱中,除了一组葡萄糖信号和 酮母核信号外,未见其它碳信号,可以断定黄酮母核上的四个含氧取代基团均为羟基。1H-NMR谱中,δ7.38(1H,s)和δ6.88(1H,s)为两个孤立芳氢信号,δ6.62(1H,d,J=2Hz)和δ6.38(1H,d,J=2.0Hz)为一组间位偶合氢信号,说明黄酮母核两个芳环中一个被邻位取代,另一个被间位取代。http://ng1.17img.cn/bbsfiles/images/2014/10/201410301106_520802_2672081_3.png由以上信息可知,该化合物含有一个葡萄糖,一个 1,3,6,7-四羟基—黄酮。通过HSQC和HMBC,对该化合物的碳、氢信号进行了归属(如:表格)http://ng1.17img.cn/bbsfiles/images/2014/10/201410301109_520804_2672081_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/10/201410301109_520805_2672081_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/10/201410301109_520806_2672081_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/10/201410301109_520807_2672081_3.png结合HMBC谱发现,δ13.14 羟基氢与δ162.2(1 位碳)和δ98.2(2 位碳)及δ103.1(8b位碳)远程相关,证明此羟基连在 1 位碳上。δ6.38 氢与δ163.4(3 位碳)和δ162.2(1 位碳)及δ103.1(8b位碳)、δ94.2(4 位碳)远程相关,证明此氢连在 2 位碳上。δ6.6 氢与δ163.4(3 位碳)和δ156.9(4a位碳)及δ103.1(8b位碳)、δ98.2(2 位碳)远程相关,证明此氢连在 4 位碳上。δ6.88 [fon
黄酮总量检测和单个黄酮分析。黄酮总量分析依据到底是依据芦丁还是其他黄酮参加显色反应,测试波长410还是中510nm。而单个黄酮测试,必须用响应黄酮作标曲还是其他也可以参考。谢谢!
黄酮具有强抗氧化作用,对食物中脂肪、蛋白质、矿物质及其它微量元素有很好的分解消化吸收作用。黄酮的特性包括利肺、润肺、养肺,提升人体免疫力等。黄酮能被人体迅速吸收,能通过血脑屏障,能时入脂肪组织,进而体现出如下功能:帮助人体防御辐射、消除疲劳、保护血管、防动脉硬化、扩张毛细血管、疏通微循环、活化大脑及其他脏器细胞的功能、抗脂肪氧化、抗衰老。
谁有黄酮纯化的资料,具体怎么做?在纯化黄酮的时候

大家好,我是新手,最近想要用气质检测一个黄酮苷元组分,我查了些资料,有报道表明HP-5-MS(长30m,膜厚0.25um,内径0.25mm)可用于分析BSTFA+1%TMCS衍生化的黄酮苷元(见附件),我们学校的气质柱为Rtx-5MS(长30m,膜厚0.25um,内径0.25mm),似乎HP-5-MS和Rtx-5MS都是非极性的?所以我就用Rtx-5MS进行了分析,结果如下:黄酮苷元不经过衍生化直接进样1ul,GC/MS只出现一个黄酮苷元峰(之前我HPLC-DAD分析过有15-20左右黄酮苷元);经过衍生化后进样1ul分析,一个峰都没有;非常郁闷,不知道啥原因?是柱子不适合分析黄酮苷元?还是其他参数条件设置有问题?希望各位高手多多指教!http://ng1.17img.cn/bbsfiles/images/2011/06/201106010914_297216_1736519_3.jpg
[font=楷体_GB2312[size=4]]我看大部分文献是用显色反应,试剂是(亚硝酸钠,硝酸铝,氢氧化钠)第一个问题是他们与总黄酮含量关系怎样确定,及怎样的情况使显色剂过量?参比溶液一般是试剂空白(亚硝酸钠,硝酸铝,氢氧化钠)第二个问题是我觉得用乙醇,水,还是试剂空白,影响不大吧?因为在510出他们没有吸收第三个问题是参比溶液是试样空白更科学吧,既参比溶液为(样品+溶剂(水或乙醇溶液))?我看有一篇文献于村俞莎沈向红的《中草药总黄酮的提取和含量测定》他们选择的参比溶液是样品+氢氧化钠他们说考虑到某些中草药(如大黄等)遇碱也显红色,应从样品中扣除,故本法选择样品加碱作为样品空白扣除。我的疑问是在黄酮的定性上(加氢氧化钠,也是显红色),因为是在可见光驱,这样不就都扣除了,他们这样做行吗?请高人指点,谢谢[/size][/font]
请教各位有没有用保健食品检测方法做黄酮检测的。我最近做黄酮总是不太好,不知道是不是因为换了聚酰胺粉。请问有没有什么重要的注意事项,大家做回收率一般能做到多少?
我在测蜂胶黄酮时,色谱图上出了接近30几个峰,请问这些峰在相同的波长下都是黄酮类物质吗?是不是其他的物质?
我的样品是枸杞,测了四个品种枸杞的总酚和总黄酮含量,三个品种总酚含量高于总黄酮(但是差的不多,大概只高1mg),另外一个品种测了几次,抽了一天同时测定,数据就是总黄酮比总酚高!!! 但是总黄酮是总酚的一种,按理说应该总酚比较高,不知道为什么会有这种结果? 黄酮标品是芦丁,总酚是没食子酸 还有就是,我的样品直接用80%乙醇提取就开始测定,没有进行脱脂脱色等处理,因为也只是粗略测一下进行比较,会不会是因为没有脱色导致的?但是总黄酮含量高的那个品种没有太大的颜色,反而另外三种有颜色,如果不脱色影响会很大吗?不想脱色......没有试剂没有设备
实验原理黄酮类化合物是植物的重要次生代谢产物,也是一些保健品和中药材的有效成分之一。黄酮类化合物的定量方法常用的有HPLC法和分光光度法,在实际生产和科研过程中,对于黄酮单体的定量常采用HPLC法,而对总黄酮的测定,考虑到方法的简便、快捷以及可行性,多采用在碱性介质中加铝盐显色的分光光度法。在碱性条件下黄酮类化合物与铝盐形成络合物、在500nm波长处有最大吸收峰。标准品选用芦丁。试剂和器材一、试剂芦丁标准品。5%NaNO2;10%A1(NO3)3;5%NaOH;70%乙醇。二、材料新鲜银杏叶。三、器材容量瓶10ml(×7),25ml(×1),100ml(×2);吸管 0.5ml(×2),1ml(×2),2ml(×1),5ml(×1);分光光度计。操作方法一、制作标准曲线精密称取芦丁标准品5mg,用70%乙醇溶解,定容于25mL容量瓶中,摇匀,得0.2mg/mL的标准溶液。精确吸取标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2mL,分别置于10mL容量瓶中,加入 5%NaNO20.4mL,摇匀,放置6min;加入10%A1(NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH4.0mL,再加水至刻度,摇匀,放置15min。以试剂空白作为参比溶液。用1cm比色皿,在500nm波长处测定吸光度,绘制标准曲线。二、总黄酮的提取把新鲜的银杏叶低温烘干,使水分小于8%,制成干粉。精确称取干粉1.0g,置于 100mL容量瓶中,加入70%乙醇30mL,浸泡24h。超声波提取30min,过滤,滤液用70%乙醇定容于100mL容量瓶中,得到黄酮提取液,待用。三、测定吸取黄酮提取液1.00mL, 置于10mL容量瓶中,加入5%NaNO30.4mL,摇匀,放置6min;加入10%A1(NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH4.0mL,再加水至刻度,摇匀,放置15min。以试剂空白作为参比溶液。用1cm比色皿,在500nm波长处测定吸光度,由标准曲线法计算总黄酮含量。注意事项对于某些热敏成分的提取,采用超声波破碎法效果较为理想。由于此过程是一个物理过程,浸提过程中无化学反应,被浸提的生物活性物质在一定时间内保持不变。
硝酸铝显色法测定总黄酮的原理为:在中性或弱碱性及亚硝酸钠存在条件下,黄酮类化合物与铝盐生成螯和物,加入氢氧化钠溶液后显红橙色,在510nm波长处有吸收峰且符合定量分析的比尔定律,一般以芦丁标准品定量。 先用亚硝酸钠还原黄酮, 然后加入硝酸铝络合,最后加氢氧化钠溶液使黄酮类化合物开环,生成 2''''羟基查耳酮而显色。显色原理发生在黄酮醇类成分邻位无取代的邻二酚羟基部位,不具有邻位无取代邻二酚羟基的黄酮醇类成分加入上述试剂时不显色。用亚硝酸钠还原黄酮,还原那个基团?硝酸铝络合,与那个基团?
请问黄酮的标准溶液放置时间长了,里面的物质会发生变化吗?
用液相测黄酮进样6次,在class-vp工作站中如何求得平均值。
采用回流提取的方法,并结合大孔树脂吸附分离,富集并浓缩得到总黄酮和总多糖,用分光光度法测定总黄酮和总多糖含量,通过大孔吸附树脂分别得到含量为105.2%的总多糖及含量为5.3%的总黄酮,则大枣中总黄酮含量为0.11%,总多糖含量为16.43%。运用大孔吸附树脂可以同步提取大枣中的总多糖和总黄酮,对总多糖提取率高,有利于大枣的综合利用,为其质量控制提供参考。
总黄酮测试和芦丁测试,总黄酮测试波长建议420nm(需要络和在碱性溶液中显色),而芦丁标准品也在如此处理后的最大吸收波长在507nm。如此二者测试对总黄酮含量的影响?!
谁知道对异黄酮展开效果好点的展层剂和比较专一的显色剂 请高手指点一下 或者谁有更好的异黄酮定性的方法 请指点一下 最近提取到新的物质 初步怀疑是这个异黄酮 想确定一下 谢谢高手指点
使用紫外分光光度计测黄酮含量 加入亚硝酸钠,硝酸铝等后产生絮状物是怎么回事?测吸光度前 定容前过滤和定容后过滤对此影响大不大?
在做总黄酮含量测定时,为什么要显色?不显示也可以啊!
化妆品中补骨脂特征成分补骨脂素、异补骨脂素、新补骨脂异黄酮和补骨脂二氢黄酮的检测方法1 适用范围 本方法规定了用高效液相色谱法定性检测化妆品中补骨脂特征成分补骨脂素、异补骨脂素、新补骨脂异黄酮和补骨脂二氢黄酮的方法。 本方法适用于化妆品中补骨脂特征成分补骨脂素、异补骨脂素、新补骨脂异黄酮和补骨脂二氢黄酮的定性测定。2 方法提要 样品在经过提取后,经高效液相色谱仪分离,二极管阵列检测器检测,经与平行操作的补骨脂素、异补骨脂素、新补骨脂异黄酮和补骨脂二氢黄酮对照品及补骨脂对照药材比较,以保留时间和紫外光谱图定性,鉴别补骨脂特征成分补骨脂素、异补骨脂素、新补骨脂异黄酮和补骨脂二氢黄酮的存在。本方法对补骨脂素、异补骨脂素、新补骨脂异黄酮和补骨脂二氢黄酮的检出限和取样品0.5 g时的检出浓度见表1。 表1 4种补骨脂特征成分的检出限和检出浓度化合物检出限(ng)检出浓度(μg/g)补骨脂素0.30.6异补骨脂素0.30.6新补骨脂异黄酮0.30.6补骨脂二氢黄酮0.30.63 试剂和材料 除另有规定外,所用试剂均为分析纯,水为实验室用一级水。3.1 乙腈,色谱纯。3.2 补骨脂素,纯度≥99%。3.3 异补骨脂素,纯度≥99%。3.4 新补骨脂异黄酮,纯度≥98%。3.5 补骨脂二氢黄酮,纯度≥99%。3.6 补骨脂,中国食品药品检定研究院,供鉴别用。3.7 补骨脂特征性成分混合标准溶液(=0.1 μg/mL):分别称取补骨脂素(3.2)、异补骨脂素(3.3)、新补骨脂异黄酮(3.4)、补骨脂二氢黄酮(3.5)对照品各5 mg(精确到0.1 mg),置500 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,配制成质量浓度各为10 μg/mL的标准溶液。精密量取各标准溶液0.1 mL置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得0.1 μg/mL的混合标准溶液。3.8 补骨脂标准储备溶液:取补骨脂对照药材0.2 g,置50 mL三角瓶中,加30 mL 70%乙醇回流提取1h,滤过,滤液置100 mL量瓶中,加70%乙醇稀释至刻度,摇匀,即得。4 仪器4.1 高效液相色谱仪:具二极管阵列检测器。4.2 分析天平:感量为0.1 mg。4.3 移液器。4.4 涡旋振荡器。4.5 超声波清洗仪(功率不低于200W)。4.6 高速离心机:转速不小于10000 r/min。
各位高手,想请教蜂胶中黄酮的检测是通过什么方法?高效液相色谱法吗?能将其黄酮的各种成分进行检测吗?
各位大佬,有个很粗浅但又没法在教科书上找到的问题想请教下大佬们!我再测总黄酮的含量,使用硝酸铝显色,然后我参比池是该放我用的试剂 (乙醇)还是该放空白对照(试剂乙醇+亚硝酸钠+硝酸铝)?
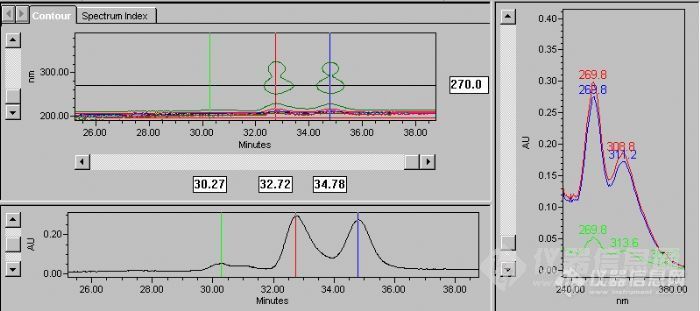
Introduction 黄酮类化合物泛指两个具有酚羟基的苯环(A环和B环)通过中央三碳原子相互连结而成的一系列化合物,其基本母核为2-苯基色原酮。黄酮类化合物结构中常连接有酚羟基、甲氧基、甲基、异戊烯基等官能团。黄酮类小部分以游离态(苷元)的形式存在,多数与糖结合成苷。绝大多数植物体内都含有黄酮类化合物,它在植物的生长、发育、开花、结果以及抗菌防病等方起着重要的作用。 本实验研究对象为某中药中一个黄酮类化合物的代谢,本次发表的为代谢产物某流分的定性分析,该流分含有3个代谢产物,我们用Ultimate XB-C18柱和国外某名牌色谱柱对该流分进行了定性分析比较。1.Chemical and reagents 甲醇(色谱纯,天津大茂),水(哇哈哈纯净水,杭州),三氟乙酸(TFA, Dikma, USA),其它试剂均为分析纯。2.HPLC analysis of an unknown sample Waters 高效液相色谱系统,由Waters Model 600 controller液相色谱,Millennium 32 工作站,Model Delta 600 泵,以及Waters 996 DAD检测器组成。 色谱柱:Ultimate XB-C18柱(5μm, 4.6x250mm)和国外某品牌色谱柱(5μm, 4.6x250mm)(用column X表示,投入使用约半年) 流动相:A通道:甲醇,B通道:水(0.05%TFA)=(45:55, v/v)或A通道:甲醇,B通道:水(0.05%TFA)=(40:60, v/v) 流 速:0.6mL/min 柱 温:35℃ 检测波长:190-400nm扫描 进样量:20μL3.Sample preparation 因为涉及保密内容,此部分略去。4.Results and discussionhttp://ng1.17img.cn/bbsfiles/images/2011/05/201105181521_294755_2160661_3.jpgFig.1 Chromatogram of sample solution analyzed by column Xhttp://ng1.17img.cn/bbsfiles/images/2011/05/201105181522_294756_2160661_3.jpgFig.2 Chromatogram of sample solution analyzed by Ultimate XB-C18 columnhttp://ng1.17img.cn/bbsfiles/images/2011/05/201105181523_294757_2160661_3.jpgFig.3 Chromatogram of sample solution analyzed by column X(Fig.1的局部放大图)http://ng1.17img.cn/bbsfiles/images/2011/05/201105181524_294758_2160661_3.jpgFig.4 Chromatogram of sample solution analyzed by Ultimate XB-C18 column(Fig.2的局部放大图)http://ng1.17img.cn/bbsfiles/images/2011/05/201105181525_294759_2160661_3.jpgFig.5 Chromatogram of sample solution analyzed by Ultimate XB-C18 column(流动相比例降低后) 从图1和图2比较结果可以看出,该样品共含有3种黄酮类成分,DAD检测器给出其最大紫外吸收~270nm,~310nm,从紫外吸收还可以看出,这3种成分结构相似,其保留时间也很近。我们可以看出Ultimate XB-C18柱表现出了更好的分离度,而且展现了更好的峰形。 图3和图4是图1和图2的局部放大图,可以观察到色谱峰的保留时间,图5是将流动相比例降低后用Ultimate XB-C18柱再次分析的结果,虽然没有完全达到基线分离,但结果也是不错的。 该实验只是对代谢产物某流分中的3种黄酮类化合物进行定性分析,没有进行其它条件的考察,比如流动相加不同的酸,加酸的量(pH),以及在乙腈水系统下进行考察,这些将在后续实验中补充。5.Conclusions 我们通过一个简单的定性实验,即中药某成分代谢产物的分析,比较了2种色谱柱对该流分中3种黄酮类化合物分离能力的研究,结果显示Ultimate XB-C18柱丝毫不落下风,反而表现出了神勇的分离能力。在未来的实验中,Ultimate色谱柱会一直伴随该项目的研究,我们会有更加精彩的结果发表出来,供大家分析讨论。
怎样使黄酮色谱峰分离更好?
[color=#333333]甘草是一种药食同源的草本植物,广泛用于中药处方与食品工业中。现今使用的甘草主要为其根与根状茎,而地上部分却作为畜牧饲料或燃料低值化处理。目前关于甘草根及根状茎的成分及生理活性研究已相当充分,而对甘草地上部分却研究较少。本论文通过对比分析光果甘草(Glycyrrhiza glabra L.)叶与根中物质组成和生理活性,确定光果甘草叶的研究价值 通过色谱分离和光谱技术分离并鉴定了光果甘草叶中的黄酮并对其活性进行评价 优化了光果甘草叶黄酮的测定和提取方法,并通过大孔树脂对光果甘草叶黄酮进行富集研究 研究了光果甘草叶黄酮对猪肉及其制品储藏过程中油脂氧化和蛋白氧化的抑制作用,以期为甘草叶的高值利用提供理论指导。[/color]
求救!请问各位,有遇到测定总黄酮出现沉淀的情况吗?什么原因,如何处理(除离心、过滤外)。万分感激。
哪位大侠知道黄酮类标准品的有效时间是多少????????????、、、[em04]
[color=#3e3e3e]异黄酮的功能与人体自然分泌的雌激素相似,能缓解更年期症状,大豆和豆制品是最佳来源,如豆粉、豆浆、豆豉、豆腐、豆皮等。[/color]
用紫外测定总黄酮含量时,常会遇到一些问题!!欢迎大家积积讨论,关于显色剂的影响!!
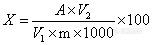
[align=center]胶囊中总黄酮的测定方法验证[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:肖颖[/align]一、目的:对《保健食品检验与评价技术规范》(2003版)中总黄酮测定方法进行方法适用性验证。二、验证内容:方法适用性验证包括检出限、线性范围、重复性、回收率、耐用性。三、验证方法:1 范围 本标准适用于胶囊中总黄酮的含量测定。2 原理 试样中黄酮经乙醇提取,聚酰胺粉吸附,以苯除去杂质,用甲醇洗脱黄酮后,在360nm有最大吸收,其吸收值与黄酮量在一定范围内成正比,与标准系列比较定量。3 试剂和材料3.1 试剂实验室用水为双蒸馏水,所用试剂为分析纯级。3.1.1 无水乙醇:分析纯。(来源:天津奥普升化工有限公司 批号:20161019)3.1.2 芦丁标准溶液:(来源:上海金穗生物科技有限公司 批号:20161027)称取5.0芦丁,加甲醇溶解并定容至100mL。3.1.3 甲醇(来源:天津市天力化学试剂有限公司 批号:20150408 )3.1.4 聚酰胺粉(来源:浙江省台州市路桥四甲生化塑料厂 批号:201600409 )3.1.5 苯(来源:天津市科密欧化学试剂有限公司 批号:20140510 )以上试剂符合检测要求4 仪器和设备4.1超声波清洗器:昆山市超声仪器有限公司 型号:KQ5200B4.2电子天平:沈阳龙腾电子有限公司 型号:JM-B10002 精度:0.0001g4.3分光光度计:北京普析通用仪器有限责任公司 型号:TU-1901或同等程度仪器 以上仪器符合检测要求5 波长选择专属性实验取芦丁标准溶液(3.1.2)1.0mL加乙醇(3.1.1)定容至25mL,摇匀后,超声20min,吸取上清液1.0mL于蒸发皿中,加1g聚酰胺粉(3.1.4)吸附,于水浴上挥去乙醇,然后转入层析柱。先用20mL苯(3.1.5)洗,苯液弃去,然后用甲醇(3.1.3)洗脱,定容至25mL,以甲醇(3.1.3)为参比,进行紫外可见光谱扫描,同时对样品空白进行扫描。6 试样处理样品提取:称取1.0g左右试样,加乙醇(3.1.1)溶解并定容至25mL,摇匀后,超声提取20min,吸取上清液1.0mL于蒸发皿中,加1g聚酰胺粉(3.1.4)吸附,于水浴上挥去乙醇,然后转入层析柱。先用20mL苯(3.1.5)洗,苯液弃去,然后用甲醇(3.1.3)洗脱黄酮,定容至25mL,为待测液。7 测定:标准曲线绘制:分别移取0、1.0、2.0、3.0、4.0、5.0mL芦丁标准溶液于10mL比色管中,加甲醇(3.1.3)至刻度,摇匀。用1cm石英比色皿在360nm处比色,测其吸光度。以吸光度为横坐标,总黄酮含量为纵坐标绘制校正曲线。同时取待测液在360nm测定吸光度,计算试样中总黄酮含量。8 公式试样总黄酮含量按下式进行计算。[img=,153,45]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091803387785_8072_2904018_3.png!w153x45.jpg[/img]式中:X—样品中总黄酮的含量,mg/100g; A—样品测定液中黄酮的含量,μg;m—样品质量,g;V[sub]1[/sub]-测定用样品液体积,mL;V[sub]2[/sub]-试样定容体积,mL。计算结果保留二位有效数字。四、验证数据1.波长选择经过全波长扫描,芦丁标准溶液在360nm处有最大吸收峰,且试剂空白和样品空白在此波长处无干扰,故选择360nm为最佳测定波长。[img=,690,546]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091803507036_5107_2904018_3.png!w690x546.jpg[/img]2.线性范围以总黄酮含量(C)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线,进行线性回归,得回归方程:A=0.0029C-0.0069 R[sup]2[/sup]为0.999。[table][tr][td][align=center]总黄酮含量(μg)[/align][/td][td]0[/td][td]52[/td][td]104[/td][td]156[/td][td]208[/td][td]260[/td][/tr][tr][td][align=center]A[/align][/td][td]0[/td][td]0.133[/td][td]0.284[/td][td]0.445[/td][td]0.598[/td][td]0.730[/td][/tr][/table][align=center][img=,482,290]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091803598216_9725_2904018_3.png!w482x290.jpg[/img] [/align]以上结果表明总黄酮在0-260μg范围内,吸光值与总黄酮含量线性良好,符合要求。3. 检出限以甲醇(3.1.3)为参比,同时在360nm处对标准曲线0管进行20次测定,计算标准偏差,以3倍标准偏差值与斜率的比值为最低检出含量,利用公式计算出检出限。经测定,标准偏差为0.000366,最低检出含量为0.379μg,检出限为1.0mg/100g,满足胶囊中对检出浓度的要求。4.重复性称取6份试样按照上述处理方法进行试样处理,分别吸取适量样液进行比色,求得样液中总黄酮含量。[table][tr][td][align=center]测定编号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]样品含量mg/100g[/align][/td][td]323.1[/td][td]318.9[/td][td]320.2[/td][td]326.1[/td][td]324.6[/td][td]322.7[/td][/tr][tr][td][align=center]平均值mg/100g[/align][/td][td=6,1][align=center]322.6[/align][/td][/tr][tr][td][align=center]相对标准偏差%[/align][/td][td=6,1][align=center]0.831[/align][/td][/tr][/table]由上表可知,试样中总黄酮测定的重复性均值为322.6,RSD值为0.831%,符合规定。5.回收率在进行重复性试验基础上,同时进行加标试验,加标量分别为1.2倍,1.0倍,0.8倍,结果见下表:[table][tr][td][align=center]测定编号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]样品含量mg/100g[/align][/td][td]323.1[/td][td]318.9[/td][td]320.2[/td][td]326.1[/td][td]324.6[/td][td]322.7[/td][/tr][tr][td][align=center]加标量mg/100g[/align][/td][td][align=center]347.30[/align][/td][td][align=center]354.98[/align][/td][td][align=center]304.81[/align][/td][td][align=center]309.28[/align][/td][td][align=center]251.82[/align][/td][td][align=center]258.99[/align][/td][/tr][tr][td][align=center]加标样品含量mg/100g[/align][/td][td]651.22[/td][td]659.02[/td][td]630.58[/td][td]649.8[/td][td]549.98[/td][td]567.79[/td][/tr][tr][td][align=center]加标回收率%[/align][/td][td]94.48 [/td][td]95.81 [/td][td]101.83 [/td][td]104.66 [/td][td]89.50 [/td][td]94.63 [/td][/tr][/table]由上表可以看出胶囊中总黄酮测定的加标回收范围在80%-120%,符合规定。6.耐用性同时进行人员比对和仪器比对检测胶囊中总黄酮,结果见下表。[table][tr][td]编号[/td][td]人员1[/td][td]人员2[/td][td]仪器1[/td][td]仪器2[/td][/tr][tr][td]样品含量mg/100g[/td][td]322.8[/td][td]325.7[/td][td]322.1[/td][td]323.7[/td][/tr][tr][td]相对误差%[/td][td=2,1][align=center]0.89[/align][/td][td=2,1][align=center]0.50[/align][/td][/tr][/table]由上表可知,胶囊中总黄酮测定耐用性符合要求综上所述:从波长选择、检出限、线性范围、重复性、回收率、耐用性测试结果可知,均符合方法要求,本实验方法符合胶囊中总黄酮测定。