怎样区分亚铁氰化钾和亚铁氰化钠?
急需硫化亚铁的扫描电镜图片,要是有其他硫化物的图片更好了,谢谢各位盆友了
配亚铁溶液,用亚铁铵还是用7水的?
京一家豆腐作坊生产臭豆腐时,添加了一种叫硫酸亚铁的物质。经了解,这家黑作坊使用的硫酸亚铁属于工业原料,而且对人体有害。相关部门已经查处了这家黑作坊。在一座废弃的砖窑边有几排房子,房子原来属于砖窑,其中一家是豆腐作坊。执法人员在里边发现了一袋粉状物质,呈淡绿色。上面的化学分子式是“FeSO4·7H2O”,经确认,这就是硫酸亚铁。经检查,这家作坊根本没有证照,属于黑作坊。该作坊生产时间不超过一年,期间曾被取缔过一次。对于硫酸亚铁是否对有人体危害性,小作坊主表示不确定,同时称在兑菜点就有人卖这个,用法也很简单。而至于生产量,徐某自称每天大概生产三百多块臭豆腐,卖价也就是几虽然该作坊也登记了销量记录,但非常简单,根本看不出具体的流向,只有大致数量和销售额。相关部门已经勒令该作坊立即停止生产,对于其生产设备予以清理。雨花台区食安办负责人表示,该作坊首先是存在无证生产的问题。另外,添加的化学物质可能对人体造成伤害,因此他们会调查其销量等,如果构成违法,将会移送相关部门进行调查处理。
一篇题为《中盐之恶,触目惊心!》的自媒体文章刷屏朋友圈,文中“食盐添加亚铁氰化钾导致慢性中毒”的说法令大家担忧。文中讲述了“中央党校余教授”的亲身经历:余教授此前肾脏出现问题,经一一排查后发现罪魁祸首正是食盐中的抗结剂亚铁氰化钾。改为食用不含抗结剂的盐之后不久,所有的症状都消失了,化验单恢复正常。文章作者就此得出结论,“食盐添加剂是多么可怕”,“中国人早晚会从地球消失”。截至目前,该文章访问量已超10万次。不少人留言直斥盐业公司“对全民下毒”,并询问何处能买到不含亚铁氰化钾的食盐。事实果真如此吗?我国允许的食盐抗结剂有亚铁氰化钾、亚铁氰化钠、柠檬酸铁铵、硅铝酸钠、二氧化硅和硅酸钙,综合考虑工艺、成本、效果等因素,其中以亚铁氰化钾最常用。2014年12月,原国家卫计委发布的《食品安全国家标准食品添加剂使用标准》明确规定,盐及盐制品可添加亚铁氰化钾作为抗结剂使用。“食用盐里使用抗结剂,是世界各国普遍采取的措施,其中亚铁氰化钾(钠)在国外市场上销售食盐中时常可见。作为合法食品添加剂的亚铁氰化钾加入食盐中,其安全性不用担心。事实上,“食盐含亚铁氰化钾致慢性中毒”的传闻并不新鲜。早在六七年前就有网友发帖讨论,2017年、2018年此类自媒体文章更是频繁出现,并多数出自“中央党校余教授”的亲身经历。为此,全国盐业标准化技术委员会曾于2018年8月27日发布《就近日有关自媒体传播“盐里面加进了亚铁氰化钾”危害消费者健康不实信息的有关说明》,驳斥传闻。说明指出,目前我国制盐行业在食盐中添加抗结剂“亚铁氰化钾”,是严格按照原国家卫计委发布的《食品安全国家标准食品添加剂使用标准》(GB2760)执行的,我国食盐安全是有保障的。

酸性条件下,氯化亚锡能还原亚铁离子吗,经氯化亚锡还原后的三价铁离子溶液为什么是无色的,是氯化亚锡可以直接把铁离子氧化成铁单质吗,如果不是那在酸性条件下这个溶液应该呈氯化亚铁溶液的黄绿色才对吧?http://ng1.17img.cn/bbsfiles/images/2013/08/201308310907_461079_1638724_3.jpg
试亚铁林在测COD中的显色原理是怎么样的?标定硫酸亚铁铵是直接标定还是在测完空白后再加入重铬酸钾进行滴定?哪种方法更好?试亚铁试剂在测完空白后进行标定硫酸亚铁铵中的显色原理?
请教硫酸亚铁铵溶液在一天的时间内浓度变化大吗?试亚铁灵指示剂的有效期为多少?隔多长时间要重新配制.另外加入的量需要很精确吗?如果要求加入三滴试亚铁灵指示剂,这个量如何掌握?
对于河涌淤泥上覆水,将水样调节到还原条件下,滴定测定亚铁离子浓度,作为铁离子总浓度;同时不调节水样氧化还原电位直接测定水样中亚铁离子浓度,但亚铁离子浓度总高于总铁离子浓度,不知为何?望高手指教?
由于硫化亚铁极易被氧化,如何获得纯净的硫化亚铁,并加入培养基中?求助
食品添加剂——亚铁氰化钾 [align=center]马恒一[/align]摘要:以文献调研为方法,研究食品级亚铁氰化钾的化学组成、理化性质、限量标准、工业应用、检测方法.本文为亚铁氰化钾的化学组成、理化性质、工业应用、限量标准、检测方法的相关综述.关键词:食品添加剂、亚铁氰化钾、理化性质、限量标准、检测方法亚铁氰化钾是一种常用的食盐抗结剂,但是大众对它的实际毒性缺乏一定的认识,以至于经常大幅度夸大它的毒性和危害性,实际上它是一种非常安全的食品添加剂,本文将简要介绍它的化学组成、理化性质、工业应用、限量标准及检测方法。1 亚铁氰化钾的化学组成亚铁氰化钾(K4[Fe(CN)6])是经典的Werner型配合物,其外界是钾离子K+,内界是由六个氰根CN-与一个亚铁离子Fe2+通过碳原子配位键合而成的正八面体配合物亚铁氰根[Fe(CN)6]4-,阴阳离子以1:4组成离子化合物晶体。其常见的水合状态是三水合物K4[Fe(CN)6]3H2O和无水物K4[Fe(CN)6]。2 亚铁氰化钾的理化性质2.1 亚铁氰化钾的物理性质2.1.1 主要物理性质其外观为浅黄色颗粒或粉末,无气味,其稀水溶液颜色极为浅淡,近乎无色;分子量为368.35g/mol(无水物),422.388g/mol(三水合物),三水合物密度为1.85g/cm3,三水合物20℃下在水中溶解度为28.9g/100mL,微溶于丙酮,难溶于乙醇和醚类[1],其摩尔磁化率为-130.0×10-6cm3/mol [1],呈抗磁性。2.1.2 结构参数无水物:a=4.18, b=14.01, c=21.04 A α=β=γ=90°正交晶系,Cmcm空间群[2]角柱状三水合物:a=9.38~9.40, b=16.84~16.88, c=9.39~9.41 A α=γ=90°, β=90.69~90.096°单斜晶系,C2/c空间群[2]六边形三水合物晶体:a=9.39~9.41, b=9.39~9.41, c=33.67~33.72 A α=β=γ=90°四方晶系,I41/a空间群[2]2.2 亚铁氰化钾的化学性质亚铁氰根化学性质稳定,主要体现在配合物不稳定常数K不稳极低,只有10-35;其根本原因是氰根碳端配位能力非常强,最高占据轨道能量高,易于填入Fe2+的空d轨道,同时氰根为π酸配体,其缺电子的π轨道能接受Fe2+充满电子并与之对称性匹配的dxy,dxz,dyz轨道,形成反馈π键,使得Fe2+与氰根的结合更为牢固。因此它在常规条件下,例如在动物体内,很难解离释放剧毒的氰根CN-,因此它毒性较低,可以被允许用作食品添加剂;成年大鼠口服的半数致死量LD50高达6.4g/kg[3];每日摄入0.025mg/kg都是可以允许的[4],可认为几乎没有毒性。2.2.1 与酸碱反应亚铁氰化钾结构稳定,100℃以下在水中基本不与强碱反应。(不像铁氰化钾在强碱水溶液中加热分解产生Fe(OH)3和CN-)由于氰根易于和氢离子结合,同时氰基还容易水解,因此亚铁氰化钾在一定条件下可以与酸反应:亚铁氰化钾和盐酸在低温下反应可以得到亚铁氰酸[5][6]:和硫酸反应的产物则很大程度上取决于硫酸的浓度、具体反应条件等[5][6]:其基本规律是,低温下缓慢加入时,写出亚铁氰酸;和稀强酸加热时,主要反应是氰根结合质子释放剧毒的HCN气体;和浓强酸加热时,同时伴随着氰基被水解,HCN被酸性水解为其广义等电子体CO,依然是一种剧毒气体。因此应避免亚铁氰化物与强酸共热。2.2.2 与沉淀剂反应亚铁氰根[Fe(CN)6]4-是带有4个单位负电荷的阴离子,同时N原子具有一定配位能力。使得它易于与各种高电荷的阳离子形成沉淀。亚铁氰化钾在水溶液中易于与各种金属盐发生复分解反应,形成对应亚铁氰化物沉淀,其中K+被部分或完全取代。[5]可以通过水溶液中的复分解反应生成的亚铁氰化物有[5]:K2Ca[Fe(CN)6](制备时需保证亚铁氰化钾溶液低温高浓度)、Ca2[Fe(CN)6]、 K2Ba[Fe(CN)6]3H2O(煮沸条件下制备)、K2Mg[Fe(CN)6]7H2O(煮沸条件下制备)、Pb2[Fe(CN)6](白色沉淀)、Fe4[Fe(CN)6]3(普鲁士蓝)、K6Fe6[Fe(CN)6]6(溶液,低温下制备)、Fe2[Fe(CN)6](普鲁士白,白色沉淀,氧化后变蓝)、 Co2[Fe(CN)6](绿色沉淀)、Cd2[Fe(CN)6](白色沉淀)、Th[Fe(CN)6](白色沉淀)、Ti[Fe(CN)6](淡红棕色沉淀)、Cu2[Fe(CN)6](红褐色沉淀)、Ag4[Fe(CN)6](白色沉淀)、(UO2)2[Fe(CN)6](黑棕色沉淀)其中最常用的反应是:Fe3+与[Fe(CN)6]4-反应生成蓝色的KFe[Fe(CN)6]沉淀或溶液,常用于分光光度法检测亚铁氰化钾的含量[7];也常用于化学工业除去Fe3+。以及Zn2+与[Fe(CN)6]4-反应生成白色的Zn2[Fe(CN)6]沉淀,这一反应常用于沉淀滴定法测定亚铁氰化钾含量[8],同时若用K3[Fe(CN)6]代替K4[Fe(CN)6],并加入氧化还原指示剂如KI/淀粉或二苯胺,则滴定终点时[Fe(CN)6]3-会强烈倾向于得电子生成[Fe(CN)6]4-并与Zn2+结合成稳定的Zn2[Fe(CN)6]沉淀,使得氧化还原指示剂被氧化显现深蓝色,起到指示滴定终点的作用。该沉淀反应也常用作澄清剂吸附沉降一些蛋白质[9]。2.2.3 配位解离反应由于亚铁氰化钾稳定性极高,K稳高达1035,很少有其它的亚铁配合物稳定性比它还高,因此它很难发生配体取代反应,即使能发生,往往因为氰根解离很慢,而反应非常慢;使得亚铁氰化钾对配体取代反应常规条件下几乎是惰性的。但也并非完全不能发生,例如它与浓硝酸作用或者在弱酸性条件下与亚硝酸钠作用,都可以得到高血压急症及急性左心衰竭的药物硝普盐[10]:相比较而言,硝普盐并不像亚铁氰化钾那样稳定:2.2.4 氧化还原反应一定的还原性是亚铁氰化钾主要的氧化还原特征。被氯气氧化[5]:(常用于制备铁氰化钾)低温或常温下被氮含氧酸氧化[5]:被酸性过氧化氢氧化[5]:高温下被氧气氧化,产生Fe3O4、KFeO2等[11]2.2.5 热分解反应在无氧条件下,三水合亚铁氰化钾首先在65~71℃左右失去结晶水生成无水亚铁氰化钾[12]:无水亚铁氰化钾灼烧时,根据条件的不同发生以下反应[5]:若加入K2CO3,则反应为[5]:若再加入S,则反应为[5]:可以看出,亚铁氰化钾受强热分解产生剧毒的KCN,但是因为亚铁氰根高度的稳定性,分解反应在400℃以上才会开始进行,而一般烹调温度最高也就在340℃左右,因此在烹调条件下,亚铁氰化钾作为食品添加剂是非常安全的[13]。3 亚铁氰化钾的应用亚铁氰化钾在钢铁、染料、医药、化学、食品等工业中都有应用:3.1 非食品工业领域主要用作钢铁工业的渗碳剂,以提高钢铁制件的表面硬度。印染工业用作氧化助剂,使精元棉布染色逐步进行,保持染色质量。医药工业用作凝聚剂,能达到理想的除杂工艺,提高药品质量。颜料工业用作生产颜料华蓝的主要原料。化学工业用作除铁剂。[14]3.2 食品生产3.2.1 可溶性糖的提取亚铁氰化钾可配合乙酸锌作为澄清剂:它是利用乙酸锌[Zn(CH3COO)2]与亚铁氰化钾反应生成的亚铁氰化锌Zn2[Fe(CN)6]沉淀来挟走或吸附干扰物质。这种澄清剂除蛋白质能力强,但脱色能力差,适用于色泽较浅,蛋白质含量较高的样液的澄清,如乳制品、豆制品等,可以用于可溶性糖类的提取和澄清。[9]3.2.2 食盐抗结剂食盐由于颗粒度不均匀,且具有吸湿性,在较短时间内易出现结块现象——不仅会影响其感官品质和包装运输,还不便于消费者的烹饪食用。因此,目前市场上销售的食盐一般会添加抗结剂[15]。《食品安全国家标准 食品添加剂使用标准》(GB 2760-2014)[16]规定,食盐中允许添加的抗结剂有5种,即亚铁氰化钾(钠)、柠檬酸铁铵、SiO2、CaSiO3、酒石酸铁。当前,亚铁氰化钾(钠)和柠檬酸铁铵是较为常用的食盐抗结剂,其中,柠檬酸铁铵可以用于绿色食品,而亚铁氰化钾(钠)不允许添加于绿色食品中[13]。按照我国食品安全国家标准(GB 2760-2014)规定,亚铁氰化钾最大使用量为0.01g/kg(以亚铁氰根计)[16]。从1996年开始至今,亚铁氰化钾一直是国家认可的食用盐抗结剂,其最大使用限量为10mg/kg,因此,食用盐生产企业普遍将亚铁氰化钾作为食用盐抗结剂使用,在生产过程中添加量一般控制在5-7mg/kg,远低于国家标准限量[13]。亚铁氰化钾之所以能够作为抗结剂,是因为Fe2+和CN-之间配位键合稳定,只有当温度高于400℃时才可能分解产生KCN,而日常烹调温度通常在340℃左右,因此在正常烹调温度下很难使亚铁氰化钾分解[13]。另外,按照国家标准GB/T 5461-2016《食用盐》的规定,食用盐品种主要有精制盐、粉碎洗涤盐、日晒盐。由于日晒盐颗粒度大,不易结块,因此一般无需添加抗结剂;而精制盐、部分粉碎洗涤精制盐由于颗粒度较细,且粒度也不够均匀,容易结块,因此需要添加一定量的抗结剂。由于亚铁氰化钾可溶于水,通过喷雾方式加入,使用量低、均匀、抗结效果好,因此食用盐生产企业首选亚铁氰化钾作为食用盐抗结剂。[13]4 亚铁氰化钾的限量标准4.1 食品级亚铁氰化钾试剂标准食品级纯品亚铁氰化钾,主要成分通常是三水合亚铁氰化钾。其国家标准[8]如下:4.1.1 感官要求[table][tr][td][color=black]项 目 [/color][/td][td][color=black]要 求 [/color][/td][td][color=black]检验方法[/color][/td][/tr][tr][td][color=black]色泽 [/color][/td][td][color=black]淡黄色 [/color][/td][td=1,2][color=black]取适量试样置于[/color][font=timesnewromanpsmt][color=black]50mL[/color][/font][color=black]烧杯中,在自然光下观察色泽和组织状态[/color][/td][/tr][tr][td][color=black]组织状态 [/color][/td][td][color=black]结晶颗粒或粉末 [/color][/td][/tr][/table]4.1.2 理化指标[table][tr][td][color=black]项 目 [/color][/td][td][color=black]指 标 [/color][/td][/tr][tr][td][color=black]亚铁氰化钾[/color][font=timesnewromanpsmt][color=black][K[/color][/font][font=timesnewromanpsmt][size=8px][color=black]4[/color][/size][/font][font=timesnewromanpsmt][color=black]Fe[/color][/font][font=times new roman][color=black](CN)[/color][/font][font=timesnewromanpsmt][size=8px][color=black]6[/color][/size][/font][font=timesnewromanpsmt][color=black]3H[/color][/font][font=timesnewromanpsmt][size=8px][color=black]2[/color][/size][/font][font=timesnewromanpsmt][color=black]O] [/color][/font][color=black], [/color][font=timesnewromanps-italicmt][color=black]w/[/color][/font][font=timesnewromanpsmt][color=black]% [/color][/font][color=black]≥ [/color][/td][td][color=black]99.0 [/color][/td][/tr][tr][td][color=black]氯化物(以[/color][font=timesnewromanpsmt][color=black]Cl [/color][/font][color=black]计), [/color][font=timesnewromanps-italicmt][color=black]w/[/color][/font][font=timesnewromanpsmt][color=black]% [/color][/font][color=black]≤ [/color][/td][td][color=black]0.3 [/color][/td][/tr][tr][td][color=black]水不溶物, [/color][font=timesnewromanps-italicmt][color=black]w/[/color][/font][font=timesnewromanpsmt][color=black]% [/color][/font][color=black]≤ [/color][/td][td][color=black]0.02 [/color][/td][/tr][tr][td][color=black]钠([/color][font=timesnewromanpsmt][color=black]Na[/color][/font][color=black]), [/color][font=timesnewromanps-italicmt][color=black]w/[/color][/font][font=timesnewromanpsmt][color=black]% [/color][/font][color=black]≤ [/color][/td][td][color=black]0.2 [/color][/td][/tr][tr][td][color=black]砷([/color][font=timesnewromanpsmt][color=black]As[/color][/font][color=black]) [/color][font=timesnewromanpsmt][color=black]/[/color][/font][color=black]([/color][font=timesnewromanpsmt][color=black]mg/kg[/color][/font][color=black]) ≤ [/color][/td][td][color=black]1 [/color][/td][/tr][tr][td][color=black]氰化物 [/color][/td][td][color=black]通过检验 [/color][/td][/tr][tr][td][color=black]六氰合铁([/color][font=timesnewromanpsmt][color=black]III[/color][/font][color=black])酸盐 [/color][/td][td][color=black]通过检验 [/color][/td][/tr][/table]4.2 食盐中亚铁氰化钾含量标准盐或代盐产品中,亚铁氰化钾的限量标准是0.01g/kg,以亚铁氰根[Fe(CN)6]4-计[16]。5 食品中亚铁氰化钾的检测方法主要包括食盐及盐渍制品中亚铁氰化钾含量的检测。5.1 食盐中亚铁氰化钾含量的检测国标方法是利用分光光度法,通过作标准工作曲线,进而对亚铁氰化钾定量测定[7]:5.1.1 方法原理亚铁氰化钾在酸性条件下与硫酸亚铁生成蓝色复盐, 与标准比较定量。 方法检出限为1.0 mg/kg。反应方程式如下:(蓝色)5.1.2 试剂配制注: 除非另有说明, 本方法所用试剂均为分析纯, 水为 GB/T6682 规定的三级水。5.1.2.1 试剂硫酸,硫酸亚铁(FeSO4 7H2O) ,亚铁氰化钾。5.1.2.2 试剂的配制5.1.2.2.1 硫酸溶液: 量取5.7 mL 硫酸, 倒入50 mL 水中, 冷却后再加水至100 mL5.1.2.2.2 硫酸亚铁溶液(80 g/L) : 称取8 g 硫酸亚铁, 溶于100 mL 硫酸溶液中, 过滤, 贮于棕色试剂瓶中低温保存。5.1.2.3 标准溶液的制备5.1.2.3.1 亚铁氰化钾标准溶液: 准确称取0.1993g亚铁氰化钾(K4[Fe(CN)6]3H2O) , 溶于少量水,移入100mL容量瓶中, 加水稀释至刻度。1mL此溶液相当于1.0mg亚铁氰根([Fe(CN)6 ]4- ) 。5.1.2.3.2 亚铁氰化钾标准工作液: 吸取10.0 mL 亚铁氰化钾标准溶液, 置于100 mL 容量瓶中, 加水稀释至刻度,1 mL 此溶液相当于0.10 mg 亚铁氰根([Fe(CN)6]4-) 。5.1.3 [font=宋体]仪器和设备[/font]5.1.3.1 分光光度计。5.1.3.2 天平: 感量为0.001 g。5.1.4 分析步骤称取10g(精确至0.01 g) 试样溶于水, 移入50 mL 容量瓶中, 加水至刻度, 混匀, 过滤, 弃去初滤液,然后吸取25.0 mL 滤液于比色管中。吸取0 mL、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL 亚铁氰化钾标准工作液 [相当于 0 μg、10.0 μg、20.0 μg、30.0 μg、40.0 μg、50.0 μg 亚铁氰根([Fe(CN)6 ]4-)], 分别置于25 mL 比色管中, 各加水至25 mL。试样管与标准管各加2 mL 硫酸亚铁溶液, 混匀。 20 min 后, 用3 cm 比色杯, 以零管调节零点, 于波长670 nm 处测吸光度。 以亚铁氰根质量为横坐标, 对应的吸光度为纵坐标绘制标准工作曲线。 根据试样的吸光度, 从工作曲线查出测定用样液中亚铁氰根的含量。5.1.5 分析结果的表述试样中亚铁氰化钾的含量按下式计算:式中:X6 ———试样中亚铁氰化钾(以[Fe(CN)6]4- 计) 的含量, 单位为克每千克(g/kg) m1 ———测定用样液中亚铁氰根的质量, 单位为微克(μg) m2 ———试样质量, 单位为克(g) 25/50———50 mL 试样滤液中取25 mL 用于试验 1 000 ———单位换算系数。计算结果保留两位有效数字。5.1.6 精密度在重复性条件下, 获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。5.2 盐渍制品中亚铁氰化钾含量的检测与食盐中亚铁氰化钾含量的检测的原理方法一致;只是增加了样品前处理的过程,同时增加了试剂空白和样品空白(不加硫酸亚铁)以消除有色浸取液的影响[17]。以盐渍黄瓜为例[17]说明这一方法:(需要注意的是,本方法并非国标方法。)5.2.1 操作大致流程 称取剪碎后样品20.0 g,加100 mL水,搅均匀,过滤。分别吸取滤液40 mL于2个小烧杯,加NaOH溶液0.6 mL,搅匀,过滤到50 mL容量瓶中,加0.5mL H2SO4溶液,使之呈中性。一个加水到刻度,另一个加FeSO4溶液4 mL,加水到刻度,混匀。同时作试剂空白。10min后于670 nm处,用4 cm比色皿测定吸光度,根据标准工作曲线得到对应亚铁氰化钾含量,求两者之差,根据样品稀释倍数可得样品中亚铁氰化钾的含量。[17]5.2.2 干扰的消除 亚铁氰化钾与许多阳离子反应生成有色络合物。因此当样品中存在这些金属离子时,可能会产生蓝色,影响结果的测定。[17]消除干扰采用以下步骤:在样液中加入少许NaOH,使金属离子沉淀,过滤后用H2SO4调至中性,再加FeSO4显色。[18]6 结论综上,我们可以看出目前对于亚铁氰化钾理化性质、毒性的研究,工业上的应用以及检测方法都比较成熟。亚铁氰化钾用作食盐抗结剂技术成熟且已经普遍推广,它是一种安全的食品添加剂。参考文献:[1]Potassium ferrocyanide https://en.wikipedia.org/wiki/Potassium_ferrocyanide[2]Anduix-Canto, Clara Kim, Yi-Yeoun Wang, Yun-Wei Kulak, Alexander Meldrum, Fiona C. Christenson, Hugo K. Effect of Nanoscale Confinement on the Crystallization of Potassium Ferrocyanide. Crystal Growth & Design, 2016. 16 (9): 5403-5411.doi:10.1021/acs.cgd.6b00894[3]http://chem.sis.nlm.nih.gov/chemidplus/rn/13943-58-3[4]Toxicological evaluation of some food additives including anticaking agents, antimicrobials, antioxidants, emulsifiers and thickening agents". World Health Organization, Geneva. 1974. Retrieved 18 May 2009.[5]《无机化学反应方程式手册》.曹忠良 王珍云 编.湖南科学技术出版社.第十三章 铁系元素. P344. 【K4[Fe(CN)6]】和【[Fe(CN)6]4-】[6]《无机化学丛书》. 第九卷 锰分族 铁系 铂系. 谢高阳 等. 科学出版社. P191. Fe(II)的阴离子络合物[7]中华人民共和国 国家卫生和计划生育委员会《食品安全国家标准 食盐指标的测定》GB 5009.42—2016[8]中华人民共和国卫生部《食品安全国家标准 食品添加剂 亚铁氰化钾(黄血盐钾)》GB 25581―2010[9]大连轻工业学院等8所高校.食品分析:中国轻工业出版社,2012.5:155[10]Sodium nitroprusside https://en.wikipedia.org/wiki/Sodium_nitroprusside[11]J. I. Kunrath, C. S. Müller, E. Frank. Thermal decomposition of potassium hexacyanoferrate(II) trihydrate. Journal of Thermal Analysis. 1978-12, 14 (3): 253–264 [2018-07-20]. ISSN 0022-5215. doi:10.1007/bf01915163[12]金满平, 黄文君, 石宁. 氯酸钠和亚铁氰化钾的热稳定性研究[J]. 安全、健康和环境, 2010, 10(8):36-38.[13]李帮柱.食用盐中添加亚铁氰化钾究竟是怎么回事[J].中国盐业,2018(17):12-14.[14]https://baike.baidu.com/item/%E4%BA%9A%E9%93%81%E6%B0%B0%E5%8C%96%E9%92%BE/2750650?fr=aladdin[15]赵伦秀,陈俊,陈勇.绿色食用盐的推广应用[J].中国井矿盐,2012,43(1):44-46.[16]中华人民共和国 国家卫生和计划生育委员会《食品安全国家标准 食品添加剂使用标准》GB 2760-2014[17]俞旭峰. 盐渍黄瓜中亚铁氰化钾的测定[J]. 食品与机械, 2002, 000(004):31-31.[18]国家技术监督局,制盐工业通用试验方法. 亚铁氰化钾的测定, GB13025.1()—91,1991.
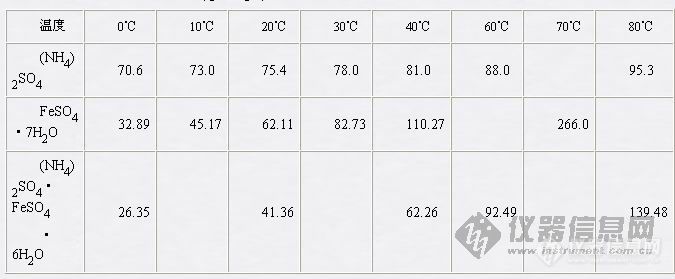
硫酸亚铁铵的制备目的原理实验目的1.了解复盐的制备方法;2.熟练过滤、蒸发、结晶等基本操作;3.了解目测比色法检验产品质量的方法。实验原理铁溶于稀硫酸中生成硫酸亚铁,并与等摩尔数的硫酸铵在水溶液中相互作用,即生成溶解度较小的浅蓝绿色硫酸亚铵FeSO4(NH4)2SO46H2O复盐晶体,反应式如下:Fe+H2SO4 = FeSO4+H2FeSO4+(NH4)2SO4+6H2O = FeSO4(NH4)2SO46H2O在空气中亚铁盐通常都易被氧化,但形成的复盐比较稳定,不易被氧化。仪器药品台称、布氏漏斗和吸滤瓶、比色管(25ml)、蒸发皿、表面皿。pH试纸、滤纸。HCl (2moldm-3)、H2SO4 (3moldm-3)、HaOH (2moldm-3)、Na2CO3(10%)、(NH4)2SO4固体。过程步骤一、铁屑表面油污的去除称取4g铁屑,放在小烧杯中,加入20ml 10% Na2CO3溶液,小火加热约10分钟,用倾析法除去碱液,用水把铁屑冲洗干净至中性,备用。二、硫酸亚铁的制备在盛有4g铁屑的小烧杯中倒入30ml 3moldm-3 H2SO4溶液,盖上表面皿,放在石棉网上用小火加热,使铁屑和H2SO4反应直至不再有气泡冒出为止 (约需20分钟)。在加热过程中应不时加入少量水,以补充被蒸发掉的水份,这样做可以防止FeSO4结晶出来。趁热减压过滤,滤液立即转移至蒸发皿中,此时溶液的pH值应在1左右。三、硫酸亚铁铵的制备根据FeSO4的理论产量,执照反应式计算所需固体硫酸铵的质量。在室温下将称出的(HN4)2SO4配制成饱和溶液加到硫酸亚铁溶液中,混合均匀,并用3moldm-3H2SO4溶液调节pH值为1-2。用小火蒸发浓缩至表面出现晶体膜为止。(蒸发过程中不宜搅动) 放置使溶液慢慢冷却,硫酸亚铁铵即可结晶出来。用减压过滤法滤出晶体,把晶体用滤纸吸干。观察晶体的形状和颜色,称出质量并计算产率。四、产品检验1.试用实验方法证明产品中含有NH4+、Fe2+和SO42-。2.Fe3+的限量分析,称取1g产品置于25ml比色管中,用15ml不含氧的蒸馏水溶解,加入2ml moldm-3HCl和1ml KNCS(1moldm-3)溶液,再加不含氧的蒸馏水至25ml刻度,摇匀后,将可呈现的红色和下列标准溶液的红色比较,确定Fe3+的含量符合哪一级的试剂的规格。标准溶液的配制在三支比色管中分别加入含有下列数量Fe3+的标准溶液各15ml (由实验室配制)(1) 含Fe3+0.5mg(符号Ⅰ级试剂)(2) 含Fe3+0.10mg(符号Ⅱ级试剂)(3) 含Fe3+0.20mg(符号Ⅲ级试剂)然后用处理试样相同的方法配制成25ml。附注:表几种化合物的溶解度数据 ( g / 100g水)[img]http://ng1.17img.cn/bbsfiles/images/2007/03/200703101024_44217_1632583_3.jpg[/img]分析思考 1.铁屑表面的油污是怎样除去的?2.为什么制备硫酸亚铁铵晶体时,溶液必须呈酸性?3.如何计算FeSO4的理论产量和反应所需(NH4)2SO4的质量?4.怎样证明产品中含有NH4+、Fe2+和SO42-离子?怎样分析产品中Fe3+的含量?
HJ 828 COD测试中,硫酸亚铁铵使用高锰酸钾标准溶液在临用前标定,操作起来太麻烦,是否可以购买已经定值的0.1mol的硫酸亚铁铵标准滴定液稀释后直接使用?
原子吸收测定的结果能区分出铁和亚铁吗?个人认为是不能区分的,根据原理只能测出是铁元素,但分辨不出是铁还是亚铁。
因为食盐打开后容易吸收空气中的水分,受潮受湿就会结块,而抗结剂就能防止食盐结块。简单来说,抗结剂的主要作用是保持食盐的松散状态,防止食盐粘结在一起,这样,炒菜的时候就不太容易手抖掉下一大坨。海盐之所以未添加抗结剂,原因是海盐是粗盐,形态为大颗粒状,因此这种盐不需要加抗结剂。 亚铁氰化钾是什么?亚铁氰化钾别名黄血盐,具有抗结性能,可用于防止细粉、结晶性食品板结。例如,食盐长久堆放易发生板结,加入亚铁氰化钾后食盐的正六面体结晶转变为星状结晶,从而不易发生结块。作抗结剂,我国规定可用于食盐,最大使用量0.005 g/kg(以亚铁氰根计)。中国GB 2760-96规定,允许作为食盐的抗结剂。最大使用量为0.01g/kg(以亚铁氰根计)。 添加于食盐中,用量0.01g/kg(以亚铁氰根计)。具体使用时,可配制成浓度为0.25~0.5g/100mL的水溶液,再喷入100kg食盐中。欧洲常将亚铁氰化钾用作葡萄酒中铁、铜离子去除剂。根据世界卫生组织和国际粮农组织专家委员会的评估数据,亚铁氰化钾的终生安全剂量是每公斤体重0.025毫克。这相当于,一个70公斤的人每天吃下1.75毫克,吃一辈子都没有问题。
近日,《中国卖盐的是畜生》一文在网上广为传播,文章以某教授的名义,指出盐里面的抗结剂亚铁氰化钾对人体肝脏肾脏造成伤害。文章的传播引起了一些人的恐慌,毕竟,食盐是生活中最常用的调味品。食盐中添加亚铁氰化钾是否安全?就此《民生周刊》记者采访了北京市卫计委、国家食品安全风险评估中心等机构及相关专家。“亚铁氰化钾是一种常见的抗结剂,添加到食盐中是经过安全性评估的,很多国家都在用,没有问题。”对于亚铁氰化钾的安全性,国家食品安全风险评估中心研究员李宁表示。根据我国《食品安全国家标准食品添加剂使用标准》(GB2760-2014)的规定,亚铁氰化钾在食盐中的最大添加量是0.01g/kg。“只要在这个限值内使用都是安全的。”国家食品安全风险评估中心标准三室副研究员王华丽表示,目前,国家食品安全风险评估中心也没有收到过相关风险报告。《民生周刊》记者从北京市卫计委了解到,临床方面,尚未发现因亚铁氰化钾中毒的聚集病历。“亚铁氰化钾是食品添加剂,有相应的国家标准,标准量值源于毒理学实验,严格按照标准添加应该是安全的。”北京市卫计委相关人员表示。其实亚铁氰化钾在国外也是主要用作抗结剂(anticakingagent),防止食盐结块。欧盟可以用亚铁氰化钾/钠/钙,限量为20毫克/每公斤。美国可以用亚铁氰化钠,限量(四舍五入)和中国其实一样。日本可以用亚铁氰化钾/钠/钙,限量值是中国的2倍。澳大利亚和新西兰也是允许使用的,批准的是亚铁氰化钾和亚铁氰化钠。针对食盐中添加亚铁氰化钾是否安全,大家如何看待这个问题呢?
请教各位高手一个问题,我们单位配制的亚铁氰化钾溶液滴定锌溶液时,出现蓝色,无法辨别滴定终点,是什么原因?另外,根据亚铁氰化钾标准溶液中 亚铁氰化钾:铁氰化钾:无水碳酸钠=21.6:0.6:0.2的配比是怎么来的,为什么要放置一周才 能使用,谢谢!!
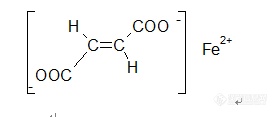
【中文名称】富马酸亚铁;反丁烯二酸亚铁【英文名称】ferrous fumarate【结构或分子式】 http://ng1.17img.cn/bbsfiles/images/2012/04/201204161937_361731_1855403_3.jpg 【性状】 橙红色至红棕色粉末。无臭,无味。【溶解情况】 略溶于水,微溶于乙醇。【用途】 是含铁量高的抗贫血药,用于缺铁性贫血。可用于人和动物缺铁性贫血。【制备或来源】 由反丁烯二酸经碳酸氢钠中和成盐,得到反丁烯二酸钠,再与硫酸亚铁置换而得。【包装及贮运】 桶装、内衬聚乙烯薄膜袋,遮光、密闭保存。【生产单位】 略
请问哪种有机溶剂可以溶解亚铁氰化钾?物性手册说丙酮就可以溶解,可是发现溶解度不大,而且一旦体系中加入少量乙醇,溶解的亚铁氰化钾马上变成微晶而析出了。请问有没有可大量溶解亚铁氰化钾的有机溶剂,乙睛和二甲基甲酰胺可以吗?
0.5%的氧化亚铁量。2. 原理样品用氢氟酸-硫酸分解,溶液中剩余的氟加入硼酸络合掉,以二苯胺磺酸钠为指示剂,用基准重铬酸钾溶液滴定,计算FeO量。 3.试剂 3.1 氢氟酸(ρ=1.15g/ml ) 3.2 硫酸( ρ=1.84g/ml ) 3.3 硫酸(1+1 ) 3.4 硫酸( 5+95 ) 3.5 磷酸( ρ=1.69g/ml ) 3.6 饱和硼酸溶液。 3.7 硫磷混合酸:取150ml浓硫酸慢慢倒入700ml水中,冷却,加入150ml磷酸,搅匀。 3.8 硫酸亚铁铵溶液: c=0.0050mol/L,称取0.98g硫酸亚铁铵溶解于硫酸(3.4)中,再加硫酸(3.4)至500ml,搅匀。 3.9 重铬酸钾标准滴定溶液c(K2Cr2O7)=0.002319mol/L :称取0.6825g预先经150°C干燥2h的基准重铬酸钾,溶解于水中,移入1000ml容量瓶,用水稀释至刻度,摇匀。这个浓度可以根据样品含量的高低调整浓度,并非一成不变。 3.10 二苯胺磺酸钠溶液(5.0g/L):称取0.5g二苯胺磺酸钠溶解于100ml水中,加1~2滴(1+1)硫酸,储于棕色瓶中,若颜色变绿则不能使用。4.试样4.1 单独测定亚铁,试样粒径应小于149µm。4.2 同一试样,一般应进行双份测定。4.3 试料量根据氧化亚铁含量范围,按下表称取试样量。含量范围(%)试料量([/
不知哪位知道测有机质时用硫酸亚铁与用硫酸亚铁铵有何区别?是否后者比较稳定?指示剂是否也要用相应的的物质来配制?

[align=center][img=,600,375]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091517531707_5062_932_3.jpg!w440x275.jpg[/img][/align]最近关于“食盐里面加了亚铁氰化钾危害健康”的文章在微博、微信朋友圈疯传,文章提到国产食盐里面有种可怕的添加剂:亚铁氰化钾。什么是亚铁氰化钾?亚铁氰化钾是否对人体有危害?如何检测亚铁氰化钾?月旭的小编带你走近亚铁氰化钾。1. 亚铁氰化钾是什么?中文名:三水合六氰合铁(Ⅱ)酸钾,亚铁氰化钾英文名:Potassium hexacyanoferrate(II)别 名:黄血盐化学式:K4分子量:422.42CAS号:14459-95-1(三水),13943-58-3(无水)熔 点:70℃水溶性:28.9g/100mL (20 ℃)密 度:1.85g/cm3 (固)外 观:黄色晶体应 用:防止食盐结块[align=center][img=,600,600]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091517585609_98_932_3.jpg!w400x400.jpg[/img][/align]2. 亚铁氰化钾有危害吗?[align=center][img=,600,399]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091518028919_2375_932_3.jpg!w500x333.jpg[/img][/align]很多人看到氰化钾三个字都会变色,那么很多人就会有疑问:亚铁氰化钾会不会分解为氰根和亚铁离子呢?事实上,亚铁氰化钾的稳定性很高,它的氰根和亚铁结合的作用力非常强,即使是在亚铁氰化钾的溶液里也很难检测到氰根。理论上,亚铁氰化钾在高温下可以分解产生氰化钾,但这个温度至少要400℃,而一般家庭烹饪的温度达不到这么高。到200多℃就开始有大量油烟,到330℃不粘锅的涂层就开始融化了。真的达到400℃菜得什么样啊!你还能愉快地吃吗?说到这里,还是有人不放心,万一它真的分解出氰化钾怎么办呢?氰化钾毒死一个成年人大约需要0.1g以上,而1kg食盐里的亚铁氰化钾最多才0.01g。就算亚铁氰化钾全都神奇地分解了,那么人得吃几十公斤的盐才有可能被毒死。可见,网传的“盐里面加进了亚铁氰化钾”危害消费者健康是不实信息。对此,全国盐业标准化技术委员会就此问题作出了特别说明。说明表示,欧盟、日本、澳大利亚和新西兰等在食盐生产过程中均允许使用亚铁氰化钾(亚铁氰化钠)作为食盐抗结剂,我国制盐行业添加亚铁氰化钾(亚铁氰化钠)作为食盐抗结剂的安全性是有保障的。说明还称,目前我国制盐行业在食盐中添加的“亚铁氰化钾”是严格按国家卫健委发布的《食品安全国家标准 食品添加剂使用标准》(GB 2760)的规定执行的,希望广大消费者放心食用。并且,我国还制定了制盐工业通用试验方法—亚铁氰根的测定国家标准。3. 如何检测亚铁氰化钾?[align=center][img=,600,399]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091518064909_3120_932_3.jpg!w500x333.jpg[/img][/align][align=center][/align][align=center]测定方法[/align]参考GB/T 13025.10-2012 制盐工业通用试验方法—亚铁氰根的测定。[align=center]测定原理[/align]在酸性条件下,亚铁氰根与硫酸亚铁反应,生成白色亚铁氰化亚铁沉淀,经空气氧化生成普鲁士兰,用分光光度法测定。[align=center]测定步骤[/align][b]1、限量法测定[/b]吸取与限定量相对应的亚铁氰化钾标准工作液于50mL比色管中,加入5g氯化钠,加水溶解,加入4mL硫酸亚铁溶液,加水稀释至刻度,摇匀,放置10min后,在670nm波长,用试剂空白作参比,测定吸光度。另取一只50mL比色管,称取5.0g试样置于比色管中,加40mL水浴解(若溶液浑浊应用0. 45μm的滤膜过滤),加入4mL硫酸亚铁溶液,加水稀释至刻度,摇匀,放置10min后,在670nm波长,用试剂空白作参比,测定吸光度。试样溶液吸光度低于标准溶液吸光度为合格,反之不合格。[b]2、工作曲线法测定[/b]2.1 标准曲线吸取含亚铁氰0μg、10μg、20μg、30μg、40μg、50μg的标准工作液分别于50mL比色管中,分别加入5g氯化钠,加水溶解,加4mL硫酸亚铁溶液,加水稀释至刻度,摇匀,放置10min后,在670nm波长,用试剂空白作参比,测定吸光度。以亚铁氰根质量为橫坐标,以对应的吸光度为纵坐标绘制标准工作曲线。2.2 试样的测定称取5.0g试样置于50mL比色管中,加40mL水溶解(若溶液混浊应用0.45μm的滤膜过滤),加4mL硫酸亚铁溶液。加水稀释至刻度,摇匀,放置10min后,在670nn波长,用试剂空白作参比,测定吸光度。根据试样的吸光度,由工作曲线查出亚铁氰根的质量。2.3 结果计算试样中亚铁氰根含量以质量分数w计,数值以毫克每千克(mg/kg)表示。按式(1)计算:[align=center][img=,600,143]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091518103559_379_932_3.jpg!w457x109.jpg[/img][/align]2.4 精密度在同一实验室,由同一操作者使用相同设备,按相同的测试方法,并在短时间内对同一被测对象相互独立进行测试获得的两次独立测试结果的绝对差值不大于表1的规定。[align=left][/align][align=left]表1 [/align][table=371][tr][td=1,1,190]亚铁氰根含量/(mg/kg)[/td][td=1,1,181]结果的绝对差值/(mg/kg)[/td][/tr][tr][td]1[/td][td]1[/td][/tr][/table][align=center][/align][align=center][/align][align=center][/align][align=center][/align]
硫酸亚铁铵标准溶液不能长期保存,24小时标液浓度就会变低,只能现配现用。前几天在文献上看到,在标液里面放两小片金属铝,就能使标液保存一个月浓度不变。想来是因为溶液表明的亚铁离子被空气氧化了以后,又被金属铝还原了吧,所以能保持亚铁离子浓度不变。还没有进行验证,不敢独享,拿来和大家分享。
硫酸亚铁胺固体上有一些红色的小点,可能是亚铁被氧化成三价铁了,这个还能用于配制标准溶液吗,硫酸亚铁胺氧化后是成硫酸铁胺吗?原子吸收上能反映出亚铁与三价铁的区别吗?
亚铁的测定(1)重铬酸钾滴定法1方法提要 在隔绝空气的条件下用盐酸和氟化钠分解试样,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定。2主要试剂2.1 氟化钠:固体。2.2 盐酸(r1.19g/mL)。2.3 硫磷混酸(1.5+1.5+7)。2.4 碳酸氢钠:固体。2.5 二苯胺磺酸钠指示剂(0.5%):称取二苯胺磺酸钠0.5g,溶于100mL水中,加2滴磷酸( 1.69g/mL)。2.6 重铬酸钾标准溶液:c( k2Cr2O7)=0.03581mol/L。 3分析步骤 称取试样0.2000g,置于500mL干燥的锥形瓶中,加氟化钠0.5g,碳酸氢钠1g,盐酸(r1.19g/mL)30mL,迅速盖上瓷坩埚,放在事先预热的低温电炉上溶解。待溶解完全(溶液体积8~10mL),取下,迅速沿瓶壁加入100mL水及0.5g碳酸氢钠,加硫磷混酸20mL,二苯胺磺酸钠指示剂4滴,以重铬酸钾标准溶液[c( k2Cr2O7)=0.03581mol/L]滴定至稳定的紫红色溶液为终点。4分析结果的计算按下式计算亚铁的百分含量: ……………………(1)式中:c—重铬酸钾标准溶液的浓度,mol/L; V—滴定时消耗重铬酸钾标准溶液的体积,mL; V0- 滴定空白溶液所消耗的重铬酸钾标准溶液的体积,mL; m—称样量,g; 55.85—Fe的摩尔质量,g/mol。FeO(%)=1.286´ V式中:V—滴定消耗重铬酸钾标准溶液体积,mL; 1.286—氧化亚铁换算系数。5 注5.1 当试样中FeO%5时,称样0.2000~0.5000g。5.2 三角瓶干燥为好,称量后不可久置,否则亚铁易氧化。5.3 试样不易溶解时,可适当增加酸量。5.4 溶解试样时应始终保持微沸,不可间断,以避免空气进入瓶内。5.5 整个操作过程应迅速。5.6 对含有金属铁的试样应先分离或折算扣除。本法不适用于含硫高的试样,因在以盐酸溶样时,在硫化氢发生时,能将三价铁还原为二价铁,导致结果偏高。6 允许差亚铁量,%标样允许差%试样允许差%>1.00-2.00±0.150.20>2.00-5.00±0.180.25>5.00-10.00±0.210.30>10.00-20.00±0.280.407 氧化物系数按式(2)计算氧化亚铁百分含量: FeO%=1.286×Fe(II)%……………… (2)
七水合硫酸亚铁(L)——GR500ml,和七水合硫酸亚铁——AR500g的区别?试剂后面带个(L)是个什么意思?
如题:本来硫酸亚铁用盐酸就可完全溶解,可是因为是钛白粉的副产物,里面有少量的钛,因此溶解不完全,怎样处理合适不知各位有何高见?
HJ828做化学需氧量,低浓度重铬酸钾的空白试验消耗硫酸亚铁铵在20ml左右,标定硫酸亚铁铵消耗的重铬酸钾在24ml左右,怀疑是水的问题,买了怡宝的纯净水,重新加热回流做了一遍,低浓度空白实验还是消耗硫酸亚铁铵20ml左右,请问问题出在哪里?谢谢!
请问各位大虾谁有测亚铁的方法给共享一下,谢谢
[[size=4]font=楷体_GB2312] 请问“化学需氧量(重铬酸钾)测定法”中的亚铁灵指示剂配制时,硫酸亚铁不能完全溶解有何解决办法?[/font][/size][em09501][em09510]