[size=4]请教各位抗生素发酵过程检测的高手,由于我公司现在在转产,即将上马红霉素。但是由于各方面的原因在红霉素发酵与提炼过程中红霉素效价检测的方法过于繁琐,不太适合批量检测。现在的检测方法大致是根据效价的高低,稀释倍数也就不相同,加入碳酸钾的量也不同,但是发酵液与碳酸钾的总量20ml,再加入乙酸丁酯20ml,摇匀,静置,分层后取上层液10ml,再加入HCL溶液10ml,摇匀,静置,分层后取下层溶液5ml,再加入5ml硫酸。摇匀后放入水浴锅中30min。最后,冷却至室温,利用分光光度计检测吸光度。得出的吸光度带入线性公式计算,再乘以稀释倍数就得到效价。我们也尝试了利用高效液相检测红霉素发酵液的效价,但是杂质峰比较难分开,而且理论值与测定的值相差比较大。[/size] 化学方法很是繁琐,不知道各位高手中有没有做过红霉素的,请教一下各位有没有其他快速的检测方法,能够提供高效液相的方法最好。在此本人深表谢意!
[size=4] 请教各位抗生素发酵过程检测的高手,由于我公司现在在转产,即将上马红霉素。但是由于各方面的原因在红霉素发酵与提炼过程中红霉素效价检测的方法过于繁琐,不太适合批量检测。现在的检测方法大致是根据效价的高低,稀释倍数也就不相同,加入碳酸钾的量也不同,但是发酵液与碳酸钾的总量20ml,再加入乙酸丁酯20ml,摇匀,静置,分层后取上层液10ml,再加入HCL溶液10ml,摇匀,静置,分层后取下层溶液5ml,再加入5ml硫酸。摇匀后放入水浴锅中30min。最后,冷却至室温,利用分光光度计检测吸光度。得出的吸光度带入线性公式计算,再乘以稀释倍数就得到效价。我们也尝试了利用高效液相检测红霉素发酵液的效价,但是杂质峰比较难分开,而且理论值与测定的值相差比较大。[/size] 化学方法很是繁琐,不知道各位高手中有没有做过红霉素的,请教一下各位有没有其他快速的检测方法,能够提供高效液相的方法最好。在此本人深表谢意!
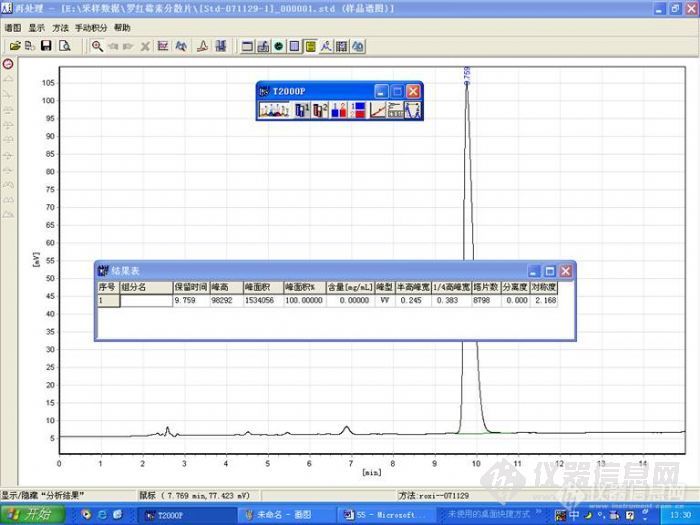
(一)分析背景及色谱条件 红霉素是一种十四元大环内酯类抗生素,一直是临床上治疗革兰氏阳性菌感染的重要药物,半个世纪以来为人类提供了一条安全高效的用药途径。经过不断研究人们相继开发出了耐酸性好的第二代红霉素和不易引起细菌耐药性的第三代红霉素。阿奇霉素可以说是目前第二代红霉素中最具有活力的大环内酯类抗生素,其生产步骤简单,在国内外都具有很大的生产量,尤其在国内,在许多药厂都有生产。但与其它第二代大环内酯类抗生素相比阿奇霉素的HPLC分析一直是个难点,这也与其独特的十五元环结构有关系。而且我们经过试验发现不同色谱柱对其检测的结果差别很大,普通的C18柱无法保证效果,C18 BDS的色谱柱的检测结果也不是很好,我们尝试了几种不同的在C18柱基础上经过各种填料处理的色谱柱,其中包括了“极限”系列的色谱柱。 阿奇霉素分子式http://ng1.17img.cn/bbsfiles/images/2009/11/200911211508_185763_1916092_3.jpg 色谱条件:磷酸氢二钾盐水溶液与乙腈以45:55混合。检测波长210纳米,柱温30°C,流速1.0ml/min,进样量50微克。阿奇霉素样品取自上海某药厂提供的产品,其纯度在95%以上。色谱柱我们共尝试了五根:(1)普通C18柱,编号为1;(2)某品牌BDS C18柱,编号为2;(3)大连某国产色谱柱,编号3;(4)日本某色谱柱(药检所推荐)。编号4;(5)Ultimate XB-C18色谱柱,编号5.(二)试验结果 (1)http://ng1.17img.cn/bbsfiles/images/2009/11/200911211502_185756_1916092_3.jpg(2)http://ng1.17img.cn/bbsfiles/images/2009/11/200911211503_185757_1916092_3.jpg(3)http://ng1.17img.cn/bbsfiles/images/2009/11/200911211503_185758_1916092_3.jpg(4)http://ng1.17img.cn/bbsfiles/images/2009/11/200911211503_185759_1916092_3.jpg(5)http://ng1.17img.cn/bbsfiles/images/2009/11/200911211503_185760_1916092_3.jpg 主峰时间 拖尾因子不对称度半峰宽 理论塔板数 杂质分离度118.4324.8567.2580.6534409——216.7801.4551.7040.42088440.452318.6201.0381.0390.41711067——428.9951.2311.4490.583136981.860527.3920.7440.4750.582123061.172(三)分析与讨论(1)对于两种主要杂质的显示情况,1和3只能显示出一种。4对它们的分离度最好,5次之。(2)从主峰阿奇霉素的峰型来看3最好,4,5次之。(3)关于主峰也就是阿奇霉素的出峰时间,4,5明显晚于前三个色谱柱。关于不同厂家不同批次的阿奇霉素我们已做过很多实验,绝大多数杂质出峰都在阿奇霉素之前,而且种类很多,也就是除了本实验所测样品显示的这两种主要杂质之外还存在有很多杂质,理论上讲主峰出峰时间晚有利于前面杂质峰的分离。 总结起来,从初步的对比检测中发现Ultimate XB-C18色谱柱对阿奇霉素杂质检测的情况还是很令人满意的,甚至不亚于药检所推荐使用的色谱柱。我们准备继续进行一系列的分析实验,对几种较难分离的杂质进行对比分析。
在用高效液相法测红霉素含量遇到问题,按照药典方法测,对照、样品中杂质C的峰基本找不到,也许是太小,暂时不管他,测含量时样品和对照主峰随着时间在变化,相差4、5个小时峰面积能差几倍?还有就是几天前配的标准品和新配的差异更大,标准品溶液是冷藏保存的,我记得抗生素基本都是测效价来定含量的,第一次用高效液相法测,问题不少,有做过这个产品的虫虫没?指点一下,十分感谢![em09512]
[table=100%][tr][td]求助,用液相色谱UV检测器分析红霉素含量,色谱图后面一块基线跑到负值?为什么出现这种情况,怎么解决?是不是后面一些杂质未分离开?还是梯度变化引起的?A 0.1%甲酸 B 甲醇 0-1min A 95% B5% 1.01-7min A5% B95% 7.01-30min 95% 5%柱温:30℃ 0.5ml/min[/td][/tr][/table][img]http://muchongimg.xmcimg.com/oss2/img/2018/0502/w173h5117980_1525248580_747.png[/img][img]http://muchongimg.xmcimg.com/oss2/img/2018/0502/w173h5117980_1525248581_603.png[/img]
[color=#444444]最近 我在做猪肉中红霉素、林可霉素、替米考星遇到点问题,想请教同仁一些关键控制点,首先我用的标准是GB 20762 内标用的罗红霉素,发现不过柱内标跑步出来,林可霉素外标法回收率能做到60%多,请教同仁谢谢![/color]
[color=#444444]最近 我在做猪肉中红霉素、林可霉素、替米考星遇到点问题,想请教同仁一些关键控制点,首先我用的标准是GB 20762 内标用的罗红霉素,发现不过柱内标跑步出来,林可霉素外标法回收率能做到60%多,请教同仁谢谢![/color]
在做红霉素肠溶片这批检品的组分A测定时,我是只做出了一个峰,但不能确定就是组分A啊,在22分钟左右出峰,然后我又继续跑了了100分钟,后面还是没有峰,我是按照05版药典配置的标准品溶液,配置好后室温放置了2个小时,咋就没出现峰呢,各位老师有做过的吗?
做依托红霉素中游离红霉素,系统适用性实验,依托红霉素峰难看,或出双头峰,怎么回事?
请问红霉素A组分测定德过程中需要注意哪些事项?怎才能获得很哈很好的峰形和分离度。pH值流动相对分离有没有影响?样品中除红霉素A外还有没有其他较大的峰?
请问这是峰是啥情况啊,红霉素,50ng 响应值也很低[img]https://ng1.17img.cn/bbsfiles/images/2020/03/202003101700335382_4192_4031315_3.png[/img]
红霉素的红外图谱,单纯的样品的图谱,是跟红外谱库的编号167的谱图对得一致的,可是红霉素标准品的谱图却跟谱库的编号167的谱图对得不是很一致。样品跟标准品均经过前处理之后,两个图谱是一致的,可跟谱库的编号167的谱图对得不是很一致。那是要跟标准品图谱比对呢,还是跟标准谱库比对呢?
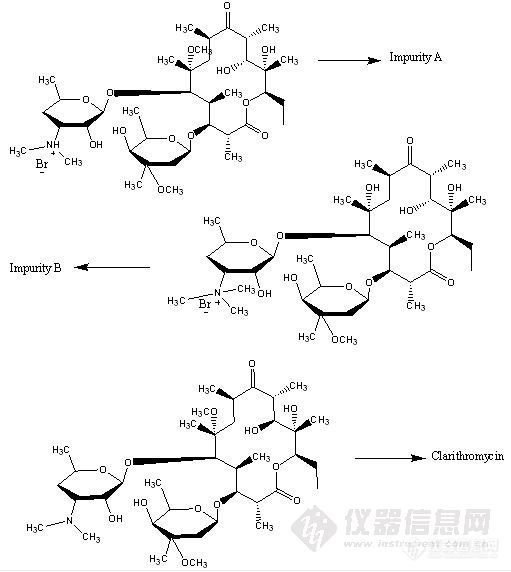
[color=#ba4b01][size=3]维权声明:本文为[size=2]11093661[/size]原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。[/size][/color]在红霉素发酵过程中,对红霉素发酵液效价的检测,能够起到对红霉素发酵过程起到一定的监督作用,对发酵过程提供参考价值,对生产异常起到眼睛的作用。而传统化学检测法对红霉素的检测不仅程序繁琐,周期长,而且容易受操作者水平,熟练程度等各方面的限制,导致结果误差较大,不利于对生产的监控。红霉素发酵过程中有红霉素A,红霉素B,红霉素C等产生,其中红霉素A成分活性最大,而其它成分活性小,而且有一定副作用,而传统化学吸光度方法的检测并不能准确检测红霉素A的成分,而是有可能是检测出的含有红霉素所有的物质。这样就不能更好的对发酵生产中起到更为准确的数据依据。 红霉素发酵过程中如果应用液相色谱分析,能够准确分离出红霉素A,红霉素B,红霉素C等物质,对红霉素A的效价检测更加准确。但红霉素发酵液中各类物质复杂,如果用蒸馏水定容,再色谱分析,结果发现基线漂移比较厉害,这样就限制了红霉素发酵生产中高效液相色谱仪的应用。本人通过多方查找资料,多次做试验发现,如果在定容过程中能够对发酵液中的各类复杂物质能够分离出来的话,有利于解决色谱分析中基线漂移问题。发酵液中的各类复杂物质容易溶于水,而难溶于有机相中,而红霉素则相反。利于这个原理,在分析定容中如果用有机相定容,各类复杂物质被分离出来,而红霉素溶于有机相中,在将物质摇匀后离心分离,使分离效果更好,基线漂移的问题能够得到相当程度的解决。 这个方法纯属个人自己试验中,查阅资料中摸索得到的,过程中没有依靠任何已有的分析方法,当然传统的吸光度法除外。而本人所在单位因为即将改产才有这个机会做的实验。所以可能有错误之处,或与某些方法雷同。我个人纯属将我自己的经验方法提出与朋友分享,希望广大朋友不吝赐教。 本人所在城市为四川成都。有空多联系。
中科院上海有机化学研究所刘文领衔的课题组立足于国内生物产业的现实需求,结合该所在化学合成方面的优势,致力于化学的理念促进现代生物技术的合理运用。他们与华东理工大学教授张嗣良等合作,在国家“863”项目“红霉素发酵工业用菌种改造和过程优化控制技术”中取得了重要突破,获得了一批具有自主知识产权、质量和产量得以明显提升的新型红霉素生产重组菌株。目前该成果已在湖北东阳光生化制药有限公司成功地进行了放大和试生产,其潜在经济、社会效益显著。在人类与致病微生物的斗争历史上,以抗生素为代表的微生物药物起到了至关重要的作用。红霉素是一类广泛使用、用于治疗革兰氏阳性菌感染的广谱大环内酯类抗生素。其临床应用领域的扩大和以阿奇霉素、罗红霉素、克拉霉素等为代表的新型半合成红霉素的出现,快速拉动了红霉素原料药的生产需求。过去几年,国际抗生素的市场规模大约在350亿~380亿美元之间,2012年有望达到450亿美元。据西方经济学家预测,2010年红霉素系列产品的全球市场总规模达70亿美元以上,市场前景乐观。抗生素发酵生产本身是高耗能产业,存在环境污染等问题,发达国家近年来正逐步把抗生素原料药的生产转移到中国等发展中国家。目前,我国是世界上红霉素生产和出口的第一大国,年产量超过7000吨。刘文介绍,由于许多抗生素具有十分复杂的化学结构,采用化学方法大量合成往往需要繁杂的工艺途径和苛刻的反应条件,在制药工业上的实际应用价值相当有限。采用微生物发酵是获取药用抗生素原料的主要途径,而我国作为世界上原料抗生素的主要生产大国,发酵单位偏低、产品质量偏低、缺乏自主知识产权的新型抗生素药物等一系列原因却严重制约了这一产业的发展。自红霉素作为一种广谱抗生素药物进入临床以来,以提高其产生菌种发酵单位为目的的遗传育种工作一直未曾停止。由于对微生物次级代谢产物生物合成的机制了解不多,常规诱变选育的方法存在周期长、效率低和随机性大的缺点,近年来在红霉素高产菌株的筛选方面收效不大。随着分子生物学技术的发展,国际上在红霉素产生菌种的基因工程改造方面进行了诸多尝试;然而,这些研究主要集中在与红霉素产生相关的底物供应或限制因素的改进方面,并未就红霉素生物合成的次生代谢途径做特异性的遗传修饰,因此,在解决红霉素生产中经常面临的有效组分偏低等问题时,缺乏有效的针对性。作为中科院“百人计划”、国家杰出青年基金获得者,自2007年以来,刘文带领课题组以包括红霉素、阿维菌素、林可霉素、泰乐菌素和螺旋霉素等大宗抗生素产品为对象,就我国抗生素原料药产业普遍存在的问题进行了分析,提出了以组分优化为切入点、采用遗传操作来控制体内合成的化学反应,从而改善产品质量和产量的研究思路。基于红霉素各组分结构的差异和相互转化的化学本质,他们运用组合生物合成技术的方法和原理对红霉素工业用高产菌株进行了针对性的遗传改良。通过发酵过程中后修饰酶的表达比例调整,他们将无效副产物组分B和C几乎完全转化为有效组分红霉素A,从而在提高了产品质量(基本消除主要的副产物)的同时,有效地提高了产品的产量达25%左右。部分研究成果发表在国际著名学术刊物《应用和环境微生物》上,引起国内外同行的关注。有关重组菌株在华东理工大学的协助下完成了中试,已在湖北宜都东阳光生化制药有限公司进行了放大和试生产,具备了工业化生产的价值。据厂方估计,相关生产技术若能得以推广使用,每年所产生的经济效益将达10亿元以上。这一重要成果还获得了上海市科技进步奖一等奖,并申请国家专利4项。有关专家认为,其在红霉素发酵工业方面的应用,将明显改善产品质量、简化下游纯化工艺;同时,缓解企业在环境污染方面所面临的压力。“抗生素在微生物体内的合成其本质是化学问题,化学过程和机制的解析可以使生物学技术的运用找到合适的目标并发挥更大作用。”刘文表示,“以上是我们构建的第一代红霉素生产重组菌株,主要侧重于品质(组分优化)的提升。目前我们侧重于产量提高的第二代重组菌株已完成中试,结合前两代优势、综合提高质量和产量的第三代重组菌株完成了小试,初步数据表明效果明显。”作为上海有机所开展红霉素菌种遗传改造工作的最初建议者,中国科学院院士戴立信高度关注面向国家重大需求的科学研究。“以汪猷先生为代表的有机所老一辈科学家早在上世纪50年代就开展了抗生素的研究工作,并在实际生产中得到应用,解决了当时有和无的问题。我国现在已经成为红霉素第一生产大国,对于技术创新的需求尤为迫切。”他思路非常清晰,“我听了刘文教授关于生物合成的学术报告后,又了解了一些红霉素生产企业的现状和需求,感觉在生物技术中融入化学的理念,应该有可能解决一些生产中的瓶颈问题并产生不错的效果。”“这是有机所在知识创新过程中,在面向国家需求、立足原始创新方面所做的一件有重要意义的研究工作,充分体现了学科交叉的优势。”中科院上海有机所所长丁奎岭表示,“我们以化学的思想促进生物技术的应用,以提高大宗医药抗生素产品的产量和质量为研究目标,所要解决的关键问题在抗生素生产中具有普遍意义。红霉素工业用生产菌种的遗传改造取得的系列创新技术在生产中成功实施,预示着这样的理念在其他抗生素发酵生产中将有着普遍的推广意义,有利于促进我国传统抗生素生产行业整体技术水平的提升。”
老师们好哈,最近公司做链霉素项目,我们公司是做农药5批次的,我做的就是杂质纯化,要原药里50mg杂质纯品,链霉素各位老师应该都知道,不保留,现在方法开发好了,用的是庚烷磺酸钠,这应该是通用的方法。氨基柱也试过205nm基线噪音有点大,效果也不好。总之用庚烷磺酸钠跑出来5个杂质,液相归一含量低于1%,如果是别的项目也好做,但是链霉素不容有机溶剂,过普通硅胶柱都没法过,而且链霉素也没办法走质谱,确定杂质分子量,就算确定分子量结构猜出来也无法合成,正相柱也试过效果也不好,过柱子基本放弃。中高压制备的话流动相也用的庚烷磺酸钠,但是制备上样量太大,链霉素还没来得及和庚烷磺酸钠结合就直接被冲不来,大部分不保留,而且制备上也基本看不到杂质峰,如果制备出来,后面怎么除去庚烷磺酸钠也是问题。能有老师傅懂的么,要不要换个液相条件跑跑,让杂质少一点,或者给我出出主意怎么才能拿到杂质纯品,现在是没办法了。感觉所有的都试过了。如果能提点建议,真就帮了大忙了,各位老师傅们,我在这里跪谢了。
求助红霉素相关的文献5篇 悬赏50分 每篇10分 谢谢大家【序号】: 1【作者】:杨志和 【题名】:硫氰酸红霉素转碱工艺的优化【期刊】: 华东理工大学 硕士论文【年、卷、期、起止页码】: 【全文链接】: 【序号】: 2【作者】:尚永崇 【题名】:重组红霉素工业菌发酵优化与工业规模放大规律研究【期刊】: 华东理工大学 硕士论文【年、卷、期、起止页码】: 【全文链接】: 【序号】: 3【作者】:王向辉 【题名】:红霉素反应结晶过程的研究【期刊】: 华东理工大学 硕士论文【年、卷、期、起止页码】: 【全文链接】: 【序号】: 4【作者】:叶文杰 【题名】:红霉素硫氰酸盐转碱结晶工艺研究【期刊】: 华东理工大学 硕士论文【年、卷、期、起止页码】: 【全文链接】: 【序号】: 5【作者】:马清进 【题名】:硫氰酸红霉素提取工艺的优化【期刊】: 华东理工大学 硕士论文【年、卷、期、起止页码】: 【全文链接】:
单位工艺生产出来的克拉霉素在主峰的相对保留时间0.84处出现了一个超过0.1%的杂质,现在需要对其进行结构确证。对这个未知杂质,我们了解的情况是,(一)这个杂质对EP/USP液相条件很是敏感的,主要体现在流动相的PH值上,EP/USP液相条件的缓冲液PH值是4.4,当我们把PH值调到4.0时,其他峰的保留时间基本没有变化,提前约0.2~0.3min,但是该杂质的保留时间提前约2min;当把PH调到5.0时,其他峰的保留时间也是基本不变,但是该杂质在主峰之后出峰了,大约延后了约4min。(二)将该杂质接出来做[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url],最明显的离子峰是748.4,但是这个峰是不是分子离子峰不是很确定,继续对这个离子做多级[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url],其主要碎片情况与克拉霉素一样。EP/USP液相条件:溶液A— 4.76 g磷酸二氢钾至1000ml水中,用磷酸) (l - 10) 或氢氧化钾(45% w/v) 调PH至4.4溶液B— 乙腈. Time (minutes) Solution A (%) Solution B (%) 0 75 2532 40 6034 40 6036 75 2542 75 25 流速是1.1ml/min然后我们根据748.4的离子峰,以及工艺,推测了几个可能的杂质,希望大家帮我看看,哪个可能,或者是不是还有其他的可能呢? [img]http://ng1.17img.cn/bbsfiles/images/2010/01/201001280805_199202_1638724_3.jpg[/img]
求求大家分享一下林可霉素和红霉素的洗脱液和洗脱梯度吧,我用的20762这个标准,林可霉素的加标回收率一直很低
有没有在做红霉素液相的大神,最近做红霉素液相一点进展都没有,试了各种液相条件,都没有达到理想的效果,要不然就是不出峰,要不然就是浓度和峰面积不成比例。又跑去分析中心测,最后的结果说在210nm处没有吸收峰。分析中心的用的流动相是:A0.1%的甲酸+10mmol的乙酸铵,B甲醇,以梯度洗提的方式A:B=95:5到5:95.最后在210处没有任何峰了,,问问题可能出在了哪里
有没有专门检测红霉素的设备。
检测有机磷,氨基甲酸酯类、磺胺类、呋喃类,氯霉素类、红霉素、青霉素等,用什么色谱柱?
1.概述REAGEN™红霉素酶联免疫反应测试盒是用于检测水/尿/肉/鱼/虾中的红霉素的残留量。该试剂盒特点包括:Ø 高回收率(80-105%),快速(10-40分钟),多种样品低成本提取方法。Ø 高灵敏度(0.5ng/g或ppb),牛奶检测下限(2.5 ppb)。Ø 高重现性。Ø 快速的ELISA检测方法(只需不到2小时)。2.试剂盒原理REAGEN™红霉素酶联免疫反应测试盒基于竞争性酶联反应原理,含有红霉素的药物抗原已经包被于微孔板上,在分析时,样品中药物特异性地与抗体相结合。如果药品中有药物存在,它将阻止包被于微孔板上的药物与抗体结合。当与样品药物相结合的药物抗体被洗涤去除后,只剩下与微孔内药物相结合的抗体,与经酶标记物相结合。反应后颜色深度与样品中红霉素的含量成反比。
2010版药典中,罗红霉素的含量检测项下的系统适用性下新增加的红霉素峰与罗红霉素峰的分离度不得小于15.0,我们试做了几次都不成功,请教各位前辈,是否可告知具体操作
维权声明:本文为012304原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现的,均属侵权违法行为,我们将追究法律责任。蜂蜜中红霉素残留量的检验方法的不确定度评估报告1 目的进出口动物源性食品中红霉素测量结果的不确定度测评。2 依据《红霉素(Erythromycin)检测作业指导书》。3 范围动物源性食品蜂蜜。4 方法概要4.1样品制备。┅┅取1.0±0.05g蜂蜜样本,加入2ml去离子水,涡动2 min至蜂蜜全部溶解,加入100ml0.1M氢氧化钠溶液;涡动混匀,再加入8ml三氯甲烷,充分振荡5min;3000g以上,室温(20-25℃/68-77°F)离心5 min;┅┅去除上层的杂质相,取下层有机相4ml,50-60℃水浴氮气吹干/ 旋转蒸发至干;┅┅加入1ml复溶工作液,涡动5min;4.2测量样品。将样品经酶联免疫反应,在酶标仪中, 450nm/630nm条件下检测,在450nm /630波长下检测吸光度,吸光值与样品中的红霉素浓度成反比。4.3标样制备。将标液在实验前20min取出,恢复到室温,使用前摇匀。4.4比较定量。待测样品与标准溶液比较定量。4.5实验条件和引用数据。本实验在室温下进行。本法红霉素的加标回收率为(90~110)%。5数学模型y = C×F×V×100/( m×100)………………………(1)式中:y——红霉素的含量(ppb);C——进样样液的浓度(ppb);F——稀释倍数;V——定容容积,vL;m——样品的质量,g。6仪器设备、计量器具、标准物质①移液枪检定 移液枪检定点(μL) 容量相对误差(%) 重复性(%) 10 +3.8 1.7 50 +2.5 0.5 100 +2.7 0.2 1000 +1.2 0.1 ②A级移液管10 mL,允差为±0.020 mL;③A级容量瓶,100 mL, 允差为±0.10 mL;④A级容量瓶,1 000 mL, 允差为±0.40 mL;⑤电子天平,0~200 g,允差为±0.000 2 g;⑥CAS: 114-07-8红霉素标准储备液,ρ=1ppm,U=±0.50%,k=3。7计算测量结果及标准差(单位:ppb)在重复性条件下,对蜂蜜样品进行5次测量,5次测量数据为0.358 0.331 0.355 0.351 0.351平均值0.349ppb;单次测量标-准偏差s=0.009ppb平均值的标准偏差sa=0.009/51/2=0.004ppb;8 不确定度分量的识别、分析、量
罗红霉素按《中国药典》2005版分析,峰严重拖尾,拖尾因子在2点几,不知各位有什么经验,交流一下!
大家好,求助红霉素的液相色谱检测方法,急用,谢谢![em61]
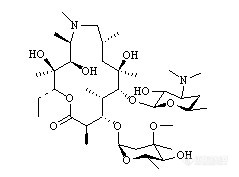
罗红霉素分散片含量的测定一.样品分子结构分子式:C41H76N2O15分子量:837.05CAS号:80214-83-1罗红霉素分散片测定主成分的结构http://ng1.17img.cn/bbsfiles/images/2009/11/200911202247_185655_1621890_3.gif二. 样品来源记录样品商品名 样品测定描述(主成分含量测定):生产厂家:海南xxx医药生物技术有限公司,批号:080502,规格:150mg三. 液相方法条件液相色谱条件:色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以0.067mol/L磷酸二氢铵溶液(用三乙胺调节pH值至6.5)-乙腈(65﹕35)为流动相;检测波长为210nm;罗红霉素的保留时间不少于9分钟,其与前相邻杂质峰的分离度不得小于1.0,与后相邻杂质峰的分离度不得小于2.0;理论板数按罗红霉素峰计算不低于2500。测定法 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中含1mg的溶液,精密量取20µl注入色谱仪,记录色谱图;另取罗红霉素对照品,同法测定。按外标法以峰面积计算供试品中C41H76N2O15的含量。谱图:使用UltimateTM XB-C18, 5um, 4.6×200mm柱子得到的色谱图详见图一http://ng1.17img.cn/bbsfiles/images/2009/11/200911202249_185656_1621890_3.jpg
最近用高效液相(C18色谱柱 250mm * 4.6, 5um)做红霉素标准品时检测不到色谱峰。看文献大多数都用磷酸盐缓冲溶液和乙腈作为流动相,之后用紫外(210nm)检测。目前因为缓冲盐干扰其他组员的检测,所以不得不尝试用纯水(或者加了0.5%醋酸的纯水)和乙腈做流动相。但是奇怪的是进样品后即使用100%乙腈冲一个小时都见不到峰。我可以确定标准品,检测器和色谱仪器没有问题。当然样品浓度也够大。。有没有遇到这种情况的啊??个人感觉是标准品一直留在色谱柱里没出来,但是觉得说不通啊!!晕!!! 希望大家给指点下,先谢了~~~ 【目前手边没有其它C18色谱柱】再补充的详细些。色谱柱为Thermo scientific BDS Hypersil C18,比较新。楼下“老多”说的不是什么流动相都出峰也是我比较关心的。难道红霉素必须得用缓冲盐?
顶空做依托红霉素,按药典中平衡温度90度,平衡时间30分钟,平衡时间指的是加热时间吗?
过柱淋洗是12ml水,洗脱是9ml甲醇,氮吹到剩一点,回收率做出来只有1%,这是什么原因?标曲里面红霉素没有问题。