如何购买欧洲药典标准品?[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=106895]如何购买欧洲药典标准品?[/url]
欧洲药典标准品介绍可提供1900多个参考标准品欧洲药典个论规定并正式有效:化学物质、生物制品和对照图谱。新:可在线查阅参考标准品批号有效期说明(BVS)。这个工具便于用户保证上批标准品效期的可追踪性。新启用参考标准品清单也同时在线公布。 欧洲药典:质量和可靠性的保证EDQM实验室按EP个论规定方法选择和检查参考标准品批号及其制备, 其官方报告由欧洲药典委员会批准。网址:http://crs.edqm.eu/需注意,欧洲药典标准品由于已通过欧洲药品委员会认证,故标准品不随带证书(见《欧洲药典关于标准品证书的声明》),纯度和有效期见以下介绍。欧洲药典关于纯度和有效期的说明:关于有纯度:一般可作为100%使用,详见以下描述。TOPICS : 03- Ph.Eur. REFERENCE STANDARDS (CRS/BRP) / 01- General / 05. How can I find out the assay/content of a CRS? You can obtain it from our catalogue of reference standards, which is available at http://CRS.edqm.eu. If the content is not required to perform the test(s) described in the Ph.Eur. monograph (see also the FAQ about "What is the intended use of CRS/BRP?"), it is not indicated in the catalogue or on the label (or on the leaflet) and you cannot assume the content of a CRS to be 100% for a quantitative test.However, when an impurity reference standard is used in a related substances test for the control of impurity, if no assigned content is stated on the label, the purity of the reference standard, for the purpose of this estimation, is considered to be 100 per cent.关于有效期:TOPICS : 03- Ph.Eur. REFERENCE STANDARDS (CRS/BRP) / 01- General / 04. How do we find out the Expiry date of CRS/BRP? No expiry date is indicated as European Pharmacopoeia Reference Standards are monitored regularly. It is down to the user to demonstrate that the CRS/BRP used in an official Ph. Eur. test or assay was current at the time of use. The “information” column of the catalogue may indicate an official date on which the batch is no longer valid as a CRS/BRP. Therefore, it is recommended to purchase only a sufficient amount for immediate need and to use the products as soon as possible. Moreover, the stability of the contents of opened vials or ampoules cannot be guaranteed.[em0812]
小编曾在前几期的推文中归纳了常见的标准品名称与类别,介绍了ISO国际标准体系、国内的国家计量技术规范体系和国家标准体系下标准品的区别,但是,医药行业的朋友需要使用的药典体系的标准品只是简单提及。由于药典体系对标准品的定义、分类、用途与上述规范体系定义的标准品不同,需要另外说明。[b]“药典标准品”[/b]只是一个通称,由于“标准品”在药典体系中有明确定义,因此后续使用“标准物质”代替。[align=center][img]http://img70.chem17.com/9/20190927/637051818691501895319.jpg[/img][/align][color=#3e3e3e]那么接下来小编就来给大家说说药典标准物质的那些事儿。[/color][b]什么是药典标准物质?药典标准物质[/b]是由国际或各国家ji药典机构收录、研制提供的标准物质,主要分为“标准品”、“对照品”等,2015年版《中国药典》针对不同种类的药品有不同分类。根据品质与使用需要,药典标准物质在我国可大致分为三大类:[i][b]1.[/b][/i][b]进口标准物质[/b]由国际药典或其他国家药典机构如美国药典(USP)、英国药典(BP)、欧洲药典(EP)等收录并提供的现行批号的标准物质。高品质,可不经标定直接使用,可作为基准物质标定工作标准物质,但比较昂贵。[i][b]2.[/b][/i][b]国家药品标准物质[/b][color=#3e3e3e]在2015版《中国药典》中有明确定义,可作为基准物质标定工作标准物质。中国食品药品检定研究院(简称“中检院”)是研制、分装、分发、保存国家药品标准物质的唯yi单位。[/color][align=center][color=#ed6e0e][/color][/align][i][b]3.[/b][/i][b]工作标准物质[/b][color=#3e3e3e]自行研制或市售的[/color][b]非药典机构[/b][color=#3e3e3e]的标准物质,成本较低,使用前须经法定药典标准物质标定。[/color][b]什么是国家药品标准品物质?[/b]《中国药典》2015年版 四部《0291国家药品标准物质通则》规定:[b]“国家药品标准物质系指供国家法定药品标准中药品的物理、化学及生物学等测试用,具有确定的特性或量值,用于校准设备、评价测量方法、给供试药品赋值或鉴别用的物质。”[/b][color=#3e3e3e]根据定义与说明,国家药典标准物质具国家标准体系的“[b]标准样品[/b]”的性质,是《中国药典》所收录的各类药品、杂质成分、辅料等文本标准对应的实物标准,是检查药品质量的特殊的专用量具,是测量药品质量的基准。[/color][color=#3e3e3e]在《中国药典》2015版中,我国药品主要被分为中药、化学合成药、生物制品三大类,分别收录于一部、二部、三部,在这三部的凡例中分别根据用途规定了三类药品标准物质的类别:[/color][b][color=#3e3e3e]🔹 据一部《凡例》,中药标准物质分为:标准品、对照品、对照药材、对照提取物;[/color][color=#3e3e3e]🔹 据二部《凡例》,化学合成药标准物质分为:标准品、对照品(又称化学对照品);[/color][color=#3e3e3e]🔹 据三部《凡例》,生物制品标准物质分为标准品、对照品、参考品。[/color][/b]这些分类在四部《0291国家药品标准物质通则》被总结为五类,定义如下:[i][b]1.[/b][/i][b]标准品[/b][color=#3e3e3e]系指含有单一成分或混合组分,用于[/color][b]生物检定、抗生素或生化药品中效价、毒性或含量测定[/b][color=#3e3e3e]的国家药品标准物质。其生物学活性以国际单位(IU)、单位(U)或以重量单位(g,mg,μg)表示。[/color][i][b]2.[/b][/i][b]对照品[/b][color=#3e3e3e]系指含有单一成分、组合成分或混合组分,用于化学药品、抗生素、部分生化药品、药用辅料、中药材(含饮片)、提取物、中成药、生物制品(理化测定)等检验及仪器校准用的国家药品标准物质。在药典二部、四部《凡例》中提及,对照品用于理化分析,其特性量值一般按纯度(%)计。[/color][i][b]3.[/b][/i][b]对照提取物[/b][color=#3e3e3e]系指经特定提取工艺制备的含有多种主要有效成分或指标性成分,用于中药材(含饮片)、提取物、中成药等鉴别或含量测定用的国家药品标准物质。[/color][i][b]4.[/b][/i][b]对照药材[/b][color=#3e3e3e]系指基原明确、药用部位准确的优质中药材经适当处理后,用于中药材(含饮片)、提取物、中成药等鉴别用的国家药品标准物质。[/color][i][b]5.[/b][/i][b]参考品[/b][color=#3e3e3e]系指用于定性鉴定[/color][b]微生物(或其产物)[/b][color=#3e3e3e]或定量检测某些制品生物效价和生物活性的国家药品标准物质,其效价以特定活性单位表示;或指由生物试剂、生物材料或特异性抗血清制备的用于疾病诊断的参考物质。[/color][b]怎么购买标准品呢?[/b]知道了上面的这些信息,对我们购买标准品有什么帮助呢?[i][b]1.[/b][/i][b]了解如何选购药典标准物质[/b][color=#3e3e3e]在需要严格按照药典方法进行试验的前提下,根据实际用途选择合适类型的标准物质;经费足够的情况下可直接购买中检院或各国药典机构研制的法定标准物质,经费不充裕亦可使用经法定标准物质标定且标定结果符合需求的工作标准物质。如仅需要满足某些检测指标比如只需要定性,也可使用其他体系的标准物质/标准样品。[/color][i][b]2.[/b][/i][b]轻松区分药典标准物质与其他体系标准品[/b][color=#3e3e3e]药典体系对标准物质有独有的分类,比如“对照药材”、“对照提取物”、“中药对照品”、“杂质对照品”等,如是“标准品”“标准物质”此类容易混淆的类别,可通过单位、产品名称、证书内容与其他规范体系的“标准样品”、“标准物质”区分。[/color][color=rgba(62, 62, 62, 0.62)]参考资料:[/color][color=rgba(62, 62, 62, 0.62)]国家药典委员会. 《中华人民共和国药典》2015年版// 中华人民共和国药典(2015年版). 2000.[/color][color=rgba(62, 62, 62, 0.62)]张晓松. 中国药典的化学对照品. 中国药业, 2004, 13(5):24-25.[/color][color=rgba(62, 62, 62, 0.62)]朱霁虹. 药物标准物质的发展和应用概况. 中国药品标准, 2000(1):15-16.[/color][color=rgba(62, 62, 62, 0.62)]牛剑钊, 宁保明, 张启明. 国内外化学药品标准物质的研究与应用. 中国药学杂志, 2011, 46(11):877-879.[/color]
五年磨砺,一朝亮剑!近日,国家食品药品监管总局发布《中国药典》(2015年版)。新版药典终于登上了药品监管与医药卫生行业改革与发展的舞台,这也是我国药品监管领域期待已久的一件盛事。新版药典的颁布标志着我国用药水平、制药水平以及监管水平的全面提升,将促进药品质量的整体提高,对于保障公众用药安全有效意义重大。药品安全,关乎人命,关系着中华民族整体的健康水平乃至繁衍生息,一直受到党和国家的高度重视。在最近中央政治局第二十三次集体学习时,习近平总书记进一步强调要用“四个最严”切实加强食品药品安全监管,并首次提出要“坚持产管并重”,对药品安全“严把从实验室到医院的每一道防线”。 作为“四个最严”之首的“最严谨的标准”的具体体现,新版药典为我们提供了最基本的要求与准则,是不可逾越的红线。今后5年,新版药典在经受药品监管与医药卫生实践检验与洗礼、见证历史与创造历史的同时,更需要全社会的充分理解、信任乃至敬畏,并得到全面贯彻与认真执行。 6月3日,本报围绕当下银杏叶提取物事件,在头版头条发表《留给违法企业的时间已经不多了》的署名文章。该文分析认为,某些企业为降低成本,把药典中规定的用稀乙醇提取工艺改为用稀盐酸提取,是造成这次银杏叶药品市场地震的两大根源之一。由此举一反三,分析既往发生的药害事件,我们不难看出,长期以来,一些药企之所以敢冒天下之大不韪,“前赴后继”生产经营假劣药品,是他们缺乏对国家药典的敬畏之心,缺乏对老百姓用药安全与生命健康的起码责任。 药品生产与监管实践告诫我们,面对药典标准,任性而为,是产业健康发展之灾,是人民安全用药之祸!但“利字边上一把刀”,“举头三尺有神明”,这把“刀”就是药典,这“神明”就是国家法律。谁不敬畏国家药典,谁就难逃国家法律的追究甚至严厉制裁!在此,我们不禁要棒喝一声:执行药典标准绝不可心存侥幸,更不可任性。 普通读者也许要问何为药典?辞海说药典是记载药品标准、规格的法典。而从药品监管的角度来说,药典也是评判药品质量的权威性典章,还是监督药品质量标准执行的法定依据。这一定义铸就了药典在药品生产经营及安全监管中的崇高地位,也决定了药典是维护公众健康,保障用药安全有效的“防护墙”;是引领产业结构调整和产品质量升级的“导航仪”;是提升企业核心竞争力的“杀手锏”;是推动药品监管科学化的“基准线”。这充分显示出药典在药品生产经营和安全监督过程中发挥着不可替代的作用。 难以想象,一个国家没有一部高水平的药典,如何保障自己的国民安全用药,如何保障医药产业正常参与国际贸易?一个药品行政或技术监管机构没有配备药典,不熟悉了解药典,如何去履行法律赋予的神圣监管职责?一个药品生产经营企业没有配备药典,或者有了药典却束之高阁不去切实遵守,如何保证生产、经营安全有效的药品? 一个医疗机构没有配备药典,或者不按药典基本要求处方,又如何科学合理地临床用药、救死扶伤?尤其是在中国经济与社会发展新常态下,即将实施的《中国药典》(2015年版),对于提高药品技术门槛,促进药品质量优胜劣汰,推动医药产业健康发展和中国制药“走出去”战略的实施具有重要意义。这充分表明,对医药市场各利益主体来说,主动配备学习、深刻理解、严格执行新版药典,既是一种权利,也是义不容辞的责任与义务! 桃李不言,下自成蹊。一部药典的崇高地位与重要作用被广泛认可,其背后自有她潜藏的逻辑。首先,任何一部新版药典总是当今最新医药科技成果在药品标准制定时最大限度的转化与运用,体现了制定者和自觉执行者的与时俱进与科技水平。 其次,药典是药品标准这一科学规范的集大成者,也是对执行者最基本的要求。药品标准的内容不仅包括药品检验方法、质量指标及限度规定,还包括生产工艺和处方组成的规定,同样应当遵守。 未经批准擅自改变生产工艺,或者不按批准的工艺标准执行都属违反药品管理法规的行为。 第三,新版药典是对新时期药品监管和最新医药卫生实践的总结,需要全社会共同遵循并指导当前与将来的实践。 历史的经验反复证明,敬畏药典,崇尚法治,是产业健康发展之幸,是人民安全用药之福!这既是一种物质需求,也是一种精神追求,某种意义上更是一种对国家药品标准的信赖与信仰。我们要从“四个最严”的政治高度进一步要求自己:执行药典绝不可心存侥幸,更不可任性(来源中国医药报)
日前,烟台东诚生化股份有限公司研发质检中心项目成功奠基。科技部生物中心副主任安道昌、中国生化制药工业协会常务副会长徐康森、山东省科技厅副厅长徐茂波等国家和省市有关部门领导出席仪式。烟台开发区工委副书记、管委副主任刘建民出席活动并致辞。 东诚生化(002675),是一家以肝素钠和硫酸软骨素系列产品为主要产品的高新技术企业,于2012年5月25日登陆深交所中小板。作为公司IPO的募投项目之一,研发质检中心项目的实施将快速提升公司的研发能力和质量保证水平,有效解决公司生产规模扩大、产品线延伸及项目研发的瓶颈,进一步增强公司的核心竞争力。根据规划设计,该研发质检中心项目占地面积1260平方米,内设多糖实验室、色谱中试实验室、化学合成药物实验室、制剂实验室以及中药实验室。 该募投项目的迅速开展,是公司一贯重视技术研发的一个注脚。目前,公司已经形成了以研发部为核心,以化验室、生产技术部、中试车间为支撑的研发体系。2009年,公司受国家药典委员会邀请,参与起草硫酸软骨素钠中国药典标准,并为新制定的标准提供标准品;受欧盟EDQM邀请参与肝素原料药欧洲药典(ep标准品)的修订(提高),受邀参与肝素钠原料药中国药典标准的修订(提高)。2010年公司承担了国家“重大新药创制”科技重大专项《国家山东创新药物孵化基地建设项目》中的两个子项目。项目完成后,公司肝素生产工艺将进一步优化,同时公司也将拥有一个自主知识产权的一类新药。 研发中心建成后,公司将以此为契机,进一步提升自主研发能力和水平,促进新型、安全、高效新药产品研发,从而不断拓展公司新的经济增长点,促进企业持续快速发展。本文转载自: http://www.uwalab.com/news/623.htm
如题。一直以来困扰我呐。为什么药厂的客户总是钟情于中检所,药典的标准品呢?有次一个药厂的客户因为中检所的产品断货,和我们买了一大批Dr.的罗红霉素,结果说是不合适,测下来的纯度不够,我们和供应商反映,最终无果。药厂的贴友多说说,必须使用药典系统的产品么?
转自广州日报。 新版《药典》本月正式实施,有七成左右的药品标准得到完善和提高,由于药典是我国药品生产的最低标准,标准的提高将形成新的门槛,业内预计,这势必引发部分不达标企业产品的停产,也让难以承受成本压力的企业淘汰出局。 本报讯 如果按照新的药品标准来生产消炎利胆片,全国目前只有一半该药的企业能够做到。而这就是新版《药典》的杀伤力。现在很多药厂都在为执行新药典标准而头疼。"昨天,一位医药界人士对记者如是说。 行业门槛大大提高 据悉,2010版药典共收载品种4598个,新增1462个,其中中药收载2193种,新增990种,修订612种。全国人大常委会副委员长桑国卫公开表示:"新版药典收载品种增加了40%以上,而且对70%的原有标准进行了完善或者提高,这意味着对上市药品质量控制的要求越来越严格。" "新《药典》对中成药和中药材的影响最大。"广州一家大型医药集团工程师告诉记者。据悉,此次药典大量加入了中药的比例,较之前版本增加82.3%,这对部分中药生产企业形成压力。 以消炎利胆片为例,新质量标准共增修了11项内容,其中关键一项"穿心莲内酯含量",比原标准提高了近5倍。 药厂成本压力大幅增加 全国最大的消炎利胆片生产厂家广东罗浮山国药市场部长郑传誉对记者表示,全国有50多家企业在生产该药,10月1日后,生产厂家只有20余家有条件按新标准来生产。 新标准在提升技术门槛的同时也大大增加了企业的成本压力。郑传誉表示:"公司80多个中药品种有50多个纳入新药典的规范中。今年上半年光设备引进就花费了1000多万。" 本次新《药典》还有一亮点就是对新的质量控制手段的应用,而这将可能成为新的技术壁垒。[b][color=#f10b00] 土豆点评:仪器厂商的喜讯,中小药企的杯具。[/color][/b]
2010年版《中国药典》已经编制完成,2009年年底前将由中国医药科技出版社出版发行,2010年7月1日正式实施。 《中国药典》是国家为保证药品质量可控、确保人民用药安全有效而依法制定的药品法典,是药品研制、生产、经营、使用和管理都必须严格遵守的法定依据,是国家药品标准体系的核心,是开展国际交流与合作的重要内容。 2010年版《中国药典》是新中国成立60年来组织编制的第九版药典,新版药典在总结历版药典的基础上,充分利用近年来国内外药品标准资源,注重创新与发展,实事求是地反映了我国医药产业和临床用药水平的发展现状,为进一步加强药品监督管理提供了强有力的技术支撑。 2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。2010年版《中国药典》收载品种4600余种,其中新增1300余种,基本覆盖国家基本药物目录品种和国家医疗保险目录品种。 2010年版《中国药典》有以下主要特点: 一、药品安全性得到进一步保障 在药品安全性方面,除在附录中加强安全性检查总体要求外,在品种正文标准中也大幅度增加或完善安全性检查项目,进一步提高对高风险品种的标准要求,进一步加强对重金属或有害元素、杂质、残留溶剂等的控制,并规定眼用制剂按无菌制剂要求,明确用于烧伤或严重创伤的外用剂型均按无菌要求。新版药典的附录和凡例等通用性、基础性技术规定与要求,对药典以外的所有上市药品都有直接的作用和影响力。 在有效性和质量可控性方面,除新增和修订相关的检查方法和指导原则外,在品种正文标准中增加或完善有效性检查项目,大幅度增加了符合中药特点的专属性鉴别,含量测定采用了专属性更强的检查方法,增加溶出度、含量均匀度等检查项目。 2010年版《中国药典》重点药品标准的系统性提高工作,对高风险药品尤为重视。新版药典增加了化学药注射剂安全性检查法应用指导原则;在制剂通则中将渗透压摩尔浓度检查作为注射剂的必检项目;对药典一部收载的中药注射剂品种全部增加了重金属和有害元素限度标准;此外对于其他注射剂品种的标准也不同程度地增加了对产品安全性、有效性及质量可控性等方面的质控要求,这些措施对于解决注射剂、特别是中药注射剂的安全性问题必将起到积极的作用。 二、中药标准整体水平全面提升 (一)中药收载品种数量大幅度提高 新版药典收载中药材、中药饮片、中成药和中药提取物标准大幅提升,一举改变和扭转长期以来收载品种少、基础差,尤其是中药饮片缺乏标准的局面。在中药资源保护及其相关标准技术创新得到跨越式发展。 (二)中药品种分别增加和完善了安全性质控指标。 一是在中药附录中加强安全性检查总体要求。如在附录制剂通则中,口服酊剂增订甲醇限量检查,橡胶膏剂首次提出不得检出致病菌检查要求等;在附录检测方法中,新增二氧化硫残留量测定法、黄曲霉毒素测定法、渗透压摩尔浓度测定法、异常毒性检查法、降压物质检查法、过敏反应检查法、溶血与凝聚检查法等。 二是在中药正文标准中增加或完善安全性检查项目。如对易霉变的桃仁、杏仁等新增黄曲霉素检测,方法和限度与国际一致;在正文标准中全面禁用苯作为溶剂;对工艺中使用有机溶剂的均检查有机溶剂残留;对川乌、草乌、马钱子等剧毒性饮片,采用高效液相色谱法(HPLC)等更先进、更精确的方法加以限量检查。 三是在重金属和有害元素控制方面,新版药典采用电感耦合等离子体质谱(ICP-MS)测定中药中砷、汞、铅、镉、铜的含量;对一部所有中药注射剂及枸杞子、山楂、人参、党参等用药时间长、儿童常用的品种均增加了重金属和有害元素限度标准。 (三)解决了中药饮片标准的问题。 2010年版《中国药典》的一个主要特点就是,大幅增加了中药饮片标准的收载数量,初步解决了长期困扰中药饮片产业发展的国家标准较少、地方炮制规范不统一等问题。对于提高中药饮片质量,保证中医临床用药的安全有效,推动中药饮片产业健康发展,将起到积极的作用。 (四)大幅增加符合中药特点的专属性鉴定。 新版药典大幅增加符合中药特点的专属性鉴别。 一是中药标准中不再使用颜色或沉淀的化学反应和光谱鉴别方法。 二是标准中大幅增加横切面或粉末显微鉴别。2005年版药典共收载显微鉴别620项;2010年版仅新增显微鉴别就达633项,所有的药材和饮片及含生药粉的中成药基本都增加了专属性很强的横切面或粉末显微鉴别。 三是标准中大量使用专属性较强的薄层色谱(TLC)鉴别技术。2005年版药典共收载薄层色谱鉴别1507项;2010年版药典仅新增薄层色谱鉴别就达2494项,除矿物药外均有专属性强的薄层鉴别方法。 三、现代分析技术广泛应用 一是扩大了对成熟新技术方法的收载。如附录中新增离子色谱法、核磁共振波谱法、拉曼光谱法指导原则等。中药品种中采用了液相色谱/质谱联用、DNA分子鉴定、薄层-生物自显影技术等方法,以提高分析灵敏度和专属性,解决常规分析方法无法解决的问题。新增药品微生物检验替代方法验证指导原则、微生物限度检查法应用指导原则、药品微生物实验室规范指导原则等,以缩小附录在微生物方面与国外药典的差距。 二是进一步扩大了对新技术的应用。除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用。 药典一部根据中医药理论和中药成分复杂的特点,建立能反映中药整体特性的方法,将反映中药内在质量整体变化情况的色谱指纹图谱技术应用到药品标准中,以保证质量的稳定均一。 药典化药品种中采用了分离效能更高的离子色谱法和毛细管电泳法;红外光谱在原料药和制剂鉴别中的应用进一步扩大;总有机碳测定法和电导率测定法被用于纯化水、注射用水等标准中;气相色谱技术被广泛用于检查残留溶剂等。 药典生物制品逐步采用体外方法替代动物试验用于生物制品活性/效价测定,采用灵敏度更高的病毒灭活验证方法等。 2010年版《中国药典》的颁布实施,必将在我国全面提高药品质量过程中起到积极而重要的作用,并将进一步扩大和提升我国药典在国际上的积极影响。
以下是国家药典委员会勘误药品标准中有关内容(7月~10月)转自医药网国家药典委员会关于勘误“乳块消胶囊”药品标准有关内容的函 (国药典中发〔2006〕325号) 各省、自治区、直辖市食品药品监督管理局(药品监督管理局): “乳块消胶囊”系国家药品监督管理局药品标准新药转正标准(中药)第 35 册收载的品种,标准编号为 WS 3 -250 ( Z-240 ) -2002 ( Z )。现申报单位提出原申报材料有误,经我会核查,由于原申报材料打印错误,该品种国家药品标准【含量测定】项下色谱条件与系统适用性试验“……乙腈—水—磷酸( 20 ∶ 80 ∶ 20 )为流动相”,应为“……乙腈—水—磷酸( 20 ∶ 80 ∶ 0.2 )为流动相”;【含量测定】项下供试品溶液的制备“……精密量取续滤液 10ml ,蒸干,残渣用 20ml 乙醚洗涤 3 次,……”,应为“……精密量取续滤液 10ml ,蒸干,残渣加水溶解,用乙酸乙酯振摇提取 4 次( 20 , 15 , 15 , 10ml ),合并乙酸乙酯提取液,蒸干,残渣用 20ml 乙醚洗涤 3 次,……”。特此勘误,自即日起照此执行。请有关省级食品药品监督管理局及时通知有关生产企业。 国家药典委员会 二〇〇六年十月三十日
[color=#DC143C]2009年10月10日 发布[/color]2010年版《中国药典》已经编制完成,年底前将由中国医药科技出版社出版发行,明年7月1日正式实施。 《中国药典》是国家为保证药品质量可控、确保人民用药安全有效而依法制定的药品法典,是药品研制、生产、经营、使用和管理都必须严格遵守的法定依据,是国家药品标准体系的核心,是开展国际交流与合作的重要内容。 2010年版《中国药典》是新中国成立60年来组织编制的第九版药典,新版药典在总结历版药典的基础上,充分利用近年来国内外药品标准资源,注重创新与发展,实事求是地反映了我国医药产业和临床用药水平的发展现状,为进一步加强药品监督管理提供了强有力的技术支撑。 2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。2010年版《中国药典》收载品种4600余种,其中新增1300余种,基本覆盖国家基本药物目录品种和国家医疗保险目录品种。 2010年版《中国药典》有以下主要特点: 一、药品安全性得到进一步保障 在药品安全性方面,除在附录中加强安全性检查总体要求外,在品种正文标准中也大幅度增加或完善安全性检查项目,进一步提高对高风险品种的标准要求,进一步加强对重金属或有害元素、杂质、残留溶剂等的控制,并规定眼用制剂按无菌制剂要求,明确用于烧伤或严重创伤的外用剂型均按无菌要求。新版药典的附录和凡例等通用性、基础性技术规定与要求,对药典以外的所有上市药品都有直接的作用和影响力。 在有效性和质量可控性方面,除新增和修订相关的检查方法和指导原则外,在品种正文标准中增加或完善有效性检查项目,大幅度增加了符合中药特点的专属性鉴别,含量测定采用了专属性更强的检查方法,增加溶出度、含量均匀度等检查项目。 2010年版《中国药典》重点药品标准的系统性提高工作,对高风险药品尤为重视。新版药典增加了化学药注射剂安全性检查法应用指导原则;在制剂通则中将渗透压摩尔浓度检查作为注射剂的必检项目;对药典一部收载的中药注射剂品种全部增加了重金属和有害元素限度标准;此外对于其他注射剂品种的标准也不同程度地增加了对产品安全性、有效性及质量可控性等方面的质控要求,这些措施对于解决注射剂、特别是中药注射剂的安全性问题必将起到积极的作用。 二、中药标准整体水平全面提升 (一)中药收载品种数量大幅度提高 新版药典收载中药材、中药饮片、中成药和中药提取物标准大幅提升,一举改变和扭转长期以来收载品种少、基础差,尤其是中药饮片缺乏标准的局面。在中药资源保护及其相关标准技术创新得到跨越式发展。 (二)中药品种分别增加和完善了安全性质控指标。 一是在中药附录中加强安全性检查总体要求。如在附录制剂通则中,口服酊剂增订甲醇限量检查,橡胶膏剂首次提出不得检出致病菌检查要求等;在附录检测方法中,新增二氧化硫残留量测定法、黄曲霉毒素测定法、渗透压摩尔浓度测定法、异常毒性检查法、降压物质检查法、过敏反应检查法、溶血与凝聚检查法等。 二是在中药正文标准中增加或完善安全性检查项目。如对易霉变的桃仁、杏仁等新增黄曲霉素检测,方法和限度与国际一致;在正文标准中全面禁用苯作为溶剂;对工艺中使用有机溶剂的均检查有机溶剂残留;对川乌、草乌、马钱子等剧毒性饮片,采用高效液相色谱法(HPLC)等更先进、更精确的方法加以限量检查。 三是在重金属和有害元素控制方面,新版药典采用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]([url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url])测定中药中砷、汞、铅、镉、铜的含量;对一部所有中药注射剂及枸杞子、山楂、人参、党参等用药时间长、儿童常用的品种均增加了重金属和有害元素限度标准。 (三)解决了中药饮片标准的问题。 2010年版《中国药典》的一个主要特点就是,大幅增加了中药饮片标准的收载数量,初步解决了长期困扰中药饮片产业发展的国家标准较少、地方炮制规范不统一等问题。对于提高中药饮片质量,保证中医临床用药的安全有效,推动中药饮片产业健康发展,将起到积极的作用。 (四)大幅增加符合中药特点的专属性鉴定。 新版药典大幅增加符合中药特点的专属性鉴别。 一是中药标准中不再使用颜色或沉淀的化学反应和光谱鉴别方法。 二是标准中大幅增加横切面或粉末显微鉴别。2005年版药典共收载显微鉴别620项;2010年版仅新增显微鉴别就达633项,所有的药材和饮片及含生药粉的中成药基本都增加了专属性很强的横切面或粉末显微鉴别。 三是标准中大量使用专属性较强的薄层色谱(TLC)鉴别技术。2005年版药典共收载薄层色谱鉴别1507项;2010年版药典仅新增薄层色谱鉴别就达2494项,除矿物药外均有专属性强的薄层鉴别方法。 三、现代分析技术广泛应用 一是扩大了对成熟新技术方法的收载。如附录中新增[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法、核磁共振波谱法、拉曼光谱法指导原则等。中药品种中采用了液相色谱/质谱联用、DNA分子鉴定、薄层-生物自显影技术等方法,以提高分析灵敏度和专属性,解决常规分析方法无法解决的问题。新增药品微生物检验替代方法验证指导原则、微生物限度检查法应用指导原则、药品微生物实验室规范指导原则等,以缩小附录在微生物方面与国外药典的差距。 二是进一步扩大了对新技术的应用。除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用。 药典一部根据中医药理论和中药成分复杂的特点,建立能反映中药整体特性的方法,将反映中药内在质量整体变化情况的色谱指纹图谱技术应用到药品标准中,以保证质量的稳定均一。 药典化药品种中采用了分离效能更高的[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法和毛细管电泳法;红外光谱在原料药和制剂鉴别中的应用进一步扩大;总有机碳测定法和电导率测定法被用于纯化水、注射用水等标准中;[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]技术被广泛用于检查残留溶剂等。 药典生物制品逐步采用体外方法替代动物试验用于生物制品活性/效价测定,采用灵敏度更高的病毒灭活验证方法等。 2010年版《中国药典》的颁布实施,必将在我国全面提高药品质量过程中起到积极而重要的作用,并将进一步扩大和提升我国药典在国际上的积极影响。
小弟刚接手2015版药典农药残留测定项目,现在在弄标准品,问题是现在的标准品浓度大概在100ug/mL左右,而且有153种,这153种农药混在一起会不会有什么反应将其中的某些成分降解掉,这个对照品买齐掉费些功夫啊,有没有同仁做过类似的研究,将这153种农药混在一起的稳定性,求解
因为实验需要欧洲药典的标准品,请问通过什么途径可以购买呢?谢谢
我想买药品的标准品,是要符合欧洲药典标准的。请问在什么地方可以买到?谢谢!

药典里面的色谱法,有小部分是明确讲到了标准曲线的,这个做个标曲没有疑问。但是大部分的[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]、液相方法都只给了单一浓度的对照品配制和进样,按字面来理解,是用的单点定量。那么像这样的,不做标准曲线可不可以?关键是药典里面的方法既有标曲也有单点,那么单点法就不是标曲的简写,那么按药典来做单点会被质疑吗?下图为辛酸钠的标准曲线法:[img=,690,213]https://ng1.17img.cn/bbsfiles/images/2021/08/202108111506314918_139_4186957_3.jpg!w690x213.jpg[/img]下面这个是乙醇的内标法:[img=,690,408]https://ng1.17img.cn/bbsfiles/images/2021/08/202108111508148835_3538_4186957_3.jpg!w690x408.jpg[/img]那么按药典来测乙醇量就不用做标准曲线了吧?
大家用的药典有机氯农药残留标准品在哪买的是混标吗
这是广州市药检所药杨仲元所长在05版药典培训班上的讲义,讲述了新版药典的变化及有关药品质量标准制订方面的内容。供从事药检工作的同行们参考。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=9263]药品标准及有关指导原则[/url]
标准全套药典筛到底是怎么样一存在?药典筛是指按《中国药典》规定,统一规格的用于药剂生产的筛子。药典筛用于中药、西药、生产制剂厂家或药典单位对液体、粉体、颗粒状药品进行分级、筛分、过滤、去杂等。在实际生产中有也有直接用标准筛替代的情况。文章转载自奥淇洛谱实验室之家文章中心关于药典筛的简介,特注明。对于药典筛与标准筛的区别,上一期已经介绍了标准筛,这一期我们附上药典筛的目数/孔径对照表,供您参考。筛号孔径目数1号筛2000±70μm10目2号筛850±29μm24目3号筛355±13μm50目4号筛250±9.9μm65目5号筛180±7.6μm80目6号筛150±6.6μm100目7号筛125±5.8μm120目8号筛90±4.6μm150目9号筛75±4.1μm200目底盖
老师好:上次我没有说清楚,我想用药典上产品的紫外吸收曲线对我手头的产品作定量(我找不到标准品),我稀释的浓度同药典的浓度,既按药典的方法作我的产品的曲线,并按指定波长下的吸收强度的比值来计算含量.不知可否?另外用95乙醇与无水乙醇作溶剂有差别吗(254NM)?仪器间的误差有多大?谢谢指教!
请问哪位朋友有甘油的英国药典、美国药典的标准吗?
《中国药典》2010年版将于2010年10月1日起正式实施。今天国家药典委员会召开大会,介绍《中国药典》2010年版编制工作情况,部署新版药典执行工作,表彰在药品标准研究方面取得突出成绩的先进单位。 全国人大常委会副委员长桑国卫在大会上高兴地说:新版药典的实施,是我国药品监督管理工作中具有里程碑意义的一件大事,标志着我国药品质量水平达到一个新的高度。 桑国卫认为新版药典实施的重大意义体现在以下几方面: 一是有助于提升公众用药安全水平。新版药典进一步扩大了收载范围,基本形成中药材、中药饮片、中成药、化学药品、药用辅料、生物制品等门类齐全的药品标准体系;药品安全性检测通用技术要求明显提高。 二是有助于提升我国医药产品国际竞争力。新版药典编制工作着力于提升科技含量,力争使药品质量指标、检验方法和生产工艺与国际先进水平保持一致或者加快接近步伐。在中药、民族药的标准制定方面,着力打造符合中药质量控制特点的质量标准体系,逐步确立我国在天然药物和传统药物标准发展方面的国际引领地位。新版药典不仅是联系我国医药与世界医药的桥梁和纽带,也是世界了解中国医药的重要窗口,对进一步推动我国医药生产技术进步、推动医药产品创制与开发、推动我国医药产业参与世界医药市场竞争,必将发挥重要作用。 三是将进一步推动我国医药产业结构调整。新版药典特别注重标准的系统性提高,对上市药品质量控制的要求越来越严格。其推广执行,必将给医药市场带来冲击,更多低质量的药品将被市场淘汰;那些生产工艺先进、质量控制水平突出的医药生产企业,在执行新的标准的过程中,会获得更多的市场竞争优势,这将有利于促进企业提高标准意识和创新意识,更加重视药品研发和生产控制,更加积极主动地投入到关键技术攻关上来,有助于推动国内企业加快缩短与国外企业的差距,加快与国际先进水平的接轨,加快我国从仿制药大国向仿制药强国的转变。 “十二五”期间,我国将加快实施药品标准提高行动计划,加快提高药品质量控制水平。桑国卫透露,自2008年以来,中央财政已拨付约2亿元专项资金用于药品标准提高,今后还会继续加大经费支持力度。
大家好,哪位有英国药典较新的版本啊,我找吐温80英国标准。我在网上查询的英国药典2010年版吐温80标准与欧洲药典吐温80的标准完全一样,一个字不差。不知我们是不是搞错了。
我们在标准或者药典中,经常会看到这个情况,使用某色谱柱,或者可以采用其他等效的色谱柱,在这种情况下,标准和药典提供的是方法学意义,色谱柱选择的余地还是很大的。这种情况下,色谱柱只是一个分离的介质,是一个分离的通道,提供的更多的是一个方法学建议。但是,还有另外的一种情况,就是指定某一品牌某一型号的色谱柱。在那格列奈的分离分析过程中,我国的国家药典就指定了kromasil的TBB色谱柱作为分析色谱柱,分析效果最好,能够达到良好的分析效果。目前kromasil已经有相关的替代产品Cellucoat色谱柱,在论坛中已经进行了详细的介绍,感兴趣的版友可以去找找该帖子。两种色谱柱都能够达到良好的分析效果。一种色谱柱能被药典或者标准指定,只能说明该色谱柱无可替代。一般情况下,一个品牌的色谱柱能有一两种药物被药典指定。而kromasil的色谱柱目前有14种应用被药典指定。充分体现了该色谱柱卓越的性能和优越的品质!!!
大家有谁能给我讲讲药典有机氯农残标准品(包括六六六,DDT,五氯硝基苯)的有关情况啊:比如在哪买的,是固体还是液体,是液体的话多大浓度,混标是怎么配的,是买了固体天平称呢还是直接买液体的,买了液体后配混标是直接稀释呢还是用天平称了再配呢,还有药典有好几个浓度,都怎么用啊,是选一个配了用吗,选哪个用啊我做原药材,含量是千万分之一或二。多谢大家了
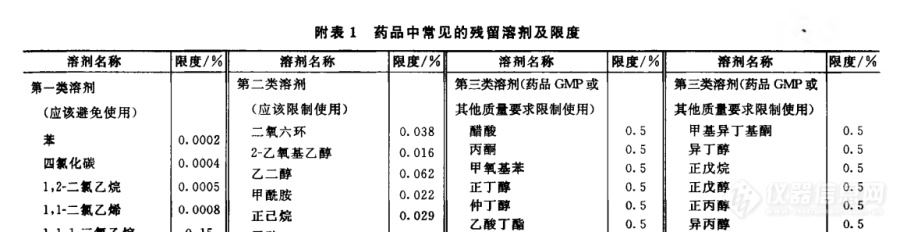
[img=,690,177]https://ng1.17img.cn/bbsfiles/images/2019/02/201902181740213114_5586_3373632_3.png!w690x177.jpg[/img]药典上说的溶剂残留的标准,指的是药品主成分的么,还是整个药品的,举例,比如说醋酸限度0.5%,那么这个0.5%是指谁的0.5%,现有1g某原料药,纯度是0.99g,那么这个醋酸的残留指的1g原料药中的0.5%,还是指有机溶剂残留量比上0.99小于0.5%呢,为什么这么问呢,因为原料药在中间产品阶段是液体,该液体里面有许多其他的杂质,这个环节有机溶剂残留也是0.5%的话,指的整个中间产品药液液体中么,还是药液中中间产品的(中间产品中可不纯,里面有很多杂质的),如果中间产品的话,通过方法我只能知道药液中主成分的量,无法知道整个药液中含有的不纯的中间产品质量
大家帮下忙,哪位知道微生物限度标准在EP和USP药典中的哪个地方呢,太难找了,中国药典里是找到了的。就是细菌总数小于定于1000cfu/g,霉菌酵母菌总数小于等于100cfu/g,大肠不得检出/g。
[em09504]请问哪位知道2010版药典中制药用水的标准啊?其与2005版药典中的标准有什么不同啊?尤其是关于TOC的限度?谢谢!
问题:请问15版药典 有机氯农药残留第二法 22种对照品的计算方法 外标标准曲线法事如何计算?
哪能免费下载药品质量标准?特别是英国药典,美国药典?
[color=#444444]药用级原料的使用标准都是药典吗,还是可以使用其他标准[/color]
大家学习一下领导们开会讨论的内容:)会议纪要根据第九届药典委员会中医专业委员会的工作部署及我委工作安排,2008年10月27-29日在北京召开了“《中国药典》2010年版品种中医标准规范会议”。参加会议的有本届中医专业委员会委员7名,有关专家23名,共30名;特邀的执行委员周超凡教授出席会议;药典委员会药品信息处中药组全体工作人员参加了会议,主管秘书长周福成同志专程到会作了重要指示。会议由信息处刘兴昌处长主持,专业委员会常务副主任委员高学敏教授重点讲解了《中国药典》2010年版品种中医标准规范的原则和技术要求,要求参会代表本着认真审慎的工作态度,完成此项工作,以保证药典内容的权威性、严肃性、科学性。周福成秘书长在会上从中医药发展的高度,从中医药体制的管理以及中医药标准的制订等方面作了重点发言,他的发言让参会专家对我国的中医药现状有了全面了解,深刻体会到药典的编纂工作不仅仅是一项技术性工作,同时还有很强的政策性,并起着引导本行业发展的重要作用。周秘书长在讲话中强调了以下几点:1、新时期标准工作应有崭新的理念:科研为标准服务,标准为监管服务,监管为人民的健康安全服务。这个理念理顺了标准工作的程序,并明确了标准的意义和作用。为我们以后科研项目的提出、制订及实施确定了方向。2、提出多做雪中送炭,避免锦上添花,好钢用在刀刃上。科研为标准服务理念的提出,重新赋予了科研的内涵,我们的精力应放在急需要提高、急需要解决的问题上,而不是哪个基础研究资料丰富,就开展那个,这样的锦上添花对我们标准的发展是无益的,我们应多做雪中送炭,使国家标准整体提高,更好地为监管服务。3、标准工作的开展应系统考虑,整体推进,均衡发展。国家标准中处方相同,功能主治相同,剂型不同的品种应按一个系列考虑,每个系列品种应统一考虑,建立相同的或类同的标准体系,这样的系列品种要整体推进,均衡发展,避免同一系列品种标准相差较大,影响国家标准的严肃性。4、标准的制订应坚持科学、实用、规范、系统的原则。因本届委员会成立较晚,本版药典新增品种多,安全性要求高,因此时间紧,任务重,要求高。针对国家标准中的中医标准,周秘书长强调:1、要以科学发展观来指导我们的工作,对历版药典存在的谬误予以勘正,有错必纠,有错必改。2、药材来源要加强考证,一药多名、一名多药的混乱情况要厘清,确保正品药材收载。对于濒危、匮乏的药材,如果必须收载,需要加警示语,以保护药材资源。3、药材及饮片的功能主治因是法定标准,所以规范一定要有依据,药材的功能主治过于宽泛,体现不出中医的配伍理论,因此不宜增加过多,要言简意骇,尽量围绕性味归经表述。功能主治的不规范易引起社会反映,比如研发新药、成药的功能主治不好定酌以及影响临床用药安全等。4、药材及饮片的性味归经是中医的特色之一,对于现版药典阙如的,要进行补遗;对有错误的预以改正。5、不良反应及注意项的表述,不能完全替代说明书,只能引导说明书的大方向。最后,周秘书长讲到,我们中医药工作者,保护中医中药是天经地义的责任,我们必须开拓创新,求真务实,把握好度,这次中医标准的规范工作,我们要认真取舍,严格把关,不能迎合市场,要为国人负责。会议分成方制剂和药材与饮片两个组分别进行功能主治的规范。一、参加《中国药典》2010版药材与饮片功能主治规范会议的专家(附件1)按照“国家药品标准中药材及饮片临床标准的原则与技术要求”,以及领导讲话精神,对《中国药典》2010版入选的药材与饮片品种进行临床标准的规范,包括对2005版原有品种进行临床标准的规范以及对新增品种进行临床标准的厘定。本次中药材及饮片临床标准的修订工作是自药典1985年版以来的第二次大修订,力求通过规范工作,使中药材及饮片的临床标准进行一次较大的改进和提高,从而发扬与时俱进的精神,满足时代的要求,体现当代的研究成果,反映当代的用药水平,为临床、生产、管理、科研、教学服务。由于时间紧、任务重,本次会议分两个组进行工作,分别由工作委员会常务副主任委员高学敏教授、副主任委员钟赣生教授负责主持修订。会议对初步入选2010年版《药典》的679种中药材及饮片品种(包括正药579种、附药85种、炮制品单列15种)逐个仔细认真地进行了性味归经、功能主治、用法用量、使用注意的审核和修订。参加《中国药典》2010版成方制剂功能主治规范会议的专家(附件2):按照“规范国家药品标准中成药功能主治的原则与技术要求”,对《中国药典》2010年版成方制剂拟新增品种129个的功能主治进行了规范。因《中国药典》2005年版成方制剂的功能主治规范有较好的基础,因此本次会议在预定的时间内,顺利完成。二、本次会议基本上达到了预期的目的。但药材及饮片部分存在以下一些问题:1.有些新增品种不属于历版药典的品种,属于地方标准,专家们无法获得其临床标准的资料,因而本次会议没有加以修订,还有待于药典会提供资料后再行修订,并组织专家审定。3.有些品种属于少数民族药,本次会议的参会者均属于中医药学专家,无法对其进行临床标准的修订。应专门组织相关的民族药专家进行这部分药的临床标准修订工作,并且在2010版药典中单列民族药一项内容,而不宜像2005版混在中药材及饮片之中编排。4.有些品种属于地方草药,资料少,且内容也不够成熟,中医临床处方使用很少,因此本着审慎、认真的态度,坚持宁缺毋滥的原则,建议暂不收入2010版药典。5.有些05版药典中的内容有待统一和确定。如中药材及饮片的“使用注意”一项各药之间繁简不一,应统一。又如,“瓜蒌类”、“乌头类”是指哪些药?活血药有的写了孕妇禁用或慎用,有的没有写,也应统一。研末吞服一日应几次,也应当统一。禁服、禁用,忌服、忌用应统一。另外,有国家级科研课题的调查结果表明,现在临床上常规药物的计量基本不用“.5g”的剂量表示,但药典中有些药还是采用小数点五的剂量,如川牛膝的量是“4.5-9g。”,是否能统一去掉常规药物用量中的小数点五的表示。又,现在临床为了计算价钱的便利已经基本采用10g的计量表示,但药典均采用9g计量的表示,是否能统一改为10g的计量表示。三、下步工作设想1、尽快将本次会议的情况向主任委员张伯礼教授汇报。2、药材及饮片遗留问题全面汇总,专请资深专家及管理人员研讨。3、对于药材及饮片剂量、毒性问题,争取报国家科研课题。经过三天紧张有序的工作,完成了《中国药典》2010年版品种中医标准的规范工作,达到了预期的目的。 附件1:药材及饮片专家北京中医药大学高学敏、钟赣生、李敏(代张冰)成都中医药大学彭成南京中医药大学唐德才黑龙江中医药大学刘树民浙江中医药大学宋捷民湖南中医药大学郭建生广西中医药大学邓家刚湖北中医学院周祯祥广州中医药大学蓝森麟、吴庆光天津中医药大学于虹、张德芹辽宁中医药大学任艳玲中国中医科学院广安门医院王阶中日友好医院晁恩祥附件2:成方制剂专家季绍良、梁茂新、鲁卫星、陈淑长、马 融、刘绍能、冯兴华、周超凡、翁维良、陈德兴、韩冰。