多糖的分析是一个大问题啊!和大家讨论一下吧,经综合各种文献我认为多糖结构分析内容:要搞清1. 多糖的单糖组成(种类、比例)2. 每个单糖残基的D-、L-构型,吡喃环式或呋喃环式3. 羟基被取代情况(糖苷键的位置)4. 糖苷键及构型(α、β异头异构体)5. 重复单元方法:1、单糖组成:(对照品:葡萄糖、岩藻糖、半乳糖、甘露糖、木糖、阿拉伯糖、鼠李糖)a:水解: 纸层析薄层层析气相色谱(糖氰乙酸酯衍生物、糖醇乙酸酯)液相色谱(ZORBAX-NH2、HRC-NH2、RID)首选气相,灵敏度高,液相RSD、ELSD灵敏度低b:TFA酸解:气相色谱(乙酰化物)c:甲醇解:气相色谱(三甲基硅醚)2:高碘酸钠氧化和Smith降解a:每摩尔己糖基的高碘酸消耗量、甲酸释放量。(目的:判断可氧化糖基与不可氧化糖基之比例)b:Smith降解完全水解,气相分析,如有葡萄糖(表示有1-3键糖基)、甘油(有1-6或1-2糖基)、甲酸(有1-6糖基)Smith降解部分水解,说明主干糖苷键类型。3:甲基化分析(Hakrmor法)-支链分布多糖—甲基化—水解—还原得甲基化单糖醇—乙酰化得糖醇衍生物—GC-MS检测。 对照品 2,3,4,6-四甲基葡萄糖 糖苷键类型 1—2,4,6- 三甲基葡萄糖 1—32,3,4-三甲基葡萄糖 1—62,4-二甲基葡萄糖 1—3,6 4:IR图谱解析a:吡喃环式或呋喃环式α、β异头异构体5:1HNMR及13CNMR解析(构型)6:纯度检查:a: 紫外吸收光谱(280、260)b:电泳(琼脂糖电泳、聚丙烯酰胺凝胶、醋酸纤维素薄膜)c:薄层色谱(多糖不水解)7:X射线衍射,立体构型。好多啊!想和大家讨论讨论多糖的HPLC分析,我们试验室用的液相是C18柱,紫外检测器,做多糖含量及纯度检测,这样的装备够不够用呀?是不是做前必须衍生化或有其它方法,如用示差折射仪作检测器,是不是不需衍生化?多糖的HPLC分析,用得较多用HPGPC测分子量及分子量分布。一般纯多糖紫外吸收较弱,多用RID或ELSD。至于含量测定多用硫酸蒽酮比色或苯酚硫酸法。http://img.dxycdn.com/images_new/smiles/smile_angry.gif
我们现在有一根Sepax Nanofilm SEC-150凝胶柱,我看介绍这种柱子主要是用于测定蛋白、肽类的,查网上资料说这种柱子可以代替Tosoh公司的TSK G-2000SW,但是TSK G-2000SW一般也是测试蛋白等,测多糖类一般用TSK gel PW 系列,现在想测试多糖,不知道能不能用Sepax Nanofilm SEC-150凝胶柱来测,哪位高手做过这方面的实验,请给点意见,我是刚刚接触GPC,什么都不懂呀,学习中……
Sepax Nanofilm SEC-150柱子可以用来测多糖吗
大家好,我正在做多糖的研究.现在有两个样品,结构相似,有一定的区别.想通过核磁找出它们的区别.请问能否通过核磁把他们中的呋喃糖和砒喃糖的氢分别定量,知道它们的比例?具体方法如何呢?谢谢各位!![em20]
最新发现与创新 科技日报上海6月29日电(记者左朝胜)今天,在上海浦东召开的化学糖生物学国际研讨会上,中科院上海药物研究所无限极多糖联合实验室公布了他们的最新研究成果:肠道为香菇多糖(Lentinan)等中草药多糖预留的秘密通道被发现。这些中草药多糖可以经由该通道被人体完整吸收,进而随血液达到全身各处,发挥其各种生物生理功效。 多糖是自然界中含量最丰富的物质之一,广泛存在于动物细胞膜、植物和微生物细胞壁中,对维持生命活动起着至关重要的作用。大量药理和临床研究发现,多糖、特别是中草药多糖,具有调节免疫、抗辐射、抗肿瘤、抗病毒、抗衰老、调节血糖、保护胃肠系统等作用。自1986年日本批准香菇多糖应用于临床以来,目前在中国、美国、韩国、日本及一些欧洲国家,已有几十种多糖被批准应用于疾病的治疗或辅助治疗。同时,多糖还被广泛应用于保健食品。 但由于多糖的分子量一般都很大,如果一个水分子相当面包屑那么大的话,一个高活性多糖分子起码会像一个汉堡包。水分子可以自由进出肠道壁细胞,多糖也可以吗?这个问题一直困惑着中外科学家。 2009年,中科院上海药物研究所丁侃研究员与无限极(中国)有限公司联合开展多糖吸收机制研究,经过几年努力,利用Caco-2细胞、多糖荧光标记等手段,终于找到了肠道给多糖预留的秘密通道——clathrin蛋白。 多糖可借助clathrin蛋白进入肠道细胞内,然后再进入毛细血管,随血液到达全身各处,与其受体结合发挥各种生物活性。该研究成果得到了美国功能性糖组学协会、国际糖复合物组织的赞赏和肯定,并得到世界各国多糖研究领域专家的关注。这项成果为多糖各种生理功效的活性机制研究奠定了坚实的基础,不但为口服吸收与口服有效提供了新依据,而且为多糖靶向治疗提供了可能性。 《科技日报》(2013-6-30 一版)

[b]摘要:目的:[/b]探索提取温度、液固比和提取时间对拳参多糖产率的影响,得到提取[color=#000000]拳参[/color]多糖最优工艺条件。[b]方法:[/b]用均匀设计实验优化[color=#000000]拳参[/color]多糖的提取工艺,用苯酚硫酸法测出每次实验所得多糖的纯度,再求得每次实验纯多糖的得率,然后应用回归分析的方法分析实验得出的数据,以纯多糖的得率为指标,对提取温度、液固比、提取次数和提取时间3个因素进行分析,得出最佳工艺条件,并进行验证。[b]结果:[/b]实验得出茵陈多糖的最佳提取条件是:提取温度100℃、提取时间135 min、提取液固比55:1。[b]结论:[/b]验证实验平均得率纯多糖实际产率5.95%与理论得率5.79%十分接近,说明我们得到的最佳工艺条件是可靠的。[align=center]1 前言[/align]拳参又名紫参,草河车,为蓼科蓼属多年生草本植物拳参[i]Polygonum bistirta[/i] L.的干燥根茎。拳参一名最早出现在《本草图经》中,其性状呈扁圆形而弯曲,两端钝圆或稍尖,质硬脆,易折断,断面棕红或赤褐色,无嗅,其性苦、涩、微寒,具有清热解毒,凉肝熄风,消肿止血的功效。临床上用于赤痢,热泻,肺热,咳嗽,痈肿,瘰疬,口舌生疮,吐血,痔疮出血,毒蛇咬伤的治疗[sup][/sup]。近十几年来研究表明,拳参的化学成分多样,主要有绿原酸、丁二酸、没食子酸、儿茶素及鞣质等。刘晓秋等[sup][/sup]从拳参的乙醇提取物中得到9个化合物,经理化常数和光谱分析,确定为没食子酸、丁二酸、槲皮素、槲皮素-5-O-β-D-吡喃葡萄糖苷、原儿茶酸[sup][/sup]、丁香苷、(+)-儿茶素、芦丁及mururin A。孙晓白[sup][/sup]对拳参根茎的化学成分进行了系统的研究,干燥根茎粉碎后用95%甲醇浸泡提取3次,减压浓缩后,依次用石油醚,乙酸乙酯,正丁醇萃取,再通过硅胶柱层析,葡聚糖柱层析,制备薄层层析和重结晶等手段,得到了20个化合物,并确定了其中的3β-acetoxy-dammara-20、24-diene、Ferenemone等17个化合物结构。肖凯等[sup][/sup]用60%的丙酮对拳参根茎进行提取,并用反向层析的方法进行分离纯化,得到10个化合物,最终确定为没食子酸、色氨酸、2,6-二羟基苯甲酸等。现代药理研究表明拳参有抗菌作用、镇痛作用、中枢抑制作用、心肌保护作用等,临床用于治疗菌痢、肠炎、肺结核、婴幼儿秋冬腹泻、湿热型痢疾等[sup][/sup]。曾靖等[sup][/sup]通过实验表明拳参的镇痛作用与氨基比林相当。刘晓秋等[sup][/sup]通过采用斜面法测定拳参各提取物和单体化合物的最低抑菌浓度,研究了拳参根茎中得到的5种不同溶剂提取物及4种单体化合物的体外抑菌活性。刘春棋等[sup][/sup]过滤纸片对拳参提取物进行了抑菌试验,结果发现不同浓度的拳参提取物对金黄色葡萄球菌和大肠杆菌有一定的抑菌效果。eepak Mittal[sup][/sup] 研究了拳参提取了拳参及其活性成分对四氯化碳和扑热息痛所造成的肝损伤的保护作用。李洪亮在首届全国方剂组成原理高峰论坛上发表的论文[sup][/sup]研究发现拳参-413本身对正常血管无明显作用,在NA致血管收缩的前提下,拳参-413对大鼠离体胸动脉环具有显著的剂量依赖性舒张作用。曾纪荣、曾庆磊等[sup][/sup]研究了拳参提取物在大鼠视网膜缺血再灌注损伤时抗氧化作用的影响。曾昭毅、王敏等[sup][/sup]用昆明小鼠证明拳参水提物有与氨基比林、吗啡相当的镇痛作用,并认为其镇痛作用并非通过阿片受体而发挥。李珂珂、栾希英等[sup][/sup]探讨了拳参水提物对正常小鼠免疫功能的影响。李珂珂、栾希英[sup][/sup]研究了拳参乙醇提取物(BRE)的免疫调节作用。近年来国内外对拳参的研究日趋深入,有关其化学成分和药理活性方面的研究已进行了一定量的工作,但通过查阅资料,关于拳参多糖的文献较少,说明目前对于拳参多糖的研究鲜有报道。因此,本课题拟对拳参多糖的提取工艺进行研究,对拳参多糖的提取条件进行优化,从而为拳参多糖的深入开发利用提供实验依据。本课题我们就重点探讨拳参多糖的最佳提取条件,通过对拳参多糖提取过程中影响拳参多糖产率、纯度的因素进行单因素实验,单因素实验包括提取时间、提取温度、液固比及提取次数,最终确定最优提取时间为2.5h,提取温度为100℃,液固比为20:1。然后根据单因素最优条件进行均匀设计实验,用线性回归的分析方法分析实验得出的数据,找出拳参多糖的最佳提取条件。[align=center]2 实验材料与方法[/align]2.1 实验仪器CPJ1003型电子天平(上海奥豪斯仪器有限公司)HH-1数显恒温水浴锅(金坛市晶玻实验仪器厂)80-2离心机(上海荣泰生化工程有限公司)RE-52A旋转蒸发仪(上海亚荣生化仪器厂)GZX-9070电热恒温鼓风干燥箱(上海博讯实业有限公司医疗设备厂)ZKXF-1型真空干燥箱(河北荣昌试验仪器厂)SHD-Ⅲ型循环水式多用真空泵(保定市新区阳光科教仪器厂)BCD-223MT冰箱(河南新飞电器有限公司)752型紫外可见分光光度计(上海恒平科学仪器公司)24目,100目标准筛(浙江上虞市华丰五金仪器有限公司)2.2 实验材料和试剂拳参(河北省安国药材市场)无水乙醇(分析纯,天津市富宇精细化工有限公司)蒸馏水(实验室自制)葡萄糖(分析纯,天津市科密欧化学试剂有限公司)苯酚(分析纯,天津市福晨化学试剂厂)浓硫酸(分析纯,北京化工厂)2.3 实验方法步骤2.3.1拳参的前处理拳参粉碎,放入真空烘箱中,70℃干燥2h,过24目筛得到拳参粉,备用。2.3.2粗多糖的提取流程拳参粗多糖提取的实验流程如下:精确称取拳参粉约5.0g于500mL圆底烧瓶中,加入规定液固比的蒸馏水,用恒温水浴锅T℃加热不同时间,先用脱脂棉过滤,然后用布氏漏斗抽滤,将滤液浓缩(旋转蒸发)至约10mL,加95%乙醇30mL,置具塞锥形瓶中,冰箱4℃放置24mL,然后用10mL试管离心(4000rpm,20min),弃去上清液,取沉淀,于50℃真空干燥箱干燥过夜,然后将所得沉淀称重,并计算粗多糖产率。其中,液固比、提取温度T、提取时间t及提取次数根据实验过程中考察因素的改变,作相应更改。2.3.3粗多糖产率的计算实验提取出的拳参粗多糖,经过烘干后,置于电子分析天平称重,得出的数据除以样品重量,即可得出拳参粗多糖的产率。2.3.4单因素实验2.3.4.1 液固比对拳参粗多糖提取率的影响采用提取温度80 ℃,加热2.5h,提取1次,考察了液固比对提取收率的影响。在结合前人相关中药材实验的基础上,确定考察液固比为10:1、20:1、30:1、40:1。粗多糖产率见表2-1。 表2-1 液固比对粗多糖提取率的影响 [table][tr][td] [align=center] 液固比(mL/g)[/align] [/td][td] [align=center]10:1[/align] [/td][td] [align=center]20:1[/align] [/td][td] [align=center]30:1[/align] [/td][td] [align=center]40:1[/align] [/td][/tr][tr][td] 粗多糖产率(%)[/td][td] [align=center]7.61[/align] [/td][td] [align=center]10.86[/align] [/td][td] [align=center]10.14[/align] [/td][td] [align=center]9.18[/align] [/td][/tr][/table]2.3.4.2 提取温度对拳参粗多糖提取率的影响采用液固比为20:1,提取时间2.5h,提取1次,考察了提取温度对粗多糖得率的影响。本实验确定考察温度为60℃、70℃、80℃、90℃、100℃。粗多糖产率见表2-2。[align=center]表2-2 提取温度对粗多糖提取率影响[/align] [table][tr][td] [align=center]提取温度[/align] [/td][td] [align=center]60℃[/align] [/td][td] [align=center]70℃[/align] [/td][td] [align=center]80℃[/align] [/td][td] [align=center]90℃[/align] [/td][td] [align=center]100℃[/align] [/td][/tr][tr][td]粗多糖产率(%)[/td][td] [align=center]6.42[/align] [/td][td] [align=center]9.24[/align] [/td][td] [align=center]10.67[/align] [/td][td] [align=center]12.11[/align] [/td][td] [align=center]17.83[/align] [/td][/tr][/table]2.3.4.3 提取时间对拳参粗多糖提取率的影响采用提取温度80 ℃,液固比20:1,提取1次,考察了提取时间对粗多糖得率的影响。通过查阅文献,本实验确定考察时间为1.5h、2h、2.5h、3h、3.5h。粗多糖产率见表2-3。[align=center]表2-3 提取时间对粗多糖提取率的影响[/align] [table][tr][td] [align=center]提取时间(h)[/align] [/td][td] [align=center]1.5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2.5[/align] [/td][td] [align=center]3[/align] [/td][td]3.5[/td][/tr][tr][td]粗多糖产率(%)[/td][td] [align=center]8.25[/align] [/td][td] [align=center]8.85[/align] [/td][td] [align=center]11.14[/align] [/td][td] [align=center]9.90[/align] [/td][td]8.92[/td][/tr][/table]2.3.4.4 提取次数对拳参粗多糖提取率的影响采用提取温度80 ℃,提取时间2.5h,液固比20:1,考察了提取次数对粗多糖得率的影响。根据前人提取数据,将提取次数定为1次、2次、3次、4次。粗多糖产率见表2-4。[align=center]表2-4 提取次数对粗多糖提取率的影响[/align] [table][tr][td] [align=center]提取次数[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]4[/align] [/td][/tr][tr][td]粗多糖产率(%)[/td][td] [align=center]11.27[/align] [/td][td] [align=center]13.08[/align] [/td][td] [align=center]16.49[/align] [/td][td] [align=center]16.83[/align] [/td][/tr][/table]2.3.5均匀设计实验2.3.5.1 均匀设计实验方案根据单因素实验结果确定各因素的取值范围:提取温度X[sub]1[/sub] :55℃~100℃;料液比X[sub]2[/sub]:1:10~1:37:提取时间X[sub]3[/sub]:1.5h~3.75h,设计出一个3因素10水平的均匀设计表。根据均匀设计表中所列的提取条件,按照拳参粗多糖的提取流程,提取拳参粗多糖,用苯酚硫酸法测定各次实验所得粗多糖含量,计算纯多糖产率,结果见表2-5。[align=center] [/align][align=center]表2-5 均匀设计实验表及结果[/align] [table=519][tr][td] [table][tr][td] [table=100%][tr][td] 条件 编号[/td][/tr][/table] [/td][/tr][/table][img=,98,65]https://bbs.instrument.com.cn/xheditor/xheditor_skin/blank.gif[/img][img=,84,52]https://bbs.instrument.com.cn/xheditor/xheditor_skin/blank.gif[/img][/td][td] [align=center]提取温度(℃)[/align] [/td][td] [align=center]液固比[/align] [align=center](mL/g)[/align] [/td][td] [align=center]提取时间(min)[/align] [/td][td] [align=center]纯多糖产率[/align] [align=center](%)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]55[/align] [/td][td] [align=center]22[/align] [/td][td] [align=center]180[/align] [/td][td] [align=center]1.819[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]60[/align] [/td][td] [align=center]37[/align] [/td][td] [align=center]120[/align] [/td][td] [align=center]2.209[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]65[/align] [/td][td] [align=center]19[/align] [/td][td] [align=center]225[/align] [/td][td] [align=center]1.610[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]70[/align] [/td][td] [align=center]34[/align] [/td][td] [align=center]165[/align] [/td][td] [align=center]1.947[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]75[/align] [/td][td] [align=center]16[/align] [/td][td] [align=center]105[/align] [/td][td] [align=center]2.007[/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]80[/align] [/td][td] [align=center]31[/align] [/td][td] [align=center]210[/align] [/td][td] [align=center]3.647[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]85[/align] [/td][td] [align=center]13[/align] [/td][td] [align=center]150[/align] [/td][td] [align=center]3.616[/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]90[/align] [/td][td] [align=center]28[/align] [/td][td] [align=center]90[/align] [/td][td] [align=center]4.717[/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]95[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]195[/align] [/td][td] [align=center]4.852[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]100[/align] [/td][td] [align=center]25[/align] [/td][td] [align=center]135[/align] [/td][td] [align=center]6.595[/align] [/td][/tr][/table]2.3.5.2 标准曲线的绘制标准液的配制:称取葡萄糖0.1246g于100mL容量瓶中,加蒸馏水至刻度,摇匀得124.6mg/L的储备液,分别精密量取储备液1.0mL、0.8mL、0.6mL、0.4mL、0.2mL,置于25mL的容量瓶中,加水至刻度,摇匀。则得5个不同浓度的标准液。配制5%苯酚溶液:称取苯酚1.2512g于烧杯中,用加热至约50℃的蒸馏水溶解,转移至25mL的容量瓶中,加水至刻度,摇匀。标准曲线的绘制:用干燥的2mL移液管取2mL标准溶液于具塞试管中,再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]移取1mL5%的苯酚溶液,快速加入上述具塞试管中,充分混匀,用5mL移液管取5mL浓硫酸快速加入上述试管中,充分摇匀,盖好试管塞。沸水浴15min,冷水浴10min,室温放置5min(5个储备液之间间隔5min加硫酸)。再将标准液换成蒸馏水,其他操作不变配成空白待测溶液。将上述反应30min后的溶液分别在490nm处测定吸光度,以吸光度A为纵坐标,以葡萄糖标准溶液C为横坐标,绘制标准曲线。(见图2-6)标准曲线的线性范围为:0.10072×10[sup]-1[/sup] mg/mL ~0.50360×10[sup]-1[/sup]mg/mL。曲线方程:A=0.015C+0.0502,相关系数:R[sup]2[/sup]= 0.9997 [align=center] [img=,654,351]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261738563747_2538_3237657_3.png!w654x351.jpg[/img][/align][align=center]图2-6 标准曲线[/align][align=center] [/align]2.3.5.3 苯酚-硫酸法测纯多糖含量分别取均匀设计实验所得粗多糖0.0201g于小烧杯中,加少量水搅拌使其溶解,转移至500mL容量瓶中,加蒸馏水至刻度,摇匀。用2mL移液管移取2mL上述溶液于具塞试管中,再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]移取1mL5%的苯酚溶液,快速加入上述具塞试管中,充分混匀,用5mL移液管取5mL浓硫酸快速加入上述试管中,充分摇匀,盖好试管塞。沸水浴15min,冷水浴10min,室温放置5min,反应完全后在490nm处测定其吸光度,每次需配制空白对照用来校正可见分光光度计。将测得的吸光度带入标准曲线方程中计算出所配溶液的多糖浓度,进而得到纯多糖的质量,再除以所称拳参样品的质量,即为纯多糖得率,结果见表2-5。 [table][tr][td=1,2][img=,232,45]https://bbs.instrument.com.cn/xheditor/xheditor_skin/blank.gif[/img][/td][/tr][tr][td=1,2] [table=100%][tr][td][b]×[/b]100%[/td][/tr][/table] [/td][/tr][/table][align=center]3 实验结果[/align]3.1 单因素实验结果3.1.1液固比图3-1表明,液固比在10:1和20:1之间粗多糖得率共提高42.76 %,在20:1到30:1之间以及30:1到40:1之间,反而下降。主要是由于开始增加提取液体积有利于细胞内容物的溶出,而液固比到达20:1之后,多糖成分已基本溶出,故粗多糖得率没有太大增加,并且考虑到工业生产中水的用量,所以液固比20:1最为合适。[align=center][img=,679,328]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261739157427_7789_3237657_3.png!w679x328.jpg[/img][/align][align=center]图3-1 液固比对拳参粗多糖得率的影响[/align]3.1.2提取温度结果见图3-2。由图中可以看出,当温度从60 ℃上升到70 ℃时,粗多糖得率共提高了64.59%,从70℃到80℃,提高了21.40%,80℃到90℃,提高了8.55%,从90℃到100℃,提高了54.77%。随着温度的上升,粗多糖产率一直在增加,说明温度的提高对粗多糖的溶出有帮助。显然,从60℃到70℃时,粗多糖产率上升得最快,从70℃到100℃,产率仍然在上升, 100℃时粗多糖产率达到最高得出粗多糖的最佳提取温度为100 ℃。[align=center][img=,690,332]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261739334261_7804_3237657_3.png!w690x332.jpg[/img][/align][align=center]图3-2 提取温度对拳参粗多糖得率的影响[/align][align=center] [/align]3.1.3提取时间中药材有效药物成分溶出需要一定的时间,较短会造成药物有效成分无法最大限度地溶出,过长的提取时间则会导致有效成分分解。结果见图3-3。可以看出,提取时间超过2.5h后粗多糖得率并未继续增加,反而下降;而2.5h之前,粗多糖得率增加显著,从1.5h到2.5h增加了 35.03%,故2.5h为最佳提取时间。[align=center][img=,690,354]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261739498948_3879_3237657_3.png!w690x354.jpg[/img][/align][align=center]图3-3 提取时间对拳参粗多糖得率的影响[/align]3.1.4提取次数结果见图3-4。结果发现:提取4次时粗多糖得率最高,比1次提取提高了49.33%,差别显著,提取三次较之提取一次,提高了46.32%,而提取两次较提取一次,仅提高了16.06%,提高有限,确定最佳提取次数为3次。[align=center][img=,684,350]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261740048693_1694_3237657_3.png!w684x350.jpg[/img][/align][align=center]图3-4 提取次数对拳参粗多糖得率的影响[/align][align=center] [/align]3.2 均匀设计实验结果最优提取条件的选择:用SPSS 19.0统计软件,以纯多糖得率为评价指标对各因素进行线性回归分析,模型的优度通过复相关系数和方差分析来判定。结果如表3-5。表3-5 回归方程 [table=638][tr][td] [align=center] [/align] [/td][td] [align=center]回归方程式[/align] [/td][td] [align=center]R[/align] [/td][td] [align=center]P[/align] [/td][/tr][tr][td] [align=center]回归方程1[/align] [/td][td] [align=center]Y=-6.090+0.109X[sub]1[/sub]+0.035X[sub]2[/sub]+0.001X[sub]3[/sub][/align] [/td][td] [align=center]0.933[/align] [/td][td] [align=center]0.005[/align] [/td][/tr][tr][td] [align=center]回归方程2[/align] [/td][td] [align=center]Y=-4.559+0.101X[sub]1[/sub][/align] [/td][td] [align=center]0.917[/align] [/td][td] [align=center]0.000[/align] [/td][/tr][/table]表3-5中,Y为纯多糖得率,X[sub]1[/sub]为提取温度,X[sub]2[/sub]为液固比,X[sub]3[/sub]为提取时间。方程1,R[sup]2[/sup]= 0.870,P值为0.005,回归非常显著,常数项与X[sub]1[/sub]项P值分别0.037和0.001,均小于0.05 ,回归显著,有统计意义,而X[sub]2[/sub],X[sub]3[/sub]均回归不显著,方程1多糖产率预测值为5.59%;方程2为将各项及其交叉乘积项全部纳入进行逐步回归的结果,我们发现,最后的方程中只保留了X[sub]1[/sub]项,方程2的 R[sup]2[/sup]= 0.841,常数项与X[sub]1[/sub]项P值分别为0.037和0.001,均小于0.05,回归亦显著有效,其预测值为5.79%,因第二个方程更为有效,故我们采用预测值5.79%。 综合上述两方程的回归结果,及均匀设计和单因素实验结果,我们采取提取温度100℃、提取时间为135 min、提取液固比为25:1,即第10组的条件为最佳条件,并重复3次进行实验验证。结果如下:[align=center]表3-6 均匀设计最优条件验证[/align] [table][tr][td]实验编号[/td][td]1[/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][/tr][tr][td]纯多糖产率(%)[/td][td] [align=center]6.07[/align] [/td][td] [align=center]5.80[/align] [/td][td] [align=center]5.97[/align] [/td][/tr][tr][td]平均(%)[/td][td=3,1] [align=center]5.95[/align] [/td][/tr][/table]所得纯多糖实际产率5.95%与理论得率5.79%十分接近。[align=center]4 讨论[/align](1)在研究粗多糖提取过程中单因素变量时,要保证单一变量,其他操作平行一致,若无法保证单一变量,则可能造成实验结果的误差。(2)在绘制标准曲线及用苯酚-硫酸法测多糖含量时,加硫酸时应均匀快速加入,并用力摇匀,若震摇过慢,硫酸会直接氧化苯酚,导致硫酸不能与糖类反应完全,造成误差。并在测量时保证每组的反应时间一致。(3)用苯酚-硫酸法测多糖含量时,为使测得的吸光度在标准曲线的吸光度范围之内,使其能用该标准曲线进行计算。(4)拳参多糖提取次数虽然提取3次比提取1次粗多糖产率高,但所用提取溶剂较多,且粗多糖提取量较所用时间及用料性价比不高,故采用提取1次。均匀设计法通过提高实验点均匀分散程度,使实验点具有更好的代表性,可通过较少的实验获得较多的信息,使实验结果更准确。实验得到的数据对于今后的实验研究、生产活动具有很强的指导意义。参考文献 国家药典委员会.中华人民共和国药典(一部). 北京: 化学工业出版社, 2000:239 刘晓秋, 陈发奎, 吴立军, 等.拳参的化学成分.沈阳药科大学学报, 2004, 21(5): 187~189 刘晓秋, 李维维, 生可心, 等.拳参正丁醇提取物的化学成分.沈阳药科大学学报, 2006, 1(23): 15~17 孙晓白.拳参和黄帚橐吾化学成分研究.兰州大学研究生学位论文, 2007, 5 肖凯, 宣立江, 徐亚明, 等.拳参的DNA裂解活性成分研究.中草药 2003, 34(3): 203~206 李兴玉, 李兴奎.中药拳参的研究进展.国际中医中药杂志, 2008, 30(6): 471~473 曾靖, 单热爱, 钟声, 等.拳参水提取物镇痛作用的实验观察.中国临床康复, 2005, 9(6): 80~81 刘晓秋, 李维维, 李晓丹, 等.拳参提取物及单体化合物的体外抑菌活性初步研究.中药材,2006, 9(1): 51~53 刘春棋, 王小丽, 曾靖.拳参提取物抑茵活性的初步研究.赣南医学院学报, 2006, 26(4): 489~450 Mittal Deepak Kumar*, Joshi Deepmala,Shukla Sangeeta. Hepatoprotective effects of Polygonum bistorta and activeprinciples on albino rats intoxicated with carbon tetrachloride and paracetamol. Toxicology Letters 2009, 189(1): 226~233 李洪亮, 贺方兴, 孙立波, 等.拳参-413对大鼠离体胸主动脉环的舒张作用机制研究.安徽农业科学, 2012, 40(24):12005~12006 曾纪荣, 曾庆磊, 谢明红, 等.视网膜缺血再灌注损伤后拳参提取物对大鼠抗氧化作用的影响.2011, 31(3): 332~333 曾昭毅, 王敏, 叶和扬, 等.拳参水提物的镇痛作用.中国临床康复, 2006, 10(47): 199~201 李珂珂, 栾希英, 刘现兵, 等.拳参水提物对小鼠免疫功能的影响.中药材, 2010, 33(8):1302~1306 李珂珂, 栾希英.拳参乙醇提取物的免疫调节作用.中国现代应用药学, 2011, 28(1): 21~25

[b]摘要:目的:[/b][color=#000000]探索提取温度、液固比和提取时间对泽泻多糖产率的影响,得到提取泽泻[/color][color=#000000]多糖最优工艺条件。[/color][b]方法:[/b][color=#000000]用均匀设计实验优化泽泻[/color][color=#000000]多糖的提取工艺,用苯酚硫酸法测出每次实验所得多糖的纯度,再求得每次实验纯多糖的得率,然后应用回归分析的方法分析实验得出的数据,以纯多糖的得率为指标,对提取温度、液固比、提取次数和提取时间3个因素进行分析,得出最佳工艺条件,并进行验证。[/color][b]结果:[/b][color=#000000]实验得出茵陈多糖的最佳提取条件是:提取温度100℃、提取时间135 min、提取液固比40:1。[/color][b]结论:[/b][color=#000000]验证实[/color][color=#000000]验平均得率为8.83%,预测值是8.28%,二者很接近,说明我们得到的最佳工艺条件是可靠的。[/color]1前言[color=#000000]泽泻为泽泻科植物泽泻[i]Alsima orientalis(sam.)Juzep.[/i]的干燥块茎,分布在中国、韩国和日本等国。性味甘、淡、寒,归肾、膀胱经[sup][/sup]。作为常用中药,是六味地黄丸、龙胆泻肝丸、五苓散等临床常用重要方剂的主要组成[sup][/sup]。具有利水渗湿,泄热,化浊降脂等功效,用于治疗小便不利,水肿胀满,泄泻尿少,痰饮眩晕,热淋涩痛,高脂血症等症[sup][/sup]。1.1泽泻的化学成分泽泻中的三萜类化合物主要有:泽泻醇A、泽泻醇A-24-乙酸酯、泽泻醇B-23-乙酸酯、表泽泻醇A、11-去氧泽泻醇A、泽泻醇C、泽泻醇C-23-乙酸酯、16,23-氧化泽泻醇E、泽泻醇F、阿里泽泻醇A和阿里泽泻醇B等原萜烷型四环三萜[sup][/sup]。从生物途径归纳,三萜类都是由 23- 泽泻醇 B 衍生而来[sup][/sup]。中药泽泻中获得的倍半萜类化合物多数为愈创木烷型。现分离到的倍半萜化合物主要有:泽泻醇,环氧泽泻烯,Orientalol A,B,C,Sulfooriental A,B,C,D[sup][/sup]。Yamaguchi等首次从泽泻鲜品中分离出一个贝壳杉烷型四环二萜类化合物,并最终确定了绝对构型为(-)-16R-ent-kauranre-2,12-doine[sup][/sup]。彭国平等从泽泻中分离出两个新的贝壳杉烷型四环二萜类化合物:泽泻二萜醇(Oriediterpenol)及泽泻二萜醇苷 (Oriediter-penoside)[sup] [/sup]。泽泻除了萜类成分外,此外,泽泻还含挥发油、多糖、蒽醌、磷脂、蛋白质及淀粉等成分[sup][/sup]。如胡萝卜素-6-硬酸脂、β-谷甾醇、三十烷、正二十烷、卫矛醇、挥发油(内含糖醛)、少量生物碱、天门冬素、脂肪酸、树脂、植物凝集素、大黄素、酸性多糖,胆碱,以及大量淀粉、蛋白质、氨基酸和钾、钙、镁等金属元素[sup][/sup]。1.2 泽泻的药理作用现代研究表明,泽泻有明显的利尿,抑制肾结石形成,降血压,降血脂及抗动脉粥样硬化,抗脂肪肝,抗肾炎活性和调节免疫等作用[sup][/sup]。1.3立题依据多糖具有多种生物活性, 具有提高免疫, 降血糖,抗肿瘤, 抗病毒等功能, 被认为是构成生命的四大基本物质之一。由于其独特功能和较低的毒性, 多糖类化合物在抗衰老、 抗病毒和肿瘤治疗、 糖尿病治疗等方面有良好的应用前景。另外,多糖可以改善食品的食用品质、加工特性和外观特性, 可用于抑制脂质氧化, 稳定酸性饮料, 也可作为乳化剂等, 在食品中的用途十分广泛[sup][/sup]。目前已发现的天然多糖有几百种,其中植物多糖对肿瘤治疗及调节机体免疫力效果显著,同时还有治疗肝炎、抗衰老等药理作用,且毒副作用很小[sup][/sup]。由于泽泻的药理作用显著,而关于泽泻多糖研究的文献很少,因此对于泽泻多糖的研究也具有很大的意义。开发泽泻多糖产品,首先需要把多糖从泽泻中提取出来。笔者决定对泽泻多糖的提取工艺进行研究,对其提取条件进行优化,从而为泽泻多糖的深入开发利用提供实验依据。本课题我们就重点探讨泽泻多糖的最佳提取条件,通过对泽泻多糖提取过程中影响泽泻多糖产率、纯度的因素进行单因素实验,然后进行均匀设计实验,用线性回归的分析方法分析实验得出的数据,寻找泽泻多糖的最优化工艺条件。1.4提取方法的确定提取植物多糖的方法有多种,一般是采用水提醇沉法,采用水提醇沉法提取,可防止引起糖苷键的断裂[sup][/sup]。李小凤等[sup][/sup]通过单纯的水提醇沉法对泽泻多糖进行了提取和含量测定。此外,很多研究对多糖的水提醇沉工艺做了优化,如朱秀灵等[sup][/sup]采用超声波辅助提取银杏叶多糖;缪建等[sup][/sup]采用酶法结合水提醇沉法提取银杏叶多糖;金汝城等[sup][/sup]采用均匀设计优化超声波法提取黄芪多糖。由于实验设备有限,本实验采用水提醇沉法对泽泻多糖进行提取。[/color][color=#000000]2 实验材料2.1实验仪器FA2104N型电子分析天平(上海民桥精密科学仪器有限公司)HH-1数显恒温水浴锅(金坛市晶玻实验仪器厂)80-2离心机(上海荣泰生化工程有限公司)RE-52A旋转蒸发仪(上海亚荣生化仪器厂)GZX-9070电热恒温鼓风干燥箱(上海博讯实业有限公司医疗设备厂)DZF-6050真空干燥箱(巩义市予华仪器责任有限责任公司)SHD-Ⅲ型循环水式多用真空泵(保定市新区阳光科教仪器厂)BCD-223MT冰箱(河南新飞电器有限公司)722可见分光光度计(上海菁华科技仪器有限公司)24目,100目标准筛(浙江上虞市华丰五金仪器有限公司)2.2实验材料和试剂泽泻(河北省安国药材市场)无水乙醇(分析纯,天津市美琳工贸有限公司)蒸馏水(实验室自制)葡萄糖(分析纯,天津市科密欧化学试剂有限公司)苯酚(分析纯,天津市福晨化学试剂厂)浓硫酸(分析纯,北京化工厂)[/color][color=#000000]3实验方法3.1泽泻粗多糖的提取流程将预备好的泽泻放入70℃真空烘箱中干燥2h,粉碎取过24目筛,不可过100目筛的粉末,装在密封袋中置于干燥器中备用。泽泻多糖提取的实验流程如下:精密称定已制备的泽泻粉末5.000g于500mL圆底烧瓶中,加入规定液固比的蒸馏水,用恒温水浴锅T℃水浴加热不同时间,先用脱脂棉过滤得粗滤液,然后用布氏漏斗抽滤粗滤液,通过旋蒸仪旋转蒸发将所得滤液浓缩至约10mL,加95%乙醇30mL,置具塞锥形瓶中,冰箱4℃放置约18h,然后用10mL试管离心(3000rpm,10min),弃去上清液,得沉淀,于50℃、0.099MPa真空干燥箱中放置3.5h后,关闭电源,真空放置过夜。然后,将所得沉淀与离心管一起称重,通过差量法计算多糖产率。其中,液固比、水浴温度T、提取时间t及提取次数根据实验过程中考察因素的改变,作相应更改。粗多糖产率=粗多糖质量/泽泻样品质量×100%3.2 泽泻纯多糖含量的测定本课题中,泽泻提取工艺最佳条件分析中所用的是纯多糖含量,粗多糖的数值只是作为参考数值。本实验中是通过苯酚-浓硫酸反应使多糖显色,在紫外可见分光光度计490nm处测得吸光度,然后通过将数据代入当天测得的标准曲线中,计算出相应多糖浓度,从而计算出不同提取条件下泽泻中纯多糖的含量。3.2.1 标准曲线的绘制标准液的配制:称取葡萄糖0.1259g于100mL容量瓶中,加蒸馏水至刻度,摇匀得1.259g/L的储备液,分别精密量取储备液1.0mL、0.8mL、0.6mL、0.4mL、0.2mL,置于25mL的容量瓶中,加水至刻度,摇匀。则得五个不同浓度的标准液。配制5%苯酚溶液:称取苯酚1.2508g于烧杯中,用加热至约50℃的蒸馏水溶解,转移至25mL的容量瓶中,加水至刻度,摇匀,避光保存以备用。标准曲线的绘制:取2mL移液管,分别取2mL蒸馏水和五个标准溶液于六根具塞试管中,再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]移取1mL5%的苯酚溶液,快速加入上述具塞试管中,充分混匀,用5mL移液管取5mL浓硫酸快速加入上述试管中,盖好试管塞,充分摇匀。从放入沸水浴中计时,沸水浴15min,冷水浴10min,室温放置5min(六个溶液之间间隔3min加硫酸)。将上述反应30min后的溶液分别在490nm处测定吸光度,以吸光度A为纵坐标,以葡萄糖标准溶液C(Co=50.36)为横坐标,绘制标准曲线。(见图1-1)标准曲线的线性范围为:0.10072×10[sup]-4[/sup]g/mL ~0.50360×10[sup]-4[/sup]g/mL曲线方程:A=0.0165C-0.0216,相关系数:r=0.9998[/color][align=center][img=,619,343]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261725042952_9256_3237657_3.png!w619x343.jpg[/img][/align][align=center]图1-1 标准曲线[/align][align=center] [/align]3.2.2 苯酚-浓硫酸法测多糖含量分别取不同提取条件下所得粗多糖0.040g于小烧杯中,加少量温水搅拌使其溶解,转移至250mL容量瓶中,加蒸馏水至刻度,摇匀。使用前用布氏漏斗抽滤,滤去不溶物,得澄清滤液。然后用2mL移液管分别移取2mL上述滤液于具塞试管中,再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]移取1mL 5%的苯酚溶液,快速加入上述具塞试管中,充分混匀,用5mL移液管取5mL浓硫酸快速加入上述试管中,充分摇匀,盖好试管塞。沸水浴15min,冷水浴10min,室温放置5min,反应完全后在490nm处测定其吸光度,每次需配制空白对照用来校正可见分光光度计。将测得的吸光度带入标准曲线方程中计算出所配溶液的多糖浓度,进而可计算出纯多糖的产率。3.2.3 纯多糖产率的计算纯多糖产率=(纯多糖浓度×体积×粗多糖质量)/(粗多糖测样量×泽泻质量)×100%3.3 单因素实验3.3.1 液固比对泽泻多糖提取率的影响考察液固比,是为了能够在使用较少溶剂的情况下提取出最多的多糖,这不光能够减少工业生产中单位产量水的使用量,同样也为多糖提取液后期处理减少了时间和成本,具有重要的经济和生态效益。在结合前人相关中药材多糖提取实验的基础上,确定考察液固比为10:1、20:1、30:1、40:1、50:1。纯多糖产率见表3-1。[align=center] 表3-1 液固比对多糖提取率的影响 [/align] [table=582][tr][td]提取温度[/td][td] [align=center]80℃[/align] [/td][td=2,1] 提取时间[/td][td] [align=center]2.5h[/align] [/td][td=2,1] [align=center]提取次数[/align] [/td][td]1[/td][/tr][tr][td] [align=center]液固比(mL/g)[/align] [/td][td=2,1] 10:1[/td][td=2,1] 20:1[/td][td]30:1[/td][td]40:1[/td][td] [align=center]50:1[/align] [/td][/tr][tr][td]多糖产率(%)[/td][td=2,1] 3.38[/td][td=2,1] 3.46[/td][td]5.43[/td][td]7.87[/td][td]6.81[/td][/tr][/table]3.3.2 提取温度对泽泻多糖提取率的影响中药材提取过程中,温度是极其重要的条件。通过查阅文献及综合各方面考虑,确定提取温度为60℃、70℃、80℃、90℃、100℃。多糖产率见表3-2。[align=center]表3-2 提取温度对多糖提取率影响[/align] [table=640][tr][td]液固比[/td][td] [align=center]20:1[/align] [/td][td=2,1] [align=center]提取时间[/align] [/td][td] [align=center]2.5h[/align] [/td][td=2,1] [align=center]提取次数[/align] [/td][td=2,1] [align=center]1次[/align] [/td][/tr][tr][td]提取温度[/td][td=2,1] [align=center]60℃[/align] [/td][td=2,1] [align=center]70℃[/align] [/td][td] [align=center]80℃[/align] [/td][td=2,1] [align=center]90℃[/align] [/td][td] [align=center]100℃[/align] [/td][/tr][tr][td]多糖产率(%)[/td][td=2,1] [align=center]1.81[/align] [/td][td=2,1] [align=center]2.87[/align] [/td][td] [align=center]4.55[/align] [/td][td=2,1] [align=center]5.75[/align] [/td][td] [align=center]9.57[/align] [/td][/tr][/table][color=fuchsia] [/color]3.3.3 提取时间对泽泻多糖提取率的影响通过查阅文献,本实验确定考察时间为0.5h、1h、1.5h、2h、2.5h、3h、3.5h。多糖产率见表3-3。[align=center]表3-3 提取时间对多糖提取率的影响[/align] [table=653][tr][td]液固比[/td][td] [align=center]20:1[/align] [/td][td=2,1] [align=center]提取温度[/align] [/td][td] [align=center]80℃[/align] [/td][td=3,1] [align=center]提取次数[/align] [/td][td=2,1] [align=center]1次[/align] [/td][/tr][tr][td] [align=center]提取时间(h)[/align] [/td][td=2,1] 0.5[/td][td=2,1] 1[/td][td] [align=center]1.5[/align] [/td][td]2[/td][td] [align=center]2.5[/align] [/td][td]3[/td][td] [align=center]3.5[/align] [/td][/tr][tr][td] [align=center]多糖产率(%)[/align] [/td][td=2,1] [align=center]3.57[/align] [/td][td=2,1] 3.38[/td][td] [align=center]4.75[/align] [/td][td] [align=center]5.04[/align] [/td][td] [align=center]5.00[/align] [/td][td] [align=center]4.55[/align] [/td][td] [align=center]5.15[/align] [/td][/tr][/table]3.3.4 提取次数对泽泻多糖提取率的影响众所周知,在最合适的料液比、提取温度、提取时间条件下,提取次数越多,药物的有效成分在中药材中溶出的就会越多,提取率相应就会越高,但提取次数决定操作成本,提取次数越多,成本越高,且工艺用水量大。所以根据前人提取数据,将提取次数定为1次、2次、3次。多糖产率见表3-4。[align=center]表3-4 提取次数对多糖提取率的影响[/align] [table=582][tr][td]提取温度[/td][td] [align=center]80℃[/align] [/td][td=2,1] [align=center]提取时间[/align] [/td][td] [align=center]2.5h[/align] [/td][td] [align=center]液固比[/align] [/td][td] [align=center]20:1[/align] [/td][/tr][tr][td]提取次数[/td][td=2,1] [align=center]1[/align] [/td][td=2,1] [align=center]2[/align] [/td][td=2,1] [align=center]3[/align] [/td][/tr][tr][td]多糖产率(%)[/td][td=2,1] [align=center]3.46[/align] [/td][td=2,1] [align=center]5.71[/align] [/td][td=2,1] [align=center]8.68[/align] [/td][/tr][/table]3.4 均匀设计实验3.4.1 均匀设计实验方案在泽泻(均为5g干粉)多糖提取工艺中,我们要考察的主要因素有:提取温度、料液比及提取时间三个因素。根据单因素实验结果确定各因素的取值范围:提取温度X[sub]1[/sub] :55℃~100℃;料液比X[sub]2[/sub]:1:15~1:60:提取时间X[sub]3[/sub]:1.5h~3.75h。再根据各种因素的取值范围、试验精度要求,按提取温度间隔5℃,液料比间隔5,提取时间间隔0.25h,设计出一个3因素10水平的均匀设计表。根据均匀设计表中所列的提取条件,按照泽泻粗多糖的提取流程,对泽泻粗多糖进行提取,并计算其产率。(见表4-1)提取得到粗多糖并测定多糖纯度,进而求得纯多糖产率。[align=center]表4-1 均匀设计实验数据[/align] [table=638][tr][td] [table][tr][td] [table=100%][tr][td] 条件 编号[/td][/tr][/table] [/td][/tr][/table][img=,98,65]https://bbs.instrument.com.cn/xheditor/xheditor_skin/blank.gif[/img][img=,84,52]https://bbs.instrument.com.cn/xheditor/xheditor_skin/blank.gif[/img][/td][td] [align=center]温度(℃)[/align] [/td][td] [align=center]料液比[/align] [align=center](g/mL)[/align] [/td][td] [align=center]时间(min)[/align] [/td][td] [align=center]粗多糖产率(%)[/align] [/td][td] [align=center]纯多糖产率(%)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]55[/align] [/td][td] [align=center]1:35[/align] [/td][td] [align=center]180[/align] [/td][td] [align=center]14.24[/align] [/td][td] [align=center]1.22[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]60[/align] [/td][td] [align=center]1:60[/align] [/td][td] [align=center]120[/align] [/td][td] [align=center]15.44[/align] [/td][td] [align=center]1.67[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]65[/align] [/td][td] [align=center]1:30[/align] [/td][td] [align=center]225[/align] [/td][td] [align=center]12.72[/align] [/td][td] [align=center]1.27[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]70[/align] [/td][td] [align=center]1:55[/align] [/td][td] [align=center]165[/align] [/td][td] [align=center]14.94[/align] [/td][td] [align=center]2.50[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]75[/align] [/td][td] [align=center]1:25[/align] [/td][td] [align=center]105[/align] [/td][td] [align=center]13.62[/align] [/td][td] [align=center]3.74[/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]80[/align] [/td][td] [align=center]1:50[/align] [/td][td] [align=center]210[/align] [/td][td] [align=center]23.82[/align] [/td][td] [align=center]6.55[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]85[/align] [/td][td] [align=center]1:20[/align] [/td][td] [align=center]150[/align] [/td][td] [align=center]23.19[/align] [/td][td] [align=center]5.98[/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]90[/align] [/td][td] [align=center]1:45[/align] [/td][td] [align=center]90[/align] [/td][td] [align=center]23.05[/align] [/td][td] [align=center]5.71[/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]95[/align] [/td][td] [align=center]1:15[/align] [/td][td] [align=center]195[/align] [/td][td] [align=center]16.52[/align] [/td][td] [align=center]4.92[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]100[/align] [/td][td] [align=center]1:40[/align] [/td][td] [align=center]135[/align] [/td][td] [align=center]39.93[/align] [/td][td] [align=center]8.74[/align] [/td][/tr][/table]3.4.2 最优提取条件的选择用SPSS 19.0统计软件,以纯多糖得率为评价指标对各因素进行线性回归分析,模型的优度通过复相关系数和方差分析来判定。结果如表4-2。[align=center]表4-2 回归方程[/align] [table=638][tr][td] [align=center] [/align] [/td][td] [align=center]回归方程式[/align] [/td][td] [align=center]R[/align] [/td][td] [align=center]P[/align] [/td][/tr][tr][td] [align=center]回归方程1[/align] [align=center]回归方程2[/align] [align=center]回归方程3[/align] [/td][td] [align=center]Y=-9.850+0.164X[sub]1[/sub]+0.033X[sub]2[/sub]+0.001X[sub]3[/sub][/align] [align=center]Y=-7.595+0.153X[sub]1[/sub][/align] [align=center]Y=3.780-0.002X[sub]2[/sub] X[sub]3[/sub]+3.004E-5 X[sub]1[/sub]X[sub]2[/sub] X[sub]3[/sub] [/align] [/td][td] [align=center]0.919[/align] [align=center]0.902[/align] [align=center]0.960[/align] [/td][td] [align=center]0.008[/align] [align=center]0.000[/align] [align=center]0.000[/align] [/td][/tr][/table]表4-2中,Y为纯多糖得率,X1为提取温度,X2为液固比,X3为提取时间。方程1,R[sup]2[/sup]= 0.844,P值为0.008,回归非常显著,常数项和X1项P值分别0.041和0.002小于0.05 ,回归显著,有统计意义,而X2,X3均回归不显著,方程1多糖产率预测值为7.98%;方程2为将各项及其交叉乘积项全部纳入进行逐步回归的结果,我们发现,最后的方程中只保留了X1项,方程2的 R[sup]2[/sup]= 0.813,常数项和X1项P值分别为0.006和0.000,均小于0.01,回归亦非常显著有效,其预测值为7.66%。方程3为全体向后回归分析结果,R[sup]2[/sup]= 0.922,P值为0.000,常数项乘积项P值分别为0.001,0.000和0.000,均小于0.01 。故回归非常显著,其预测值为8.28%。3.4.3 最优提取条件的验证综合上述三方程的回归结果,及均匀设计和单项实验的结果,我们采取提取温度100℃、提取时间为135 min、提取料液比为40,即第10组的条件为最佳条件,并重复3次进行实验验证。结果见表4-3。[align=center]表4-3 最优提取条件测得的多糖含量[/align] [table][tr][td] [align=center]实验编号[/align] [/td][td] [align=center]提取条件[/align] [/td][td] [align=center]粗多糖得率(%)[/align] [/td][td] [align=center]纯多糖得率(%)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td=1,4] [align=center]提取温度:100℃[/align] [align=center]料液比:1:40[/align] [align=center]提取时间:135 min[/align] [/td][td] [align=center]32.24[/align] [/td][td] [align=center]8.57[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]28.64[/align] [/td][td] [align=center]8.99[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]28.99[/align] [/td][td] [align=center]8.92[/align] [/td][/tr][tr][td] [align=center]平均值[/align] [/td][td] [align=center]29.96[/align] [/td][td] [align=center]8.83[/align] [/td][/tr][/table]4 实验结果4.1 单因素实验结果4.1.1 液固比采用提取温度80 ℃,加热2.5h,提取1次,考察了液固比对提取收率的影响。图4-1表明,固液比从10:1增到20:1多糖产率并无太大变化,液固比从20:1增到30:1纯多糖产率提高了56.94 %,同样,从30:1到40:1纯多糖产率又提高了44.94%。而在40:1到50:1之间,反而下降。主要是由于开始增加提取液体积有利于细胞内容物的溶出,而液固比到达40:1之后,多糖成分已基本溶出,故多糖产率并没有提高,反倒降低。考虑到工业生产中水的用量和多糖产率的综合因素,可以得出40:1应为最佳提取液固比。[align=center][img=,542,271]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261726359481_8405_3237657_3.png!w542x271.jpg[/img][/align][align=center]图4-1 液固比对泽泻粗多糖得率的影响[/align][align=center] [/align]4.1.2 提取温度采用液固比为20:1,提取时间2.5h,提取1次,考察了提取温度对多糖产率的影响,结果见图4-2。由图中可以看出,当温度从60 ℃上升到70 ℃时,粗多糖得率共提高了58.56%,从70℃到80℃,提高了58.54%,80℃到90℃,提高了26.37%,从90℃到100℃,提高了66.43%。随着温度的上升,多糖产率一直在增加,说明温度的提高对多糖的溶出有显著影响。显然,从60℃到90℃,多糖产率几乎呈线性上升,从90℃到100℃,较60℃到90℃上升更快,且产率最高。过低的温度会造成提取物溶出少甚至不溶出,而较高温度会显著提高多糖产率。所以,即使较高的温度会略微增加能源上的成本,但是却使多糖产率增加数倍,提高药材利用率,大大降低总生产成本。综合以上各方面因素考虑,得出多糖的最佳提取温度为100 ℃。[align=center][img=,556,281]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261727189034_3165_3237657_3.png!w556x281.jpg[/img][/align][align=center]图4-2 提取温度对泽泻多糖得率的影响[/align][align=center] [/align]4.1.3 提取时间中药材有效药物成分溶出需要一定的时间,较短会造成药物有效成分无法最大限度地溶出,过长的提取时间则会导致有效成分分解。采用提取温度80 ℃,液固比20:1,提取1次,考察了提取时间对多糖得率的影响,结果见图4-3。可以看出,提取时间超过2h后多糖得率并未继续增加,反而下降;而2h之前,多糖得率增加显著,从1h到2h增加了49.11%。虽然在3.5h处总产率较2h增加了0.11%,但是提取时间却较2h多出将近一倍,大大增加了生产成本,故2h为最佳提取时间。[align=center][img=,560,260]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261727397775_5830_3237657_3.png!w560x260.jpg[/img][/align][align=center]图4-3 提取时间对泽泻多糖得率的影响[/align]4.1.4 提取次数采用提取温度80 ℃,提取时间2.5h,液固比20:1,考察了提取次数对多糖得率的影响,结果见图4-4。结果发现:提取3次时多糖得率最高,比1次提取提高了1.5倍,差别显著。而提取两次较提取一次,也提高了65.03%,提高显著。提取三次的多糖产率是提取一次的2.5倍。因此,从约成本,提高药材利用率的角度考虑,确定最佳提取次数为3次。[align=center][img=,548,269]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261727581933_5743_3237657_3.png!w548x269.jpg[/img][/align][align=center]图4-4 提取次数对泽泻多糖得率的影响[/align][align=center] [/align]4 . 2 均匀设计实验结果本实验采用水提醇沉法提取泽泻多糖,通过对料液比、提取时间、提取温度等三个可控条件进行均匀设计实验,结合实验及生产实际,确定了泽泻多糖提取的最优条件,并利用该最优条件测定了泽泻多糖的含量,计算出了纯多糖的得率。结果见表4-4。[align=center]表4-4 泽泻多糖提取最优条件及多糖含量[/align] [table][tr][td=4,1] [align=center]最优提取条件[/align] [/td][td=1,2] [align=center]粗多糖得率[/align] [align=center](%)[/align] [/td][td=1,2] [align=center]纯多糖得率[/align] [align=center](%)[/align] [/td][/tr][tr][td] [align=center]提取温度[/align] [/td][td] [align=center]提取料液比[/align] [/td][td] [align=center]提取时间[/align] [/td][td] [align=center]提取次数[/align] [/td][/tr][tr][td] [align=center]100℃[/align] [/td][td] [align=center]1:40[/align] [/td][td] [align=center]135 min[/align] [/td][td] [align=center]1次[/align] [/td][td] [align=center]29.96[/align] [/td][td] [align=center]8.83[/align] [/td][/tr][/table]所得纯多糖实际产率8.83%与理论得率8.28%十分接近。[color=#000000]5 讨论5 . 1多糖提取与含量测定过程(1)在多糖提取过程中,除待测因素温度、料液比、提取时间按要求改变外,其他条件均应保持一致,以减少系统误差,增加数据的准确性。(2)在转移多糖溶液的过程中要尽可能的减少损失及其操作的一致,如粗过滤完抽滤时滤渣滤棉中残余多糖成分的转移,旋蒸浓缩提取液后的转移和离心过程中多糖的转移应最大程度减少多糖损失量,并保持操作的一致性。(3)在绘制标准曲线及用苯酚-硫酸法测多糖含量时,加入苯酚后一定要混匀,以防止硫酸直接氧化苯酚,导致糖类反应不完全。此外,苯酚须现用现配,避光保存。(4)在硫酸与糖反应时,一般方法是加入苯酚和硫酸后摇匀,直接室温放置30min后测其吸光度,为了保证反应完全,本实验在加入硫酸并摇匀后,先沸水浴15min,再冷水浴10min,再室温放置5min后测量吸光度。并在测量时保证每组的反应时间一致。(5)纯多糖含量的测定过程,为了保证数据的准确性,单因素实验中同一组的最好同时测,均匀设计实验的十组最好同一天测完。(6)由于实验时间有限,对于泽泻多糖测定时,采用的是以往经验的可见光范围490nm进行测定,这是实验中不完善的地方,准确的操作应通过实验找到多糖吸光度最大的波长进行测定。5 . 2 单因素实验由于单因素只是考虑单个提取条件对产率的影响,不能考虑到多种因素共同的影响,所以只是作为参考结果,对于单因素对多糖提取的影响具有参考价值,但是从总的生产上来说,均匀设计具有更加实用的价值。本实验中,单因素最优条件为:液固比40:1,提取温度100℃,提取时间2h,提取次数3次。单因素中提取次数的结果中提取两次较提取一次产率的增长值,还没有提取三次较提取两次的增长值大。可能是因为提取温度不够高,多糖溶出较慢所致。单从单因素的角度来看提取三次为最佳条件。但是从生产过程考虑,提取次数的增加会增加很大工作量,一般会选择一次就能提取完全的条件。而均匀设计实验中也证明,在100℃,40:1,135min条件下多糖的产率就可以达到8.74%,比单因素实验中提取三次的量还要高,故选择一次为最佳提取次数。5 . 3 均匀设计实验均匀设计实验结果8.83%同实验分析的理论结果8.28%较为接近,这也证明了实验数据的准确性,并通过回归分析确定了实验的最佳提取条件。均匀设计是在单因素的基础上进行的,综合两个实验的数据结果,不难发现提取的最佳条件为:提取温度100℃、提取时间为135 min、提取料液比为40、提取一次。5 . 4 整体结果讨论单因素实验中,我们可以得到以下关于单因素对多糖提取率的影响。提取次数与多糖产率呈正相关,提取时间也是呈正相关。提取时间与多糖产率的关系是到一定时间就达到稳定,即超过这个时间显著性不过。液固比与多糖产率的关系是存在一个峰值,低于此值,产率随液固比增加而增加,超过此值则随液固比增加而产率降低。这也给我们一些启发,对于这些植物药中似多糖类水溶性物质的提取条件也应存在此种规律,可作为以后研究的参考。均匀设计实验是在单因素的基础上,综合考虑了提取时间、温度和液固比对多糖产率的影响,是较符合实际生产条件的一项实验,具有较高的应用参考价值。当然,除了本课题中考虑到的因素,可能还有其他未被考虑到的一些因素。均匀设计只是以线性回归的方式对实验数据进行分析,而现在有更为先进的如响应面分析法等。这都说明多糖的提取工艺有很大的提升空间。参考文献 中药大辞典.上海:上海科学技术出版社,2006:2067Xie Min.Phmaracology of traditional Chinese medical formulas.Beijing:The People’s Public Health Publish House,2007 国家药典委员会编.中国药典(一部).中国医药出版社,2010:213 黄珍,刘咏松.泽泻降血脂药理作用及物质基础研究进展.山西中医学院学报,2008,9(5):55~56 陈曦.泽泻的研究现状与进展.中国民族民间医药,2011,20(9):50~51,53 臧萍.泽泻的研究现状及展望.中国中医药现代远程教育,2009,07(6):180~182Yamaguchi K.Akauurane derivative isolated from Alisma orientale Acta Crystallogr SectC Cryst. Struct .医药导报,2003,22(5):295Peng GP,LouFC.Isolation and indentification of diterpenoids fromAlisma orientalis .Actapharmaceutica sinica,2002,37:950~954 丁霞,吴水生.泽泻的研究进展.中医药信息,2008,25(5):19~21 王建平,傅旭春,泽泻的药理作用和临床研究进展.2011年浙江省医学会临床药学分会学术年会论文汇编,2011 冯欣煜,姚志凌.泽泻药理研究与临床新用.中国医药指南,2007,S1:37~38 尹艳,高文宏,于淑娟,等.多糖提取技术的研究进展.食品工业科技,2007,28(2):248~250 吴华振.植物多糖的药理作用及应用进展.实用医技杂志,2005,12(7):1803~1804 杨艳,徐应淑.川、黔地区金钗石斛多糖的含量测定.中国药房,2010,21(27):2552~2554 李小凤,韦庆宁,史柳芝,等.泽泻多糖的提取及含量测定.山东化工,2012,41(7):26~28 朱秀灵,戴清源,冯宏波.超声波辅助提取银杏叶多糖工艺研究. 安徽工程科技学院学报,2010,25(3):6~8 缪建,杨文革,周彬.银杏叶多糖提取工艺的优化. 中国食品添加剂,2007,12(2):153~156 金汝城,周术涛,张东博,等.均匀设计优化超声波法提取黄芪多糖的研究. 安徽农业科学,2009,37(12):5498~5499[/color][align=center] [/align]
蘑菇中的多糖可以帮助调节免疫、降低炎症;膳食纤维有助降低餐后血糖;β葡聚糖对改善血脂有明显效果,因此,经常食用蘑菇可帮助降低慢病风险。
本人最近测定枸杞多糖含量时,所用测定方法均为2005年版药典枸杞项下,结果出现如下问题:测定枸杞提取物(注:厂家未提供提取方法)枸杞多糖含量时,直接称样水溶解然后测定,结果所测提取物含量高达95%;按药典方法进行前处理,测出值也高达70%;而厂家提供的是50%。另外,我们公司有一种产品,45度白酒,其中添加了葛根黄酮提取物和这种枸杞提取物,结果所测枸杞多糖含量也与理论添加量有很大差别。请问:像我这种情况,在测定枸杞多糖时,需要像药典中那样前处理吗?有哪些更好的方法?多糖测定时葛根黄酮会不会影响?测定提取物和测定白酒中多糖含量时方法是否可以一致?不行的话又分别该怎样测定? 恳请问各位专家朋友指点迷津!谢谢![/color][/color][/color]
亚甲基蓝比色法测定海参不同组织酸性黏多糖含量http://www.cnki.com.cn/Article/CJFDTotal-HYKX201103014.htm不知道有没有版友做过海参中的多糖呀?看到这样一篇文章不知道有没有版友手里有呀?是否能分享一下如果有做过的版友也可以分享一下你的经验,谢谢!!
黄芪多糖提取用水提,还是醇提出膏率跟纯度哪个好一点
请问植物多糖~就是纤维素多糖是酸性还是碱性?
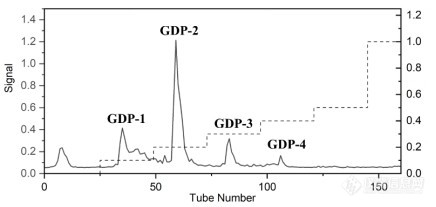
[align=center][b][font=Arial][font=宋体]天然多糖研究体积排阻色谱柱选择初探[/font][/font][/b][/align][font=Arial][font=宋体]多糖是最丰富的生物聚合物,已被发现参与许多生物过程,例如细胞间通讯、胚胎发育、细菌和[/font]/[font=宋体]或病毒感染以及体液和细胞免疫。因此,多糖与核苷酸、蛋白质、脂质一起构成了生命科学中最重要的四大生物大分子。[/font][/font][font=Arial][font=宋体]尽管多糖已在各种工业应用中使用了几十年,例如[/font] [font=宋体]药物、生物材料、食品和营养以及生物燃料,对多糖在生命科学中的重要性的日益了解和深入研究正在推动多糖用于新型(生物分子)应用的开发。不断有来自植物(膳食纤维、草药和木本植物)、藻类和地衣的生物活性多糖,以及来自动物的其他生物活性多糖(例如肝素、硫酸软骨素和透明质酸)被报道。[/font][/font][font=Arial][font=宋体]天然多糖发现的主要方法为提取纯化得到相对较纯的多糖组分,从而进行结构表征和活性评价。具体而言,通过水提醇沉得到粗多糖,再通过弱阴离子交换色谱法([/font]DEAE[font=宋体])进行纯化,得到不同盐梯度洗脱的组分。对于这些组分,需要通过体积排阻色谱法([/font][font=Arial]SEC[/font][font=宋体])分析判定,是否需要进一步纯化;得到纯品之后,需要测定多糖组分的分子量;研究多糖在体内的降解规律,也需要[/font][font=Arial]SEC[/font][font=宋体]判定多糖分子量的变化。因此,多糖研究实验室往往需要多支[/font][font=Arial]SEC[/font][font=宋体]色谱柱,以适应不同的用途。研究人员热切期望有一只首选[/font][font=Arial]SEC[/font][font=宋体]色谱柱,可以快速开展研究。本文以小秦艽多糖的研究为例,说明[/font][font=Arial]BioCore SEC-1000[/font][font=宋体]作为多糖研究的首选色谱柱,在多个用途中的效果。[/font][/font][font=Arial][font=宋体]小秦艽,学名为达乌里秦艽[/font]([/font][i][font=Arial]Gentiana dahurica Fisch[/font][/i][font=Arial])[font=宋体],为龙胆科植物龙胆属多年生草本植物,始载于《神农本草经》,列为中品,具有祛风湿、清湿热、止痹痛、退虚热的功效。小秦艽多糖经过提取和除杂后,通过中压制备[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]([/font][font=Arial]DEAE[/font][font=宋体]填料)填料纯化,得到四个组份。在后续多糖组份纯度判定和降解规律研究中,使用了[/font][font=Arial]BioCore SEC-1000[/font][font=宋体]色谱柱。[/font][/font][b][font=Arial][font=宋体]一、实验条件与方法[/font][/font][font=Arial]1.1. [font=宋体]仪器及色谱条件[/font][/font][/b][font=Arial][font=宋体]高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url]:安捷伦[/font] 1260 infinity II[font=宋体],配有[/font][font=Arial]Wyatt[/font][font=宋体],[/font][font=Arial]Optilab T-REX[/font][font=宋体]示差折光检测器([/font][font=Arial]RI[/font][font=宋体])[/font][font=Arial] [/font][font=宋体]岛津[/font][font=Arial]LC-2030C[/font][font=宋体],配有岛津[/font][font=Arial]RID-20A1.2[/font][font=宋体]示差折光检测器([/font][font=Arial]RI[/font][font=宋体]);大连依利特有限公司 [/font][font=Arial]Elite 1100 [/font][font=宋体][url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url],配有岛津[/font][font=Arial]RF-20AXS[/font][font=宋体]荧光检测器([/font][font=Arial]FLD[/font][font=宋体])。[/font][/font][font=Arial][font=宋体]色谱柱:[/font]T (13μm[font=宋体],[/font][font=Arial]7.8×300mm)[/font][font=宋体]或[/font][font=Arial]Biocore SEC-1000[/font][font=宋体]([/font][font=Arial]5μm, 7.8×300mm[/font][font=宋体]);[/font][/font][font=Arial][font=宋体]流动相:[/font]50 mM NH[/font][sub][font=Arial]4[/font][/sub][font=Arial]OAc (80%)+Methanol (20%)[font=宋体];[/font][/font][font=Arial][font=宋体]流速:[/font]0.5 mL/min[font=宋体];[/font][/font][font=Arial][font=宋体]柱温:[/font]25[/font][font=宋体]℃[/font][font=Arial][font=宋体];[/font][/font][font=Arial][font=宋体]进样量:[/font]20 μL[font=宋体];[/font][/font][font=Arial][font=宋体]采集时间:[/font]30 min[font=宋体]。[/font][/font][b][font=Arial]1.2 [font=宋体]样品处理[/font][/font][/b][font=Arial]1[font=宋体])秦艽多糖组份纯度分析:称取秦艽多糖[/font][font=Arial]GDP-3[/font][font=宋体](即样品[/font][font=Arial]0.3 M[/font][font=宋体])约[/font][font=Arial]5 mg[/font][font=宋体],溶于流动相,配制成[/font][font=Arial]10 mg/mL[/font][font=宋体]溶液。上样前用[/font][font=Arial]0.22 μm[/font][font=宋体]滤膜过滤。[/font][/font][font=Arial]2[font=宋体])多糖[/font][font=Arial]GDP-2[/font][font=宋体]体外稳定性的考察: [/font][font=Arial]GDP-2[/font][font=宋体]的经 [/font][font=Arial]FITC[/font][font=宋体]荧光标记(产物为[/font][font=Arial]FGDP-2[/font][font=宋体]),进行体外模拟消化。模拟胃液由胃蛋白酶[/font][font=Arial](10 g/L)[/font][font=宋体]和稀[/font][font=Arial]HCl (16.4 mL/L)[/font][font=宋体]组成,调节[/font][font=Arial]pH[/font][font=宋体]至[/font][font=Arial]1.3[/font][font=宋体]。将[/font][font=Arial]FGDP-2 (25 mg/mL)[/font][font=宋体]与各人工胃液和人工肠液[/font][font=Arial]10 mL[/font][font=宋体]混合,[/font][font=Arial]37[/font][/font][font=宋体]℃[/font][font=Arial][font=宋体]孵育。分别于[/font]0 h[font=宋体]、[/font][font=Arial]4 h[/font][font=宋体]、[/font][font=Arial]6 h[/font][font=宋体]、[/font][font=Arial]12 h[/font][font=宋体]取孵育液各[/font][font=Arial]500 μL[/font][font=宋体]作为[/font][font=Arial]HPLC-FLD[/font][font=宋体]测定样品。用[/font][font=Arial]0.2 M NaOH[/font][font=宋体]和[/font][font=Arial]TCA (20 % , w/w)[/font][font=宋体]终止反应。[/font][/font][b][font=Arial][font=宋体]二、结果与讨论[/font][/font][/b][font=Arial][font=宋体]多糖纯度及分子量的测定是多糖结构解析及构效关系研究的关键步骤。小秦艽多糖的纯化色谱洗脱曲线如图[/font]1[font=宋体]所示,一共得到四个组份。[/font][/font][align=center][img=,348,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081451227890_6619_3237657_3.jpg!w436x207.jpg[/img][/align][align=center][font=Arial][font=宋体]图[/font]1 [font=宋体]小秦艽多糖的[/font][font=Arial]DEAE[/font][font=宋体]纯化色谱图(硫酸苯酚法重构)[/font][/font][/align][font=Arial][font=宋体]组份经透析、冻干后,首先需要确定它的纯度。如果组份不纯,则后续的核磁分析将是徒劳无功的。我们实验室前期配备了三支不同孔径的[/font]SEC[font=宋体]色谱柱,经分析组份[/font][font=Arial]1[/font][font=宋体]和[/font][font=Arial]2[/font][font=宋体]较纯,而[/font][font=Arial]3[/font][font=宋体]和[/font][font=Arial]4[/font][font=宋体]不纯。如果不纯,则需要通过凝剂渗透色谱([/font][font=Arial]GPC[/font][font=宋体])进一步纯化。[/font][font=Arial]SEC[/font][font=宋体]分析可以确定组份的数目,以在[/font][font=Arial]GPC[/font][font=宋体]纯化时收集馏分。[/font][/font][font=Arial][font=宋体]在用实验室已有[/font]SEC[font=宋体]色谱柱分析时(图[/font][font=Arial]2[/font][font=宋体]上),色谱峰数目不明确。该色谱柱孔径为[/font][font=Arial]450?[/font][font=宋体],粒径为[/font][font=Arial]13 μm[/font][font=宋体],分离度不理想,可能分子量超出其适用范围。于是改用孔径更大且粒径为[/font][font=Arial]5 μm[/font][font=宋体]的[/font][font=Arial]Biocore SEC-1000[/font][font=宋体]柱进行试验(图[/font][font=Arial]2[/font][font=宋体]下),结果表明分离效果好,明显识别为三个色谱峰。为该组份的后续纯化以及多糖稳定性的考察提供基础。[/font][/font][align=center][img=,264,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081451353696_6101_3237657_3.jpg!w331x346.jpg[/img][/align][align=center][font=Arial][font=宋体]图[/font]2 [font=宋体]秦艽多糖分子量的分析色谱图[/font][/font][/align][align=center][font=Arial][font=宋体](上图,实验室已有色谱柱[/font]T[font=宋体];下图,纳谱[/font][font=Arial]Biocore SEC-1000[/font][font=宋体])[/font][/font][/align][font=Arial][font=宋体]此外,该色谱柱,分离中等分子量多糖标准品([/font]36 kDa ~ 131 kDa[font=宋体])时,也呈现了较好的线性关系。因此,我们认为该色谱柱具有分子量适用范围宽的优点,可以作为多糖分析中的通用[/font][font=Arial]SEC[/font][font=宋体]色谱柱。[/font][/font][font=Arial][font=宋体]为了确定秦艽多糖的体外消化模式,选取了经测量相对较纯的秦艽多糖[/font]GDP-2[font=宋体]组分进行荧光标记,建立了[/font][font=Arial]HPLC - FLD[/font][font=宋体]分析方法,进行体外稳定性考察。通过上述实验对[/font][font=Arial]SEC[/font][font=宋体]柱的比较分析,选取了分离效果较好的[/font][font=Arial]Biocore SEC-1000[/font][font=宋体]进行该实验。[/font][font=Arial]FGDP-2[/font][font=宋体]在模拟胃液中的分子量随时间变化色谱图如图[/font][font=Arial]3[/font][font=宋体]所示,发现色谱峰的相对峰高向小分子偏移,说明[/font][font=Arial]FGDP-2[/font][font=宋体]在消化[/font][font=Arial]4 h[/font][font=宋体]后发生部分降解。可能是由于多糖对酶和强酸敏感,导致多糖的糖苷键断裂。然而,观察到整个消化系统中没有单糖出现,胃和肠道不会造成多糖结构的过度损失。[/font][/font][align=center][img=,288,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081451479308_4610_3237657_3.jpg!w361x212.jpg[/img][/align][align=center][font=Arial][font=宋体]图[/font]3[font=宋体]模拟胃液消化过程中[/font][font=Arial]FGDP-2[/font][font=宋体]的[/font][font=Arial]HPLC - FLD[/font][font=宋体]表征[/font][/font][/align][font=Arial][font=宋体]三、小结[/font][/font][font=Arial][font=宋体]多糖研究人员往往面对不同来源的多糖分子,分子量差异较大,从几万到上百万的多糖分子量。在多糖的研究过程中,需要一支通用的[/font]SEC[font=宋体]色谱柱,进行快速分子量判断,以确定后续研究操作。[/font][font=Arial]BioCore SEC-1000[/font][font=宋体]在我们对小秦艽多糖的分子量纯度分析、分子量测定和体外消化稳定性等研究中,均获得了良好的效果。我们认为,[/font][font=Arial]BioCore SEC-1000[/font][font=宋体]可以作为多糖研究实验室的首选[/font][font=Arial]SEC[/font][font=宋体]色谱柱。[/font][/font][font=Arial] [/font][font=Arial][font=等线]公司:[/font][/font][font=等线][font=等线]苏州大学药学院[/font][/font][font=等线][font=等线]色谱柱信息:[/font][/font][font=Arial]BioCore SEC-1000 5μm, 7.8×300mm[/font][font=宋体] [/font]
有版友做过粗多糖吗?样品处理大家都是怎么做的?尤其是在沉淀粗多糖的那一步,洗涤残渣,如何保证清洗干净,只是去掉上清液还是需要过滤?如果要过滤有需要用什么过滤呢?希望做过的版友来一起讨论一下!谢谢
请问有没有做过利用Thermo 的SEC 色谱柱测多糖分子量或者分离多糖的?可行么?有什么注意的地方?
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网[em0805]
[color=#444444]我用我们实验室的[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]来测多糖结构,但是我们的柱子是测醇类物质的,不知道可不可以直接用,若是可以的话我应该做哪些前期处理呢?我想是不是可以把糖分解成醇类物质后再走柱子呢?还请各位高手指点一二,我想测多糖结构应该都做哪些呢?谢谢大家的慷慨帮助[/color]
公司新生产的药中含有一种叫云芝多糖的原料,在检验过程中遇到了一些问题,想请教一下论坛里的老师。云芝多糖是多孔菌科植物云芝的干燥子实体提取的多糖。其中一项理化检验标准:取本品(云脂多糖原料)适量,置锥形瓶中,加斐林试液甲、乙各10ml,煮沸3-4分钟,冷却,滤过,取滤液适量,用12%的盐酸调至酸性,取5ml加热10分钟,冷却中和,再加斐林试液甲乙各10ml,煮沸2分钟,溶液中应析出红色氧化亚铜沉淀。但是我在做的过程中发现:加斐林试液甲乙各10ml煮沸后冷却,就有红色沉淀物析出,过滤后照标准做下去,得不到最后的结论??不知道是什么原因?想请教一下论坛里的老师帮忙给解答一下。谢谢!
我现在正在做植物中多糖的提取、分离和纯化,在测定多糖分子量时,若没有除蛋白会不会影响结果?还有多糖要多纯才能进行测定分子量呢?谢谢
各位: 有做过微生物多糖提取的朋友吗?请问微生物多糖是怎么提取的。小弟急着要了解哈,谢谢!
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网
我的多糖在做单糖组成时测到有葡萄糖、果糖、甘露糖、木糖,而做的核磁解析出了果糖、葡萄糖,另外解出一个鼠李糖,但是单糖组成并未测到鼠李糖,想问一下这种情况正常吗,会不会被审稿人所质疑
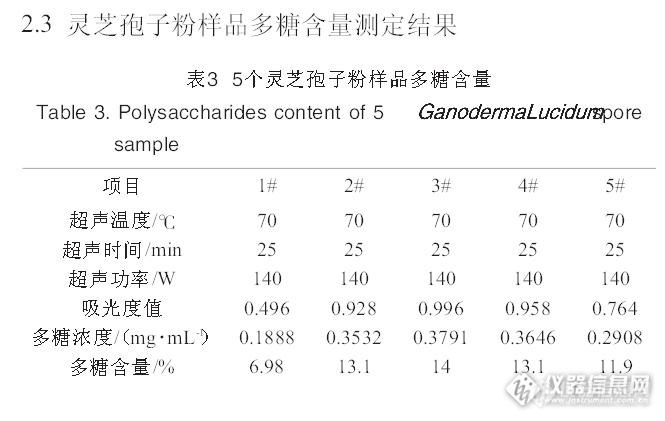
中国药典2010年版一部关于灵芝药材的多糖含量测定问题偶然的机会,有个样品是灵芝药材,做全检,其中含量测定是做灵芝的多糖含量.多糖含量做的多了,但都是保健食品的检验项目,还有做枸杞子的多糖.这个灵芝的多糖没做过.按常理这个灵芝多糖该很顺利就做出来的.可是事与愿违.按药典方法做出来的结果大跌眼镜,多糖含量结果是0.之后就是找原因,先找个人操作问题,步骤没错,顺序也没错,试剂也没加错.那操作排除了.又去药店买了整个的灵芝回来作参照,结果也是大跌眼镜,一样测出来的结果是0。问题来了。细细观察过程,原来在醇沉的那步骤里有异常,送检的灵芝和买回来的灵芝都没有沉淀产生,溶液还是透明的。难道是多糖量少的原因,于是又按药典的量称了1mg葡聚糖对照品用2ml水溶解后,再醇沉,是阳性反应啊,有乳白色的浑浊产生(沉淀)。http://ng1.17img.cn/bbsfiles/images/2013/10/201310171824_471607_1621232_3.jpg后来又拿了黄芪药材作参照(黄芪含有大量的黄芪多糖),在醇沉的那步骤里也是有乳白色的浑浊产生啊(沉淀)。到这里,该推断出问题该出在样品上了。后来又查了一下文献,有文献说到灵芝饱子粉含有的多糖含量大约为10%左右。http://ng1.17img.cn/bbsfiles/images/2013/10/201310171826_471610_1621232_3.jpg最后,我又把送检灵芝和买来的灵芝做了薄层鉴别,薄层是与对照药材一样有荧光斑点的哦。到这里,想到一个原因,现在灵芝饱子粉热销,很值钱,很多的种植户都是待灵芝开了后收集了饱子粉才会采摘整个的灵芝子实体,图经济效应最大化。所以以前我们还可以买到子实体(带有泥灰一样的),现在的买到子实体都是非常的干净,干净到发亮反光(哈哈,有点夸张吧)。我是这样想的,为什么这次送检的灵芝和药店买回来的灵芝做不出多糖呢,问题在于饱子粉上,饱子粉含多糖达到10%,而子实体基本是木头(纤维),子实体的多糖该很低的,子实体开过收集了饱子粉以后,剩下的没有孢子的子实体的多糖数值肯定没多少了。做不出来也难怪了。所以,在修定药材标准时,特别是整株植物药材,由几个不同的部位组成的,有花有果有茎有叶有根的,就更复杂了。一定要弄清楚目标物的来源,现有的商人都是追逐利润最大化的。
本人最近测定枸杞多糖含量时,所用测定方法均为2005年版药典枸杞项下,结果出现如下问题:测定枸杞提取物(注:厂家未提供提取方法)枸杞多糖含量时,直接称样水溶解然后测定,结果所测提取物含量高达95%;按药典方法进行前处理,测出值也高达70%;而厂家提供的是50%。另外,我们公司有一种产品,45度白酒,其中添加了葛根黄酮提取物和这种枸杞提取物,结果所测枸杞多糖含量也与理论添加量有很大差别。请问:像我这种情况,在测定枸杞多糖时,需要像药典中那样前处理吗?有哪些更好的方法?多糖测定时葛根黄酮会不会影响?测定提取物和测定白酒中多糖含量时方法是否可以一致?不行的话又分别该怎样测定? 恳请问各位专家朋友指点迷津!谢谢!

[align=center]保健品中粗多糖含量的测定[/align]本文研究了苯酚-硫酸法检测不同基质的保健品中粗多糖的含量,论述了不同基质的前处理方法和经验。1 前言市场上常见的保健品多种多样,胶囊、口服液、药片等等。多糖含量作为保健品中的有效成分之一,越来越引起人们的关注。从药理学上讲,多糖具有抗肿瘤、抗病毒、增强免疫力、抗氧化、抗心血管疾病等。因为具有诸多功效,许多保健品生产公司也开发越来越多的含多糖保健品,通过在保健品中添加含有多糖的中药材或者海洋生物,从而使该保健品具有较高的多糖含量,增强其功效。不仅在胶囊、口服液等常规的保健品中添加含有多糖的成分,甚至在一些咖啡、饮料、食品中也添加含有多糖的组分,使其成为功能性的产品。多糖的含量对其功效的发挥至关重要,那么怎么准确、有效地检测出保健品中多糖的含量是一个重要的环节。保健品由于种类繁多,基质复杂,找到一种简单、有效的检测方法,能够检测出各种基质的保健品中多糖的含量具有重要的意义。本实验中采用了常见的苯酚-硫酸法检测保健品中粗多糖含量,选用乙醇提取以除去单糖、低聚糖、甙类及生物碱等干扰成分,然后用去离子水提取其中所含的多糖类成分。多糖在硫酸作用下,水解成单糖,并迅速生成糖醛衍生物与苯酚综合成有色化合物,用分光光度法测定其多糖含量。2 实验部分2.1 试剂95%乙醇 葡萄糖:优级纯;葡萄糖标准液:精确称取105℃干燥恒重的葡萄糖100 mg,置100 ml容量瓶中,加蒸馏水溶液解并稀释至刻度(可加几滴甲苯或几粒苯甲酸防腐)。此标准溶液1.00 ml含葡萄糖1.00 mg,储存于冰箱冷藏;苯酚;苯酚液:称取优级纯苯酚10.0 g,加水150 g ,置棕色瓶中备用,储存于冰箱;浓硫酸。2.2 仪器分光光度计。2.3 分析步骤2.3.1 样品预处理(1) 口服液等液体样品准确移取2.00~10.00 mL液体口服液试样,置于250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。(2)内容物为膏状的胶囊样品或者膏状类样品准确称取0.50~1.00 g膏状内容物或膏状样品,倘若其中含有油脂类辅料,加入乙醚或者石油醚脱脂,离心,弃去乙醚或者石油醚层。再用一定体积的水溶解,转移至250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。(3)内容物为粉状的胶囊样品或者粉状片剂、咖啡等准确称取0.10~0.50 g均质后的粉状样品,倘若其中含有脂肪类辅料,先加入一定体积的水,溶解粉状样品,再加入乙醚或者石油醚脱脂,离心,弃去乙醚或者石油醚层。将水层转移至250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。2.3.2 标准曲线的制备吸取葡萄糖标准液0.25 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL,分别置于50 mL容量瓶中,加水定容。吸取上述溶液各2.00 mL,再加苯酚液1.00 mL,涡旋混合均匀,迅速沿管壁加入浓硫酸5.00 mL,摇晃后涡旋混合,放置5 min,置沸水浴中加热15 min,取出后冷却至室温,于490 nm处以水代替样品作参比测吸光度,绘制标准曲线。2.3.3 样品中多糖含量测定吸取2.00 mL样品液,置于10 ml容量瓶中,加水定容。吸取2.00 mL上述溶液,按标准曲线制备项下方法测定吸光度。另以2.00 mL水,同上操作做空白。查标准曲线得样品液中葡萄糖含量。2.3.4 液体样品分析结果的计算计算液体样品中酸性多糖的含量按式(1)或者(2)计算,分别以mg/mL或者mg/g表示。[img=,503,114]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709449978_4859_3246897_3.png[/img][sub] [/sub] 式中: X—保健品中酸性多糖含量(以葡萄糖计), mg/g或者mg/mL表示;A—从浓度-吸光度曲线上查得样品溶液的葡萄糖浓度,μg;B—从浓度-吸光度曲线上查得空白溶液的葡萄糖浓度,μg;V[sub]1[/sub]—多糖溶液总体积,mL,如按本方法为100 mL;V[sub]2[/sub]—移取多糖溶液的初始体积,mL,如按本方法为2 mL V[sub]3[/sub]—待测多糖浓度溶液的总体积,mL,如按本方法为10 mL;V[sub]4[/sub]—待测多糖溶液的移取体积,mL,如按本方法为2 mL m—保健品的称取质量,g;V[sub]0[/sub]—保健品的测试体积,mL;如两次测定符合允许差时,取两次测定结果的算术平均值作为结果,报告结果取三位有效数字。2.3.5 允许差同一样品的两次测定值之差不得超过两次测定平均值的10%。2.3.6 结果与分析(1)含油脂类样品脱脂与否的影响含有油脂类的保健品,脱脂前后采用上述方法进行酸性多糖含量测定时,多糖含量有一定的差别,未脱脂的样品进行多糖含量测定时,过滤过程十分缓慢,耗时长,多糖含量数据经常不平行,而且数值偏高。[align=center][img=,300,307]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230846_01_3246897_3.jpg[/img][/align][align=center]图1 乙醚脱脂[/align]样品经过乙醚脱脂后有明显的油脂层。[align=center][img=,300,296]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230846_02_3246897_3.jpg[/img][/align][align=center]图2 回流后的未脱脂样品[/align][align=center][img=,300,302]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230847_01_3246897_3.jpg[/img][/align][align=center]图3 回流后的脱脂样品[/align]通过比较图2和图3,脱脂后的样品溶液更加澄清,无论是过滤还是洗涤,反应更快速,洗涤效果也更好。相反,未脱脂的样品,整个容器壁上都黏附着脂肪、油脂层,即使离心后过滤,过滤速率也很差,滤液也很浑浊,如下图4所示。[align=center][img=,300,268]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230847_02_3246897_3.jpg[/img][/align][align=center]图4 脱脂前后滤液的比较[/align][align=left]没有脱脂的样品,油脂层包裹着含有单糖或者寡糖的乙醇溶液,不容易被乙醇洗涤干净,这部分残留的单糖或者寡糖导致结果偏高。因此,对相应的含油脂保健品提前进行脱脂后再检测多糖,不仅能减少操作的时间,还能获得更为准确的结果。 [/align][align=left](2)醇沉时间的影响[/align][align=left]对以含有大豆油辅料的胶囊内容物进行脱脂后沉淀粗多糖,对比了加入9倍95%乙醇后立即回流提取多糖和加入9倍95%乙醇后室温下静置1 h再回流提取多糖,结果显示,加入乙醇后立即回流提取多糖与静置1h后再回流检测出的多糖含量分别为41.69 mg/g、48.08mg/g。可以看出,室温下醇沉时间的增加可以使更多的粗多糖醇沉完全,检测含量增高。[/align][align=left](3) 苯酚硫酸法操作方法的影响[/align][align=left]苯酚硫酸法检测粗多糖含量最为常见,操作简单,适用于常规检测。在实验过程中发现,无论苯酚和浓硫酸的加入比例是1:5还是1:10,苯酚的体积分数是5%还是6%,在进行加入时最好是一个样品加完苯酚,混匀后,立即沿管壁加入浓硫酸,混匀后,再加另一个样品的苯酚和浓硫酸,这样显色更稳定。实验中发现,倘若对所有样品全加完苯酚混匀后,再统一加浓硫酸,显色及不稳定,标准曲线甚至不成线性。苯酚易挥发,长时间与空气接触也容易被氧化,造成结果不稳定。[/align][align=center][img=,300,287]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230848_01_3246897_3.jpg[/img][/align][align=center]图 5 苯酚-硫酸法检测多糖含量[/align][align=left]图5为苯酚硫酸法侧多糖含量的标准曲线和样品,采用了单个样品加完苯酚和浓硫酸后再加另一个样品的苯酚好浓硫酸,显色稳定有规律,经过分光光度计检测,线性良好,样品数据平行,能够有效避免苯酚-硫酸法重现性差这一缺点。[/align]3. 结论采用苯酚-硫酸法检测保健品中粗多糖含量时,针对各种基质进行相应的脱脂操作、增加回流前的醇沉时间、进行显色反应时加入苯酚后混匀立即加入浓硫酸,能够使检测的数据更可靠、稳定。
目的 从虎眼万年青中提取、分离水溶性多糖,初步研究其特征和抗肿瘤活性。 方法 采用热水提取,乙醇沉淀,Sevag法脱蛋白,DEAE-Sepharose Fast Flow离子交换柱色谱和Sephadex G-75凝胶过滤柱色谱分离纯化,得到虎眼万年青均一多糖OCAP-2-2。毛细管区带电泳法(CZE)分析单糖组成;采用高效凝胶渗透色谱法(HPGPC)测定多糖纯度和相对分子质量;动物移植性实体瘤的瘤重实验法研究对小鼠S180肉瘤的抑瘤作用,采用细胞体外培养技术,MTT法检测对人白血病细胞株K562细胞的增殖抑制作用。 结果 经过分离纯化得到的均一多糖组分OCAP-2-2主要由葡萄糖、木糖、甘露糖、半乳糖等4种单糖组成,其相对分子质量之比为2.16∶1.26:0.88∶1.00,平均相对分子质量9.84×104,总糖含量为92.3%,总糖醛酸含量为6.21%,蛋白质含量为3.68%;在0.1~100 μgmL-1内与荷瘤对照组相比,OCAP-2-2对小鼠S180肉瘤有显著的抑制活性,其中多糖浓度为100 μgmL-1时抑瘤率达(53.16±4.23)% ([i]P<[/i]0.001);OCAP-2-2对K562细胞有明显的增殖抑制作用([i]P<[/i]0.01),在多糖浓度为0.10 μgmL-1时,增殖抑制率最高为(39.83±7.31)% ([i]P<[/i]0.01)。 结论 OCAP-2-2具有很高的抗肿瘤活性,可以探索作为一种潜在的天然抗肿瘤药物。
以猕猴桃根为原料,研究其多糖的微波辅助提取工艺条件。采用单因素试验和正交试验,探讨料液比(猕猴桃根粉:蒸馏水)、提取温度、提取时间、微波功率等对猕猴桃根多糖提取率的影响,并以提取率为评价指标,优化提取工艺。实验结果表明:微波辅助提取猕猴桃根多糖的最佳工艺条件为料液比1:20(g/mL)、提取温度60℃、提取时间15min、微波功率600W,在此条件下猕猴桃根多糖的提取率为11.34%。
多糖类手性固定相在色谱中的应用郑 芸 方积年(中国科学院上海生命科学院上海药物研究所,上海201203)摘要 手性色谱技术是最重要的手性分离方法之一,它不仅可以快速地分析对映体纯度,也可以用于大量制备光学异构体。设计和发展高效的固定相是手性色谱技术的核心。在诸多的手性固定相中,多糖类手性固定相因品种繁多、耐用而被广泛应用。本文综述了多糖类手性固定相在高效液相色谱、模拟移动床色谱、超临界流体色谱及膜分离中的应用。共引用文献52篇。关键词 多糖,手性固定相,色谱,评述1 引 言 近20年来,用色谱方法分离手性化合物取得了显著进展,已广泛应用于许多领域,如药物化学、不对称合成和生物分析等,不仅可以测定光学纯度,也可用于大量制备光学异构体。 手性色谱技术的核心是设计和制备适用范围广的手性固定相(chiral stationary phase,CSP)。至今已制备出大量用于色谱的CSP,其中120多种已商品化。CSP可分为两大类:一类是由小分子固定在硅胶载体上构成(刷型或Pirkle型),另一类是用光学聚合物固定在载体上制成,多孔胶状的聚合物也可直接用作CSP。其中Okamoto等发展的多糖类固定相是非常有用的分离工具,它们种类繁多、耐用而且负荷量大。其它广泛使用的手性固定相有衍生化的酒石酸CSP(Kromasil—TBB) ]、a1一酸性糖蛋白、Pirkle固定相、环糊精、聚丙烯酰胺和大环抗生素,如万古霉素、teicoplanin和瑞斯托菌素以及最新的用分子印记技术及仿生传感技术发展的CSP 。 多糖,如纤维素和淀粉是自然界大量存在的有光学活性的生物聚合物。它们具有良好的精细结构,能拆分异构体,包括氨基酸衍生物和联苯衍生物的阻转异构体,但它们的手性识别能力不强,适用面也很窄,只能用于毛细管电泳(CE)分析中。半合成的经过改性的多糖适用范围则大大扩展,可用于LC、CE、SFC、TLC、膜分离及萃取中,既可用于分析也可用于制备。经研究发现,多糖类衍生物的手性识别能力与单糖残基的性质、连接位置和连接形式有关。2 高效液相色谱(HPLC) 多糖类手性固定相在HPLC中的应用相当广泛,常见的商品化多糖类手性固定相及应用实例可参考相关文献。纤维素类多糖为刚性的线形结构,而淀粉类多糖具有螺旋形结构。据报道有84%的小分子外消旋化合物可用Chiralcel OJ、Chiralcel OD、Chiralpak AD、Chiralpak AS分离 。用HPLC分析对映体时,除了常用的UV或示差折光指数检测器,还可使用专门检测手性物质的旋光检测器和圆二色散检测器。这也是HPLC比[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]和NMR光谱等其它分析方法的优越之处。 为提高手性分离效果以利于检测,还可以对样品进行适当的衍生化。Fukushima 用荧光试剂DBD—PZ([4.[(N,N—dimethylamino)一sulfony1]-7一piperazino-2,1,3-benzoxadiazole])和DBD—COHz(4[[(N—hydrazinoformy1)methy1]一N—methy1]amino-7一[N,N一(dimethylamino)sulfony1]-2,1,3-benzoxadiazole)对(RS)-2一芳基丙酸类化合物进行了衍生化,并发现衍生物洗脱顺序发生改变。3 动态高效液相色谱(DHPLC) 新发展的手性DHPLC方法 可用于研究高温时立体化学稳定的手性化合物,它可得到一系列受温度控制的平顶或峰形曲线,从而可以考察对映体互变的动态过程、动力学数据及对映体互变的能垒。一般在CSP上用色谱方法分离外消旋混合物,最多可以得到收率50% 的两种纯的光学异构体。而在DHPLC中,利用CSP来达到对映体互变平衡,从而使分离和平衡合二为一,理论上可以从外消旋混合物中以100%收率得到一种纯的光学异构体。它的基本原理是外消旋混合物立体化学稳定在较低温度时对映体互变过程被抑制,而较高温度发生对映体互变。实验中让外消旋混合物先通过一个低温CSP柱子,将先洗脱出来的组分(A)继续通人第二个高温CSP柱子,收集后洗脱组分(B)。(A)进入第二个柱子后停留足够长时间达到对映体互变平衡,再继续洗脱,得到(A)和(B)。如果进行多次循环平衡、过柱,则可得到纯的对映体(B)。如Lorenz等用DHPLC分离一螺环化合物,该化合物可通过螺环处的C—O 键开环和闭环进行对映体互变。将它依次通过0℃和40℃ 的两根Chiralcel OD柱,平衡2h,即可得到32% ee(enantiomerie excess,ee)的(+)一对映体。4 模拟移动床色谱(SMB) 至今批次处理色谱在应用中仍占主导地位,但大规模制备需要大量CSP。CSP价格昂贵,而且产品的浓度低,洗脱液消耗量大,难以回收。SMB可以节省90% 的流动相并得到更高的产率。在批次处理色谱中被分离组分在流动相的驱动力下移动,固定相只有一小部分起作用。在移动床色谱中,不仅流动相发生移动,固定相也要向相反方向移动,易洗脱的化合物(萃余液)随流动相移动,难洗脱的化合物(萃取液)随固定相移动。整个固定相的分离能力被持续利用,明显地提高了系统产率。但就技术而言很难移动固定相,因此采用模拟方式,SMB的环状柱子实际上是用许多小柱依次连接而成,有规律地改变进样口和出样口,可以达到和固定相移动相同的效果。SMB技术起于20世纪60年代UOP(Universal Oil Products,Des Plaines,IL,USA)从C8 中分离对二甲苯,后来该技术被广泛用于制药工业,以获得光学纯药物。其中应用于SMB的CSP约有70%是多糖类CSP。如Nagamatsu等用SMB方法替代以前的非对映体结晶的方法,用稍做改性的Chiralcel OF(cellulose 4-chlorophenyl carbamate)分离了一种制药工业的中间体喹啉甲瓦龙酸酯。Francotte等的研究还发现,SMB对于难溶的化合物,如formoterol尤为有用。而且可调节不同参数如进样率和萃取率来达到最佳纯度和产率。
用蒽酮比色法测胞外多糖,显色该是绿色的。可是我做的生化水样测胞外多糖显色发黄发棕是怎么回事?水样显黄色不深但是加完硫酸之后一下子变得很深的棕色。
请问多糖的含量可以用高效液相色谱来测定吗?现在的方法大多用紫外可见分光光度法来检测的。