
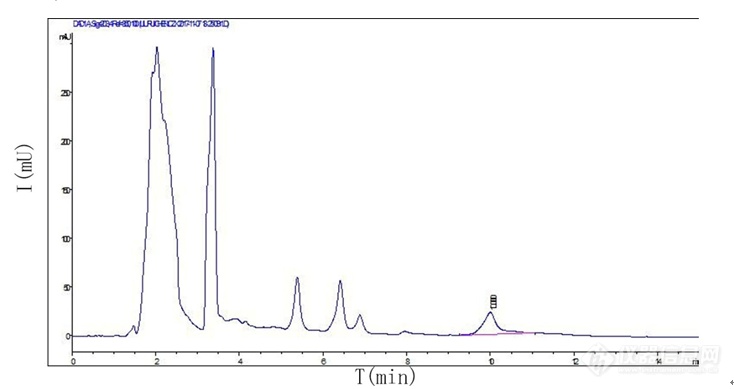
【作者】 刘近荣;【机构】 山西泰盛制药有限公司;【摘要】 目的建立以高效液相色谱法测定黄芪总皂苷氯化钠注射液中黄芪甲苷含量的方法。方法色谱柱为DiamonsilC18(5μm,4.6×250mm),流动相为乙腈-水(36:64),流速为0.8ml/min,柱温为室温。结果黄芪甲苷进样量在5μg~40μg范围内与峰面积积分值线性关系良好(r=0.9993,n=5),平均加样回收率为99.75%(RSD=0.57%)。结论本方法测定结果准确、操作简便、灵敏度高、重复性好,可用于本品的质量控制。 更多还原http://ng1.17img.cn/bbsfiles/images/2012/08/201208131255_383443_2379123_3.jpg
[align=center][b]HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定黄芪醇提物中的黄芪甲苷的含量[/b][/align][b]黄芪甲苷是黄芪皂苷提取物中的特征性成分,也是具有代表性的主要成分,黄芪甲苷可以促进患者心肌细胞的供氧能力,使冠状动脉供血区供血充足,避免因缺血导致的大范围心肌坏死,继而缓解患者心绞痛症状,平稳心跳速率[sup][/sup]。药典中有关于黄芪药材中黄芪甲苷含量的测定方法,但此方法并不完全适用于黄芪醇提物中的黄芪甲苷的含量测定,而且黄芪水提物与黄芪醇提物中化学成分有差异,预实验中发现测定黄芪水提物中黄芪甲苷含量建立的方法也不适应于黄芪醇提物中中黄芪甲苷含量的测定。本章实验利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用仪[/color][/url]建立黄芪醇提物中黄芪甲苷含量测定方法,并利用该方法测定其含量,计算出黄芪甲苷的转移率,用于黄芪醇提最佳提取工艺的优选。同时,本章实验系统地验证所建立的方法的可行性,为选择黄芪甲苷的含量测定方法提供参考。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪醇提物样品,所有黄芪药材均由济宁华能制药厂提供。[b]1.2 试剂 [/b]黄芪甲苷对照品(成都瑞芬思生物科技有限公司批号H-013-170117);乙腈为色谱纯(赛默飞世尔科技有限公司);D101大孔吸附树脂(廊坊淼阳化工有限公司生产20160310);盐酸溶液(国药集团化学试剂有限公司生产);氢氧化钠溶液(国药集团化学试剂有限公司生产20160824);超纯水。[b]1.3 仪器 [/b]液相色谱仪系统(美国Agligent Technology 公司1260型液相色谱仪,包括G1312B二元泵,G1322A在线脱气机,G1316A柱温箱);NASCA F5100型自动进样器(日本SHISEIDO公司);资生堂CAPCELL PAC CN 色谱柱(2.0*150 mm,5 mm,日本SHISEIDO公司);API 4000型三重四级杆串联离子肼质谱仪(美国Applicated Biosystem Scuex公司)。[b]2 方法学考察2.1 色谱条件[/b]色谱柱为 Synergi C18 80A(250 mm×4.6 mm,4 μm),以十八烷基硅烷键合硅胶为填充剂,以乙腈-水(35 : 65)进行等度洗脱;进样量10 μL;检测波长为203 nm;柱温30 ℃,流速为1 mL/min。黄芪甲苷保留时间约为10 min。黄芪醇提物和黄芪甲苷标准品HPLC色谱图见表5-1,表5-2。[/b][align=center][img=,690,365]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711071808_2711_3237657_3.png!w690x365.jpg[/img][/align][align=center]图5-1 黄芪醇提物HPLC色谱图[/align][align=center][img=,690,373]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711240945_4181_3237657_3.png!w690x373.jpg[/img][/align][align=center]图5-2 黄芪甲苷标准品HPLC色谱图[/align][b]2.2 质谱条件 [/b]电喷雾电离,正离子模式(喷雾电压:4.5 kV);鞘气压力:30 arb;辅助气压力:10 arb;离子传输管温度:550 ℃;扫描模式:全扫描;扫描范围:m/z 100-1000。按“2.1.3”项下色谱条件进样,进样量10 μL。为进一步验证10 min出峰的物质是黄芪甲苷,利用LC/MS技术对黄芪皂苷提取物的化学成分进行研究,采用正离子源ESI检测。黄芪甲苷分子量784.97 Da,由于仪器差异,黄芪甲苷出峰时间后移至12.5 min,此峰的鉴定结果质谱图显示含大量黄芪甲苷。图5-3为黄芪皂苷提取物的正离子模式HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]总离子流图、分离子流图和质谱图。[align=center][img=,690,426]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711415732_2681_3237657_3.png!w690x426.jpg[/img][/align][align=center]图5-3 黄芪甲苷正离子模式HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] 总离子流图、分离子流图和质谱图[/align][b]2.3 供试品溶液的制备[/b]对D101大孔吸附树脂预处理:第一步用乙醇或甲醇清洗吸附柱内壁,向柱内加入称量好的树脂体积0.4-0.5倍的乙醇或甲醇,然后将新的D101大孔吸附树脂投入吸附柱中,使乙醇液面高于D101大孔吸附树脂层0.5 m,浸泡过夜。用2 个柱体积的乙醇或甲醇通过D101大孔吸附树脂层,用乙醇缓慢浸泡D101大孔吸附4-5 h,观察洗脱液加水后不呈白色浑浊为止。再用蒸馏水以2 BV洗柱,洗至洗脱液呈中性。用2 BV的5 %盐酸溶液以4-6 BV/h过柱,浸泡2-4 h。用蒸馏水以2 BV/h洗至洗脱液呈中性。用2 BV的2 %氢氧化钠溶液以4-6 BV/h过柱,浸泡2-4 h。最后用蒸馏水洗D101大孔吸附树脂,洗至洗脱液显中性即可。上样:取黄芪醇提物加水溶解至15 mL得黄芪提取液,以1 mL/min过树脂,先以4 BV蒸馏水洗脱,弃去水液,再用4 BV的70 %乙醇溶液洗脱,用烧杯收集吸附柱内的洗脱液,转入蒸发皿,水浴蒸干后,用甲醇溶解并转移至10 mL容量瓶定容。[b]2.4 对照品溶液的制备[/b]用万分之一天平精密称取10.1 mg黄芪甲苷对照品至10 mL容量瓶,加甲醇定容,得1.01mg/mL的对照品溶液,用0.22μm的微孔滤膜过滤,备用。[b]3 结果3.1 线性关系考察[/b]精密量取黄芪甲苷标准品10.1 mg黄芪甲苷,用甲醇10 mL制备成1.01 mg/mL黄芪甲苷储备液,然后吸取相应体积稀释成浓度梯度为150 μg/mL、250 μg/mL、300 μg/mL、400 μg/mL 、500 μg/mL的对照品溶液,上述对照品溶液按“2.3”项下色谱条件分别进样10 μL,利用自动积分功能测定峰面积积分值,以黄芪皂苷提取物中黄芪甲苷的峰面积积分值对标准品浓度进行线性回归,所得回归方程为y = 2821.6x + 12.438(回归系数[i]R[sup]2[/sup][/i]= 0.9989),证明蒙古黄芪中黄芪甲苷在150~500 μg/mL范围内线性关系良好,黄芪甲苷对照品标准曲线如图5-4所示。[align=center][img=,542,346]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711574358_4557_3237657_3.png!w542x346.jpg[/img][/align][align=center]图5-4 黄芪甲苷标准曲线[/align][b]3.2 精密度试验[/b]在拟定分析条件下,精密吸取供试品溶液10 μL,连续进样 6 次,记录提取离子流图峰面积,测定黄芪甲苷量,计算得相对标准偏差RSD为1.9% ,提示该方法具有较好的精密度。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按2. 2 项下方法制备供试品溶液,在拟定分析条件下,准确吸取10 μl 进样分析,测定黄芪甲苷量,计算得 RSD为2.0%,提示该方法重复性良好。[b]3.4 稳定性试验[/b]取黄芪药材供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,在拟定分析条件下,准确吸取10 μl 进样分析,测定黄芪甲苷量,计算得RSD为 4.4% ,提示黄芪供试品溶液稳定性较差。[b]3.5 加样回收率试验[/b]精密称取 6 份黄芪甲苷量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入浓度为 0. 0 342 mg /ml 黄芪甲苷溶液1 ml,1 ml,2ml,2ml,3ml,3ml,按 2. 2 项下方法制备供试品溶液,准确吸取 1. 0 μl 进样分析,测定黄芪甲苷量,计算回收率,结果见表3-1。由表3-1可见,方法平均回收率为 97.92%,表明该方法具有较好的回收率。[align=center]表5-1 黄芪甲苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]0.96 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]97.92 [/align] [/td][td=1,6] [align=center]97.92 [/align] [/td][td=1,6] [align=center]0.7 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]0.96 [/align] [/td][td] [align=center]2.89 [/align] [/td][td] [align=center]98.96 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]1.92 [/align] [/td][td] [align=center]3.83 [/align] [/td][td] [align=center]98.44 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]1.92 [/align] [/td][td] [align=center]3.81 [/align] [/td][td] [align=center]97.40 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]4.76 [/align] [/td][td] [align=center]97.92 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]4.73 [/align] [/td][td] [align=center]96.88 [/align] [/td][/tr][/table][b]3.6 黄芪甲苷的含量测定结果[/b]取9组黄芪水提物按照“2.3”项下操作,制备供试品溶液,准确吸取 1 0 μL 进样分析,在拟定的分析条件下,测定黄芪甲苷峰面积积分值,计算相应的黄芪甲苷含量。9组蒙古黄芪中黄芪甲苷含量测定结果如表5-2所示。[align=center]表5-2 9组蒙古黄芪中黄芪甲苷含量测定结果[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]560.07 [/align] [/td][td] [align=center]0.13 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]501.70 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]564.61 [/align] [/td][td] [align=center]0.13 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]507.19 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]524.05 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]477.02 [/align] [/td][td] [align=center]0.11 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]921.07 [/align] [/td][td] [align=center]0.21 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]783.88 [/align] [/td][td] [align=center]0.18 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]924.71 [/align] [/td][td] [align=center]0.22 [/align] [/td][/tr][/table][b]3.7 黄芪甲苷转移率正交试验设计及结果[/b]醇提的黄芪甲苷转移率考察正交试验与醇提的出膏率考察正交试验设计相同,首先以乙醇作为提取溶剂,把影响药材提取效果的提取溶剂乙醇用量(A)、提取次数(B)、提取时间(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表5-3。[align=center]表5-3 实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(乙醇用量/倍)[/align] [/td][td] [align=center]B(提取次数/次)[/align] [/td][td] [align=center]C(提取时间/h)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table]黄芪甲苷转移率=各实验组黄芪提取物中黄芪甲苷含量/原黄芪药材中黄芪甲苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.4042mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表5-4,5-5。[align=center]表5-4 黄芪甲苷转移率考察 L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]32.01 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]28.60 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]32.28 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]28.92 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]29.91 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]27.16 [/align] [/td][/tr][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]53.11 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]45.09 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]53.33 [/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]92.89[/align] [/td][td] [align=center]114.04[/align] [/td][td] [align=center]104.26[/align] [/td][td] [align=center]115.25[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]85.99[/align] [/td][td] [align=center]103.60[/align] [/td][td] [align=center]110.85[/align] [/td][td] [align=center]108.87[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]151.53[/align] [/td][td] [align=center]112.77[/align] [/td][td] [align=center]115.30[/align] [/td][td] [align=center]106.29[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]65.54[/align] [/td][td] [align=center]9.17[/align] [/td][td] [align=center]11.04[/align] [/td][td] [align=center]8.96[/align] [/td][td] [align=center] [/align] [/td][/tr][/table][align=center]表5-5 黄芪甲苷转移率考察方差分析结果[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]864.64[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]46.01[/align] [/td][td] [align=center]*[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]21.63[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.07[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]20.57[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.07[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]D [/align] [/td][td] [align=center]14.18[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知:醇提实验中,各因素对黄芪甲苷转移率的影响大小顺序为:A(乙醇用量)B(提取次数)C(提取时间);每个因素3水平之间的趋势为A[sub]3[/sub]A[sub]1[/sub]A[sub]2[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]3[/sub]C[sub]2[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]3[/sub]B[sub]1[/sub]C[sub]3[/sub],即加醇10倍量,提取1次,每次3h。表5-5的方差分析结果表明: A因素的影响具有统计学差异(PB(提取次数)C(提取时间);每个因素3水平之间的趋势为A[sub]3[/sub]A[sub]1[/sub]A[sub]2[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]3[/sub]C[sub]2[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]3[/sub]B[sub]1[/sub]C[sub]3[/sub],即加醇10倍量,提取1次,每次3h。表5-7的方差分析结果表明: A因素的影响具有统计学差异(P0.05),即乙醇用量对黄芪甲苷转移率具有显著影响。[b]4 讨论[/b]本章实验利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]技术,测定了黄芪醇提物中黄芪甲苷的含量,并系统地验证所建立的方法的可行性,经过试验条件的摸索,黄芪甲苷的色谱条件为35 %乙腈洗脱,所建立的方法能够较好的将黄芪甲苷与其他成分分开,可用于黄芪皂苷中黄芪甲苷含量测定,黄芪甲苷稳定性试验结果RSD值高于2 %,可能是由于黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在酸性水解的条件下易转化成黄芪皂苷Ⅳ,即黄芪甲苷,使黄芪水提物中黄芪甲苷在48h内的稳定性不好。根据三个因素水平趋势可知,随着乙醇的用量增加,黄芪甲苷的提取效率越来越高,实验设置中每次10倍量是最大乙醇用量,这是从大工业生产和节能降耗等方面考虑的结果。根据煎煮次数水平趋势,提取1次的黄芪甲苷转移率最大,这有可能是因为黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在酸性水解的条件下易转化成黄芪皂苷Ⅳ,即黄芪甲苷,而黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在第一次就较完全的被提取出来,随着时间增加,转换成黄芪皂苷Ⅳ,即黄芪甲苷,第二次时黄芪皂苷Ⅰ或黄芪皂苷Ⅱ的结构可能被破坏,影响其转化成黄芪甲苷。第三次时可能黄芪甲苷被提取的更彻底,转移率又开始小幅增大。在3h内,当提取时间增加,黄芪甲苷会逐渐增大,原因可能是黄芪甲苷的提取更加彻底,黄芪皂苷Ⅰ或黄芪皂苷Ⅱ转化成黄芪甲苷最多。实验设置中每次3h是最大提取时间,这也是从综合成本与效率的角度考虑的结果。因此,综合考虑,将加醇10倍量,提取1次,共3h作为最佳醇提实验工艺。由黄芪甲苷转移率结合出膏率的到的综合评分的结果可以看出,不同提取工艺对黄芪醇提物中黄芪甲苷的含量和出膏率的影响不同,其中7、8、9组评分较高,三个组的黄芪甲苷转移率相较于其他组也是最高,但第8组出膏率却相对较低,另外出膏率高低的顺序也不与黄芪醇提物中黄芪甲苷的转移率高低的顺序项一致,这说明出膏率与黄芪醇提物中黄芪甲苷的转移率并无明显的对应关系。[align=center]参考文献[/align] 朱燕辉, 严奉祥. 黄芪甲苷及其生物学活性.现代生物医学进展,2008, 8 ( 4 ) : 781-783.
想问问各位你们都是用什么测黄芪甲苷的,用什么牌子的仪器,感觉怎么样?国家对测黄芪甲苷的仪器有什么灵敏度或者是其他方面的规定吗?我们公司想买蒸发光散射检测器来测黄芪甲苷,大家觉得哪个好些?老板的心理价位就8-10万吧,谢谢各位[em58]
黄芪饮片按照中国药典2015年版方法测定黄芪甲苷液相图谱为2个峰,用含黄芪的超微粉制成的颗粒,测定其黄芪甲苷,液相图谱为1个峰,为什么?颗粒不只含有黄芪,含有其他成分,求解答,谢谢
黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定摘要:建立黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定方法。方法:用高效液相色谱法测定黄芪甲苷的含量,用碘量法测定黄芪多糖的含量。结果:黄芪甲苷和黄芪多糖的平均回收率分别为9751%、9918%,相对标准差分别为248%、191%。结论:本文建立的方法准确可靠、灵敏度高、重现性好,可作为黄芪静脉输[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量控制的有效方法。关键词:黄芪甲苷;黄芪多糖;高效液相色谱法;碘量法; 英文摘要:ToestablishthemethodfordeterminationofastragalosideIVandastragaluspolysaccharidesinRadixAstragaliinjectionMETHODS:AstragalosidewasdeterminedbyHPLCandastragaluspolysaccharidesbyiodometryRESULTS:Therecoveriesofastragalosideandastragaluspolysaccharideswere9751%RSD=248%and9918%(RSD=191%)respectivelyCONCLUSION:Thismethodisaccurate,sensitiveandrepeatable,andcanbeusedforqualitycontrolofthepreparation英文关键词:astragaloside;astragaluspolysaccharide;HPLC;iodometry;contentdetermination黄芪为补气药,性甘温,归肺、脾经,具有补气固表、利尿托毒、排脓、敛疮生肌之功效。医疗实践证明,黄芪注射液对心气虚损、血脉瘀阻、病毒性心肌炎、心功能不全、脾虚困湿之肝炎有较好的疗效,也是肿瘤、免疫功能低下等较理想的辅助治疗药物。目前临床所使用的黄芪注射液为小容量针剂,需稀释后滴注,且不含黄芪多糖,所以疗效不够理想。为此,武警四川总队乐山医院和四川省乐山市三民药物研究所共同研制了含黄芪多糖、黄酮、苷类等有效成分的黄芪静脉输液。黄芪注射液的含量检测尽管WS3-β-3335-98执行标准仅要求采用薄层色谱法,但因高效液相色谱法操作更简便,精密度更高,故笔者参照文献以蒸发光散色高效液相色谱法[1]测定黄芪静脉输液中的黄芪甲苷含量;至于黄芪多糖含量的检测则选择采用碘量法。1仪器与试药11仪器美国奥泰公司高效液相色谱仪,包括蒸发光散射(ELSD)500检测器、Alltech426主机泵;电动离心机(江苏金坛公司);TP-150超声波清洗机(北京天鹏公司)。12试药黄芪甲苷对照品(中国药品生物制品检定所,批号:0781-9908);甲醇、乙醇、正丁醇、氢氧化钠、硫酸、葡萄糖均为分析纯;乙腈为色谱纯;水为重蒸馏水。2方法和结果21黄芪甲苷含量的测定211色谱条件:色谱柱为ODS柱(250mm×40mm),柱温为40℃,流动相为乙腈-水(36∶64),流速为06ml/min,进样量为20μl。212漂移管温度选择:根据ELDS检测使用手册推荐,设置气体流速为300slpm,漂移管温度为75℃,观察流动相(不进样)进入检测器的基线噪音,不断改变漂移管温度(步长为5℃),根据基线随温度的变化情况,选择95℃为试验最优温度。213载气流速选择:设定漂移管温度为95℃,取黄芪甲苷对照液恒量,得相应峰面积,不断改变气体流速(步长为025slpm)观察峰面积和基线的变化情况,最终选择270slpm为试验最优载气流速。214最低检测限试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为1mg/ml的溶液作为贮备液,精密量取适量,逐步稀释测定,直到黄芪甲苷主峰信号为检测器噪声水平的3倍为止。得黄芪甲苷最低检测限为153ng。215线性试验:取“214”项黄芪甲苷对照品贮备液适量,精密量取10、20、30、40、50、60分别置于10ml容量瓶中,加甲醇稀释至刻度(约相当于黄芪甲苷01、02、03、04、05、06mg)。以对照品峰面积的常用对数值为横坐标(X),以进样量的常用对数值(Y)为纵坐标进行线性回归,得回归方程为Y=06001X—34896(r=09991),黄芪甲苷进样量在20μg~120μg范围内线性关系良好。216精密度试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释至浓度为025mg/ml的溶液作为对照溶液,注入液相色谱仪,连续重复进样6次,测得黄芪甲苷的相对标准差为179%,精密度符合规定。217重现性试验:精密量取黄芪注射液适量(相当于黄芪甲苷约20mg)5份,按“2110”项下方法制备,测定黄芪甲苷含量。结果黄芪注射液中黄芪甲苷为2390mg,RSD=201%,表明方法重现性良好。218稳定性试验:取“217”项下样品溶液,分别于0、1、2、3、5、8h取样测定峰面积,结果RSD=107%,表明黄芪甲苷溶液在8h内基本稳定。219回收率试验:分别精密量取黄芪注射液适量(约相当于黄芪甲苷10、12、14mg)共3份,每份各精密加入对照溶液(0404mg/ml)25、30、35ml,按“2110”项下方法制备,测定黄芪甲苷含量,结果详见表1。由表1可见,平均回收率为9751%,RSD=248%,符合规定,说明方法具有可行性。2110样品中黄芪甲苷的含量测定:精密量取黄芪注射液100ml,置于烧杯中浓缩至10ml,加无水乙醇40ml沉淀,放置20min,离心,沉淀用80%的乙醇溶液洗涤2次,每次10ml,合并离心液与洗涤液,置水浴上蒸干。残渣加1%NaOH溶液10ml溶解,用饱和的正丁醇水溶液提取3次,每次20ml,合并正丁醇的水溶液,蒸干,残渣再加1%NaOH溶液5ml溶解,通过已处理的D101大孔吸附树脂柱(Φ15×20cm,内装树脂高约10cm)吸附,以1%NaOH溶液50ml洗脱,弃去,用蒸馏水洗至中性,再用30%乙醇溶液50ml洗脱,弃去洗脱液,继续用70%乙醇液50ml洗脱,收集洗脱液并蒸干,残渣加甲醇溶解并定容至10ml,得供试品溶液。精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为01、03mg/ml的溶液作为对照溶液。分别精密量取上述溶液各20μl注入液相色谱仪,记录色谱图,并以峰面积和进样量的对数值按二点法计算,详见图1;3批样品按上述方法制备测定,结果详见表2。22黄芪多糖含量的测定[2,3]221线性试验:精密称取105℃干燥至恒重的葡萄糖适量,加水溶解并稀释成浓度为10mg/ml的标准溶液,分别精密量取此标准溶液100、90、80、70、60ml,置于250ml碘量瓶中,分别加水0、10、20、30、40ml,然后精密加入01mol/L碘滴定液25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,在暗处放置10min,然后加入05mol/LH2SO4液6ml,摇匀,立即用01mol/LNa2S2O3滴定液滴定,近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正。以取样量(X)与Na2S2O3的消耗量(Y)进行线性回归,得回归方程为Y=009766X—000244,(r=09999),表明葡萄糖在60mg~100mg的范围内线性关系良好。222重现性试验:精密量取黄芪注射液100ml,按“224”项下方法制备5份,测定黄芪多糖含量,结果为10423mg,RSD=099%,表明方法重现性良好。223回收率试验:分别精密量取黄芪注射液(多糖含量为10423mg/100ml)120、150、180ml,每份各加入葡萄糖标准液(25002mg/ml)50、60、70ml制成80%、100%、120%浓度的溶液。分别浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,弃去离心液与洗涤液,沉淀加热蒸馏水10ml溶解,并转移至25ml容量瓶中,定容,摇匀。分别精密量取3种不同浓度的溶液80、70、60ml置于250ml碘量瓶中,分别精密加水2、3、4ml,按“224”项方法测定,每个浓度测定3次,共9次,计算得到回收率为9918%,RSD=191%,详见表3。224样品中黄芪多糖的含量测定:精密量取黄芪注射液100ml,浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,加热蒸馏水3ml使沉淀溶解并定容至10ml,摇匀。移置于250ml碘量瓶中,加入1mol/LH2SO420ml,置于水浴中水解2h,取出,放冷,加入2mol/LNaOH溶液调节pH值=7,冷却至室温。精密加入碘滴定液(01mol/L)25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,置暗处放置10min。然后加入05mol/LH2SO46ml,摇匀,立即用Na2S2O3滴定液(01mol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正,计算即得(每1ml上述碘滴定液相当于9008mg的C6H12O6)。3批黄芪注射液样品,按上述方法测定多糖含量均符合规定,结果详见表4。3讨论测定黄芪甲苷含量时,如将精密量取的黄芪注射液浓缩后仅采用正丁醇的水饱合液提取制得供试品溶液,则所得的样品杂质峰多,基线略有漂移,因此不宜采用。黄芪多糖主要为葡萄糖,因此,可采用以葡萄糖或葡聚糖作对照品的苯酚-浓硫酸法[4]、蒽酮-浓硫酸法[5]或水解后用碘量法等测定其含量,但一般多采用后两种方法。采用蒽酮-浓硫酸法时,由于其线性试验回归方程为C=98481A+08314(r=09663),浓度线性范围为35~165μg/ml,线性关系不好,故不宜采用。
检测黄芪药材中的黄芪甲苷,用elsd检测器,c18柱,雾化管30 漂移管70 药典方法乙腈比水32比68 对照品塔板数11000,但是样品塔板数才2800,含量合格,要求塔板数是4000这是怎么回事,重做了好多次塔板数就是上不去
[align=center][b]UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定黄芪水提物中的黄芪甲苷含量[/b][/align][b] 传统中药的煎煮,大多是用水作为溶剂,因此研究药材的水提物中有效成分的含量对药材的工业生产和实际应用具有不可忽视的指导意义。据文献报道[sup][/sup],黄芪水提物中主要为糖类和皂苷类成分,而水提物药渣中则是提取后剩余的淀粉、纤维素、木质素等原药材的基体成分和一些不易溶于水的酯类、酮类和芳香类成分。黄芪甲苷作为黄芪皂苷中一类重要的物质,已被药典收录为黄芪含量测定的指标成分。为了保证临床应用制剂的质量和进一步开发利用中药黄芪,研究黄芪水提物中黄芪甲苷的含量显得格外重要。在预实验中,笔者发现药典中测定黄芪中黄芪甲苷含量的方法并不完全适用于黄芪水提物中黄芪甲苷含量的测定,预处理时出现乳化现象导致萃取不完全,另外利用药典中规定的蒸发光检测器液相色谱仪测定无法得到理想的线性方程。因此,笔者结合黄芪水提物的性质和仪器灵敏性等特点,利用UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法考察黄芪水提物中的黄芪甲苷含量测定的方法学和并利用该方法测定黄芪水提物中黄芪甲苷的含量。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪水提取物样品,黄芪饮片为济南济成堂中药饮片有限公司提供(批号18033101)。[b]1.2 试剂 [/b]黄芪甲苷对照品(成都瑞芬思生物科技有限公司批号H-013-170117),乙腈为色谱纯(天津市科密欧化学试剂有限公司);超纯水。[b]1.3 仪器 [/b]Waters XevoTQ-S三重四级杆质谱仪(美国Waters公司)。ACQUITY UPLC H-CLass超高效液相色谱仪(美国Waters公司);超声波清洗机KS-300E(宁波科生仪器厂);电子天平MS205DU(梅特勒/瑞士)。[b]2 方法学考察2.1 色谱与质谱条件[/b]色谱条件:色谱柱为ACQUITY UPLC BEH C18柱(2.1*50 mm,1.7 mm)。流动相为乙腈-水(A∶B)系统。梯度洗脱,A相:0→1 min A保持30%;1→2 min A为30→60%;2→3 min A为60→70%;3→4 min A保持70%;4→4.5 min A为70→30%;A相:4.5→5.5 min A保持30%。流速 0. 2 mL/min,柱温为40 ℃,进样体积 1. 0 μL。质谱条件:电喷雾正离子检测模式,毛细管电压;3.0 kV;脱溶剂气流:N2,流速800 L h[sup]-1[/sup],脱溶剂温度400 ℃;锥孔电压:40 V,锥孔气流:N2,流速150 Lh[sup]-1[/sup];离子源温度: 400 ℃;雾化气压力为7.0 bar碰撞气体: 氩气。采用MRM 定量模式,质量扫描范围为100~1 000 amu。该条件下,获得黄芪甲苷的分子离子峰 m /z 785. 42,子离子峰m /z 143.08。黄芪甲苷提取总离子流图和一级质谱图分别见图3-1和图3-2。[/b][align=center][img=,690,322]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131701299261_9069_3237657_3.png!w690x322.jpg[/img][/align][align=center]图3-1 黄芪甲苷的总离子流图[/align][align=center][img=,690,331]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131701493040_8991_3237657_3.png!w690x331.jpg[/img][/align][align=center]图3-2 黄芪甲苷的一级质谱图[/align][b]2.2 供试品溶液的制备[/b]精密称定1/200重量的黄芪水提物样品(折合黄芪药材0.5g)置于锥形瓶中,精密加入4%氨水溶液100 mL,称定重量,超声30 min,取出放至室温,用4%氨水溶液补足减失的重量,摇匀,过滤,精密吸取续滤液10 mL过Dikma ProElut C18-U-SPE柱(先以甲醇20 mL活化,再以水20 mL平衡),上样后用10 mL水淋洗,弃去,再用适量甲醇洗脱,收集洗脱液,定容至10 mL容量瓶中,摇匀,用0.22 μm的微孔滤膜过滤,即得。[b]2.3 对照品储备溶液的制备[/b]精密称取黄芪甲苷标品1.01mg至10 mL容量瓶中,用甲醇溶解后定容,吸取1 mL至100 mL容量瓶中,用甲醇定容,制成浓度为1.01 μg/mL的对照品储备溶液。[b]3 结果3.1 线性关系考察[/b]精密吸取 2. 3 项下对照品储备溶液 1,3,5 mL,用甲醇稀释并定容到 10mL 容量瓶中,制备0.1,0.3,0.5 mgmL[sup]-1[/sup]质量浓度对照品溶液。另吸取0.1,0.3 mg/mL质量浓度对照品溶液5 mL至10 mL容量瓶,用甲醇定容,得到0.05,0.15 mg/mL质量浓度对照品溶液。在拟定分析条件下,准确吸取 10. 0 μL 进样分析。黄芪甲苷离子选择 m/z 785. 42 为母离子,143.08 为子离子,准确吸取1 0 μL 进样分析。以质量浓度为横坐标,以提取离子流图峰面积为纵坐标进行线性回归,如图3,得回归方程为:Y=46.135X + 1938.8(r[sup]2[/sup]= 0. 9984),提示黄芪甲苷在0. 05~0.5 mg/m L 范围内线性关系良好。黄芪甲苷对照品标准曲线如图3-3所示。[align=center][img=,690,423]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131702057366_9110_3237657_3.png!w690x423.jpg[/img][/align][align=center]图3-3 黄芪甲苷标准曲线[/align][b]3.2 精密度实验[/b]在拟定分析条件下,精密吸取供试品溶液1.0 μL,连续进样 6 次,记录提取离子流图峰面积,测定黄芪甲苷量,计算得相对标准偏差RSD为1.1% ,提示该方法具有较好的精密度。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按2. 2 项下方法制备供试品溶液,在拟定分析条件下,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷量,计算得 RSD为2.0%,提示该方法重复性良好。[b]3.4 稳定性实验[/b]取黄芪药材供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,在拟定分析条件下,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷量,计算得 RSD 为 4.7% ,提示黄芪供试品溶液稳定性较差。[b]3.5 加样回收率实验[/b]精密称取 6 份黄芪甲苷量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入浓度为 0. 0 342 mg /mL 黄芪甲苷溶液1 ml,1 ml,2 ml,2 ml,3 ml,3 ml,按 “2. 2 ”项下方法制备供试品溶液,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷量,计算回收率,结果见表3-1。由表3-1可见,方法平均回收率为 102.35% ,表明该方法具有较好的回收率。[align=center] [/align][align=center]表3-1 黄芪甲苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.034[/align] [/td][td] [align=center]0.1[/align] [/td][td] [align=center]101.68[/align] [/td][td=1,6] [align=center]102.35[/align] [/td][td=1,6] [align=center]2.8[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.034[/align] [/td][td] [align=center]0.11[/align] [/td][td] [align=center]104.44[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.068[/align] [/td][td] [align=center]0.14[/align] [/td][td] [align=center]104.17[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.068[/align] [/td][td] [align=center]0.13[/align] [/td][td] [align=center]96.42[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.10 [/align] [/td][td] [align=center]0.17[/align] [/td][td] [align=center]102.78[/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]0.069[/align] [/td][td] [align=center]0.10 [/align] [/td][td] [align=center]0.18[/align] [/td][td] [align=center]104.63[/align] [/td][/tr][/table][align=center] [/align][b]3.6 黄芪甲苷的含量测定结果[/b]取9组黄芪水提物按照“2.2”项下操作,制备供试品溶液,准确吸取 1. 0 μL 进样分析,测定黄芪甲苷的含量。黄芪甲苷对照品和黄芪水提物样品的MRM 离子流图见图3-4、图3-5。供试品黄芪甲苷含量测定结果见表3-2。[align=center][img=,690,348]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131702286759_7988_3237657_3.png!w690x348.jpg[/img][/align][align=center]图3-4 黄芪甲苷对照品的 MRM 离子流图[/align][align=center][img=,690,344]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131702391650_7279_3237657_3.png!w690x344.jpg[/img][/align][align=center]图3-5 黄芪水提物样品的 MRM 离子流图[/align][align=center] [/align][align=center]表3-2 9组黄芪水提物中黄芪甲苷含量测定结果[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]5120.00 [/align] [/td][td] [align=center]0.14 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]6744.00 [/align] [/td][td] [align=center]0.21 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10275.67 [/align] [/td][td] [align=center]0.36 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]26955.00 [/align] [/td][td] [align=center]1.08 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]10599.00 [/align] [/td][td] [align=center]0.38 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]7212.33 [/align] [/td][td] [align=center]0.23 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]11247.33 [/align] [/td][td] [align=center]0.40 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]8008.33 [/align] [/td][td] [align=center]0.26 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]9171.00 [/align] [/td][td] [align=center]0.31 [/align] [/td][/tr][/table][align=center] [/align][b]3.7 正交试验设计及结果[/b]水提的黄芪甲苷转移率考察正交试验与水提的出膏率考察正交试验设计相同,即以水作为提取溶剂,把影响药材提取效果的用水量(A)、提取时间(B)、提取次数(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表3-3。[align=center]表3-3水提实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(用水量/倍)[/align] [/td][td] [align=center]B(提取时间/h)[/align] [/td][td] [align=center]C(提取次数/次)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table][b] [/b]黄芪甲苷转移率=各实验组黄芪提取物中黄芪甲苷含量/原黄芪药材中黄芪甲苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.4042mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表3-4,表3-5。[align=center]表3-4 黄芪甲苷转移率考察L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]34.12 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]51.54 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]89.41 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]268.30 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]92.88 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]56.56 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]99.83 [/align] [/td][/tr][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]65.10 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]77.56 [/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]175.07 [/align] [/td][td] [align=center]402.25 [/align] [/td][td] [align=center]155.78 [/align] [/td][td] [align=center]204.56 [/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]417.74 [/align] [/td][td] [align=center]144.42 [/align] [/td][td] [align=center]397.40 [/align] [/td][td] [align=center]207.93 [/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]242.49 [/align] [/td][td] [align=center]223.53 [/align] [/td][td] [align=center]282.12 [/align] [/td][td] [align=center]422.81 [/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]242.67 [/align] [/td][td] [align=center]257.83 [/align] [/td][td] [align=center]241.62 [/align] [/td][td] [align=center]218.25 [/align] [/td][td] [align=center] [/align] [/td][/tr][/table][align=center] [/align][align=center]表3-5 黄芪甲苷转移率考察方差分析结果[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]10460.75[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.13[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]7698.00[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.75[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]9736.83[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.02[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]D[/align] [/td][td] [align=center]10424.20[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知,水提实验中,各因素对黄芪甲苷转移率的影响大小顺序为:A(用水量)C(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]3[/sub]A[sub]1[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]2[/sub]B[sub]1[/sub]C[sub]2[/sub],即加水8倍量,提取2次,每次1h。表3-5的方差分析结果表明: A、B、C三因素对黄芪甲苷转移率的影响都无统计学差异(P0.05)。[b]4 讨论[/b]本章实验利用超高效液相串联三重四级杆质谱仪测定黄芪水提物中黄芪甲苷的含量,相比药典中测定黄芪药材中黄芪甲苷的方法,此方法预处理步骤更少,用时更短,目标峰与其他相邻峰的分离度也更大,适合于黄芪水提物中黄芪甲苷含量的测定。但美中不足的是,供试品的预处理需要过SPE柱,仪器的使用和维护费用更高,实验者在测定样品的含量前需要综合考虑。从测定结果来看,设置的三个因素中,用水量对黄芪甲苷的转移率影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提物中黄芪甲苷的含量无显著性影响。第4、5、7组的黄芪甲苷转移率相比其他组的更高,尤其是第4组测得的黄芪甲苷的含量远高于用药典方法测得的药材中黄芪甲苷的含量,正交实验分析结果也说明加水8倍量,提取2次,每次1h是最佳提取工艺。这一结果与水提实验中第3、4、7组测得的出膏率较高有些差异,第4组实验的出膏率也不算低,但不是最高,而出膏率最高的第3组黄芪甲苷的转移率却不高,这说明出膏率与黄芪水提物中黄芪甲苷的转移率并无明显的对应关系。合乎标准要求的有效成分含量是保证药物疗效稳定可靠的硬性指标,实现有效成分提取的最大化是优化工艺条件的重要目标。本章关于不同提取工艺条件下黄芪甲苷转移率的考察研究,对芪龙胶囊和黄芪配方颗粒工艺的优化具有指导性意义。[align=center]参考文献[/align] 黄冬兰,徐永群,陈小康. 黄芪药材及其水提物的红外光谱分析. 光谱实验室,2012,29(5):2823-2826.
大茴香酸-硫酸荧光体系测定黄芪甲苷刘养清 杜鸣 徐秉玖关键词: 黄芪甲苷; 大茴香酸; 黄芪; 中药复方补阳还五汤; 荧光分光光度法中图分类号: R927.2 R284.1 文献标识码: A 文章编号: 0513-4870(2000)07-0544-03黄芪甲苷(astragaloside)是中药膜荚黄芪Astragalus membranaceus (Fisch.) Bge.和蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao的主要活性成分,有抗炎、降压、镇痛、镇静、升高血浆中cAMP水平、促进小鼠再生肝DNA的含量[1,2]以及促进免疫功能等生理活性。黄芪甲苷的测定方法主要有:紫外分光光度法[3,4]、薄层扫描法[5,6]和HPLC法[7,8]。光度法常用香草醛在浓硫酸作用下与甲苷显色反应,空白值较高,干扰严重;薄层扫描法操作繁琐,准确度相对较差。黄芪甲苷仅在200 nm处有末端吸收,对HPLC法不利。黄芪甲苷的荧光分析尚未见报道。本文首次根据在浓硫酸条件下黄芪甲苷与大茴香酸反应产物具有荧光的特性建立了荧光分光光度法测定黄芪甲苷,方法灵敏度高、选择性好、线性范围宽、检出限低、操作简便。可直接用于黄芪生药、中药复方、黄芪制剂以及含药血清等多种样品的测定,无干扰。材料与方法 仪器 日本岛津RF-540型荧光分光光度计。 试剂 黄芪甲苷对照品(中国药品生物制品检定所提供)配成1.0 mg.mL-1的甲醇溶液。2%大茴香酸的无水乙醇溶液,72%硫酸溶液,85%磷酸溶液。所用试剂均为分析纯。 样品及处理 黄芪口服液(上海福达制药有限公司生产,批号980502)。取口服液1.00 mL,加入无水乙醇2.00 mL,离心分离沉淀,上清液蒸干,用甲醇1 mL溶解,备用。补阳还五汤复方汤剂煎煮3次,合并水煎液,分别用石油醚、氯仿、正丁醇萃取4次,每次萃取剂用量为水煎液体积的一半。合并正丁醇相,总体积为800 mL。取正丁醇萃取液2 mL,蒸干,用甲醇2 mL溶解,备用。含药猪血清样品(北京医科大学药学院生药研究室提供):用补阳还五汤复方浸膏连续3 d喂猪,3 d后取血,分离猪血清,取猪血清50 mL,用正丁醇萃取4次,每次萃取剂用量为原血清体积的一半。得含药血清样品100 mL,取正丁醇萃取液4 mL,蒸干,用甲醇2 mL溶解,备用。黄芪生药样品:按文献[3]方法提取分离,甲醇溶样,备用。结果与讨论1 黄芪甲苷反应产物的激发光谱和发射光谱 取1.0 mg.mL-1黄芪甲苷对照品0.1 mL,于5 mL量瓶中,加入2%大茴香酸溶液0.6 mL、72% H2SO4溶液0.8 mL,于60℃水浴中反应20 min,迅速冷却后,用无水乙醇定容至刻度,摇匀,在荧光分光光度计测荧光光谱黄芪甲苷反应产物最大激发波长Ex=320 nm,最大发射波长Em=387 nm。2 大茴香酸用量的影响 取大茴香酸0.1,0.3,0.5,0.6,0.7,0.9 mL按照分析方法操作,选择大茴香酸最佳用量。结果表明大茴香酸用量0.6 mL较合适(图1)。3 稀释液的选择 准确移取1.0 mg.mL-1黄芪甲苷0.1 mL,按照分析方法操作,体积定容时选无水乙醇、甲醇、冰醋酸和水作稀释液,测得其荧光强度(If)分别为77.6,48.4,35.0,1.3。可见无水乙醇对荧光强度影响最小。本文采用无水乙醇作为稀释液。 Fig 1 Effect of amount of anisic acid4 酸的种类和用量的影响 选72% H2SO4, 85% H3PO4及浓HClO4进行实验,结果发现选用72% H2SO4时反应产物的荧光强度最大。对72%硫酸的用量进行选择,结果表明72% H2SO4取0.8 mL为最佳(图2)。 Fig 2 Effect of amount of sulphuric acid5 反应温度的影响 准确移取1.0 mg.mL-1黄芪甲苷对照品0.1 mL,按分析方法内容操作,分别在40,50,60,70,80,90℃和沸水浴中反应20 min,同时做空白。考察荧光强度随温度的变化,结果表明:60℃时反应空白小,荧光强度较高。故实验选择60℃为反应温度较适宜。6 加热时间的影响 将温度控制在60℃,改变加热时间,考察加热时间对反应的影响。结果表明加热时间选20 min为宜。7 反应产物的稳定性 准确移取1.0 mg.mL-1黄芪甲苷对照品0.1 mL,按照分析方法操作,测定荧光强度值,每间隔5 min测定1次,对产物稳定性进行考察。结果表明反应产物在90 min内均稳定。8 工作曲线及检出限 分别准确移取1.0 mg.mL-1黄芪甲苷对照品0.010,0.025,0.050,0.100,0.150和0.200 mL,在最佳实验条件下,测定工作曲线,得回归方程为:Y=-0.4201+1.575X,γ=0.9993。黄芪甲苷浓度在2.0~40 μg.mL-1与荧光强度呈良好的线性关系。检出限为0.02 μg.mL-1。9 干扰考察 为解决基体太浓或基体不一致所造成的影响,在适当稀释溶液后,采用标准加入法测定样品。为考察此反应选择性,利用薄层分离黄芪甲苷[6]后测定样品中其他物质的荧光强度,证明杂质荧光强度与样品总荧光强度的比1.2%。10 样品的测定与回收率实验 取被测样品6份各0.1 mL,依次加入1.0 mg.mL-1黄芪甲苷对照品0.0,0.01,0.02,0.03,0.04和0.05 mL,按照分析方法操作,分别测定了黄芪、复方补阳还五汤、黄芪口服液及猪血清样品中黄芪甲苷的含量,测定结果及回收率实验见表1。SampleContent/%Recovery/%RSD/%HQOL0.210±0.00298.5~101.91.8BYHWT0.280±0.02098.8~102.12.1AMB0.420±0.00498.6~102.02.0PS0.063±0.00198.8~102.41.9黄芪是补阳还五汤的君药,黄芪甲苷定量分析是黄芪中药制剂质量控制的重要指标,本方法灵敏度高,选择性好,操作简便且无干扰,可作为黄芪甲苷的质控方法。基金项目: 九五攀登计划项目杜鸣(北京医科大学药学院分析化学与药物分析研究室,北京 100083 )徐秉玖(北京医科大学药学院分析化学与药物分析研究室,北京 100083 )刘养清(山西师范大学化学系,山西 临汾 041004)收稿日期: 1999-08-03
使用蒸发光检测器做黄芪甲苷含量不出峰怎么办?使用的液相是伍丰手动的
建立高效液相色谱-蒸发光散射检测器测定黄芪甲苷含量的方法。方法:采用一种新的检测器-蒸发光散射检测器(ELSD)以黄芪甲苷为对照品对黄芪中的黄芪甲苷进行HPLC分析,色谱柱:Phenomenex-ODS;流动相:乙腈-水(37∶63);流速:0.85mL/min;ELSD参数;漂移管温度:100℃;载气流速:2.7L/min。结果:黄芪甲苷在0.396~3.564μg范围内呈线性,回收率为97~94%(RSD=0.68%)。结论:本法具有良好的精密度和重现性,结果准确可靠,可作为原料的质量控制方法。
完全按照药典标准做的三七总皂苷,可是对照品和样品的Re均不出峰,其他几个峰都出得很好
高效液相色谱法测定黄芪中黄芪甲苷含量的计算方法
不同产地百合药材中薯蓣皂苷元及总皂苷元的含量测定 帮忙下载下啦
[align=center][b]HPLC法测定黄芪水提物中的毛蕊异黄酮苷含量[/b][/align][b]黄芪中的主要有效成分除皂苷外就是异黄酮类化合物。异黄酮类成分具有调节免疫、抗肿瘤、抗突变、抗氧化、抗炎、抗突变抗辐射、抗心肌缺血、抗心律失常、抗病毒、抗细胞凋亡、保肝、防止动脉粥样硬化等作用[sup][/sup],其代表成分就是毛蕊异黄酮 7-O-β-D 吡喃葡萄糖苷(即毛蕊异黄酮苷)。2010版药典才开始将毛蕊异黄酮苷收录为黄芪中有效成分含量测定项。本章实验借鉴药典中的测定方法,对不同工艺条件下获得的黄芪水提物中的毛蕊异黄酮苷含量进行考察,以期为优化芪龙胶囊和黄芪配方颗粒中黄芪的提取工艺参数提供科学基础和理论依据。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪水提取物样品,黄芪饮片为济南济成堂中药饮片有限公司提供(批号18033101)。[b]1.2 试剂 [/b]毛蕊异黄酮苷对照品(成都瑞芬思生物科技有限公司批号M-020-170926),乙腈为色谱纯(天津市科密欧化学试剂有限公司);甲酸(天津市科密欧化学试剂有限公司);超纯水。[b]1.3 仪器 [/b]液相色谱系统,包括日本岛津公司LC-20AT型液相色谱仪,LC-20AT岛津输液泵,CTO-20A柱温箱,SIL-20A自动进样器,SPD-20A紫外-可见光检测器;超声波清洗机KS-300E(宁波科生仪器厂);电子天平MS205DU(梅特勒/瑞士)。[b]2 方法学考察2.1 色谱条件及系统适应性试验[/b]DiamonsiL(钻石)C18柱(250*4.6 mm,5 mm)。以乙腈为流动相A,0.2%甲酸溶液为流动相B,梯度洗脱,A相:0→20 min A为20→40%;20→30 min A保持40%;30→40 min A保持20%。检测波长260 nm;流速为1 mL/min;柱温35 ℃进样量为10 μL。毛蕊异黄酮苷对照品溶液以及黄芪水提物样品色谱图见图4-1与图4-2。[/b][align=center][img=,690,365]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706005051_4964_3237657_3.png!w690x365.jpg[/img][/align][align=center]图4-1 毛蕊异黄酮苷对照品色谱图[/align][align=center][img=,690,384]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706118782_6652_3237657_3.png!w690x384.jpg[/img][/align][align=center]图4-2 黄芪水提物样品色谱图[/align][b]2.2 供试品溶液的制备[/b]精密称定1/50重量的黄芪水提物样品(折合黄芪药材2 g)置于锥形瓶中,精密加入50 mL甲醇,超声30 min,过滤,将滤液放至水浴锅上蒸干,残渣用甲醇溶解,并定容至25 mL,用0.22 μm的微孔滤膜过滤,即得。[b]2.3 对照品储备溶液的制备[/b]精密称取黄芪甲苷标品5.10mg至10 mL容量瓶中,用甲醇溶解后定容,摇匀,即得浓度为0.51 mg/mL的对照品储备溶液。[b]3 结果3.1 线性关系考察[/b]精密吸取 2. 3 项下对照品储备溶液 4,2,1,0.5,0.25 mL至10 mL容量瓶中,用甲醇定容,得到浓度为204.00,102.00,51.00,25.50,12.75 μg/mL的对照品溶液。按“2.3”项下色谱条件分别进样10 μL,利用自动积分功能测定峰面积积分值,并以峰面积积分值与浓度进行线性回归。如图3,得回归方程为:Y =25445X + 44225(r[sup]2[/sup]= 0.9994)提示毛蕊异黄酮苷在12.75~204.00 μg/mL范围内线性关系良好。毛蕊异黄酮苷对照品标准曲线如图4-3所示。[align=center][img=,690,406]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131706302801_395_3237657_3.png!w690x406.jpg[/img][/align][align=center]图4-3 毛蕊异黄酮苷标准曲线[/align][b]3.2 精密度实验[/b]按2. 2 项下方法制备供试品溶液,精密吸取供试品溶液10 μL,重复进样 6 次,记录色谱图峰面积,测定毛蕊异黄酮苷含量,计算得相对标准偏差RSD为1.6% ,提示该方法精密度良好。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按“2. 2”项下方法制备供试品溶液,在拟定分析条件下,精密吸取供试品溶液10 μL,测定毛蕊异黄酮苷含量,计算得RSD为1.1%,提示该方法重复性良好。[b]3.4 稳定性实验 [/b]按2. 2 项下方法制备供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷含量,计算得 RSD 为 0.6%,提示黄芪供试品溶液在48h内稳定性良好。[b]3.5 加样回收率实验[/b]精密称取 6 份毛蕊异黄酮苷含量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入样品中毛蕊异黄酮苷含量的50%,50%,100%,100%,150%,150%重量的毛蕊异黄酮苷标品,按2. 2 项下方法制备供试品溶液,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷含量,计算回收率,结果见表4-1。方法平均回收率为108.48%,表明该方法具有较好的回收率。[align=center]表4-1 毛蕊异黄酮苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量[/align] [align=center]/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率[/align] [align=center]/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD[/align] [align=center]/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]0.52 [/align] [/td][td] [align=center]1.64 [/align] [/td][td] [align=center]111.54 [/align] [/td][td=1,6] [align=center]108.85 [/align] [/td][td=1,6] [align=center]2.9 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]0.52 [/align] [/td][td] [align=center]1.64 [/align] [/td][td] [align=center]112.08 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]2.22 [/align] [/td][td] [align=center]109.20 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]2.24 [/align] [/td][td] [align=center]111.02 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.59 [/align] [/td][td] [align=center]2.72 [/align] [/td][td] [align=center]104.57 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]1.06 [/align] [/td][td] [align=center]1.59 [/align] [/td][td] [align=center]2.72 [/align] [/td][td] [align=center]104.67 [/align] [/td][/tr][/table][b]3.6 毛蕊异黄酮苷的含量测定结果[/b]取9组黄芪水提物按照“2.2”项下操作,制备供试品溶液,准确吸取 10 μL 进样分析,测定毛蕊异黄酮苷的含量。结果见表2。[align=center]表4-2 9组黄芪水提物中毛蕊异黄酮苷含量测定结果[/align] [table][tr][td] [align=center]批号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1123989.50 [/align] [/td][td] [align=center]0.53 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]2707047.50 [/align] [/td][td] [align=center]1.31 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1947171.50 [/align] [/td][td] [align=center]0.93 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]3573103.75 [/align] [/td][td] [align=center]1.73 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1824562.00 [/align] [/td][td] [align=center]0.87 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2767419.00 [/align] [/td][td] [align=center]1.34 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]2077551.50 [/align] [/td][td] [align=center]1.00 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]1677225.50 [/align] [/td][td] [align=center]0.80 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]1725416.00 [/align] [/td][td] [align=center]0.83 [/align] [/td][/tr][/table][b]3.7 毛蕊异黄酮苷转移率测定正交试验结果[/b]水提的毛蕊异黄酮苷转移率考察正交试验与水提的出膏率考察正交试验设计相同,即以水作为提取溶剂,把影响药材提取效果的用水量(A)、提取时间(B)、提取次数(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表4-3。[align=center]表4-3水提实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(用水量/倍)[/align] [/td][td] [align=center]B(提取时间/h)[/align] [/td][td] [align=center]C(提取次数/次)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table][b] [/b]毛蕊异黄酮苷转移率=各实验组黄芪提取物中毛蕊异黄酮苷含量/原黄芪药材中毛蕊异黄酮苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.1425mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表4-4,4-5。[align=center]表4-4 毛蕊异黄酮苷转移率考察L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]批号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]毛蕊异黄酮苷[/align] [align=center]转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]37.21[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]91.77[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]65.58[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]121.62[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]61.36[/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]93.85[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]70.08[/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]56.28[/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]57.94[/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]194.56[/align] [/td][td] [align=center]228.91[/align] [/td][td] [align=center]187.34[/align] [/td][td] [align=center]156.51[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]276.83[/align] [/td][td] [align=center]209.41[/align] [/td][td] [align=center]271.33[/align] [/td][td] [align=center]255.70[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]184.30[/align] [/td][td] [align=center]217.37[/align] [/td][td] [align=center]197.02[/align] [/td][td] [align=center]243.48[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]92.53[/align] [/td][td] [align=center]19.50[/align] [/td][td] [align=center]83.99[/align] [/td][td] [align=center]99.19[/align] [/td][td] [align=center] [/align] [/td][/tr][/table][b] [/b][align=center]表4-5 毛蕊异黄酮苷转移率考察方差分析表[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]1715.05[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.50[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]64.09[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.04[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]1407.78[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1.13[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]D [/align] [/td][td] [align=center]1950.20[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知:水提实验中,各因素对毛蕊异黄酮苷转移率的影响大小顺序为:A(用水量)C(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]1[/sub]A[sub]3[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得提取工艺为A[sub]2[/sub]B[sub]1[/sub]C[sub]2[/sub],即加水8倍量,提取2次,每次1h。表4-5的方差分析结果表明: A、B、C三因素的对毛蕊异黄酮的转移率影响都无统计学差异(PC(提取次数)B(提取时间);每个因素3水平之间的趋势为A[sub]2[/sub]A[sub]3[/sub]A[sub]1[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]2[/sub]C[sub]3[/sub]C[sub]1[/sub],直观分析得提取工艺为A[sub]2[/sub]B[sub]1[/sub]C2,即加水8倍量,提取2次,每次1h。表4-7的方差分析结果表明:A、B、C三因素对综合评分的影响都无统计学差异(P0.05)。[b]4 讨论[/b]本章实验借鉴药典中测定黄芪药材中毛蕊异黄酮苷含量的方法,利用紫外-可见光检测器的高效液相色谱仪测定黄芪水提物中毛蕊异黄酮苷的含量。与药典中方法测得的结果相比,本实验测得的结果除色谱峰分离度稍差外,其他方法学考察指标显示良好。从毛蕊异黄酮苷转移率测定正交试验结果来看,第4组实验毛蕊异黄酮苷转移率最高,这也是正交结果分析中最佳提取工艺,即加水8倍量,提取2次,每次1小时。本结果与上一章实验中第四组黄芪水提物中黄芪甲苷的转移率最高结果一致,但其他组别毛蕊异黄酮苷的转移率高低顺序与上一章黄芪甲苷的转移率高低顺序并不一致,这说明毛蕊异黄酮苷和黄芪甲苷对提取工艺的要求并不完全一致。同一种原药材,加工成不同功效的药物,那么发挥药效的物质也有可能不同,因此相应的提取工艺也是需要根据药效物质适时调整的。另外,用水量在设置的三个因素中对毛蕊异黄酮苷的转移率影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提物中毛蕊异黄酮苷的含量无显著性影响。从综合评分计算正交试验结果来看,第4组实验综合评分最高,这也是正交结果分析中最佳提取工艺,即加水8倍量,提取2次,每次1小时。用水量在设置的三个因素中对综合评分影响最大,但仍无统计学差异(P0.05),说明用水量、提取次数、提取时间三种工艺的改变对黄芪水提工艺的综合评分无显著性影响。综合出膏率、黄芪甲苷和毛蕊异黄酮苷的含量得出综合评分来优选黄芪水提的最佳提取工艺,能够从化学成分的角度来客观全面地评价和研究黄芪水提的关键环节,这也为芪龙胶囊和黄芪配方颗粒水提环节工艺的优化提供借鉴和指导。[align=center] [/align][align=center]参考文献[/align] 陈建真,吕圭源, 叶磊, 等.黄芪黄酮的化学成分与药理作用研究进展. 医药导报, 2009, 28(10): 1314-1316. 赵四清,周日宝, 陈胜璜, 等.不同的产地加工方法对中药材金樱子质量的影响. 湖南中医学院学报, 2005, 25(3): 21-22.
液相质谱方法优化了很长时间,样品处理办法由开始的沉淀蛋白换成了液液萃取,还是在血浆中没有检测到。该化合物分子量为785.6,我的MRM是+,即807.6-627.5我看到文献有做成功的,可含量也很低Cmax=16ng,请问是黄芪甲苷在大鼠胃内被酸化了吗?还是有别的原因?灌胃液中含黄芪甲苷大于1mg/mL。[img=,555,239]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211951256531_6859_3255306_3.jpg!w555x239.jpg[/img]
人参皂苷有好多种,如果用比色法测定总皂苷的话,是不是用任何一种人参皂苷都可以呀?有些文献中要求用Re,其他的可不可以呢?
有谁检测过人参总皂苷方法为GB/T 19506-2009 附录B,我们这边检测的结果总是在2%左右,送出去检测对方能达到3.5%,问对方怎么测的,人家就告诉是按国标方法做的,有谁做过,烦请给指导一下,万分感谢,盼回复。
活血通络颗粒是由黄芪、丹参、当归、赤芍、地龙、川芎等多味中药组成的复方制剂,具有益气活血、抗凝、降脂等功效。主要用于中风后遗症、脑血栓、脑动脉硬化及高血压、高血脂、心绞痛等心脑血管疾病。黄芪为方中君药,黄芪甲苷为其指标成分,中药复方中黄芪甲苷含量测定已有文献报道。本研究参考文献方法,建立测定活血通络颗粒中黄芪甲苷含量的方法,为控制本品质量打下基础。 1 仪器与试药 薄层扫描仪(日本岛津CS一9000),硅胶G薄层板(青岛海洋化工厂,10cm×10cm),定样毛细管(美国Drumond公司),电子分析天平(梅特勒一托利多仪器上海有限公司),黄芪、丹参、当归等原料药(医药公司),黄芪甲苷对照品(中国药品生物制品检定所),活血通络颗粒剂(本院自制,批号20020326,20020410,20020419)。所用试剂均为分析纯。
有没有哪位大神用紫外或者示差测过黄芪甲苷啊,我们这边没有蒸发光散射,只能用紫外和示差,但是跟着文献上搜出来的资料完全没有走出来的迹象啊。仪器条件如下:1:紫外:流动相30%乙腈水,色谱柱150mm的C18柱子走,检测波长203。2:示差 流动相:67%甲醇水,色谱柱:150mm C18。以上,标都是用甲醇配的,最大浓度是500ppm。
用奥泰的ELSD2000做黄芪甲苷一直没有峰,流动相乙腈-水32:68(药典),标准品一直没峰?加大有机相到40:60还没有,用乙腈冲出来的峰不知道是不是黄芪甲苷请各位高人指点!!!不胜感谢!!!
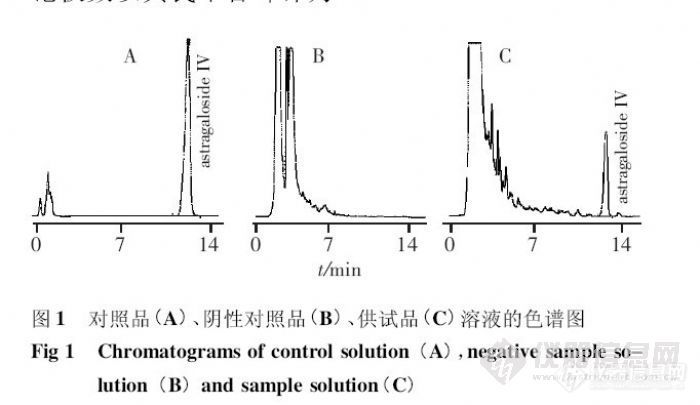
HPLC-ELSD测定芪桂消癓颗粒中的黄芪甲苷 张梦云,冯俭* ,张煜华,李煌,朱晗 (成都中医药大学附属医院,四川成都610072)摘要: 目的建立测定芪桂消癥颗粒中黄芪甲苷含量的方法。方法采用HPLC - ELSD 法,色谱柱为Diamonsil C18柱(150mm × 4. 6 mm,5. 0 μm),流动相为乙腈- 水(32∶68),流速为1. 0 mL·min - 1 ,柱温为35℃;检测器漂移管温度为80℃,氮气压力为45 psi。结果黄芪甲苷7. 72 ~ 23. 16 μg 与峰面积的线性关系良好( r = 0. 9993),平均回收率为97. 49%,RSD = 2. 08%(n = 6)。结论所建方法简便、准确、重复性好,可有效地控制芪桂消癥颗粒的质量。关键词: 高效液相色谱- 蒸发光散射检测器法;芪桂消癥颗粒;黄芪甲苷http://ng1.17img.cn/bbsfiles/images/2012/07/201207242113_379515_2432394_3.jpg
在做黄芪甲苷的时候,蒸发光散射检测器参数如何设

全自动固相萃取-比色法测定保健食品中总皂苷 作者:赵晓冬http://ng1.17img.cn/bbsfiles/images/2015/11/201511261708_575182_2904170_3.jpg目的:建立保健食品中总皂苷的含量测定方法。方法:采用Sepline全自动固相萃取装置对保健食品中的总皂苷富集,通过70%乙醇回收,以香草醛-高氯酸为显色剂,采用比色法测定。结果:比色法测定的线性范围为0.038~0.268mg,相关系数 r=0.9997; 在不同保健食品中的平均加样回收率均在98.3%~102.4%,RSD〈2.2% (n=6)。结论:本法简便、准确、灵敏度高、重复性好,可用于不同类型保健食品中总皂苷的含量测定。 目前保健食品中的总皂甙测定方法尚无国家标准,大多都是按照《保健食品检验与评价技术规范 (2003年版) 》“保健食品中总皂甙的测定”方法检测,该方法采用人参皂苷 Re为对照,用香草醛比色法测定总皂苷。其显色体系为:香草醛-冰醋酸-高氯酸,但在实际操作中和据相关文献报道中,但采用该方法检测结果误差较大,尤其是不同实验室间测定结果差异更大,不利于产品的质量控制。有文献报道,卫生部食品卫生监督所2000年组织全国22个省、市、自治区省级疾病预防控制中心对这一方法进行比对试验,结果显示:离散度较大,有的浓度水平还出现离群值,各实验室间的RSD达80%,因此需要对测定方法加以改进。本文采用莱伯泰科公司Sepline全自动固相萃取提取装置 具有洗脱液流速恒定可控、大批量产品自动化处理,保证试验系统的密闭性等优点可保证结果的平行性和准确性。在对大孔树脂进行品牌筛选的基础上,定制统一规格固相萃取柱、对总皂苷测定前处理过程进行了优化,整套方法简单,数据结果离散性小,平行性得到提高。1材料与方法1.1 仪器 UV-2450 紫外可见分光光度计(日本,岛津公司),CP2250分析天平,AS10200ADT超声波清洗仪,TLL-DCⅡ型氮吹仪,Sepline全自动固相萃取系统(北京莱伯泰科有限公司),固相萃取柱(底层有砂芯隔板,内装XAD-2大孔树脂2.7g,Alumina-N中性氧化铝,6ml,北京莱伯泰科有限公司)。1.2 试药 人参皂苷Re对照品(中国食品药品检定研究院,含量92.7%),冰醋酸、香草醛、高氯酸、乙醇均为分析纯,水为纯化水。1.3 供试品 上普牌西洋参含片 (厦门上普药业有限公司,批号14040201);天信减肥茶( 福建安溪馨隆保健品有限公司,批号: 20140504 ) ;辅助降血脂片(哈尔滨久盛医药科技开发有限公司,批号:20140714)珍迪牌黄芪阿胶口服液(南昌健民营养补品厂,批号: 20130701)2方法与结果2.1 标准溶液制备精密称取20mg人参皂苷Re对照品置于100mL量瓶中,用甲醇溶解并稀释至刻度,摇匀。吸取10mL人参皂苷Re标准溶液(0.2mg/ml)放蒸发皿中,放在水浴挥干(低于60℃),准确加入10ml水溶解,作为标准溶液2.2 样品溶液制备 精密称取适量样品,置于50mL容量瓶中,加水适量溶解,超声30min,放置至室温,用水稀释至刻度,摇匀, 3000r·min-1离心5min,0.45um微孔滤膜过滤。若为非乙醇类液体试样,先经0.45um微孔滤膜过滤,取精密过滤后样品1mL (根据试样含总皂苷量定) 进行固相萃取。2.3 样品溶液吸附及洗脱 取样品溶液上清液置于收集管中(大于2ml), 放置于Sepline全自动固相萃取系统中,按以下步骤进行吸附及洗脱(详见图1)。2.3.1 活化:在固相萃取柱中,以2.5 ml·min-1 流速冲洗70%乙醇25ml、然后以2.5 ml·min-1 流速冲洗水25ml。2.3.2 上样:以1ml·min-1 流速加1ml样品溶液于固相萃取柱中。2.3.3 洗脱:以0.8ml·min-1 流速, 依次用25ml水,25ml70%乙醇进行洗脱,收集70%乙醇洗脱液,在收集结束时氮气吹扫管理残留洗脱液50s。2.3.4 挥干:将收集的洗脱液转入50ml的离心管中,在60℃下氮气吹干。https://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXHUdyj5UNWFsWqjnVFOfw77OyyjdE8AtsH0V1ibNylQgZibv2FialaXicibA/0?wx_fmt=jpeg2.4 显色与测定 在上述已挥干的洗脱液中准确加入0.2ml5%香草醛冰乙酸溶液,使残渣都溶解,再加0.8ml 高氯酸,混匀后60℃水浴上加热 10min,冰浴冷却后,准确加入冰乙酸 5.0ml,摇匀后,以 1cm 比色池于 560nm 波长处与标准管一起进行比色测定。2.5 线性关系考察 精密吸取“2.1”项标准溶液0、0.2、0.5、0.8、1.0、1.2、、1.4人参皂苷Re标准溶液(0.2mg/ml),按 “2. 3”“2.4”项下方法进行前处理并测定。以吸光度值为横坐标, 以人参皂苷Re含量 (mg) 为纵坐标进行回归计算,回归方程为y =0.3521x+0.0018,r=0.9997,结果表明,总皂苷( 以人参皂苷Re计) 在0.038~0.268mg 范围内线性关系良好。2.6 加样回收率试验 采用加样回收率法,精密称取4类保健品适量,分别按样品量的100%的比例各6份加入对照品 ,按“2.3”项下和“2.4”项下进行测定,并分别计算回收率(见表1-表5),结果各品种平均加样回收率均在98.3%~102. 4% ,RSD<2.2% ,并与传统方法(手填层析柱、人工进行柱洗脱)进行比较,表明该方法准确度良好,且离散度低于传统方法。https://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXpKdklF1UoeMzvU6eQJEseF6P0shyEyUViacyO2M0iaBmcQmLVtq4YUIQ/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXcxdobibU0cPzwap5qsdShaQtxlrmMbDxOG6AKyWSTxYHbwu085loQog/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXudGTrHbh0Eu8R6zY3PNo4iaHwJMh58wAxhK00QPk76bje6KXTQ6LWAA/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXO3ae9XyfEiaaUU6Qkibib1WgWDiaAVh9AQEFhV6tJ8oJxfsibuHW7tMWHUw/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXfVUKQfmpzF7ootVP2rp4VREoKIGLKDM54tMwEK2GyZ8DazgJL6tfug/0?wx_fmt=jpeg2.7 稳定性试验 将显色后样品分别放置 0、0.5、1、1.5、2、2.5、3h, 测定吸光值。结果表明该显色体系在1 h内吸光度基本不变,1h后吸光度有所降低,故在显色后1 h内测定。2.8 样品含量测定 取4类保健食品 ,按“2.3”项下和“2.4”项下进行测定,于 560nm 波长处测定吸光度值, 根据所得到的标准曲线计算样品中总皂苷的含量(见表6) 。[align
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=102809]HPLC—ELSD法测定复方养心片中黄芪甲苷的含量[/url]
香草醛-冰醋酸显色针对的苷类包括黄酮苷、蒽醌苷、皂苷吗?因为我做的UV里面苷类成份特别多,而我只想测黄芪总苷,但阴性有干扰,现在解决不了,谁能帮我解决一下,谢谢
各位老师,帮忙想个办法能从黄芪蜜中分离出来毛蕊异黄酮葡萄糖苷
黄芪净药材—毛蕊异黄酮葡萄糖苷梯度设置请教一下怎么设置的 为什么我的不出峰 有没有做过的 请教请教[img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106032032470096_8789_4180826_3.png[/img]
今天同时做的甘草和黄芪有机氯前处理,按照药典一部来的,加了盐之后,黄芪中丙酮析出,且有机相都位于下层。可是甘草丙酮析出不好,明显上层溶液多于下层溶液,并且用无水硫酸钠做了检查,发现上层的才是有机相。现在黄芪和甘草有机相的位置是相反的,一个在上,一个在下,不明白为何会出现这种情况,希望哪位大虾能帮忙解决下,谢谢了。
[b]1.[font=宋体]黄芪多糖的精制[/font][/b][font=宋体]取黄芪药材粉末约[/font]30.0 g[font=宋体],精密称定,加入石油醚([/font]60[font=宋体]~[/font]90 [font=宋体]℃[/font][font=宋体])[/font]100 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]1 h[font=宋体],弃去提取液(除去脂溶性成分),药渣烘干,用[/font]70 %[font=宋体]乙醇[/font]150 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]2 h[font=宋体]。弃去提取液(除单糖、低聚糖和苷类等小分子物质),药渣烘干,加蒸馏水[/font]200 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]2 h[font=宋体]。合并提取液,减压浓缩至[/font]100 mL[font=宋体],即得粗多糖的水溶液。在粗多糖水溶液中加入[/font]Sevage[font=宋体]试剂(氯仿[/font][font=宋体]:[/font][font=宋体]正丁醇[/font] = 4[font=宋体]:[/font]l[font=宋体])[/font]10 mL[font=宋体],剧烈震荡[/font]20 min[font=宋体],使其充分混合,在[/font]4000 rpm[font=宋体]转速下离心[/font]5 min[font=宋体],弃去中间变性蛋白层和下层有机层,水相继续重复上述操作[/font]10[font=宋体]次,直至水相与有机相中间无变性蛋白出现为止,即得脱蛋白多糖水溶液。[/font][font=宋体]向脱蛋白多糖水溶液中加入[/font]5[font=宋体]倍量无水乙醇[/font]80mL[font=宋体](使溶液含醇量达[/font]80 %[font=宋体]以上),充分搅拌,静置过夜。在[/font]4000rpm[font=宋体]转速下离心[/font]5 min[font=宋体],弃去上清液,所得沉淀依次用无水乙醇、丙酮、无水乙醚[/font]20mL[font=宋体]各洗涤[/font]3[font=宋体]次,弃去有机溶剂后挥干沉淀,并用真空干燥机抽真空,[/font]60 [font=宋体]℃[/font][font=宋体]干燥[/font]12h[font=宋体],得到灰白色颗粒状多糖样品。[/font] [font=宋体]黄芪多糖精制的工艺流程图见图[/font]1[font=宋体]。[/font][align=center][img=,627,567]https://ng1.17img.cn/bbsfiles/images/2021/11/202111161201593536_221_3528941_3.gif!w627x567.jpg[/img][/align][align=center][b]Fig.1 The isolationprocedure of the polysaccharide in [i]Radix Astragali.[/i][/b][/align][b]2.[font=宋体]黄芪多糖的纯度检查[/font]2.1 Molish [font=宋体]试验[/font][/b][font=宋体]([/font]1[font=宋体])供试品溶液:取黄芪多糖[/font]2mg[font=宋体],加[/font]10mL [font=宋体]蒸馏水,微热使溶解,再加入[/font]α-[font=宋体]萘酚;[/font][font=宋体]([/font]2[font=宋体])[/font][font=宋体]阳性对照品溶液:取淀粉[/font]2 mg[font=宋体],加[/font]10 mL [font=宋体]蒸馏水,加热溶解,再加入[/font]α-[font=宋体]萘酚;[/font][font=宋体]([/font]3[font=宋体])[/font][font=宋体]阴性对照品溶液:[/font]10 mL [font=宋体]蒸馏水,加[/font]α-[font=宋体]萘酚。[/font][font=宋体]分别摇匀,将试管倾斜,沿试管壁慢慢加入浓硫酸,竖直试管观察。供试品溶液与阳性对照品溶液试管中呈紫堇色环,阴性对照品溶液试管界面无变化。结果表明供试品溶液为糖类。[/font][b]2.2 Fehling [font=宋体]试验[/font][/b] Fehling[font=宋体]试剂的配置:称取[/font]CuSO[sub]4[/sub][sup].[/sup]5H[sub]2[/sub]O7.28 g[font=宋体],[/font][font=宋体]加水至[/font]40 mL[font=宋体],[/font]0.1 mL [font=宋体]浓硫酸酸化,再加水至[/font]100 mL[font=宋体]作为甲液;称取酒石酸钾钠[/font]34.6 g[font=宋体],氢氧化钠[/font]14.2 g[font=宋体],加水至[/font]100mL [font=宋体]作为乙液。临用时将甲、乙液按[/font]1:1[font=宋体]混匀即可。[/font][font=宋体]([/font]1[font=宋体])[/font][font=宋体]供试品溶液:取黄芪多糖[/font]2 mg[font=宋体],加[/font]10 mL [font=宋体]蒸馏水,微热使溶解;[/font][font=宋体]([/font]2[font=宋体])[/font][font=宋体]阳性对照品溶液:取葡萄糖[/font]2mg[font=宋体],加[/font]10mL [font=宋体]蒸馏水,微热使溶解;[/font][font=宋体]([/font]3[font=宋体])[/font][font=宋体]阴性对照品溶液:[/font]10 mL [font=宋体]蒸馏水。[/font][font=宋体]分别加入[/font]Fehling[font=宋体]试剂,在[/font]70℃[font=宋体]水浴中加热[/font]10 min[font=宋体]。供试品溶液与阳性对照品溶液为蓝色,阴性对照品溶液变为砖红色。单糖与[/font]Fehling[font=宋体]试剂反应变为砖红色,而多糖为非还原性糖,不与[/font]Fehling[font=宋体]试剂反应,结果表明供试品中不含单糖。[/font][b]2.3[font=宋体]显色条件[/font][/b][font=宋体]总多糖的测定:精密量取对照品溶液或供试品溶液[/font]0.5mL[font=宋体]于具刻度试管中,加水补至[/font]1.0mL[font=宋体],再加入[/font]8%[font=宋体]苯酚溶液[/font]1.0mL[font=宋体],充分混匀后,加入浓硫酸[/font]5.0mL[font=宋体],[/font]60 ℃[font=宋体]水浴加热[/font]15 min[font=宋体],取出,冷却至室温后,于[/font]487nm[font=宋体]下测定吸光度,外标一点法测定多糖含量。[/font]
作者:张杰;张凌艳;李贺一; (哈药集团三精制药股份有限公司;三精艾富西药业有限公司;三精英美药业有限公司;)摘要:目的:建立高效液相色谱法测定生血康口服液的含量。方法:采用迪马(钻石)C18(250mm×4.6mm,5μm)色谱柱,乙腈-水(35-65),流速1.0ml/min,蒸发光散射检测器。结果:黄芪甲苷与其它杂质能达到有效分离,在0.03021mg/ml~0.19206mg/ml范围内,浓度同峰面积呈良好的线形关系,r=0.999698,仪器精密度RSD为2.81%,方法的重复性RSD为3.78%。结论:该方法简便、准确、可行。可用于生血康口服液的质量控制。谱图:无