IC-测定饮用水中亚氯酸盐、氯酸盐、溴酸盐、二氯乙酸及三氯乙酸
饮用水一般来源于自来水、桶装水和井水。自来水需经过消毒后才能饮用,其消毒方式一般包括氯消毒(液氯、次氯酸钠消毒等)和二氧化氯消毒。氯消毒因成本低廉的优点,目前是我国大型水厂的主流消毒方式。除卤代烃外,常见的含氯消毒副产物还有亚氯酸盐、氯酸盐、二氯乙酸和三氯乙酸等。这四种消毒副产物目前成为生活饮用水的常规检测项目,因此如何分离这四种消毒副产物成为目前一大热点。本文探索并开发[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]分离亚氯酸盐、氯酸盐、二氯乙酸和三氯乙酸的方法。首先是色谱柱和定量环的选择。由于一般饮用水中亚氯酸盐、氯酸盐、二氯乙酸和三氯乙酸在水中的检测值较低,因此需要采用大定量环测定,选择定量环体积为是500μL。实验所用 IonPac AS19分离柱亲水性好,柱容量高,能够满足生活饮用水中常见离子、卤乙酸及卤氧乙酸的同时测定。选择KOH作为淋洗液,利用淋洗液在线发生技术实现梯度洗脱,经过 AERS4 mm自动再生微膜抑制器抑制后产物为水,背景电导低,水负峰不明显,能够实现大体积进样,显著提高方法的灵敏度。淋洗液梯度的选择。选择以初始浓度分别为8、12、15 mmol/L来进行实验,结果表明,当初始浓度为8 mmol/L时,分离效果较好,使用初始浓度为12 mmol/L时,三氯乙酸受到硫酸盐的前延展性峰的干扰,分离效果不好;当浓度为15 mmol/L时,出峰速度较快,四种消毒副产物分离效果不好。由于三氯乙酸极性较大,需要采用梯度淋洗方法将进行洗脱。当选择(20-32)min匀速升至25 mmol/L,保持2 min,可以将保留时间较长的三氯乙酸尽快洗脱出来,且分离效果较好,减少检测所用时间,增加方法的实用性。梯度洗脱程序如表[align=center]表 四种消毒副产物的梯度洗脱程序[/align][table][tr][td]时间(min)[/td][td]梯度浓度C[sub]NaOH[/sub](mmol/L)[/td][/tr][tr][td]0-20[/td][td]8[/td][/tr][tr][td]20-32[/td][td]8-25[/td][/tr][tr][td]32-34[/td][td]25[/td][/tr][tr][td]34[/td][td]8[/td][/tr][/table]实际样品的测定。先对预先活化Ag柱、Ba柱和H柱,分别用注射器以2 mL/min 的流速将10mL超纯水过柱,静置10 min使其充分平衡。然后直接取适量水样,以2 mL / min的速度依次通过串联的Ag 柱、Ba 柱、H柱和0. 22 μm针式滤器,弃去前面 6 mL后开始收集滤液,滤液直接进样测试。可以明显去除氯离子和硫酸盐的含量,减少干扰峰的影响。实验中注意事项和建议先使用标准溶液分离这四种消毒副产物,再对三氯乙酸加标水样进行测定分离,确保三氯乙酸和硫酸盐可以有很好的分离度。二氧化碳装置使用。如果装有二氧化碳装置会大大降低硫酸根前延展性峰的干扰。使分离效果更好。
各位[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]界的达人,求助各位一个问题: 有个氨基哌啶,成品盐酸盐,无紫外吸收,但也不想采用滴定的方法分析,那么,采用哪种比较适宜的GC固定性和条件分析这个氨基哌啶盐酸盐的含量呢?是否采用固定相为SE-54 或PEG20000的这两种不同极性的都可以呢?可检索到的关于哌啶或者哌啶盐酸盐的分析方法太少了啊。在此积极求助,忘各位指导迷津啊。
水质检测氯酸盐、二氯乙酸、三氯乙酸,HJ 1050-2019中测定是用氢氧化钠溶液定容,GB 5750-2022中测定直接用纯水定容,两者有什么区别吗?
我现在在摸脱氢乙酸的条件,试了好几天都没摸出来,各位大神指导一下啊,我的仪器是安捷伦7890A,求指导该用什么柱子,色谱柱条件都是什么才能检测出来,最好把你们的谱图也附上我可以参考一下。如果有丙酸盐的条件也一并赐教吧,丙酸盐我还没开始摸条件,求指导!
各位大神,有个问题想请教,做生活饮用水中消毒副产物,氯酸盐,二氯乙酸,三氯乙酸这三项,曲线没问题,样品做出来值挺高,超标了,这种情况怎么排查原因?[img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272204459696_1620_3570477_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272204462364_7396_3570477_3.png[/img]
就是现在有试过测硫酸根,用的KOH淋洗液,23mM,想问问同时测水里乙酸盐和硫酸根,要改变啥条件嘛
各位大神,有个问题想请教,做生活饮用水中消毒副产物,氯酸盐,二氯乙酸,三氯乙酸这三项,曲线没问题,样品做出来值挺高,超标了,这种情况怎么排查原因?[img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272135252703_8417_3570477_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272135253543_6790_3570477_3.png[/img]
我有个3-羟基哌啶盐酸盐的样品,用GC检测,先将盐酸盐处理掉后,成3-羟基哌啶进气相色谱,FID检测器,色谱柱是DB-5和DB-17,峰形很难看,不规则的包,求助:用什么色谱柱会比较好?
急请教一下大佬[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]同时测乙酸盐和硫酸盐的方法,课题组内有测过硫酸盐,但是师姐说柱子不好进有机物,不然会出峰偏移,想请教一下大佬[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]测两者的方法
0.1%的TFA流动相常用,但是没有加三氟乙酸盐坐缓冲对,怎么起缓冲作用的
大家好~~我是液相色谱仪使用新手,在做棒曲霉素前处理的时候要配制乙酸盐缓冲液,但具体怎么配制我不太清楚,希望大家帮帮忙~~谢谢
哪位大虾做过盐酸盐呢?它的吸收位置大概在哪里,我的样品是哌啶盐酸盐。感觉盐酸盐没有什么特征吸收,不象羧酸盐。不知道对不对,请教!!
我实验要在负离子模式下定量测定一种代谢物,但买到的对照品是三氟乙酸盐结合的形式,在论坛里看到说,三氟乙酸不能再负离子模式下使用,会抑制响应,那我的对照品就不能用了吗?应该怎么办呢?
请问液质联用做一种代谢物的定量分析时,买到的对照品是代谢物的三氟乙酸盐,如何在Q1扫描时将盐去掉,得到代谢物的母离子质核比?还是需要将对照品进行前处理?
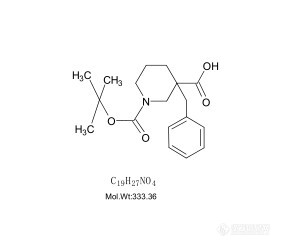
色谱世界的各位大侠们,1-boc-3-苄基哌啶甲酸文献报道说用4.6mm*150mm C18的二氧化硅柱子,用乙腈、水、三氟乙酸作为流动相,在214和254处有吸收峰。我们用紫外全波长扫描后,发现只有在204处有紫外吸收峰,可是我们用乙腈和水作流动相,这个东西在214处不出峰。这个东西该怎么检测纯度呢。这个化合物是通过1-boc-3-哌啶甲酸 和溴苄合成的, 还有1-boc-3-哌啶甲酸 的熔点是159-162℃。 我们这个东西的熔点是109-116℃。 所以这两个东西很定有是不一样的。 实在不行只有打核磁了。我们这个原料的紫外吸收也在204这个位置。但我们用254的紫外薄层检测,发现原料不显色,1-boc-3-苄基哌啶甲酸 轻微显色。[img=,281,247]https://ng1.17img.cn/bbsfiles/images/2019/07/201907231115067664_5937_1815404_3.jpg!w281x247.jpg[/img]
SH-AP-2型阴离子交换柱分析应用研究[font=宋体]Ⅲ[/font][align=center]—[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水样中高氯酸盐和三氯乙酸[/align][align=center]十月[/align]摘要:【目的】建立以SH-AP-2型阴离子交换柱为分离柱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url][font=times new roman][size=18px]-[/size][/font]抑制电导检测法同时测定水样中高氯酸盐和三氯乙酸的新方法。【方法】试验研究同时测定高氯酸盐和三氯乙酸的色谱条件和可行性,优化确定色谱条件。【结果】以SH-AP-2型阴离子交换柱为分离柱,以15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,流量为0.80mL/min,采用等度洗脱的方式可将高氯酸盐、三氯乙酸与硫酸盐等水中常见阴离子完全分离,通过抑制电导检测,高氯酸盐、三氯乙酸的峰面积与其质量浓度均在0.10~3.0mg/L范围内呈良好的线性关系,相关系数分别为0.9994和0.9993,方法应用于水样中高氯酸盐、三氯乙酸的同时测定,加标回收率分别为:90.0%~98.0%和91.6%~98.1%, 5次平行测定的相对标准偏差(RSD)小于6%,方法可在25min以内完成高氯酸盐、三氯乙酸的同时测定,简便快速。【结论】本方法可用于水样中高氯酸盐、三氯乙酸的同时测定。关键词:[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法;水;高氯酸盐;三氯乙酸;中图分类号:O652.63 文献标识码: 文章编号:高氯酸盐是具有高度扩散性的有毒污染物,多存在于地表水中,水中高氯酸盐的主要来源是火箭推进剂和烟花炸药等,其主要危害是妨碍甲状腺吸收碘,造成甲状腺素的合成量减少,进而阻碍人体生长发育,尤其是对孕妇和儿童的影响较为明显[sup][1-2][/sup],在GB5749-2022《生活饮用水卫生标准》中作为扩展指标,并规定其限值为0.07mg/L[sup][3][/sup]。三氯乙酸(TCAA)是饮水在氯化消毒的过程中产生的副产物,具有潜在致癌、致畸、致突变的风险[sup][4-5][/sup]。我国《生活饮用水卫生标准》GB5749-2022中作为毒理学指标,并规定其限值为0.1mg/L[sup][3][/sup]。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法以其独特优势在环保、卫生等行业中得到广泛的应用。目前,测定高氯酸盐[sup][1-2][/sup]和三氯乙酸[sup][4-5][/sup]的[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]方法报道较多,但这些方法大多使用的是IonPac AS19柱,以KOH淋洗液梯度洗脱[sup][1,4-5][/sup],或IonPac AS16柱,KOH淋洗液等度洗脱[sup][2][/sup]方式进行,用SH-AP-2型阴[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱作分离柱,以Na[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水中高氯酸盐和三氯乙酸文献似未见报道。本试验[font=times new roman]通过优化相关色谱条件[/font],建立了以SH-AP-2型阴离子交换柱为分离柱,以15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,流量为0.80mL/min等度洗脱抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水样中高氯酸盐和三氯乙酸的新方法。加标回收率分别为:90.0%~98.0%和91.6%~98.1%,测定结果的相对标准偏差分别为3.98%~5.00%和2.46%~5.45%(n=5),方法的检出限分别0.05mg/L和0.03mg/L 。1、试验部分1.1主要仪器CIC-100型[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url](青岛盛瀚色谱公司,编号15601),抑制器:自再生抑制器,检测器:电导检测器,定量环体积为25μL;SHA—15自动进样器(青岛盛瀚色谱公司,编号AS1518050);SH-AP-2型阴离子交换柱(250×4.0mm i.d,青岛盛瀚色谱公司,批号:2004005);SH-AP-2型保护柱(50×4.0mm i.d,青岛盛瀚色谱公司,批号:G200023)。1.2 仪器工作条件及参数设置色谱仪:柱箱温度35℃,电流:75mA,量程:1档。自动进样器:全定量环取样,取样后清洗(每针之间),置换量70μL,取样量25μL,扎针深度4mm。1.3主要试剂高氯酸钾、三氯乙酸、磷酸二氢钾、溴化钾:分析纯,国药集团化学试剂有限公司。ClO[sub]4[/sub][sup]-[/sup]标准溶液:1000 mg/L,按照文献[1]配制;TCAA[sup]-[/sup]标准溶液:1000 mg/L,按照文献[6]配制;H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]和Br[sup]-[/sup]标准溶液:1000 mg/L,按照文献[7]配制。 NO[sub]3[/sub][sup]-[/sup]、F[sup]-[/sup]、Cl[sup]-[/sup]、SO[sub]4[/sub][sup]2-[/sup]标准溶液:[color=black]质量浓度[/color]均为1000 mg/L,编号分别为GBW(E)080264、GBW(E)080549、GBW(E)080268、GBW(E)080266;NO[sub]2[/sub][sup]-[/sup]标准溶液:[color=black]质量浓度[/color]为100 mg/L,编号为GBW(E)080223,北京中国计量科学研究院。用前将上述标准溶液用纯水稀释成含ClO[sub]4[/sub][sup]-[/sup]、TCAA各10.0 mg/L混合标准应用液备用。无水碳酸钠(分析纯,国药集团化学试剂有限公司),碳酸氢钠(分析纯,国药集团化学试剂有限公司)。试验所用试剂均为AR及以上级,试验用水为超纯水(18.2ΜΩcm)。1.4 试验方法1.4.1 标准曲线的绘制 取混合标准应用液0.10、0.20、0.50、1.0、2.0和3.0 mL于10mL容量瓶中加纯水至刻度,混匀,配制成含ClO[sub]4[/sub][sup]-[/sup]、TCAAC均为0.10~3.0 mg/L的标准系列,各管取1.5mL于样品瓶中,启动自动进样器进样分别测定各组份的峰面积(S),以S对各组份浓度绘制工作曲线。1.4.2 样品测定 取水样在微波炉上加热浓缩1倍后经0.45μm滤膜过滤后取1.5mL于样品瓶中,启动自动进样器进样测定各组份的峰面积(S),以标准曲线法定量,同时进行加标回收试验。2、结果与讨论2.1 色谱条件的选择2.1.1 淋洗液的选择 试验结果表明,在SH-AP-2型分离柱上ClO[sub]4[/sub][sup]-[/sup]和TCAA是强保留组分,二者均在SO[sub]4[/sub][sup]2-[/sup][size=12px]后[/size]出峰(出峰顺序为SO[sub]4[/sub][sup]2-[/sup]、TCAA和ClO[sub]4[/sub][sup]-[/sup]),因此选用洗脱能力较强的Na[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液进行试验,结果显示当Na[sub]2[/sub]CO[sub]3[/sub]溶液浓度分别为10.0、12.0和15.0 mmol/L时,ClO[sub]4[/sub][sup]-[/sup]的保留时间(T)分别为23、21和19分多钟,试验结果见表1。从表1可见,各组分的峰分离度(R)在3.26~8.91,说明SO[sub]4[/sub][sup]2-[/sup]、TCAA和ClO[sub]4[/sub][sup]-[/sup]三组分能完全分离,为了缩短保留时间,本试验以15.0 mmol/L的Na[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液。[align=center]表1 Na[sub]2[/sub]CO[sub]3[/sub]溶液浓度对分离情况的影响(流量0.80 ml/min,柱温35℃)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]10.0mmol/L[/align][/td][td=2,1][align=center]12.0mmol/L[/align][/td][td=2,1][align=center]15.0mmol/L[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO[sub]4[/sub][sup][size=13px]2-[/size][/sup][/align][/td][td][align=center]10.818[/align][/td][td][align=center]3.26[/align][/td][td][align=center]9.180[/align][/td][td][align=center]4.19[/align][/td][td][align=center]7.821 [/align][/td][td][align=center]4.78[/align][/td][/tr][tr][td][align=center]TCAA[/align][/td][td][align=center]13.361[/align][/td][td][align=center]8.91[/align][/td][td][align=center]12.226[/align][/td][td][align=center]8.74 [/align][/td][td][align=center]11.311 [/align][/td][td][align=center]8.71[/align][/td][/tr][tr][td][align=center]ClO[sub]4[/sub][sup]-[/sup][size=12px] [/size][/align][/td][td][align=center]23.856[/align][/td][td][align=center]/[/align][/td][td][align=center]21.619[/align][/td][td][align=center]/[/align][/td][td][align=center]19.667 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.1.2淋洗液流量的选择 当淋洗液组成和浓度一定时,淋洗液流量对组分的T和R有明显的影响,本试验淋洗液流量在0.70mL/min~0.90mL/min时SO[sub]4[/sub][sup]2-[/sup]和TCAA的R在3.71以上,满足组分完全分离的要求[sup][8][/sup],随着流量的升高,组分的峰面积逐渐降低,见表2。为使各组分有适宜的保留时间、较高峰面积和峰分离度,系统有较低的压力,本试验淋洗液流量选定为0.80mL/min。[align=center]表2 淋洗液流量对保留时间、峰面积和峰分离度的影响(15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub],柱温35℃)[/align][table][tr][td=1,2][align=center][color=black]组分([/color][size=13px][color=black]mg/L)[/color][/size][/align][/td][td=3,1][align=center][color=black]0.70ml/min[/color][/align][/td][td=3,1][align=center][color=black]0.80ml/min[/color][/align][/td][td=3,1][align=center][color=black]0.90ml/min[/color][/align][/td][/tr][tr][td][align=center][color=black]T/min[/color][/align][/td][td][align=center][color=black]S[/color][/align][/td][td][align=center][color=black]R[/color][/align][/td][td][align=center][color=black]T/min[/color][/align][/td][td][align=center][color=black]S[/color][/align][/td][td][align=center][color=black]R[/color][/align][/td][td][align=center][color=black]T/min[/color][/align][/td][td][align=center][color=black]S[/color][/align][/td][td][align=center][color=black]R[/color][/align][/td][/tr][tr][td][align=center][color=black]SO[/color][sub][color=black]4[/color][/sub][sup][size=13px]2-[/size][/sup][color=black](50)[/color][/align][/td][td][align=center][color=black]9.207[/color][/align][/td][td][align=center][color=black]7967106[/color][/align][/td][td][align=center][color=black]4.14[/color][/align][/td][td][align=center][color=black]8.094[/color][/align][/td][td][align=center][color=black]6842709[/color][/align][/td][td][align=center][color=black]4.43[/color][/align][/td][td][align=center][color=black]7.218[/color][/align][/td][td][align=center][color=black]6038981[/color][/align][/td][td][align=center][color=black]3.71[/color][/align][/td][/tr][tr][td][align=center]TCAA[color=black](1)[/color][/align][/td][td][align=center][color=black]13.263[/color][/align][/td][td][align=center][color=black]32517[/color][/align][/td][td][align=center][color=black]6.73[/color][/align][/td][td][align=center][color=black]11.678[/color][/align][/td][td][align=center][color=black]30346[/color][/align][/td][td][align=center][color=black]7.05[/color][/align][/td][td][align=center][color=black]10.382[/color][/align][/td][td][align=center][color=black]26138[/color][/align][/td][td][align=center][color=black]6.19[/color][/align][/td][/tr][tr][td][align=center][color=black]ClO[/color][sub][color=black]4[/color][/sub][sup][color=black]-[/color][/sup][size=12px][color=black] (1)[/color][/size][/align][/td][td][align=center][color=black]22.878[/color][/align][/td][td][align=center][color=black]61905[/color][/align][/td][td][align=center][color=black]/[/color][/align][/td][td][align=center][color=black]20.073[/color][/align][/td][td][align=center][color=black]50148[/color][/align][/td][td][align=center][color=black]/[/color][/align][/td][td][align=center][color=black]17.979[/color][/align][/td][td][align=center][color=black]43194[/color][/align][/td][td][align=center][color=black]/[/color][/align][/td][/tr][/table]2.1.3 柱箱温度的确定 考察了30℃、35℃和40℃时各组分的分离效果,结果见表3,从表3可见,在30℃~40℃范围内,各组分均能较好的分离,其R值均在4.24以上,且随着柱温的升高组分的T稍微缩短,在保证各组分有适宜的R和T的前提下尽量使用较低的柱温,故本试验确定柱箱温度为35℃。[align=center]表3 柱箱温度对分离度和保留时间的影响(15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub],流量0.80 ml/min)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]30℃[/align][/td][td=2,1][align=center]35℃[/align][/td][td=2,1][align=center]40℃[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO[sub]4[/sub][sup][size=13px]2-[/size][/sup][/align][/td][td][align=center]8.076[/align][/td][td][align=center]4.24[/align][/td][td][align=center]8.094[/align][/td][td][align=center]4.25 [/align][/td][td][align=center]8.127 [/align][/td][td][align=center]4.43 [/align][/td][/tr][tr][td][align=center]TCAA[/align][/td][td][align=center]11.755[/align][/td][td][align=center]7.98[/align][/td][td][align=center]11.693[/align][/td][td][align=center]7.15 [/align][/td][td][align=center]11.549 [/align][/td][td][align=center]6.87 [/align][/td][/tr][tr][td][align=center]ClO[sub]4[/sub][sup]-[/sup][size=12px] [/size][/align][/td][td][align=center]21.102[/align][/td][td][align=center]/[/align][/td][td][align=center]20.157[/align][/td][td][align=center]/[/align][/td][td][align=center]19.129 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.2[color=black]线性方程、线性范围与检出限[/color]按照1.4.1配制标准系列,测定TCAA和ClO[sub]4[/sub][sup]-[/sup]的峰面积(S)和峰高(H),以S、H为纵坐标,以其质量浓度(C)为横坐标绘制标准曲线,进行线性回归。测定仪器30min的基线噪声[sup][9][/sup],以3倍基线噪声除以标准曲线的斜率(3N/b)计算TCAA和ClO[sub]4[/sub][sup]-[/sup]的最低检出限。其标准曲线的线性范围、回归方程、相关系数r(回归方程的截距、斜率和r均由仪器软件自动生成)、检出限列于表4。从表4可见,TCAA和ClO[sub]4[/sub][sup]-[/sup]的峰面积及峰高与其质量浓度均在0.10~3.0mg/L范围内呈良好的线性关系,相关系数r在0.9993~0.9998,TCAA和ClO[sub]4[/sub][sup]-[/sup]检出限(以峰面积计)分别为0.05mg/L和0.03mg/L。其中,2.0mg/L的TCAA和ClO[sub]4[/sub][sup]-[/sup]标准溶液色谱图见图1。[align=center]表4 标准曲线试验结果[/align][table][tr][td][align=center]组分[/align][/td][td][align=center]线性范围/mg/L[/align][/td][td][align=center]回归方程[/align][/td][td][align=center]相关系数/r[/align][/td][td][align=center]检出限/mg/L[/align][/td][/tr][tr][td=1,2][align=center]TCAA[/align][/td][td=1,2][align=center]0.10~3.0[/align][/td][td][align=center]S=37380C-1346[/align][/td][td][align=center]0.9994[/align][/td][td][align=center]0.05[/align][/td][/tr][tr][td][align=center]H=931C-10.51[/align][/td][td][align=center]0.9997[/align][/td][td][/td][/tr][tr][td=1,2][align=center]ClO[sub]4[/sub][sup]-[/sup][size=12px] [/size][/align][/td][td=1,2][align=center]0.10~3.0[/align][/td][td][align=center]S=74740C-2845[/align][/td][td][align=center]0.9993[/align][/td][td][align=center]0.03[/align][/td][/tr][tr][td][align=center]H=1329C-21.60[/align][/td][td][align=center]0.9998[/align][/td][td][/td][/tr][/table][align=center]图1 TCAA和ClO[sub]4[/sub][sup]-[/sup]的标准色谱图[/align]2.3 [color=black]共存物质的影响[/color]考察了F[sup]-[/sup]、Cl[sup]-[/sup]、NO[sub]2[/sub][sup]-[/sup]、Br[sup]-[/sup]、NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]、SO[sub]4[/sub][sup]2-[/sup]等7种常见阴离子对TCAA和ClO[sub]4[/sub][sup]-[/sup]测定结果的影响,结果见图2,从图2可知,在本试验条件下,[color=black]7种[/color]阴离子均在TCAA和ClO[sub]4[/sub][sup]-[/sup]前出峰,且F[sup]-[/sup]、Cl[sup]-[/sup]、NO[sub]2[/sub][sup]-[/sup]、Br[sup]-[/sup]的保留时间远小于TCAA和ClO[sub]4[/sub][sup]-[/sup],只有NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]、SO[sub]4[/sub][sup]2-[/sup](三者合并为一个峰)与TCAA的保留时间较为接近,为此考察了[color=black]10.0mg/L的[/color]NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][color=black],200.0mg/L的[/color]SO[sub]4[/sub][sup]2-[/sup][color=black]对[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup](均为1.0[color=black]mg/L[/color])测定结果的影响,[color=black]结果见图3,[/color]从图3可知,200倍量的SO[sub]4[/sub][sup]2-[/sup]、1[color=black]0倍量的[/color]NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][color=black]均不干扰[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup]的测定。[align=center]图2 TCAA和ClO[sub]4[/sub][sup]-[/sup]与常见阴[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]图[/align][align=center]图3 10mg/L的硝酸盐、磷酸盐和200mg/L的硫酸盐与1.0mg/L的TCAA和ClO[sub]4[/sub][sup]-[/sup]色谱图[/align]2.4 样品测定及回收率试验结果取水样按照1.4.2的方法测定TCAA和ClO[sub]4[/sub][sup]-[/sup]的含量,同时在水样中分别添加0.10、0.50和0.75[color=black]mg/L的[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup]并平行测定5次,计算加标回收率及测定结果的相对标准偏差(RSD),结果见表5。由表5可知,TCAA和ClO[sub]4[/sub][sup]-[/sup]的加标回收率分别为:90.0%~98.0%和91.6%~98.1%,测定结果的相对标准偏差分别为3.98%~5.00%和2.46~5.45%。其中,自来水加0.50[color=black]mg/L的[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup]色谱图见图4,从图4可知,TCAA和ClO[sub]4[/sub][sup]-[/sup]与基体组分能完全分离。[align=center]图4 自来水加标样品色谱图[/align][align=center]表5样品测定及回收率试验结果[/align][table][tr][td][align=center]样品名称[/align][/td][td][align=center][color=black]组分[/color][/align][/td][td][align=center][color=black]本底值/(mgL[/color][sup][color=black]-1[/color][/sup][color=black])[/color][/align][/td][td][align=center]加入量/(mgL[sup]-1[/sup])[/align][/td][td][align=center][color=black]测得量/[/color][/align][align=center][color=black](mgL[/color][sup][color=black]-1[/color][/sup][color=black])[/color][/align][/td][td][align=center]回收率/%[/align][/td][td][align=center]RSD/%[/align][/td][/tr][tr][td=1,2][align=center]自来水[/align][/td][td][align=center]TCAA[sup]-[/sup][/align][align=center]ClO[sub]4[/sub][sup]-[/sup][/align][/td][td][align=center]0.05[/align][align=center]0.03[/align][/td][td][align=center]0.10[/align][align=center]0.10[/align][/td][td][align=center][color=black]0.103,0.100,0.091,0.095,0.101[/color][/align][align=center][color=black]0.091,0.093,0.092,0.085,0.097[/color][/align][/td][td][align=center]98.0[/align][align=center]91.6[/align][/td][td][align=center]5.00[/align][align=center]4.73[/align][/td][/tr][tr][td][align=center]TCAA[sup]-[/sup][/align][align=center]ClO[sub]4[/sub][sup]-[/sup][/align][/td][td][align=center]0.05[/align][align=center]0.03[/align][/td][td][align=center]0.50[/align][align=center]0.50[/align][/td][td][align=center][color=black]0.461,0.425,0.455,0.479,0.430[/color][/align][align=center][color=black]0.464,0.491,0.438,0.430,0.472[/color][/align][/td][td][align=center]90.0[/align][align=center]91.8[/align][/td][td][align=center]4.98[/align][align=center]5.45[/align][/td][/tr][tr][td][align=center]井水[/align][/td][td][align=center]TCAA[sup]-[/sup][/align][align=center]ClO[sub]4[/sub][/align][/td][td][align=center]0.05[/align][align=center]0.03[/align][/td][td][align=center]0.75[/align][align=center]0.75[/align][/td][td][align=center][color=black]0.668,0.694,0.736,0.678,0.674[/color][/align][align=center][color=black]0.745,0.757,0.723,0.742,0.712[/color][/align][/td][td][align=center]92.0[/align][align=center]98.1[/align][/td][td][align=center]3.98[/align][align=center]2.45[/align][/td][/tr][/table]3 小结本工作建立了以SH-AP-2型阴离子交换柱为分离柱,以15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,流量为0.80mL/min等度洗脱抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水样中TCAA和ClO[sub]4[/sub][sup]-[/sup]的新方法。方法重现性良好,可在25min以内完成高氯酸盐、三氯乙酸的同时测定,简便快速,测定结果准确可靠,适用环境水样中TCAA和ClO[sub]4[/sub][sup]-[/sup]的同时测定。参考文献1)王会霞.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定水中亚氯酸盐、氯酸盐和高氯酸盐[J].中国卫生检验杂志,2015,25(19):3250-32522)张振城,于雪荣,单晓梅,等. 饮用水中高氯酸盐的[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]测定法[J].职业与健康,2018,34(1):40-433)GB5749-2022.生活饮用水卫生标准[s]4)夏演,解焕英,林鑫.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定饮用水中二氯乙酸和三氯乙酸研究[J].环境科学与管理,2020,45(1):142-1465)郭学谦,魏娜.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定饮用水中二氯乙酸及三氯乙酸[J].中国卫生检验杂志,2021,31(24):2982-29856)[color=#333333]HJ1050-2019[/color].[color=#333333]水质 氯酸盐、亚氯酸盐、溴酸盐、二氯乙酸和三氯乙酸的测定 [/color][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法[s]7)《水质分析大全》编写组. 水质分析大全[M]. 重庆:科学技术文献出版社重庆分社,1989:115-1188)许春向,邹学贤.现代卫生化学[M].北京:人民卫生出版社,2000:491-4929)国家质量监督检验检疫总局.中华人民共和国国家计量检定规程 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]:JJG823-2014 [s].北京:中国质检出版社,2014[/s][/s][/s]
请问专家,用HPLC分析蛋白多肽,流动相加入三氟乙酸作用是什磨?磷酸盐缓冲液可代替吗?谢谢!
哌啶和乙醇
有哪位朋友做过哌啶基哌啶的分析,能否跟我联系下,有一些问题想请教谢谢
[size=14px] [/size] [size=14px]丹参酮是中药丹参的功效物质,丹参酮I(Tanshinone I,Tan I)是丹参酮的一个亚类,具有芳香二萜醌的结构,具有抗菌和抗炎活性。然而,其过高的亲脂性,效价较弱,溶解度低、不稳定等特质,极大地限制了丹参酮I的应用。因此,建立有效的化学演化机制,开发更有效的丹参酮Ⅰ衍生物具有重要意义。哌啶是一种重要的饱和杂环支架,是美国FDA批准的药物中最常用的氮杂环,具有良好的药理特性。该团队将丹参酮Ⅰ和哌啶的骨架杂交,得到了一类新型有效的NLRP3炎症小体抑制剂。2023年2月14日,浙江大学药学院的崔孙良和王毅团队在J Med Chem(IF=7.3)上发表题为“Scaffold Hybrid of the Natural Product Tanshinone I with Piperidine for the Discovery of a Potent NLRP3 Inflammasome Inhibitor”的文章,通过骨架杂交策略得到了一系列具有NLRP3抑制活性的丹参酮Ⅰ-哌啶杂化物,相较于丹参酮Ⅰ,这些化合物在活性、选择性和类药性具有显著改善。其中化合物5j、12a和12d对IL-1β的分泌有较强的抑制作用,在脓毒症小鼠模型中也具有较好的治疗效果。机制研究表明,这些化合物可以阻断ASC的寡聚化,抑制NLRP3炎症小体的激活,且化合物5j可与NLRP3蛋白直接结合,对NLRP3蛋白具有显著亲和力。本研究发现了一种全新结构的丹参酮Ⅰ衍生物,为NLRP3炎性体抑制剂的开发提供了新的思路。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]1、设计合成了36种Tan Ⅰ-哌啶杂化物前期研究发现Tan Ⅰ中的醌结构是其主要药效团,不宜进行结构修饰。因此研究团队从呋喃结构入手,通过支架杂交的策略,利用哌啶合成出了5个系列 36个Tan Ⅰ的衍生物。为了提升反应活性,在引入哌啶骨架前,研究团队将Tan Ⅰ中的醌并呋喃部分活化为富电子的苯并呋喃。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]2、体外生物学评价Tan Ⅰ-哌啶杂化物抗炎活性前期研究发现Tan Ⅰ具有抗炎活性,而NLRP3炎症小体作为炎症反应的核心,被证明与多种炎症性疾病相关。因此,作者选用小鼠腹膜巨噬细胞(PMs)开展了一系列体外生物学评价,首先通过MTT法发现36种Tan Ⅰ-哌啶杂化物在4 μΜ浓度无明显细胞毒性,随后发现与Tan-I相比,化合物5d、5j、10c、10f、10g、12a、12d在2 μΜ浓度下更能抑制IL-1β分泌,其中化合物12d与经典的NLRP3抑制剂MCC950活性相当。综合构效关系结果发现引入氢键受体或亲水基团可提升抑制活性(5j、12a、12d),于是作者选用化合物5j、12a、12d作为进一步的研究对象。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]3、化合物5j、12a和12d阻断NLRP3炎症小体激活,是广谱抑制剂NLRP3炎症小体通路包含准备和激活两个阶段,准备阶段pro-IL-1β和pro-caspase-1的表达升高,而激活阶段IL-1β和caspase-1分泌增加。作者发现化合物5j、12a、12d可抑制IL-1β和caspase-1的分泌,而对pro-IL-1β和pro-caspase-1的表达没有显著影响,表明它们通过阻断激活阶段而不是准备阶段来抑制NLRP3炎症小体活化。此外,5j、12a、12d也可以抑制尿酸钠晶体(MSU)、尼日利亚菌素(Nig)刺激的NLRP3炎症小体激活,表明5j、12a和12d是针对NLRP3炎症小体激活的广谱抑制剂。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]4、Tan Ⅰ-哌啶杂化物5j/12a/12d可抑制ASC寡聚化,5j可直接结合NLRP3蛋白ASC寡聚化可促进caspase-1的活化,是NLRP3炎症小体活化的标志之一。作者进一步研究化合物5j、12a、12d抑制NLRP3炎症小体的作用机制,通过免疫荧光实验发现在添加化合物5j、12a、12d和阳性药MCC950时,ASC寡聚化形成的斑点显著减少,表明它们均可抑制ASC寡聚化。接着利用表面等离子体共振分析(SPR)和细胞热位移测定(CETSA)实验证明化合物5j和NLRP3存在直接互作。[/size] [size=14px] [/size] [size=14px]5、Tan Ⅰ-哌啶杂化物在脓毒症小鼠模型的体内抗炎评价接着作者对Tan Ⅰ-哌啶杂化物5j、12a、12d进行了成药性评价,发现它们相较于Tan Ⅰ有极大的改善。进一步开展体内抗炎效果评价,发现在LPS诱导的炎症性脓毒症小鼠模型中,化合物5j、12a和12d预处理可以显著降低IL-1β的释放,显著改善肺组织病理损伤,如肺泡壁增厚明显减轻,粒细胞数量和炎症浸润显著减少。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]总结该研究通过骨架杂交策略得到了一系列具有NLRP3抑制活性的丹参酮Ⅰ-哌啶杂化物,与原型丹参酮Ⅰ相比,这些新的结构化合物在效力、选择性和类药性方面有显著改善,其中化合物5j、12a和12d对IL-1β的分泌具有高抑制活性。机制研究表明,这些化合物可以阻断ASC的寡聚化,抑制NLRP3炎症小体的激活,同时SPR和CETSA显示化合物5j可与NLRP3蛋白直接结合。体内研究表明它们对脓毒症小鼠模型具有较好的治疗效果,研究开发出了一种丹参酮I的简单结构修饰策略并提供了一类新的有效的NLRP3炎症小体抑制剂。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size]
新版生活饮用水GB/T5750,测定生活饮用水中氯酸盐,溴酸盐,亚氯酸盐,二氯乙酸,三氯乙酸,其他项目均正常,唯独亚氯酸盐没响应?有做过的老师请教下呀
臭氧对矿泉水消毒的过程中,会将水体中自然存在的溴化物氧化为对人体有害的溴酸盐,溴酸盐是被国际癌症研究机构定为2b级潜在致癌物;国家标准GB 8537-2008规定瓶装水中的溴酸盐含量不得高于10μg/L,并且要求瓶装水的包装上必须标注溴酸盐的含量。网上找了个方法 有谁试过,结果如何?:默克密理博饮用水溴酸盐检测解决方案 碘化钾GR(1.05043.0250) 3,3二甲基萘啶(1.03122.0001) 乙酸100%GR(1.03122.0001) 高氯酸70-72%GR(1.00519.1000) 高纯水GR(1.16754.9010) 50mm方形比色皿(1.14944.0001) 0.45μm滤膜(测试浑浊样品时用) 所需测量仪器: Spectroquant?NOVA-Photometer(NOVA60/60A) Spectroquant?PharoSpectrophotometer(Pharo100/300) 测试试剂配置方法: 试剂1: 将1g的碘化钾溶于100ml的高纯水中,将此溶液避光室温密闭保存,有效期1年左右。 试剂2: 将0.125g3,3二甲基萘啶溶于25ml加热后的乙酸(温度不能超过50°C),直至二甲基萘啶完全溶解。该溶液避光密闭保存可长期使用,放在冰箱里保存可以延长使用寿命。建议尽量使用新配制的试剂,以保证分析质量。http://info.edu.hc360.com/2011/12/091516495507-2.shtml
2010年版药典氟哌啶醇片红外鉴别方法是:取本品粉末适量(相当氟哌啶醇约50mg),用20ml三氯甲烷分次研磨使溶解,过滤,取滤液水浴蒸干,残渣减压干燥后,压片,与标准图谱比较. 因为氟哌啶醇易溶于三氯甲烷,我在做的过程中就没有剥片;另氟哌啶醇对光 热具不稳定性,滤液采用60度水浴蒸至近干,采用药典原料项下的方法干燥:即60度减压干燥,约5小时,但取出压片时发现它的性状为半固体,压出的片透明度不好,还粘模具,没法做! 会不会是辅料有影响呢?想请教一下,如何改进我的试验,压制一个好的片子?
借用xuanleer的帖子提一下几个疑问:不知道从何说起,我们在做某些碱性化合物检测时,购买的标准品通常是盐酸盐、硫酸盐、草酸盐之类的,如下面的糠氨酸(二盐酸盐)以及莱克多巴胺盐酸盐、四环素盐酸盐等等,疑问:(1)想问下大家这类目标化合物在进(HPLC、GC)色谱分析时,(色谱峰)是以游离碱的形式(糠氨酸、莱克多巴胺、四环素)存在还是以游离碱盐酸盐的形式存在?(2)这类化合物不少选用酸性环境下进行HPLC/LC-MS分析,其原因是否是让目标化合物以游离碱的形式(糠氨酸、莱克多巴胺、四环素)存在? (3) 如果第(2)个问题是对的,哪进GC分析时得到色谱峰是以何种形式存在的?也是游离碱吗?欢迎各位老师专家解答啊!顺祝大家节日快乐!参考资料如下:糠氨酸的鉴定适用于《NYT 939-2005 复原乳的鉴定》,具体见附件。色谱柱:LAEQ-462572 CNW Athena C18-WP 液相色谱柱,4.6*250mm,5um流动相:A=0.1%三氟乙酸水溶液;B=0.1%三氟乙酸乙腈平衡:A:B=99:1梯度:0min:99%A/1%B,25min:79%A/21%B检测波长:280nm流速:1ml/min进样浓度:2ppm柱温:室温标准品:CDDD-SC494-10MG,糠氨酸(二盐酸盐),品牌 NeoMPS,现货供应。参考:http://bbs.instrument.com.cn/shtml/20120903/4223471/
借用xuanleer的帖子提一下几个疑问:不知道从何说起,我们在做某些碱性化合物检测时,购买的标准品通常是盐酸盐、硫酸盐、草酸盐之类的,如下面的糠氨酸(二盐酸盐)以及莱克多巴胺盐酸盐、四环素盐酸盐等等,疑问:(1)想问下大家这类目标化合物在进(HPLC、GC)色谱分析时,(色谱峰)是以游离碱的形式(糠氨酸、莱克多巴胺、四环素)存在还是以游离碱盐酸盐的形式存在?(2)这类化合物不少选用选型环境下进行HPLC/LC-MS分析,其原因是否是让目标化合物以游离碱的形式(糠氨酸、莱克多巴胺、四环素)存在? (3) 如果第(2)个问题是对的,哪进GC分析时得到色谱峰是以何种形式存在的?也是游离碱吗?欢迎各位老师专家解答啊!顺祝大家节日快乐!参考资料如下:糠氨酸的鉴定适用于《NYT 939-2005 复原乳的鉴定》,具体见附件。色谱柱:LAEQ-462572 CNW Athena C18-WP 液相色谱柱,4.6*250mm,5um流动相:A=0.1%三氟乙酸水溶液;B=0.1%三氟乙酸乙腈平衡:A:B=99:1梯度:0min:99%A/1%B,25min:79%A/21%B检测波长:280nm流速:1ml/min进样浓度:2ppm柱温:室温标准品:CDDD-SC494-10MG,糠氨酸(二盐酸盐),品牌 NeoMPS,现货供应。参考:http://bbs.instrument.com.cn/shtml/20120903/4223471/
用的是赛默飞ICS 1100[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url],AS27分析柱和AG27保护柱;测定条件是20mM KOH淋洗液、等度,抑制器电流50mA ,流速是1ml/min,定量环350微升。一起测定的氯酸盐可以做,同样条件下做溴酸盐、二氯乙酸、三氯乙酸都可以,只有亚氯酸盐的进样浓度在20mg/L一下时都找不到峰。不知道是什么原因,麻烦各位大神帮忙分析分析。
请问高手,在测定水中亚硫酸盐的过程中,加入冰乙酸是起什么作用呢?还有呀,有没有测定固体物质(如,石膏)中的亚硫酸盐含量的方法呢?希望高手解惑,谢谢先~~
现在要做哌啶,N-甲酰基哌啶的含量,都是微量的,用了DB-624,DB-waxetr的测1000ppm的峰形都不好,请问有推荐色谱柱和方法么
请问哪位用过流动注射分析仪测硝酸盐,我用乙酸提取硝酸根,但是提取液和显色剂反应后怎么也不显色,试剂都检查过了没有问题,是不是乙酸影响反应呀,请高人指点一下,谢谢!