WOB呈弱酸性还是弱碱性?
【题名】:用弱酸性硫脲溶液浸出硫化银【全文链接】: https://www.cnki.com.cn/Article/CJFDTOTAL-ZXJS503.016.htm
一种黄色粉末,易溶于水,弱酸性,主要成分为铝,请问这样的物质是什么?
强极性弱酸性(pka9.4)的化合物可以用什么spe小柱萃取?
做弱酸性物质时,采用的是ESI源,负离子模式,为了加强其离子化,一般加的三乙胺的量是多少?
化学实验中一旦眼内溅入弱酸性化学药品,立即用( )缓缓彻底冲洗。 A水 B弱碱 C弱酸
有奖问答’对错题:真丝服装洗涤时冷水手洗,不可用力搓洗,不可使用碱性皂液,易用弱酸性洗涤液,阴凉滴干?( )
单位很多化验员不习惯用酸式滴定管,所以很多弱酸性的标准溶液也选择碱式滴定管,这样行不行,大家怎么看呢?
如题,欢迎各位讨论啊http://simg.instrument.com.cn/bbs/images/brow/em09502.gif一、水质标准中pH值指标 我国GB5749生活饮用水卫生标准:6.5-8.5;GB17324瓶装饮用纯净水:pH5.0-7.0。这些指标和发达国家一致。(饮用水的酸、碱性在化学上以pH值表示,pH=7为中性,pH7为碱性。) 符合标准的水都可放心饮用,不存在喝碱性水还是喝酸性水好的问题。
周末跟父母出去玩,口渴的时候去买水,妈妈说“不要买怡宝,买农夫山泉!” 我问:“为啥?” 我妈:“怡宝是纯净水,喝了会形成酸性体质” 我:“……” 喝纯净水真的会形成酸性体质?据说纯净水呈弱酸性,缺乏矿物质和矿物元素,饮用后会形成酸性体质,并导致矿物质等对人体有益的元素流失和析出,降低免疫力,引发疾病。但其实在医学上并没有“酸性体质”或“碱性体质”这种说法。如果一个人的pH值低于7.35的话,实际上应该发生酸中毒,正常人没有疾病的情况下,PH值很难达到这样的水平。实际上,人体内有一个保持酸碱平衡的稳定系统——酸碱缓冲体系,这个系统会自动调节人体内的酸碱度。不管是弱碱还是弱酸性的水,其中酸碱物质的含量非常低,与人体酸碱缓解系统相比,只是沧海一粟,并不能改变人体的酸碱度。另外,碱性水、离子水改变酸性体质等说法,也是不成立的。胃酸的pH值是0.9-1.5,酸性极强,即便是喝下所谓弱碱性的水,到胃里已经彻底酸化了。 综上所述,并没有科学证据表明纯净水对人体可以形成危害,大家可以放心饮用。
记得以往蒸馏水都是弱酸性的,有时pH都能到5点几,这回是7点几,这个正常么?
如题,大家快来启示俺一下
(1)淀粉指示剂的性质及注意事项 a 温度升高可使指示剂灵敏度降低。 b 若有醇类存在,亦降低灵敏度。 c 直链淀粉能与I2结合成蓝色络合物;支链淀粉只能松动的吸附I2,形成一种红紫色产物。 d I2和淀粉的反应,在弱酸性溶液中最为灵敏。若溶液的pH9,则I2因生成IO-而不显蓝色。 e 大量电解质存在能与淀粉结合而降低灵敏度。 f 若配成的指示剂遇I2呈红色,便不能用。配制时,加热时间不宜过长,并应迅速冷却以免其灵敏性降低。淀粉溶液易腐败,最好于临用前配制 各位老师,C中的淀粉分支链和直链,这两种淀粉有什么区别啊 还有F中的 为什么指示剂遇碘呈红色就不能用啊,求原理
间接碘量法测定时,下列注意事项不妥的是( )。 A、滴定时,为加快反应,应先加热 B、I-与含氧性氧化剂作用时,要加酸,KI过量 C、Na2S2O3与I2反应在中性或弱酸性溶液中进行 D、指示剂淀粉在滴定近终点时加入
甲基磺酸可以用酚酞滴定吗?为什么用酚酞滴定时候溶液变得很浑浊。。。非得用甲基红滴定吗?? [b]问题补充:[/b]我意思是为什么用酚酞做指示剂时候溶液会变浑浊。。。肯定用氢氧化钠滴定啦。。酚酞弱酸性啊。。
一种物质是不是肯定是:中性,碱性(弱碱性),酸性(弱酸性)中的其中一种?比如莠去津在中性,弱酸或弱碱中稳定,那它是什么性的?中性,酸性(弱酸性)还是碱性(弱碱性)的呢?
(1)基本原理: 样品经处理后,试样中的二价钴离子在弱酸性溶液中(pH=5~6)与亚硝基红盐反应生成红色络合物,其颜色的深度与钴含量成正比,用目视比色法进行钴含量的测定,浓度越高,颜色越深,根据光的吸收定律----朗泊-比耳定律,由已知标准溶液浓度对应的吸光值求算出未知浓度: A=K*b*C(2)仪器及试剂:7200型分光光度计 1.0cm比色皿 100 ml容量瓶 5.0 ml、10.0 ml吸量管 0.50ml吸量管250ml烧杯(带表面皿)电炉10%乙酸-乙酸钠缓冲溶液0.2%亚硝基红盐指示剂1:1硝酸 (3)操作步骤:用0.5ml吸量管准确吸取0.2ml料液置于1号250毫升烧杯中,2号烧杯不加料液(做试剂空白),先各加10ml乙酸-乙酸钠缓冲溶液,置于高温电炉上加热煮沸,后置于低温电炉加入亚硝基红盐指示剂5ml,再煮1~3分钟,最后加入1:1硝酸10ml煮1~3分钟,取下冷却,转移至100ml容量瓶中,用蒸馏水定容至100毫升的刻度,摇匀,放置10分钟左右(天热可放置5分钟左右),用1.0 cm比色皿,以蒸馏水做参比,在530nm波长处进行比色,记下空白样的吸光值A空,样的吸光值A样,当钴标浓度为128.8ug/ml时,其吸光值为0.265。一般很稳定(4)计算公式:C(Co2+)=(A样-A空)* 0.1288÷0.265 单位: 克每升C(Co2+)------料液中Co2+的含量,单位:克每升A样-------样的吸光值A空-------空白的吸光值V取样-------取样量(即毫升数)0.1288-----钴标浓度, g/L0.265---钴标浓度为128.8ug/ml时,其吸光值为0.265
C18反相色谱柱分析混合物,其中既含有弱酸类物质又含有弱碱类物质,请问流动相缓冲液应如何配制?
一元弱酸的线性滴定ppt[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=43465] 一元弱酸的线性滴定.part1.rar [/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=43466]一元弱酸的线性滴定.part2.rar[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=43468]一元弱酸的线性滴定.part3.rar[/url]
虽然教材中都可查到酸碱常数,但当你手里没有书时,或书中的常数太少时,可以从附件的电子表格中直接查到你要的数据。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=147559]弱酸弱碱离解常数[/url]
弱酸氢离子浓度最简计算公式里面有两个条件:1.K(HA)*c20K(水),可忽略水的影响2.C/K(HA)500,可忽略酸的离解。于是得出[H+]=(K*C)1/2忽略这二个条件,那么计算得到的氢离子来自哪里?谢谢各位指点,我大脑现在实在是不开窍了。[em0801]
[size=4]此计算器可以计算一元或多元弱酸、弱碱溶液的PH值(极稀的情况没有考虑在内,只考虑了用近似式计算的公式)。 启动界面[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004230838_214172_1644756_3.jpg[/img] 一元弱酸请代入浓度C和pKa,一元弱碱请代入浓度C和pKb;多元弱酸碱只需代pKa1或pKb1即可。[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004230836_214171_1644756_3.jpg[/img] 代入数据后,直接点击下面的单选框,若计算的是弱酸则点左边,弱碱则点右边,结果就出来了(看黄色加亮部分),对应的公式和条件见右边的图形框,PH值见上面的数字框。[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004230839_214173_1644756_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004230840_214174_1644756_3.jpg[/img]请注意:解压后,务必将文件夹放在D:根目录下,见下图(可执行文件可以放在任意地方,但其中的图片不能变路径,不然,公式就无法显示了)[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004230835_214169_1644756_3.jpg[/img]请多指教[img]http://simg.instrument.com.cn/bbs/images/brow/em09511.gif[/img][img]http://simg.instrument.com.cn/bbs/images/brow/em09511.gif[/img][img]http://simg.instrument.com.cn/bbs/images/brow/em09511.gif[/img][/size]
最近购置一瓶溶液,PH=4,用来做絮凝沉淀的,在需絮凝水样中无论加多少这种药水,絮凝后水样都是中性,很想知道这种药水可能含有哪些特殊金属盐物质,会不会对环境造成污染,对人体有无毒性,望有这方面经验的伙伴们指点指点,谢过了!!
[color=#3e3e3e]泡茶首选纯净水:纯净水是经纯化处理后的水,呈弱酸性,去除了矿物质,也常被称为“软水”。在弱酸性的条件下,茶叶中的茶多酚比较稳定,有助于保持其活性;没有矿物质的影响,茶的汤色、香气和滋味较好。[/color]
说0.145克的弱酸用0.100浓度的NaOH来滴定。给了一组数据,就是随着NaOH体积添加的变化,溶液的pH值。是这样对应的0 2.885 4.1510 4.5812.5 4.7615 4.9320 5.3624 6.1424.9 7.1525 8.7326 11.2930 11.96左边是NaOH的体积,右边是pH.问说,弱酸的ka和pka值是多少?没有告诉酸的体积。
亲水性色谱是正相色谱的一个变种。 HILIC HPLC Column亲水性色谱柱是以超纯硅胶为基质,表面键合有二氧化硅(silica,弱酸性),氰基(cyano,弱酸性), 二羟基(diol,中性),二丙基乙酰胺基(valpromide,弱碱性),丙基酰胺基(Venusil,弱碱性),氨基(amino,弱碱性), 吡啶基(Pyridine,弱碱性),咪唑基(Imidazole,弱碱性)等亲水基团的极性固定相。请问大家它与正相柱有什么区别都体现在什么地方?
一直以来,经常有客户对纯水的PH提出质疑,问题通常有2类,一是测得RO水偏弱酸性(6.0左右),二是测得RODI水(甚至已经达到10M以上的电阻率)亦呈酸性(PH=6.0左右)。首先,RO水偏弱酸性是正常的,凡是经由RO技术获得的初级纯水基本都呈弱酸性,这是由于自来水中溶解的CO2不能被去除导致的,原理如下:2CO2+2H2O==HCO3-+CO32-+3H+CO2在水中溶解,存在上述化学平衡,由于CO2跟水分子大小相当,RO膜无法去除气态的CO2,但HCO3-和CO3--却可以被绝大部分去除,产物的大幅度减少会导致化学反应向右移动,另一产物H+浓度会增加,从而导致RO产水的PH下降,体现弱酸性。因此,RO水在某些应用范围会收到限制,但是它仍然符合国家实验室用水标准的三级要求,在CLASS III标准里,允许纯水的PH在5.0-7.5之间,因此在所有要求三级水的应用领域,RO水不乏是理想的选择,RO方法也是公认的纯化手段。受限制的应用包括严格要求PH的领域,比如工业冷却水,弱酸性的RO水有诱发金属管道锈蚀的风险,因此我们通常使用软化水当作冷却水,成本也低,PH也有保障,对于精度很高的设备,也有要求使用10M以上的水做为冷却水的,这当然不用考虑PH问题了(它一定是中性的)。对于水质在10M以上的高纯水而言,测得的PH是酸性的结论是错误的,这与RO水的酸性测量结果完全不同,这个结果是一个典型的方法错误导致。高纯水的PH测量需要特殊的手段和仪表,一般的PH计都是设计用来测试含盐量很高的电解质溶液的,而不适合测量导电性很差,而且极度不饱和的超纯水(极易吸收外界杂质)。如果电阻率仪可靠,当然是无须做这个无谓的PH测量的。正如在实验室用水的国家标准(GB6682-92)中指出的,对一、二级水不主张测量pH一样,超纯水就更难准确测量了。 附:中国国家标准 分析实验室用水规格和实验方法GB/T6682-2008名 称一 级二 级[font='Times New Roman
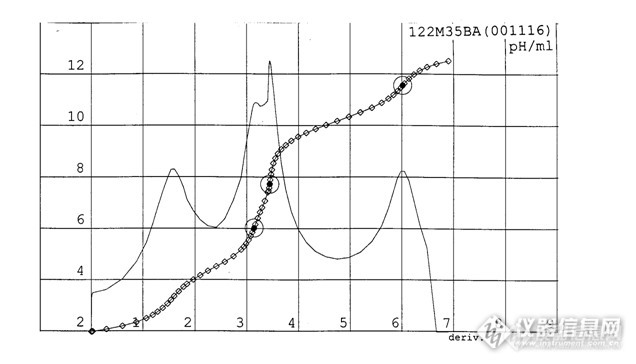
脱碳液中硼酸、弱酸测定法1 适用范围 本方法适用于CO2脱除系统中碳酸盐溶液中的弱酸、硼酸的测定。2 方法概要自动电位滴定法,以乙腈为溶剂,将样品加入足量的盐酸酸化后,在氮气置换条件下,用氢氧化钠标准溶液进行滴定,自动电位滴定仪根据pH值变化情况自动识别各化学计量点。3 试剂及材料3.1 盐酸标准溶液:0.5mol/L3.2 氢氧化钠标准溶液:0.5mol/L3.3 乙腈:分析纯4 仪器及设备4.1 自动电位滴定仪:带两套加液设备,定量管分度0.01mL,长寿命pH计,250mL滴定杯4.2 平顶加液器:1mL~60mL4.3 分析天平5 试验步骤5.1 向滴定杯中加入约2.5g样品,称准至0.1mg。5.2 用平顶加液器向滴定杯中加入50mL乙腈。5.3 通过电位滴定仪人工控制功能加入过量的盐酸标准溶液。注意,根据碳酸钾及碳酸氢钾含量的滴定体积,加入过量盐酸(3.1),如碳酸钾及碳酸氢钾含量滴定消耗19mL盐酸,可加入过量3mL,即22mL盐酸进行酸化。5.4 将滴定杯放在滴定位置,开启氮气置换溶液。选择正确方法,输入样品质量,用氢氧化钠标准溶液(3.2)开始滴定。乙腈蒸气为有害气体,滴定要在适宜的通风橱中进行。在使用乙腈的时候一定要小心,要使用合适的防护设备。5.5 仪器滴定第一化学计量点pH范围应在2~5之间,对应消耗的标准溶液体积计为V1;第二化学计量点pH范围应在5~9.5之间,对应消耗的标准溶液体积计为V2;第三化学计量点pH范围应在9.5~13之间,对应消耗的标准溶液体积计为V3。分析结束,检查分析曲线和各化学计量点之间对应滴定体积无异常。5.6 输入钒含量,进行数据再处理后读取分析结果。曲线1如下:典型的滴定曲线 (针对长期使用后的贫液),弱酸浓度影响显著。[img=,636,364]http://ng1.17img.cn/bbsfiles/images/2017/09/201709032131_01_2166779_3.png[/img][img=,648,365]http://ng1.17img.cn/bbsfiles/images/2017/09/201709032131_02_2166779_3.png[/img][img=,690,421]http://ng1.17img.cn/bbsfiles/images/2017/09/201709032131_03_2166779_3.png[/img]7 精密度7.1 重复性 同一实验室、同一操作员用同一试验方法与仪器,对同一试样重复做两次试验,所得结果差值不大于其算术平均值的5%。8 结果报告 分析结果保留两位小数,取单样分析结果作为报告值。
哪位达人有抑制法和非抑制法测定弱酸根离子的对比试验数据,本人想了解弱酸根离子被抑制为弱酸后其响应信号的减少与背景信号的减少哪个更显著,其信噪比和灵敏度怎么变化,非常感谢!
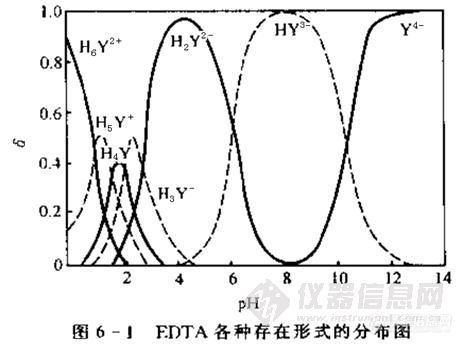
弱酸弱碱溶液的型体分布分数及其应用 弱酸、弱碱及其盐溶液由于存在部分离解(电离或水解)的多级可逆平衡,溶液中弱酸、弱碱的各种成分(型体)都可能存在,在指定条件下(指定PH值),各型体的浓度相对大小如何计算,谁是主体成分,谁是次要成分,浓度比值如何,在化学分析中还是很有实际意义的。 一、分布分数的定义和计算式 以磷酸溶液为例。 磷酸溶液中存在磷酸的三级平衡和水的离解平衡,磷酸体系存在四个型体,即H3PO4、H2PO4-、HPO42-、PO43-,(n元弱酸、n元弱碱具有n+1个型体)存在三个与磷酸根相关的化学平衡。理论上讲,不作任何近似时,溶液中四种型体都存在,而且,它们都有一定的浓度比,不过像磷酸根、磷酸一氢根都型体,相对浓度(即后述的分布分数)就极其小,而磷酸、磷酸二氢根的相对浓度(分布分数)则相对较大。分析化学中将某型体的平衡浓度与体系的总浓度(本例中,指四种含磷酸根的型体浓度之和)之比称作分布分数。 符号约定(分析浓度、标签浓度C): http://ng1.17img.cn/bbsfiles/images/2010/10/201010272011_254486_1644756_3.gif 磷酸平衡体系中四种分布分数的定义式和计算式如下http://ng1.17img.cn/bbsfiles/images/2010/10/201010272012_254487_1644756_3.gif每个分布分数虽然定义为浓度比,但导出的公式表明,分布分数只与氢离子浓度有关,即只是pH值的函数,这表明:任何弱酸弱碱溶液,平衡时,只要pH一定,溶液中各成分(型体)的浓度比是确定的值,而与配制时原浓度的大小没有关系。分布分数的计算式虽然看似复杂,但仍有一定的书写规律,即对于n元弱酸或n元弱碱,1、分母含有n+1个单项式,正好与溶液含n+1个成分(型体)相对应;2、分母为氢离子浓度幂与逐级酸常数的乘积之和,氢离子浓度由n次方依次降幂到0次,而Ka逐渐地连乘至所有常数之积,每次递增一个常数,氢离子浓度减少一次方;3、比较各分布分数的分子可知,将分母中的某一项放到分子上就是某一个型体的分布分数,而且,从n到Ka1Ka2、Ka3,依次对应于n元正酸,离解1个氢、2个氢.....不含氢酸根的酸(碱)型体;4、四个分布分数相加,其值为1. 根据以上的规律,可以直接写出HAc及醋酸盐溶液的两个分布分数为 http://ng1.17img.cn/bbsfiles/images/2010/10/201010272014_254488_1644756_3.gif 又如,对于碳酸、碳酸氢钠、碳酸钠等其他碳酸体系溶液,具有如下的三个分布分数: http://ng1.17img.cn/bbsfiles/images/2010/10/201010272015_254489_1644756_3.gif 需要说明的是:定义式中分母的浓度项并未规定为碳酸(醋酸),你可以表示为实际配制时的物质形式,如醋酸钠,后一例中碳酸钾、碳酸氢钠等,都是可以的。它只表示该体系中各型体的总浓度(即分析浓度)。另外,分布分数的计算式也可以表示成用和Kbi表示的形式,因为计算结果都相同,因此,只需记一种表示式即可。例如,对于氨-铵根体系,两个分布分数可以用氢离子,也可以用氢氧根离子浓度表示,其计算结果是相同的,见下面的恒等式: http://ng1.17img.cn/bbsfiles/images/2010/10/201010272017_254490_1644756_3.gif (根据水的离子积关系和Ka与Kb换算关系可以证明上面的恒等式是成立的)二、分布分数的图解方法分布分数随着pH变化而变化,它们是PH值的函数,可以用作图的方法来讨论它们之间的变化规律,下图是磷酸体系的分布分数图,共有四条,每一条对应于一个型体的分布分数曲线: http://ng1.17img.cn/bbsfiles/images/2010/10/201010272019_254491_1644756_3.jpg可以看出,1、磷酸根和磷酸的曲线是单向变化的,pH增大,磷酸的分布分数减小(指pH0-4区间),磷酸根的分布分数增大(指PH10.5-14