您好!想请教蛋白酶酶解糖蛋白的具体问题,蛋白酶在酶解糖蛋白的过程中是否与糖蛋白上的糖链构象有关系?有相关方面的书籍或者文献可供参考吗?谢谢
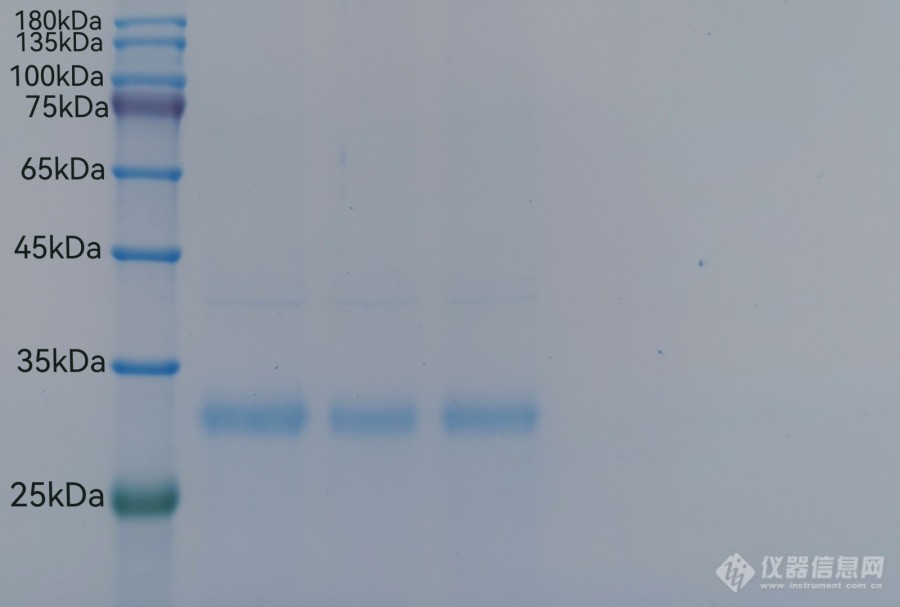
提取纯化了一种植物糖蛋白,凝胶电泳之后分别对蛋白和多糖进行染色,在25-35kDa有一条带是糖蛋白,但是多糖的条带有很严重的拖影,是因为物质不纯吗,还是这种电泳的方法不适用于多糖?[img=,690,465]https://ng1.17img.cn/bbsfiles/images/2022/07/202207141602541824_6299_5405797_3.jpg!w690x465.jpg[/img][img=,690,470]https://ng1.17img.cn/bbsfiles/images/2022/07/202207141603025571_1576_5405797_3.jpg!w690x470.jpg[/img]
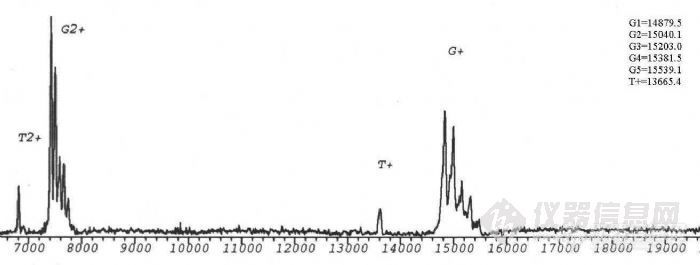
生物质谱在糖蛋白结构分析中的应用项目完成人:桑志红 蔡 耘项目完成单位:国家生物医学分析中心 随着人们对糖蛋白参与生命活动机理的日益深入了解,对天然糖蛋白及重组糖蛋白类药物的分析越来越受到重视。重组糖蛋白类药物的质量控制更是直接关系到药物的疗效及至人类的健康。九十年代以来,随着带有反射功能的基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF-MS)和纳升电喷雾串联质谱(nano-ESI-Q-TOF)等具有软电离方式的现代质谱 技术的发展,质谱以其高灵敏度和强有力的分析混合物的能力,提供了生物大分子的分子量、序列、一级结构信息以及结构转换、修饰等方面的信息,使糖基化分析有了重要的进展。 通常研究糖蛋白的方法是把蛋白链上的寡糖切下来,分别研究蛋白部分和寡糖部分的结构,因此无法研究与两部分共同相关的结构问题,也不能区分不同糖基化位点上切下来的寡糖。自90年代初,国外有人开始用质谱法研究糖蛋白的结构,同时描述了各个位点的不均一性。我们用建立的现代生物质谱技术研究糖蛋白一级结构的方法,将其应用与基因重组糖蛋白的结构分析。为糖蛋白结构分析及基因重组糖蛋白类药物的质量控制提供新的手段。一、 生物质谱研究糖蛋白结构方法的建立实验所用仪器为:1.德国BRUKER 公司的REFLEXIII型基质辅助激光解吸附电离飞行时间质谱仪,N2激光器,波长337nm,线性飞行距离150cm,加速电压2kv。2.英国Micromass 公司Q-TOF型电喷雾串联质谱仪。源温80°C,气体流速40L/h,枪头电压650V,检测频率2.4S,氩气碰撞池压力6*10-5mbar。1. 基质的选择,在MALDI-TOF-MS分析中,基质起着相当重要的作用。不同的基质对不同类的物质响应不同,a-氰基-4-羟基肉桂酸用于测定糖蛋白核糖核酸酶B效果相对较好。2. 糖蛋白分子量的测定,糖蛋白核糖核酸酶B由124个氨基酸组成,在34位Asn处连有一个高甘露糖型N-糖链。由于糖链的微不均一性,与普通蛋白质及核酸不同,其分子离子峰在MALDI-TOF-MS 质谱图上表现为一簇峰,各峰之间约相差一个糖基。正是由于这种微不均一性,使得其分子离子峰变宽,灵敏度降低。糖链分子量越大,峰越宽,灵敏度越低,所以一般只有糖链较短,蛋白的质量不太大的糖蛋白才能测定其平均分子量。用MALDI-TOF可直接测定糖蛋白核糖核酸酶B的平均分子量为 15208.6Da。http://ng1.17img.cn/bbsfiles/images/2011/03/201103211511_284179_1604317_3.jpg3. 糖含量的测定,采用O聚糖酶及内糖苷键酶F分别作用于核糖核酸酶 B,只有内糖苷键酶F能够是其分子量发生变化,表明核糖核酸酶B分子中不存在O-连接糖链存在着N-连接糖链。内糖苷键酶F切断N-糖链五糖核心最内侧的GlcNAc-GlcNAc糖苷键,得到含一个GlcNAc的肽链,减去GlcNAc,可以计算出准确的肽链分子量T=13695.6,与糖蛋白平均分子量之差为糖链的平均分子量G=1513.4,平均糖含量为:(糖链大小/糖蛋白分子量)×100%=9.95%。4. 糖基化位点的确定,研究糖基化类型及糖基化位点的策略:采用蛋白酶酶解与糖苷内切酶酶解相结合的方法,通过酶切前后含糖肽片的位移,结合网上数据库检索,可以确定糖基化类型和糖基化位点。以不同类型的糖苷内切酶作用于糖蛋白(N-糖苷键酶或O-糖苷键酶),在MALDITOF-MS 上观察其质量的变化,可以直接确定糖蛋白中是否含有响应类型的糖链,这是我们确定糖蛋白中糖苷键类型的基础。我们采用先将核糖核酸酶B还原烷基化,加Glu-C酶切,产物再用内糖苷肩酶F酶切,可观察到含糖肽段出现位移,将核糖核酸酶B的肽质量指纹图进行数据库检索,证实发生位移的肽段中含有N-糖链特异连接位点,由此确定34位Asn为糖基化位点。另外我们采用内糖苷键酶F及肽-N-聚糖酶F两种酶进行差位酶切法对含糖肽段进行验证,两种酶酶切后分子离子峰的差值除以GlcNAc的质量,结果就是N-糖基化位点的个数5. 质谱测定氨基酸序列, 我们对核糖核酸酶B肽质量指纹谱中的含糖肽段进行了串联质谱测定,首先在一级质谱图中选择离子4972.23,在串联质谱的碰撞活化室以氩气与其碰撞产生碎片,从碎片的质荷比推算出此肽片中的一段氨基酸序列,检索结果为核糖核酸酶B,从而判断其理论序列是否一致。6. 糖链结构的研究,凝集素对糖肽的亲和提取,进一步分析糖肽序列及糖链结构的关键是含糖肽段的提取。核糖核酸酶B中糖链为高甘露糖型,我们选用对其有特异性吸附的伴刀豆球蛋白对其进行提取利用这种简捷的亲和质谱的方法,对糖肽段进行了分析。建立了亲和质谱分析糖肽类物质的方法,为今后糖肽序列分析及糖链结构分析奠定了基础。二、基因重组糖蛋白人促红细胞生成素(rhEPO)的结构分析。 利用以上建立的方法,我们对样品重组人促红细胞生成素进行了分析,断定此样品为非完全糖基化,样品中只存在N-连接的糖链,无O-糖链。应用酶切法用肽-N-聚糖酶处理后,得到两个含糖肽段,进行数据库检索,测得38位及83位为N-糖基化位点,与文献报道相符,结果可靠。因此,该项课
为什么大肠菌群MPN法,GB4789.2-2003是用9管的乳糖胆盐,而GB5750做水时候要用15管法的乳糖蛋白胨,而改版后的新GB4789.2008.2中改用LST,其与乳糖胆盐相比又有什么优势呢?
请教各位老师,从一个资料上看说乳糖蛋白胨中的乳糖不能换成葡萄糖是因为葡萄糖经发酵产酸过多使PH达到4.5,使大肠杆菌死亡!这个说法对吗?还有大肠菌群的生长ph范围是多少。有根据吗?
最近在做生姜糖蛋白的提取纯化,看了很多文献,都要用到DEAE-52纤维素纯化,想问一下大家收集管数应该按照什么计算,是按照柱体积吗,多少个柱体积为一管呢?目前洗脱条件如下:上样浓度50mg/ml,上样量1ml,柱子规格16mm×20cm,洗脱液0.2mol/L Tris缓冲液(含0.1mol/LNaCl),pH7.8,每10ml一管进行收集,共收集50管,在1-5管处有蛋白和多糖共同的洗脱峰。
做粪大肠菌群前,将倒管放到试管中,加入乳糖蛋白胨10mL,之后我一看,倒管里面几乎都是有气泡的,要颠倒试管好几遍才能把倒管中的气泡赶走。之前我都没看,这样就是说我之前做出来的阳性都有可能是假阳性啦?
乳糖蛋白胨灭菌完放在室内不放冰箱可以保存吗
乳糖蛋白胨的培养基,是需要自己培养还是买 成品?成品是否需要 检测纯度之类的???
我今天已经把装有乳糖蛋白胨的培养基115[size=2]℃[/size]20min高压灭菌好了,但样品明天才来,那我这培养基可以放到明天才用吗?
PAD对糖蛋白水解以后释放出的氨基酸和单糖都有响应,如何在进样前分离氨基酸和单糖?请高手指教。
这里有一个检测,多糖蛋白粉785的激光器波数50-4 000想问下这边有机构可以帮忙检测么?价格是怎样的,以后量大,可以找我合作。
位于HIV病毒表面的糖蛋白gp120可让人体B免疫细胞失去活性,这是《自然—免疫学》Nature Immunology上一项研究给出的结论。这项发现解释了为什么HIV病人抗体反应比较弱。人们已经发现HIV能够引起CD4+辅助性T免疫细胞不断丧失,导致免疫系统功能受损、其他感染更容易乘机而入。但人们一直没有弄清为何在HIV感染早期,T细胞数量还处于相对正常时,人体就不产生有力的抗体反应了。Claudia Cicala与同事发现,HIV的gp120蛋白可通过宿主细胞表面受体α4β7直接作用于B细胞。通过α4β7将信号传递给B细胞,诱发一种免疫反应抑制分子和一种抑制受体的表达。这种由gp120引发的反应大大影响了B细胞活性并降低其产生病毒抗体的能力。
乳糖蛋白胨的培养基,是需要自己培养还是买 成品?成品是否需要 检测纯度之类的???这种合成品符合CMA的要求吗?如果厂家能提供成品的检测报告是否可以使用,,是否符合认定要求???
[align=center][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖[/color][/size][size=16px][color=#0d0d0d]基[/color][/size][size=16px][color=#0d0d0d]化[/color][/size][size=16px][color=#0d0d0d]及其[/color][/size][size=16px][color=#0d0d0d]糖蛋白规模化的鉴定[/color][/size][/align]O- [size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化是一种发生在蛋白质丝氨酸或苏氨酸上的具有一个糖单元结构的翻译后修饰,广泛分布在细胞核和细胞质中,是一种重要的胞内修饰调控方式。它参与细胞的多种应激响应和细胞进程,如信号转导、转录、翻译、蛋白降解、基因调控与细胞周期调控等。目前,已发现的[/color][/size][size=16px][color=#0d0d0d]1000[/color][/size][size=16px][color=#0d0d0d]多种[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖蛋白中,主要有细胞骨架蛋白、核孔蛋白、转录因子、激素受体、磷酸酶、激酶等。[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化异常与一些疾病,如糖尿病、帕金森病、阿尔兹海默症等有紧密联系。因此,系统地对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化蛋白质进行鉴定与分析[/color][/size][size=16px][color=#0d0d0d],[/color][/size][size=16px][color=#0d0d0d]对于研究其生物学功能和在疾病发生发展中的作用都具有重要意义。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][1][/color][/size][/sup][/font][size=16px][color=#0d0d0d]与目前磷酸化蛋白的鉴定规模相比,[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]蛋白的鉴定尚处于初级水平。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][2-4][/color][/size][/sup][/font][size=16px][color=#0d0d0d]导致[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]难以鉴定的原因主要有:[/color][/size][size=16px][color=#0d0d0d]1[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰在胞内是动态变化的,并且在细胞裂解时糖苷键容易被破坏;[/color][/size][size=16px][color=#0d0d0d]2[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰蛋白表达丰度较低,[/color][/size][size=16px][color=#0d0d0d]且糖基[/color][/size][size=16px][color=#0d0d0d]化水平不一;[/color][/size][size=16px][color=#0d0d0d]3[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰蛋白在进行质谱检测时容易发生中性丢失,难以被完全检测。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][5][/color][/size][/sup][/font][size=16px][color=#0d0d0d]由于[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰具有表达丰度低、高度动态变化、容易分解等特点,常规质谱鉴定手段难以对其实现高灵敏度、规模化的分析鉴定,因此对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]的鉴定往往需要先对糖蛋白[/color][/size][size=16px][color=#0d0d0d]/[/color][/size][size=16px][color=#0d0d0d]糖肽进行分离富集后方能成功进行。[/color][/size][size=16px][color=#0d0d0d]在近年来发展了多种针对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化修饰蛋白质和[/color][/size][size=16px][color=#0d0d0d]肽段[/color][/size][size=16px][color=#0d0d0d]的分离与富集新策略,已有的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽富集方法包括凝集素富集法、抗体富集法、代谢标签富集法、化学酶促反应标签富集法以及酰肼富集法等。[/color][/size][size=16px][color=#0d0d0d]基于亲和作用的直接捕捉方法操作简便,但由于亲和力较弱,难以避免非特异性吸附,导致特异性差;而通过非天然糖基的代谢标记法或化学酶促标记法将生物兼容性的反应基团([/color][/size][size=16px][color=#0d0d0d]炔[/color][/size][size=16px][color=#0d0d0d]基、叠氮基等)引入[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽,再由点击化学反应进行捕捉可以显著提高糖肽的富集特异性,但点击化学等反应不可逆,容易造成糖肽修饰基团的质量标签过大,影响糖肽的鉴定效率,而且操作复杂。[/color][/size][size=16px][color=#0d0d0d]因此,应该开发特异性高、覆盖高度、操作简便,并且不会影响质谱鉴定的新方法实现[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖蛋白规模化的鉴定。[/color][/size]
我有一个多糖蛋白粉,波数 400-4000这边有机构可以帮忙检测么?以后量很多,可以合作。
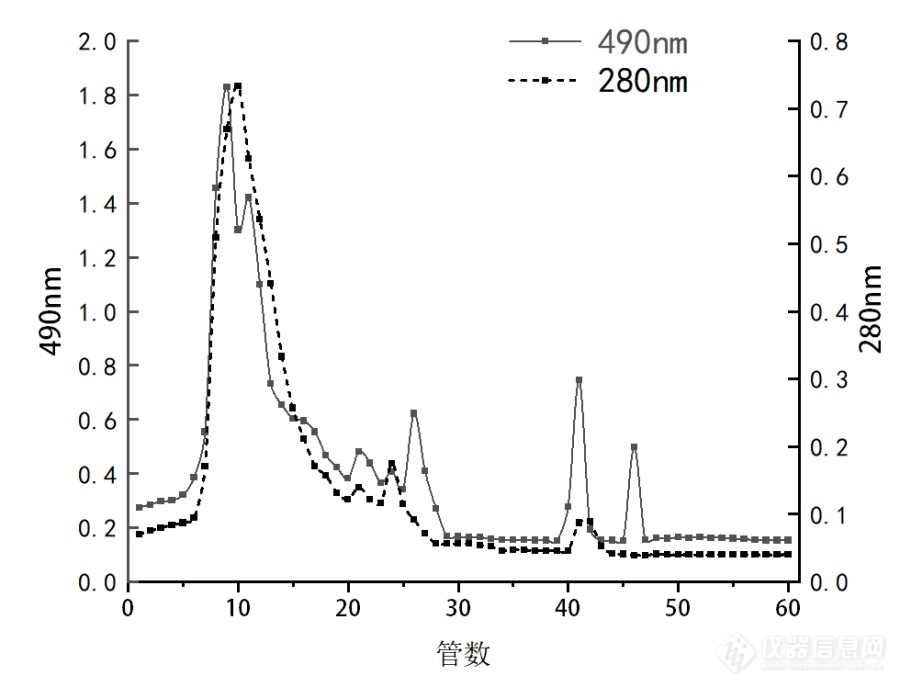
过了G100凝胶柱,1/40个柱体积收集一次,洗脱液为0.1M NaCl,为什么蛋白和多糖出峰位置差一管呢[img=,690,526]https://ng1.17img.cn/bbsfiles/images/2022/06/202206292303064650_39_5405797_3.png!w690x526.jpg[/img]
最近在做几个酸性蛋白的CIEF。贝克曼的方法比较适用于中性和偏碱性的蛋白分析,对于酸性蛋白分析效果不太理想。氨水迁移法比较适合酸性蛋白,但是据说很伤柱子,做不了几个样品。讨论一下,有没有人遇到同样的问题,是怎么优化方法的呢?我尝试调整占位剂的配比,暂时也没有得到理想的结果。
1、C反应蛋白概述 1930年Tillet和Francis在急性大叶性肺炎患者血清中发现一种物质,能在钙离子存在时与肺炎球菌C-多糖起沉淀反应,随后证实这种能与C-多糖反应的物质是一种蛋白质,因而将这种蛋白质命名为C反应蛋白(C-reactive protein,CRP)。 CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性相蛋白(注:急性时相反应包括感染、炎症及创伤时某些血清蛋白浓度的变化,这些蛋白除CRP外,还包括血清淀粉样蛋白A、纤维蛋白原、触珠蛋白、α1酸性糖蛋白、铜蓝蛋白、α1抗胰蛋白酶等。其中CRP在健康人血清中浓度<5mg/L,而在细菌感染或组织损伤时,浓度可升高上千倍,循环中的CRP半衰期为19小时,故被认为其最有价值),由五个相同的亚基依靠非共价键形成的环状五聚体,这一特征性结构使其归类于五聚素(一组具有免疫防御特性的钙结合蛋白)家族。CRP是机体非特异性免疫机制的一部分,它结合C-多糖,在Ca2+存在时可结合细胞膜上磷酸胆碱,可激活补体的经典途径,增强白细胞的吞噬作用,调节淋巴细胞或单核/巨噬系统功能,促进巨噬细胞组织因子的生成,在动脉粥样硬化斑块中也可检测到CRP。 人CRP主要生物学功能: 通过与配体(凋亡与坏死的细胞,或入侵的细菌、真菌、寄生虫等的磷酰胆碱)结合,激活补体和单核吞噬细胞系统,将载有配体的病理物质或病原体清除。 (1)识别外来物质,激活补体系统; (2)增强条理作用,增强吞噬细胞吞噬作用; (3)与血小板激活因子(RAF)结合,降低炎症反应; (4)与染色体结合,消除坏死组织里的细胞DNA。

水质总大肠的最后一步复发酵实验,就是接种了EMB培养上的菌落应该是取10ML 的乳糖蛋白胨培养液还是5ML?[img=,654,120]https://ng1.17img.cn/bbsfiles/images/2019/12/201912101144341109_959_4064492_3.png!w654x120.jpg[/img]医疗废水上就写着取[img=,690,139]https://ng1.17img.cn/bbsfiles/images/2019/12/201912101148371298_8342_4064492_3.png!w690x139.jpg[/img]谢谢大家。
我现在正在做植物中多糖的提取、分离和纯化,在测定多糖分子量时,若没有除蛋白会不会影响结果?还有多糖要多纯才能进行测定分子量呢?谢谢
各位老师大家好,我刚接触使用Agilent 1100系统检测蛋白,用的是Agilent Zorbax GF-250的柱子,1100进样是用的手动进样器。有个很奇怪的现象,用相同的标准品(蛋白marker),在load状态下进样4~5次,每次进样20ul,inject后平均只有一次有峰,其余的都没有任何峰出现。 因为样品是糖蛋白,纯化损失很大得率很小,所以在没搞清楚前不敢随便浪费,还希望有经验的老师不吝赐教!谢谢了!
比如说,buffer pH是7.0蛋白A的PI是3,蛋白B的PI是11,那么一个带正电,一个带负电,色谱柱对于两者的分离会有区别吗?
[b][font=宋体]什么是膜蛋白?[/font][/b][font=宋体]膜蛋白是一类广泛存在于生物体细胞膜上的蛋白质分子。它们在维持细胞结构完整性、调控物质运输和信号传导等方面起着重要作用。根据蛋白分离的难易及在膜中分布的位置,膜蛋白基本可分为三大类:外在膜蛋白或称外周膜蛋白、内在膜蛋白或称整合膜蛋白和脂锚定蛋白。膜蛋白包括糖蛋白,载体蛋白和酶等。[/font][font=宋体] [/font][font=宋体][font=宋体]通常在膜蛋白外会连接着一些糖类,这些糖相当于会通过糖本身分子结构变化将信号传到细胞内。研究膜蛋白结构的技术包括[/font][font=Calibri]X[/font][font=宋体]射线衍射等,常用于重组膜蛋白的表达系统有真核表达系统。[/font][/font][font=宋体] [/font][b][font=宋体]膜蛋白的类型:[/font][/b][font=宋体]目前存在不同类型的膜蛋白,例如:[/font][font=宋体]①整合膜蛋白[/font][font=宋体]②外周膜蛋白[/font][font=宋体]③脂质结合蛋白[/font][font=宋体]④两性蛋白[/font][font=宋体] [/font][b][font=宋体]膜蛋白的特点:[/font][/b][font=宋体][font=宋体]膜蛋白有多种形状和大小,执行多种任务,但它们总是依赖于一些关键特征。[/font] [font=宋体]膜蛋白的一些区别特征如下。[/font][/font][font=宋体]①跨膜域: 跨膜结构域是延伸到脂质双层全长的蛋白质片段。 疏水性氨基酸残基是这些结构域的共同特征,它们介导与膜磷脂疏水性尾部的相互作用。[/font][font=宋体]②疏水和亲水区域: 膜蛋白包含疏水和亲水结构域,使它们能够与脂质双层和两侧的水环境进行交流。[/font][font=宋体]③选择性:膜蛋白的一个共同特征是它们能够调节某些分子或离子的通过。 通常是蛋白质的独特结构和电荷决定了它的选择性。[/font][font=宋体]④受体位点: 当膜蛋白上的受体区域与各自的目标分子或离子结合时,这些区域就会被激活。 大多数时候, 分子 或由受体检测到的离子在受体上具有与该位点结构或化学相容的结合位点。[/font][font=宋体]⑤构象变化: 当膜蛋白结合特定分子或离子时,它通常会发生构象变化,从而引发生物反应或允许蛋白质将结合的分子转运穿过膜。[/font][font=宋体]⑥锚固:多种机制,包括与其他蛋白质的相互作用和与膜中脂质分子的结合,可用于将膜蛋白锚定到细胞膜。[/font][font=宋体]⑦糖基化:碳水化合物链通过称为糖基化的过程与几种膜蛋白结合。 这种改变可以作为防止蛋白水解的保护措施,并作为细胞中下游蛋白质的信号。[/font][font=宋体][font=宋体]跨膜结构域、疏水和亲水区域、选择性、受体位点、构象变化、锚定和糖基化都是膜蛋白的特性,对它们在细胞膜中的功能至关重要。[/font] [font=宋体]由于这些特性,膜中的蛋白质能够运输分子、发送信号、提供结构支持和催化反应。[/font][/font][font=宋体] [/font][b][font=宋体]膜蛋白的功能:[/font][/b][font=宋体]①运输功能[/font][font=宋体]膜转运蛋白分为载体蛋白和通道蛋白两种。主动运输和协助扩散都需要载体蛋白。水分子进去细胞时需要水通道蛋白,还有一种离子通道蛋白,需要注意的是通过通道蛋白进出细胞因为不需要能量所以属于协助扩散。[/font][font=宋体] [/font][font=宋体]②识别功能[/font][font=宋体] [/font][font=宋体]两个不相邻细胞间信息交流是通过信号分子(如激素、神经递质、淋巴因子等)来完成的,而细胞膜上能与信息分子结合的便是细胞膜上的特异性受体。[/font][font=宋体] [/font][font=宋体][font=宋体]细胞与细胞之间可以通过相互接触而相互识别,例如精子与卵细胞的相互识别,效应[/font][font=Calibri]T[/font][font=宋体]细胞与靶细胞之间的相互识别就是依靠糖蛋白来完成的[/font][/font][font=宋体] [/font][font=宋体]③催化功能[/font][font=宋体] [/font][font=宋体][font=宋体]膜蛋白可能是某些反应所需要的酶。例如[/font][font=Calibri]Na+-K+[/font][font=宋体]泵中存在[/font][font=Calibri]ATP[/font][font=宋体]水解酶;光反应、有氧呼吸之所以在膜上发生的原因之一就是膜上存在反应所需的相关酶。[/font][/font][font=宋体] [/font][font=宋体]④抗原功能[/font][font=宋体] [/font][font=宋体][font=宋体]表面抗原能和特异的抗体结合,如人细胞表面有一种蛋白质抗原[/font][font=Calibri]HLA[/font][font=宋体],是一种变化极多的二聚体。不同的人有不同的[/font][font=Calibri]HLA[/font][font=宋体]分子,器官移植时,被植入的器官常常被排斥,这就是因为植入细胞的[/font][font=Calibri]HLA[/font][font=宋体]分子不为受体所接受之故。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins][b]跨膜蛋白制备[/b][/url]平台及跨膜蛋白详解:详情可查看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
看到这么一句话:酸性药物多与清蛋白结合,为什么呢?
糖肽是什么包含一个叫做聚糖的碳水化合物的多肽(氨基酸分子)被称为糖肽(Glycopeptides)。由于聚糖在所有生物体细胞中无所不在,并且糖肽有保持健康和防止疾病作用,糖生物学领域出现了分子等方面的研究。【合肥国肽生物】此外,还开发出治疗某些感染类型的糖肽类抗生素。糖肽是通过肽合成过程生产出来的。在此过程中,聚糖绑定多肽,并与其它聚糖结合氨基酸联系在一起,直到产生一个链。新产生的多肽随后通过糖基化绑定蛋白质和脂质。这一酶催化过程让糖肽影响细胞之间的生化沟通。因此,这些多肽在生物体生命过程中有很重要的生物学作用。细胞产生皮肤和有机组织,并有抵御疾病,帮助身体保持体内平衡等作用。糖生物学试图确定糖肽的分子结构,并进一步探索这些多肽在与人体其它相关细胞和分子中的功能。通过确定糖肽结构,进一步了解它们的机制,糖生物学领域工作者能生产出有助于促进健康和延长寿命的治疗方法。例如,糖肽包含一种特质-在癌细胞扩散前必须被分解;因此,了解糖肽结构能让科学家创造一种防止糖肽变质和抑制癌细胞扩散的方法。糖肽抗生素是一种专门开发出来用于抵御特定类型细菌(对青霉素等常见治疗形式抵抗)的抗生素。例如,万古霉素就是一种常见的糖肽类抗生素,可用于治疗肠道发炎。这种疾病通常是由肠道有害细菌导致,而万古霉素能杀死这些细菌。不过,从糖肽提取的抗生素没有抵御病毒感染的功效。这些药物通常通过静脉注射,或口服药片治疗肠道感染。由于糖肽类药物一般被视为抵抗菌株的最后治疗手段,在病人开始感觉好转的情况下也应坚持完整个疗程。否则,再次感染会加剧,并且更难治疗。糖肽抗生素并非没有副作用。如果大剂量给予,这种药会导致皮疹,或通过呼吸道肌肉收紧而干扰呼吸。糖肽连键的主要类型有两种:一,N-糖肽键,是指β-构型的N-乙酰葡糖胺异头碳与天冬酰胺的γ-酰胺N原子共价连接而成的N-糖苷键。二,O-糖肽键,是指单糖的异头碳与羟基氨基酸的羟基O原子共价结合而成的O-糖苷键。我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397多肽及蛋白质的人工合成多肽及蛋白质的人工合成,指以氨基酸为原料,用化学方法合成多肽或蛋白质。以氨基酸为原料,用化学方法合成多肽或蛋白质。其目的是:①确证天然多肽或蛋白质的结构;②生产天然的、在生物体内含量极微但有医疗或其他生物效用的多肽;③改变部分结构,研究其结构与功能的关系,并设计更有效的药物。
ChromTech AGP 手性柱(CHIRAL-AGP柱;CHIRAL-HSA柱;CHIRAL-CBH柱 高压液相色谱手性柱 ChromTech AGP 手性柱 1.CHIRAL-AGP柱 α-酸糖蛋白(AGP)是一种非常稳定的蛋白质 它不溶于各种有机溶剂,耐高温以及较高或较低 的PH值。AGP是CHIRAL-AGP柱的手性选择 体,它涂敷在5μm的球形硅颗粒之上。CHIRAL -AGP柱适用于反相色谱,用途十分广泛,是所有 手性柱中应用范围最广的,可以分离所有类型化合 物、胺(伯,仲,叔,季胺)、酸(强和弱)、非光 解质(酰胺,酯,醇,亚砜等)该柱的手性选择性 及保留值可以通过改变流动相的PH、缓冲液的浓 度和性质以及有机改性剂的浓度来调节。因此它是 目前使用最广泛的手性柱之一 货号: 产品描述: AGP 100.4 AGP 100.4 ,5u 100mm ×4.0mm AGP 150.4 AGP 100.4 ,5u 150mm ×4.0mm AGP 10.42 AGP 保护柱芯,PK2 CH 10.3 AGP 保护柱套,PK1 CON 2 AGP 保护柱套连接器
有没有同学用CE-SDS测高糖基化蛋白的?现有的方法多数是测单抗的,对我目前检测的蛋白不适用。想要改进方法又没有方向。希望有类似研究方向的同学交流一下,怎么能建立一个适用的方法。我用的仪器是贝克曼PA800plus
我现在需要测定麦汁里的有机酸,直接稀释进样对柱子伤害太大,各位有没有什么好的前处理方法?我觉得主要是糖和蛋白污染了柱子
酵母菌产生的糖蛋白,有没有做过类似得大佬,用的赛默飞液相