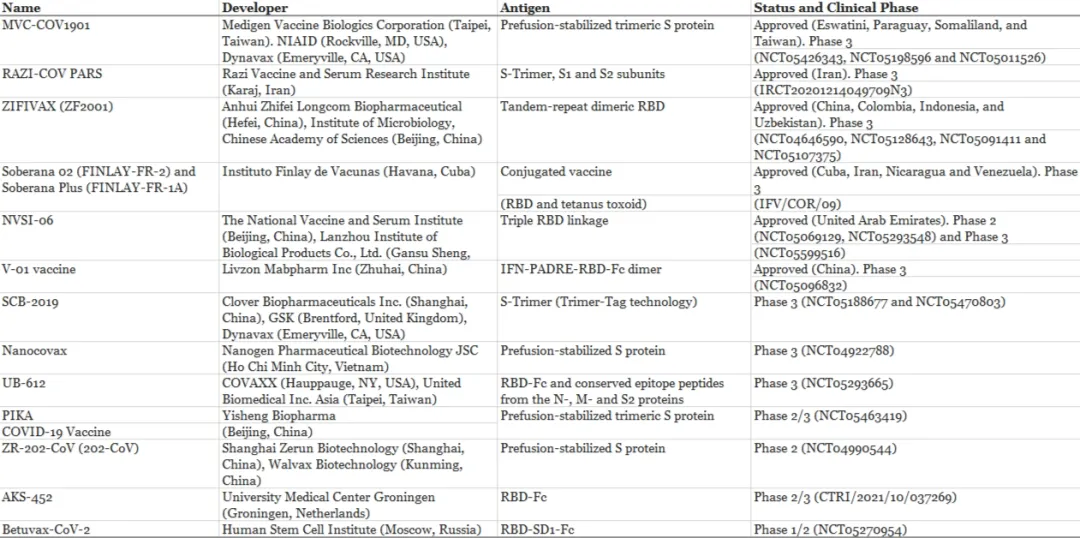
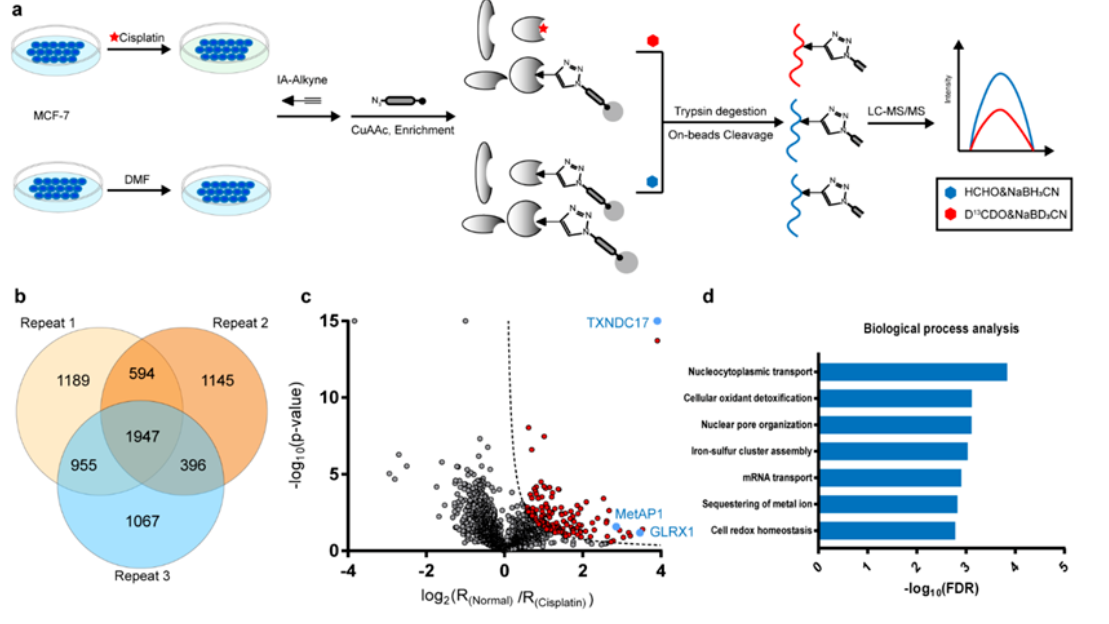
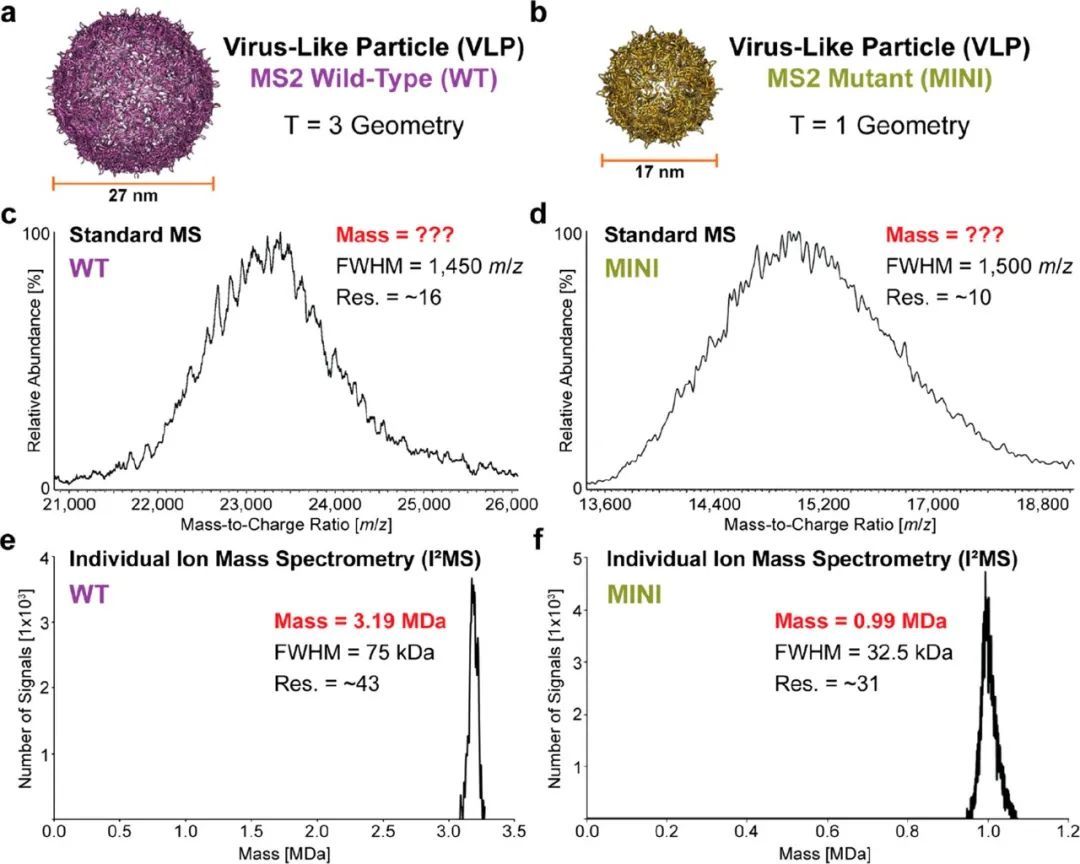
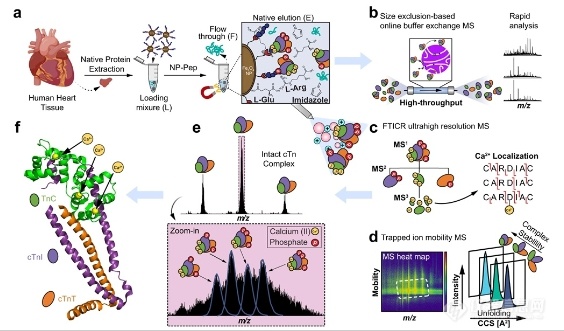
西安交通大学第二附属医院576.00万元采购基因测序仪,流式细胞仪,核酸蛋白分析,细胞计数器,核酸提...
html,body{-webkit-user-select:text }*{padding:0 margin:0 }.web-box{width:100% text-align:center }.wenshang{margin:0auto width:80% text-align:center padding:20px10px010px }.wenshangh2{display:block color:#900 text-align:center padding-bottom:10px border-bottom:1pxdashed#ccc font-size:16px }.sitea{text-decoration:none }.content-box{text-align:left margin:0auto width:80% margin-top:25px text-indent:2em font-size:14px line-height:25px }.biaoge{margin:0auto /*width:643px */width:100% margin-top:25px }.table_content{border-top:1pxsolid#e0e0e0 border-left:1pxsolid#e0e0e0 font-family:Arial /*width:643px */width:100% margin-top:10px margin-left:15px }.table_contenttrtd{line-height:29px }.table_content.bg{background-color:#f6f6f6 }.table_contenttrtd{border-right:1pxsolid#e0e0e0 border-bottom:1pxsolid#e0e0e0 }.table-left{text-align:left padding-left:20px }详细信息西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目公开招标公告陕西省-西安市状态:公告更新时间:2022-07-29招标文件:附件1西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目公开招标公告发布时间:2022072915:11:08西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目公开招标公告项目概况西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目招标项目的潜在投标人应在线上获取招标文件,并于2022年08月24日09时30分(北京时间)前递交投标文件。一、项目基本情况项目编号:XBMH2022152项目名称:西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目预算金额:576万元/年采购需求:西安交通大学第二附属医院采购分子组及大明宫院区医用试剂一批。本项目共分24个标段,各标标段具体采购的标的物及预算如下:标段号序号采购标的物名称检测方法采购预算(万元/年)中标家数参数要求招标最小单位第1标段(180万)1乙型肝炎病毒核酸定量检测PCR荧光探针法180万1家每测试2沙眼衣原体核酸检测每测试3淋球菌核酸测定每测试4解脲脲原体核酸检测每测试5单纯疱疹病毒II型核酸测定每测试7人巨细胞病毒核酸定量检测每测试8结核分枝杆菌核酸检测每测试9肺炎支原体核酸检测试剂盒每测试10EB病毒核酸检测每测试11幽门螺旋杆菌核酸检测每测试12肠道病毒71型核酸检测每测试13肠道病毒通用型核酸检测每测试14乙型肝炎病毒基因分型检测每测试15丙型肝炎病毒基因分型检测试剂盒每测试16人感染H7N9禽流感病毒RNA检测每测试17甲型H1N1流感病毒RNA检测每测试18季节性流感病毒H3亚型核酸检测每测试19季节性流感病毒H1亚型核酸检测每测试20Ⅰ群肠道沙门氏菌核酸检测每测试21发热伴血小板减少综合征布尼亚病毒核酸检测每测试22柯萨奇病毒A16型核酸检测每测试23柯萨奇病毒A6型核酸检测每测试24柯萨奇病毒A10型核酸检测每测试25呼吸道合胞病毒核酸检测试剂盒每测试26登革病毒核酸检测每测试27HIV1核酸测定试剂盒每测试28中东呼吸综合征冠状病毒核酸检测每测试29寨卡病毒核酸检测每测试30B族链球菌核酸检测每测试31人博卡病毒核酸检测每测试32腺病毒核酸检测每测试33人鼻病毒核酸检测每测试34乙型肝炎病毒前C区/BCP区突变检测PCR反向点杂交法每测试35乙型肝炎病毒YMDD基因突变检测每测试36人乳头瘤病毒核酸检测及基因分型(至少标段含20种)PCR反向点杂交法每测试372019nCoV核酸快速检测试剂(标段含采样管及保存液、提取试剂、扩增试剂、八连管等耗材)荧光PCR法(快速扩增)1具备内源性内标;2.防污染系统。3.目的基因不少于双靶标;4检测最低下限小于等于500copy/L5快速核酸释放技术6扩增时间小于50分钟每测试382019nCoV核酸检测试剂(标段含采样管及保存液、提取试剂、扩增试剂、八连管等)荧光PCR法1具备内源性内标;2.防污染系统。3.目的基因不少于双靶标;4检测最低下限≤500copy/mL每测试39诺如病毒RNA荧光PCR法每测试40多瘤病毒(BKV、JCV)每测试41人偏肺病毒(HMPV)每测试42副流感病毒PIV每测试43甲型流感病毒每测试44乙型流感病毒每测试45呼吸道病毒核酸六重联检(甲、乙型流感病毒、腺病毒、呼吸道合胞病毒、副流感病毒1型、副流感病毒2型)每测试46白血病融合基因每测试47细小病毒(B19)胶体金法每测试第2标段(145万)1核酸提取或纯化试剂磁珠法145万1家每测试2丙型肝炎病毒核酸定量检测PCR荧光探针法每测试3丙型肝炎病毒基因分型检测每测试4HBVDNA/HCVRNA/HIVRNA(1+2)型三联检测每测试5乙型肝炎病毒核酸定量检测(高敏)检测下限≤10copies/mL每测试6乙型肝炎病毒基因分型检测每测试7丙型肝炎病毒核酸定量检测(高敏)检测下限≤25copies/mL每测试8丙型肝炎病毒核酸定量检测(超敏)检测下限≤15copies/mL每测试9EB病毒核酸定量检测检测下限≤400copies/mL每测试10人巨细胞病毒核酸定量检测检测下限≤400copies/mL每测试11沙眼衣原体核酸检测、解脲脲原体核酸检测、淋球菌核酸检测检测下限≤400copies/mL每测试12新型冠状病毒2019nCoV核酸检测,最低检测下限≤200copy/L(标段含采样管及保存液、提取试剂、扩增试剂、八连管)荧光PCR法1具备内源性内标;2.防污染系统。3.目的基因不少于双靶标;4最低检测下限≤200copy/mL每测试13高危型人乳头状瘤病毒DNA检测(15种)荧光PCR法(无需杂交)每测试132019nCoV、甲型流感病毒、乙型流感病毒核酸三联检荧光PCR法1具备内源性内标;2.防污染系统。3检测最低下限小于等于500copy/mL14腺病毒核酸检测荧光PCR法每测试第3标段(30万)新冠核酸快检试剂2019nCoV核酸快速检测试剂(标段含采样管及保存液、保存管、提取试剂、扩增试剂、吸头、八连管等)快速核酸检测30万1家1磁珠法提取;2.全检测流程≤80分钟3检测模式:核酸提取、扩增检测均在同一封闭;4独立模块,随来随测,独立检测。5.目的基因不少于双靶标(ORFlab基因、N基因);6检测最低下限小于500copy/mL;7检测通量≥8;每测试第4标段(6万)(MTHFRC677T基因检测+高血压个体化治疗基因检测+HLAB27核酸检测等)MTHFRC677T基因检测(3个位点)PCR熔解曲线法6万1家每测试人类CYP2C19基因分型检测每测试CYP2D6*10、CYP2C9*3、ADRB1(1165GC)、AGTR1(116AC)、ACE(I/D)检测每测试人运动神经元存活基因1(SMN1)检测每测试测序反应通用试剂盒(高血压个体化治疗基因检测)聚合酶链杂交法每测试测序反应通用试剂盒(叶酸)每测试测序反应通用试剂盒(他汀类)每测试测序反应通用试剂盒(氯比格雷)每测试测序反应通用试剂盒(华法林)每测试测序反应通用试剂盒(硝酸甘油)每测试人类HLAB27核酸检测荧光PCR法每测试高血压个体化治疗基因检测试剂(5个位点)每测试人类HLAB*5801基因每测试B族链球菌核酸检测每测试结核分枝杆菌复合群核酸检测恒温扩增荧光法每测试MTHERC677基因检测PCR金磁微粒层析法每测试第5标段(20万)(免费按需提供检测的质控品、校准品、辅助试剂及一次性耗材)恒温扩增相关试剂(20万)结核TBRNA检测恒温扩增法20万1家每测试乙肝HBVRNA检测每测试泌尿生殖道病原体RNA检测(沙眼衣原体、解脲脲原体、淋病奈瑟菌、生殖支原体)每测试第6标段(5万)细菌耐药基因检测耐甲氧西林金黄色葡萄球菌耐药基因检测荧光PCR法5万1家每测试碳青霉烯耐药基因KPC检测每测试鲍曼不动杆菌耐碳青霉烯类抗生素基因(OXA23)检测每测试耐万古霉素肠球菌基因(vanA,vanB)检测每测试第7标段(20万)呼吸道病原菌核酸检测呼吸道病原菌核酸检测(标段括常见细菌、特殊病原体如嗜肺军团菌、结核分枝杆菌、肺炎支原体、肺炎衣原体、流感嗜血杆菌等)恒温扩增芯片法20万1家每测试第8标段(30万)维生素类检测脂溶维生素(VA,D2,D3,E,K)串联质谱30万1家每测试水溶维生素(维生素B1、维生素B2、维生素B3、维生素B5、维生素B6、维生素B7、维生素B9、维生素B12)每测试类固醇激素类类固醇激素18项(二氢睾酮、脱氢表雄酮硫酸酯、脱氢表雄酮、皮质醇(氢化可的松)、雌酮、17α羟孕酮、孕烯醇酮、皮质酮、11去氧皮质醇、脱氧皮质酮、雄烯二酮、17α羟孕烯醇酮、睾酮、醛固酮、雌二醇、雌三醇、可的松(皮质素)、孕酮)1.82.5ng串联质谱每测试原醛激素5项(醛固酮、血管紧张素I,皮质醇,脱氧皮质酮、可的松)每测试四种激素萃取液(醛固酮、皮质醇,脱氧皮质酮、可的松)每测试血儿茶酚胺代谢检测(肾上腺素、去甲肾上腺素、多巴胺、变肾上腺素、去甲变肾上腺素)每测试尿儿茶8项(DA,E,NE,MN,NMN,3MT,HVA,VMA)每测试高香草酸和香草扁桃酸萃取液每测试人体代谢物浓度胆汁酸谱15项(胆酸、牛磺胆酸、甘氨脱氧胆酸、石胆酸、甘氨胆酸、牛磺熊脱氧胆酸、脱氧胆酸、牛磺石胆酸、甘氨熊脱氧胆酸、熊脱氧胆酸、甘氨石胆酸、牛磺鹅脱氧胆酸、鹅脱氧胆酸、牛磺脱氧胆酸、甘氨鹅脱氧胆酸)串联质谱每测试药物浓度检测免疫抑制剂(他克莫司、环孢霉素A、西罗莫司)药物浓度检测串联质谱每测试抗癫痫药(卡马西平、卡马西平10,11环氧化物、奥卡西平、10羟基卡马西平、丙戊酸/苯巴比妥、苯妥英钠、拉莫三嗪、托吡酯、左乙拉西坦)药物浓度检测每测试抗菌药(万古霉素、伏立康唑、替考拉宁、利奈唑胺、美洛培南、替加环素、莫西沙星、氟康唑)药物浓度检测每测试抗肿瘤药(甲氨蝶呤、氟尿嘧啶、多西他赛、多柔比星)每测试镇静催眠药(阿普唑仑、氯硝西泮、咪达唑仑、劳拉西泮、奥沙西泮、唑吡坦、艾司唑仑、替马西泮、溴西泮)药物浓度检测每测试抗抑郁药(米氮平、帕罗西汀、舍曲林、西酞普兰、艾司西酞普兰、文拉法辛、O–去甲文拉法辛、曲唑酮、氟西汀+去甲氟西汀、氟伏沙明、度洛西汀、安非他酮、羟安非他酮)药物浓度检测每测试抗精神病药(氯氮平及去甲氯氮平、氯丙嗪、利培酮+9–羟基利培酮、喹硫平、阿立哌唑、脱氢阿立哌唑、奥氮平、齐拉西酮、氨磺必利、丙戊酸、舒必利、氟哌啶醇、奋乃静、氟奋乃静)药物浓度检测每测试第9标段(8万)阿司匹林耐药基因检测LTC4S一代测序技术8万1家为临床服用阿司匹林是否存在抵抗提供帮助每测试PTGS1每测试GP1BA高血糖个体化用药基因检测外周血液基因组中的CYP2C9、OCT2、SLCO1B1、PPARy基因多态性性为临床鉴别患者对降糖药物敏感性提供帮助每测试SLCO1B1ApoE检测SLCO1B1检测*1b和*5两个位点;ApoE检测E2和E4两个位点每测试个体化用药指导AGTR1/ACE/ADRB1CY2D6/CYP2C9/CYP3A5/NPPA检测高血压合理用药;总共检测7个基因,10位点每测试CYP2C19氯吡格雷用药每测试CYP2C9VKORC1华法林初始剂量每测试MTHFR检测评判叶酸代谢能力,指导合理补充叶酸每测试ALDH2检测判断硝酸甘油用药无效风险,评估酒精代谢能力每测试细胞因子联合检测试剂细胞因子六联检(IL2\IL4\IL6\IL10\IFNγ\TNFα);流式细胞术(2类注册证)每测试细胞因子七联检(IL2\IL4\IL6\IL10\IL17A\IFNγ\TNFα) 每测试细胞因子八联检(IL2\IL4\IL6\IL10\IL12P70\IL17A\IFNγ、TNFα) 每测试PD1(程序性死亡蛋白1)每测试十二联检(IL1β\IL2\IL4\IL6\IL8\IL10\IL12P70\IL17A\IFNγ\TNFα\IFNα)维生素类检测脂溶维生素(VA,D2,D3,E,K)串联质谱每测试水溶维生素(维生素B1、维生素B2、维生素B3、维生素B5、维生素B6、维生素B7、维生素B9、维生素B12)每测试串联质谱检测3多种氨基酸检测试剂盒串联质谱每测试抗生素药物浓度检测试剂盒(阿米卡星、亚胺培南西司他丁、头孢哌酮舒巴坦、哌拉西林他唑巴坦、美罗培南、替加环素、利奈唑胺、万古霉素、去甲万古霉素、替考拉宁、氟康唑、伏立康唑、醋酸卡泊芬净)每测试第10标段(5万)1白色念珠菌核酸检测荧光PCR法5万1家每测试2光滑假丝酵母菌核酸检测每测试3热带假丝酵母菌菌核酸检测每测试4金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌核酸检测每测试5沙门氏菌和志贺氏菌核酸检测每测试6单纯疱疹病毒1型(HSV1)核酸检测每测试7单纯疱疹病毒2型(HSV2)核酸检测每测试8人感染H7N9禽流感病毒RNA检测每测试9麻疹病毒和风疹病毒核酸检测每测试10人乳头瘤病毒核酸检测及基因分型(至少标段含20种)荧光PCR定量法(无需杂交)每测试第11标段(大明宫)(60万)肝炎系列+新冠抗体+胃蛋白酶原乙型肝炎病毒表面抗体测定试剂盒磁微粒化学发光法60万1家每测试乙型肝炎病毒表面抗原测定试剂盒每测试乙型肝炎病毒e抗原测定试剂盒每测试乙型肝炎病毒e抗体测定试剂盒每测试乙型肝炎病毒核心抗体测定试剂盒每测试乙型肝炎病毒前S1抗原测定试剂盒每测试戊型肝炎病毒IgM测定试剂盒每测试丙型肝炎病毒抗体测定试剂盒每测试胃蛋白酶原Ⅰ测定试剂盒每测试胃蛋白酶原Ⅱ测定试剂盒每测试新型冠状病毒(2019nCoV)抗体检测试剂盒(磁微粒化学发光法)每测试抗HCV质控品每毫升HBcAb质控品每毫升HBeAb质控品每毫升HBeAg质控品每毫升HBsAb质控品每毫升HBsAg质控品每毫升抗HAVIgM质控每毫升抗HEVIgM质控品每毫升白介素6测定试剂盒(CMIA)每测试降钙素原测定每测试超敏C反应蛋白测定每测试肌酸激酶同工酶测定每测试心肌肌钙蛋白I测定每测试心肌肌钙蛋白T测定每测试肌红蛋白测定每测试心型脂肪酸结合蛋白测定每测试N端脑钠肽前体测定每测试白介素6质控品IL6免费提供胃蛋白酶原I质控品PGI免费提供胃蛋白酶原II质控品PGII免费提供人类免疫缺陷病毒抗原抗体测定试剂盒每测试梅毒螺旋体抗体测定试剂盒每测试甲型肝炎病毒IgM抗体测定试剂盒每测试激发液免费提供预激发液免费提供清洗液免费提供整装反应杯免费提供整装吸头免费提供样本稀释液免费提供FDP+DD纤维蛋白/原降解复合物胶乳免疫比浊法/颗粒增强免疫比浊法每测试D二聚体检测每测试FDP、D二聚体控制品每毫升D二聚体校准品每毫升FDP校准品每毫升生化类超敏C反应蛋白免疫比浊法每测试尿微量白蛋白测定每测试糖化白蛋白每测试糖化血红蛋白高压液相色谱法每测试第12标段(6万)多种心脑血管药物基因核酸样本预处理试剂心血管个性化用药指导11基因检测+核酸质谱法6万1家每测试心血管个性化用药指导21基因检测每测试高血压个性化用药指导9基因检测每测试冠心病个性化用药指导4基因检测每测试氯吡格雷+阿司匹林个性化用药基因检测每测试抗栓个性化用药9基因检测每测试儿童安全用药基因检测(核心板)每测试叶酸及营养每测试精神类药物基因核酸样本预处理试剂抑郁症个性化用药指导10基因检测每测试精神分裂症个性化用药10基因检测每测试癫痫个性化用药12基因检测每测试焦虑个性化用药9基因检测每测试肿瘤基因检测核酸样本预处理试剂化疗用药每测试男性18项高发肿瘤风险基因筛查(含BRCA基因)每测试女性21项高发肿瘤风险基因筛查(含BRCA基因)每测试核酸样本预处理试剂遗传性耳聋基因检测(20位点)每测试第13标段(5万)肝癌检测高尔基体蛋白73磁微粒化学发光免疫分析法5万1家每测试甲胎蛋白异质体比率(AFPL3%)每测试异常凝血酶原每测试感染三项1.全程C反应蛋白(CRP)上转发光免疫分析每测试2.血清淀粉样蛋白(SAA)每测试3.降钙素原(PCT)每测试第14标段(8万)ApoE基因型载脂蛋白EApoE基因型检测基因芯片法8万1家每测试第15标段(4万)SDC2基因甲基化检测人类SDC2基因甲基化检测荧光PCR法4万1家每测试第16标段(3万)S9甲基化Septin9基因甲基化检测荧光探针法3万1家每测试第17标段(25万)一次性加样枪头一次性加样枪头200微升迪肯酶免一体机专用25万1家每个一次性加样枪头1000微升每个核酸检测耗材盒装灭菌无酶吸头10微升核酸检测专用每个盒装灭菌无酶吸头100微升每个盒装灭菌无酶吸头200微升每个盒装灭菌无酶吸头1000微升每个加长型滤芯枪头(200ul)每个加长型滤芯枪头(10ul)每个HPV细胞保存液HPV细胞保存液(标段含采样器和保存管)5mlHPV分型专用每管采样管及保存管鼻拭子采样管、咽拭子采样管RNA检测标本采集每个第18标段(2万)六项呼吸道病毒核酸联合检测六项呼吸道核酸联合检测(甲、乙型流感病毒,呼吸道合胞病毒,腺病毒,肺炎支原体,人鼻病毒)荧光PCR法2万1家1具备内源性内标;2.防污染系统。3检测最低下限小于等于500copy/mL每测试六项呼吸道病原菌核酸检测六项呼吸道病原菌核酸检测(肺炎链球菌、肺炎克雷伯杆菌、流感嗜血杆菌、铜绿假单胞菌、嗜肺军团菌、金黄色葡萄糖菌)荧光PCR法1具备内源性内标;2.防污染系统。3检测最低下限小于等于500copy/mL每测试第19标段(1万)传染病三项血液筛查核酸检测HBV+HCV+HIV血液筛查核酸检测荧光PCR法1万1家每测试第20标段(3万)心脑血管疾病风险预测MTHFRC677T基因检测(3个位点)PCR金磁微粒层析法2万1家每测试ALDH2(Glu504Lys)基因检测每测试氧化型低密度脂蛋白金磁微粒免疫层析法每测试S100β蛋白检测每测试早产早破预测胰岛素样生长因子结合蛋白1(IGFBP1)——胶体金与酶免方法1万胎膜早破诊断每测试胎儿纤维连接蛋白(fFN)——早产风险预测每测试第21标段(3万)颗粒酶B及穿孔素联合检测GranzymeB抗体试剂流式细胞计数法2万1家每测试穿孔素(Perforin)抗体试剂每测试CD45检测试剂(APCCy7)每测试CD3检测试剂(PerCP)每测试CD8检测试剂(APC)每测试CD16检测试剂(CD16PECy7)每测试CD56检测试剂(CD16PECy7)每测试HLAB27基因分型HLAB27基因分型检测荧光PCR法1万每测试百日咳杆菌核酸检测百日咳杆菌核酸检测荧光PCR法每测试第22标段(3万)耳聋基因检测遗传性耳聋易感基因检测(至少20种基因位点)PCR反向点杂交2万1家每测试艰难梭菌抗原及毒素快检艰难梭菌谷氨酸脱氢酶抗原GDH及毒素A/B酶联免疫层析法1万每测试第23标段(2万)SDC2和TFPI2基因甲基化联合检测SDC2和TFPI2基因甲基化联合检测试剂盒荧光PCR法2万1家每测试第24标段(2万)呼吸道病毒6项呼吸道合胞病毒、呼吸道腺病毒、人偏肺病毒、副流感病毒Ⅰ型、副流感病毒Ⅱ型、副流感病毒Ⅲ型荧光PCR法1万最低检测限:1000copies/mL每测试诺如病毒核酸检测诺如病毒RNA检测(粪标本)荧光PCR法0.5万每测试肠道病毒核酸检测试剂可检测肠道病毒,如柯萨奇病毒A组2型、4型、5型、6型、7型、9型、10型、12型、16型;柯萨奇病毒B组1型、2型、3型、4型、5型;肠道病毒C组;肠道病毒71型和埃可病毒。荧光PCR法0.5万(咽拭子)每测试合计共24个标段,总计576万元各供应商可选择参投一个或多个标段,可兼投兼中,但必须对所投标段内全部标的进行投标报价,不得缺项、漏项。本项目(不接受)联合体投标。二、申请人的资格要求:1、基本资格条件:符合《政府采购法》第二十二条规定的供应商条件;1.1、提供在中华人民共和国境内注册的营业执照(或事业单位法人证书,或社会团体法人登记证书,或执业许可证)、组织机构代码证和税务登记证复印件【如已办理了多证合一,则仅需提供合证后的营业执照】,如供应商为自然人的需提供自然人身份证明。1.2、提供2021年度任意一个月的财务报表(至少标段括资产负债表、现金流量表和利润表)或具有财务审计资质的单位出具的2020年度财务会计报告或开标日前三个月内基本存款账户银行出具的资信证明(附开户许可证);2021年以后新成立企业提供成立之日至开标前任意一个月的财务报表(至少标段括资产负债表、现金流量表和利润表)或开标日前三个月内基本存款账户银行出具的资信证明(附开户许可证)。1.3、提供2021年以来至少一个月的纳税证明或完税证明(提供增值税、企业所得税至少一种),纳税证明或完税证明上应有代收机构或税务机关的公章或业务专用章。依法免税的供应商应提供相关文件证明。1.4、提供2021年以来至少一个月的社会保障资金缴存单据或社保机构开具的社会保险参保缴费情况证明。依法不需要缴纳社会保障资金的供应商应提供相关文件证明。1.5、提供履行合同所必需的设备和专业技术能力的书面声明。1.6、提供参加政府采购活动前3年内在经营活动中没有重大违法记录的书面声明。2、落实政府采购政策需满足的资格要求:本项目非专门面向中小企业采购。3、特定资格条件:3.1、供应商应授权合法的人员参加投标全过程,其中法定代表人直接参加投标的,须出具法人身份证,并与营业执照上信息一致;法定代表人授权代表参加投标的,须出具法定代表人授权书及授权代表身份证。3.2、投标产品纳入医疗器械(或药品)管理的,须提供供应商有效的医疗器械(或药品)经营许可证或经营备案凭证。3.3、投标产品纳入医疗器械(或药品)管理的,须提供产品有效的医疗器械(或药品)注册证或备案凭证。3.4、若投标产品为进口,供应商须提供有效的完整授权链的产品授权书(授权期限不足2年的须附能够提供持续供货的声明材料,英文授权须提供中文翻译版;制造商直接参与投标的不提供此项)。若投标产品为国产且纳入医疗器械(或药品)管理的,供应商须提供投标产品制造商有效的营业执照和生产许可证。3.5、供应商未被列入“信用中国”网站(www.creditchina.gov.cn)以下情形之一:①记录失信被执行人;②重大税收违法案件当事人名单。同时,在中国政府采购网(www.ccgp.gov.cn)“政府采购严重违法失信行为信息记录”中查询没有处于禁止参加政府采购活动的记录名单。本项目(不接受)联合体投标。三、获取招标文件1、时间:2022年08月01日至2022年08月05日,法定工作日每天上午09:0012:00,法定工作日每天下午14:0017:00(北京时间,法定节假日除外)地点:线上发售方式:(1)根据陕西省人民政府《关于加强新型冠状病毒感染的肺炎防控工作的通告》要求,本次招标文件采用线上发售,供应商在文件发售期以内将单位介绍信(介绍信中必须注明项目名称、项目编号、标段号)、经办人身份证、联系电话及电子邮箱等资料,加盖投标单位公章的彩色扫描件发送至邮箱714884417@qq.com,并及时关注邮箱回复消息。(2)招标文件售价人民币¥7200.00元(本招标项目各标段招标文件之和,每单个标段300元),售后不退。(标书费交纳信息:账户名称:陕西西北民航招标咨询有限公司;开户银行:建行西安高新科技支行;账号:61001925700052502533;转帐事由:项目名称简称、编号、标段号,如以个人名义转入,须备注单位名称。财务电话:029883479258013),采购代理机构在收到邮件并确认文件收费到账后,通过邮箱向供应商发售招标文件,请及时查收。四、提交投标文件截止时间、开标时间和地点提交投标文件截止时间:2022年08月24日09时30分(北京时间)开标时间:2022年08月24日09时30分(北京时间)地点:西安市唐延路3号唐延国际中心AB区8楼开标室五、公告期限自本公告发布之日起5个工作日。六、其他补充事宜:(1)招标文件售价为每标段300元。(2)本项目接受进口产品投标。(3)采购项目需要落实的政府采购政策:1、《财政部国家发展改革委关于印发〈节能产品政府采购实施意见〉的通知》(财库〔2004〕185号);2、《国务院办公厅关于建立政府强制采购节能产品制度的通知》(国办发〔2007〕51号);3、《财政部环保总局关于环境标志产品政府采购实施的意见》(财库〔2006〕90号);4、《财政部司法部关于政府采购支持监狱企业发展有关问题的通知》(财库〔2014〕68号);5、《三部门联合发布关于促进残疾人就业政府采购政策的通知》(财库〔2017〕141号);6、《财政部发展改革委生态环境部市场监管总局关于调整优化节能产品、环境标志产品政府采购执行机制的通知》(财库〔2019〕9号);7、《关于运用政府采购政策支持乡村产业振兴的通知》(财库〔2021〕19号);8、《政府采购促进中小企业发展管理办法》(财库〔2020〕46号);9、陕西省财政厅关于印发《陕西省中小企业政府采购信用融资办法》(陕财办采〔2018〕23号)。七、对本次招标提出询问,请按以下方式联系。1.采购人信息名称:西安交通大学第二附属医院地址:西安市西五路157号联系方式:冯老师029876798612.采购代理机构信息名称:陕西西北民航招标咨询有限公司地址:西安市唐延路3号唐延国际中心AB区8楼联系方式:佘冰霞029883479878046/139912653493.项目联系方式项目联系人:佘冰霞电话:029883479878046/13991265349(2022.07.27)重新招标公告分子组及大明宫耗材项目.pdf×扫码打开掌上仪信通App查看联系方式$('.clickModel').click(function(){$('.modelDiv').show()})$('.closeModel').click(function(){$('.modelDiv').hide()})基本信息关键内容:基因测序仪,流式细胞仪,核酸蛋白分析,细胞计数器,核酸提取仪,液相色谱仪,PCR开标时间:2022-08-2409:30预算金额:576.00万元采购单位:西安交通大学第二附属医院采购联系人:点击查看采购联系方式:点击查看招标代理机构:陕西西北民航招标咨询有限公司代理联系人:点击查看代理联系方式:点击查看详细信息西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目公开招标公告陕西省-西安市状态:公告更新时间:2022-07-29招标文件:附件1西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目公开招标公告发布时间:2022072915:11:08西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目公开招标公告项目概况西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目招标项目的潜在投标人应在线上获取招标文件,并于2022年08月24日09时30分(北京时间)前递交投标文件。一、项目基本情况项目编号:XBMH2022152项目名称:西安交通大学第二附属医院分子组及大明宫院区医用试剂采购项目预算金额:576万元/年采购需求:西安交通大学第二附属医院采购分子组及大明宫院区医用试剂一批。本项目共分24个标段,各标标段具体采购的标的物及预算如下:标段号序号采购标的物名称检测方法采购预算(万元/年)中标家数参数要求招标最小单位第1标段(180万)1乙型肝炎病毒核酸定量检测PCR荧光探针法180万1家每测试2沙眼衣原体核酸检测每测试3淋球菌核酸测定每测试4解脲脲原体核酸检测每测试5单纯疱疹病毒II型核酸测定每测试7人巨细胞病毒核酸定量检测每测试8结核分枝杆菌核酸检测每测试9肺炎支原体核酸检测试剂盒每测试10EB病毒核酸检测每测试11幽门螺旋杆菌核酸检测每测试12肠道病毒71型核酸检测每测试13肠道病毒通用型核酸检测每测试14乙型肝炎病毒基因分型检测每测试15丙型肝炎病毒基因分型检测试剂盒每测试16人感染H7N9禽流感病毒RNA检测每测试17甲型H1N1流感病毒RNA检测每测试18季节性流感病毒H3亚型核酸检测每测试19季节性流感病毒H1亚型核酸检测每测试20Ⅰ群肠道沙门氏菌核酸检测每测试21发热伴血小板减少综合征布尼亚病毒核酸检测每测试22柯萨奇病毒A16型核酸检测每测试23柯萨奇病毒A6型核酸检测每测试24柯萨奇病毒A10型核酸检测每测试25呼吸道合胞病毒核酸检测试剂盒每测试26登革病毒核酸检测每测试27HIV1核酸测定试剂盒每测试28中东呼吸综合征冠状病毒核酸检测每测试29寨卡病毒核酸检测每测试30B族链球菌核酸检测每测试31人博卡病毒核酸检测每测试32腺病毒核酸检测每测试33人鼻病毒核酸检测每测试34乙型肝炎病毒前C区/BCP区突变检测PCR反向点杂交法每测试35乙型肝炎病毒YMDD基因突变检测每测试36人乳头瘤病毒核酸检测及基因分型(至少标段含20种)PCR反向点杂交法每测试372019nCoV核酸快速检测试剂(标段含采样管及保存液、提取试剂、扩增试剂、八连管等耗材)荧光PCR法(快速扩增)1具备内源性内标;2.防污染系统。3.目的基因不少于双靶标;4检测最低下限小于等于500copy/L5快速核酸释放技术6扩增时间小于50分钟每测试382019nCoV核酸检测试剂(标段含采样管及保存液、提取试剂、扩增试剂、八连管等)荧光PCR法1具备内源性内标;2.防污染系统。3.目的基因不少于双靶标;4检测最低下限≤500copy/mL每测试39诺如病毒RNA荧光PCR法每测试40多瘤病毒(BKV、JCV)每测试41人偏肺病毒(HMPV)每测试42副流感病毒PIV每测试43甲型流感病毒每测试44乙型流感病毒每测试45呼吸道病毒核酸六重联检(甲、乙型流感病毒、腺病毒、呼吸道合胞病毒、副流感病毒1型、副流感病毒2型)每测试46白血病融合基因每测试47细小病毒(B19)胶体金法每测试第2标段(145万)1核酸提取或纯化试剂磁珠法145万1家每测试2丙型肝炎病毒核酸定量检测PCR荧光探针法每测试3丙型肝炎病毒基因分型检测每测试4HBVDNA/HCVRNA/HIVRNA(1+2)型三联检测每测试5乙型肝炎病毒核酸定量检测(高敏)检测下限≤10copies/mL每测试6乙型肝炎病毒基因分型检测每测试7丙型肝炎病毒核酸定量检测(高敏)检测下限≤25copies/mL每测试8丙型肝炎病毒核酸定量检测(超敏)检测下限≤15copies/mL每测试9EB病毒核酸定量检测检测下限≤400copies/mL每测试10人巨细胞病毒核酸定量检测检测下限≤400copies/mL每测试11沙眼衣原体核酸检测、解脲脲原体核酸检测、淋球菌核酸检测检测下限≤400copies/mL每测试12新型冠状病毒2019nCoV核酸检测,最低检测下限≤200copy/L(标段含采样管及保存液、提取试剂、扩增试剂、八连管)荧光PCR法1具备内源性内标;2.防污染系统。3.目的基因不少于双靶标;4最低检测下限≤200copy/mL每测试13高危型人乳头状瘤病毒DNA检测(15种)荧光PCR法(无需杂交)每测试132019nCoV、甲型流感病毒、乙型流感病毒核酸三联检荧光PCR法1具备内源性内标;2.防污染系统。3检测最低下限小于等于500copy/mL14腺病毒核酸检测荧光PCR法每测试第3标段(30万)新冠核酸快检试剂2019nCoV核酸快速检测试剂(标段含采样管及保存液、保存管、提取试剂、扩增试剂、吸头、八连管等)快速核酸检测30万1家1磁珠法提取;2.全检测流程≤80分钟3检测模式:核酸提取、扩增检测均在同一封闭;4独立模块,随来随测,独立检测。5.目的基因不少于双靶标(ORFlab基因、N基因);6检测最低下限小于500copy/mL;7检测通量≥8;每测试第4标段(6万)(MTHFRC677T基因检测+高血压个体化治疗基因检测+HLAB27核酸检测等)MTHFRC677T基因检测(3个位点)PCR熔解曲线法6万1家每测试人类CYP2C19基因分型检测每测试CYP2D6*10、CYP2C9*3、ADRB1(1165GC)、AGTR1(116AC)、ACE(I/D)检测每测试人运动神经元存活基因1(SMN1)检测每测试测序反应通用试剂盒(高血压个体化治疗基因检测)聚合酶链杂交法每测试测序反应通用试剂盒(叶酸)每测试测序反应通用试剂盒(他汀类)每测试测序反应通用试剂盒(氯比格雷)每测试测序反应通用试剂盒(华法林)每测试测序反应通用试剂盒(硝酸甘油)每测试人类HLAB27核酸检测荧光PCR法每测试高血压个体化治疗基因检测试剂(5个位点)每测试人类HLAB*5801基因每测试B族链球菌核酸检测每测试结核分枝杆菌复合群核酸检测恒温扩增荧光法每测试MTHERC677基因检测PCR金磁微粒层析法每测试第5标段(20万)(免费按需提供检测的质控品、校准品、辅助试剂及一次性耗材)恒温扩增相关试剂(20万)结核TBRNA检测恒温扩增法20万1家每测试乙肝HBVRNA检测每测试泌尿生殖道病原体RNA检测(沙眼衣原体、解脲脲原体、淋病奈瑟菌、生殖支原体)每测试第6标段(5万)细菌耐药基因检测耐甲氧西林金黄色葡萄球菌耐药基因检测荧光PCR法5万1家每测试碳青霉烯耐药基因KPC检测每测试鲍曼不动杆菌耐碳青霉烯类抗生素基因(OXA23)检测每测试耐万古霉素肠球菌基因(vanA,vanB)检测每测试第7标段(20万)呼吸道病原菌核酸检测呼吸道病原菌核酸检测(标段括常见细菌、特殊病原体如嗜肺军团菌、结核分枝杆菌、肺炎支原体、肺炎衣原体、流感嗜血杆菌等)恒温扩增芯片法20万1家每测试第8标段(30万)维生素类检测脂溶维生素(VA,D2,D3,E,K)串联质谱30万1家每测试水溶维生素(维生素B1、维生素B2、维生素B3、维生素B5、维生素B6、维生素B7、维生素B9、维生素B12)每测试类固醇激素类类固醇激素18项(二氢睾酮、脱氢表雄酮硫酸酯、脱氢表雄酮、皮质醇(氢化可的松)、雌酮、17α羟孕酮、孕烯醇酮、皮质酮、11去氧皮质醇、脱氧皮质酮、雄烯二酮、17α羟孕烯醇酮、睾酮、醛固酮、雌二醇、雌三醇、可的松(皮质素)、孕酮)1.82.5ng串联质谱每测试原醛激素5项(醛固酮、血管紧张素I,皮质醇,脱氧皮质酮、可的松)每测试四种激素萃取液(醛固酮、皮质醇,脱氧皮质酮、可的松)每测试血儿茶酚胺代谢检测(肾上腺素、去甲肾上腺素、多巴胺、变肾上腺素、去甲变肾上腺素)每测试尿儿茶8项(DA,E,NE,MN,NMN,3MT,HVA,VMA)每测试高香草酸和香草扁桃酸萃取液每测试人体代谢物浓度胆汁酸谱15项(胆酸、牛磺胆酸、甘氨脱氧胆酸、石胆酸、甘氨胆酸、牛磺熊脱氧胆酸、脱氧胆酸、牛磺石胆酸、甘氨熊脱氧胆酸、熊脱氧胆酸、甘氨石胆酸、牛磺鹅脱氧胆酸、鹅脱氧胆酸、牛磺脱氧胆酸、甘氨鹅脱氧胆酸)串联质谱每测试药物浓度检测免疫抑制剂(他克莫司、环孢霉素A、西罗莫司)药物浓度检测串联质谱每测试抗癫痫药(卡马西平、卡马西平10,11环氧化物、奥卡西平、10羟基卡马西平、丙戊酸/苯巴比妥、苯妥英钠、拉莫三嗪、托吡酯、左乙拉西坦)药物浓度检测每测试抗菌药(万古霉素、伏立康唑、替考拉宁、利奈唑胺、美洛培南、替加环素、莫西沙星、氟康唑)药物浓度检测每测试抗肿瘤药(甲氨蝶呤、氟尿嘧啶、多西他赛、多柔比星)每测试镇静催眠药(阿普唑仑、氯硝西泮、咪达唑仑、劳拉西泮、奥沙西泮、唑吡坦、艾司唑仑、替马西泮、溴西泮)药物浓度检测每测试抗抑郁药(米氮平、帕罗西汀、舍曲林、西酞普兰、艾司西酞普兰、文拉法辛、O–去甲文拉法辛、曲唑酮、氟西汀+去甲氟西汀、氟伏沙明、度洛西汀、安非他酮、羟安非他酮)药物浓度检测每测试抗精神病药(氯氮平及去甲氯氮平、氯丙嗪、利培酮+9–羟基利培酮、喹硫平、阿立哌唑、脱氢阿立哌唑、奥氮平、齐拉西酮、氨磺必利、丙戊酸、舒必利、氟哌啶醇、奋乃静、氟奋乃静)药物浓度检测每测试第9标段(8万)阿司匹林耐药基因检测LTC4S一代测序技术8万1家为临床服用阿司匹林是否存在抵抗提供帮助每测试PTGS1每测试GP1BA高血糖个体化用药基因检测外周血液基因组中的CYP2C9、OCT2、SLCO1B1、PPARy基因多态性性为临床鉴别患者对降糖药物敏感性提供帮助每测试SLCO1B1ApoE检测SLCO1B1检测*1b和*5两个位点;ApoE检测E2和E4两个位点每测试个体化用药指导AGTR1/ACE/ADRB1CY2D6/CYP2C9/CYP3A5/NPPA检测高血压合理用药;总共检测7个基因,10位点每测试CYP2C19氯吡格雷用药每测试CYP2C9VKORC1华法林初始剂量每测试MTHFR检测评判叶酸代谢能力,指导合理补充叶酸每测试ALDH2检测判断硝酸甘油用药无效风险,评估酒精代谢能力每测试细胞因子联合检测试剂细胞因子六联检(IL2\IL4\IL6\IL10\IFNγ\TNFα);流式细胞术(2类注册证)每测试细胞因子七联检(IL2\IL4\IL6\IL10\IL17A\IFNγ\TNFα) 每测试细胞因子八联检(IL2\IL4\IL6\IL10\IL12P70\IL17A\IFNγ、TNFα) 每测试PD1(程序性死亡蛋白1)每测试十二联检(IL1β\IL2\IL4\IL6\IL8\IL10\IL12P70\IL17A\IFNγ\TNFα\IFNα)维生素类检测脂溶维生素(VA,D2,D3,E,K)串联质谱每测试水溶维生素(维生素B1、维生素B2、维生素B3、维生素B5、维生素B6、维生素B7、维生素B9、维生素B12)每测试串联质谱检测3多种氨基酸检测试剂盒串联质谱每测试抗生素药物浓度检测试剂盒(阿米卡星、亚胺培南西司他丁、头孢哌酮舒巴坦、哌拉西林他唑巴坦、美罗培南、替加环素、利奈唑胺、万古霉素、去甲万古霉素、替考拉宁、氟康唑、伏立康唑、醋酸卡泊芬净)每测试第10标段(5万)1白色念珠菌核酸检测荧光PCR法5万1家每测试2光滑假丝酵母菌核酸检测每测试3热带假丝酵母菌菌核酸检测每测试4金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌核酸检测每测试5沙门氏菌和志贺氏菌核酸检测每测试6单纯疱疹病毒1型(HSV1)核酸检测每测试7单纯疱疹病毒2型(HSV2)核酸检测每测试8人感染H7N9禽流感病毒RNA检测每测试9麻疹病毒和风疹病毒核酸检测每测试10人乳头瘤病毒核酸检测及基因分型(至少标段含20种)荧光PCR定量法(无需杂交)每测试第11标段(大明宫)(60万)肝炎系列+新冠抗体+胃蛋白酶原乙型肝炎病毒表面抗体测定试剂盒磁微粒化学发光法60万1家每测试乙型肝炎病毒表面抗原测定试剂盒每测试乙型肝炎病毒e抗原测定试剂盒每测试乙型肝炎病毒e抗体测定试剂盒每测试乙型肝炎病毒核心抗体测定试剂盒每测试乙型肝炎病毒前S1抗原测定试剂盒每测试戊型肝炎病毒IgM测定试剂盒每测试丙型肝炎病毒抗体测定试剂盒每测试胃蛋白酶原Ⅰ测定试剂盒每测试胃蛋白酶原Ⅱ测定试剂盒每测试新型冠状病毒(2019nCoV)抗体检测试剂盒(磁微粒化学发光法)每测试抗HCV质控品每毫升HBcAb质控品每毫升HBeAb质控品每毫升HBeAg质控品每毫升HBsAb质控品每毫升HBsAg质控品每毫升抗HAVIgM质控每毫升抗HEVIgM质控品每毫升白介素6测定试剂盒(CMIA)每测试降钙素原测定每测试超敏C反应蛋白测定每测试肌酸激酶同工酶测定每测试心肌肌钙蛋白I测定每测试心肌肌钙蛋白T测定每测试肌红蛋白测定每测试心型脂肪酸结合蛋白测定每测试N端脑钠肽前体测定每测试白介素6质控品IL6免费提供胃蛋白酶原I质控品PGI免费提供胃蛋白酶原II质控品PGII免费提供人类免疫缺陷病毒抗原抗体测定试剂盒每测试梅毒螺旋体抗体测定试剂盒每测试甲型肝炎病毒IgM抗体测定试剂盒每测试激发液免费提供预激发液免费提供清洗液免费提供整装反应杯免费提供整装吸头免费提供样本稀释液免费提供FDP+DD纤维蛋白/原降解复合物胶乳免疫比浊法/颗粒增强免疫比浊法每测试D二聚体检测每测试FDP、D二聚体控制品每毫升D二聚体校准品每毫升FDP校准品每毫升生化类超敏C反应蛋白免疫比浊法每测试尿微量白蛋白测定每测试糖化白蛋白每测试糖化血红蛋白高压液相色谱法每测试第12标段(6万)多种心脑血管药物基因核酸样本预处理试剂心血管个性化用药指导11基因检测+核酸质谱法6万1家每测试心血管个性化用药指导21基因检测每测试高血压个性化用药指导9基因检测每测试冠心病个性化用药指导4基因检测每测试氯吡格雷+阿司匹林个性化用药基因检测每测试抗栓个性化用药9基因检测每测试儿童安全用药基因检测(核心板)每测试叶酸及营养每测试精神类药物基因核酸样本预处理试剂抑郁症个性化用药指导10基因检测每测试精神分裂症个性化用药10基因检测每测试癫痫个性化用药12基因检测每测试焦虑个性化用药9基因检测每测试肿瘤基因检测核酸样本预处理试剂化疗用药每测试男性18项高发肿瘤风险基因筛查(含BRCA基因)每测试女性21项高发肿瘤风险基因筛查(含BRCA基因)每测试核酸样本预处理试剂遗传性耳聋基因检测(20位点)每测试第13标段(5万)肝癌检测高尔基体蛋白73磁微粒化学发光免疫分析法5万1家每测试甲胎蛋白异质体比率(AFPL3%)每测试异常凝血酶原每测试感染三项1.全程C反应蛋白(CRP)上转发光免疫分析每测试2.血清淀粉样蛋白(SAA)每测试3.降钙素原(PCT)每测试第14标段(8万)ApoE基因型载脂蛋白EApoE基因型检测基因芯片法8万1家每测试第15标段(4万)SDC2基因甲基化检测人类SDC2基因甲基化检测荧光PCR法4万1家每测试第16标段(3万)S9甲基化Septin9基因甲基化检测荧光探针法3万1家每测试第17标段(25万)一次性加样枪头一次性加样枪头200微升迪肯酶免一体机专用25万1家每个一次性加样枪头1000微升每个核酸检测耗材盒装灭菌无酶吸头10微升核酸检测专用每个盒装灭菌无酶吸头100微升每个盒装灭菌无酶吸头200微升每个盒装灭菌无酶吸头1000微升每个加长型滤芯枪头(200ul)每个加长型滤芯枪头(10ul)每个HPV细胞保存液HPV细胞保存液(标段含采样器和保存管)5mlHPV分型专用每管采样管及保存管鼻拭子采样管、咽拭子采样管RNA检测标本采集每个第18标段(2万)六项呼吸道病毒核酸联合检测六项呼吸道核酸联合检测(甲、乙型流感病毒,呼吸道合胞病毒,腺病毒,肺炎支原体,人鼻病毒)荧光PCR法2万1家1具备内源性内标;2.防污染系统。3检测最低下限小于等于500copy/mL每测试六项呼吸道病原菌核酸检测六项呼吸道病原菌核酸检测(肺炎链球菌、肺炎克雷伯杆菌、流感嗜血杆菌、铜绿假单胞菌、嗜肺军团菌、金黄色葡萄糖菌)荧光PCR法1具备内源性内标;2.防污染系统。3检测最低下限小于等于500copy/mL每测试第19标段(1万)传染病三项血液筛查核酸检测HBV+HCV+HIV血液筛查核酸检测荧光PCR法1万1家每测试第20标段(3万)心脑血管疾病风险预测MTHFRC677T基因检测(3个位点)PCR金磁微粒层析法2万1家每测试ALDH2(Glu504Lys)基因检测每测试氧化型低密度脂蛋白金磁微粒免疫层析法每测试S100β蛋白检测每测试早产早破预测胰岛素样生长因子结合蛋白1(IGFBP1)——胶体金与酶免方法1万胎膜早破诊断每测试胎儿纤维连接蛋白(fFN)——早产风险预测每测试第21标段(3万)颗粒酶B及穿孔素联合检测GranzymeB抗体试剂流式细胞计数法2万1家每测试穿孔素(Perforin)抗体试剂每测试CD45检测试剂(APCCy7)每测试CD3检测试剂(PerCP)每测试CD8检测试剂(APC)每测试CD16检测试剂(CD16PECy7)每测试CD56检测试剂(CD16PECy7)每测试HLAB27基因分型HLAB27基因分型检测荧光PCR法1万每测试百日咳杆菌核酸检测百日咳杆菌核酸检测荧光PCR法每测试第22标段(3万)耳聋基因检测遗传性耳聋易感基因检测(至少20种基因位点)PCR反向点杂交2万1家每测试艰难梭菌抗原及毒素快检艰难梭菌谷氨酸脱氢酶抗原GDH及毒素A/B酶联免疫层析法1万每测试第23标段(2万)SDC2和TFPI2基因甲基化联合检测SDC2和TFPI2基因甲基化联合检测试剂盒荧光PCR法2万1家每测试第24标段(2万)呼吸道病毒6项呼吸道合胞病毒、呼吸道腺病毒、人偏肺病毒、副流感病毒Ⅰ型、副流感病毒Ⅱ型、副流感病毒Ⅲ型荧光PCR法1万最低检测限:1000copies/mL每测试诺如病毒核酸检测诺如病毒RNA检测(粪标本)荧光PCR法0.5万每测试肠道病毒核酸检测试剂可检测肠道病毒,如柯萨奇病毒A组2型、4型、5型、6型、7型、9型、10型、12型、16型;柯萨奇病毒B组1型、2型、3型、4型、5型;肠道病毒C组;肠道病毒71型和埃可病毒。荧光PCR法0.5万(咽拭子)每测试合计共24个标段,总计576万元各供应商可选择参投一个或多个标段,可兼投兼中,但必须对所投标段内全部标的进行投标报价,不得缺项、漏项。本项目(不接受)联合体投标。二、申请人的资格要求:1、基本资格条件:符合《政府采购法》第二十二条规定的供应商条件;1.1、提供在中华人民共和国境内注册的营业执照(或事业单位法人证书,或社会团体法人登记证书,或执业许可证)、组织机构代码证和税务登记证复印件【如已办理了多证合一,则仅需提供合证后的营业执照】,如供应商为自然人的需提供自然人身份证明。1.2、提供2021年度任意一个月的财务报表(至少标段括资产负债表、现金流量表和利润表)或具有财务审计资质的单位出具的2020年度财务会计报告或开标日前三个月内基本存款账户银行出具的资信证明(附开户许可证);2021年以后新成立企业提供成立之日至开标前任意一个月的财务报表(至少标段括资产负债表、现金流量表和利润表)或开标日前三个月内基本存款账户银行出具的资信证明(附开户许可证)。1.3、提供2021年以来至少一个月的纳税证明或完税证明(提供增值税、企业所得税至少一种),纳税证明或完税证明上应有代收机构或税务机关的公章或业务专用章。依法免税的供应商应提供相关文件证明。1.4、提供2021年以来至少一个月的社会保障资金缴存单据或社保机构开具的社会保险参保缴费情况证明。依法不需要缴纳社会保障资金的供应商应提供相关文件证明。1.5、提供履行合同所必需的设备和专业技术能力的书面声明。1.6、提供参加政府采购活动前3年内在经营活动中没有重大违法记录的书面声明。2、落实政府采购政策需满足的资格要求:本项目非专门面向中小企业采购。3、特定资格条件:3.1、供应商应授权合法的人员参加投标全过程,其中法定代表人直接参加投标的,须出具法人身份证,并与营业执照上信息一致;法定代表人授权代表参加投标的,须出具法定代表人授权书及授权代表身份证。3.2、投标产品纳入医疗器械(或药品)管理的,须提供供应商有效的医疗器械(或药品)经营许可证或经营备案凭证。3.3、投标产品纳入医疗器械(或药品)管理的,须提供产品有效的医疗器械(或药品)注册证或备案凭证。3.4、若投标产品为进口,供应商须提供有效的完整授权链的产品授权书(授权期限不足2年的须附能够提供持续供货的声明材料,英文授权须提供中文翻译版;制造商直接参与投标的不提供此项)。若投标产品为国产且纳入医疗器械(或药品)管理的,供应商须提供投标产品制造商有效的营业执照和生产许可证。3.5、供应商未被列入“信用中国”网站(www.creditchina.gov.cn)以下情形之一:①记录失信被执行人;②重大税收违法案件当事人名单。同时,在中国政府采购网(www.ccgp.gov.cn)“政府采购严重违法失信行为信息记录”中查询没有处于禁止参加政府采购活动的记录名单。本项目(不接受)联合体投标。三、获取招标文件1、时间:2022年08月01日至2022年08月05日,法定工作日每天上午09:0012:00,法定工作日每天下午14:0017:00(北京时间,法定节假日除外)地点:线上发售方式:(1)根据陕西省人民政府《关于加强新型冠状病毒感染的肺炎防控工作的通告》要求,本次招标文件采用线上发售,供应商在文件发售期以内将单位介绍信(介绍信中必须注明项目名称、项目编号、标段号)、经办人身份证、联系电话及电子邮箱等资料,加盖投标单位公章的彩色扫描件发送至邮箱714884417@qq.com,并及时关注邮箱回复消息。(2)招标文件售价人民币¥7200.00元(本招标项目各标段招标文件之和,每单个标段300元),售后不退。(标书费交纳信息:账户名称:陕西西北民航招标咨询有限公司;开户银行:建行西安高新科技支行;账号:61001925700052502533;转帐事由:项目名称简称、编号、标段号,如以个人名义转入,须备注单位名称。财务电话:029883479258013),采购代理机构在收到邮件并确认文件收费到账后,通过邮箱向供应商发售招标文件,请及时查收。四、提交投标文件截止时间、开标时间和地点提交投标文件截止时间:2022年08月24日09时30分(北京时间)开标时间:2022年08月24日09时30分(北京时间)地点:西安市唐延路3号唐延国际中心AB区8楼开标室五、公告期限自本公告发布之日起5个工作日。六、其他补充事宜:(1)招标文件售价为每标段300元。(2)本项目接受进口产品投标。(3)采购项目需要落实的政府采购政策:1、《财政部国家发展改革委关于印发〈节能产品政府采购实施意见〉的通知》(财库〔2004〕185号);2、《国务院办公厅关于建立政府强制采购节能产品制度的通知》(国办发〔2007〕51号);3、《财政部环保总局关于环境标志产品政府采购实施的意见》(财库〔2006〕90号);4、《财政部司法部关于政府采购支持监狱企业发展有关问题的通知》(财库〔2014〕68号);5、《三部门联合发布关于促进残疾人就业政府采购政策的通知》(财库〔2017〕141号);6、《财政部发展改革委生态环境部市场监管总局关于调整优化节能产品、环境标志产品政府采购执行机制的通知》(财库〔2019〕9号);7、《关于运用政府采购政策支持乡村产业振兴的通知》(财库〔2021〕19号);8、《政府采购促进中小企业发展管理办法》(财库〔2020〕46号);9、陕西省财政厅关于印发《陕西省中小企业政府采购信用融资办法》(陕财办采〔2018〕23号)。七、对本次招标提出询问,请按以下方式联系。1.采购人信息名称:西安交通大学第二附属医院地址:西安市西五路157号联系方式:冯老师029876798612.采购代理机构信息名称:陕西西北民航招标咨询有限公司地址:西安市唐延路3号唐延国际中心AB区8楼联系方式:佘冰霞029883479878046/139912653493.项目联系方式项目联系人:佘冰霞电话:029883479878046/13991265349(2022.07.27)重新招标公告分子组及大明宫耗材项目.pdf