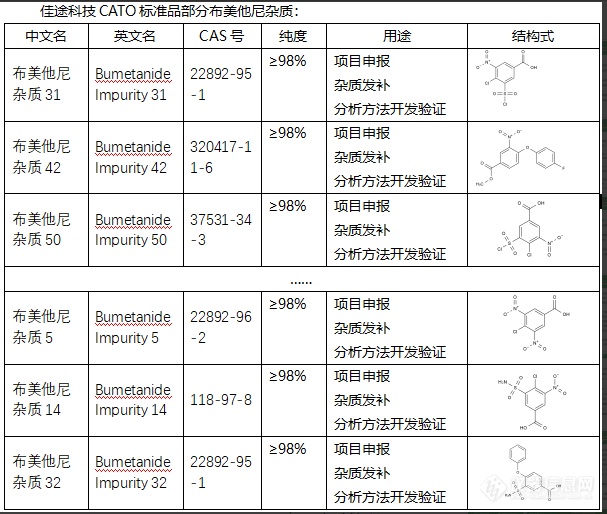
布美他尼杂质是药物布美他尼制剂中可能存在的杂质,这些杂质可能来源于原料药的生产过程、制剂的准备过程或者储存过程。1. 影响药效:药物中含有过多的杂质可能会影响药物的药效,产生药效不稳定、药效降低等问题。2. 影响安全性:部分杂质可能具有潜在的毒性,长期或高剂量使用可能对人体造成伤害。严重情况下可能出现药品不良反应甚至中毒。3. 影响药物的稳定性:不同类型的杂质结构,可能影响药物的稳定性,例如酸性或碱性杂质可能引起药物分解,导致药效降低或失效。4. 影响药物的外观质量:杂质可能会影响药物的外观性状,如颜色、透明度和溶解性等。因此,确定和控制药物中的杂质是药品质量控制的重要环节。CATO标准品对于药物杂质的研究,主要包括杂质的来源、形成机理、控制策略和杂质的鉴定、定量测定等内容。[img=,607,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402041444015575_2473_6381668_3.png!w607x514.jpg[/img]

[align=center]Ghost-Buster 流动相杂质捕集柱[/align][align=center][img=,300,242]http://ng1.17img.cn/bbsfiles/images/2017/09/201709061345_01_932_3.jpg[/img][/align][align=left][b]ghost peak (鬼峰)[/b]是指,在某个谱图里出现,可能同样的条件再做一次又不出现了,时有时无,没有规律的异常色谱峰。鬼峰一般在梯度洗脱时出现的几率更大,它的出现意味着 流动相中的微小成分和杂质 在柱子的初始比例平衡过程中富集在柱子上,当梯度中流动相洗脱能力变大时,这些东西会象样品一样从柱子上脱离出现峰。[/align][align=left][b]危害[/b]:对样品成分误判断与目标峰重叠,影响分离度增加工作量要做更多的验证工作去判定这个物质是否是目标物质污染仪器[b][/b][/align][align=left][b]来源:[/b]水有很多途径带来杂质净化系统本身存储容器引入和放置时间太长导致细菌生长各种流动相添加剂,盐,酸,碱等一系列的有机污染物[b] 杂质捕集柱使用方法:[/b]1、使用时将杂质捕集小柱安装在梯度混合器和进样器之间。2、流动相中如果使用离子对试剂时,可能会吸附离子对试剂进而影响目标物的保留时间或者峰型[b],这一类的流动相条件建议试用[/b]。3、捕集小柱的寿命与色谱分析条件、流动相品牌及其纯度相关,如捕集效果变差后,[b]建议及时更换,并不是连接上以后无限次使用的[/b]。4、杂质捕集小柱作为仪器的一个小部件,相当于仪器上的在线过滤器,只是说在线过滤器只能过滤固体颗粒物,而杂质捕集小柱不仅仅过滤固体颗粒物,还能净化流动相中的有机污染物,对仪器和色谱柱是更好的保护;5、使用缓冲盐流动相前后注意使用高比例的水进行过渡冲洗,避免换成盐析出,导致填料堵塞。[/align][align=left][/align][align=center][img=,500,197]http://ng1.17img.cn/bbsfiles/images/2017/09/201709061347_01_932_3.jpg[/img][/align][align=center][/align][align=center][img=,500,224]http://ng1.17img.cn/bbsfiles/images/2017/09/201709061347_02_932_3.jpg[/img][/align][align=left][b]使用杂质捕集柱的效果:[/b]消除梯度条件流动相中紫外吸收的杂质产生的鬼峰;消除了梯度条件下基线漂移现象;对目标物进行准确的定量。[/align][align=left][b]其他常见问题:[/b]1、 检测不同的品种,流动相不一样需要取下吗?答:不需要刻意取下来,除非出现出峰位置改变等不满足要求的情况。2、 等度条件需要使用吗?答:建议使用,等度条件下没有检测出来异常峰,只是在等度条件下流动相的洗脱能力都是一样的,所以一般检测不到峰,不代表流动相就没有污染物。3、 在梯度系统中,增加的混合滞后体积影响分离效果怎么办?答:一般杂质捕集小柱是链接在混合器和进样器之间,4.6*50mm规格的体积是[color=#ff0000]400ul,[/color]对常规检测的影响不大,如果有影响,请将捕集柱链接到混合器或者切换阀前水相通道。[/align][align=left]4、 仪器空间不大,客户反馈放不进去,怎么办?答:可以送给客户一定长度的peek管和接头,或者客户自己实验室里的都可以,连接到进样器上流动相入口位。[/align]
0.05%)的位置和出处,但是我发现大多杂质分离度都在1以下,理论塔板数都偏小(有些只有几百),这样我选的杂质峰还有意义不??
这段时间我分析的样品是不溶于水的,于是用乙腈-水做溶剂来稀释样品。色谱柱是 Agileng XDB C18(250*4.6mm,5um),流速是2.0ml/min。流动相是辛烷磺酸钠溶液-乙腈(60:40)。辛烷磺酸钠溶液不是很浓,是由 4.35g辛烷磺酸钠用2000ml水稀释得到。每天分析结束后我都用水-乙腈(60:40)先冲洗柱子100分钟,再换纯甲醇冲洗100分钟。第二天用时先用水-乙腈(60:40)过30分钟柱子后再换流动相。可是就这样做了大概50针样品后。柱子就柱压特高,柱效降低,拖尾造成主峰后相邻杂质峰分不开。我真的很困惑,请各位帮帮忙。谢谢!
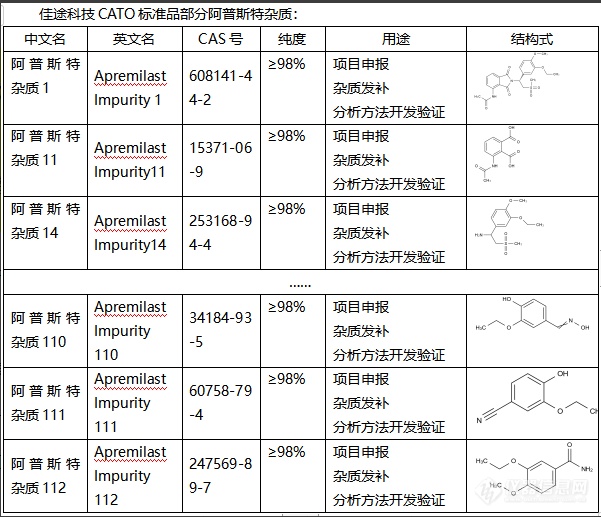
阿普斯特杂质(Acceptor impurities)在半导体中起到了非常关键的作用。1. 提供洞:阿普斯特杂质是电子受主,它会吸收自由电子,形成空穴(或称为“洞”)。这些空穴可以移动,起到电流传导的作用。因此,添加阿普斯特杂质后,半导体的导电性能会增强。2. 形成P型半导体:当阿普斯特杂质的浓度足够高时,半导体中的空穴数量将超过电子数量,形成了主导电流传导的是空穴的P型半导体。3. 局域能级:阿普斯特杂质也能产生在能带间的局域态,充当了能量级的“桥梁”,使电子更容易通过能阶间跃迁,也有助于电流的传导。CATO标准品改变半导体性质:通过改变阿普斯特杂质的种类和浓度,可以改变半导体的性质,如导电性、光学性质、磁性等,使之满足特定的使用需求。[img=,601,517]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021700369834_2567_6381668_3.png!w601x517.jpg[/img]
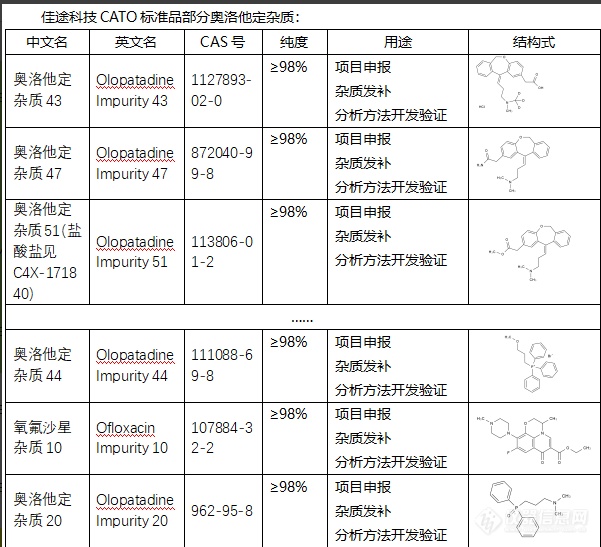
奥洛他定是一种用于治疗孤独症、精神分裂症和双相情感障碍的药物。在其生产过程中可能产生一些杂质。这些杂质可能源于原料、废弃的生产物或制造过程中的化学反应。过多的杂质可能会干扰药物的效力,引起不良反应,甚至影响患者的安全性。因此,对奥洛他定药品的杂质进行严格的检测和控制是非常重要的。制药公司必须遵循严格的质量控制程序,以保证药品的质量和安全性。CATO标准品对奥洛他定杂质进行研究和分析,可以为改善和优化制造过程,以及提高药品质量提供有价值的信息。通过了解含有哪些杂质,及其如何形成,制药厂商可以改进其生产过程,以减少杂质的产生,并提高药物的纯度和效力[img=,601,547]https://ng1.17img.cn/bbsfiles/images/2024/02/202402052109512474_2064_6381668_3.png!w601x547.jpg[/img]
各位高手:我现在遇到很棘手的问题,希望大家帮帮忙,着急啊。草甘膦含量95%以上,杂质含量0.5%以上的都要能够检测出。杂质包括:甘氨酸,亚氨基二乙酸,双甘膦,增甘膦。整个检测时间不超过15分钟,并且检测方法不能太复杂。检测器可为紫外或者DAD或ELSD或其他都可以。希望各位高手指点指点阿。我都快急疯了。谢谢阿。
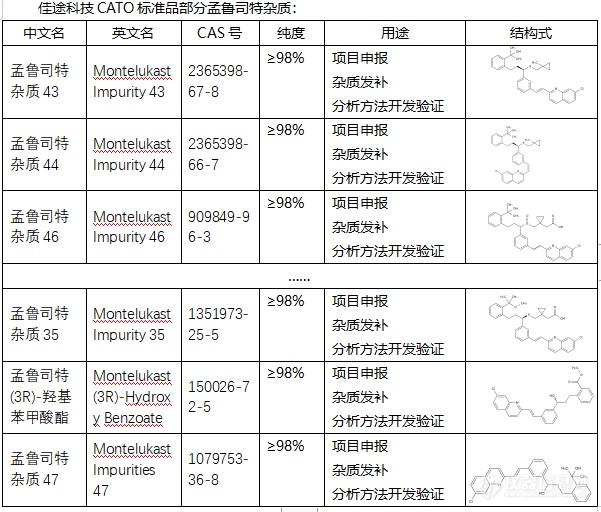
[font=宋体]◇孟鲁司特[/font][font=宋体]杂质[/font][font=宋体] 孟鲁司特[/font][font=宋体],[/font][font=宋体]其英文名为[/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]Montelukast[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe],[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]也被称为孟鲁司特钠,[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]它[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]是一种白三烯受体拮抗剂[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]。[/back][/color][/font][font=宋体]孟鲁司特[/font][font=宋体]的[/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]原理机制主要是通过抑制白三烯受体和阻断炎症介质[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]的[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]释放,[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]它[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]能够与白三烯受体结合,竞争性地阻止白三烯与受体结合,从而抑制白三烯的活性,减轻炎症反应[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]。[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]所以在临床上,[/back][/color][/font][font=宋体]孟鲁司特[/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]主要用于预防和治疗哮喘以及过敏性鼻炎[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]。[/back][/color][/font][font=宋体][font=Calibri] CATO[/font][font=宋体]标准品提供的孟鲁司特全套的杂质[/font][/font][font=宋体],[/font][font=宋体]这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分[/font][font=宋体]。[img=,601,512]https://ng1.17img.cn/bbsfiles/images/2024/02/202402062150449184_6802_6381607_3.png!w601x512.jpg[/img][/font][font=宋体][color=#05073b][back=#fdfdfe] 广州[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]佳途科技[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]股份有限公司[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]深知药物研发与质量控制的重要性[/back][/color][/font][font=宋体][font=宋体],[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供孟鲁司特全套[/font][/font][font=宋体]的[/font][font=宋体]杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展[/font][font=宋体]。[/font]
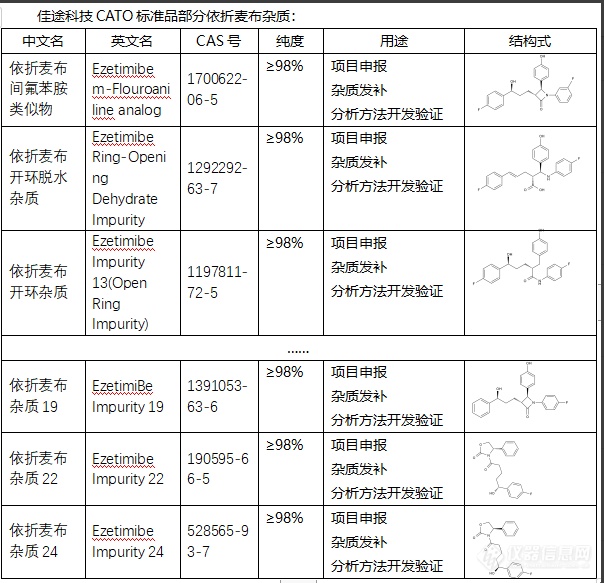
依折麦布是一种抗凝血药物,用于预防和治疗血栓和栓塞疾病。然而,在其生产过程中可能会生成杂质。依折麦布杂质可能会影响依折麦布的质量、疗效和安全性。如果杂质存在过多,可能对药物的抗凝作用产生干扰,造成药效减弱;此外,某些杂质可能对人体产生毒性,增加药物的副作用,甚至引发不良反应。因此,对于依折麦布的杂质需要通过有效的生产工艺和质量控制手段进行控制,以确保药物的质量和安全性。同时,药物注册时,也需要对杂质进行详细的评估,并提供关于杂质来源、性质、水平以及控制措施等的信息。在实际研究过程中,杂质的研究和控制也是药品研发的重要部分。CATO标准品通过研究依折麦布的杂质,可以进一步了解其化学性质和生理作用,有助于更好地理解和优化药物的生产过程,提高药品的质量和疗效。[img=,604,583]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021712539448_6005_6381668_3.png!w604x583.jpg[/img]
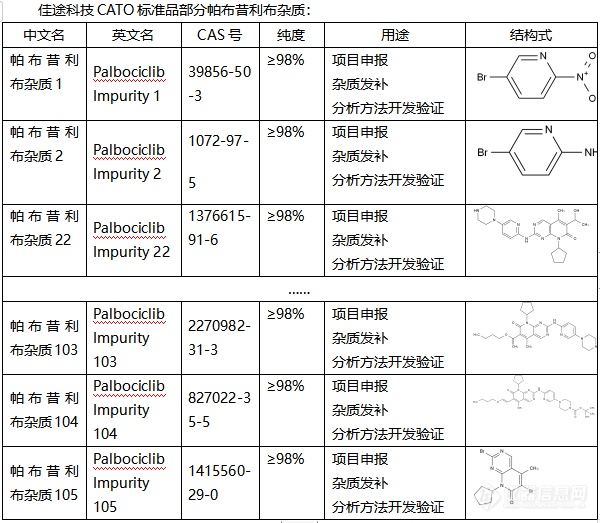
◇关于帕布昔利布杂质 帕布昔利布杂质是一种治疗乳腺癌的杂质,它也是一种新型的CDK4/6抑制剂,它是FDA首个获得批准的药物。帕布昔利布杂质是通过调节细胞周期,抑制CDK4和CDK6的活性,从而阻止细胞从G1期进入到S期,进一步抑制DNA的合成。 帕布昔利布首次于 2015 年 2 月在美国获得批准,CATO标准品提供的帕布昔利布杂质,在妇女绝经后的人群中还显示它还可以与来曲唑合并用于 HR+、HER2-晚期或转移性乳腺癌治疗。[img=,600,523]https://ng1.17img.cn/bbsfiles/images/2024/02/202402040904326373_1427_6381607_3.png!w600x523.jpg[/img]
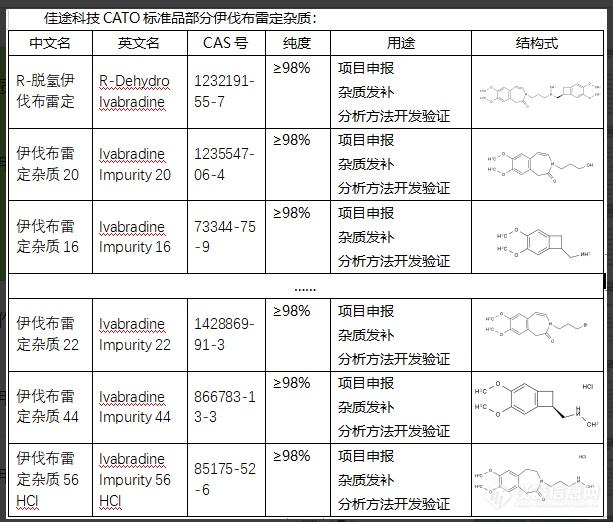
伊伐布雷定是一种用于治疗成人和儿童音乐综合症等疾病的药物。在伊伐布雷定的制造过程中,可能会产生一些杂质。这些伊伐布雷定杂质可能由化学反应生成,也可能来自原始材料。无论杂质来源如何,过多的杂质可能会影响药品的质量、疗效和安全性。例如,一些杂质可能会导致药物的疗效降低,或者引发不良反应。因此,制药公司必须在生产过程中严格检测和控制这些杂质,以确保药品的质量和安全性。CATO标准品对杂质进行研究和分析也可以有助于优化制药过程,例如,找出产生杂质的环节并进行调整,以减少杂质的生成。这有助于提高药品质量,保证疗效,保证患者的安全。[img=,613,522]https://ng1.17img.cn/bbsfiles/images/2024/02/202402052104420028_3541_6381668_3.png!w613x522.jpg[/img]
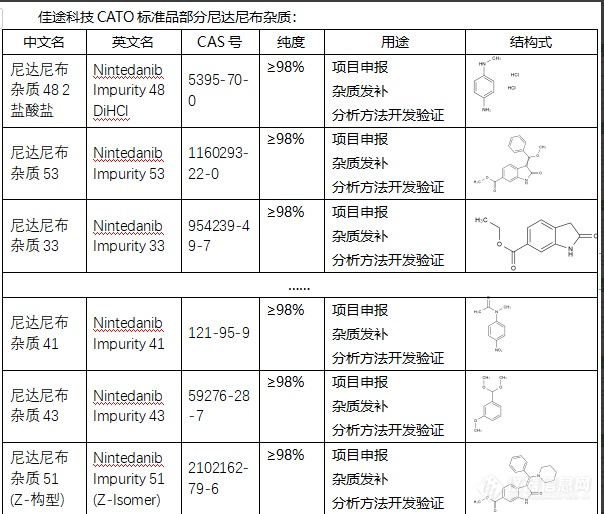
尼达尼布杂质可能会对药物的药理活性产生不利影响,导致药效降低。比如,有可能降低尼达尼布对肿瘤细胞的抑制作用,从而影响治疗效果。另一方面,尼达尼布杂质可能对人体产生毒性反应,对患者的身体健康产生不良影响。例如,有可能引起过敏反应,导致患者出现皮疹、呼吸困难等症状。但是,值得注意的是,这些展示都是可能性,并不一定在所有情况下都会发生。具体情况需要根据尼达尼布药品中杂质的类型和含量来判断。为了避免杂质对药物效果的影响,CATO标准品在药品生产中会进行严格的质量控制,对杂质进行有效的控制和清除。同时,掌握和理解杂质的产生机制,也有助于进一步完善和优化药品的生产工艺。[img=,604,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402041439114552_8061_6381668_3.png!w604x514.jpg[/img]
[align=center] [/align][font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]CDE:请提供1.0g加速6月有关物质结果,将其和0.25g加速6月试验结果放同一表格,并对二者杂质的增长趋势情况作适当总结 背景:一个增加规格的项目发补,0.25g是增加规格,1.0g是获批规格 第一次解释 杂质对比见下表 [/color][/size][/font][font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font] [img=,600,148]https://file3.foodmate.net/attachment/forum/202408/24/185459wm0qmcki9g4c6mi4.png.thumb.jpg[/img] [font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font][font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444] 由上表可知,0.25g杂质R和最大单杂的含量高于1.0g的 关于杂质R 杂质R为水解产物,0.25g的水分明显高于1.0g,这是0.25g杂质R含量高于1.0g的主要原因 关于最大单杂 0.25g最大单杂为RRT0.83,1.0g最大单杂为RRT1.16。其中RRT0.83是0.5g和1.0g的共同杂质,为高温降解杂质 如低规格的杂质含量大于高规格的,为什么一文处理数据,见下表,0.25g “瓶内空气体积/理论装量”明显高于1.0g的,即0.25g的氧气较1.0g的相对丰富,而0.25g的水分高于1.0g的,这两个因素可能是0.25g的 RRT0.83未知杂质(最大单杂)增长趋势高于1.0g的原因 [/color][/size][/font][font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font] [img]https://file3.foodmate.net/attachment/forum/202408/24/185649qvttiz78te17izlt.png.thumb.jpg[/img] [font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font][font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444] [/color][/size][/font][font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]CDE不认同最大单杂的解释 猜测原因是最大单杂的含量高于鉴定限(鉴定限为0.10%) [/color][/size][/font][font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font] [img]https://file3.foodmate.net/attachment/forum/202408/24/185710sb0xzo4u04pmfo3x.png.thumb.jpg[/img] [font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font][font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444] 第二次解释 0.25g最大单杂为RRT0.83,1.0g最大单杂为RRT1.16 0.25g的最大单杂高于1.0g的原因是RRT0.83未知杂质与杂质R分离效果不佳,而采用“垂直”积分方式使0.25g的RRT0.83未知杂质的峰面积明显积大了,垂直积分与切线撇去思路不合适本例 [/color][/size][/font][font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font] [img]https://file3.foodmate.net/attachment/forum/202408/24/185747ozdk6gb3jk9i9v66.png.thumb.jpg[/img] [font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]分离不佳影响准确性,对有关物质分析方法进行优化为:[/color][/size][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]1、因流动相中磷酸盐缓冲液的浓度较高,在梯度洗脱中存在盐析会缩短色谱柱寿命,故把盐浓度降低一半[/color][/size][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]2、梯度的初始比例为高纯水会使色谱柱的填料流失,故把初始梯度比例调整为初始梯度的有机相比例由1%调整至5%[/color][/size][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]杂质R与其相邻的未知杂质达基线分离,见下图[/color][/size][/font] [img]https://file3.foodmate.net/attachment/forum/202408/24/185820jttt55cf1kwtwf1k.png.thumb.jpg[/img] [font=Tahoma, Helvetica, SimSun, sans-serif][color=#444444][/color][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444] [/color][/size][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]优化后方法,各已知杂质分离度满足要求,出峰顺序没有改变,与优化前方法同步检测3批样品的结果基本一致,表明专属性和准确性满足要求(言外之意:优化后方法无需验证,只需对比3批样品的检测结果)[/color][/size][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]用优化后方法检测两个规格的长18月样品,最大单杂的含量相当(RRT也一致)[/color][/size][/font] [font=Tahoma, Helvetica, SimSun, sans-serif][size=18px][color=#444444]在批件里,CDE接收原分析方法但要求稳定性继续关注最大单杂的变化趋势[/color][/size][/font]
最近我们在做阿伐他汀中3位上的羟基变成甲氧基那个杂质,我们判断它相对阿伐他汀峰的相对保留时间是0.89,但是阿伐他汀前面一直没有峰出现,我想请我问下是不是我们的判断是错误的,还是我们这个杂质一直没有做出来。
公司想采购2台电位滴定仪,领导想在万通和梅特勒之间选择1个,他希望看到公开发布的仪器广告,最好是杂志上公开发表。谁见过这2家公司的杂志广告吗?请提供杂志名称和期号。谢谢!
索非布韦杂质是一种化学物质,它是索非布韦的同分异构体或相关化合物。索非布韦是一种直接作用在肝脏的抗病毒药物,用于治疗丙型肝炎。COTO标准品是一种高纯度的标准物质,用于测定索非布韦及其杂质的纯度、含量和化学性质。通过与COTO标准品进行对比和分析,可以确定索非布韦及其杂质的结构、组成和含量,从而保证索非布韦的质量和安全性。在药物研发和生产过程中,COTO标准品的使用非常重要。它可以提供可靠的参照物,用于质量控制、药物分析和化学计量学研究。通过使用COTO标准品,可以确保索非布韦及其杂质的准确性和可靠性,为药物的安全性和有效性提供保障。总的来说,COTO标准品在索非布韦杂质的研究和控制中具有重要作用。通过使用COTO标准品,可以更好地了解索非布韦及其杂质的性质和含量,从而确保药物的安全和有效性。同时,也需要加强生产过程中的管理和监督,加强质量标准和监管措施的执行力度,确保药物质量和安全。
样品前处理:样品是浓度为1ug/L的标准品溶液,用乙酸铵溶液稀释(没加乙酸调到ph5.2 )1、净化(分别测试了waters MCX和安捷尔阳离子交换柱):6ml甲醇、6ml水、6ml 2%甲酸水溶液依次过柱2、上5ml样品,然后依次6ml水、6ml甲醇过柱冲洗杂质3、洗脱:洗脱分别用过6%氨甲醇溶液、50%乙酸乙酯-甲醇溶液、5%氨水甲醇溶液4、氮气吹干后、1ml 0.1%甲酸水溶液定容,过滤上机。最终结果,沙丁胺醇在72-80%,特步它林57-70%,莱克多巴胺40-80%,克伦特罗46-58%。想请教各位大侠,回收率怎么提升到90%以上,前处理方法怎么还能改进呢?求助求助求助!已经焦头烂额了,不知道是没吸附上还是没洗脱下来?
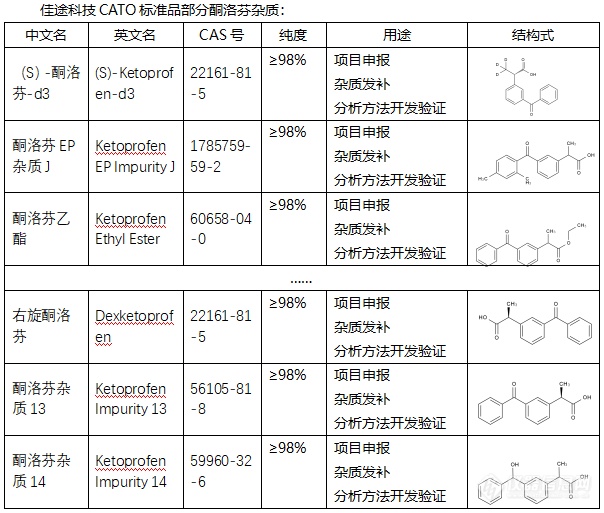
[font=宋体]◇关于酮洛芬杂质[/font][font=微软雅黑]酮洛芬杂质[/font][font=微软雅黑][color=#666666]是一种非甾体类抗炎[/color][/font][font=微软雅黑][color=#666666]杂质[/color][/font][font=微软雅黑][color=#666666],[/color][/font][font=微软雅黑][color=#666666]它的两个[/color][/font][font=微软雅黑][color=#666666]主要成分为对乙酰氨基酚、阿司匹林。[/color][/font][font=微软雅黑]酮洛芬杂质[/font][font=Helvetica][color=#333333]具有镇痛、消炎及解热作用[/color][/font][font=宋体][color=#333333],[/color][/font][font=微软雅黑][color=#666666]临床上主要用于缓解轻至中度疼痛以及发热等症[/color][/font][font=微软雅黑][color=#666666],[/color][/font][font=微软雅黑]酮洛芬杂质[/font][font=微软雅黑]的原理机制是[/font][font=微软雅黑][color=#666666]通过与体内前列腺素合成途径中的环氧合酶结合而起[/color][/font][font=微软雅黑][color=#666666]效果[/color][/font][font=微软雅黑][color=#666666],并且可以减少细胞内花生四烯酸转化为前列腺素的过程[/color][/font][font=微软雅黑][color=#666666]。[/color][/font][font=宋体][color=#333333]相比其他抗炎杂质,其不良反应更小[/color][/font][font=Helvetica][color=#333333]30%一90%[/color][/font][font=宋体][color=#333333]是以尿液[/color][/font][url=https://baike.baidu.com/item/%E8%91%A1%E8%90%84/0?fromModule=lemma_inlink][font=Helvetica][color=#136ec2]葡萄[/color][/font][/url][font=Helvetica][color=#333333]糖醛酸结合物形式[/color][/font][font=宋体][color=#333333][font=宋体]在[/font][font=Helvetica]24[/font][font=宋体]小时内排[/font][/color][/font][font=宋体][color=#333333]出。[/color][/font][font=宋体][font=Calibri]CATO[/font][font=宋体]标准品提供的酮洛芬杂质[/font][/font][font=宋体],[/font][font=宋体]对[/font][font=宋体][color=#333333]各种关节炎以及痛风有十分显著的效果。[/color][/font][img=,604,513]https://ng1.17img.cn/bbsfiles/images/2024/02/202402042137581297_3118_6381607_3.png!w604x513.jpg[/img]
高纯磷的质量数是31。如果采用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]方法测定的话,影响太多,有什么方法可以解决?或者是采用哪种分析方法(设备)更为妥当一些?现在可以查找的是可以使用AES法测定高纯磷的杂质,我想问的是除了AES以外的方法。
请问:关于用DAD检测器检测共流出杂质的问题。我做食品中一种成分的检测,但是要用二极管阵列检测器确定是否和这种成分有共流出的杂质,我看了一篇国外的资料,他说看杂质因子是否远大于域值,如果是的话就说明该种物质不含共流出的杂质。这些我不是很懂希望用过DAD的老师解答一下,谢谢,原文:Purity factor is calculated based on the similarity in the shape of spectra and, if the peak is pure,the purity value should be greater than the threshhold value, calculated by taking into account the system baseline noise
看了岛津、月旭的杂质捕集柱,还有一些国产的,但是没用过,不知道哪个牌子好用,主要是装在waters e2695的仪器上,用过的大家求推荐一下!
因为换了工作,对现在公司的一些处理方式很不理解,问了一些同事,发现他们也不懂,只知道一直以来是按照那样用。可是我认为那样不对,遂发上来和大家讨论。以下说的都是我现在所在公司的做法:1.在进样之前,先进一针LOQ(定量限)溶液,如果LOQ中特定峰S/N(信躁比)=10或者连续进三针,峰面积RSD=10%(根据具体而定),则认为LOQ通过,否则不通过,不能进行后面的分析。2.在LOQ通过的情况下,进样品,然后用面积归一化法,对图谱进行分析,据此得出各杂质的含量,前面进的LOQ得到的数据不参与结果的计算。3.对于色谱图中,小峰的处理是这样的,峰面积百分比=LOQ(比如0.1%,将样品溶液稀释1000倍)则积上,否则不积。对于这样的做法,我主要有以下几个疑问:1.LOQ不是在做方法验证的时候才需要做吗?而且药典(包括USP)上明确写了,除了杂质定量外,都可以不做。那么每次都做个LOQ,有意义,有必要吗?2.将样品溶液稀释1000倍,得到的是浓度,怎么直接把它给转换成了峰面积比?这样科学吗?当然了,不考虑响应值的不同,即不引入校正因子。3.想问一下,大家对小峰是怎么处理的呢?一个小峰到底积不积上,根据什么来判断呢?我们以前基本是根据经验的。4.药典上不是说用面积归一化法对杂质进行定量分析是很不准确的吗?那仍然这样分析是否合理。5.药典上说的杂质定量都是与自身比对(与另一低浓度),那么我们这样的做法科学吗?希望大家不吝赐教!
我们用的仪器是岛津LC-20A系列的,样品中同一个杂质,不同的进样量,杂质含量变化很大。因为可能与样品性质和色谱柱型号有关系,会使峰型拖尾,峰型总是比较胖的。所以我想问一下,这会不会和理论塔板数有关系?
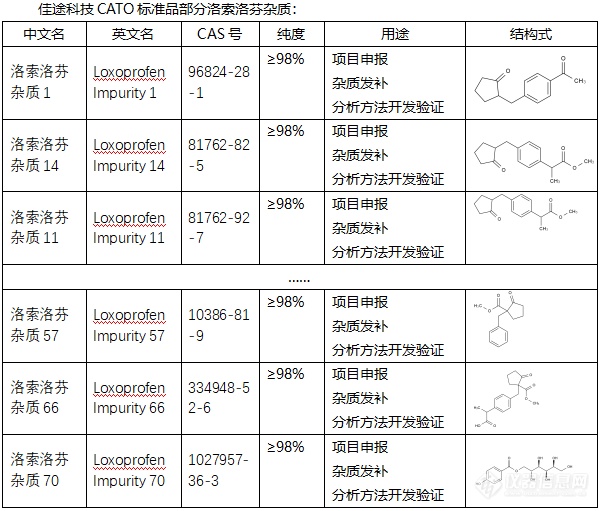
◇关于洛索洛芬杂质 洛索洛芬杂质是一种[font=Arial][color=#333333][font=宋体]非甾体抗炎[/font][/color][/font]杂质,具有镇痛、抗炎症以及解热作用。索洛芬钠杂质主要通过以下机制发挥药效:一、抑制环氧化酶:这种酶在炎症过程中起着重要作用,通过抑制它能够减少前列腺素的生成。二、[font=.pingfang sc]阻断前列腺素合成:洛索洛芬钠片通过作用于环氧合酶([/font]COX)的特定位置,阻止了前列腺素的合成,从而起到了抗炎和镇痛的效果。[font=UICTFontTextStyleBody] [/font][font=UICTFontTextStyleBody]CATO[/font]标准品提供的[font=宋体]洛索洛芬杂质[/font][font=宋体],有着广泛的作用,其中它的镇痛效果十分显著。[img=,601,511]https://ng1.17img.cn/bbsfiles/images/2024/02/202402041058193581_5312_6381607_3.png!w601x511.jpg[/img][/font]
想问下大家,现在杂质捕集柱都有哪些牌子的,哪个牌子比较好用!!!谢谢[img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010221138139319_2077_4234095_3.png[/img]
提供盐酸曲美他嗪欧洲药典杂质标准品Trimetazidine for system suitabilityImp. A (EP) as Dihydrochloride: 1-(3,4,5- Trimethoxybenzyl)piperazine DihydrochlorideImp. B (EP): 1,4-Bis(2,3,4-trimethoxy-benzyl)piperazineImp. C (EP): 2,3,4-TrimethoxybenzaldehydeImp. D (EP): (2,3,4-Trimethoxyphenyl)methanolImp. E (EP) as Dihydrochloride: 1-(2,4,5- Trimethoxybenzyl)piperazine DihydrochlorideImp. F (EP) as Dihydrochloride: 1-(2,4,6-Tri- methoxybenzyl)piperazine DihydrochlorideImp. G (EP) as Hexahydrate: Piperazine HexahydrateImp. H (EP): Ethyl 4-(2,3,4-Trimethoxybenzyl)- piperazine-1-carboxylate1-Formyl-4-(2,3,4-trimethoxybenzyl)piperazine Hydrochloride
食用油的不溶性杂质,看了国标,感觉有点懵,对于坩埚过滤器怎么使用呢
[align=center]奥美拉唑成品中杂质的质量检测[/align][align=center][b]摘要:目的:[/b]在对奥美拉唑原料药中引入的基因毒性杂质,即4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺设定质量检测方法,并进行方法验证。同时,对合成工艺中引入的残留溶剂进行质量检测,确保奥美拉唑成品的质量安全。[b]方法:[/b]在对4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行质量检测中,采用液相色谱的方法,并对其进行限度验证;而对残留溶剂采用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url],利用内标法进行质量检测。[b]结果:[/b]本研究对两种基因毒性杂质及残留溶剂的检测是可行有效的,有利于对奥美拉唑原料药的质量监控,同时为后续对奥美拉唑质量标准的制定提供理论依据。[b]关键词:[/b]奥美拉唑;质量标准;毒性杂质;残留溶剂[/align][b]Abstract Objective[/b]: Themass detection is set in the introduction of genotoxic impurities into theomeprazole APIproducts, namely 4-methoxy-2-nitroaniline and4-methoxy-o-phenylenediamine, and the method was verified.At the same time, the quality of theresidual solvent introduced in the synthesis process is checked to ensure thequality and safety of the omeprazole.[b]Methods:[/b]In the mass detection of4-methoxy-2-nitroaniline and 4-methoxy-o-phenylenediamine, the method of liquidchromatography is used, and the limit is verified the residual solvent aretested by the gas chromatogram and internal standard method for quality.[b]Results:[/b]This study is feasible and effective for the detection of twogenotoxic impurities and residual solvents, which is the benefit of qualitymonitoring of omeprazole APIproducts, and provides a theoretical basis forthe subsequent development of omeprazole quality standards.[b]Keywords:[/b] Omeprazole Quality standard Genotoxicimpurities Residual solvents随着人们平时工作、学习等压力的不断增加,导致消化类疾病患病率不断上升,而在中国,发病率已达到20%左右[sup][/sup]。用于治疗消化类疾病的药物也逐步成为生活中的常用药,其发展市场也在不断扩大。在消化系统溃疡类疾病的临床治疗中,质子泵抑制剂类药物因其具有良好的治疗效果,市场销售份额高达58%[sup][/sup]。而奥美拉唑是质子泵抑制剂类的代表药物,通过抑制胃酸分泌,用于治疗胃溃疡、十二指肠溃疡等疾病。但长期服用奥美拉唑存在着潜在风险,可能会引起心脏类疾病等。且其生产过程引入的有机杂质、基因毒性杂质、无机杂质或残留的有机溶剂等均对人体健康有一定危害。因此,建立奥美拉唑引入杂质或残留有机溶剂的质量检测方法是十分有必要的,严格控制质量标准,把控药品市场质量安全。[b]1 仪器与材料1.1 实验仪器[/b]高效液相色谱仪(THERMO SCIENYIFIC, Mltimate3000);电子天平(METTLER-TOLEDO、BP-210S) [url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url](Agilent 6890N)顶空进样器(Agilent 7694E)[b] 1.2 实验试剂[/b][align=center][b]表1-1 实验所需试剂[/b][/align] [table][tr][td=2,1] [align=center][b]实验试剂[/b][/align] [/td][td] [align=center][b]厂家[/b][/align] [/td][/tr][tr][td=2,1] [align=center]磷酸二氢钾[/align] [/td][td] [align=center]莱阳经济技术开发区精细化工厂[/align] [/td][/tr][tr][td=2,1] [align=center]氢氧化钾[/align] [/td][td] [align=center]国药集团[/align] [/td][/tr][tr][td=2,1] [align=center]乙腈[/align] [/td][td] [align=center]Fisher Scientific[/align] [/td][/tr][tr][td=2,1] [align=center]4-甲氧基-2-硝基苯胺[/align] [/td][td] [align=center]北京百灵威科技有限公司[/align] [/td][/tr][tr][td=2,1] [align=center]4-甲氧基-邻苯二胺[/align] [/td][td] [align=center]Alfa Aesar[/align] [/td][/tr][tr][td=2,1] [align=center]奥美拉唑[/align] [/td][td] [align=center]寿光富康制药有限公司[/align] [/td][/tr][tr][td=1,6] [align=center]分析纯[/align] [/td][td] [align=center]丙酮[/align] [/td][td] [align=center]西陇化工股份有限公司[/align] [/td][/tr][tr][td] [align=center]甲醇[/align] [/td][td] [align=center]Fisher Scientific[/align] [/td][/tr][tr][td] [align=center]苯[/align] [/td][td] [align=center]天津富宇化工有限公司[/align] [/td][/tr][tr][td] [align=center]甲苯[/align] [/td][td] [align=center]莱阳经济技术开发区精细化工厂[/align] [/td][/tr][tr][td] [align=center]二氯甲烷[/align] [/td][td] [align=center]天津科密欧化学试剂有限公司[/align] [/td][/tr][tr][td] [align=center]DMA[/align] [/td][td] [align=center]Sigma-Aldrich[/align] [/td][/tr][/table][b]2 基因毒性杂质的检验方法的设定及方法学验证[/b]来源于起始物料苯并咪唑的合成路线的基因毒性杂质[sup][/sup]不适用于药典各论方法检测此类物质,在药典规定的波长无吸收。因此,采用液相色谱方法,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测和控制。[b]2.1色谱条件[/b]色谱柱:ODS-3,5μm,4.6×250mm;检测波长分别设定为4-甲氧基-2-硝基苯胺(230nm)及4-甲氧基-邻苯二胺(210nm);流速为1.0ml/min;进样量为80μl;柱温为30℃。[b]2.2 溶液配制[/b]1) 流动相:溶解6.8g的磷酸二氢钾用纯化水溶解并稀释至1000ml,用氢氧化钾调节pH至6.5,和乙腈按(73:27)混合。2) 对照溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再量取1ml用流动相稀释至50ml。3) 奥美拉唑供试液:称取奥美拉唑样品100mg,精密称定置于50ml容量瓶中,用流动相溶解并稀释至刻度。注:计算奥美拉唑中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺含量都不得超过8ppm。[b]2.3质量检测方法验证[/b]通过限度验证,即该方法的专属性、系统适应性、检测限以及样品测定,是否符合验证可接受的标准,来判断该方法是否符合标准,可用于杂质测定。[b]2.3.1 专属性[/b]1) 溶液配制定性溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用配制完毕的流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再稀释1ml用流动相稀释至50ml。2) 测定取流动相作为空白、定性溶液进样,记录色谱图,数据和结果。3) 数据与结果[align=center][b]表2-1专属性测试数据和结果[/b][/align] [table][tr][td] [align=center][b]项目[/b][/align] [/td][td] [align=center][b]4-甲氧基-2-硝基苯胺峰面积(230nm)[/b][/align] [/td][td] [align=center][b]4-甲氧基-邻苯二胺峰面积(210nm)[/b][/align] [/td][/tr][tr][td] [align=center]空白[/align] [align=center]溶液[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]定性[/align] [align=center]溶液[/align] [/td][td] [align=center]8550[/align] [/td][td] [align=center]12258[/align] [/td][/tr][/table][align=center][b]表2-2信噪比测试数据和结果[/b][/align] [table=100%][tr][td] [align=center][b]杂质[/b][/align] [/td][td] [align=center][b]信噪比[/b][/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]0[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]0[/align] [/td][/tr][/table][b]2.3.2系统适用性试验[/b]1) 溶液制备贮备液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml。杂质溶液:用流动相稀释1ml贮备液到50ml或用专属性定性溶液及图谱。分离度:称取埃索美拉唑镁或奥美拉唑镁样品100mg,精密称定置于50ml容量瓶中,用流动相溶解后准确加入1ml贮备液并用流动相稀释至刻度。2) 测定以方法规定的色谱条件,取杂质溶液、分离度溶液分别进样,记录色谱图,数据和结果。3) 数据与结果[align=center][b]表2-3 系统适用性性测试结果[/b][/align] [table=562][tr][td] [align=center][b]溶液[/b][/align] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]峰面积1[/b][/align] [/td][td] [align=center][b]峰面积2[/b][/align] [/td][td] [align=center][b]峰面积3[/b][/align] [/td][td] [align=center][b]峰面积4[/b][/align] [/td][td] [align=center][b]峰面积5[/b][/align] [/td][td] [align=center][b]峰面积6[/b][/align] [/td][td] [align=center][b]峰面积平均值[/b][/align] [/td][td] [align=center][b]RSD[/b][/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]8427[/align] [/td][td] [align=center]8425[/align] [/td][td] [align=center]8481[/align] [/td][td] [align=center]8533[/align] [/td][td] [align=center]8483[/align] [/td][td] [align=center]8460[/align] [/td][td] [align=center]8468.17[/align] [/td][td] [align=center]0.48%[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]11701[/align] [/td][td] [align=center]11539[/align] [/td][td] [align=center]11086[/align] [/td][td] [align=center]11043[/align] [/td][td] [align=center]10548[/align] [/td][td] [align=center]10679[/align] [/td][td] [align=center]11099.33[/align] [/td][td] [align=center]4.11%[/align] [/td][/tr][/table][align=center][b]表2-4 奥美拉唑和4-甲氧基-邻苯二胺分离度测试结果[/b][/align] [table=100%][tr][td] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]保留时间[/b][/align] [/td][td] [align=center][b]分离度[/b][/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]3.813[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]4.736[/align] [/td][td] [align=center]2.16[/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]5.248[/align] [/td][td] [align=center]1.69[/align] [/td][/tr][/table][align=center][b]表 2-5奥美拉唑和4-甲氧基-2-硝基苯胺分离度测试结果[/b][/align] [table=100%][tr][td] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]保留时间[/b][/align] [/td][td] [align=center][b]分离度[/b][/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]23.168[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]26.908[/align] [/td][td] [align=center]3.32[/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]29.467[/align] [/td][td] [align=center]2.85[/align] [/td][/tr][/table][b]2.3.3检测限[/b]1) 溶液制备按照选择项下贮备溶液的配制方法配制溶液,并将标准溶液逐步稀释,得到适当浓度的溶液。2) 测定在色谱条件下,取溶液进样,记录色谱图。当待测组分的信噪比大于2时,对应的浓度为该组分的最小检测浓度。3) 数据与结果4-甲氧基-2-硝基苯胺检测限0.00256 μg/ml,LOD=1.28ppm,S/N=2.22 4-甲氧基-邻苯二胺检测限0.00256μg/ml,LOD=0.000128,S/N=2.[b]2.3.4样品检测[/b]1) 溶液配制根据已设定检测方法已将溶液配制完毕。2) 测定分别取三批样品按照溶液的配制方法,配制供试液进样,记录色谱图。3) 数据与结果[align=center][b]表2-6 奥美拉唑样品检测结果[/b][/align] [table=102%][tr][td] [align=center][b]批号[/b][/align] [/td][td] [align=center][b]4-甲氧基-2-硝基苯胺(230nm)[/b][/align] [/td][td] [align=center][b]4-甲氧基-邻苯二胺(210nm)[/b][/align] [/td][/tr][tr][td] [align=center]20150401[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]20150402[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]20150403[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][/table][b]3残留溶剂的检测方法的设定[/b]在《中国药典》[sup][/sup]规定的奥美拉唑中各论残留溶剂的检测方法的基础上,进行修正,更改部分参数,选用内标法对残留溶剂进行检测,有利于快速检验及产品及时入库。[b]3.1 色谱条件[/b]1) [url=https://insevent.instrument.com.cn/t/Mp]气相[/url]部分色谱柱:Agilent DB-624, 0.32mm×30m,膜厚1.8μm;柱温先以50 ℃保持5分钟,后以20℃/min升温到200℃保持4分钟;进样口温度为200℃; 分流比为1:1;检测器为FID,其温度为300℃;载气设定为氮气;柱流量则为3.0ml/min。2) 顶空部分顶空瓶平衡温度98℃,平衡时间20min;定量环温度115℃,体积1ml;传输管线温度为130℃。[b]3.2 溶液配制[/b]1) 苯贮备液:精密称取苯0.02g于已加入少量DMA的100ml容量瓶中,用DMA稀释至刻度,摇匀。2) 标准贮备液:精密称取丙酮0.15g,甲醇0.1g,二氯甲烷0.01g,甲苯0.03g,于已加入少量DMA的100ml容量瓶中,在此容量瓶中加入1ml准确量取的苯贮备液,用DMA稀释至刻度,摇匀。3) 标准溶液:精密量取标准溶液贮备液5.0ml于50 ml容量瓶中,用DMA稀释至刻度,混合均匀。4) 供试溶液:精密称定样品0.5g于20ml顶空瓶中,用5ml DMA溶解。[b]3.3 检测方法[/b]1) 按照[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]部分和顶空部分的操作条件设定操作方法。取标准溶液顶空进样,记录色谱图(主要组分出峰顺序依次为甲醇、丙酮、二氯甲烷、苯、甲苯)。注:计算相邻组分之间的分离度R,均应不小于1.5;取6份标准溶液,连续进样,计算各溶剂峰面积的RSD,应不大于10%。2) 先将空白溶液、6份标准溶液和样品溶液各5ml置于顶空瓶中,密封。取空白溶液进样,记录图谱,再取6份标准溶液,记录色谱图,进行系统适用性试验和标准校正,最后取供试溶液进样,记录图谱。计算公式如下式(2-1):[align=center][img=,211,60]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241130224283_2738_3389662_3.png!w211x60.jpg[/img];[/align][align=center][img=,187,81]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241130597462_639_3389662_3.png!w187x81.jpg[/img][/align]注:X[sub]1[/sub]:残留甲醇、甲苯、二氯甲烷、丙酮的量,ppm X[sub]2[/sub]:残留苯的量,ppm Ai:供试溶液的图谱中溶剂(i)的峰面积;A[sub]0[/sub]:空白溶液的图谱中溶剂(i)的峰面积;A[sub]si[/sub]:标准溶液的图谱中溶剂(i)的峰面积;W:样品的称量,g;W[sub]si[/sub]:溶剂(i)的称重,g。[b]3.4 检测结果[/b][align=center][b]表3-1 奥美拉唑残留溶剂检验结果[/b][/align] [table][tr][td=1,2] [align=center][b]项目[/b][/align] [/td][td=1,2] [align=center][b]标准[/b][/align] [/td][td=1,2] [align=center][b]方法[/b][/align] [/td][td=3,1] [align=center][b]奥美拉唑检验批号[/b][/align] [/td][/tr][tr][td] [align=center][b]A-51511507002[/b][/align] [/td][td] [align=center][b]A-51511507003[/b][/align] [/td][td] [align=center][b]A-51511507004[/b][/align] [/td][/tr][tr][td=1,5] [align=center]残留溶剂检验[/align] [/td][td] [align=center]丙酮不得超过1500ppm[/align] [/td][td=1,5] [align=center]内控[/align] [/td][td] [align=center]309ppm[/align] [/td][td] [align=center]396ppm[/align] [/td][td] [align=center]423ppm[/align] [/td][/tr][tr][td] [align=center]二氯甲烷不得超过100ppm[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]甲醇不得超过500ppm[/align] [/td][td] [align=center]115ppm[/align] [/td][td] [align=center]129ppm[/align] [/td][td] [align=center]122ppm[/align] [/td][/tr][tr][td] [align=center]甲苯不得超过300ppm[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]苯不得超过1ppm(LOQ)[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][/table][b]4小结[/b]本研究对治疗胃溃疡的一线药物奥美拉唑进行质量检验方法的研究。通过分析其合成过程中引入的杂质,创新性的提出原料药中可能存在的基因毒性杂质4-甲氧基-2-硝基苯胺、4-甲氧基-邻苯二胺,同时对生产过程引入的残留有机溶剂进行质量监控。根据ICH的指南Q2A和Q2B的要求,采用液相色谱,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测,并对检测方法进行了专属性、系统适应性、检测限,样品测定等方面的限度验证。限度验证结果均应符合标准,说明该检测方法符合测定的准确性、可靠性和灵敏度的要求,能够进行该杂质的测定。且使用该方法进行三种批号的奥美拉唑基因毒性杂质检验时,均未发现存在4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺。说明现有的工艺可有效除去原料药中引入的这两种基因毒性杂质,可不放入日常质量监控之中。同时,在对奥美拉唑合成工艺中残留的有机溶剂的质量检测研究中,进行检测时,发现,其药品中检测出少量的丙酮和甲醇,但均在质量标准规定以内,未检测出二氯甲烷、甲苯、苯,说明选用的三批奥美拉唑成品药均符合药品质量标准。而在检测中,本研究创新性使用不同于中华人民共和国药典中的N ,N-二甲基甲酰胺(DMF),而选择易于冲洗的N ,N-二甲基乙酰胺(DMA)做溶媒,易冲洗干净,且不影响公司内其它产品的检测,与中华人民共和国药典方法相比,大大缩短检验样品的时间,中华人民共和国药典方法单个样品的检测时间为65min,内控的方法仅为36.5min,对工业化规模生产来说,快速检测样品既经济又能保证产品及时入库。[b]参考文献[/b] AnaLuisa Correia, Mina J Bissell. The tumor microenvironment is a dominantforceinmulti drμg resistance.Drμg Resist Update. 2012, 15(6):39-49. Shaojun Shi, ΜlrichKlotz,Protonpump inhibitors: an update of their clinical us and pharmacokinetics .EurJ Clin Pharmacol, 2008, 64(30): 935-951. ICHVALIDATION OF ANALYTICAL PROCEDURES: TEXT AND METHODOLOGY Q2 (R1) Current Step4 version (Complementary Guideline on Methodology dated 6 November 1996incorporated in November 2005). 国家药典委员会.中华人民共和国药典.二部.北京:中国医药科技出版社, 2015: 1412.
求助该期杂志的封面和目录。由于内容特殊,无法按照版规执行,请版主谅解。杂志: Child's Nervous System 时间: [url=http://www.springerlink.com/content/k7575266gv67/?p=4821dd1d0c4f4070a95a1a513fa1234a&pi=3]Number 1 / 2010年1月[/url] Volume 26 [table][tr][td]ISSN[/td][td]: 0256-7040 (Print) 1433-0350 (Online)[/td][/tr][/table][table][tr][td]出版社 : [/td][td]Springer Berlin / Heidelberg[/td][/tr][/table]
在ICH分别于2002年2月及2003年2月颁布的《新原料药的杂质研究指导原则》(简称Q3A(R))与《新制剂的杂质研究指导原则》(简称Q3B(R))中,为便于控制各类杂质的限度,将药品中的有机杂质细分为特定杂质(Specified Impurities)和非特定杂质(Unspecified Impurities)。特定杂质是指在质量标准中分别规定了明确的限度,并单独进行控制的杂质。特定杂质包括结构已知的杂质和结构未知的杂质。对于结构未知的杂质,为便于在标准中进行指认,一般采用代号(如未知杂质A等)或合适的定性分析指标(如相对保留时间为0.8的杂质)加以区分。 非特定杂质是指在质量标准中未单独列出,而仅采用一个通用的限度进行控制的一系列杂质,其在药品中出现的种类与几率并不固定。由于非特定杂质的不确定性,因此,在药品的临床前与临床研究中,很难对这些杂质的安全性进行评价。为将这些杂质可能带来的安全性隐患降至最小,在ICH的以上杂质指导原则中,对其限度做了明确的规定。《新原料药的杂质研究指导原则》中要求:在原料药质量标准中任一单个非特定杂质的限度不得过鉴定限度(见表1)。 表1:原料药的杂质限度