二甲酚橙 二甲酚橙(xylenol orange)属三苯甲烷类显色剂,简称XO。 二甲酚橙是紫色结晶,易溶于水。它在pH6.3时显红色,pH=6.3时呈中间颜色。而二甲酚橙与金属离子的络合物则是红紫色的,故它只能在pH6.3的酸性溶液中作用。用二甲酚橙为指示剂,在酸性溶液中以EDTA直接滴定Bi3+,Zn2+,Pb2+,Hg2+等离子可得很好结果。 二甲酚橙常配成0.2%的水溶液使用。 使用EDTA滴定Al3+时,使用的是反滴定法,一般都是使用Zn2+络合多余的F-,使用二甲酚橙滴定Zn2+方法简单,效果也很好.性质:二甲酚橙属于三苯甲烷类显色剂;一般商品是钠盐,红棕色粉末。易溶于水,不溶于无水醇。二甲酚橙是紫色结晶,易溶于水,它有6级酸式解离。其中H6In至H2In4-都是黄色,HIn5-至In6-是红色。在pH=5~6时,二甲酚橙主要以H2In4-形式存在。H2In4-的酸碱解离平衡如下:H2In4-pKa=6.3H++HIn5-黄 红 由此可知,pH6.3时,它呈现红色;pH6.3时,呈现黄色;pH=pKa=6.3时,呈现中间颜色。二甲酚橙与金属离子形成的配合物都是红紫色,因此它只适用于在pH6的酸性溶液中。 可用于许多金属离子的直接滴定,如ZrO2+(pH1),Bi3+(pH=1~2),Th4+(pH=2.5~3.5)等,终点由红紫色转变为亮黄色,变色敏锐。Al3+、Fe3+、Ni2+、Ti4+和pH为5~6时的Th4+对二甲酚橙有封闭作用,可用NH4F掩蔽Al3+、Ti4+,抗坏血酸掩蔽Fe3+,邻二氮菲掩蔽Ni2+,乙酰丙酮掩蔽Th4+、Al3+等,以消除封闭现象; 二甲酚橙通常配成2g·L-1的水溶液,大约稳定2~3周。用途:酸碱指示剂、金属指示剂
夏天室内温度35℃,避光保存,有1、2个月时间没用了,两瓶不同厂商的都硬成了一块,二甲酚橙的熔点这么低么?维基百科里的熔点很高啊化学式C31H32N2O13S C31H28N2Na4O13S (四钠盐)外观红棕色结晶粉末熔点195 ℃ (368 K)溶解度(水)200 g/l 510 g/l (四钠盐)危险性警示术语R:10-20-21-22-36-38安全术语S:1/2-26-27-28-62-63欧盟分类有害 (Xn)
除铁离子外还有哪些离子或物质能封闭二甲酚橙的变色?
刚买了瓶XO,想做锌的测定但是好几次都是在最后颜色没变化,(测过PH值,都在5~6)溶液颜色都是浅黄,没有络合紫色现象是不是二甲酚橙过期或假冒?正在与厂家联系有谁知道二甲酚橙容易失效吗一般保质期为多长时间?
本来想用锆标准溶液来检验EDTA 的浓度,但是却遇到了问题。是这样的:EDTA 的浓度已经用氧化锌标定过的,想用锆标准溶进行检验(EDTA是用来滴定原料中氧化锆的含量)。我之前也检验过,用的锆标准溶液是国家钢铁材料测试中心的,盐酸做介质,效果很好。但是现在买的锆标准溶液介质换了,变成了硝酸与氢氟酸的混合酸做介质,往里面加二甲酚橙指示剂时颜色稍变成黄色的了(正常的话应该是紫红色的 ),颜色不正常了,无法滴定。出现这种问题是不是二甲酚橙被混合酸氧化了,失去指示剂的作用?抑或是别的原因?
我们公司进的二甲酚橙,打开时就结块凝固在一块,很难分开,也就不能称取配制溶液,不知大家有没有什么好的办法让结块的二甲酚橙还能继续使用!
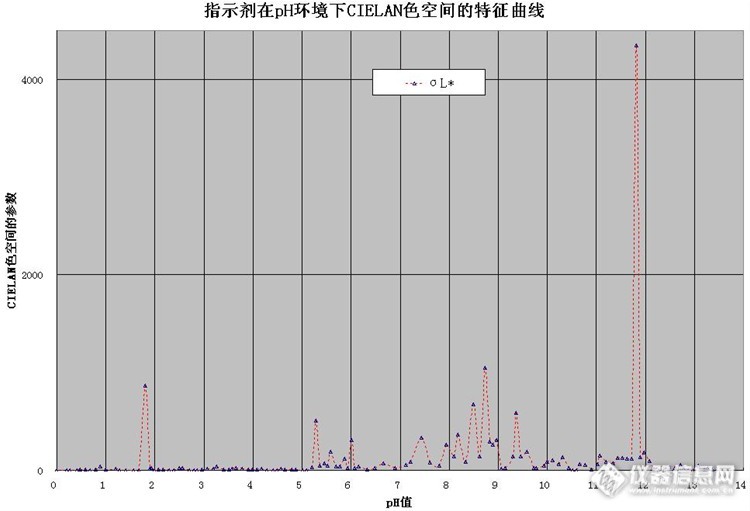
【中秋国庆我这么度过】《新技术5:二甲酚橙在pH环境下CIELAB参数的变色指标选择》前言 二甲酚橙(Xylenol Orange),也称二甲苯酚橙;二甲酚桔黄,3,3′-双邻甲酚磺酰酞,邻甲酚磺酰酞-3,3′-双甲基亚氨基二乙酸,二甲酚橙三钠盐;XO指示剂。英文别名:英文别名:o-cresolsulphonephthalein-6,6-di(methylaminodiacetic acid);o-Cresolsulfonphthaleindi-(methyl-iminodiacetic acid);2,2',2'',2'''-tetraaceticacid;2--4-hydroxy-5-methyl-phenyl]-1,1-dioxo-benzooxathiol-3-yl]-2-hydroxy-3-methyl-phenyl]methyl-(carboxymethyl)amino]aceticacid。分子式C[sub]31[/sub]H[sub]32[/sub]Na[sub]4[/sub]N[sub]2[/sub]O[sub]13[/sub]S,分子量760.60,CAS号:1611-35-4。结晶性粉末。易吸湿。易溶于水,不溶于无水乙醇。210℃分解。最大吸收波长580nm。[align=center][img=,690,285]http://ng1.17img.cn/bbsfiles/images/2017/01/201701191701_669931_1722582_3.jpg[/img][align=center]图1. 二甲酚橙二钠盐的结构式 pH变色域:黄色6.3。有6级酸式解离。其中H6In至H2In4-都是黄色,HIn5-至In6-是红色。在pH=5~6时,二甲酚橙主要以H2In4-形式存在。H2In4-的酸碱解离平衡如下:H2In4-(黄)—— H+ + HIn5-(红) (pKa=6.3)[align=center][img=,666,287]http://ng1.17img.cn/bbsfiles/images/2017/10/2016091607083327_01_1722582_3.jpg[/img][align=center]图2. 二甲酚橙显色产物的结构式 主要用于络合指示剂、酸碱指示剂,滴定锌、铋、镉、钴、铜、铁、汞、铟、镧系元素、镍、铅、钪、钍、锆、铊、铀(VI)、钒等,光度测定锌、铝、铍、铋、镧、铌、镍、钯、钍、钇、锆等。在酸性溶液中以EDTA直接滴定Bi[sup]3+[/sup],Zn[sup]2+[/sup],Pb[sup]2+[/sup],Hg[sup]2+[/sup]等离子效果很好,终点由红紫色转变为亮黄色,变色敏锐。二甲酚橙通常配成2g·L[sup]-1[/sup]的水溶液,大约稳定2~3周。1. 实验部分1.1试剂、仪器与测量条件 0.5mol/L H[sub]2[/sub]SO[sub]4[/sub]溶液,0.5 mol/L NaOH溶液,二甲酚橙指示剂(二甲酚橙0.2 g,水溶解、定容至100ml)。UV2600分光光度计,色度测量系统(自研),测量条件。1.2 实验内容1.2.1二甲酚橙指示剂溶液的吸收峰 将二甲酚橙指示剂溶液滴入不同pH值的溶液中,在分光光度计测量其吸收峰,见表1、图3。[align=center][img=,553,272]http://ng1.17img.cn/bbsfiles/images/2017/10/2016091607085430_01_1722582_3.jpg[/img][align=center]图3. 二甲酚橙指示剂在pH环境的吸收曲线 图3显示,二甲酚橙在不同pH值的溶液中均有2个吸收峰,而且随着pH值的变化而发生位移。pH值在5~10之间,有2个吸收峰,其它浓度有一个最大吸收峰,见表1。[align=center]表1. 不同PH环境下二甲酚橙指示剂最大吸收峰的变化 [table][tr][td] [align=center]波长(nm) [/td][td] [align=center]PH1 [/td][td] [align=center]PH2 [/td][td] [align=center]PH3 [/td][td] [align=center]PH4 [/td][td] [align=center]PH5 [/td][td] [align=center]PH6 [/td][td] [align=center]PH7 [/td][td] [align=center]PH8 [/td][td] [align=center]PH9 [/td][td] [align=center]PH10 [/td][td] [align=center]PH11 [/td][td] [align=center]PH12 [/td][/tr][tr][td] [align=center]430 [/td][td] [align=center]1.722 [/td][td] [align=center]1.559 [/td][td] [align=center]1.600 [/td][td] [align=center]1.565 [/td][td] [align=center]1.748 [/td][td] [align=center]1.688 [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][/tr][tr][td] [align=center]435 [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center]1.934 [/td][td] [align=center]1.679 [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][/tr][tr][td] [align=center]440 [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center]1.497 [/td][td] [align=center] [/td][td] [align=center] [/td][td] [align=center] [/td][/tr][tr][td] [align=center]445 [/td][td] [align=cent
[em61] 请大家对用过的二甲酚橙指示剂发表一下经验:1、哪家的质量可以?曾用过什么厂的?2、变色不灵敏和什么因素有关?
按照GBZ160.26方法测定锆,标液是买的锆标准溶液1000μg/ml,二甲酚橙也重新买了一瓶,还是做不出标线,做出来的是一条类似对数的曲线,不出线性,有没有人做过这个方法?
GBZ/T 300.32-2017锆的二甲酚橙做不出曲线,为啥呀,求助
二甲酚橙溶液水是什么颜色,应该是橙红色,我的怎么是紫红色?急~~~~
GB/T 223.29-2008 钢铁及合金 铅含量的测定 载体沉淀-二甲酚橙分光光度法[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=190511]GBT 223.29-2008 钢铁及合金 铅含量的测定 载体沉淀-二甲酚橙分光光度法.pdf[/url]
各位朋友,有谁用液相做过4-氯邻苯二甲酸单钠盐的定量分析吗?
你们标线怎么做的?
在线等,急!!!PH5.5左右用何种掩蔽三价铁二价铁离子,我们分析的是废水中的锌离子,用二甲酚橙做指示剂,EDTA滴定,主要是现在如何排除三价铁离子,二价铁离子的干扰?
做一甲酚、二甲酚、三甲酚用什么机器什么柱子啊?求大神们指点一下http://simg.instrument.com.cn/bbs/images/default/em0817.gif
专家你好,我想问的是EDTA四钠盐试剂纯度的分析方法.因为在国标中只有EDTA二钠盐的分析方法,不知可否用于四钠盐的分析?另,在国标中分析二钠盐的方法里,样品必须溶于热水中,是否在溶完后需冷却后再滴定?还有,国标中要求在接近终点时再加入铬黑T指示剂,如何判断是否已接近终点?谢谢
在配制氨-氯化铵锾冲溶液中所加的乙二胺四乙酸镁二钠盐,测定水样硬度之前,对所用Na2MgY必须进行鉴定,以免对分析结果产生误差。鉴定方法:取一定量的Na2MgY溶于除盐水中,按硬度测定方法测定其中Mg2+或EDTA是否有过剩量,根据分析结果精确地加入EDTA或Mg2+,使溶液中EDTA和Mg2+均无过剩量”。在上面所说的测定Mg2+或EDTA是否有过剩量,是否是说:取一定体积V1的除盐水,测其除盐水的硬度为YD1。按上面所说在同样体积V1的除盐水中加入Na2MgY,测量硬度为YD2。然后根据YD1和YD2硬度比较,所消耗EDTA标准溶液体积变化,来说明Mg2+或EDTA谁多,如果EDTA标准液消耗体积变大,说明Mg2+离子多。我的理解对不对,大家告诉下我好吗。再问下市售的乙二胺四乙酸镁二钠盐中的Mg2+和EDTA含量是不是1:1呀?除
二甲四氯钠盐和二甲四氯异辛酯是两种不同的物质,有人知道二甲四氯异辛酯液相分析方法吗?要具体点的
我公司现急需以下标样,有知道联系厂家的联系方式的请帮帮忙,谢谢!!2,6-二甲酚:纯度大于99.0%3,4-二甲酚:纯度大于99.0%3,5-二甲酚:纯度大于99.0%2,3,5-三甲酚:纯度大于99.0%2,4,5-三甲酚:纯度大于99.0%2,4,6-三甲酚:纯度大于99.0%3,4,5-三甲酚:纯度大于99.0%邻-乙基酚:纯度大于99.0%间-乙基酚:纯度大于99.0%对-乙基酚:纯度大于99.0%萘:纯度大于99.0%联系方式:0531-88032362/88034128联系人:项亮华
三氧化二氯铝的测定1.方法提要试样经强碱熔解过滤除去二氧化锰沉淀,铝留在溶液中。铝能和EDTA形成中强度络合物。在pH5.5—6.0下使铁铝铜锌铅鈦镍等例子和EDTA完全络合后用氯化锌溶液回滴过量的EDTA。然后加氟化钠置换EDTA-Al络合物,再用氯化锌标准溶液滴定释放出的EDTA,以二甲酚橙作指示剂,由黄变红为终点。2.试剂1.EDTA溶液 C=0.01mol/L 称取3.723g乙二胺乙酸二钠溶解于水中移入1000毫升容量瓶中用水定容。2.氯化锌标准溶液 称取1.2821克金属锌(99.9%)于150毫升烧杯中,加15毫升(1+1)盐酸加热蒸发至2毫升移入1000毫升容量瓶中用氨水(1+1)中和至甲基橙变黄,再用(1+1)盐酸滴至指示剂变红过量5滴,用水定容,此溶液每毫升等于1毫克三氧化二铝。3.乙酸—乙酸钠缓冲溶液 pH5.5-6.0 溶解200克结晶乙酸钠于500毫升水中加10毫升冰乙酸用水稀释至1000毫升。3.分析步骤称取0.1-0.5克试样于银坩埚中加1克过氧化钠4克氢氧化钠混均,于500-600℃熔融至红色透明,取下冷却洗净坩埚底置于250毫升烧杯中加50毫升水1克碳酸钠濅取,用盐酸调pH大于3,洗净坩埚,冷却定容100毫升。干过滤,吸取20毫升鱼300毫升三角瓶中,用(1+1)氨水中和至pH6左右,加过量的0.01molEDTA,再加20毫升乙酸—乙酸钠缓冲溶液在电炉上煮沸3分钟。冷却后加3-5滴二甲酚橙,用氯化锌标准溶液滴至换色恰好变为红色,不记读数,加1克氟化钠在电炉上煮沸3分钟,冷却后补加1滴二甲酚橙用氯化锌标准溶液滴至黄色恰好变为红色即为终点。计算: Al2O3=TV/m×100
10%2.方法原理试料用盐酸溶解,过滤。调节滤液的PH值,在PH值在5~6的六次甲基四胺缓冲溶液中,加入氟化钠以掩蔽铝、铁等元素。以二甲酚橙为指示剂,用EDTA标准滴定液滴定锌含量。3.市售试剂和溶液3.1 市售试剂3.1.1盐酸(约1.19g/mL),分析纯3.1.2氢氧化钠,分析纯3.1.3金属锌(质量分数≥99.99%)3.2 溶液3.2.1 盐酸 (1+1)3.2.2氟化钠溶液(60g/L):称取60g氟化钠,溶于1000mL沸水中,冷却至室温,静置后取上清液,储存于聚乙烯塑料瓶中。3.2.3 六次甲基四胺缓冲溶液(50%):称取1000g六次甲基四胺溶于800mL水中,加入100mL盐酸,用水稀至1000mL,混匀。3.2.4 六次甲基四胺溶液(30%):称取300g 六次甲基四胺,溶于1000mL水中,混匀。3.3 指示剂3.3.1 二甲酚橙溶液(0.1%):称取0 .1g二甲酚橙溶于100mL水中,摇匀,两周之内有效。3.3.2 甲基橙溶液(0.1%):称取0.1 g甲基橙溶于100mL乙醇中,混匀。3.4 标准溶液3.4.1锌标准溶液(0.02g/mL[/fo
F-CL-YS-Al-0072铝及铝合金—铝含量的测定—EDTA 滴定法(2) 1 范围本法适用于金属铝中铝含量的测定。 2 原理试样盐酸溶解。在 pH5.3~5.6 时,加入过量 EDTA ,煮沸 2min,使铝与 EDTA 完全络合,以二甲酚橙为指示剂,用铅标准滴定溶液返滴定过量的 EDTA,由所消耗的铅标准滴定溶液和加入 EDTA 标准溶液的体积,计算铝的含量。铜、铁可使二甲酚橙产生僵化现象,可以采取在微酸性介质中,加入邻菲啰啉掩蔽。 3 试剂3.1 盐酸,约 1.19g/mL。 3.2 盐酸,1+2。3.3 硫酸,1+1。3.4 乙酸钾溶液,400g/L。3.5 麝香草酚蓝溶液,1g/L称取 0.1g 麝香草酚蓝溶于乙醇(1+4)溶液中。3.6 邻苯二甲酸二氢钾-盐酸缓冲溶液,pH2.2 量取 500mL 邻苯二甲酸二氢钾(0.1mol/L)于 1000mL 容量瓶中,加入 467mL 盐酸(0.1mol/L),以水稀释至刻度,摇匀。3.7 六次甲基四胺溶液,300g/L,pH 为 5.3~5.6。3.8 邻菲啰啉溶液,2g/L。3.9 二甲酚橙溶液,2g/L。3.10 EDTA 标准溶液,约 0.05mol/L 称取 18.6130gEDTA 二钠盐,置于 1000mL 容量瓶中,加约 400mL 水,用氢氧化钠溶液(200g/L)调整酸度值 pH5.0~5.5,以上稀释至刻度,摇匀。3.11 铅标准滴定溶液,0.0200mol/L 称取6.6250g 优级纯硝酸铅于事先放有1mL 硝酸的500mL 蒸馏水中,溶完后,移入1000mL 容量瓶中,加水至刻度,摇匀。3.12 铝标准溶液,0.1515mg/mL 称取 0.1515g 金属铝(质量分数为 99.999%)溶于少量盐酸(必要时加 1mL 硝酸)。加5mL 硫酸(1+1),加热冒烟,取下冷却,移入盛有少量水的 1000mL 容量瓶中,以上稀释至刻度,摇匀。 4 试样 试样为长度小于 5mm 的钻屑。 5 分析步骤5.1 称样 称取约 0.10g 试样,精确至 0.0001g 5.2试液制备 将试料置于 250mL 三角烧杯中,盖上表面皿。小心加入 30mL 盐酸(1+2),加热溶解,冷却,移入 100mL 容量瓶中,用水洗涤数次表面皿,洗涤液一起并入容量瓶中,以水稀释至刻度,摇匀。5.3 测定 移取 10.00mL 试液,置于 400mL 锥形瓶中,加入 2 滴麝香草酚蓝溶液(1g/L),用乙酸钾溶液(400g/L)调至溶液恰为黄色,再加入 10mL 邻苯二甲酸二氢钾-盐酸缓冲溶液(此时溶液应为黄色,如有红色滴加乙酸钾溶液至刚为黄色)。移取 10.00mLEDTA 标准溶液于锥形瓶中,加水(洗涤杯壁)至约 60mL。煮沸 2min,取下,冷却,加 50mL 水、15mL 六次甲基四胺溶液(300g/L)、2mL 邻菲啰啉溶液(2g/L),摇匀,放置 1min。加 5 滴二甲酚橙溶液(2g/L),用铅标准滴定溶液滴定至溶液由柠檬黄变为淡红色为终点,记下 V1。5.4 标定 移取 50.00mL 铝标准溶液,相当于 7.575mg 铝,按 5.3 分析步骤操作,记下 V2。移取 10.00mLEDTA 标准溶液,置于 500mL 锥形瓶中,加入 1mL 盐酸,50mL 水,15mL六次甲基四胺溶液(300g/L), 2mL 邻菲啰啉(2g/L),5 滴二甲酚橙溶液(2g/L),用铅标准滴定溶液滴定至溶液由黄色变为橙红色,记下 V3。 6 结果计算按下式计算铝的含量,以质量分数表示: 式中:WAl /%——铝的质量分数,%; V1 分取试液消耗铅标准滴定溶液的体积,mL;V2 50.00mL 铝标准溶液消耗铅标准滴定溶液的体积,mL;V3 滴定 10.00mLEDTA 标准溶液所消耗铅标准滴定溶液的体积,mL;V4——分取试液的体积,mL;V0——试液总体积,mL; m 试料的质量,g;0.07575 抽取铅标准滴定溶液后换算的系数.
我用二甲酚橙与铅显色分光光度法测水中的铅,最后处理河水测铅,处理方法如下:取已酸化澄清的水样100ml于250ml烧杯中,补加硝酸3ml,高氯酸0.5m1.于电热板上加热消解.蒸发分解高氯酸并浓缩溶液体积为2.Oml左右,取下冷却,加入少量水溶解盐类.转入25ml比色管中.调pH 至中性.视情况加入适量掩蔽剂,接试验方法显色后,测量溶液的吸光度.分析结果见表。我按上面文献处理遇到几个问题:1、水样处理后酸度太大,用什么中和2、我在显色定容后用氢氧化钠固体调节PH=6,出现了大显固体沉淀,且再加HNO3不溶。3、河水样加二甲酚橙显橙色,25ML含铅12.5UG标样加二甲酚橙显黄色(其中都加了柠檬酸三铵,邻二氮菲作掩蔽剂),不知河水中是什么没有被掩蔽和二甲酚橙显了橙色请问有没有更好的铅的富集与处理方法,减少分光光度法测的干扰??
铅、铋混合液中铅、铋含量的连续测定目的原理实验目的1. 掌握借控制溶液的酸度来进行多种金属离子连续测定的络合滴定方法和原理;2. 熟悉二甲酚橙指示剂的应用。实验原理Bi3+、Pb2+离子均能与EDTA形成稳定的络合物,其稳定性又有相当大的差别(它们的1gK值分别为27.94和18.04),因此可以利用控制溶液酸度来进行连续滴定。在测定中,均以二甲酚橙为指示剂。二甲酚橙属于三苯甲烷指示剂,易溶于水,它有7级酸式离解,其中H7In至H3In4-呈黄色、H2In5-至In7-呈红色。所以它在溶液中的颜色随酸度而变,在溶液pH<6.3时呈黄色,pH>6.3时呈红色。二甲酚橙与Bi3+离子及Pb2+离子的络合物呈紫红色,它们的稳定性与Bi3+、Pb2+离子和EDTA所成络合物的相比要弱一些。测定时,先调节溶液的酸度至pH≈1,进行Bi3+离子的滴定,溶液由紫红色变为亮黄色,即为终点。然后再用六次甲基四胺为缓冲剂,控制溶液pH≈5-6,进行Pb2+离子的滴定。此时溶液再次呈现紫红色,以EDTA溶液继续滴定至突变为亮黄色,即为终点。仪器药品0.02mol/dm3EDTA标准溶液,0.2%二甲酚橙指示剂,20%六次甲基四胺溶液,ZnO(基准用),0.1mol/dm33溶液,0.5mol/dm3NaOH溶液,1+1HCl溶液,精密pH(0.5—5)试纸。过程步骤一、Bi3+离子的滴定移取25ml试液3份,分别置于250ml锥形瓶中。取一份作初步试验。(由于调节溶液酸度时要以精密pH试纸检验,心中无数,检验次数必然较多,为了消除因溶液损失而产生误差,故采用初步试验的方法。) 先以pH为0.5-5范围的精密pH试纸试验试液的酸度。一般来说,不带沉淀的含Bi3+离子的试液其pH应在1以下(为什么?),为此,以0.5mol/dm3NaOH溶液(装在滴定管中)调节之,边滴加边搅拌,并时时以精密pH试纸试之,至溶液pH达到1为止。记下所加的NaOH溶液的体积。(不必准确至小数点后第二位,只需1位有效数字,为什么?)接着加入10ml 0.1mol/dm33溶液及2滴0.2%二甲酚橙指示剂,用0.02mol/dm3EDTA标准溶液滴定至溶液由紫红色变为棕红色,再加1滴,突变为亮黄色,即为终点,记下粗略读数。然后开始正式滴定。取另一份25ml试液,加入初步实验中调节溶液酸度时所需的相同体积的0.5mol/dm3NaOH溶液,接着再加10ml 0.1mol/dm3NHO3溶液及2滴0.2%二甲酚橙指示剂,用EDTA标准溶液滴定之,终点变化同上。在离终点1-2ml前可以滴得快一些,近终点时则应慢一些,每加1滴,摇动并观察是否变色。二、Pb2+离子的滴定在滴定Bi3+离子后的溶液中,加4-6滴二甲酚橙指示剂(溶液中原先已加2滴二甲酚橙指示剂,由于滴定中加入EDTA标准溶液后使体积增大等原因,指示剂的量会感到不足(由溶液颜色可以看出),所以需要再加。),并逐滴滴加1+1氨水,边滴边搅拌,至溶液由黄色变橙色(注意,不能多加,否则生成Pb(OH)2沉淀,影响测定),然后再加20%六次甲基四胺,至溶液呈紫红色(或橙红色),再加过量5ml,最后以0.02mol/dm3EDTA溶液滴定至溶液由紫红色突变为亮黄色,即为终点。分析思考1.滴定Bi3+、Pb2+离子时溶液酸度各控制在什么范围?怎样调节?为什么?2.能否在同一份试液中先滴定Pb2+离子,而后滴定Bi3+离子? [em05]
想问一问大家有没有关于检测水质和土壤中6种二甲酚的分析方法
请问各位大神,哪里能买到乙二醇二钠盐,如果自己制备该怎么做呢
第四章 答案 一、选择题1.D 2.A 3.C 4.A 5.C 6.D 7.D 8.D 9.B 10. C11.D 12.C 13.B 14.D 15.B二、填空题1.乙二胺四乙酸,Na2H2Y.2H2O 2.七,Y4- 3.小,弱 4.M+Y=MY,KMY=[MY]/[M][Y]5.金属离子的电荷数,离子半径,电子层结构,溶液的酸度6.[Y']/[Y],严重 7.配位,酸8.配合物的条件稳定常数,金属离子的起使浓度9.最小pH,金属离子又不发生水解 10.10 红,蓝 11.△lgK≥5 12.掩蔽剂,配位掩蔽,沉淀掩蔽,氧化还原掩蔽13.大于 14.返滴定法 15.Ca2+、Mg2+,暂时硬度,永久硬度三、判断题1.√ 2.× 3.× 4.× 5.× 6.× 7.× 8.× 9. × 10.√四、计算题1.3.25×1013、13.51 2.p Zn2+=7.6,pH=3.8 3.60.75%、35.04%、3.90%4.37.30%、62.31% 5.27.48%、19.99%、3.41%6.(1)在 pH=1的酸性介质中,加入抗坏血酸将Fe3+还原为Fe2+,以0.01molL-1 EDTA直接滴定,指示剂选用二甲酚橙。 (2)控制酸度分别滴定。∵ ΔlgK =7.8 ,∴ 所以可以在不同的pH介质中分别滴定。测 Zn2+ :在pH 5~6的六次二甲基四胺缓冲体系中,以二甲酚橙为指示剂,以0.01M EDTA滴定至溶液从红色变为亮黄。 测 Mg2+ :在上述溶液中加入pH 10的氨性缓冲体系中,以为铬黑T指示剂,以0.01M EDTA滴定至溶液从红色变为蓝色。五、问答题(略)
铬铝鞣剂一般含硫酸铬和硫酸铝混合物,铬和铝的含量测定方法是用过量EDTA把铬和铝完全络合,然后以二甲酚橙为指示剂,用乙酸锌返回滴定过量的EDTA求出总量, 然后用氟化铵屏蔽铝,继续滴定释放的EDTA,进而求出铬的含量,两者相减可得铝的含量,或者先求总量,然后用碘量法求铬。问题是在滴定总量时,由于铬和EDTA生成紫色络合物,使得无法看见终点颜色,(二甲酚橙由橙色变浅红色)在没有铬的干扰下好测,现在由于有铬,很难看终点,是否可以用pH来判断终点?或者如何分离铬和铝来分别测含量?高人请指点,看过文献有人用这方法做的,但是都没有说如何看终点,说是变紫色后,加二甲酚橙会变橙色,我试了压根不行,这都是照书写的,都不知道这些人有没做过!
1、我取25mL锰酸锂的溶液(0.1gLiMn2O4→100mL),加入15mLpH=6的乙酸-乙酸钠缓冲溶液,用0.01M的EDTA滴定,指示剂为二甲酚橙,这种方法可行吗???2、我做了一次实验,但是颜色一开始是紫红色,滴定时只是慢慢变浅到橙黄色,并没有颜色突变,求助啊!!!后来怀疑有Al3+封闭指示剂,所以加入NH4F作掩蔽剂,但是还是没有效果。。