科瑞恩特:新一代质谱成像技术TransMIT AP-SMALDI 5AF在生物学研究中的应用
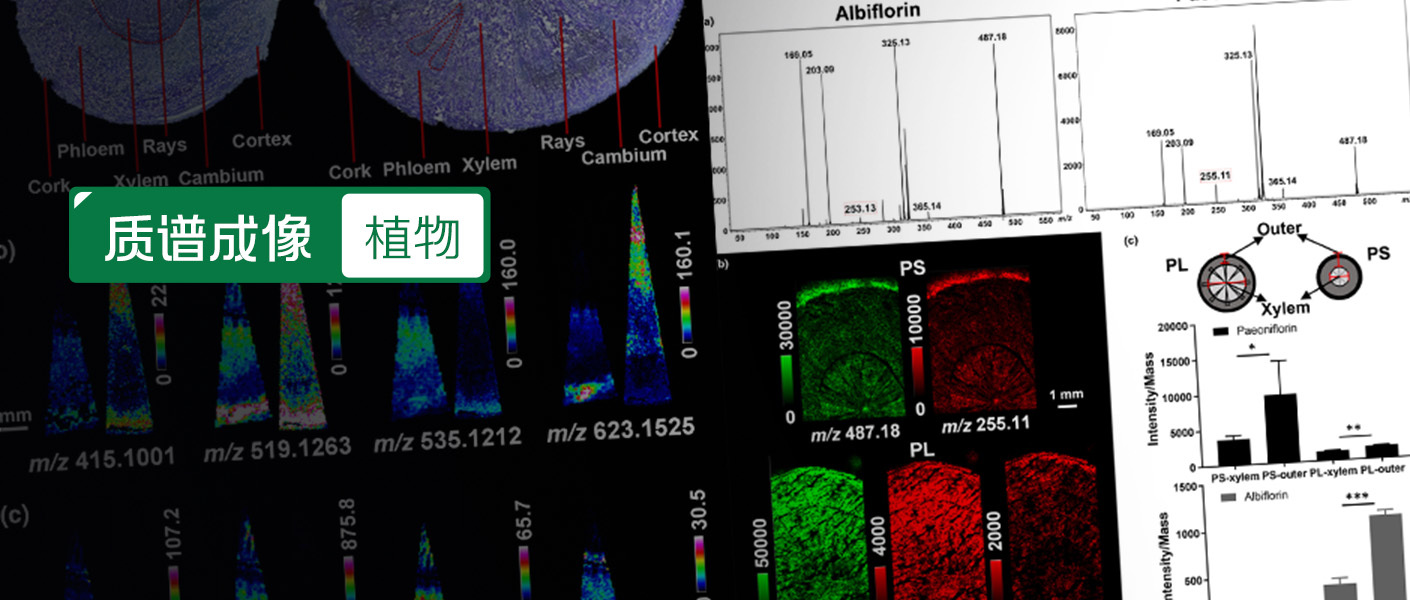
质谱成像(Mass Spectrometry Imaging, MSI)是以质谱技术为基础的成像方法,该方法通过离子源(MALDI/DESI/SIMS)直接扫描生物样品成像,可以在同一张组织切片同时分析数百种甚至数千种分子的空间分布特征。该技术结合质谱分析和影像可视化,不需要任何特异性标记,一般针对生物组织样品可进行多点检测、多维数据获取,可同时实现不同分子或多种分子的高灵敏度检测,并能够直接提供目标化合物的空间分布和分子结构信息。当前国际上,质谱成像技术是分析化学领域的一支强有力新生力量,也是目前最前沿的表面分析技术之一。因其独特的分析方式,为科研工作者带来了全新的研究视角。近五年在各大领域,特别是医学研究、药物开发、动物学、植物生物学、昆虫学、微生物等领域大显身手,获得越来越多的青睐和认可。 ▍关于AP-SMALDI TransMIT AP-SMALDI5 AF 3D快速超高分辨率质谱成像系统由德国吉森大学世界知名质谱学家Bernhard Spengler教授研制开发。Spengler教授于1994年在芝加哥举行的第42届美国质谱年会(ASMS)上提出了MALDI Ion Imaging和Biological Ion Imaging的概念,即质谱成像(Mass Spectrometry Imaging) ,并首次把MALDI成像方法用于分析多肽类化合物。 TransMIT AP-SMALDI5 AF质谱成像系统搭载Thermo Scientific&trade Q Exactive&trade 或Obitrap Exploris&trade 系列质谱仪,实现了高空间分辨率、高质量分辨率、高灵敏度以及多模式检测的完美结合,是一款高端的质谱成像系统。目前该成像离子源搭载Q Exactive&trade 或Obitrap Exploris&trade 系列质谱仪,能够实现细胞水平的空间成像分辨率,并且集高质量分辨率、高质量精度、高灵敏度多模式检测及串联质谱于一身,为准确、全面的分析质谱成像数据提供了可靠保证。新一代质谱成像TransMIT AP-SMALDI 5AF在技术方面有诸多突破:◆ 常压到中压的操作环境,极大简化了样品制备的方法,无需昂贵的导电靶板(如ITO导电玻璃),极大的节约了成本。 ◆ 能够获得3 μm的高空间分辨率,全景呈现了分析物在组织中的分布和细微差别,可用于单细胞质谱成像分析。 ◆ 激光束和离子流的同轴设计解决了高空间分辨率和低采样量之间的矛盾。◆ 具有多种检测模式包括单点检测模式、连续检测模式、自动聚焦模式、3D检测模式、全像素检测模式和倾斜校正模式,适合不同类型的样品采集;3D检测模式,允许在成像采集期间跟踪非平面物体的高度变化;全像素扫描模式,激光光束对25 µ m x 25 µ m或更大的方形像素区域进行“W”型扫描,检测灵敏度比单像素模式提升一个数量级;自动聚焦功能,激光斑点可自动聚焦至待测样品表面。◆ 具有独立开发的用于高分辨质谱成像的数据分析处理软件。 ◆ 与Thermo Scientific&trade Q Exactive&trade 或Obitrap Exploris&trade 系列质谱仪兼容,实现未知化合物的准确鉴定。 ▍临床医学诊断——全贴式自动聚焦SMALDI质谱成像对患者来源类器官的空间脂质组学表征 患者来源的类器官(patient-derived organoids, PDOs),作为临床前模型在个性化医疗中展现出巨大的潜力,能够准确模拟来源样本的异质性,与原始临床标本表现出高度一致的基因型和组织病理学特性。然而,在进行类器官构建前尚无快速、高效的方法确保肿瘤组织样本的质量,从而无法保证获得的肿瘤类器官中无正常类器官的污染;另一方面,虽然有研究提出在类器官培养过程中优化培养基的配方尽可能避免正常类器官的过度生长,但尚无高效便捷的技术平台直接用于肿瘤类器官和正常类器官的鉴别。截止目前,类器官的基因组学和组织病理学表征技术已经相对成熟,但由于大多数癌前病变的基因突变特征与癌症样本相对一致,因此无法仅通过基因组学特征进行肿瘤和正常类器官的鉴别。脂质在解析细胞结构和功能方面扮演重要的角色,分析脂质组学特征能够对样本状态有更系统全面的理解,并且对细胞过程、细胞膜动态变化和能量代谢提供一定的见解。本研究创造性提出了全贴式类器官成像方法,即类器官不用切片,直接完整的类器官粘附到载玻片上,然后用 AP SMALDI 5AF & Orbitrap 质谱成像系统直接三维成像,该技术平台有望实现对不同状态类器官的区分。图1. 质谱成像可视化 NBOs 和 BCOs 脂质差异,图1A和B显示了4种具有代表性的在 NBOs 及 BCOs 中上调的脂质。 ▍药物分析与代谢物研究——AP-SMALDI质谱成像可视化呈现肝片吸虫体内药物摄取和空间分布 了解药物或其代谢物在组织中的摄取机制和空间分布是了解药物疗效的关键因素。然而应用于肝片吸虫体内药物及其代谢物检测的经典方法仍存在一定局限性,如高效液相色谱法和液质联用法都无法获取样本的空间信息。MALDI质谱成像作为一种强大的分子成像技术,可以有效实现在寄生虫中药物、药物代谢物及内源性代谢物的空间分布分析。采用常压扫描微探针基质辅助激光解吸电离质谱成像(AP-SMALDI MSI),可获得化合物的强度信息及其空间分布信息,从而研究药物或候选药物的摄取动力学、摄取途径和组织趋向性。在用于药物治疗后的肝片吸虫(一种寄生虫)成像时,实现了寄生虫体内的药物可视化,有助于肝片吸虫及后续研究的临床前药物发现。通过该方法,检测到肝片吸虫体内的脂质标志物和药物信号,讨论了药物暴露在寄生虫体内摄取和分布特征差异。该方法不仅适用于肝片吸虫,也适用于其他寄生虫,有助于研究寄生虫药物代谢动力学、空间分布。图2. TCBZ在肝片吸虫体内吸收和分布的动态变化。a, H&E染色光学图像。在TCBZ暴露20 min、4 h和12 h后,对肝吸虫切片进行观察,并对肠与肠表皮(i,g)、皮层(tg)、子宫(u)和卵巢(o)进行注释。b, m/z 828.5962(红色,PI O-33:0,+或HexCer 38:0 O4,+),m/z 358.9571(绿色,TCBZ,+),m/z 751.5039(蓝色,PA O-38:3+)。c, MALDI MS TCBZ(绿色)的单通道图像,MALDI MS图像中的箭头表示TCBZ在皮层下区域(20分钟后)、肠表皮和卵巢组织(4小时后,分别为实线和虚线)以及TCBZ阴性的卵子在子宫内聚集(12小时后)。 ▍药用植物研究——利用MALDI质谱成像技术揭示牡丹和芍药根的空间代谢组 空间代谢组学是代谢组学研究发展中的一个分支,它提供了组织结构和个体代谢物之间的直接联系。以牡丹PS和芍药PL为例,两者的植物化学和药理作用的相似性和差异性已经被广泛研究,但其空间代谢组的比较几乎没有报道。阐明PS和PL的空间代谢组差异在植物分类和药用植物质量控制等领域具有重要意义。研究采用 MALDI MSI 结合 LC-MS 代谢物检测技术,系统表征了单萜和丹皮酚苷类、鞣质类、黄酮类、糖类和脂类等多种代谢产物(65种)的空间分布。用高分辨 MALDI MSI 研究了两种芍药科植物牡丹和芍药共同代谢物和特定代谢物在空间分布上的相似性和差异性,为代谢物的生物合成、运输和积累研究提供了重要信息。为了解决异构代谢物空间分布不明确的问题,运用MALDI 串联质谱成像,明确了芍药苷和芍药内酯苷的空间分布。通过研究发现,牡丹和芍药的皮以及中心部位都含有丰富的生物活性物质,能够为传统药材加工方法的改良提供直观的依据。此外,还首次绘制了参与没食子单宁生物合成途径的前体以及中间体的空间分布图,可水解的单宁主要分布在木栓层、韧皮部等,其可能在不损害细胞质成分的情况下发挥保护作用,如对抗生物压力;鞣花鞣质倾向于在木质部区域积累,这可能与木质素具有共同的支持植物的功能。高分辨率 MALDI MSI 提供了全面、准确的代谢物空间分布,为中药的深入研究、使用和加工方法的改良提供了独特的见解。图3. MALDI MSI 及 LC-MS 验证。(a)前体物质m/z 487.18的串联质谱,分别来自芍药内酯苷和芍药苷。(b)像素大小为50μm的牡丹(PS,上)和芍药(PL下)根中芍药苷和/或芍药内酯苷的 MSI图。(c)用 LC-MS 从 PL 和 PS 根切片的不同部位相对定量芍药苷和/或芍药内酯苷。 ▍单细胞分析——高分辨AP-SMALDI MSI技术助力揭示人源小胶质细胞的脂质特征和细胞间异质性 单细胞质谱成像技术正日益成为辅助解锁生物复杂性的重要工具。有效绘制单个细胞的脂质组成图,能够区分不同细胞系和刺激条件,揭示初始细胞和LPS刺激细胞中的局部脂质异质性。以人源小胶质细胞研究为例,使用高分辨AP-SMALDI MSI分析玻片上培养的固定或快速冷冻的人源小胶质细胞,可视化单细胞的脂质异质性。此外,该方法能够识别同一细胞系中单细胞之间(如LD)或细胞内(如PI物种)的异质性,表明小胶质细胞会分化成不同的表型。一方面,观察到亚细胞炎症诱导的异质性通过脂滴形成表达,这是首次报道通过MSI显示亚细胞特征中的完整生物分子,结果与荧光显微镜和文献报道一致。由于LPS触发小胶质细胞的炎症反应机制,这种异质性在LPS刺激的样本中更加明显。另一方面,在正离子和负离子模式下,影响完整细胞体的单细胞异质性被发现,这一点在检测PI脂质物种的负离子模式中尤其突出。这些发现表明先进的MSI技术可以区分培养中的单细胞的脂质组表型,结合其他单细胞分析方法,可以绘制细胞脂质组甚至亚细胞组成的异质性,这将有助于进一步了解细胞特异性脂质代谢。图4. 提高横向分辨率后,AP-SMALDI MSI能够定位亚细胞结构的特定区域。a:B8细胞系中LPS刺激的MGL细胞,100x100像素,5μm像素大小。c:B8细胞系中未刺激的MGL细胞,250x250像素,μm像素大小。e:B8细胞系中未刺激的MGL细胞,300x300像素,1.5μm像素大小。b,d,f:对应的显微镜图像。a,c,e:红色,TG 52:2(m/z 881.7568);绿色,PC 34:1(m/z 896.6140)。标尺:100μm。 ▍空间多组学研究--鞘脂质控制真皮成纤维细胞的异质性 人类真皮成纤维细胞是皮肤的细胞成分,由于自身特性表现出细胞间的表型异质形态。单个真皮成纤维细胞可以有不同的细胞特性,负责伤口修复、细胞外基质改变、纤维化或重塑等功能。而不同表型的成纤维细胞的脂质代谢及脂质成分是否参与成纤维细胞亚型的建立尚不清楚。研究真皮成纤维细胞的总体脂质组成和表型状态,以寻找脂质在确定真皮成纤维细胞身份中的可能作用是尚待解决的难题。以鞘脂质控制真皮成纤维细胞的异质性研究为例,通过高分辨率质谱成像、单细胞转录组学、RNA 测序技术等研究方法,以人真皮成纤维细胞(dHFs)为研究的对象,发现了人真皮成纤维细胞(dHFs)的特征,探究了真皮成纤维细胞的异质性机理,描绘了真皮成纤维细胞的脂质和转录图谱。为研究真皮成纤维细胞的脂质组成、转录和表型状态提供了理论依据。图5.AP SMALDI单细胞质谱成像揭示脂质异质性的组成原则 ▍MALDI MSI在现代分析中的技术挑战与未来发展趋势 在国际上,质谱成像技术作为分析化学领域的一支新生力量,并且是目前最前沿的表面分析技术之一。因其独特的分析方式,为科研工作者带来了全新的研究视角。相信未来各个领域将持续应用该技术,辅助解决科研中遇到的难题。TransMIT AP-SMALDI 5AF离子源与Obitrap高分辨率质谱仪结合独具特色,兼具高空间分辨率、高质量分辨率和质量精度,以及串联质谱功能,将成为医学研究、药物开发、植物生物学、昆虫学、微生物等领域的重要研究工具。未来质谱成像仪的各项性能都会继续得到提升,最受关注的依然是空间分辨率的提升,定量方法的开发以及便捷准确的数据处理方法。预测质谱成像仪在我国的需求量将呈现快速增长的态势,成为各大科研院所的必备科研设备。科瑞恩特在产品技术推广上主要以参加学术会议和讲座为主,比如中国质谱学术大会和国际脂质代谢会议。到目前为止,我们先后在清华大学、北京师范大学、国科大杭州高等研究院、黑龙江中医药大学、青岛大学、海南大学等开展了系列学术讲座,向科研工作者介绍TransMIT AP-SMALDI 5AF质谱成像仪的原理和应用,收到了众多关注和好评。未来,我司会逐步加大推广力度,为科研工作者提供切实可靠的质谱成像整体解决方案,相信创新性的质谱成像技术将会被愈来愈多的科学家和技术人员所了解和应用。我们愿为人类探索生命科学的奥秘提供独具特色的质谱成像技术,同时不断改进和完善MALDI成像整体解决方案。参考文献: Lan C, Peng Y, Zuo H, et al. Spatially lipidomic characterization of patient-derived organoids by whole-mount autofocusing SMALDI mass spectrometry imaging. Analytica Chimica Acta, 2024, 1325: 342989. Morawietz C M, Peter Ventura A M, Grevelding C G, et al. Spatial visualization of drug uptake and distribution in Fasciola hepatica using high-resolution AP-SMALDI mass spectrometry imaging. Parasitology Research, 2022, 121(4): 1145-1153. Li B, Ge J, Liu W, et al. Unveiling spatial metabolome of Paeonia suffruticosa and Paeonia lactiflora roots using MALDI MS imaging. New Phytologist, 2021, 231(2): 892-902. Morawietz, C.M., Peter Ventura, A.M., Grevelding, C.G. etal. Spatial visualization of drug uptake and distribution in Fasciola hepatica using high-resolution AP-SMALDI mass spectrometry imaging. Parasitol Res ,2022,121, 1145–1153. Capolupo L, Khven I, Lederer A R, et al. Sphingolipids control dermal fibroblast heterogeneity. Science, 2022, 376(6590): eabh1623.