化妆品中6-甲基香豆素的检测方法
[size=3][b]有没谁有4-甲基-5,7-二羟基香豆素的1H谱图[/b][/size]我们学校核磁仪器坏了,答辩前都修不好,希望有此化合物的图的可以给我一张,最好是扫描的。。。。谢谢了。
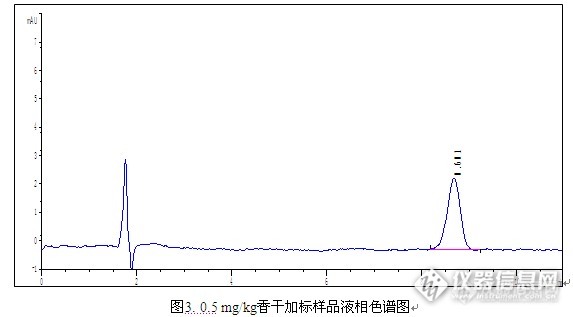
简介: 二甲基黄属于亲脂性偶氮染料,在工业上常用于油漆、鞋油、纺织品等的染色,禁止作为食品添加剂的使用。但是,近年来我国和世界各国不断报道在食品中检出工业色素二甲基黄。 二甲基黄也称甲基黄,化学名称为对二甲氨基偶氮苯,遇高温、明火或与氧化及接触有燃烧的危险。受热分解放出有毒烟气。经呼吸道、消化道、皮肤进入体内,可导致铁血红蛋白症、紫绀,严重时可致死。致癌性甲基黄是可疑人类致癌物,国际癌症研究中心已将其列入动物致癌剂。 因此通过有效的实验技术手段,对食品中的有关色素残留进行监控,以确保消费者对食品消费的安全具有重要意义。前处理方法:样品提取 称取已均质好的样品1.0 g(精确到0.01 g)试料,置于50 mL离心管中,加入15 mL甲醇,混匀后超声提取10 min,4000 r/min离心10 min,将上样液转移至另一50 mL离心管中,残渣用5 mL甲醇再次提取,离心后合并上清液,作为待净化液。样品净化 取Cleanert Sudan专用柱 (500 mg/6 mL),依次用5 mL二氯甲烷,10 mL甲醇活化小柱;将上述待净化液以1.0 ml/min流速通过小柱,再用5 mL甲醇淋洗小柱,抽干;最后用10 mL二氯甲烷洗脱,收集;40℃氮气吹干洗脱液,用1 mL甲醇溶解定容,过0.45 μm针式过滤器尼龙滤膜后,进行HPLC检测。检测条件 色谱柱:Venusil XBP C18(L),5 μm,150 Å,4.6 × 150 mm; 流动相:0.1%甲酸水溶液:甲醇= 25:75; 柱 温:30℃;波长:390 nm;进样量:20 μL;实验结果 http://ng1.17img.cn/bbsfiles/images/2015/08/201508210918_561816_2960317_3.png实验谱图 http://ng1.17img.cn/bbsfiles/images/2015/08/201508210919_561817_2960317_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508210920_561818_2960317_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508210921_561819_2960317_3.png实验结论 本实验建立了豆干中二甲基黄的检测方法,使用Cleaner Sudan专用柱对豆干样品进行前处理,当加标量为0.5 mg/kg时,平均回收率为87.4%,RSD为3.36%,说明本方法可以用于豆干中二甲基黄的检测。
各位大侠帮帮忙,从文献上看到如题衍生化试剂,但上面说取适量4-溴甲基-7-甲氧基香豆素和18-冠醚-6溶于N,N-二甲基甲酰胺10ml,可到底取多少量呢,各位有知道的吗,帮帮忙,具体这个衍生化试剂怎么配得呀?急候大家的回复!谢谢啦!
有谁知道对甲基苯磺酸和邻甲基苯磺酸液相色谱分离的条件么?
跟着5009.284-2021走的梯度洗脱,4个标准品配的混标,只有甲基香兰素和乙基香兰素分不开,呈大M,自己试了好几种梯度都分不开,色谱柱是全新的,排除色谱柱原因,想问一下大家有没有更好的梯度洗脱?[img]https://ng1.17img.cn/bbsfiles/images/2022/08/202208311552565427_9283_5511445_3.jpeg[/img]
邻(间、对)甲基苯胺是禁用偶氮中常检出的物质,用液相色谱法可以区分,但是用气相很少,迪马有分邻(间、对)甲基苯胺的的气相方法吗?
今天看对于不对称化合物十分相近的两个甲基的分析,因为有裂分,但是还是有一点交叠,可以通过向体系中加入D苯来使两个峰分开,
QB/T 2544-2002 香豆素2002-09-21发布,2002-12-01实施,代替QB/T 3761-1999(原标准号GB/T 8798-1988),现行有效。本标准等效采用美国精油协会标准EOA №201《香豆素》本标准技术指标与美国精油协会标准EOA №201《香豆素》基本一致,检验方法则采用香料通用试验方法,该通用试验方法绝大部分为等效采用ISO相关标准。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=168380]QB/T 2544-2002 香豆素[/url]
300℃。含5mo1%苯基硅油的凝固点低达-70℃,表面张力约在2.1×10-4~2.85×10-4N/cm,相对密度1.00-1.11,折射率1.425~1.533。热稳定性好,250℃热空气中的凝胶化时间为1750h,还具有良好的耐辐照性能及高的氧化稳定性、耐热性、耐燃性、抗紫外性和耐化学性。可由八甲基环四硅氧烷、二甲基四苯基二硅氧烷、甲基苯基二乙氧基硅烷的水解物在催化剂存在下进行调聚反应来制取。用作润滑油、热交换液、绝缘油、气液相色谱的载体等。用于绝缘、润滑、阻尼、防震、防尘及高温热载体等,是电子仪表的理想液态阻尼介电液。http://www.zhongbaohg.cpooo.com/
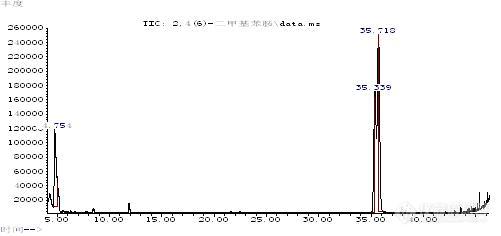
2,4-二甲基苯胺和2,6-二甲基苯胺的鉴别2,4-二甲基苯胺和2,6-二甲基苯胺同属于国家强制标准GB18401-2003附录C中所列的还原条件下染料中不允许分解出的23种芳香胺之一,二者又属于同分异构体,沸点和极性都很接近,故在检测过程中很难鉴别。目前,对于两者的分离鉴别主要靠液相色谱来实现,而使用气-质联用仪来鉴别两者还没有很好的方法。而针对有害芳香胺的气相色谱-质谱检测方法,大多采用非极性或极性较弱的色谱柱,如HP-5MS,DB-5MS,DB-35MS,这些色谱柱普遍存在的缺点是对常见的芳香胺异构体不能很好的分离。由于2,4-二甲基苯胺和2,6-二甲基苯胺沸点太接近,单纯依靠两者的沸点差异来实现其分离鉴别是有一定难度的。于是,作者考虑采用中等极性色谱柱DB-17MS(固定相等同于50%苯甲基聚硅氧烷),除了利用2,4-二甲基苯胺和2,6-二甲基苯胺的沸点差异外,再利用中等极性柱对于二者的保留作用差异来研究二者的分离鉴别。通过改善优化色谱条件,作者使用中等极性色谱柱DB-17MS,同时使用三阶程序升温,实现了2,4-二甲基苯胺和2,6-二甲基苯胺的较好分离。1 试验1.1 仪器与试剂气相色谱-质谱联用仪(GC-MS):Agilent 7890A/5975C,美国Agilent公司毛细管柱:DB-17MS柱(30m×0.25mm×0.25μm)叔丁基甲醚 分析纯 国药集团化学试剂有限公司甲醇 色谱纯 美国Fisher公司旋转蒸发仪 上海亚荣生化仪器厂2,4-二甲基苯胺和2,6-二甲基苯胺均为德国Dr.Ehrenstorfer公司。1.2 试样的制备分别称取适量的2,4-二甲基苯胺和2,6-二甲基苯胺,以甲醇为溶剂分别配制适宜浓度的2,4-二甲基苯胺溶液、2,6-二甲基苯胺溶液和2,4-二甲基苯胺和2,6-二甲基苯胺混合溶液。1.3 仪器操作条件色谱柱:DB-17MS 30m×0.25mm×0.25μm;温度:进样口220℃ ;辅助器280℃;离子源230℃ ;四极杆温度:150℃;柱温:40℃保持2分钟,以15℃/分钟升温至[/font
[size=18px]目前在用AB的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]测三苯基氯甲烷,Q1 MI模式扫243.1的离子[font=-apple-system, BlinkMacSystemFont, &](应该是三苯甲基碳正离子)[/font],发现基线非常高(30万-50万之间),且不稳定,时高时低,导致峰面积也 不稳定,打电话问客服,几个人几种说法,“液相部分污染了”“这个是正常现象,多走走就稳定了”,尝试用MRM模式去做,打出一个165.2的碎片,基线不到1000,做了线性和回收也都挺好,但是,这个碎片离子是怎么打出来的比较困惑,就怕以后再做的时候重现不出来……[/size][size=18px]流动相是90%甲醇,溶剂是正丁醇:乙腈(80:20)[/size][size=18px]请教一下各位大神,AB的仪器用SIM模式选择Q1 MI还是Q3 MI好呢?基线高且时高时低,除了污染还有什么原因呢?[font=-apple-system, BlinkMacSystemFont, &]三苯甲基碳正离子在质谱里能被打碎吗?会裂解成什么碎片离子?[/font][/size][size=18px][font=-apple-system, BlinkMacSystemFont, &][/font][/size]

“超高效液相色谱-串联质谱法测定大豆中草甘膦及其代谢物氨甲基膦酸的残留”是本人去年开展大豆中草甘膦检测项目整个试验过程的总结,欢迎各位老师和同行批评指正,该文章还未在任何刊物上发表。[align=center][b]超高效液相色谱-串联质谱法测定大豆中草甘膦及其代谢物氨甲基膦酸的残留[/b][/align][align=center][/align][align=center]户江涛[/align][align=center](黑龙江省农垦科学院测试化验中心,黑龙江 佳木斯 154007 )[/align]摘要:采用超高效液相色谱-串联质谱法建立了快速检测大豆中草甘膦和氨甲基膦酸残留量的分析方法。试样经水超声提取,二氯甲烷去除脂肪,C[sub]18[/sub]固相萃取柱净化后,在硼酸钠缓冲溶液中与9-芴甲氧羰酰氯(FMOC-Cl)进行衍生反应,其衍生产物在C[sub]18[/sub]色谱柱上以 2 mmol/L 乙酸铵溶液和乙腈为流动相,进行液相色谱分离:质谱检测采用电喷雾正离子化模式和多反应监测模式(MRM)。结果表明,草甘膦和氨甲基膦酸在0.001~0.5 mg/L范围内线性关系良好,相关系数(R)分别为0.9996和0.9993,定量限(LOQ)均为0.01mg/kg。在空白大豆样品添加浓度为0.02、0.2、2 mg/kg 时,草甘膦和氨甲基膦酸的平均回收率分别为80.2%~91.5%和77.7%~89.3%,相对标准偏差(RSD)分别为3.37%~6.96%和4.11%~8.27%(n=6)。本方法快速、简便、灵敏,适用于大豆中草甘膦和氨甲基膦酸残留的同时检测。关键词:超高效液相色谱-串联质谱;大豆;草甘膦;氨甲基膦酸;衍生反应[align=center]Determination of glyphosate and its metabolite aminomethyl-phosphonic acid residues in soybean by ultra performance liquid chromatography-tandem mass spectrometry[/align][align=center]HU Jiangtao[/align][align=center]([i]Testing and Analysis Center of Heilongjiang Academy of Land Reclamation Sciences, Jiamusi 154007,China[/i])[/align][b]Abstract:[/b]A method[b] [/b]was developed for the determination of glyphosate(PMG) and aminomethyl-phosphonic acid(APMA) residues in soybean by ultra performance liquid chromatography-tandem mass spectrometry(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS). After extracted with water under ultrasonication, the sample was defatted with dichloromethane and purified by C[sub]18 [/sub]solid phase extraction cartridge, and then PMG and APMA were derivatized using 9-fluorenylmethoxycarbonyl(FMOC-Cl) in borate buffer for 2 h.The derivatives of PMG and APMA were separated on a Waters BEH C[sub]18[/sub] column with gradient elution with the mobile phase of 2 mmol/L ammonium acetate and acetonitrile, and finally detected by positive eletrospray ionization-mass spectrometry(ESI[sup]+[/sup]-MS/MS) in multiple reaction monitoring(MRM) mode.The results showed the linearities of PMG and APMA were good in the concentration range of 0.001~0.5 mg/L ,and the correlation coefficients were 0.9996 and 0.9993 respectively. The limit of quantification(LOQ) of PMG and APMA was both 0.01mg/kg. At the spiked levels of 0.02、0.2、2 mg/kg in the blank soybean samples, the mean recoveries of PMG and APMA were 80.2%~91.5% and 77.7%~89.3% respectively, and the relative standard deviation(RSD) of PMG and APMA were 3.37%~6.96% and 4.11%~8.27% res-pectively(n=6).This method is fast,simple,sensitive, and suitable for simultaneous determination of PMG and APMA in soybean.[b]Key words: [/b]ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) soybean glyphosate(PMG) aminomethyl-phosphonic acid(APMA) derivatization草甘膦(Glyphosate,PMG)又名镇草宁、农达,分子式为C[sub]3[/sub]H[sub]8[/sub]NO[sub]5[/sub]P,是1971年美国孟山都公司研发的一种有机磷除草剂,因其兼具内吸、传导性、灭生性及非选择性,同时不易在生物体内累积,故广泛应用于农业生产中一年生和多年生杂草防除,是目前世界上应用最广、生产量最大的除草剂[sup][/sup]。草甘膦及其在植物中的主要代谢物氨甲基膦酸(Aminomethyl-phosphonic acid,APMA,分子式为CH[sub]6[/sub]NO[sub]3[/sub]P)均属于强极性、易溶于水的高沸点化合物,具有不易挥发、无紫外吸收等特性,因此用常规方法分析检测十分困难[sup][/sup]。 目前, PMG和APMA残留检测的方法主要有色谱法(GC[sup][/sup]、LC[sup][/sup]、IC[sup][/sup])、质谱法(GC/MS[sup][/sup]、ICP/MS[sup][/sup]、LC/MS/MS[sup][/sup])、光谱法[sup] [/sup]等。光谱法虽然操作简便,但其灵敏度不高,而[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法[sup][/sup]只能适用于水样等简单基质,用于植物源样品检测时干扰太大;用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]和[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用[/color][/url]技术检测时,需要将PMG和APMA衍生转化为可气化物质,其引入试剂多、过程相对繁琐,效率较低[sup][/sup];用LC/MS/MS法直接检测时[sup][/sup],由于PMG和APMA分子量(分别为169、111)均较小,其主要碎片离子的质荷比多在100以下,检测实际样品时受基质干扰严重,灵敏度较低,因此柱前衍生——[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]法成为近年来国内外检测PMG和APMA残留的主流方法[sup][/sup]。以9-芴甲氧羰酰氯(FMOC-Cl)做为衍生试剂,在硼酸盐缓冲溶液中与PMG和APMA水提取液相容性好,过程简单,其衍生产物在LC/MS/MS中响应信号高,碎片离子干扰小,适合定性定量分析。 目前,采用柱前衍生——LC/MS/MS法检测茶叶、稻米等基质中PMG和APMA残留的报道很多[sup][/sup],专门针对大豆基质的报道很少。行业标准[sup][/sup]的适用范围虽然包括了大豆基质,但该方法在实验过程中试剂用量大、操作繁琐(反复调pH值)、衍生时间长(需过夜),尤其是使用阳离子交换柱(CAX)洗脱时需要加入11 mL 1%的盐酸甲醇水(20/80,v/v),水分含量过高导致旋转蒸发时很难蒸干,容易造成PMG和APMA回收率不稳定。本文专门针对大豆这类高蛋白、高脂肪含量的特殊基质,采用纯水作为提取试剂,二氯甲烷去除脂溶性杂质,C[sub]18[/sub]固相萃取小柱净化后采用FMOC-Cl衍生,最后用UPLC/MS/MS测定。该方法前处理过程简便、快速、灵敏度高,适用于大豆中PMG和APMA的残留检测。[b]1 实验部分[/b]1.1 材料与试剂 草甘膦、氨甲基膦酸(纯度≥99%,德国Dr.Ehrensorfer公司);FMOC-Cl(纯度99%,Sigma公司),使用时配置成10g/L的丙酮溶液;乙腈、二氯甲烷、甲酸、乙酸铵(色谱纯,美国Fisher公司);十水四硼酸钠(优级纯,天津市科密欧化学试剂有限公司),使用时配置成50g/L的水溶液;实验用水为Millipore纯水仪制备;C[sub]18[/sub]固相萃取小柱(200mg/3ml,美国Agilent公司)。1.2 仪器与设备 Acquity UPLC型超高效液相色谱仪(Waters公司);XEVO TQ-S三重四级杆质谱仪(Waters公司);CR21GⅢ型高速离心机(HITACHI公司);KQ5200DB型台式超声波仪(昆山市超声仪器有限公司);涡旋混合器(IKA公司)。1.3 标准溶液的配置 分别称取草甘膦和氨甲基膦酸标准品10mg(精确到0.1mg),用水溶解并定容至10mL,配置成质量浓度为1.0 mg/mL标准储备液,于4℃冰箱保存待用;使用时用水逐级稀释成所需浓度的混合标准工作液。1.4 样品前处理 提取:称取粉碎均匀后的试样1.0g(精确到0.01g)于50mL聚乙烯离心管中,加入10.0mL超纯水,涡旋混合30 s并超声提取20 min后,以10000 r/min离心3 min,将上清液转移至另一离心管中,加入5 mL二氯甲烷涡旋混合30 s,以10000 r/min离心3 min,上清液待净化。 净化:取2.5 mL上清液加入到C[sub]18[/sub]固相萃取柱(使用前依次用3mL甲醇和3mL超纯水活化)中,弃去最初的几滴流出液(约0.5 mL),将剩余部分用5 mL玻璃管收集,待衍生。 衍生:取1.0 mL净化液于5 mL离心管中,依次加入1.0 mL 50g/L的硼酸钠溶液和 1.0 mL 10g/L的FMOC-Cl衍生液,混匀后室温下衍生2 h,以10000 r/min离心3 min,取上清液过0.22 mm有机系微孔滤膜后,供UPLC/MS/MS分析测定。1.5 液相色谱及质谱条件 液相色谱:色谱柱:Waters BEH C[sub]18[/sub](1.7 μm,50mm×2.1mm);柱温:30℃;流速:0.5 mL/min;进样量:2 μL;流动相A:乙腈;流动相B: 2 mmol /L 的乙酸铵水溶液。梯度洗脱程序:0~0.5min,10% A;0.5~3. 0 min,10%~100% A;3. 0 ~4. 0 min,100%A,4 ~4.1min,100% A~10% A,4.1 ~5.0min 10% A。 质谱:离子源:电喷雾离子源( ESI [sup]+[/sup] ) ;扫描方式:正离子扫描;检测方式:多反应监测( MRM);毛细管电压:3.2 kv;离子源温度:150℃;去溶剂气温度:500℃;去溶剂气流量:1000 L /h;定性、定量离子对及碰撞能量见表1。[align=center]表1 PMG-FMOC和 AMPA-FMOC的MRM质谱参数[/align][align=center]Table 1 MRM parameters of PMG-FMOC and AMPA-FMOC[/align][table][tr][td][align=center]Analyte[/align][/td][td][align=center]Cone/V[/align][/td][td][align=center]Parent ion/(m/z)[/align][/td][td][align=center]Daughter ion/(m/z) [/align][/td][td][align=center]Collision energy/V[/align][/td][/tr][tr][td][align=center]PMG-FMOC[/align][align=center] [/align][align=center]AMPA-FMOC[/align][/td][td][align=center]30[/align][align=center] [/align][align=center]30[/align][/td][td][align=center]392[/align][align=center][sup] [/sup][/align][align=center]334[/align][align=center][sup] [/sup][/align][/td][td][align=center]88[/align][align=center]214﹡[/align][align=center]112﹡[/align][align=center]179[/align][/td][td][align=center]14[/align][align=center]8[/align][align=center]11[/align][align=center]20[/align][/td][/tr][/table]﹡quantitative ion[b]2 结果与讨论[/b]2.1 色谱及质谱条件的优化 流动相的选择:对比了酸性体系(0.1%甲酸水溶液)与非酸性体系(乙酸铵水溶液)分别于甲醇、乙腈的流动相体系组合,结果发现两种分析物在酸性体系中分离效果欠佳,峰形拖尾严重,而在非酸性体系中其色谱分离效果得到明显改善,峰形对称;乙腈比甲醇体系洗脱能力更强,可以有效缩短分析时间。故本研究采用乙酸铵水溶液+乙腈流动相体系,并比较了1、2、5 mmol/L三种乙酸铵浓度与乙腈的组合,结果发现随着乙酸铵浓度的增加,目标物响应值虽略有提高但相差不大,而同时仪器背景值却显著升高,综合考虑目标物信号强度、信噪比、色谱分离效果以及分析时间等因素,本实验最终选择了2 mmol /L 乙酸铵水溶液+乙腈分析体系。质谱的选择:PMG、 AMPA对应的衍生物PMG-FMOC、AMPA-FMOC分子量分别为391、333。用超纯水配置10 mg/L 混合标准溶液直接注射到质谱中,在正负离子模式下分别进行母离子全扫描,发现正离子模式下392、334具有很好的响应,然后分别以392、334为母离子进行子离子全扫描,各得到两组丰度高、干扰小的子离子对进行MRM监测,最终确定的质谱条件见表1。2.2 前处理条件的优化 提取溶液的选择:PMG和APMA属于强极性物质,易溶于水,难溶于有机溶剂,故一般采用极性溶剂提取,如纯水及KOH、NaHCO[sub]3[/sub]溶液等[sup][/sup]。实验发现,用碱性溶液提取后,大豆中脂肪、蛋白等物质会与碱性物质发生反应,导致离心后的提取液异常浑浊,不利于后期净化和衍生,因此本实验采用纯水作为提取试剂,再经二氯甲烷液液萃取去除脂溶性杂质。 净化柱的选择:研究发现,对提取后的溶液不经SPE净化直接进行衍生, PMG和APMA的回收率均不足30%,且精密度很差,这可能是由于大豆中富含脂肪、蛋白质等物质干扰衍生过程,故本实验比较了对脂肪、蛋白质有很好去除效果的C[sub]18[/sub]、中性Al[sub]2[/sub]O[sub]3[/sub]、HLB固相萃取SPE柱的净化效果,结果发现提取液经中性Al[sub]2[/sub]O[sub]3[/sub]净化后,PMG和APMA几乎检测不到;而C[sub]18[/sub]净化后目标物回收率为92.7%、90.8%,HLB为83.6%、80.5%。故本实验选取了净化效果更好,成本相对低廉的C[sub]18[/sub]固相萃取小柱。 衍生条件的优化:FMOC-Cl的衍生机制是在碱性环境下(pH=9.0)通过FMOC-Cl基团取代目标化合物氮原子上的氢,从而生成较稳定的化合物FMOC-Cl。参照行业标准[sup][/sup]及文献报道[sup][/sup]所选用的缓冲液浓度,本实验采用50g/L的硼酸钠水溶液缓冲液体系,设置的衍生试剂质量浓度为1、2、5、10、20 g/L FMOC-Cl丙酮溶液,按照本文1.4步骤对PMG和APMA质量浓度为0.5 mg/L的纯水溶液和大豆空白基质溶液分别进行衍生,结果见图1。结果表明,在纯水溶液中,FMOC-Cl浓度为2 g/L时,PMG和APMA的峰面积已达到最大,随着衍生化试剂浓度的升高,其峰面积无明显变化;而在大豆空白基质溶液中,FMOC-Cl低浓度(1、2g/L)时,PMG和APMA几乎检测不到,其峰面积随衍生化试剂浓度增加而加大,浓度到达一定程度(10 g/L)时,峰面积不再变化。产生这种现象的原因,可能是由于尽管大豆提取液经过了二氯甲烷和C[sub]18[/sub]小柱的净化,但还是会有少量水溶性蛋白、脂肪等杂质残留在净化液中,这些杂质可能会与衍生试剂反应,影响目标物的衍生效果。研究还发现,当FMOC-Cl浓度为20 g/L时,得到的PMG和APMA色谱峰产生拖尾现象,可能是由于衍生试剂化学性质较活泼,其用量大时,过量的FMOC-Cl会迅速转化成FMOC-OH,干扰目标物峰形。在50g/L硼酸钠水溶液、10 g/L FMOC-Cl丙酮溶液条件下,考察不同时间(0.5h、1h、2h、4h、8h和16h)对衍生效果的影响,结果发现,2 h后PMG和APMA的测定值无明显增加。因此,本实验最终选定的衍生条件为50g/L硼酸钠水溶液、10 g/L FMOC-Cl丙酮溶液,室温下衍生2 h。[img=,596,378]http://ng1.17img.cn/bbsfiles/images/2017/07/201707020904_01_2984502_3.png[/img][img=,690,530]http://ng1.17img.cn/bbsfiles/images/2017/07/201707020904_02_2984502_3.png[/img]2.3 基质效应的考察 基质效应(主要是抑制)是LC/MS/MS仪器检测时经常遇到的现象。由于本实验采用极性很强的水作为提取剂,大豆中的色素、脂肪酸等极性较强的物质也有少部分进入到最后的上机液中,在离子化带电过程中会与目标物产生竞争,抑制目标物的离子化效率。实验考察了用PMG和APMA的纯水标样去标定经过本文1.4步骤处理后的大豆空白基质溶液配置的同浓度标样,其色谱图见图2。结果发现,PMG在纯水和大豆空白基质中峰面积基本一致,而APMA在大豆空白基质中的峰面积仅为纯水中的55.7%,产生了明显的基质抑制效应。为了消除基质干扰,本实验选用大豆样品空白基质配置不同浓度的标准溶液来绘制标准曲线进行校准。2.4 线性范围和定量限 用大豆空白基质溶液分别配置0.001、0.005、0.01、0.05、0.1、0.2、0.5 mg/L的PMG和APMA混合标准溶液,按本文1.4步骤衍生后测定,以各自定量离子的峰面积为Y对应质量浓度X(mg/L)做标准曲线,得到的线性方程和相关系数见表2。结果表明,这两种物质在0.001~0.5 mg/L浓度范围内线性良好,相关系数R分别为0.9996和0.9993。以10倍信噪比(S/N)计算,该方法PMG和APMA的定量限(LOQ)均为0.01 mg/kg。[align=center]表2 PMG和APMA大豆基质标准溶液的线性方程、相关系数和定量限(LOQ)[/align][align=center]Table 2 Linear equations,correlation and LOQ of PMG and APMA in the soybean matrix standard solutions[/align][table][tr][td][align=center]Analyte[/align][/td][td][align=center]Linear range/(mg/L)[/align][/td][td][align=center]Linear equation[/align][/td][td][align=center]R[/align][/td][td][align=center]LOQ/(mg/ kg )[/align][/td][/tr][tr][td][align=center]PMG[/align][align=center]AMPA[/align][/td][td][align=center][sup]0.001~0.5[/sup][/align][align=center][sup]0.001~0.5[/sup][/align][/td][td][align=center]Y=889809x+1671.3[/align][align=center]Y=476982x+1161.9[/align][/td][td][align=center]0.9996[/align][align=center]0.9993[/align][/td][td][align=center]0.01[/align][align=center]0.01[/align][/td][/tr][/table]2.5 回收率和精密度 称取大豆空白试样1.0 g,分别添加0.02、0.2、2 mg/kg水平的PMG和APMA混合标样,每个水平重复6次,按照本文1.4步骤前处理方法处理后上机检测,实验结果见表3。从表3可以看出,PMG的平均回收率为80.2%~91.5%,相对标准偏差(RSD,n=6)为3.37%~6.96%;APMA的平均回收率和RSD分别为77.7%~89.3%和4.11%~8.27%。[align=center]表3 大豆中PMG和APMA的加标回收率和相对标准偏差(n=6)[/align][align=center]Table 3 Recoveries and relative standard deviations(RSD)of PMG and APMA spiked in the soybean(n=6) [/align][table][tr][td][align=center]Analyte[/align][/td][td][align=center]Spiked level(mg/kg)[/align][/td][td][align=center]Recovery/%[/align][/td][td][align=center]RSD/%[/align][/td][/tr][tr][td]PMGAMPA[/td][td][align=center]0.02[/align][align=center]0.2[/align][align=center]2[/align][align=center]0.02[/align][align=center]0.2[/align][align=center]2[/align][/td][td][align=center]80.2[/align][align=center]91.5[/align][align=center]86.8[/align][align=center]77.7[/align][align=center]89.3[/align][align=center]85.9[/align][/td][td][align=center]6.96[/align][align=center]3.37[/align][align=center]3.95[/align][align=center]8.27[/align][align=center]4.25[/align][align=center]4.11[/align][/td][/tr][/table][b]3 结语[/b] 本文建立了超高效液相色谱-串联质谱法(UPLC/MS/MS)测定大豆中草甘膦及其代谢物氨甲基膦酸残留的分析方法。该方法灵敏度高,PMG和APMA定量限(LOQ)达到0.01 mg/kg,能满足大豆产品相关限量标准要求。同时该方法具有较高的准确度和精密度,前处理步骤简单快速,特别适合大批量大豆样品的检测。
氮甲基苯胺、邻甲基苯胺、间甲基苯胺,对甲基苯胺在用红外光谱检测时,波长分别是多少
用于甲苯和异丙酮混合液的分离和甲基纤维素基团的测定,不知道哪个柱子型号可以做呢?

气相色谱法对维生素E的原料三甲基氢醌的检测摘要 三甲基氢醌即2,3,5-三甲基氢醌,又名2,3,5-三甲基对苯二酚,是生产维生素E的中间体,其主要用途是用作生产维生素E的主要原料。目前,维生素E已成为国际市场上用途广泛、产销量极大的主要维生素品种,国内外市场前景广阔。目前全国生产能力不能满足国内市场供应不足,部分依赖进口。因此对三甲基氢醌的需求日益增加。而对于三甲基氢醌检测目前国家和行业都没有一个统一的检测标准。为此南京科捷分析仪器应用研究所根据客户的要求应用GC5890C气相色谱仪对2,3,5-三甲基氢醌进行方法研究。实验结果表明:本方法简便,分析速度快。能满足生产质量控制的要求,从而降价低生产成本。关键词 2.3.5- 三甲基氢醌 2,3,5-三甲基对苯二酚 维生素E中间体 气相色谱法一.2.3.5三甲基氢醌气相色谱图 http://ng1.17img.cn/bbsfiles/images/2011/06/201106171053_300271_2242538_3.jpg三、仪器配置 检测项目2,3,5-三甲基氢醌及其杂质色谱仪器型号GC5890C型色谱仪 配有FID检测器毛细管色谱柱0.32*30*0.25专用柱色谱工作站N2000(电脑1台自备)氮氢空发生器 HGT300E 1台或高纯氮、氢气、空气钢瓶各一瓶
[i]刚学色谱不知道邻、间、对甲基苯胺如何分离?使用什么仪器?请学界泰斗,帮忙分析[/i]
分析对甲基苯胺,间甲基苯胺,邻甲基苯胺,用什么毛细管色谱柱好?
请问2-甲基-4-氨基苯酚的液相检测方法是什么?
SNT 2325-2009 进出口食品中四唑嘧磺隆、甲基苯苏呋安、醚磺隆等45种农药残留量的检测方法 高效液相色谱-质谱 质谱法
SNT 2325-2009 进出口食品中四唑嘧磺隆、甲基苯苏呋安、醚磺隆等45种农药残留量的检测方法 高效液相色谱-质谱 质谱法
各位大虾,芳香族胺类化合物(苯胺、N-甲基本胺,N,N-二甲基苯胺,苄基氰)能用HP-innowax做吗?新手求助,万分感谢啊

[align=center][img=,600,400]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091122509261_9069_932_3.jpg!w600x400.jpg[/img][/align]香兰素、甲基香兰素和乙基香兰素,均为广泛使用的可食用香料。有浓烈的奶香气息,在香荚兰的种子中可以找到,也可以人工合成,被广泛的运用到,蛋糕、奶粉、冰激凌等食品的制作中。今天我们就来做一下在奶粉和蛋白粉中香兰素、甲基香兰素和乙基香兰素的检测。[b]适用范围[/b]适用于奶粉、蛋白粉中香兰素、甲基香兰素和乙基香兰素的检测。[b]溶液的配置[/b]1)标准储备液:分别精确称取香兰素、甲基香兰素和乙基香兰素10mg,分别用乙腈溶解并定容到10mL,浓度为1000mg/L。2)20%甲醇:移取20mL的甲醇,用水定容至100mL。3)5%乙酸甲醇:移取5mL乙酸,用甲醇定容至100mL。4)50%乙腈:移取50mL的乙腈,用水定容至100mL。[b]提取步骤[/b]奶粉1) 移取1g样品,加入10mL的水,振荡,超声10min,离心10min(8000r/min),吸取上清液;2) 再加入10mL水,振荡,超声10min,离心10min(8000r/min),吸取上清液;3) 重复2)的过程,合并所有上清液,混匀,再次离心2min,待净化。蛋白粉移取0.5g样品,加入10mL的水振荡,8000rpm下离心,取澄清液,再重复2次,总计30mL水提取,待净化。[b]SPE净化步骤[/b]SPE柱:月旭WelchromP-SAX规格:150 mg/6mL。活化:5 mL 甲醇、5 mL 水,弃去;上样:待净化液15mL上样,控制流速,不宜过快,弃去;淋洗:6mL20%甲醇水淋洗,弃去。洗脱:15mL5%乙酸甲醇洗脱,收集于旋转蒸发瓶,并抽干小柱。复溶:洗脱液在45℃下减压蒸干,用50%乙腈定容至1mL。过0.22μm滤膜,上HPLC检测。[b]色谱条件[/b][color=#333333][/color]色谱柱:月旭UltimateXB-C18 4.6×250mm,5μm流动相:A-0.1%磷酸溶液,B-甲醇(A/B=70/30等度洗脱)流速:1.0mL/min柱温:30℃进样量:20μL检测波长:280nm[align=left][b]色谱图或者加标回收率结果[/b][/align][align=center][b][img=,600,335]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091122549495_1545_932_3.jpg!w690x386.jpg[/img][/b][/align][align=center][color=#333333][img=,600,131]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091122584398_3527_932_3.png!w690x151.jpg[/img][/color][/align][align=center][color=#333333]图1.奶粉对照香兰素20mg/L、甲基香兰素5mg/L、乙基香兰素10mg/L图谱[/color][/align][color=#333333][/color][align=center][color=#333333][img=,600,335]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123014375_3369_932_3.jpg!w690x386.jpg[/img][/color][/align][align=center][color=#333333]图2.奶粉粉样过柱图谱[/color][/align][align=center][color=#333333][/color][/align][align=center][color=#333333][img=,600,335]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123043784_5835_932_3.jpg!w690x386.jpg[/img][/color][/align][align=center][color=#333333]图3.奶粉样加标香兰素20mg/L、甲基香兰素5mg/L、乙基香兰素10mg/L图谱[/color][/align][align=center][color=#333333][/color][/align][align=center][color=#333333][color=#333333][img=,600,335]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123079138_6486_932_3.jpg!w690x386.jpg[/img][/color][/color][/align][align=center][color=#333333][color=#333333][img=,600,158]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123107145_4550_932_3.png!w690x182.jpg[/img][/color][/color][/align][align=center][color=#333333][color=#333333]图4.蛋白粉对照香兰素100mg/L、甲基香兰素5mg/L、乙基香兰素15mg/L图谱[/color][/color][/align][align=center][color=#333333][color=#333333][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333][img=,600,335]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123138565_2990_932_3.jpg!w690x386.jpg[/img][/color][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333]图5.蛋白粉样过柱图谱[/color][/color][/color][/align][color=#333333][color=#333333][color=#333333][/color][/color][/color][align=center][img=,600,335]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123171107_510_932_3.jpg!w690x386.jpg[/img][/align][align=center]图6.蛋白粉样加标香兰素400mg/kg、甲基香兰素20mg/kg、乙基香兰素60mg/kg图谱[/align][align=center][/align][align=center][img=,600,216]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123204485_8036_932_3.png!w561x202.jpg[/img][/align][color=#333333][/color][align=center]表1.奶粉香兰素、甲基香兰素和乙基香兰素过P-SAX小柱加标回收表[/align][align=center][/align][align=center][color=#333333][color=#333333][color=#333333][img=,600,162]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123255715_3868_932_3.png!w641x174.jpg[/img][/color][/color][/color][/align][align=center][color=#333333]表2.蛋白粉香兰素、甲基香兰素和乙基香兰素过P-SAX小柱加标回收表[/color][/align][color=#333333][color=#333333][color=#333333][b]相关产品信息[/b][/color][/color][/color][align=center][img=,600,407]https://ng1.17img.cn/bbsfiles/images/2019/10/201910091123287959_7092_932_3.jpg!w690x469.jpg[/img][/align]
请问HP-5(5%苯甲基硅酮)色谱柱与HP-5(5%二苯基聚硅氧烷共聚物)的柱子有什么不同吗?一般HP-5柱子不是都指后者吗?一药典要求用前者做一物质的内标含量,我用了后面的,打出峰来难看的很
本研究建立了一种固相萃取结合高效液相色谱-三重四极杆质谱法分析饮用水处理厂水样中7种香豆素类化合物的方法。样品前处理过程采用HLB小柱进行固相萃取,然后采用超纯水(含0.25%甲酸)淋洗,最后经甲醇(含0.25%甲酸)洗脱。萃取液用Phenomenex Luna C18柱(100 mm×2.0 mm, 3μm)分离后,以甲醇-0.1%甲酸水溶液为流动相进行梯度洗脱,在电喷雾多反应监测模式下检测。以饮用水原水和出厂水为基质考察方法的基质效应、精密度和准确度。7种香豆素类化合物在各自的线性范围内呈现良好的线性关系,相关系数(r)均大于0.99,方法检出限(MDL)为0.67~1.12 ng/L。不同加标水平(20、50、100 ng/L)下7种香豆素类化合物回收率为61.4%~91.5%,相对标准偏差(RSD,n=6)均≤11.2%。利用该方法分析了饮用水处理厂不同处理阶段的水样,其中7-羟基香豆素、6,7-二羟基香豆素、香豆素的检出率为100%,含量为0.21~27.9 ng/L。6-羟基-4-甲基香豆素在原水、混凝后水样、炭滤后水样中均未检出,只在砂滤后水样和出厂水中被检出,而且出厂水中的含量(4.69 ng/L)高于砂滤后水样(1.79 ng/L)。8-氯-7-羟基香豆素只在出厂水中被检出(0.28 ng/L)。本方法分析时间短,精密度和准确度良好,在监测实际水样中香豆素的含量,评估饮用水处理过程对于水样中香豆素类化合物去除方面可发挥积极作用。
联苯苄基氯(学名;4,4’-双氯甲基联苯)溶解方法?用ICP-AES测定其中的Ca,Fe,Zn,P,Na等元素(1--5ppm)。请高手指点样品处理方法为盼。谢谢啊http://simg.instrument.com.cn/bbs/images/brow/emyc1010.gif
分析对甲基苯胺,间甲基苯胺,邻甲基苯胺,用什么毛细管柱色谱柱好?
各位老师好!想请教下香豆素和异香豆素极性的大小,在c18柱子上的出峰顺序,感谢!
氧化器主要含异丙苯,测定其中所含杂质含量,主要杂质有二甲基苯甲醇,苯乙酮和过氧化氢异丙苯等,选用何种色谱柱?如何选择操作条件,我们要使用安捷伦1200液相色谱仪,
请教α-甲基苯乙烯,邻甲基苯乙烯,2-甲基苯乙烯,3-甲基苯乙烯,4-甲基苯乙烯,是不同的物质吗?,物质结构