——胡丽涛、王治国目的 为凝血酶原时间(PT)和活化部分凝血酶时间(APTT)检测提供指南。方法 主要参考美国临床和实验室标准化研究院(CLSI)H47-A2文件相关内容,并结合具体的实际进行总结。结果 PT和APTT检测受到检验前、中和后各种变异的影响。通过检测技术的标准化提高检测的重复性,通过设定性能目标来确保检测的临床相关性。PT检测可用于检测肝素治疗,实验室应该建立肝素治疗范围。结论 对于疑似血液凝固障碍的患者评估,PT和APTT是非常重要的实验室筛查检测。在实际工作中要严格按照操作规程和厂家说明,保证结果的准确可靠,为临床提供诊疗依据。凝血酶原时间;部分活化凝血酶时间;国际标准化比值;校准 自从Quick在1953年首次描述了凝血酶原时间(PT),PT在可疑凝血障碍的患者评估方面成为了一项非常重要的实验室筛查检测,也是实验室最常见的凝血检测。尽管PT最先被描述成一种凝血酶原或凝血因子Ⅱ的特异性一步法检测,但是PT对凝血系统的共同途径和外源性途径所涉及到的任何凝血因子(凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅹ和纤维蛋白原)及因子抑制物的定量或定性的异常都非常敏感。同时,PT也是严重肝脏疾病或慢性肝病的一项适当指标,还是用于监测维生素K治疗最常用的指标。 PT检测的主要试剂凝血活酶是一种磷脂或组织制剂,通常为人源性或动物源性或人和动物的混合材料制成的各种商业化的制剂。这些商业化的凝血活酶制剂在其减少凝血因子的反应性方面存在差异,影响了其使用,特别是在维生素K治疗的检测过程中。 APTT对内源性凝血途径和共同途径的定量和定性异常敏感。是除PT之外,常规实验室最常进行的凝血检测。APTT对内源性凝血途径凝血因子缺乏(凝血因子Ⅷ、Ⅸ、Ⅺ、Ⅻ、前激肽释放酶和高分子激肽原)尤为敏感。APTT检测通常用于监测低分子肝素抗凝治疗。APTT还用于检测其他类型的病理型血液凝固抑制物,最常见的是狼疮抗凝物质(LA)。APTT用于凝血因子替代治疗。APTT的检测试剂是促凝物、磷脂和接触激活剂组成的混合物。磷脂可能来源于人、动物或者植物。激活剂的种类也很多,如硅藻土、高岭土、微粉化的硅土和鞣花酸等。 一般,当凝血因子的活性低于参考区间的95%置信限水平时APTT会延长。但是,大量的研究表明不同的APTT试剂对于轻度和中度的凝血因子缺乏的反应程度存在一定的区别,特别是Ⅷ和Ⅸ因子缺乏。有相似的报道APTT对循环狼疮抗凝物质有不同的敏感性。同样,有文献报道商品化的APTT试剂对肝素的反应性不同,使得APTT值存在显著差异。
蕲蛇蛇毒中凝血酶样酶的分离纯化与特性[~119829~][~119828~]
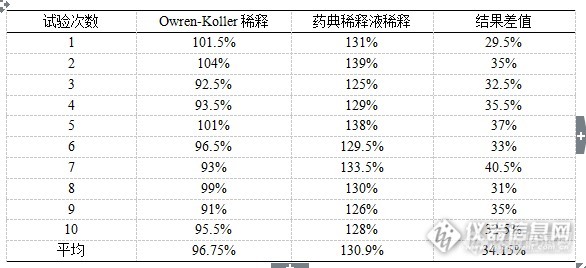
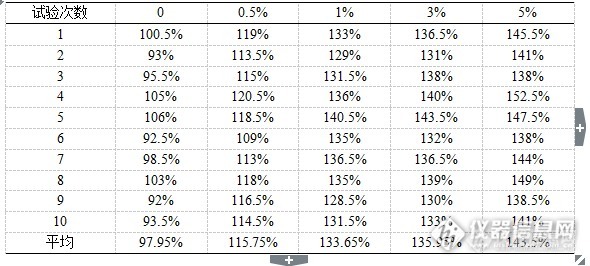
[align=center][/align][align=left][b] 摘要:目的 [/b]确立不同稀释液对凝血因子效价检测的影响,研究因子效价检测的稀释方法,从而完善因子类血液制品效价检测的方法。 [b]方法 [/b]对同一批和连续生产的10批人凝血因子Ⅷ、人凝血酶原复合物样品进行全自动血凝仪法的效价检测,分别选用全自动血凝仪稀释液和含1%人血白蛋白稀释液进行检测,统计10次以上的检测结果以确定不同稀释液之间的差别。 [b]结果 [/b]本实验确定了在人凝血因子Ⅷ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅷ的样品进行稀释,无论是对同一批质控品的测定还是对连续批次样品的测定,检测结果之间存在较大的差别。而在人凝血酶原复合物人凝血因子Ⅸ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅸ的样品进行稀释,同一批质控品和连续批次样品检测结果之间差别较小。[b]结论 [/b]因子类血液制品效价检测时,同一样品采用不同的稀释液进行稀释检测结果可能存在较大差别,应对血凝仪是否可用于因子类血液制品进行评估,并应建立起正确的检测操作规程。[/align][b] 关键词: [/b]凝血因子; 稀释液; 效价测定 目前国内血液制品的生产是以健康人血浆为原料,经过分离纯化和病毒灭活制成,主要分为三大类,人血白蛋白、人免疫球蛋白类产品、人凝血因子类产品。国内已上市或在研的人凝血因子类产品主要有人凝血因子Ⅷ、人凝血酶原复合物、人纤维蛋白原、人纤维蛋白粘合剂、人凝血因子Ⅸ、人抗凝血酶Ⅲ等。人凝血因子Ⅷ主要用于防治甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状病人的手术治疗。人凝血酶原复合物主要有效成分为人凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ,主要用于治疗主要用于乙型血友病、 维生素K依赖的凝血因子缺乏症等病症的治疗。 人凝血因子Ⅸ主要用于防治乙型血友病和获得性凝血因子Ⅸ缺乏而致的出血症状病人的手术治疗。因子类血液制品是血液中凝血因子的高纯度浓缩物,在进行效价测定时需要对样品进行稀释,而稀释液中蛋白含量的不同对其检测结果有着影响。因子效价测定方法有一期法、二期法和发色底物法。一期法是目前应用最广泛的检测方法,系用人凝血因子缺乏血浆为基质,在APTT试剂和氯化钙的参与下,根据凝血因子国家标准品和供试品的凝集时间来计算供试品中的人凝血因子效价,实际检测过程中将基于一期法原理的人凝血因子效价测定法分为三种方法,即手工法、半自动血凝仪法、全自动血凝仪法。全自动血凝仪只是对一期法中各反应试剂的加入顺序进行了修订以便实现仪器的自动操作。相对于手工法检测,消除了很多主观因素。在日常工作中,当使用不同种类的稀释剂而采用相同的检测原理和方法进行效价测定应不会对测定结果产生影响,但实际工作中发现使用不同种类的稀释剂对效价测定结果有一定的影响。在人凝血因子Ⅷ效价检测过程中,采用手工法、半自动血凝仪法、全自动血凝仪法进行人凝血因子Ⅷ效价的比对试验,发现手工法、半自动血凝仪法检测结果一致,这两种方法比全自动血凝仪法的检测结果高20%以上。血液制品的原料来源于人血浆,受原料限制,一直较为稀缺,尤其是当前人凝血因子Ⅷ的生产量远远无法满足血友病患者的需求[sup][[/sup][sup]1-5[/sup][sup]][/sup],不同检测方法间20%以上的检测差别可能影响20%的产品收率,所以建立起因子类产品效价准确的检测至关重要。[b][b]1 实验仪器与试剂1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法2.1 人凝血因子Ⅷ不同稀释液稀释效价测定2.1.1 人凝血因子Ⅷ供试品Owren-Koller(稀释液)稀释效价测定方法[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.1.2 人凝血因子Ⅷ供试品药典稀释液稀释效价测定方法[/b][/b] 人凝血因子Ⅷ国家标准品的定标同2.1.1人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血酶原复合物人凝血因子Ⅸ不同稀释液稀释效价测定2.2.1 人凝血酶原复合物供试品Owren-Koller(稀释液)稀释效价测定方法[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《STAGO Compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.2.2 人凝血酶原复合物供试品药典稀释液稀释效价测定方法[/b][/b] 人凝血因子Ⅸ国家标准品的定标同2.1.1。人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同稀释液稀释效价测定结果[/b][/b] 2015ZK0801批人凝血因子Ⅷ为泰邦公司人凝血因子Ⅷ产品的质控品,取自正常生产的产品,用国家标准品标定后用作工作质控品。在进行人凝血因子Ⅷ效价测定时,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅷ进行再稀释。检验结果见表1,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品两种稀释液检测结果对比[/align][align=center][img=,586,268]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141920_02_1626619_3.png[/img][/align]用柱形图表示,如图1:[align=center][img=,488,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141921_02_1626619_3.png[/img][/align][align=center]图1 FⅧ质控品两种稀释液检测结果对比[/align] 选取泰邦公司生产的连续10个批次的人凝血因子Ⅷ产品,进行人凝血因子Ⅷ效价测定,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅷ进行再稀释。检验结果见表2,效价检测结果为效价标示量的百分比。[align=center]表2 连续10批FⅧ两种稀释液检测结果对比[/align][align=center][img=,580,273]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141921_03_1626619_3.png[/img][/align]用柱形图表示,如图2:[align=center][img=,499,310]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141922_01_1626619_3.png[/img][/align][align=center]图 2 连续10批FⅧ两种稀释液检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同稀释液稀释效价测定结果[/b][/b] 2015ZK0901批人凝血酶原复合物为泰邦公司人凝血酶原复合物产品的质控品,取自正常生产的产品,用国家标准品标定后用作工作质控品。在进行人凝血酶原复合物人凝血因子Ⅸ效价测定时,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅸ进行再稀释。检验结果见表3,效价检测结果为效价标示量的百分比。[align=center]表3 PCC质控品两种稀释液检测结果对比[/align][align=center][img=,580,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141923_01_1626619_3.png[/img][/align]用柱形图表示,如图3:[align=center][img=,548,288]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141923_02_1626619_3.png[/img][/align][align=center]图3 PCC质控品两种稀释液检测结果对比[/align] 选取泰邦公司生产的连续10个批次的人凝血酶原复合物产品,进行人凝血酶原复合物人凝血因子Ⅸ效价测定,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅸ进行再稀释。检验结果见表4,效价检测结果为效价标示量的百分比。[align=center]表4 连续10批PCC两种稀释液检测结果对比[/align][align=center][img=,573,259]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141947_01_1626619_3.png[/img][/align]用柱形图表示,如图4:[align=center][img=,548,327]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141947_03_1626619_3.png[/img][/align][align=center]图4 连续10批PCC两种稀释液检测结果对比[/align][b][b]4 讨论[/b][/b] 本实验确定了在人凝血因子Ⅷ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅷ的样品进行稀释,无论是对同一批质控品的测定还是对连续批次样品的测定,检测结果之间存在较大的差别,另外对FⅧ质控品两种稀释液检测结果运用软件SPSS17.0进行均值单因素ANOVA比较,计算P值,P<0.05表明两种方法的结果有显著性差异,含有蛋白的稀释液的检测结果明显高于不含蛋白的稀释液。而在人凝血酶原复合物人凝血因子Ⅸ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅸ的样品进行稀释,同一批质控品和连续批次样品检测结果之间差别较小,另外对PCC质控品两种稀释液检测结果运用软件SPSS17.0进行均值单因素ANOVA比较,计算P值,P>0.05表明两种方法的结果无显著性差异。在使用全自动血凝仪进行人凝血因子Ⅷ和人凝血酶原复合物等因子类血液制品效价检测时,一般按照仪器的使用说明书和配套试剂进行稀释检测,但是忽视了血凝仪的开发目的是用于临床血浆样品的检测,而血浆与高纯度的血液制品浓缩物是不同的,用检测血浆样品的方法进行因子类血液制品的效价检测可能影响检测结果。因子类血液制品效价检测时,同一样品采用不同的稀释液进行稀释检测结果可能存在较大差别,应对血凝仪是否可用于因子类血液制品进行评估,并应建立起正确的检测操作规程。因子类血液制品采用不同的稀释液进行稀释检测结果可能存在较大差别可能跟产品本身的性质有关,因子类血液制品经过分离、纯化,去除了众多的杂质蛋白,为高纯度的浓缩物,活性较高,但蛋白质含量较低,人凝血因子Ⅷ的蛋白质含量约为0.1%,人凝血酶原复合物的蛋白质含量约为2.3%,而临床血浆样本的蛋白质含量约为5%,, 人凝血因子Ⅷ加入含1%人血白蛋白的稀释液后对FⅧ效价测定影响较大,PCC中加入含1%人血白蛋白的稀释液后对FⅨ效价测定影响较小,可能是人凝血因子Ⅷ的蛋白质含量远小于血凝仪设计用于检测的血浆样本的蛋白含量,故建立不同蛋白质浓度梯度的稀释液对因子效价进行测定,从而确认蛋白质浓度对因效价测定的影响。[b]参考文献:[/b]Cheng E, Jinzenji D, Lorthiois AP, et al. Purification of coagulation factorⅧ using chromatographic methods. Direct chromatography of plasma in anion exchange resins . Biotechnol Lett, 2010, 32(9):1207-1214.李策生, 周志军, 胡勇, 等. 人凝血因子Ⅷ中试纯化工艺的质量控制 .中国生物制品学杂志, 2013, 26(10):1508-1512.冉曙光, 刘文芳, 赵辉. 凝血因子Ⅷ浓缩物的制备及安全性和有效性 .中国输血杂志, 2008, 21(2):156-159.倪道明, 朱威. 血液制品 . 北京: 人民卫生出版社, 2013:21.王卓, 赵雄, 吕茂民, 等. 血液制品的现状与展望 . 生物工程学报, 2011, 27(5):730-746.[b] [/b]
RT 单位买了台凝血分析仪,想了解一些他的工作原理是什么?
摘要: 目的 对人凝血因子Ⅷ酸沉淀过程效价和总蛋白建立近红外模型,实现效价和总蛋白的快速检测,并以此确定酸沉终点。 方法 实验室模拟人凝血因子Ⅷ酸沉淀过程,对不同酸沉程度下的效价和总蛋白进行测定,同时采集近红外光谱,建立模型。结果 酸沉淀过程中FⅧ比活性达到最高时的pH值并不固定,在6.1-6.5范围内波动,所以将固定的pH值作为酸沉淀的终点并不能达到最佳的效果。结论 建立的人凝血因子Ⅷ酸沉过程中效价和总蛋白模型,固定加酸法不能准确判断酸沉最佳终点,所建立的近红外分析模型为在线实时监控溶解液中的FⅧ比活性提供参考方案。 关键词:近红外光谱分析技术 人凝血因子Ⅷ 酸沉 效价 总蛋白人凝血因子Ⅷ(coagulationfactor Ⅷ,FⅧ)是治疗甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状等的不可或缺的药品,而目前国内生产工艺相对落后,在国内29家血液制品企业中仅有4家有能力生产FⅧ,采用离子交换层析法从人血浆冷沉淀中分离纯化FⅧ的生产工艺,收率低(平均9%)、比活低。因此,针对生产现状,将现代过程分析与控制技术引入到FⅧ生产过程中的关键环节当中,增加对生产工艺过程的了解,有效控制工艺过程,提升FⅧ的收率及比活性。生产人凝血因子Ⅷ以人血浆的冷沉淀为原料,一般用含肝素钠的溶解液溶解,溶解液pH为7.2±0.1。溶解完全后依据不同蛋白质的等电点不同,加0.05M的醋酸溶液进行酸沉淀,使以纤维蛋白原为主的大量杂蛋白沉淀出来,而FⅧ大部分保留在上清液中,从而大大提升溶液的FⅧ比活性。在生产中,酸沉淀终点的控制依据经验以溶液的pH值为参考,当溶液的pH值为6.3±0.1时加酸过程终止,此时上清液中的蛋白含量较低而FⅧ的活性损失较少,因此能够得到FⅧ比活性高的产品。但是单纯以pH值为控制参数的终点控制方法,不一定能够保证不同批次的酸沉淀过程都达到最理想的状态,本试验将对FⅧ的酸沉淀过程进行分析,以检验是否不同批次溶解液的FⅧ比活性在pH=6.3时都达到最高值,并试图找到与比活性直接相关的物料参数——蛋白质含量作为酸沉淀终点的控制标准,使溶解液中FⅧ的比活提升和活性损失达到更均衡的状态。同时,利用近红外光谱分析技术,建立溶解液蛋白含量的PLS定量分析模型,进行蛋白含量的实时监控,从而实现以新参数为指标的酸沉淀终点控制。1 材料1.1 试剂 冷沉淀溶解液(山东泰邦生物制品有限公司),批号分别为201435、201436、201437、201438、201439,每批留样200mL;BCA试剂盒(碧云天生物技术研究所);凝血因子Ⅷ促凝活性检测试剂盒(成都协和生物技术中心);醋酸(国药集团化学试剂有限公司,分析纯);三蒸水。1.2 仪器 Antaris II傅里叶变换近红外光谱仪(美国ThermoFhisher公司);PB-10酸度计(德国sartorius公司);BF300恒流泵(保定齐力恒流泵有限公司);JB-3A型恒温磁力搅拌器(上海雷磁创益仪器仪表有限公司);Legendmicro 17R离心机(美国ThermoFhisher公司);TW12恒温水浴箱(德国Julabo公司);3001-1890酶标仪(美国ThermoFhisher公司)。2 方法2.1 样品的制备2.1.1 配制醋酸溶液 量取醋酸约3.0mL,加入适量蒸馏水中,然后加蒸馏水至1.0L,得到浓度约为0.05M的醋酸溶液,混匀后用0.22 μm膜过滤。2.1.2 酸沉淀过程 参照实际生产过程,在实验室进行小试规模的酸沉淀过程。将超低温冻存的冷沉淀溶解液约100mL放至室温融化,缓慢倒入烧杯中,将烧杯置于低温水浴中,用酸度计监测溶解液的pH值和温度,然后以1mL/min的速度滴加配制好的醋酸溶液,边加边搅拌,使溶液的pH值由7.2左右降低至5.9左右,此过程中溶解液的温度由室温(25℃)均匀降低至15 ℃。重复进行此实验10次,每次实验过程之间保证相同的环境温度、水浴温度、醋酸浓度、加酸速度和搅拌速度。每次酸沉淀过程中pH值每变化0.1取样800μL,取样后立即进行离心(10000 rpm,5min),保留上清液作为样品,进行后面的光谱采集和蛋白含量及FⅧ效价的测定。2.2 近红外光谱的采集 选择AntarisII光谱仪的透射模块进行上清液光谱的采集。选用4 mm光程的比色皿,加样量约为400μL,光谱扫描范围为10000-4000 cm-1,扫描次数为32次,分辨率为8cm-1,以空气为参比进行采集,每隔1小时校正一次背景,测量环境为室温,湿度30%-50%。2.3 FⅧ效价的测定 使用凝血因子Ⅷ促凝活性检验试剂盒对上清液中的FⅧ效价进行检测,试剂盒中包含正常凝血质控血浆、缺凝血因子Ⅷ血浆,APTT试剂b/a、稀释液、CaCl2溶液,现用现配。2.3.1 标准曲线的制作 除氯化钙溶液在37℃水浴预热外,其余样品、试剂均置冰水浴中。 1)将正常凝血质控血浆用稀释液1作1/2、1/5、1/10、1/20、1/40、1/80倍比稀释,其对应FⅧ:C百分活性为500%、200%、100%、50%、25%、12.5%。 2)取某一稀释度正常凝血质控血浆0.1mL、缺凝血因子Ⅷ血浆0.1 mL、APTT试剂0.1mL于透明小试管,混匀后即置37℃水浴温浴10min。 3)迅速加入氯化钙溶液0.1mL,同时启动秒表,在水浴中以1-2次/秒的频率摇动小试管,当观察到凝固出现时,立刻停表记录凝固时间。 4)以不同稀释度正常凝血质控血浆FⅧ:C百分活性为X,对应的凝固时间(秒)为Y,按照统计学方法作直线回归方程,方程形式为Y=blog X+ a,即得标准曲线。2.3.2 样品效价的测定 1)将上清液用稀释液1作1/100倍稀释,即取10µL样品液加稀释液990µL,以此代替标准曲线制作项中某一稀释度正常凝血质控血浆,按照同样方法测定凝固时间。 2)将样品凝固时间(秒)代入标准曲线方程,计算X值,即得样品FⅧ:C百分活性水平。2.4 总蛋白含量的测定样品上清液中总蛋白质的含量测定采用Bicinchoninicacid(BCA)法。BCA法是应用较为广泛的蛋白定量方法之一,其原理是在碱性条件下,蛋白质与Cu2+络合,使之还原成Cu1+,Cu1+可与BCA形成稳定的蓝紫色复合物,复合物在561nm处有强吸收且吸收值与蛋白浓度成正比。BCA法原理与Lowery法相似,但是灵敏度高,操作简单,稳定性好,干扰物质对其影响也较小。2.4.1 配制工作溶液 将BCA试剂盒铜试剂按照体积比50:1混合,得到嫩绿色的标准工作试剂(WorkingReagent,WR),WR在室温条件下十分稳定。2.4.2 配制标准蛋白溶液配制0.5 mg/mL的BSA蛋白溶液,在96孔板中用PBS缓冲液对BSA溶液进行稀释,得到相同体积的BSA标准溶液0、25、50、100、200、300、400、500μg/mL,每个浓度的BSA标准溶液再各加200μL WR。具体稀释方案如表1所示。2.4.3 测定蛋白浓度每个样品取2 μL置于96孔板中,加18μL PBS缓冲液,然后加200 μL WR,在37℃培养箱中放置30min。将反应温度冷却至室温,用酶标仪测定标准蛋白溶液和样品溶液在561 nm处的吸光度值,绘制标准曲线,计算样品的蛋白浓度。表1 标准蛋白溶液和待测样品的加样量和比例 孔数 蛋白浓度(μg/mL) 标准或待测蛋白溶液体积(μL) PBS缓冲液体积(μL) WR体积(μL) 1 0 [ali
[b][font=inherit]项目概况[/font][/b]HPV试剂、生化凝血和血常规试剂采购项目招标项目的潜在投标人应在全国公共资源交易平台(陕西省西安市)网站〖首页〉电子交易平台〉陕西政府采购交易系统〉企业端〗获取招标文件,并于 2022年12月29日 09时30分 (北京时间)前递交投标文件。[b][font=inherit]一、项目基本情况[/font][/b]项目编号:SXZBXA2022-37项目名称:HPV试剂、生化凝血和血常规试剂采购项目采购方式:公开招标预算金额:3,350,000.00元采购需求:合同包1(诊断试剂):合同包预算金额:3,350,000.00元合同包最高限价:3,350,000.00元[table=100%][tr][td]品目号[/td][td]品目名称[/td][td]采购标的[/td][td]数量(单位)[/td][td]技术规格、参数及要求[/td][td]品目预算(元)[/td][td]最高限价(元)[/td][/tr][tr][td]1-1[/td][td]诊断用生物试剂盒[/td][td]HPV试剂、生化检测试剂、凝血和血常规检测试剂[/td][td]1(批)[/td][td]详见采购文件[/td][td]3,350,000.00[/td][td]3,350,000.00[/td][/tr][/table]本合同包不接受联合体投标合同履行期限:具体时间以合同上签订时间为准。
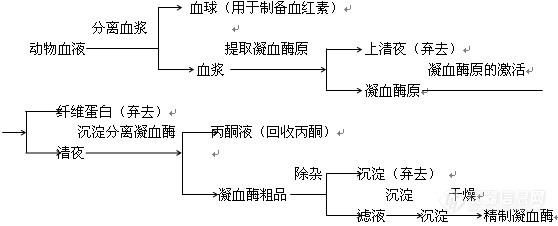
[font=黑体][color=#fe2419]本文为[font=Arial]hchemh[/font][font=宋体]原创作品,本作者是该作品唯一合法使用者,该作品暂不对外授权转载。[/font][/color][font=Arial][/font][size=3][font=宋体]其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现的,均属侵权违法行为。[/font][b][font=Arial][/font][/b]摘 要:[/size][/font][size=3] [font=楷体_GB2312]本实验分别[/font][/size][size=3][font=楷体_GB2312]采用多种方法对人体血液的部分化学成分进行了分析测定。经实验分析鉴定,可知人体血液中凝血酶和血红素的含量。这为以后对于血液成分的进一步研究奠定基础。这个实验是我在学校的时候做的,说到为什么要做这个实验,纯属有现成的样品,却没有可做的实验,于是听毛主席的话:浪费可耻!于是就想着做了这个实验,现在拿出来现眼也是因为抵制不了原创大赛的层层诱惑,可以奖品许愿现在又开始了大乐透,让我就豁出去,分享下自己的实验过程和方法吧!大家板砖轻拍哈!!先说说这次提取的血液中有效成分是什么,由于实验条件的限制,这次我们主要提取两种有效成分,那就是[/font][/size][font=黑体][size=3]凝血酶和血红素!![/size][/font][align=center][b]=================写在前面,背景知识介绍=======================[/b][/align][font=新宋体][b][size=4]凝血酶[/size][/b]是机体凝血系统的天然组分,是由[/font][font=新宋体]前体凝血酶原激活剂激活而转化成具有活性的凝血酶。[/font][color=black][font=宋体]正常血浆中存在无活性的凝血酶原,[/font][/color][color=black][font=宋体]通过对血液提取可以得到凝血酶原,经激活后上清液于沉淀分离即可得到凝血酶。[/font][/color][color=black][font=宋体]凝血酶[/font][/color][font=宋体]是一种糖蛋白,凝血酶[/font][font=宋体]([/font][font=Times New Roman,serif]thrombi,E.C,3.4.21.5[/font][font=宋体])[/font][font=宋体][/font][font=宋体]是由两条肽链之间以二硫键相连接,为蛋白水解酶。形状呈无定形粉末,易溶于水,难溶于乙醇、丙酮、乙醚等有机溶剂,但储存于[/font][font=Times New Roman,serif]2~8[/font][font=宋体]℃很稳定,水溶液室温[/font][font=Times New Roman,serif]8[/font][font=宋体]小时失活。遇热稀酸、碱、金属等活力降低。[/font][font=新宋体] 凝血酶可直接作用于血浆纤维蛋白,加速不溶性纤维蛋白凝块的生成,促进血液凝固。常以干粉或溶液局部应用于伤口或手术处,以控制毛细血管渗血。较多用于骨出血、扁桃体摘除和拔牙等。也可口服,用于胃和十二指肠出血。目前凝血酶的应用范围正日渐扩大,由单纯的局部外敷到外科手术、鼻、喉、口腔、妇产、泌尿急消化道等部位出血的止血,也可以作为多种外用止血药物的重要原料,其止血效果优于“对氨基苯甲酸”、“止血坏酸”、“止血敏”等通过注射后须经血管收缩而起止血作用的药物,故深受广大用户欢迎。据悉,国际新型高效局部止血药物—凝血酶将广泛应用于临床,是目前十分紧俏的凝血酶身价倍增,更趋紧缺。目前我国进口的凝血酶是从牛血中提取的。[/font][font=新宋体]凝血酶是机体凝血系统中的天然成分,国外主要在低温条件下从人或牛血液中提取凝血酶原,在经激活物激活而成凝血酶。其工艺流程为:[img]http://ng1.17img.cn/bbsfiles/images/2010/08/201008251635_238813_1947624_3.jpg[/img][/font][b][size=4][color=black][font=宋体]血红素[/font][/color][/size][/b][color=#333333][font=新宋体][/font][/color][color=black][font=宋体]是含铁卟啉衍生物,是由原卟啉和一个铁离子构成。如下图[img]http://ng1.17img.cn/bbsfiles/images/2010/08/201008251644_238816_1947624_3.jpg[/img][/font][/color][font=新宋体]在食品行业中,血红素可代替熟肉中得发色剂亚硝酸盐及人工合成色素。它可使肉制品产生一种诱人的鲜艳红色,增加其外观美感。更重要的是使用血红素可减少亚硝酸盐的致癌作用。在制药行业中,血红素可作为半合成胆红素原料,而且是制备抗癌的特效药。另外,血红素在临床上作为补铁剂,可治疗因缺铁引起的贫血症(在儿童、妇女中常见)。目前临床上用的非血红素补铁剂,主要从植物性食物中提取,以氢氧化铁络合物形式存在。这种铁络合物在人体中吸收率很低,并含有对人体有害的成分,而血红素补铁剂(即亚铁血红素)可直接被人体吸收,吸收率高达10%~20%。我国民间早有吃血治疗贫血的经验,但原血有异味,易腐败变质,难以作为补铁剂用于临床。从雪中提取血红素,可解决这一问题。血红素补铁剂将取代目前常用的补铁剂,成为深受欢迎的一代产品。[/font][color=black][font=宋体][/font][/color][font=新宋体]血液中的血红蛋白是由4分子亚铁血红素和分子珠蛋白结合而成的。再Ph3时,亚铁血红素与珠蛋白结合最疏松。更据此性质,提取实现从血液中分离出血球液,然后加水将血球液溶解(即溶血),调节Ph至3.0左右,加入适量丙酮,可是蛋白质凝固,亚铁血红素则溶于丙酮液中。此时若加入乙酸钠和鞣酸,即可使血红素沉淀析出。如加入羧甲纤维素(CM-C)阳离子交换剂,血红素可被CM-C吸附,然后过滤,就可以分离出血红素。[/font][b][color=black][font=新宋体][/font][/color][/b][img]http://ng1.17img.cn/bbsfiles/images/2010/08/201008251646_238819_1947624_3.jpg[/img][color=#333333][font=新宋体]用碱处理氯高铁血红素,使之变成羟高铁血红素,将此化合物还原就可得到血红素。它的吸收光谱的主要吸收带在581(α带),545(β带),415(γ带)毫微米.中心的铁原子显有进一步和二个碱基形成配位键的八面体的强烈倾向[/font][/color][b][size=4][font=新宋体][/font][/size][/b][color=#333333][font=新宋体] [/font][/color][color=#333333][font=新宋体]特别是和吡啶、喹啉、烟碱、4-甲基咪唑等三级氨基的二个构成比较稳定的血色原(例如吡啶血色原).这时基于铁原子的3d电子能级结构的永久磁性消失.它的主吸收带为尖峰,在557、525、430毫微米附近.如果把氰酸作为碱基,就生成一个氰酸和二个结合体.还常和蛋白质结合,吸收带多在560、530、430毫微米附近,一般说血红素和血色原自动氧化性强.能和氧发生反应,容易被氧化成三价铁的羟高铁血红素.但一如血红蛋白那样,可与蛋白质(珠蛋白)中的组氨酸结合,被包围在疏水环境里时是比较稳定的,很难发生自动氧化。[/font][/color][font=新宋体][/font][align=center][b]=====================华丽丽的分割,下面介绍我的试验方法=========================[/b][/align][font=楷体_GB2312]1.2[/font][font=楷体_GB2312]实验方法[/font][font=新宋体]1.2.1[/font][font=新宋体]凝血酶的制备 [/font][color=black][font=宋体]取血球研磨后称[/font][/color][color=black]10g[/color][color=black][font=宋体],加入蒸馏水,搅拌[/font][/color][color=black]30min[/color][color=black][font=宋体],使血球溶血,,再加入[/font][/color][color=black]5[/color][color=black][font=宋体]倍体积的氯仿,滤去纤维收集滤液。将上述除去纤维的血球一移入量筒加[/font][/color][color=black]4[/color][color=black][font=宋体]-[/font][/color][color=black]5[/color][color=black][font=宋体]倍体积的丙酮溶液。用[/font][/color][color=black]1mol/L[/color][color=black][font=宋体]盐酸校正[/font][/color][color=black]PH[/color][color=black][font=宋体]至[/font][/color][color=black]2[/color][color=black][font=宋体]-[/font][/color][color=black]3[/color][color=black][font=宋体],搅拌抽提[/font][/color][color=black]10min[/color][color=black][font=宋体],然后过滤收集沉淀。将上述溶液装入蒸馏瓶中,水溶蒸馏回收丙酮([/font][/color][color=black]t [/color][color=black][font=宋体]控在[/font][/color][color=black]60[/color][color=black][font=宋体]℃左右)待滤液浓缩至干时,既有沉淀析出。收集沉淀并称重。此即为血红素粗品。将血红素[/font][/color][color=black]4[/color][color=black][font=宋体]倍量的吡啶、[/font][/color][color=black]7[/color][color=black][font=宋体]倍量的氯仿倒入瓶中,然后加入粗品血红素,充分振荡[/font][/color][color=black]30min[/color][color=black][font=宋体],过滤后收集滤液。滤渣用氯仿洗涤,合并两次滤液。先把适量的冰醋酸加热至沸腾后,加入各占[/font][/color][color=black]1/7[/color][color=black][font=宋体]体积(相对于冰醋酸而言)的饱和氯化钠溶液和盐酸,随后加入滤液,搅匀后过滤,滤渣用氯仿洗涤,合并两次滤液,用旋转蒸馏器蒸馏。收集蒸馏剩物记得到产品。[/font][/color][color=black][font=新宋体][/font][/color][font=新宋体] [/font][font=新宋体]分离血浆、提取凝血酶原:取人血液,按1Kg人血液加3.8g柠檬酸三钠投料,脚板均匀,装入离心管中,以3000r/min的速度离心15min,分出血球(可供制备血红素),收集血浆。(已完成)吸取上清血浆40mL,加蒸馏水到400Ml(360mL),用2%的乙酸调Ph5.3,静置数分钟,出现絮状物后,在离心机上以3000r/min的速度离心15min,弃去上清液,取沉淀物沉重,此即为凝血酶原。[/font][font=新宋体] [/font][font=新宋体]凝血酶原的激活:在30℃条件下,将凝血酶原溶于1~2倍的0.9%氯化钠溶液中,脚板均匀,加入占凝血酶原质量1.5%的氯化钙,搅拌15min。在4℃下静置1.5小时,保证凝血酶原转化为凝血酶。[/font][font=新宋体] [/font][font=新宋体]沉淀分离凝血酶原:将激活的凝血酶溶液用离心机以3000r/min的速度离心15min,弃去沉淀。上清夜于量筒内,加入等量的预冷至4℃的丙酮,搅拌均匀,在冰箱中放置分层。然后用力离心机分离,收集沉淀,上清液可供回收丙酮。沉淀分别用95%乙醇和污水乙醇洗涤,放置在干燥器中干燥,即得凝血酶粗品。[/font][font=新宋体]计算:[/font][i][font=新宋体]凝血酶得率=凝血酶干重g/血清Ml * 100%[/font][/i][font=新宋体]1.2.2[/font][font=新宋体]血红素的制备[/font][font=新宋体]1.2.2.1[/font][font=新宋体]血红素的粗制[/font][font=新宋体] [/font][font=新宋体]分离后溶血:称取50g血球,边研磨边加蒸馏水至100Ml,搅拌30min,使血球溶血,在加入2倍体积的氯仿,滤去纤维,收集滤液。[/font][font=新宋体] [/font][font=新宋体]抽提:用离心机以3000r/min的速度离心10min,弃去沉淀,取上清液,即为红色溶血液,加5倍体积的丙酮溶液,(其中含丙酮体积3%的盐酸)。用1mol/L的演算校正Ph至2~3,搅拌均匀,然后过滤,收集滤液。[/font][font=新宋体] [/font][font=新宋体]蒸馏:将上述溶液于水浴上蒸馏回收丙酮(温度控制在60℃左右),待滤液浓缩至干时,既有沉淀析出。[/font][font=新宋体] [/font][font=新宋体]干燥:把产品干燥后,可得无定性黑绿色粉末状物,装入瓶中保存。 [/font][font=新宋体]1.2.2.2[/font][font=新宋体]血红素的精制[/font][font=新宋体] [/font][font=新宋体]提取:先将血红素4倍量的吡啶、7倍量的氯仿倒入瓶中,然后加入粗品血红素,充分振荡30min,过滤后收集滤液。滤渣用氯仿洗涤,合并两次滤液。[/font][font=新宋体] [/font][font=新宋体]沉淀、静置过夜、洗涤干燥:先把适量冰醋酸加热至沸腾后,加入各1/7体积(相对于冰醋酸来而言)的饱和氯化钠和盐酸,随后加入滤液,搅匀后过滤,滤渣用氯仿洗涤,合并两次滤液,静置过夜,过滤收集滤饼,干燥,即得产品。[/font][font=新宋体][/font][font=新宋体]计算:[/font][font=新宋体] [/font][i][font=新宋体]血红素得率=黑绿色血红素g/血球重g *100%[/font][/i][align=center][font=新宋体][b]=======================结果计算及分析====================[/b][/font][/align][i][font=新宋体]2.[/font][/i][font=新宋体]结果与分析[/font][font=新宋体]2.1[/font][font=新宋体]凝血酶制备:[/font][img]http://ng1.17img.cn/bbsfiles/images/2010/08/201008251651_238820_1947624_3.jpg[/img][font=新宋体]凝血酶原(Ⅱ,prothrombin)是含582氨基酸残基的酶原,被因子Xa在Arg-Thr及Arg-Ile处切开,切除N
问:在ELISA试剂盒实验前我们需要的基本试剂有哪些?答:捕获抗体检测抗体链霉亲和素-HRP标准品96孔酶标板:选择具有中等或高吸附力的酶标板,禁止使用培养板包被溶液:0.1M的PBS或者TBS,PH9.6 0.05M碳酸盐缓冲液阻断溶液:含3%BSA的TTBS或PBS,或者含有3-5%血清的PBS标准品/标本稀释液:含1%BSA的TTBS或PBS洗液:含0.02%吐温20的0.002M咪唑盐溶液或者PH7.4的PBS溶液底物溶液:两组份或者一组份的TMB显色液终止液:2N的硫酸或者1%HCl溶液封板膜问:elisa试剂盒血清标本采集需要注意什么呢?答:1) 要注意避免出现严重溶血。血红蛋白中含有血红素基团,其有类似过氧化物的活性,因此,在以HRP为标记酶的ELISA测定中,如血清标本中血红蛋白浓度较高,则其就很容易在温育过程中吸附于固相,从而与后面加入的HRP底物反应显色。2) 样本的采集及血清分离中要注意尽量避免细菌污染,一则细菌的生长,其所分泌的一些酶可能会对抗原抗体等蛋白产生分解作用;二则一些细菌的内源性酶如大肠杆菌的β-半乳糖苷酶本身会对用相应酶作标记的测定方法产生非特异性干扰。3) 血清标本如是以无菌操作分离,则可以在2~8℃下保存一周,如为有菌操作,则建议冰冻保存。样本的长时间保存,应在-70℃以下。4) 冰冻保存的血清标本须注意避免因停电等造成的反复冻融。标本的反复冻融所产生的机械剪切力将对标本中的蛋白等分子产生破坏作用,从而引起假阴性结果。此外,冻融标本的混匀亦应注意,不要进行剧烈振荡,反复颠倒混匀即可。5) 标本在保存中如出现细菌污染所致的混浊或絮状物时,应离心沉淀后取上清检测。问:测抗体可以用什么方法,有操作步骤么,谢谢。答:捕获法测IgM抗体 血清中针对某些抗原的特异性IgM常和特异性IgG同时存在,后者会干扰IgM抗体的测定。因此测定IgM抗本多用捕获法,先将所有血清IgM(包括异性IgM和非特异性IgM)固定在固相上,在去除IgG后再测定特异性IgM。操作步骤如下: (1)将抗人IgM抗体连接在固相载体上,形成固相抗人IgM。洗涤。 (2)加入稀释的血清标本:保温反应后血清中的IgM抗体被固相抗体捕获。洗涤除去其他免疫球蛋白和血清中的杂质成分。 (3)加入特异性抗原试剂:它只与固相上的特异性IgM结合。洗涤。 (4)加入针对特异性的酶标抗体:使之与结合在固相上的抗原反应结合。洗涤。 (5)加底物显色:如有颜色显示,则表示血清标本中的特异性IgM抗体存在,是为阳性反应。 问:血清的类别有哪些还有要怎么鉴别呢?答:血清的类别:胎牛血清、透析型胎牛血清 、天然低IGG胎牛血清 、干细胞培养胎牛血清 、特殊用途胎牛血清 、活性炭/葡萄糖处理胎牛血清 、胎牛血清替代物 、小牛血清 、新生牛血清 、加强型小牛血清 、补铁小牛血清 、成牛血清 、供体马血清 、兔血清 、鸡血清 、猪血清 、马血清 、其他动物血清 、合成血清替代品鉴别方法:血液凝固析出的淡黄色透明液体。如将血液自血管内抽出,放入试管中,不加抗凝剂,则凝血反应被激活,血液迅速凝固,形成胶冻。凝血块收缩,其周围所析出之淡黄色透明液体即为血清,也可于凝血后经离心取得。在凝血过程中,纤维蛋白原转变成纤维蛋白块,所以血清中无纤维蛋白原,这一点是与血浆最大的区别。而在凝血反应中,血小板释放出许多物质,各凝血因子也都发生了变化。这些成分都留在血清中并继续发生变化,如凝血酶原变成凝血酶,并随血清存放时间逐渐减少以至消失。这些也都是与血浆区别之处。但大量未参加凝血反应的物质则与血浆基本相同。为避免抗凝剂的干扰,血液中许多化学成分的分析,都以血清为样品。
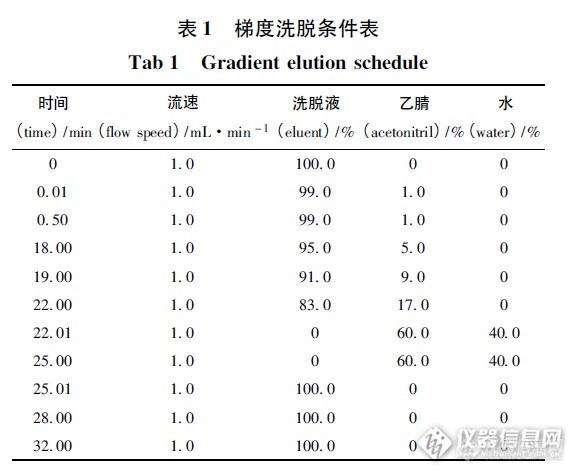
人凝血因子VIII中氨基酸含量测定摘要 目的: 建立用高效液相色谱法测定人凝血因子VIII中氨基酸含量。方法: 采用6 - 氨基喹啉- N - 羟基琥珀酰亚氨基氨基甲酸酯( AQC) 为衍生剂,与氨基酸柱前衍生后,用Agilent 1200 高效液相色谱仪,AccQ·Tag C18柱( waters 150 mm ×3. 9 mm,4 μm) ,以水Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液和乙腈进行梯度洗脱,检测波长为248 nm,柱温37 ℃,进样量10μL。结果: 各氨基酸在32 min 内测定完毕,回收率为98.7% ~ 101.5%。RSD 均小于1. 5%。结论: 本法分离度好,快速、简便,可作为产品的质量控制方法。关键词: 6 - 氨基喹啉- N - 羟基琥珀酰亚氨基氨基甲酸酯; 人凝血因子VIII; 甘氨酸; 衍生物; 梯度洗脱; 高效液相色谱法;氨基酸; 含量测定人凝血因子VIII,本品对缺乏人凝血因子礓所致的凝血机能障碍具有纠正作用,主要用于防治甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状及这类病人的手术出血治疗。该药物制备过程中使用了氨基酸( 精氨酸、丙氨酸、甘氨酸、组氨酸、盐酸赖氨酸、脯氨酸 等) 做稳定剂,为了保证药品质量和用药安全,应对其中氨基酸的含量进行控制。该法依据过量的6 - 氨基喹啉基- N - 羟基琥珀酰亚氨基氨基甲酸酯( AQC) 在一定条件和氨基酸形成稳定的衍生产物( 柱前衍生) ,用高效液相色谱法测定衍生产物,根据衍生产物的含量计算人凝血因子中各氨基酸的含量。1 仪器和试药1200 高效液相色谱系统( 美国Agilent 公司) ,配置低压四元梯度泵、1314B 紫外吸收检测器、自动进样器、柱温箱、Chemistations 化学工作站; Sartorius CP225D 电子微量天平( 德国Sartorius 公司) ; SartoriusPB - 21 型pH 计( 德国Sartorius 公司) ; LDZ5 -2 低速自动平衡离心机( 上海医用离心机厂) 等。各标准品均来自于中国食品药品检定研究院2 色谱条件及系统适用性试验色谱柱: Waters AccQ·Tag C18色谱柱( 3. 9 mm ×150 mm) ; 流动相: 水为溶剂D,Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液( A) - 乙腈( B) - 水( D) ,柱温:37 ℃; 检测波长: 248 nm。精密量取对照品溶液与供试品溶液10 μL,分别注入液相色谱仪,记录色谱图32 min。梯度洗脱条件表见表1。http://ng1.17img.cn/bbsfiles/images/2015/08/201508311802_563771_1637386_3.png
《发育细胞》(Developmental Cell)是Cell出版社旗下著名期刊之一,近期来自中科院上海生命科学研究院,以及清华大学的两组研究人员同期发表文章,获得了造血与血管发育调控机制,以及斑马鱼胚胎腹部组织发育机制的两项研究新成果。在第一篇文章“Protein Phosphatase 4 Cooperates with Smads to Promote BMP Signaling in Dorsoventral Patterning of Zebrafish Embryos”中,研究人员指出一种蛋白磷酸酶:Ppp4c是BMP信号的一个重要的正向调节因子,促进斑马鱼胚胎早期的腹部组织发育。这揭示了斑马鱼胚胎腹部组织发育的一种新机制。在脊椎动物的胚胎发育中,BMP信号对于腹部组织的形成、表皮外胚层的诱导发挥关键作用,其异常可导致胚胎夭折或出现严重的缺陷。BMP信号分子在细胞膜上与受体结合后激活胞质中的Smad1/5/8蛋白,这些Smads蛋白进入细胞核、结合在靶基因的调控元件上,与其他转录因子共同调节靶基因的表达。例如,Smad1/5/8可以与染色质的修饰蛋白—组蛋白乙转移酶(HATs)以及组蛋白去乙酰化酶(HDACs)共同作用,调节下游靶基因的表达。Ppp4c是蛋白磷酸酶4(Protein phosphatase 4,Ppp4)的催化亚基,是高等真核生物中广泛存在的一种丝氨酸/苏氨酸磷酸酶。Ppp4的催化亚基Ppp4c可以与调节亚基R1或R2相互作用形成二聚体,并同时与其它的调节亚基选择性结合,作为一个复合体共同发挥作用。Ppp4c从非脊椎动物到脊椎动物都极度保守,它可以通过磷酸酶活性将其特异底物去磷酸化,进而在绵羊血清许多信号通路中发挥作用。Ppp4C是否参与BMP信号的转导,以前并不清楚。在这篇文章中,研究人员发现在斑马鱼胚胎中抑制ppp4c基因的表达,胚胎腹部组织发育受到抑制,而背部组织扩增,因而其在胚胎背腹图式形成中是必不可少的。在分子机制上,Ppp4c与Smad1/5直接互作,被招募至BMP靶基因的增强子区域,与Smad1/5一起增强靶基因的转录。尽管Ppp4c是去磷酸酶,但它并不改变Smad1/5的磷酸化状态;当Ppp4c被Smad1/5带到靶基因启动子上后,它使启动子上结合的Hdac3去磷酸化,从而解除Hdac3对染色质的转录抑制作用。除此之外,胚胎中的互作实验室表明,下调Ppp4c的表达可以抑制过表达外源BMP信号所引起的腹部化效果,而下调Ppp4c的表达所导致的胚胎背部化效果也可以通过下调Hdac3的表达得以部分挽救。因此,Ppp4c是BMP信号的胎牛血清一个重要的正向调节因子,促进斑马鱼胚胎早期的腹部组织发育。这项研究指出了蛋白磷酸酶Ppp4c促进BMP信号的转导,参与调控斑马鱼胚胎的背腹细胞命运分化,对于斑马鱼胚胎发育,以及信号通路调控研究具有重要意义。另外一篇文章:Thrombin Receptor Regulates Hematopoiesis and Endothelial-to-Hematopoietic Transition,则指出了凝血酶受体F2r在脊椎动物造血发育过程中的重要作用,并证明了F2r-RhoA/ROCK 途径在其中的基础性功能,也提出了一种重要的造血与血管发育调控机制。 Labconco生物安全柜春季促销 买即送安全柜支架一套!造血发育,以及血管的发育与脊椎动物胚胎发育生理过程密切相关,虽然人类对脊椎动物造血系统以及心血管系统的研究已有几百年的历史,但是它们的发育机制尚未完全阐明。脊椎动物进化过程中造血过程与心血管的发生是高度保守的。近期研究人员发现内皮血液转化(endothelial-to-hematopoietic transition )过程对于造血干细胞和祖细胞诱导形成具有关键性的细胞培养作用,但是其中的机理还并未阐述清楚。在这篇文章中,研究人员发现凝血酶受体(F2r)——一种蛋白酶激活G蛋白偶联受体,是血管发育的必需成分,这种受体能作为造血发育过程中的负调控因子起作用。而且研究人员还发现在小鼠胚胎干细胞(mESCs)造血分化过程,以及斑马鱼造血发育过程中,F2r具有重要的正调控作用。抑制F2r的活性或表达能够显著促进小鼠胚胎干细胞向血液分化和斑马鱼定向造血,而过表达F2r则会导致相反的效应。进一步机理研究还确认RhoA/ROCK通路作为F2r的下游信号分子介导了F2r对EHT及造血干细胞产生的负调控作用,从而阐明了F2r-RhoA/ROCK通路在脊椎动物造血发生和EHT中的重要功能,同时证实了F2r信号通路在协调血液发育和血管发育中的作用。此项研究还有可能为提高体外血液分化效率和治疗相关的血液疾病提供新的思路。
【序号】:1【作者】: 于佳鑫【题名】:壳聚糖止血粉促凝血作用的实验研究【期刊】:影像研究与医学应用. 【年、卷、期、起止页码】:2018,2(05)【全文链接】:https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFDLAST2018&filename=YXYY201805159&uniplatform=NZKPT&v=PHm7p9Rc2CgPScGXeXyvUFix-WBMA12jeytsIyDnJZXLw-WSRFCaK9jDGAkjOwc9
用体外方法对机体各种具有免疫反应的细胞分别作鉴定、计数和功能测定,是观察机体免疫状态的一种重要手段。为此,须将各种参与免疫反应的细胞从血液或脏器中分离出来。参与免疫反应的细胞主要包括淋巴细胞、巨噬细胞、中性粒细胞等。由于检测的目的和方法有同,分离细胞的需求和技术也异。有的仅需分离白细胞,有的则需分离单个核细胞(mononuclearcell),其中含淋巴细胞和单核细胞(monocyte),有的则需分离T细胞和B细胞以及其亚群。分离细胞选用的方法应力求简便可行,并能获得高纯度、高获得率、高活力的细胞。现用分离细胞群的原则,一是根据各类细胞的大小、沉降率、粘附和吞噬能力加以组分,另一则按照各类细胞的表面标志,包括细胞表面的抗原和受体加以选择性分离。 一、白细胞的分离 (一)血液中红细胞与白细胞比例约600~1000:1,两者的比重不同其沉降速度亦异,通常用两种方法加以分离。 本法是利用血细胞自然沉降率的分离法,采集血液后应及时抗凝,通常选用肝素抗凝法。肝素能阻止凝血酶原转化为凝血酶,从而抑制纤维蛋白原形成纤维蛋白而防止血液凝固。操作原则是将含抗凝血的试管直立静置室温30~60min后,血液分成明显三层,上层为淡黄色血浆,底层为红细胞,紧贴红细胞层上面的灰白层为白细胞,轻轻吸取即得富含白细胞的细胞群,离心洗涤后加入少量蒸馏水或含氯化铵的Gey溶液,经短时间的低渗处理,使红细胞裂解,经过反复洗涤可得纯度较高的白细胞悬液。 (二)聚合物加速沉淀法 本法是利用高分子量的聚合物如明胶、右旋糖酐、聚乙烯吡喀烷酮(polyvinylpyrolidone,PVP)等使红细胞凝集成串,加速红细胞沉降,使之与白细胞分离。本法的细胞获得率比自然沉降法高。
科技日报 2013年10月18日 星期五 科技日报讯 据物理学家组织网10月16日报道,一个人若久坐飞机、手术恢复过程中长时间卧病在床,会形成危及生命的血凝块。由于没有快速而简便的诊断方法,往往会导致中风或心脏疾病。为了改变这种状况,美国麻省理工学院一个工程师团队基于纳米技术开发出一种简单的尿检试纸,可快速检测出血液中的凝块。 血液凝固是由一系列复杂的级联蛋白质相互作用,以形成一种能密封伤口的纤维蛋白质。这个过程中的最后一步纤维蛋白原转化为纤维蛋白,由一种叫做凝血酶的酶控制。该研究被最新一期的美国化学会《ACS纳米》杂志描述为一种非侵入式诊断,其依靠纳米粒子检测一个关键凝血因子即凝血酶的存在。既有的血液测试以纤维蛋白副产物为标记物,不能连贯地检测到新凝块的形成,而新方法以凝血酶为标记物,可用一种可注射的纳米粒子快速识别。 实验使用了已获美国食品和药物管理局批准的氧化铁纳米粒子、涂有专门与凝血酶肽(短蛋白质)相互作用的多肽。纳米粒子被注入老鼠体内后,会经过整个鼠体。当粒子遇到凝血酶,凝血酶在特定的位置上裂解肽类,释放的片段最终顺着动物的尿液排泄。 在处理收集的尿液样本时,他们采用含有特定多肽标记物抗体的碎片识别这些蛋白质片段,发现尿液中这些标记物的数量与凝固在小鼠肺中的血液凝块水平成正比。去年发布的系统版本,是利用质谱仪对片段质量分析来进行区分;而最新版本用抗体测试样本,更为简单且便宜。 这种尿样测试有两种应用前景:一是在急诊室用来筛查可能有血块症状的患者,允许医生迅速分诊并确定其是否需要更多的测试。另一应用是监测具有高危血栓的患者,例如手术后不得不卧床康复的病人。这种尿液试纸测试如同怀孕测试,医生可在病人术后回家时开给他们。此外,这项技术也可以用于预测血栓的复发。 麻省理工学院德什潘德技术创新中心将出资实现这项技术商业化。(华凌)
[img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221754166749_5746_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221754272172_4339_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221754375930_7082_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221754478170_9409_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221754579270_6088_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221755077660_5040_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221755154062_8177_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221755231932_519_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221755316494_3561_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221755387771_4933_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221755454692_9457_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221755534545_1492_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221756015254_5487_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221756105492_8859_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221756194351_7987_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221756271199_1141_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221756346232_4807_3389662_3.jpeg!w690x975.jpg[/img][img=,690,975]https://ng1.17img.cn/bbsfiles/images/2019/07/201907221756407302_4758_3389662_3.jpeg!w690x975.jpg[/img][align=center][b][/b][/align]
建立了使用石墨炉原子吸收分光光度法检测人凝血因子VIII中铝含量的分析方法,探讨了以非离子表面活性剂Triton X-100,基体改进剂,干燥温度和气体流量对实验结果的影响.在最佳工作条件下,铝的检测限为0.8μg/l;样品测得的相对标准偏差(n=6)为5.6%,加标回收率94.5%~103.5 %。方法适合人凝血因子VIII中铝离子残留量的分析测定。关键词:铝;石墨炉原子吸收分光光度法;人凝血因子VIII,残留量 铝是一种人体非必需的微量元素, 如果摄入过多, 将会严重影响人体的神经系统, 不仅使老年人易患痴呆病,还会引发慢性肾功能损害等病症, 故世界卫生组织及欧洲药典等均将铝含量的测定作为成品检定项目之一。 人凝血因子VIII辅料中加入Al2O3作为吸附剂,因此其在制剂中需对其残留量进行检测。由于其制剂成分复杂、有机物干扰严重、某些样品中的铝含量极低, 有些分析方法检出限达不到要求。石墨炉原子吸收光谱法是铝残留量分析中常用的方法之一。 本文采用非离子表面活性剂Triton X-100,基体改进剂硝酸镁 ,建立了石墨炉原子吸收分光光度法检测人凝血因子VIII中铝离子残留量的分析方法。1 实验部分1 .1 仪器与试剂ICE 3400GF 型原子吸收光谱仪(美国Thermo公司):ID100 自动稀释器,Chill I冷却水系统,GFS35Z石墨炉,自参比单光束塞曼系统, GFS 石墨炉自动进样器, 涂层石墨管(Extended Lifetime Cuvettes);铝空心阴极灯;ELGA Q15 纯水机。HNO3为MOS级;100μg/mL铝元素标准溶液(GSB 04-1713-2004) , 标准工作溶液均由以上溶液经超纯水逐级稀释而成的;稀释液:1%(v/v)硝酸+0.01%(v/v)Triton X-100(化学纯试剂);2.5g/L Mg(NO3)2 基体改进剂:称取0.25g分析纯Mg(NO3)2到PPE塑料烧杯中, 用超纯水溶解定容至100mL PPE塑料容量瓶中。实验所用水为电阻率为18.2 MΩ·cm 的超纯水。1 .2 样品预处理1.2.1 供试品溶液 精密量取供试品溶液0.2ml,加稀释液2.3ml。1.2.2 混合溶液 精密量取供试品溶液0.2ml,加入100μg/L标准铝溶液0.50ml,再加稀释液1.8ml。1 .3 实验方法准确移取稀释液、供试品溶液、混合溶液倒入自动进样器的样品杯中, 再通过自动进样器进样后由石墨炉原子吸收光谱仪进行铝含量的测定。1 .4 仪器工作条件石墨炉原子吸收光谱仪测定铝时的工作参数设置和石墨炉升温程序见表1 和表2 。表1 石墨炉原子吸收光谱仪的操作参数Tab.1 Operating parameters for GFAAS电流 I/mA测定波长 λ/nm缝隙宽度 l/nm测定模式进样量 V/µL基体改进剂8309.30.5峰高102.5g/L Mg(NO3)2 表2 石墨炉升温程序Tab.2 Graphite furnace heating program步骤程序温度 ℃时间 s斜坡 ℃/s气体类型气体流量 l/min1干燥8010.00氩气0.22干燥1105.03氩气0.13干燥2205.01氩气0.24灰化150010.00氩气0.15原子化26005.00氩气06清除26505.00氩气0.3 1 .5 工作曲线的制作将0
PRP(Platelet-Rich Plasma,富血小板血浆),人血浆中提取的富血小板血浆中含有多种生长因子,当PRP与氯化钙以及凝血酶混合后,各种生长因子即从血小板中的α颗粒中释放出来。富血小板血浆的制作和临床效果因需加入抗凝剂、氯化钙、凝血酶等化学物质以及离心效果差而备受争议。PRF(Platelet-RichFibrin,富血小板纤维蛋白),制备过程一次离心,无需添加任何其它物质。将PRF覆盖于切口、创面表面以促进局部止血、愈合、抗感染等。优点:富血小板纤维蛋白(PRF)是富纤维蛋白凝胶,由患者静脉中抽取的新鲜血液制作而成,属于新一代的血小板浓缩物,它制备简单无需任何生物添加剂的处理。在PRF通过离心分离的制备过程中,血小板被激活同时大量脱颗粒细胞中蕴含的重要的生长因子释放出来。[align=center][img=prp-prf-cfg,700,323]http://www.hexiyiqi.com/d/file/hexi2012xingyedongtai/2019-12-13/0e0f3910ef586e168322066d7034cbf5.jpg[/img][/align]缺点:富血小板纤维蛋白没有规范的制作标准且转速单一,不能充分激活血小板和纤维蛋白原,并且不能分离出CD34阳性细胞对骨组织无再生能力。CGF(Concentrate Growth Factors,高度浓缩生长因子的血纤维蛋白),是利用特制的[url=http://www.hexiyiqi.com/hexi2012chanpinzhongxin/xingyezhuanyonglixinji/2019-05-30/453.html]变速离心机[/url],依靠物理性加速度和减速度充分激活血小板中的α颗粒,产生富含更高浓度生长因子和CD34+细胞的自体血液浓缩制品,表现出更佳的骨组织、软组织及皮肤的再生能力。根据所使用试管不同,可制成液态、凝胶态等多种性状。PRP、 PRF及CGF都是通过离心原理获得,只不过CGF的获得要求更高,更精细化。至于PRP好还是CGF说哪种好?理论上来说,升级后的CGF的稳定性、适应性、效果更强。临床文献证明CGF能应用于口腔、颅颌面外科手术、上颌窦提升及牙槽嵴扩张手术中。而且,CGF不但能单独使用,还能与其它生物材料一起联合应用于不同的组织再生临床治疗中:整形外科、颅颌面外科、口腔外科、眼科、美容外科、运动医疗、皮肤病科、妇科、神经外科。在牙科种植领域,人们对于促进伤口愈合的产品的兴趣正不断增加。各式各样的步骤与方法不断被研发出来,增强愈合的元素及增进身体自我愈合能力。CGF是一种修补生物材料,其中含有浓缩生长因子纤维蛋白,具有改善并增强组织再生的独特性质,是再生医疗领域中组织刺激的新技术。[align=center][img=cgf,580,882]http://www.hexiyiqi.com/d/file/hexi2012xingyedongtai/2019-12-13/ab15df0be7ca673623a5d31e17c0b502.jpg[/img][/align][url=http://www.hexiyiqi.com/hexi2012xingyedongtai/2019-12-12/831.html]浓缩生长因子(CGF)[/url],与PRF一样,CGF由静脉血分离制备而成。不过,两项技术的离心速度有所不同。与PRF不同,CGF技术采用的速度从2400到2800rpm不等,这是为了分离静脉血中的细胞,因此CGF中富含纤维蛋白凝块比PRF中的大得多,而且更粘稠,纤维蛋白的含量也更多。使用富含纤维蛋白凝块时,将显示更强的再生力和更好的多样性。[align=center] [url=http://www.hexiyiqi.com/hexi2012chanpinzhongxin/xingyezhuanyonglixinji/2019-05-30/453.html][b][img=口腔种植CGF变速离心机TD4]http://www.hexiyiqi.com/d/file/hexi2012chanpinzhongxin/luodishigaosulengdonglixinji/2019-05-14/560163e9179fb04586c10ec1cd621c4e.jpg[/img][/b][/url][/align][align=center][b]口腔种植CGF变速离心机TD4[/b][/align]CGF比PRF具有更高的抗张强度、更多的生长因子、更好的粘性和更高的粘合强度。因此,外科医生可以将CGF作为隔膜来加速软组织愈合或与骨移植物混合,以加快新骨重建。CGF无需添加任何化学或过敏性添加剂(例如凝血酶或抗凝剂),因此不会引起病毒性传染病。
近日,中科院广州生物医药与健康研究院曾令文研究组模拟电子逻辑门运算机理,利用ATP和凝血酶为两种输入信号,依赖核酸适体作为分子识别元件,试纸条检测卡是否出T线为输出信号(有T线说明是阳性结果,有输出信号;没有T线说明是阴性结果,没有输出信号),成功构建了基于核酸适体-靶分子自组装生物分子逻辑门,用于小分子和蛋白的智能化快速检测。 组装的分子逻辑门可用于现场ATP或凝血酶的快速智能化分析,该装置具有很好的选择性,可便携式使用。相关成果于发表在Anal. Chem.(2012, 84 (15), pp 6321–6325)上。 该项目得到国家重大专项(2008ZX10004-004)、(2009ZX1004-109)的经费资助。http://www.cas.cn/ky/kyjz/201208/W020120830356589673798.jpg基于核酸适体-靶分子自组装生物分子逻辑门
[size=14px] [/size] [size=14px] [/size] [size=14px]非酒精性脂肪性肝病(NAFLD)的特征是肝脂肪变性和胰岛素抵抗,目前尚无批准的针对NAFLD的有效药物疗法。荷叶碱(Nuciferine)是一种含有生物碱的芳香环,是从荷叶中提取的主要活性成分,已被证明对代谢综合征具有广泛的药理活性,包括抗氧化剂,抗肥胖和抗炎作用。尽管现代药理学认为,荷叶碱能够改善肥胖及其相关的代谢紊乱性疾病,但荷叶碱改善NAFLD的作用靶点及发挥作用的分子机制并不清楚。[/size][size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px]1、荷叶碱缓解HFD小鼠肝脏脂质积累、胰岛素抵抗、氧化应激和炎症反应[/size] [size=14px] [/size] [size=14px]作者首先开展体内实验,荷叶碱处理显著减少HFD喂养的小鼠体重,增加肝脏重量和肝脏重量,减轻肝脂肪变性,降低空腹血中甘油三酯、葡萄糖和胰岛素的浓度,改善葡萄糖耐量和胰岛素敏感性,缓解肝脏氧化应激和炎症反应。这些数据表明荷叶碱可缓解HFD小鼠的肝脏中的脂质积累,胰岛素抵抗,氧化应激和炎症。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px]2、荷叶碱激活NAFLD小鼠的肝自噬-溶酶体通路[/size] [size=14px] [/size] [size=14px]作者通过转录组学分析确定荷叶碱对NAFLD的影响,发现受荷叶碱处理影响的基因富集在自噬、溶酶体和脂质代谢,并通过qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]得到验证,数据表明自噬-溶酶体通路(ALP)参与了荷叶碱治疗对NAFLD的有益作用。TFEB通过上调相关基因来控制自噬体和溶酶体生物发生,作者发现荷叶碱增强HFD小鼠中细胞核与胞质TFEB的比率,增加了TFEB的蛋白质丰度。此外,通过使用溶酶体蛋白酶抑制剂,作者发现荷叶碱增加了HFD小鼠中P62的降解和LC3-II的形成,表明荷叶碱增加了肝自噬通量。除自噬外,荷叶碱处理还增强了溶酶体功能,如溶酶体膜标志物LAMP1和CTSD丰度升高,以及溶酶体蛋白酶活性增加。这些数据表明,荷叶碱激活HFD小鼠肝脏中的TFEB和自噬-溶酶体通路。[/size] [size=14px] [/size] [size=14px]3、荷叶碱通过TFEB激活自噬-溶酶体通路[/size] [size=14px] [/size] [size=14px]作者进一步证实荷叶碱对TFEB和自噬-溶酶体通路活化的作用,发现荷叶碱增加TFEB的核定位,增强溶酶体功能。用荷叶碱和自噬通量抑制剂CQ处理的细胞检测P62和LC3-II丰度表明荷叶碱诱导自噬体形成和溶酶体降解。这些体外和体内结果进一步强调了荷叶碱对TFEB和自噬-溶酶体通路的激活作用。接着作者发现敲除TFEB消除了荷叶碱诱导的 P62降解、LC3-II 形成。此外,在饲喂HFD的肝细胞特异性TFEB敲除小鼠中,荷叶碱不显著影响肝自噬活性,也不影响溶酶体功能。这些结果表明荷叶碱对ALP的激活作用是由TFEB介导的。[/size] [size=14px] [/size] [size=14px]4、敲除肝脏TFEB阻断荷叶碱对NAFLD的有益作用[/size] [size=14px] [/size] [size=14px]作者进一步在体外敲低TFEB,发现抑制了荷叶碱对HepG2细胞中脂质积累、胰岛素抵抗、氧化应激和炎症反应的改善作用。此外,在肝细胞特异性TFEB敲除小鼠中,荷叶碱未能各种有益功效。这些数据表明,TFEB依赖性诱导自噬-溶酶体通路是荷叶碱介导的对NAFLD的有益作用的主要原因。[/size] [size=14px] [/size] [size=14px]5、荷叶碱以mTORC1依赖性方式触发TFEB核易位[/size] [size=14px] [/size] [size=14px]已有研究报道转录因子TFEB是自噬溶酶体通路的主要调节因子,被溶酶体表面的mTORC1磷酸化,使其保留在细胞质中并抑制其转录活性。Rags(RagC/RagD和RagA/RagB)和Ragulator(P18、P14、MP1、C7orf59、HBXIP组成)处于mTORC1上游可直接激活mTORC1并将mTORC1锚定在溶酶体。作者发现通过coIP实验发现荷叶碱抑制Rags和Ragulator相互作用,且抑制P14与P18、MP1、C7orf59、HBXIP之间的相互作用,表明荷叶碱通过损害Ragulator与Rags的相互作用来促进TFEB核定位,从而抑制其被mTORC1磷酸化。[/size] [size=14px] [/size] [size=14px]6、荷叶碱与HBXIP互作破坏Rag-Ragulator相互作用并抑制mTORC1活性[/size] [size=14px] [/size] [size=14px]据报道,TFEB的mTORC1依赖性磷酸化对Rags高度敏感。作者发现荷叶碱抑制Rags介导的mTORC1复合物溶酶体募集,抑制RagC与mTOR和TFEB的互作,并减少TFEB与RagA和RagC的互作,降低RagC的溶酶体定位,并减少了RagA,RagC,mTOR和TFEB的溶酶体定位。因此,荷叶碱通过减少Rags的溶酶体定位来抑制mTORC1活性。据报道,通过Ragulator复合物对Rags进行溶酶体锚定对于介导mTORC1溶酶体募集并因此激活是必要的。作者发现荷叶碱削弱了Rags和Ragulator之间的互作,以及RagC和P18之间的互作,以及P14与RagA和RagC之间的互作。此外,荷叶碱还降低了P14与P18、MP1、C7orf59和HBXIP的相互作用,表明荷叶碱也破坏了Ragulator复合物组分之间的互作。[/size] [size=14px] [/size] [size=14px]接着作者检测荷叶碱是否与Ragulator复合物直接结合,从而改变复合物的正确组装和功能。研究人员通过CETSA证明荷叶碱与HBXIP直接结合,而非P14、P18、MP1 和 C7orf59,并通过分子对接发现荷叶碱与HBXIP的潜在结合口袋结合。这些数据表明,荷叶碱通过与HBXIP亚基相互作用,阻碍RagGTPases-Ragulator溶酶体支架的形成,抑制mTORC1活性。[/size] [size=14px] [/size] [size=14px]总结[/size] [size=14px] [/size] [size=14px]研究发现荷叶碱以TFEB依赖性方式激活自噬-溶酶体通路(ALP)并减轻脂肪变性。机理研究表明,荷叶碱与Ragulator的HBXIP亚基互作,并损害 Ragulator复合物与Rag GTP酶的相互作用,从而抑制mTORC1的溶酶体定位和活性,从而激活TFEB介导的自噬-溶酶体通路,并进一步改善肝脂肪变性和胰岛素抵抗。因此,荷叶碱是治疗NAFLD的候选药物,且调节mTORC1-TFEB-ALP轴是预防和治疗NAFLD病理结果的潜在有效策略。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size]
西红柿颜色鲜艳、味道可口、食法多样,是人们餐桌上常见的平民化蔬菜。不仅味道酸甜可口,而且还含有不少对人体有益的元素,常吃西红柿,可达到祛斑、美白、降血压、防癌等多重养生功效。然而,吃西红柿的好吃虽然有不少,但食用上还是要多加注意,否则很容易出事的哦。 服用抗凝血药物时不能吃 维生素K主要作用是催化肝中凝血酶原以及凝血活素的合成,维生素K不足时,由于限制了凝血酶原的合成而使凝血时间延长,造成皮下和肌肉出血。而西红柿则刚好含有较丰富的维生素K,因此服用肝素、双香豆素等抗凝血药物时不宜食用。 不要空腹食用 西红柿含有大量可溶性收敛剂等成分,与胃酸发生反应,凝结成不溶解的块状物,这些硬块可能将胃的出口幽门堵塞,引起胃肠胀满、疼痛等不适症状。 吃成熟的西红柿 尚未成熟的青西红柿含有生物碱甙(龙葵碱)其形状为针状结晶体,进食以后轻则口腔感到苦涩,严重的时候还会出现中毒现象。所以生的西红柿最好就不要吃了。 不宜长久加热烹制后食用 长久加热烹制后就失去了原有的营养与味道,因番茄红素遇光、热和氧气容易分解,失去保健作用。因此,烹调时应避免长时间高温加热。
原理:在确定量的血浆样本经过一定时间的加温后,加入试剂。加入试剂后,采用波长为660nm的光照射样本。凝血过程(纤维蛋白原转化为纤维蛋白)中血的浑浊度可以通过测量散射光光强度的改变来测定。从散射光光强度的测定,可以做出凝血曲线,通过PercentageDetection Method方法求得凝血时间。一、仪器:(一)型号:Sysmex CA—1500自动血液凝血分析仪(二)分析和计算参数:1.处理量:约120个测试/小时2.所需样本量:10μl 3.检验时间:在最长检验时间之内测出结果,典型最长检验时间:100秒4.重复性:CV≤4%5. 计算参数:纤维蛋白原浓度(Fbg)二、试剂及配套品:(一)试剂:1. 凝血酶试剂(Thrombin Reagent)(1)商标:德灵(DADE BEHRING)(2)包装规格:Pack for 10×1ml(3)代码:B4233 G25 E0533 (961) W(4)成分:牛凝血酶冻干粉(lyophilized preparation of bovine thrombin)(近似100 NIH units/ml)
NaZura生物健康近日宣布的一项临床研究结果表明在肠道中味觉受体的激活能够增强饱腹感和葡萄糖调节荷尔蒙释放。在本周举办的肥胖协会年度会议上,该研究首席研究员Steven R. Smith博士口头汇报了NaZura所拥有的肠道感觉调节(GSM)技术能够用于增强肌体自然的食物驱动信号。通过提供一般公认安全的膳食成分配方和FDA批准的食品添加剂给肠道,以激活内分泌细胞化学感应的甜、鲜和苦受体。这些细胞释放了大量的多肽YY(PYY)和胰高血糖素样肽-1(GLP-1)。其中多肽YY可以传递饱腹感信号给大脑。而GLP-1则在调节血糖中具有重要的作用。非营养性激动剂的味觉受体的激活可刺激肠内分泌细胞消耗更多的热量。在多种饮食条件下,相比安慰剂组,甜、鲜、苦味觉受体激动剂的激活可以增加肌体食物驱动产生2倍的PYY和GLP-1。NaZura生物健康公司首席执行官Alain D. Baron博士说:“在本周的肥胖协会年度会议上我们了解到,对于安全减肥领域依旧存在着巨大的待满足的需求。而NaZura生物健康开辟了一个新的方式,即将活性化合物传递给内分泌细胞,从而达到改善体重血糖控制的目标。”基于GSM技术发现的数据,NaZura计划招募240名超重和中度肥胖受试者,以开展一项随机、安慰剂控制的双盲减肥试验。
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法 2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]

上传两张元素灯正向供电状态和反向激活状态的照片1、正向供电状态http://ng1.17img.cn/bbsfiles/images/2013/03/201303071215_428972_1618323_3.jpg2、反向激活状态http://ng1.17img.cn/bbsfiles/images/2013/03/201303071216_428973_1618323_3.jpg和大家分享一下!
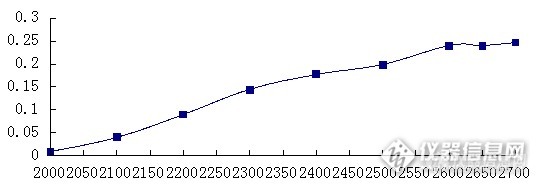
摘要:目的 建立一种快速测定人凝血因子Ⅷ冷冻干燥过程中水分含量的方法。 方法 首先采用卡尔费休容量滴定法测定不同冻干程度的人凝血因子Ⅷ的水分含量,做为一级数据,并同时采集样品的近红外光谱;采用K-S方法对样品集进行划分,学生化残差-杠杆值去除异常样品,考察不同的光谱预处理方法,利用iPLS和GA对建模波段进行选择,以R2、RMSEC、RMSECV、RMSEP值为模型评价指标。 结果 所建立模型的主要参数为R2=0.918,RMSEC=0.2141,RMSECV =0.4102,RMSEP=0.3848,线性较好,光谱与样品的水分含量有较好的相关性。结论 建立的FⅧ成品的水分含量模型满足生产需求,是一种快速无损的检测方法,同时减少了FⅧ样品和卡尔费休试剂等的损耗,是一种十分经济有效的方法。关键词:近红外光谱分析技术 人凝血因子Ⅷ 水分 冻干血液制品在医疗急救和某些特定遗传疾病治疗上具有其他药品无法替代的作用,但我国当前整个血液制品行业长期处于供不应求的状态,因此提高血浆综合利用率、增加各产品的收率是解决现状的一个必要举措。其中人凝血因子Ⅷ(coagulation factor Ⅷ, FⅧ)是治疗甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状等不可或缺的药品,而目前国内生产工艺相对落后,少数企业有能力生产FⅧ。水分是确保产品质量的一个重要参数,它的含量和存在形式对FⅧ的结构和功能影响很大,直接关系到FⅧ产品的稳定性。在生产中,通过冷冻干燥使FⅧ制剂的水分含量在3.0%以下。但是冻干过程无法取样,只能依据经验,通过观察冻干曲线对冻干条件和冻干时间进行控制,无法直接对产品水分含量进行判定;而产品的水分含量测定采用常规的卡氏水分测定方法,具有破坏性切费时费力,而且测定结果无法代表整批产品的特性。近红外光谱分析技术(Near InfraredSpectroscopy,NIRS)是当前最重要的一种PAT技术,它是指应用波长范围在780-2526nm波长范围内的电磁波的一种光谱学方法,在制药、医学诊断、食品和农产品的质量控制,天文学以及治疗医学等领域都有应用。本实验室采用近红外光谱分析技术,对产品进行快速、无损隔瓶测定,并可以实现多点测控,测定冻干产品中的水分含量,以判断干燥终点。1 材料1.1 试剂人凝血因子Ⅷ(冻干剂,200IU/瓶,山东泰邦生物制品有限公司);甲醇(分析纯,国药集团化学试剂有限公司);卡尔·费休试剂(KFR-06型,天津市科密欧化学试剂有限公司);注射用水。1.2 仪器Antaris Ⅱ傅里叶变换近红外光谱仪(美国Thermo Fisher scientific公司),附件配置:积分球漫反射检测器;KF-4型自动水分测定仪(南京科环分析仪器有限公司);Alpha 1-2 LD实验室型冻干机(德国Christ公司);VD-53真空干燥箱(德国Binder公司);EL204电子天平(METTLER TOLEDO公司)。2 方法2.1 样品的制备取若干瓶FⅧ冻干剂,每瓶加10mL注射用水溶解完全,置于-80℃超低温冰箱预冻2h以上。开启冻干机,使冷阱降温至-55℃,并将真空泵预热。取出预冻完全的FⅧ,放置在干燥室内的搁板上,抽真空开始升华干燥,干燥过程中搁板温度约为-20℃,真空度为10Pa。升华干燥的时间为12-48h不等,到时间后关闭真空泵,通过真空密封阀门使干燥室通气,取出样品。选取部分升华干燥时间在24h以上的样品,转移至真空干燥箱内,进行解析干燥,其余样品封盖密封保存。解析干燥的温度为32℃,真空度为10Pa,干燥时间为5-24h不等。干燥结束后取出样品,压盖密封保存。最终共得到88个样品,通过控制干燥时间的不同使获得的样品拥有不同的水分含量,而且能够涵盖使用该模型预测样品水分时可能遇到的浓度范围,以保证未知样品水分含量的预测是通过模型内插进行分析的,从而使模型具有有效性和实用性。2.2 光谱的采集本实验使用Antaris Ⅱ傅里叶变换近红外光谱仪,包括带InGaAs检测器的积分球漫反射分析模块,采用仪器自带的RESULT-Intergration软件编写采集光谱的工作流程。仪器的主要工作参数为:光谱扫描范围为10000cm-1-4000cm-1,分辨率为8cm-1,光谱扫描次数为32,每个样品在不同部位采集3张光谱。近红外漫反射光谱吸收强度设定为lg(1/R)。启动仪器,预热至少30分钟,检查仪器各项性能是否正常。采用仪器自带的RESULT-Operation采集光谱,调用编写好的工作流程,将装有样品的西林瓶直接放在通光孔并固定位置,即可采集样品的傅里叶变换近红外光谱数据。2.3 水分含量的测定依据《中国药典》三部附录VII D 水分测定法第一法—卡尔费休容量滴定法,测定样品的水分含量。2.4 建立校正模型在MATLAB中运行PLS_Toolbox工具箱进行数据处理,采用PLS建立FⅧ冻干过程中水分含量的定量分析模型。用K-S分类的方法将样品划分为校正集和验证集。根据学生化残差和杠杆值等统计指标识别并去除异常样品。对光谱数据进行必要的平滑、求导等预处理,以消除噪声和基线漂移等的影响。使用iPLS和GA等方法选择光谱区间,优选与水分含量相关性强的谱区,减少无效信息的使用。3 结果3.1 样品制备及水分含量测定结果共制备得到88个样品,水分含量范围为1.00%-5.30%。其中1-60号样品只进行了不同时间的升华干燥,水分含量在2.04%-5.30%之间;61-88号样品在升华干燥后进行了不同时间的解析干燥,水分含量在1.00%-2.75%之间。3.2 样品的近红外光谱所有88个样品的原始近红外漫反射光谱如图1所示。从图中可发现,样品光谱的基线漂移十分严重,所以必须进行适当的预处理,以消除基线漂移以及光谱噪声等的影响。水分子的O-H在近红外谱区有两个特征谱带:5150cm-1的组合频吸收和6950cm-1的OH伸缩振动一级倍频吸收。这两个特征吸收是建模时选择光谱区间的重要依据。data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAAAz4AAAF2CAMAAACYgb3CAAAAAXNSR0ICQMB9xQAAALpQTFRFAAAAAAA6AABmAAD/ADo6ADqQAH8AAGa2AL+/OgAAOgA6OgBmOjoAPz8/Ojo6OjpmOjqQOmZmOma2OpCQOpC2OpDbZgAAZgA6ZgBmZjoAZjqQZmY6ZmZmZma2ZpCQZrbbZrb/kDoAkDo6kDpmkGZmkGaQkJA6kJBmkLaQkNvbkNv/vwC/tmYAtmY6tmZmtpA6v78Atv+2tv//25A627a22//b2////wAA/7Zm/7a2/9uQ//+2///b////FbtuvwAAAAlwSFlzAAAWJQAAFiUBSVIk8AAAABl0RVh0U29mdHdhcmUATWljcm9zb2Z0IE9mZmljZX/tNXEAADorSURBVHja7Z0Ngxs5cp5nDzkI6wscx8nuXRyfrb2LE1vQXWApWSiS8P//VvBWAWh0s5tfQ3JmyLd2NcOPZqPJwcP6QKHqKVMolDPliR8BhUJ8KBTiQ6EQHwqF+FAoFOJDoRAfCoX4UCjEh0IhPhQKhfhQKMSHQiE+FArxoVAoxIdCIT4UCvGhUIgPhUJ8KBQK8aFQiA+FQnwoFOJDoVCID4XytvD59sfy4+uPT+/5WVOIz4ny9cd35ecXwkMhPmeIaJ/PTz98wGAUysvKm8Sn/rrOW3iZ98Wh3tRQbxqfv3xQfPjX51AvOdSbxOfL+68/qvHGvz6HIj78k3Ao4kN8OBTxIT4cikMRHw7Fod7YUPeKD4VCfCgU4kN8KMSH+FCID/GhEB/iQ6EQHwqF+BAfCvEhPhTiQ3woFOJDoRAf4kMhPsSHQnyID4X4EB8KhfhQKMSH+FCID/GhEB/iQ6EQHwqF+BAfCvEhPhTiQ3woxIf4UCjEh0IhPsSHQnyID4X4EB8K
谁知道二元NiTi的变形激活能和扩散激活能,如能提供相关文献最好,谢谢!
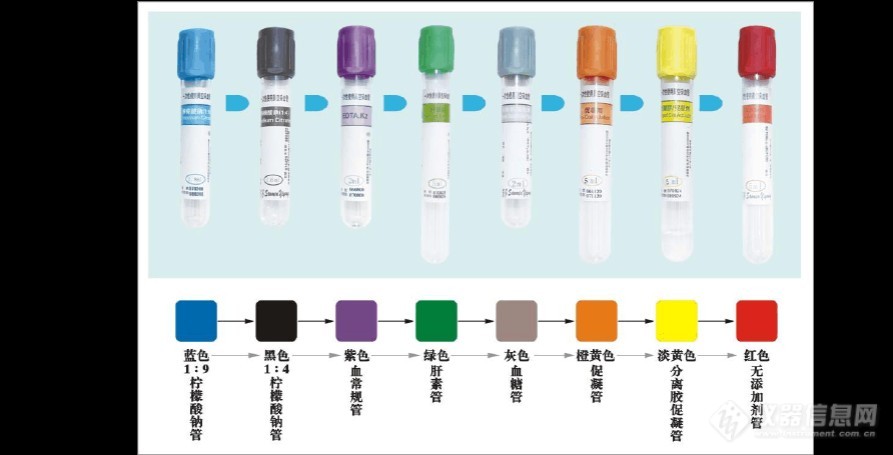
[font=宋体] 有过抽血经历的人都见到过采血管,有时见到的还不止一直颜色。采血管为一种真空负压装置,内预置了各种添加剂,用于血液标本的采集与保存,满足临床多项综合的血液检测。真空采血器是对传统的注射器采血方式的革命性创新,[color=#333333][back=white]在全封闭系统下完成采血程序,从根本上排除了血液污染和交叉感染的可能性,[/back][/color]具有快速准确采集,安全、密闭,转运方便,头色不同,易于分辨的优点,一共有[/font][font='Times New Roman',serif]9[/font][font=宋体]个种类,根据帽子的颜色不同来进行区[img=,690,351]https://ng1.17img.cn/bbsfiles/images/2021/09/202109252009147477_9002_4079281_3.jpg!w690x351.jpg[/img][/font][font='Times New Roman',serif]1.[/font][font=宋体]红色头盖:普通血清管,不含添加剂,用于常规血清生化,血库和血清学相关检验。[/font][font='Times New Roman',serif]2.[/font][font=宋体]橘红色头盖:快速促凝管,内有的促凝剂可在[/font][font='Times New Roman',serif]5[/font][font=宋体]分钟内使采集的血液凝固,适于急诊血清化验。[/font][font='Times New Roman',serif]3.[/font][font=宋体]金黄色头盖:惰性分离胶促凝管,添加有惰性分离胶和促凝剂。标本离心后,惰性分离胶能够将血液中的液体成分[/font][font='Times New Roman',serif]([/font][font=宋体]血清或血浆[/font][font='Times New Roman',serif])[/font][font=宋体]和固体成分[/font][font='Times New Roman',serif]([/font][font=宋体]红细胞,白细胞,血小板,纤维蛋白等[/font][font='Times New Roman',serif])[/font][font=宋体]彻底分开并完全积聚在试管中央而形成屏障,标本在[/font][font='Times New Roman',serif]48[/font][font=宋体]小时内保持稳定。促凝剂可快速激活凝血机制,加速凝血过程,适用于急诊血清生化试验。[/font][font='Times New Roman',serif]4.[/font][font=宋体]绿色头盖:肝素抗凝管,[color=#333333][back=white]具有加强抗凝血酶[/back][/color][/font][font='Times New Roman',serif][color=#333333][back=white]Ⅲ[/back][/color][/font][font=宋体][color=#333333][back=white]灭活丝氨酸蛋白酶的作用,从而阻止凝血酶的形成,[/back][/color][/font][font=宋体]延长标本凝血时间,[color=#333333][back=white]并有阻止血小板聚集等多种抗凝作用。[/back][/color]适用于红细胞脆性试验,血气分析,红细胞压积试验,血沉及普能生化测定。过量的肝素会引起白细胞的聚集,不能用于白细胞计数。因其可使血片染色后背景呈淡蓝色,故也不适于白细胞分类。[/font][font='Times New Roman',serif]5.[/font][font=宋体]浅绿色头盖:血浆分离管,在惰性分离胶管内加入肝素锂抗凝剂,可达到快速分离血浆的目的,是电解质检测的最佳选择,也可用于常规血浆生化测定和[/font][font='Times New Roman',serif]ICU[/font][font=宋体]等急诊血浆生化检测。血浆标本可直接上机并在冷藏状态下保持[/font][font='Times New Roman',serif]48[/font][font=宋体]小时稳定。[/font][font='Times New Roman',serif]6.[/font][font=宋体]紫色头盖:[/font][font='Times New Roman',serif]EDTA[/font][font=宋体]抗凝管,乙二胺四乙酸[/font][font='Times New Roman',serif](EDTA)[/font][font=宋体]及其盐是一种氨基多羧基酸,可以有效地螯合血液标本中钙离子,螯合钙或将钙反应位点移去将阻滞和终止内源性或外源性凝血过程,从而防止血液标本凝固。适用于一般血液学检验,不适用于凝血试验及血小板功能检查,亦不适用于钙离子,钾离子,钠离子,铁离子,碱性磷酸酶,肌酸激酶和亮氨酸氨基肽酶的测定及[/font][font='Times New Roman',serif]PCR[/font][font=宋体]试验。[/font][font='Times New Roman',serif]7.[/font][font=宋体]蓝色头盖:枸橼酸钠凝血试验管,枸橼酸钠主要通过与血样中钙离子螯合而起抗凝作用。适用于凝血实验,国家临床实验室标准化委员会[/font][font='Times New Roman',serif](NCCLS)[/font][font=宋体]推荐的抗凝剂浓度是[/font][font='Times New Roman',serif]3.2%[/font][font=宋体]或[/font][font='Times New Roman',serif]3.8%([/font][font=宋体]相当于[/font][font='Times New Roman',serif]0.109mol/L[/font][font=宋体]或[/font][font='Times New Roman',serif]0.129mol/L)[/font][font=宋体],抗凝剂与血液的比例为[/font][font='Times New Roman',serif]1:9[/font][font=宋体]。[/font][font='Times New Roman',serif]8.[/font][font=宋体]黑色头盖:枸橼酸钠血沉试验管,血沉试验要求的枸橼酸钠浓度是[/font][font='Times New Roman',serif]3.2%([/font][font=宋体]相当于[/font][font='Times New Roman',serif]0.109mol/L)[/font][font=宋体]抗凝剂与血液的比例为[/font][font='Times New Roman',serif]1:4[/font][font=宋体]。[/font][font='Times New Roman',serif]9.[/font][font=宋体]灰色头盖:添加有草酸钾[/font][font='Times New Roman',serif]/[/font][font=宋体]氟化钠,氟化钠是一种弱效抗凝剂,一般常同草酸钾或乙碘酸钠合并使用,其比例为氟化钠[/font][font='Times New Roman',serif]1[/font][font=宋体]份,草酸钾[/font][font='Times New Roman',serif]3[/font][font=宋体]份。此混合物[/font][font='Times New Roman',serif]4mg[/font][font=宋体]可使[/font][font='Times New Roman',serif]1ml[/font][font=宋体]血液在[/font][font='Times New Roman',serif]23[/font][font=宋体]天内不凝固和抑制糖分解,它是血糖测定的良好保存剂,推荐用于血糖检测,不能用于尿素酶法测定尿素,也不用于碱性磷酸酶和淀粉酶的测定。[/font][font=宋体][color=#333333][back=white][img=,690,496]https://ng1.17img.cn/bbsfiles/images/2021/09/202109252009389263_9518_4079281_3.png!w690x496.jpg[/img][/back][/color][/font][font=宋体][color=#333333][back=white] 真空采管在生产过程中预置了一定量的负压,当采血针穿刺进入血管后,由于采血管内的负压作用,血液自动流入采血管内。同时可实现一次静脉穿刺采集多管标本,在减少患者痛苦和医务人员工作量的前提下,确保静脉穿刺的安全性。[/back][/color][/font]
乳杆菌~乳酸杆菌~激活后,在血平板上培养~长成的形态是什么样???

达比加群酯杂质的作用机制是作为直接凝血酶抑制剂,通过抑制凝血酶而发挥抗凝作用,从而降低血液凝固的风险,预防血栓形成。达比加群酯的适应症主要适用于预防存在以下一个或多个危险因素的成年人非瓣膜性房颤患者的卒中和全身性栓塞,包括以前有过卒中病史、短暂性脑缺血发作或全身性栓塞、左心室射血分数小于40%、伴有症状的心力衰竭、年龄≥75岁或年龄≥65岁且伴有糖尿病、冠心病或高血压等情况。达比加群酯的常见不良反应包括恶心、呕吐、便秘、发热、低血压、失眠、水肿等。此外,达比加群酯也可能导致出血和肾功能不全的风险增加。因此,在使用达比加群酯时应在医师指导下进行,并根据患者的具体情况调整剂量。CATO标准品的达比加群酯是一种有效的抗凝药物,用于预防非瓣膜性房颤患者的卒中和全身性栓塞,以及其他适应症。[img=,609,546]https://ng1.17img.cn/bbsfiles/images/2024/02/202402041402083306_8642_6381668_3.png!w609x546.jpg[/img]
[align=center][b][/b][/align][align=center][b]Multifocal two-photon laser scanning microscopy combined with photo-activatable GFP for [i]in vivo [/i]monitoring of intracellular protein dynamics in real time[/b][/align][b]摘要[/b]使用[color=#ff0000]Lavision Biotec[/color]公司[b]多焦点双光子激光扫描显微镜[color=#ff0000]Trim Scope[/color][/b]来进行局部和选择性的蛋白激活以及细胞内蛋白动态的的量化调查。局部激活使用光激活绿色荧光蛋白(pa-GFP)和光学双光子激发来实现,以调查实时原位的细胞内动态。这个过程对于深入理解和建模活细胞内的调控和代谢过程极其重要。作为范例,既包含了一个核输入信号又包含了一个核输出信号的拟南芥MYB转录因子LHY/CCA1-like 1 (LCL1)被定量化调查。我们使用了由质粒编码的光激活绿色荧光蛋白(pa-GFP)融合蛋白和一个红色荧光转染标记联合转染的烟草BY-2原生质体,并pa-GFPLCL1在核内光激活后的快速向核外输出。作为对照,一个LCL1核输出阴性突变体仍然被束缚在核内。我们确定了由激活pa-GFP-LCL1的双向核运输和pa-GFP的扩散分别导致的核内荧光下降的51s和125s的平均时间常数。[b]材料与方法[/b][i]并行的64焦点双光子激光扫描显微镜[/i]Pa-GFP的激活和荧光的原位检测,通过基于根据蛋白动态监测需求改进的商业化系统([color=#ff0000]TriM Scope, LaVision Biotec[/color] Martini et al., 2005 Nielsen et al., 2001)多焦点2光子LSM检测(Fig. 1). 64焦点2光子LSM (Martini et al., 2006)包括一个倒置光学显微镜和一个可以产生从760nm到960nm的100fs激光脉冲的由固态激光器泵浦的锁模飞秒Ti:Sa激光器。用于激活和成像循环的波长选则通过一个允许5s内转换波长的ahome-built screw motorization来实现。激光扫描单元([color=#ff0000]TriM Scope, LaVision BioTec[/color]) 包括一个内置的预啁啾部分以补偿激光脉冲的色散,一个光束分光器部分和振镜扫描器。通过选择一组10个100%反光镜和50%分光镜,激发的NIR激光束在样品中被分为1, 2, 4,……, 64个激发焦点。这些数目可调的焦点在显微镜物镜(UPLAO60XW3/IR, NAD1.2 Olympus)的焦平面上被激光扫描单元中的2个扫描镜扫描。整个激活和测量过程在一个温度可控环境中在293±1K下进行。因为在保持每个焦点的能量沉积低于样品的退化极限的同时,多个焦点产生了相对高的双光子诱导荧光产额,成像可以30ms的时间分辨率进行。图像用一个背照明的EMCCD相机(IXON DV887ECS-UVB, Andor Technology)以non-descanned方式获取。激发的NIR激光束被引导通过一个分光镜 (2光子-Beamsplitter, Chroma)到物镜的后光圈上。为了成像深度和光谱荧光切片,倒置显微镜采用了机械聚焦驱动(MFD, Marzhauser)和一个程序控制滤波轮([color=#ff0000]LaVision-BioTec)[/color]。数据获取和实验控制由 TriM Scope的软件包Imspector(LaVision-BioTec)执行。操作和处理5维的数据列,包括光谱和时间数据轴,使用软件包Imspector ([color=#ff0000]LaVision-BioTec)[/color],ImageJ (Rasband, 1997) 或 Imaris (Bitplane)。[img=,657,421]http://qd-china.com/uploads/bio-product/81.jpg[/img]Fig. 1.多焦点双光子激光扫描显微镜的原理图(1) Tsunami Ti:Sa 激光器(波长可调)由固态Millenia X 激光器泵浦 (均来自 Spectra Physics), (2) 多焦点激光扫描单元 (TriM-scope, LaVision BioTec), (3) 分光镜 (2光子-Beamsplitter, Chroma), (4) 短波通过滤波轮 (2光子-Emitter, Chroma), (5) 物镜 (UPLAO60XW3/IR, NA D 1.2 Olympus), (6) 样品中可选择数目的荧光焦点, (7) 倒置光学显微镜(IX 71, Olympus), (8) 滤波轮 (滤波轮, LaVision BioTec)装备带通滤波片 D 605/55 (Chroma)用于检测 Ds-Red 和 HQ525/50 结合 HQ510/20 (均来自 Chroma)以检测 pa-GFP, (9) 背照式 EMCCD-camera (IXON DV887ECS-UVB, Andor Technology) 在NDD光路中, (10) 荧光灯 (HBO 50, Zeiss), (11) 带通激发滤波轮 D 540/25 (Chroma) 用于 Ds-Red 或带通激发滤波轮HQ 480/20 (Chroma) 用于 pa-GFP.[b]结果[img=,380,768]http://qd-china.com/uploads/bio-product/82.jpg[/img][/b]Fig. 2.含有核输入输出信号的拟南芥转录因子LCL1 (分别为NLS, NES). 由质粒编码GFP融合蛋白转染的烟草BY-2原生质体。通过单光子共聚焦激光扫描显微镜分析的GFP融合蛋白稳定态定位。(a) GFP-LCL1 揭示的核与细胞质间的分区。(b) 使用核输出抑制剂leptomycin B (LMB)孵育后,由于功能性NLS的存在,GFP-LCL1的稳定态分区剧烈转化为几乎完全分布于核中。 (c,d) 对照,LMB对单独的GFP没有影响。 (e) GFPLCL1(NESm)中,它的NES的点突变造成的LCL1的核输出活性削弱同样导致了GFP融合蛋白在核内的聚集。(f) 与(e)中同一个原生质体的透射光与GFP荧光成像的叠加标尺为10um (g) 作为对照的 GFP-NLS 在核内的增加。 (h) 同一原生质体的GFP-NLS绿色荧光蛋白和作为转染标记的Pra1-DsRed (At2g38360)红色荧光蛋白的叠加。[img=,700,109]http://qd-china.com/uploads/bio-product/83.jpg[/img]Fig. 3. pa-GFP 在一个活原生质体内的自由动态扩散。选出的5幅表达pa-GFP的烟草BY-2原生质体的单光子透射荧光图像。(a)实验开始,未激活 (b) pa-GFP的双光子激活期间 (c-e) 双光子激活后,所示时间点。(a)核内(红虚线)的pa-GFP在双光子激发前平均荧光很难被检测到。使用4个平行焦点(10mW at 800 nm 每焦点)的持续3s的飞秒激光对一个7X8um的区域进行pa-GFP 2光子激发开始 (b) 激发后很短时间内检测到一个强的荧光信号(c-e) pa-GFP从核内向细胞质的扩散被监测,直到两组分间达到平衡。荧光强度标尺显示在每幅图的左边。[img=,707,514]http://qd-china.com/uploads/bio-product/84.jpg[/img]Fig. 4.在核内被光激活后,pa-GFP从核内向细胞质扩散的量化分析。在激活前,核内(ROI)平均的1光子荧光强度非常低(平均强度~300).在26s和29s间的时间点,由飞秒激光激活诱导的荧光增强在图上进行了监测。 与光激活前相比,平均荧光强度是之前的大约5倍,伴随着ROI内的荧光降低。在第一个地方,监测到的细胞核内荧光下降是由于激活的pa-GFP向细胞质内的扩散。后来,光漂白变得显著。双指数拟合非常近似地拟合了整个荧光下降过程(红线)。以此方式计算出这个实验中175s的扩算时间常数。[img=,705,375]http://qd-china.com/uploads/bio-product/85.jpg[/img]Fig. 5. 烟草BY-2原生质体中At2g38360-DsRed的定位和平行双光子荧光显微镜对pa-GFP的3D监测(64 foci, 920 nm, 240 mW)。 (a) 双光子荧光下降的量化分析,给出了一个123s的扩散时间常数。Figs. 3 and 4中的数据源于两个不同的实验,解释了荧光值的绝对差异(不同的表达水平)和统计分析。 (b) At2g38360-DsRed作为转染标记在核中pa-GFP激活前的荧光 (c) At2g38360-DsRed和pa-GFP数据采集后400 s的3D荧光图像,清楚显示了荧光团从细胞核向细胞质的扩散。[img=,697,603]http://qd-china.com/uploads/bio-product/86.jpg[/img]Fig. 6.在核内光激活前后,烟草BY-2原生质体内活跃转运的pa-GFP-LCL1的3D动态监测和量化分析。(a) 在pa-GFP-LCL1双光子激发后核内的单光子荧光表明双光子激活荧光增强 (b) pa-GFP被双光子激活后双指数曲线拟合(红线)的荧光下降量化分析。计算得出的由于主动运输导致的核内pa-GFP-LCL1荧光下降的一个20s的时间常数(c,d) At2g38360-DsRed(转染标记)和pa-GFP-LCL1的双色双光子荧光3D成像 (c)核内光激活前 (d)数据获取后。[img=,691,345]http://qd-china.com/uploads/bio-product/87.jpg[/img]Fig. 7. 烟草BY-2原生质体的核输出阴性突变pa-GFP-LCL1(NESm)光激活前后的3D动态监测和量化分析。(a) pa-GFP-LCL1(NESm)被双光子激活后的单光子荧光显示了双光子激活荧光增强和激活后核内荧光极其缓慢的下降,反映了pa-GFPLCL1(NESm)的核限制 (b,c) At2g38360-DsRed (转染标记) 和 pa-GFP-LCL1(NESm) 的双光子荧光3D图像 (b) 光激活前的核内 pa-GFP (c) 数据获取后300s的时间点。