专家点评Nature子刊|刘兴国组揭示线粒体TCA酶入核调控多能性的全新模式
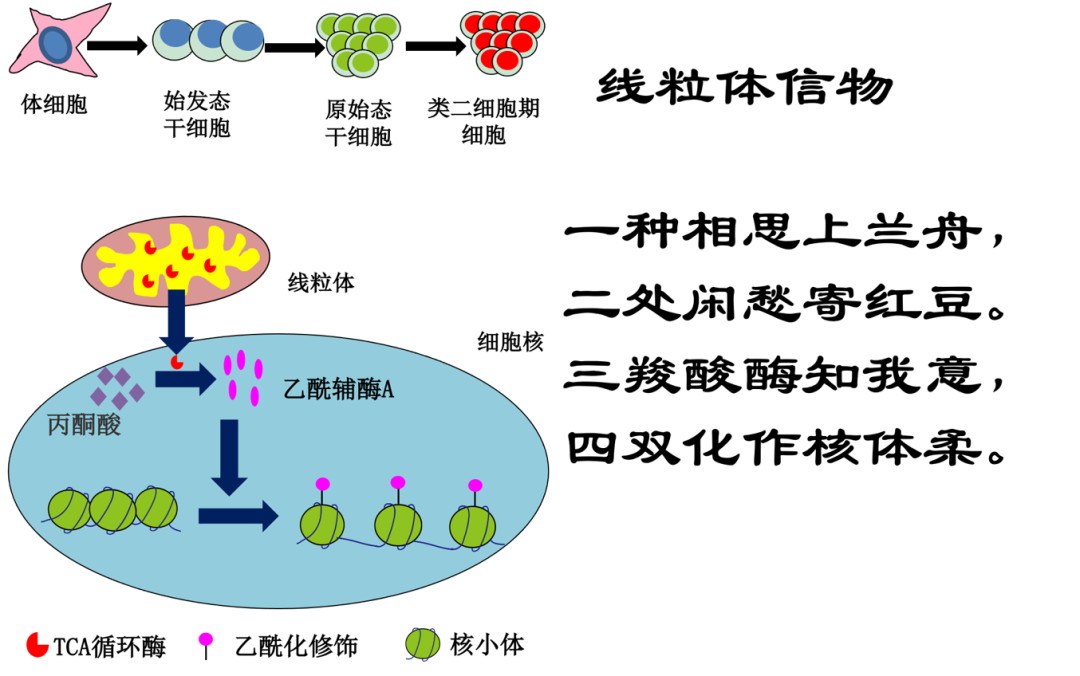
点评专家|高绍荣、乐融融(同济大学,干细胞专家),李伟、王思骐(中科院动物所,干细胞专家),吕志民(浙江大学,代谢专家),高平(广东医学科学院,代谢专家)哺乳动物细胞内,存在两个具有遗传物质的细胞器:细胞核与线粒体。这两者自从大约二十亿年前的相遇,开始了相恋相依的进化历程。多能干细胞独特的自我更新能力及分化为多种细胞类型的能力,使其在再生医学和发育生物学研究中受到了极大的关注。胚胎干细胞(embryonic stem cell, ESCs)及诱导多能干细胞(induced pluripotent stem cells, iPSCs)是两种常见的多能干细胞。多能干细胞具有特殊的表观遗传修饰状态,而许多线粒体代谢产物如:乙酰辅酶A、α-酮戊二酸、NAD+等作为组蛋白修饰酶的辅基直接发挥重要作用。刘兴国团队在国际上独辟蹊径,以多能干细胞模型系统的阐明了线粒体氧离子调控组蛋白甲基化与DNA甲基化1,2,线粒体代谢产物调控组蛋白乳酸化、乙酰化3,线粒体磷脂调控组蛋白乙酰化及基因表达4-6等一系列通过反向信号模式调控细胞核的全新模式。三羧酸循环(tricarboxylic acid cycle, TCA cycle)作为需氧生物体内最普遍存在的代谢途径,是物质代谢与能量代谢的重要枢纽。线粒体TCA循环酶正常行驶功能是TCA循环维持的关键。TCA循环酶在一些恶性肿瘤细胞中能从线粒体转运到细胞核内发挥DNA修复和表观遗传调控的作用7。然而,TCA循环酶在多能性获得与转变中时空调控的规律和作用还完全不清楚。2022年 12月2日,Nature子刊 Nature Communications 在线发表了中科院广州生物医药与健康研究院刘兴国课题组持续性工作的最新研究成果“Nuclear Localization of Mitochondrial TCA Cycle Enzymes Modulates Pluripotency via Histone Acetylation”(线粒体TCA循环酶入核通过组蛋白乙酰化调控多能性)8。该研究发现,多种线粒体TCA循环酶在多能干细胞获得、状态转变以及转变为全能干细胞等过程中均存在从线粒体转运到细胞核的现象,并且核定位TCA循环酶调控上述过程。核定位丙酮酸脱氢酶 (Pdha1) 能促进细胞核内乙酰CoA从而促进组蛋白乙酰化修饰,并进一步打开多能性相关基因,促进多能性获得。该研究揭示了线粒体TCA循环酶入核通过表观遗传调控多能性的重要作用,拓展了线粒体反向信号调控干细胞多能性的新模式。刘兴国团队聚焦多能性的各个过程,包括:多能干细胞获得(iPSCs重编程)、始发态-原始态转变(Primed-Naïve转变)、转变为全能干细胞(ESCs-类二细胞期细胞(2CLCs)转变)。在以上过程,均发现线粒体内TCA循环酶类包括Pdha1、Pcb、Aco2、Cs、Idh3a、Ogdh、Sdha、Mdh2等存在从线粒体向细胞核转运的现象。其中,过表达核定位TCA循环酶Pdha1、Pcb、Aco2、Cs及Idh3a能促进干细胞多能性的获得及Primed-Naïve转变。另外核定位的Pdha1还能促进ESCs向2CLCs的转变。Pdha1对多能干细胞命运的作用依赖于其丙酮酸脱氢酶活性。体细胞重编程早期TCA循环酶入核刘兴国团队发现,在多能性获得过程中,核定位TCA循环酶Pdha1不改变细胞的有氧呼吸及糖酵解动态平衡。核定位Pdha1通过促进细胞核内乙酰辅酶A的合成为组蛋白乙酰化提供反应底物,促进组蛋白H3乙酰化, 尤其是H3K9及H3K27两个位点的乙酰化修饰水平。进一步研究发现,核定位Pdha1能促进多能性相关基因的转录起始位点及增强子区域的H3K9ac及H3K27ac水平。核定位Pdha1能促进P300及重编程因子Sox2/Klf4/Oct4对他们下游靶标(多能性基因)的结合,并促进多能性相关基因染色质的重塑,进而促进多能性的获得。这一工作也为目前新的组蛋白修饰如:组蛋白棕榈酰化、巴豆酰化、丁酰化修饰等的研究提供了新的研究思路,这些修饰也依赖于线粒体产生的代谢物。本研究描述了多个 TCA 循环酶的转运入核。除了Pdha1 外,其他TCA 循环酶也可能在调节细胞核中的表观遗传学中发挥类似作用,提示细胞核中可能存在类似于线粒体中的复杂代谢循环,并调控多种表观遗传途径。本研究阐明的Pdha1转运入核为组蛋白乙酰化提供局部乙酰辅酶 A,是一种全新的通过活跃的组蛋白乙酰化维持染色质开放状态的新途径。这一途径对于多能性至关重要,表明在早期发育中重要的生理意义。另一方面,肿瘤干细胞同样表现出开放的染色质结构、过度活跃的组蛋白乙酰化和从氧化磷酸化到无氧糖酵解的代谢转换,这一新途径也可能为肿瘤干细胞的病理研究提供信息。细胞核与线粒体在二十亿年相恋相依中,进化很多的交流方式,其中线粒体代谢物入核作为表观遗传酶的辅基是重要的一种。这就像线粒体与细胞核隔着细胞质的海洋,“一种思念上兰舟,二处闲愁寄红豆”,代谢物就是那舟上相思的“红豆”。而线粒体TCA循环酶则另辟蹊径,作为线粒体的“信物”,到达细胞核,更加精准的对应需求,在细胞核里局部生根发芽,就地利用养料(丙酮酸)结出新鲜茂密的“红豆”,并使局部的核小体松散。正是:“三羧酸酶知我意,四双化作核体柔”。TCA循环酶入核调控多能性获得、多能性转变及全能性获得模式图本研究与香港中文大学合作完成。专家点评高绍荣、乐融融(同济大学,干细胞专家)多能干细胞具有自我更新和多向分化潜能,在发育生物学及再生医学领域有重要的研究价值及广阔的临床应用前景。诱导多能干细胞(iPSCs)技术规避了胚胎干细胞(ESCs)的免疫排斥及伦理问题,极大地推动了多能干细胞在临床治疗中的应用。线粒体对多能干细胞的命运调控有重要作用。除了经典的能量代谢调控功能,近年来的研究也揭示了线粒体对表观修饰重塑具有重要的影响,然而具体的作用机制还知之甚少。2022年 12月,Nature Communications杂志在线报道了中科院广州生物医药与健康研究院刘兴国课题组的题为Nuclear Localization of Mitochondrial TCA Cycle Enzymes Modulates Pluripotency via Histone Acetylation的工作,该研究系统地揭示了多能性转变的多条路径中均存在三羧酸循环(tricarboxylic acid cycle, TCA cycle)酶由线粒体向细胞核转运的现象。研究者进一步探索了核定位的三羧酸循环酶的功能,发现TCA循环酶Pdha1、Pcb、Aco2、Cs及Idh3a的核定位能促进干细胞多能性的获得及Primed to Naïve多能性状态转变。此外核定位的Pdha1还能促进ESCs向类二细胞胚胎细胞(2CLCs)的转变。接下来,研究者解析了Phda1在多能性获得中的作用机制,发现Phda1的入核能促进乙酰辅酶A在细胞核内的直接合成,为组蛋白乙酰化修饰提供反应底物,促进了组蛋白H3的乙酰化。进一步的研究发现,核定位的Pdha1通过提高多能性相关基因转录起始位点和增强子区域的H3K9ac和H3K27ac修饰水平,促进P300及多能性核心调控因子Sox2/ Klf4/Oct4在这些区域的结合,进而促进多能性基因网络的建立。该研究阐明了线粒体调控细胞命运转变的表观调控的新机制,揭示了TCA循环酶可在细胞核内直接合成表观修饰酶辅助因子来调控染色质修饰的重塑,拓展了对细胞核与细胞质协同调控细胞命运转变模式的理解。同时,相关的研究问题也值得进一步探索,除了组蛋白乙酰化,其它的线粒体TCA循环酶及其它表观修饰之间是否存在类似的反向信号模式的调控机制?这些TCA循环酶入核的转运机制是如何发生的?多能干细胞线粒体呼吸能力低下,缺乏成熟的结构,并在细胞核周围富集,这些有别于终末分化细胞的特征是否与TCA循环酶的转运相关。具有相似线粒体特性的其它细胞,如类全能干细胞、成体干细胞或者早期胚胎发育中是否有相似的机制。此外,干细胞的快速自我更新过程中核膜结构的重塑是否与TCA循环酶的入核相关?解答这些有趣的问题无疑将帮助我们进一步揭开核质协同互作调控细胞命运转变的奥秘。专家点评李伟、王思骐(中科院动物所,干细胞专家)多能干细胞具有无限增殖的能力,同时又保留多向分化潜能,在发育生物学和再生医学中拥有广阔的应用前景。多能干细胞的多能性受到基因调控网络的精密调控,其中在细胞核内发生的DNA甲基化、组蛋白修饰、染色体重构等表观遗传调控发挥了关键作用。线粒体作为细胞能量代谢的中心,不仅通过三羧酸循环(TCA)产生细胞所必需的能量ATP,同时产生的中间代谢产物还可以作为表观修饰的底物,通过反向转运进入细胞核中,参与多种蛋白翻译后修饰。这些发现提示线粒体代谢与细胞核内发生的表观遗传调控有着紧密联系,而这些调控是否参与干细胞多能性重编程这一重要表观重编程事件,目前仍然未知。中国科学院广州生物医药与健康研究院刘兴国课题组在Nature Communications上发表的题为Nuclear Localization of Mitochondrial TCA Cycle Enzymes Modulates Pluripotency via Histone Acetylation的研究论文,发现线粒体TCA循环酶-丙酮氨酸脱氢酶Pdha1可从线粒体转运进入细胞核,通过影响组蛋白乙酰化修饰调控细胞多能性,在iPSC重编程、Primed向Naïve多能性转变、以及类二细胞期细胞转变过程中均发挥重要作用。Pdha1是线粒体中催化丙酮酸脱羟产生乙酰辅酶A(Acetyl-CoA)的CTA循环酶,产生的乙酰辅酶A是乙酰化修饰的反应底物。研究发现核定位Pdha1显著增加了细胞核内Acetyl-CoA水平,并上调了多能性相关基因启动子区域的H3K9ac和H3K27ac水平。同时,核定位Pdha1促进P300和重编程因子在多能性相关靶基因启动子区域的结合,进而调控多能性的获取。这一研究非常有意思的发现在于,在体细胞诱导重编程这一剧烈的表观重编程事件中,线粒体TCA循环酶能够直接进入细胞核对参与表观修饰的CoA进行调控,从而拓展了线粒体调控细胞多能性的新模式。考虑到肿瘤发生和诱导重编程都是非自然发生的生物学事件,这一模式在其他重要的发育事件中是否发挥调控功能,值得未来继续探索。专家点评吕志民(浙江大学,代谢专家)新陈代谢是生命的基本特征。作为生命代谢过程的主要参与者,代谢酶除了发挥其经典功能为细胞提供物质与能量外,还能通过一些非经典/非代谢功能调控多种复杂的细胞活动及疾病的发生发展。代谢酶的非经典/非代谢功能在基因表达、DNA损伤、细胞周期与凋亡、细胞增殖、存活以及肿瘤微环境调控中均发挥了重要作用。比如,肿瘤发生过程中,FBP1可以作为蛋白磷酸酶发挥功能,α-KGDH关联KAT2A调控组蛋白H3的琥珀酰化修饰,这为代谢酶作为新的疾病治疗靶点提供了可能性。然而在多能性的获得、转变及全能性获得过程中,代谢酶是否也能通过非经典功能调控细胞的多能性或全能性功能仍不得而知。刘兴国团队研究发现在多能性获得、转变及全能性获得等多个过程中,TCA循环酶能从线粒体转运到细胞核内,并且能调控多能性获得、转变及全能性获得过程。丙酮酸脱氢酶Pdha1能特异性调控细胞核内非经典TCA循环。其中,细胞核内Acetyl-CoA的生成,为组蛋白乙酰化提供了代谢底物,从而调控组蛋白乙酰化。核Pdha1还能通过P300及经典Yamanaka因子(Sox2, Klf4, Oct4)的选择性而特异性结合多能性基因,进一步打开染色质, 并促进多能性相关基因染色质的重塑。该研究结果表明,TCA循环酶通过线粒体-细胞核反向信号调控细胞多能性的机制在细胞多能性获得,以及对表观遗传的调控中起着重要作用。该研究结果丰富了业界对TCA循环酶非经典功能的认知范围,对干细胞干性的调控,以及多能性的获取研究领域具有理论借鉴和指导意义。专家点评高平(广东医学科学院,代谢专家)细胞核和线粒体是细胞内的两类细胞器,长期以来,它们各司其职,结构鲜明。细胞核是真核细胞最大的细胞器,是储存遗传物质并传递遗传信息的主要场所,对细胞的生命活动有着极其重要的作用。线粒体是细胞的能量工厂,是细胞内三大营养物质彻底氧化和能量转化的主要场所,它通过三羧酸循环的系列氧化和磷酸化反应,将储存于有机物中的化学能转化为ATP,为细胞生命活动提供能量。两个细胞器的功能虽然彼此独立,但长期以来,它们之间也互有往来。一方面,线粒体中的许多酶其实是核编码的,在核糖体翻译成熟以后,再转输到线粒体发挥作用。而早至上世纪60年代,人们就发现在线粒体中也存在DNA,后来又发现RNA、DNA聚合酶、RNA聚合酶等进行DNA复制、转录和蛋白质翻译的全套设备,说明线粒体有相对独立的遗传体系,具有自主性的一面。另一方面,从线粒体产生的ATP被运输到细胞核内,为生命的遗传活动提供能量。同时,来自线粒体的多种三羧酸循环的中间代谢产物(乙酰CoA,α-KG,NAD+,琥珀酰CoA等)被运输到细胞核,为染色质的表观遗传学修饰提供底物。尽管礼尚往来,两类细胞器依然各司其职,互不越界,维持着一种默契。但随着研究进展,人们越来越认识到,这种默契在特定情况下是经常被打破的。近来的一些研究表明,来自线粒体三羧酸循环的一些酶进入到细胞核内,直接干预核内的事件。UCLA 的Utpal Banerjee课题组早年的研究发现,在胚胎发育过程中,来自线粒体的一些酶进入核内,通过影响组蛋白的功能及表观修饰,调控细胞命运(Nagaraj R, et al. Cell 168, 210–223) 。在肿瘤细胞中,吕志民团队发现,α-KG脱氢酶复合体 (α-KGDH complex)进入核内,在局部催化产生琥珀酰CoA,后者被乙酰转移酶KAT2A作为底物利用,导致组蛋白H3的琥珀酰化修饰并调控相关基因的表达,影响肿瘤进程 (Wang et al. Nature. 2017 552: 273-277)。有趣的是,刘兴国团队的最新结果表明,在多能性获得、细胞状态转变以及全能干细胞形成等过程中,存在多种三羧酸循环酶从线粒体转运到细胞核的现象,其中定位于细胞核的代谢酶PDHA1 能在核内催化乙酰CoA的产生,并通过调控组蛋白乙酰化修饰,促进基因表达和多能性的获得(Li, W. et al. Nature Communications. 2022)。刘兴国课题组的这一发现,描述了多能性获得过程中,三羧酸循环酶向核内“集体搬家”的现象,拓宽了目前有关线粒体调控细胞核功能的认知。刘兴国团队发现的代谢酶“集体搬家”的现象非常有趣。这唤醒我今年年初的一些回忆。受北京冬奥会的影响,南方的许多地方年初也兴起滑雪和滑冰了。这雪当然不是从南方暖洋洋的天空降下来的,也并非源于美丽的北国雪乡。真实的情况是,如果需要,温暖的南方也是可以造雪的!这或许只是一个costly decision, 正如卡塔尔人可以选择将他们宽敞的露天足球场通过空调维持在摄氏20度。的确,一些看上去并不合理的事情,在特殊情况下为了特定的目的,是可以发生的。同样的,在生命活动与疾病发生过程中,面临着许多命运决定 (Fate decision)的重要时刻,而细胞的每一次 “决定” 几乎都是精致的利己主义行为,一定有其合理性的一面。我们有理由相信,在诸如多能性获得、胚胎发育以及肿瘤发生等重要的关口,细胞 “决定” 将能量工厂的全套设备“集体搬家”,一定有其深刻的内涵,值得深入研究。有一些非常有趣的问题值得进一步探讨:1)还有谁在搬家,为什么搬家,又是如何搬家的?2)他们搬过来就不走了吗?相对于线粒体内稳定舒适的家,核内的新家又在哪里?3)他们会不会从老家(核糖体)出发直奔新家(细胞核),而无需经由工厂(线粒体)转车?