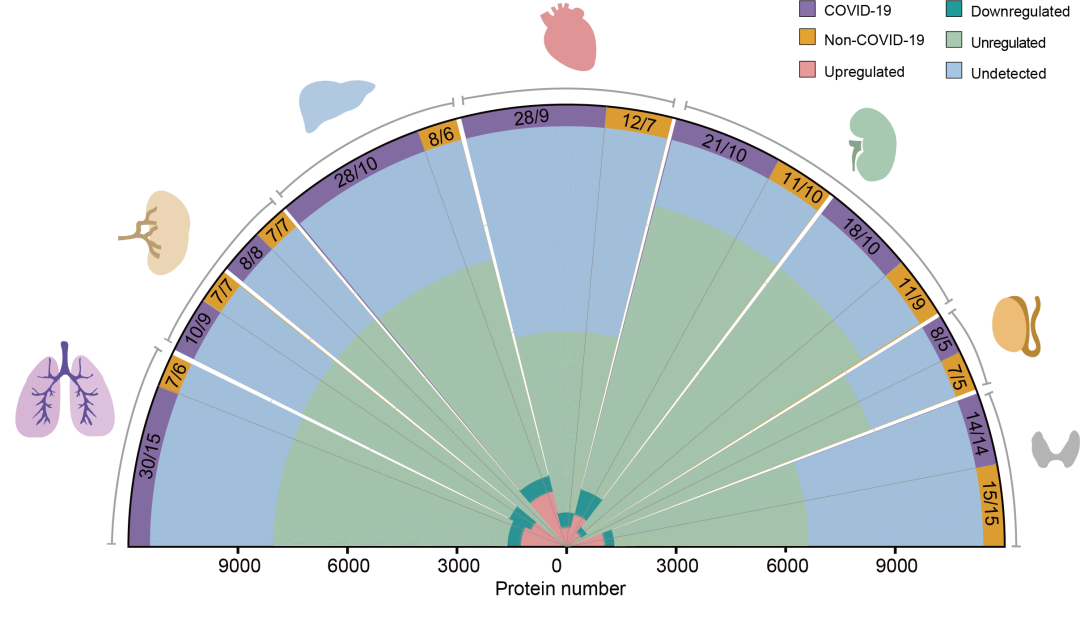
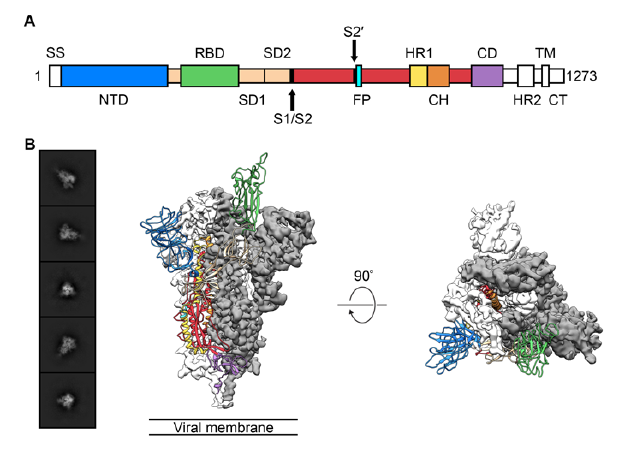
人基质金属蛋白酶抑制因子2(TIMP-2)ELISA试剂盒进口国产
公司主营产品:ELISA 试剂盒,ELISA免费代测,中国标准品,生化试剂,科研抗体,美国ATCC细胞株,生物培养基等产品经营. 人肿瘤坏死因子&alpha (TNF-&alpha )ELISA试剂盒 Human Tumor necrosis factor &alpha ,TNF-&alpha ELISA试剂盒 人肿瘤坏死因子可溶性受体Ⅱ(TNFsR-Ⅱ)ELISA试剂盒 Human Tumor necrosis factor soluble receptor Ⅱ,TNFsR-Ⅱ ELISA试剂盒 人肿瘤坏死因子可溶性受体Ⅰ(TNFsR-Ⅰ)ELISA试剂盒 Human Tumor necrosis factor soluble receptor Ⅰ,TNFsR-ⅠELISA试剂盒 人转化生长因子&beta 1(TGF-&beta 1)ELISA试剂盒 Human Transforming Growth factor &beta 1,TGF-&beta 1 ELISA试剂盒 人转化生长因子&alpha (TGF-&alpha )ELISA试剂盒 Human transforming growth factor &alpha ,TGF-&alpha ELISA试剂盒 人基质细胞衍生因子1&beta (SDF-1&beta /CXCL12)ELISA试剂盒 Human Stromal cell derived factor 1&beta ,SDF-1&beta ELISA试剂盒 人干细胞因子受体(SCFR)ELISA试剂盒 Human Stem Cell Factor Receptor,SCFR ELISA试剂盒 人干细胞因子/肥大细胞生长因子(SCF/MGF)ELISA试剂盒 Human Stem cell factor/mast cell growth factor,SCF/MGF ELISA试剂盒 人可溶性CD40配体(sCD40L)ELISA试剂盒 Human Soluble Cluster of differentiation 40 ligand,sCD40L ELISA试剂盒 人可溶性CD30配体(sCD30L)ELISA试剂盒 Human Soluble Cluster of differentiation 30 ligand,sCD30L ELISA试剂盒 人正常T细胞表达和分泌因子(RANTES/CCL5)ELISA试剂盒 Human regulated on activation in normal T-cell expressed and secreted,RANTES ELISA试剂盒 人P选择素(P-Selectin/CD62P/GMP140)ELISA试剂盒 Human P-Selectin/CD62P/GMP140 ELISA试剂盒 人血血小板衍生生长因子AB(PDGF-AB)ELISA试剂盒 Human Platelet-Derived Growth Factor AB,PDGF-AB ELISA试剂盒 人血血小板衍生生长因子可溶性受体&alpha (PDGFsR-&alpha )ELISA试剂盒 Human Platelet-Derived Growth Factor Soluble Receptor &alpha ,PDGFsR-&alpha ELISA试剂盒 人神经营养因子4(NT-4)ELISA试剂盒 Human Neurotrophin 4,NT-4 ELISA试剂盒 人神经营养因子3(NT-3)ELISA试剂盒 人神经营养因子3(NT-3)ELISA试剂盒 人的神经生长因子(NGF)ELISA试剂盒 Human Nerve growth factor,NGF ELISA试剂盒 人巨噬细胞炎性蛋白3&beta (MIP-3&beta /ELC/CCL19)ELISA试剂盒 Human Macrophage Inflammatory Protein-3&beta ,MIP-3&beta ELISA试剂盒 人巨噬细胞炎性蛋白3&alpha (MIP-3&alpha /CCL20)ELISA试剂盒 Human Macrophage Inflammatory Protein-3&alpha ,MIP-3&alpha ELISA试剂盒 人巨噬细胞炎性蛋白1&beta (MIP-1&beta /CCL4)ELISA试剂盒 Human Macrophage Inflammatory Protein-1&beta ,MIP-1&beta ELISA试剂盒 人巨噬细胞炎性蛋白1&alpha (MIP-1&alpha /CCL3)ELISA试剂盒 Human Macrophage Inflammatory Protein-1&alpha ,MIP-1&alpha ELISA试剂盒 人巨噬细胞来源的趋化因子(MDC/CCL22)ELISA试剂盒 Human Macrophage-Derived Chemokine,MDC ELISA试剂盒 人巨噬细胞来源的趋化因子(MDC/CCL22)ELISA试剂盒 Human Macrophage-Derived Chemokine,MDC ELISA试剂盒 人巨噬细胞集落刺激因子(M-CSF)ELISA试剂盒 Human Macrophage Colony-Stimulating Factor,M-CSF ELISA试剂盒 人单核细胞趋化蛋白3(MCP-3/CCL7)ELISA试剂盒 Human monocyte chemotactic protein 3,MCP-3 ELISA试剂盒 人单核细胞趋化蛋白2(MCP-2/CCL8)ELISA试剂盒 Human monocyte chemotactic protein 2,MCP-2 ELISA试剂盒 人单核细胞趋化蛋白1(MCP-1/CCL2/MCAF)ELISA试剂盒 Human monocyte chemotactic protein 1/monocyte chemotactic and activating factor,MCP-1/MCAF ELISA试剂盒 人L选择素(L-Selectin/CD62L)ELISA试剂盒 Human L-Selectin ELISA试剂盒 人白介素9(IL-9)ELISA试剂盒 Human Interleukin 9,IL-9 ELISA试剂盒 人白介素8(IL-8/CXCL8)ELISA试剂盒 Human Interleukin 8,IL-8 ELISA试剂盒 人白介素6(IL-6)ELISA试剂盒 Human Interleukin 6,IL-6 ELISA试剂盒 人白介素-5(IL-5)ELISA试剂盒 Human Interleukin 5,IL-5 ELISA试剂盒 人白介素4(IL-4)ELISA试剂盒 Human Interleukin 4,IL-4 ELISA试剂盒 人白介素3(IL-3)ELISA试剂盒 Human Interleukin 3,IL-3 ELISA试剂盒 人白介素2可溶性受体&beta 链(IL-2sR&beta )ELISA试剂盒 Human Interleukin 2,IL-2 ELISA试剂盒 人白介素2可溶性受体&alpha 链(IL-2sR&alpha /CD25)ELISA试剂盒 Human soluble interleukin-2 receptor,IL-2sR&alpha ELISA试剂盒 人白介素2(IL-2)ELISA试剂盒 Human Interleukin 2,IL-2 ELISA试剂盒 人白介素1&alpha (IL-1&alpha )ELISA试剂盒 Human Interleukin 1&alpha ,IL-1&alpha ELISA试剂盒 人白介素1可溶性受体Ⅱ(IL-1sRⅡ)ELISA试剂盒 Human soluble interleukin-1 receptor Ⅱ,IL-1sRⅡ ELISA试剂盒 人白介素1可溶性受体Ⅰ(IL-1sRⅠ)ELISA试剂盒 Human soluble interleukin-1 receptor Ⅰ,IL-1sRⅠ ELISA试剂盒 人白介素16(IL-16)ELISA试剂盒 Human Interleukin 16,IL-16 ELISA试剂盒 人白介素13(IL-13)ELISA试剂盒 Human Interleukin 13,IL-13 ELISA试剂盒 人白介素12(IL-12/P70)ELISA试剂盒 Human Interleukin 12,IL-12/P70 ELISA试剂盒 人白介素12(IL-12/P40)ELISA试剂盒 Human Interleukin 12,IL-12/P40 ELISA试剂盒 人白介素11(IL-11)ELISA试剂盒 Human Interleukin 11,IL-11 ELISA试剂盒 人白介素10(IL-10)ELISA试剂盒 Human Interleukin 10,IL-10 ELISA试剂盒 人胰岛素样生长因子结合蛋白4(IGFBP-4)ELISA试剂盒 Human insulin-like growth factors binding protein 4,IGFBP-4 ELISA试剂盒 人胰岛素样生长因子结合蛋白3(IGFBP-3)ELISA试剂盒 Human insulin-like growth factors binding protein 3,IGFBP-3 ELISA试剂盒 人胰岛素样生长因子结合蛋白2(IGFBP2)ELISA试剂盒 Human insulin-like growth factors binding protein 2,IGFBP-2 ELISA试剂盒 人胰岛素样生长因子结合蛋白1(IGFBP-1)ELISA试剂盒 Human insulin-like growth factors binding protein 1,IGFBP-1 ELISA试剂盒 人胰岛素样生长因子2(IGF-2)ELISA试剂盒 Human insulin-like growth factors 2,IGF-2 ELISA试剂盒 人胰岛素样生长因子1(IGF-1)ELISA试剂盒 Human insulin-like growth factors 1,IGF-1 ELISA试剂盒 人&gamma 干扰素(IFN-&gamma )ELISA试剂盒 Human Interferon &gamma ,IFN-&gamma ELISA试剂盒 人细胞间粘附分子1(ICAM-1/CD54)ELISA试剂盒 Human intercellular adhesion molecule 1,ICAM-1 ELISA试剂盒 人肝细胞生长因子(HGF)ELISA试剂盒 Human hepatocyte growth factor,HGF ELISA试剂盒 人粒细胞巨噬细胞集落刺激因子(GM-CSF)ELISA试剂盒 Human Granulocyte-Macrophage Colony Stimulating Factor,GM-CSF ELISA试剂盒 人胶质细胞系来源的神经营养因子(GDNF)ELISA试剂盒 Human glial cell line-derived neurotrophic factor,GDNF ELISA试剂盒 人粒细胞集落刺激因子(G-CSF)ELISA试剂盒 Human Granulocyte Colony Stimulating Factor,G-CSF ELISA试剂盒 人中性粒细胞趋化蛋白2(NAP-2/CXCL7)ELISA试剂盒 Human neutrophil activating protein-2,NAP-2 ELISA试剂盒 人趋化因子(fractalkine/CX3CL1) ELISA试剂盒 Human fractalkine/CX3CL1 ELISA试剂盒 人碱性成纤维细胞生长因子9(bFGF-9)ELISA试剂盒 Human basic fibroblast growth factor 9,bFGF-9 ELISA试剂盒 人碱性成纤维细胞生长因子6(bFGF-6)ELISA试剂盒 Human basic fibroblast growth factor 6,bFGF-6 ELISA试剂盒 人碱性成纤维细胞生长因子4(bFGF-4)ELISA试剂盒 Human basic fibroblast growth factor 4,bFGF-4 ELISA试剂盒 人酸性成纤维细胞生长因子1(aFGF-1)ELISA试剂盒 Human acidic fibroblast growth factor 1,aFGF-1 ELISA试剂盒 人凋亡相关因子配体(FASL)ELISA试剂盒 Human Factor-related Apoptosis ligand,FASL ELISA试剂盒 人凋亡相关因子(FAS/CD95)ELISA试剂盒 Human Factor-related Apoptosis,FAS ELISA试剂盒 人E选择素(E-Selectin/CD62E)ELISA试剂盒 Human E-Selectin ELISA试剂盒 人嗜酸粒细胞趋化蛋白Eotaxin 1(Eotaxin 1/CCL11)ELISA试剂盒 Human Eotaxin 1 ELISA试剂盒 人鼠嗜酸粒细胞趋化因子(ECF)ELISA试剂盒 Human eosinophil chemotactic factor,ECF ELISA试剂盒 人内分泌腺来源的血管内皮生长因子(EG-VEGF)ELISA试剂盒 Human Endocrine gland vascular endothelial growth factor,EG-VEGF ELISA试剂盒 人睫状神经营养因子(CNTF)ELISA试剂盒 Human Ciliary Neurotrophic Factor,CNTF ELISA试剂盒 人CD30分子(CD30)ELISA试剂盒 Human Cluster of differentiation 30,CD30 ELISA试剂盒 人CXC趋化因子受体1(CXCR1)ELISA试剂盒 Human CXC-chemokine receptor 1,CXCR1 ELISA试剂盒 人XC趋化因子受体1(XCR1)ELISA试剂盒 Human XC-chemokine receptor 1,XCR1 ELISA试剂盒 人二级淋巴组织趋化因子(SLC/CCL21)ELISA试剂盒 Human secondary lymphoid-tissue chemokine,SLC ELISA试剂盒 人E钙粘着蛋白/上皮性钙黏附蛋白(E-Cad)ELISA试剂盒 Human E-Cadherin,E-Cad ELISA试剂盒 人脑源性神经营养因子(BDNF)ELISA试剂盒 Human Brain derived neurotrophic facor,BDNF ELISA试剂盒 人白细胞活化黏附因子(ALCAM)ELISA试剂盒 Human Activated Leukocyte Cell Adhesion Molecule,ALCAM ELISA试剂盒 人活化素A(ACV-A)ELISA试剂盒 Human Activin A,ACV-A ELISA试剂盒 人神经调节蛋白1(NRG-1)ELISA试剂盒 human Neuregulin 1,NRG-1 ELISA试剂盒 人心钠肽(ANP)ELISA试剂盒 Human Atrial Natriuretic Peptide,ANP ELISA试剂盒 人多巴胺D2受体(D2R)ELISA试剂盒 Human dopamine D2 receptor,D2R ELISA试剂盒 人内吗啡肽-2(EM-2)ELISA试剂盒 Human endomorphin-2,EM-2 ELISA试剂盒 人&alpha -内吗啡肽(&alpha -EP)ELISA试剂盒 Human &alpha -Endomorphin,&alpha -EP ELISA试剂盒 人抑制素(INH)ELISA试剂盒 Human Inhibin,INH ELISA试剂盒 人神经元凋亡抑制蛋白(NAIP)ELISA试剂盒 Human neuronal apoptosis inhibitory protein,NAIP ELISA试剂盒 人食欲素/阿立新B(OX-B)ELISA试剂盒 Human Orexin B,OX-B ELISA试剂盒 人促睡眠肽(DSIP)ELISA试剂盒 Human delta sleep-inducing peptide,DSIP ELISA试剂盒 人6-羟多巴胺(6-OHDA)ELISA试剂盒 Human 6-hydroxydopamine,6-OHDA ELISA试剂盒 人心纳素(ANF)ELISA试剂盒 Human atrial natriuretic factor,ANF ELISA试剂盒 人神经髓鞘蛋白(p2)ELISA试剂盒 Human myelin protein 2,p2 ELISA试剂盒 人精氨酸加压素(AVP)ELISA试剂盒 Human arginine vasopressin,AVP ELISA试剂盒 人垂体腺苷酸环化酶激活肽(PACAP)ELISA试剂盒 Human pituitary adenylate cyclase activating polypeptide,PACAP ELISA试剂盒 人微管相关蛋白2(MAP-2)ELISA试剂盒 Human microtubule-associated protein 2,MAP-2 ELISA试剂盒 人神经丝蛋白(NF)ELISA试剂盒 Human neurofilament protein,NF ELISA试剂盒 人利钾尿肽(KP)ELISA试剂盒 Human kaliuretic peptide,KP ELISA试剂盒 人神经降压素(NT)ELISA试剂盒 Human Neurotensin,NT ELISA试剂盒 人神经激肽B(NKB)ELISA试剂盒 Human Neurokinins B,NKB ELISA试剂盒 人强啡肽(Dyn)ELISA试剂盒 Human dynorphin,Dyn ELISA试剂盒 人脑啡肽(ENK)ELISA试剂盒 Human enkephalin,ENK ELISA试剂盒 人&gamma 肽(P&gamma )ELISA试剂盒 Human Peptide &gamma ,P&gamma ELISA试剂盒 人C型钠尿肽(CNP)ELISA试剂盒 Human C -type natriuretic peptide,CNP ELISA试剂盒 人阿立新A(Orexin A)ELISA试剂盒 Human Orexin A ELISA试剂盒 人神经肽Y(NP-Y)ELISA试剂盒 Human neuropeptide Y,NP-Y ELISA试剂盒 人脑肠肽(BGP/Gehrelin)ELISA试剂盒 Human brain-gut peptides,BGP/Gehrelin ELISA试剂盒 人乙酰胆碱(ACH)ELISA试剂盒 Human acetylcholine,ACH ELISA试剂盒 人脑钠素/脑钠尿肽(BNP)ELISA试剂盒 Human brain natriuretic peptide,BNP ELISA试剂盒 人细胞角蛋白20(CK20)ELISA试剂盒 Human cytokeratin 20,CK20 ELISA试剂盒 人&beta 内啡肽(&beta -EP)ELISA试剂盒 human Beta-Endorphin,&beta -EP ELISA试剂盒 人N端前脑钠素(NT-proBNP)ELISA试剂盒 Human N-terminal pro-brain natriuretic peptide,NT-proBNP ELISA试剂盒 人前心钠肽(Pro-ANP)ELISA试剂盒 Human Pro Atrial Natriuretic Peptide,Pro-ANP ELISA试剂盒 人细胞角蛋白13(CK-13)ELISA试剂盒 Human cytokeratin 13,CK-13 ELISA试剂盒 人细胞角蛋白17(CK17)ELISA试剂盒 Human cytokeratin 17,CK-17 ELISA试剂盒 人制瘤素M受体(OSMR)ELISA试剂盒 human oncostatin M receptor,OSMR ELISA试剂盒 人B细胞淋巴瘤因子3(Bcl3)ELISA试剂盒 human B-cell leukemia/lymphoma 3,Bcl3 ELISA试剂盒 人癌蛋白诱导转录物3(OIT3)ELISA试剂盒 human oncoprotein induced transcript 3,OIT3 ELISA试剂盒 人P27蛋白(P27)ELISA试剂盒 Human P27 protein ELISA试剂