苯乙酸是医药、农药、香料等有机合成的中间体。在医药工业中用于青霉素、地巴唑等药物的生产。苯乙酸经氯化、酯化得到α-氯代苯乙酸乙酯,用于稻丰散和乙基稻丰散的生产,这两种农药是广谱性有机磷杀虫剂。苯乙酸本身也是农药植物生长激素。苯乙酸广泛存在于葡萄、草莓、可可、绿茶、蜂蜜等中。苯乙酸在低浓度时具有甜蜂蜜味,在1ppm以下仍具有甜味,是一种重要的香料成分。苯乙酸还具有很强的杀菌作用。
如题,在合成中有一步反应是用邻羟基苯乙酸制备其二钠盐,其中产物中可能含有的成分有邻羟基苯乙酸、邻羟基苯乙酸的一钠盐、二钠盐,请问如何建立检测方法将其分离呢?谢谢! 试过液相的方法,但是分不开,也试过双相滴定,但是里面还有过量的NaOH,影响结果,也试过用酚羟基的显色反应,但这个又太灵敏了,无法定量。请大家指导一下吧。
[color=#444444]甲酰基苯乙酸甲酯的色谱含量测试中。由于甲酰基苯乙酸甲酯会有醇酮互变性质,在液相色谱(乙腈:水=50:50)下出现三个峰。但是在LC——MS下从第一个峰开始到第三个峰这之间所有的时间都出现了M+1峰(包括峰之间的)。谁能告诉我这是怎么回事。[/color][color=#444444]有哪个大侠做过甲酰基苯乙酸甲酯的含量测试的,求指导。[/color]
求助各位同行:苯乙酸的国标或行标(HGB3444-62)全文.多谢了.我的邮箱:zjp9933@163.com
[font=Helvetica Neue,Helvetica,PingFang SC,Tahoma,Arial,sans-serif][size=14px][color=#333333]4-羟基苯乙酸酯[/color][/size][/font],[font=Helvetica Neue,Helvetica,PingFang SC,Tahoma,Arial,sans-serif][size=14px][color=#999999]CAS No.:[b]58556-55-1[/b][/color][/size][/font][font=Helvetica Neue,Helvetica,PingFang SC,Tahoma,Arial,sans-serif][size=14px][color=#999999]分子式:C[sub]1[/sub][sub]0[/sub]H[sub]1[/sub][sub]2[/sub]O[sub]3[/sub][/color][/size][/font]
[color=#d40a00][size=2]维权声明:本文为[font=Times New Roman]11093661[/font]原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。[/size][/color] 青霉素发酵过程中利用液相分析对发酵液中的苯乙酸,效价检测存在着很是矛盾的主体,那就是发酵过程中的效价检测是批量检测,在检测过程中青霉素效价有高有低,这样就不利于药典中规定的标准品与待测品的含量大致相同的规定,这就不可能每做一个样品就做一个标准,这样不实际也不利于节约成本的。那么就需要我们做一个线性范围来使在实际检测的过程中的效价范围在线性范围类,这样就有利于测样的准确性。本人通过长期反复工作实践发现在青霉素发酵过程中发酵液的稀释倍数在100倍以上时,出现了这样一个情况:在检测效价的过程中对苯乙酸检测的结果很不稳定,特别是长期工作的液相更是如此,本人在工作中试验发现原因主要是基线的漂移造成了这个现象。而检测苯乙酸对生产发酵中的地位相当重要,苯乙酸是青霉素发酵过程中的主要原材料之一,而苯乙酸的多少又决定了发酵水平高低。所以说苯乙酸的检测也同样重要。 而效价,苯乙酸是同时检测出来的,如果稀释倍数大于100后解决了效价检测的准确性得到了提高,但是苯乙酸的检测准确性也就低了。所以这个矛盾主体也就出现了。本人在长期的检测中实践发现如果分开来检测,也就是两次检测,而对于两次检测过程中的效价与苯乙酸两种物质稀释倍数采取不同的稀释倍数这样有利于检测结果的准确性。或者对苯乙酸检测采取[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]检测同时稀释倍数根据苯乙酸残量的多少采取不同的稀释倍数这样有利于检测结果的准确性,重现性。而根据本人了解某特大型青霉素发酵公司也就是只是对效价采取的稀释倍数的不同,这样提高了效价的准确性而导致了苯乙酸残量的检测的准确性也就降低了,导致发酵水平无法与成都某特大型青霉素发酵公司的水平相比较。这就说明了苯乙酸检测尤为重于效价检测。而分两次检测或气,液相同时检测这样不利于成本降低,本人通过长期的摸索,比较发现利用苯乙酸的多少来决定稀释倍数后,再根据效价的高低采取不同的标准品的含量,这样就利于检测的准确性与成本的降低——相当于分段检测。 本人事先声明这个纯属个人自己摸索试验得出的结论,在实际生产,检测中虽然得到了应用,但由于自己的试验结果,水平有限所以具体过程没有完全介绍,十分抱歉。
目前所做项目需要液相检测联苯乙腈(原料)和联苯乙酸(产物),但两者出峰时间一致,已尝试多种方法进行混合样分离,但始终只有一个尖峰显示,没有任何分离趋势,目前试过的方法有:甲醇:0.05%磷酸水=70:30(C-18长柱);乙腈:水=70:30;乙腈:0.1%氨水水溶液=70:30(NX-C18);甲醇:0.1%醋酸水=55:45(C18短柱)。求助是否有可行的方法能够较好的分离两种物质。谢谢。
完全按GB29708-2013的方法处理,衍生化后质谱检不出五氯苯乙酸酯,不知道哪里有问题!请做过这个项目的指点。
[color=#444444]求助一下啊!!!![/color][color=#444444]我做的羟基苯乙酸去送样,结果GC分析人员做出了两个峰,做了两次都是这样。[/color][color=#444444]我的样品应该是纯的,是分析方法不对,还是其它什么原因啊?有没有哪个遇到这个的情况呢?求助哈[/color]
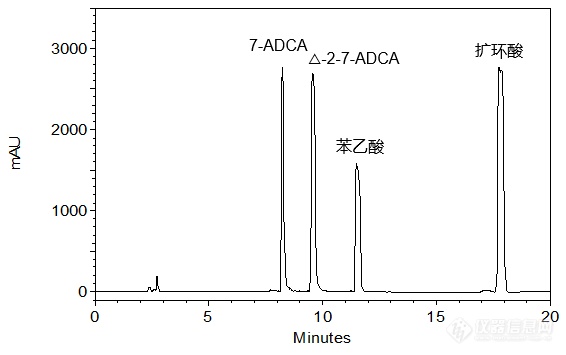
[align=center][b]4种头孢中间体的共同分析[/b][/align][align=right][b]——7-ADCA、△-2-7-ADCA、苯乙酸及扩环酸的分析[/b][/align][align=right][b][/b][/align]客户提供了7-ADCA(7-氨基去乙酰氧基头孢烷酸),△-2-7-ADCA、苯乙酸及扩环酸原料,希望本实验室依据客户所提供的色谱条件筛选合适的C[sub]18[/sub]色谱柱,实现以上4种化合物的稳定良好分析。本实验室参考客户提供的色谱条件,首先尝试使用经过聚合物包被处理的中等极性色谱柱——CAPCELL PAK C[sub]18[/sub] MGII对客户所提供样品进行分析,使用PDA检测器进行检测。如图1,在高浓度大体积进样的情况下,各色谱峰发生严重过载现象,出现平头峰;如图2,降低进样体积至5 μL可得到相对良好峰形,且各组分间能够得到良好分离,分离度均在10.0以上(结果详见表1)。[align=center][img=,566,355]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101537444868_8925_2222981_3.png!w566x355.jpg[/img][/align][align=center]图1 CAPCELL PAK C[sub]18 [/sub]MGII色谱柱分析结果(进样量:50 μL)[/align][align=center][img=,575,365]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101545063985_5910_2222981_3.png!w575x365.jpg[/img][/align][align=center]图2 CAPCELL PAK C[sub]18 [/sub]MGII色谱柱分析结果(进样量:5 μL)[/align][align=center] [/align][align=center]表1 CAPCELL PAK C[sub]18[/sub] MGII分析结果详表(进样量:5 μL)[/align][align=center][img=,553,136]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101537465105_7074_2222981_3.png!w553x136.jpg[/img][/align][align=center][/align][align=left][img=,579,319]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101545307700_4011_2222981_3.png!w579x319.jpg[/img][/align][align=left][/align][align=left]为使客户有更多色谱柱选择,本实验室也尝试了能够在纯水系流动相下稳定使用的高极性色谱柱——CAPCELL PAK C[sub]18[/sub] AQ进行分析。如图3,几种头孢中间体的整体保留有所增强,而高浓度上样仍会出现与MGII色谱柱相似的过载现象;如图4,降低进样体积进行分析,可得到良好结果,同时发现扩环酸有一定程度的拖尾(见表2)。[/align][align=center][/align][align=center][img=,527,377]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101546103944_1716_2222981_3.png!w527x377.jpg[/img][/align][align=center]图3 CAPCELL PAK C[sub]18 [/sub]AQ色谱柱分析结果(进样量:50 μL)[/align][align=center][img=,525,374]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101546123571_3070_2222981_3.png!w525x374.jpg[/img][/align][align=center]图4 CAPCELL PAK C[sub]18 [/sub]AQ色谱柱分析结果(进样量:5 μL)[/align][align=center] [/align][align=center]表2 CAPCELL PAK C[sub]18 [/sub]AQ分析结果详表(进样量:5 μL)[/align][align=center][img=,558,135]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101546125551_7090_2222981_3.png!w558x135.jpg[/img][/align][align=center][/align][align=left][img=,577,319]http://ng1.17img.cn/bbsfiles/images/2018/05/201805101547424196_8227_2222981_3.png!w577x319.jpg[/img][/align][align=left][/align][align=left]综上实验结果,使用中等极性色谱柱CAPCELL PAK C[sub]18 [/sub]MGII S5 4.6 mm i.d. × 250 mm和高极性色谱柱CAPCELL PAK C[sub]18[/sub] AQ S5 4.6 mm i.d. × 250 mm,以磷酸盐缓冲液(pH 6.0)-乙腈为流动相体系,在30°C柱温条件下进行梯度分析,均能够实现7-ADCA、△-2-7-ADCA、苯乙酸和扩环酸的良好分离,其中,CAPCELL PAK C[sub]18[/sub] MGII色谱柱所得峰形更佳。[/align]
最近做瘦肉精发现福莫特罗和苯乙醇胺a分不开啊,同分异构体,大家有什么办法教教我啊
饮用水一般来源于自来水、桶装水和井水。自来水需经过消毒后才能饮用,其消毒方式一般包括氯消毒(液氯、次氯酸钠消毒等)和二氧化氯消毒。氯消毒因成本低廉的优点,目前是我国大型水厂的主流消毒方式。除卤代烃外,常见的含氯消毒副产物还有亚氯酸盐、氯酸盐、二氯乙酸和三氯乙酸等。这四种消毒副产物目前成为生活饮用水的常规检测项目,因此如何分离这四种消毒副产物成为目前一大热点。本文探索并开发[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]分离亚氯酸盐、氯酸盐、二氯乙酸和三氯乙酸的方法。首先是色谱柱和定量环的选择。由于一般饮用水中亚氯酸盐、氯酸盐、二氯乙酸和三氯乙酸在水中的检测值较低,因此需要采用大定量环测定,选择定量环体积为是500μL。实验所用 IonPac AS19分离柱亲水性好,柱容量高,能够满足生活饮用水中常见离子、卤乙酸及卤氧乙酸的同时测定。选择KOH作为淋洗液,利用淋洗液在线发生技术实现梯度洗脱,经过 AERS4 mm自动再生微膜抑制器抑制后产物为水,背景电导低,水负峰不明显,能够实现大体积进样,显著提高方法的灵敏度。淋洗液梯度的选择。选择以初始浓度分别为8、12、15 mmol/L来进行实验,结果表明,当初始浓度为8 mmol/L时,分离效果较好,使用初始浓度为12 mmol/L时,三氯乙酸受到硫酸盐的前延展性峰的干扰,分离效果不好;当浓度为15 mmol/L时,出峰速度较快,四种消毒副产物分离效果不好。由于三氯乙酸极性较大,需要采用梯度淋洗方法将进行洗脱。当选择(20-32)min匀速升至25 mmol/L,保持2 min,可以将保留时间较长的三氯乙酸尽快洗脱出来,且分离效果较好,减少检测所用时间,增加方法的实用性。梯度洗脱程序如表[align=center]表 四种消毒副产物的梯度洗脱程序[/align][table][tr][td]时间(min)[/td][td]梯度浓度C[sub]NaOH[/sub](mmol/L)[/td][/tr][tr][td]0-20[/td][td]8[/td][/tr][tr][td]20-32[/td][td]8-25[/td][/tr][tr][td]32-34[/td][td]25[/td][/tr][tr][td]34[/td][td]8[/td][/tr][/table]实际样品的测定。先对预先活化Ag柱、Ba柱和H柱,分别用注射器以2 mL/min 的流速将10mL超纯水过柱,静置10 min使其充分平衡。然后直接取适量水样,以2 mL / min的速度依次通过串联的Ag 柱、Ba 柱、H柱和0. 22 μm针式滤器,弃去前面 6 mL后开始收集滤液,滤液直接进样测试。可以明显去除氯离子和硫酸盐的含量,减少干扰峰的影响。实验中注意事项和建议先使用标准溶液分离这四种消毒副产物,再对三氯乙酸加标水样进行测定分离,确保三氯乙酸和硫酸盐可以有很好的分离度。二氧化碳装置使用。如果装有二氧化碳装置会大大降低硫酸根前延展性峰的干扰。使分离效果更好。
IC-测定饮用水中亚氯酸盐、氯酸盐、溴酸盐、二氯乙酸及三氯乙酸
水质检测氯酸盐、二氯乙酸、三氯乙酸,HJ 1050-2019中测定是用氢氧化钠溶液定容,GB 5750-2022中测定直接用纯水定容,两者有什么区别吗?
各位大神,有个问题想请教,做生活饮用水中消毒副产物,氯酸盐,二氯乙酸,三氯乙酸这三项,曲线没问题,样品做出来值挺高,超标了,这种情况怎么排查原因?[img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272204459696_1620_3570477_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272204462364_7396_3570477_3.png[/img]
各位大神,有个问题想请教,做生活饮用水中消毒副产物,氯酸盐,二氯乙酸,三氯乙酸这三项,曲线没问题,样品做出来值挺高,超标了,这种情况怎么排查原因?[img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272135252703_8417_3570477_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2024/08/202408272135253543_6790_3570477_3.png[/img]
SH-AP-2型阴离子交换柱分析应用研究[font=宋体]Ⅲ[/font][align=center]—[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水样中高氯酸盐和三氯乙酸[/align][align=center]十月[/align]摘要:【目的】建立以SH-AP-2型阴离子交换柱为分离柱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url][font=times new roman][size=18px]-[/size][/font]抑制电导检测法同时测定水样中高氯酸盐和三氯乙酸的新方法。【方法】试验研究同时测定高氯酸盐和三氯乙酸的色谱条件和可行性,优化确定色谱条件。【结果】以SH-AP-2型阴离子交换柱为分离柱,以15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,流量为0.80mL/min,采用等度洗脱的方式可将高氯酸盐、三氯乙酸与硫酸盐等水中常见阴离子完全分离,通过抑制电导检测,高氯酸盐、三氯乙酸的峰面积与其质量浓度均在0.10~3.0mg/L范围内呈良好的线性关系,相关系数分别为0.9994和0.9993,方法应用于水样中高氯酸盐、三氯乙酸的同时测定,加标回收率分别为:90.0%~98.0%和91.6%~98.1%, 5次平行测定的相对标准偏差(RSD)小于6%,方法可在25min以内完成高氯酸盐、三氯乙酸的同时测定,简便快速。【结论】本方法可用于水样中高氯酸盐、三氯乙酸的同时测定。关键词:[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法;水;高氯酸盐;三氯乙酸;中图分类号:O652.63 文献标识码: 文章编号:高氯酸盐是具有高度扩散性的有毒污染物,多存在于地表水中,水中高氯酸盐的主要来源是火箭推进剂和烟花炸药等,其主要危害是妨碍甲状腺吸收碘,造成甲状腺素的合成量减少,进而阻碍人体生长发育,尤其是对孕妇和儿童的影响较为明显[sup][1-2][/sup],在GB5749-2022《生活饮用水卫生标准》中作为扩展指标,并规定其限值为0.07mg/L[sup][3][/sup]。三氯乙酸(TCAA)是饮水在氯化消毒的过程中产生的副产物,具有潜在致癌、致畸、致突变的风险[sup][4-5][/sup]。我国《生活饮用水卫生标准》GB5749-2022中作为毒理学指标,并规定其限值为0.1mg/L[sup][3][/sup]。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法以其独特优势在环保、卫生等行业中得到广泛的应用。目前,测定高氯酸盐[sup][1-2][/sup]和三氯乙酸[sup][4-5][/sup]的[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]方法报道较多,但这些方法大多使用的是IonPac AS19柱,以KOH淋洗液梯度洗脱[sup][1,4-5][/sup],或IonPac AS16柱,KOH淋洗液等度洗脱[sup][2][/sup]方式进行,用SH-AP-2型阴[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱作分离柱,以Na[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水中高氯酸盐和三氯乙酸文献似未见报道。本试验[font=times new roman]通过优化相关色谱条件[/font],建立了以SH-AP-2型阴离子交换柱为分离柱,以15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,流量为0.80mL/min等度洗脱抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水样中高氯酸盐和三氯乙酸的新方法。加标回收率分别为:90.0%~98.0%和91.6%~98.1%,测定结果的相对标准偏差分别为3.98%~5.00%和2.46%~5.45%(n=5),方法的检出限分别0.05mg/L和0.03mg/L 。1、试验部分1.1主要仪器CIC-100型[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url](青岛盛瀚色谱公司,编号15601),抑制器:自再生抑制器,检测器:电导检测器,定量环体积为25μL;SHA—15自动进样器(青岛盛瀚色谱公司,编号AS1518050);SH-AP-2型阴离子交换柱(250×4.0mm i.d,青岛盛瀚色谱公司,批号:2004005);SH-AP-2型保护柱(50×4.0mm i.d,青岛盛瀚色谱公司,批号:G200023)。1.2 仪器工作条件及参数设置色谱仪:柱箱温度35℃,电流:75mA,量程:1档。自动进样器:全定量环取样,取样后清洗(每针之间),置换量70μL,取样量25μL,扎针深度4mm。1.3主要试剂高氯酸钾、三氯乙酸、磷酸二氢钾、溴化钾:分析纯,国药集团化学试剂有限公司。ClO[sub]4[/sub][sup]-[/sup]标准溶液:1000 mg/L,按照文献[1]配制;TCAA[sup]-[/sup]标准溶液:1000 mg/L,按照文献[6]配制;H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]和Br[sup]-[/sup]标准溶液:1000 mg/L,按照文献[7]配制。 NO[sub]3[/sub][sup]-[/sup]、F[sup]-[/sup]、Cl[sup]-[/sup]、SO[sub]4[/sub][sup]2-[/sup]标准溶液:[color=black]质量浓度[/color]均为1000 mg/L,编号分别为GBW(E)080264、GBW(E)080549、GBW(E)080268、GBW(E)080266;NO[sub]2[/sub][sup]-[/sup]标准溶液:[color=black]质量浓度[/color]为100 mg/L,编号为GBW(E)080223,北京中国计量科学研究院。用前将上述标准溶液用纯水稀释成含ClO[sub]4[/sub][sup]-[/sup]、TCAA各10.0 mg/L混合标准应用液备用。无水碳酸钠(分析纯,国药集团化学试剂有限公司),碳酸氢钠(分析纯,国药集团化学试剂有限公司)。试验所用试剂均为AR及以上级,试验用水为超纯水(18.2ΜΩcm)。1.4 试验方法1.4.1 标准曲线的绘制 取混合标准应用液0.10、0.20、0.50、1.0、2.0和3.0 mL于10mL容量瓶中加纯水至刻度,混匀,配制成含ClO[sub]4[/sub][sup]-[/sup]、TCAAC均为0.10~3.0 mg/L的标准系列,各管取1.5mL于样品瓶中,启动自动进样器进样分别测定各组份的峰面积(S),以S对各组份浓度绘制工作曲线。1.4.2 样品测定 取水样在微波炉上加热浓缩1倍后经0.45μm滤膜过滤后取1.5mL于样品瓶中,启动自动进样器进样测定各组份的峰面积(S),以标准曲线法定量,同时进行加标回收试验。2、结果与讨论2.1 色谱条件的选择2.1.1 淋洗液的选择 试验结果表明,在SH-AP-2型分离柱上ClO[sub]4[/sub][sup]-[/sup]和TCAA是强保留组分,二者均在SO[sub]4[/sub][sup]2-[/sup][size=12px]后[/size]出峰(出峰顺序为SO[sub]4[/sub][sup]2-[/sup]、TCAA和ClO[sub]4[/sub][sup]-[/sup]),因此选用洗脱能力较强的Na[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液进行试验,结果显示当Na[sub]2[/sub]CO[sub]3[/sub]溶液浓度分别为10.0、12.0和15.0 mmol/L时,ClO[sub]4[/sub][sup]-[/sup]的保留时间(T)分别为23、21和19分多钟,试验结果见表1。从表1可见,各组分的峰分离度(R)在3.26~8.91,说明SO[sub]4[/sub][sup]2-[/sup]、TCAA和ClO[sub]4[/sub][sup]-[/sup]三组分能完全分离,为了缩短保留时间,本试验以15.0 mmol/L的Na[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液。[align=center]表1 Na[sub]2[/sub]CO[sub]3[/sub]溶液浓度对分离情况的影响(流量0.80 ml/min,柱温35℃)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]10.0mmol/L[/align][/td][td=2,1][align=center]12.0mmol/L[/align][/td][td=2,1][align=center]15.0mmol/L[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO[sub]4[/sub][sup][size=13px]2-[/size][/sup][/align][/td][td][align=center]10.818[/align][/td][td][align=center]3.26[/align][/td][td][align=center]9.180[/align][/td][td][align=center]4.19[/align][/td][td][align=center]7.821 [/align][/td][td][align=center]4.78[/align][/td][/tr][tr][td][align=center]TCAA[/align][/td][td][align=center]13.361[/align][/td][td][align=center]8.91[/align][/td][td][align=center]12.226[/align][/td][td][align=center]8.74 [/align][/td][td][align=center]11.311 [/align][/td][td][align=center]8.71[/align][/td][/tr][tr][td][align=center]ClO[sub]4[/sub][sup]-[/sup][size=12px] [/size][/align][/td][td][align=center]23.856[/align][/td][td][align=center]/[/align][/td][td][align=center]21.619[/align][/td][td][align=center]/[/align][/td][td][align=center]19.667 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.1.2淋洗液流量的选择 当淋洗液组成和浓度一定时,淋洗液流量对组分的T和R有明显的影响,本试验淋洗液流量在0.70mL/min~0.90mL/min时SO[sub]4[/sub][sup]2-[/sup]和TCAA的R在3.71以上,满足组分完全分离的要求[sup][8][/sup],随着流量的升高,组分的峰面积逐渐降低,见表2。为使各组分有适宜的保留时间、较高峰面积和峰分离度,系统有较低的压力,本试验淋洗液流量选定为0.80mL/min。[align=center]表2 淋洗液流量对保留时间、峰面积和峰分离度的影响(15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub],柱温35℃)[/align][table][tr][td=1,2][align=center][color=black]组分([/color][size=13px][color=black]mg/L)[/color][/size][/align][/td][td=3,1][align=center][color=black]0.70ml/min[/color][/align][/td][td=3,1][align=center][color=black]0.80ml/min[/color][/align][/td][td=3,1][align=center][color=black]0.90ml/min[/color][/align][/td][/tr][tr][td][align=center][color=black]T/min[/color][/align][/td][td][align=center][color=black]S[/color][/align][/td][td][align=center][color=black]R[/color][/align][/td][td][align=center][color=black]T/min[/color][/align][/td][td][align=center][color=black]S[/color][/align][/td][td][align=center][color=black]R[/color][/align][/td][td][align=center][color=black]T/min[/color][/align][/td][td][align=center][color=black]S[/color][/align][/td][td][align=center][color=black]R[/color][/align][/td][/tr][tr][td][align=center][color=black]SO[/color][sub][color=black]4[/color][/sub][sup][size=13px]2-[/size][/sup][color=black](50)[/color][/align][/td][td][align=center][color=black]9.207[/color][/align][/td][td][align=center][color=black]7967106[/color][/align][/td][td][align=center][color=black]4.14[/color][/align][/td][td][align=center][color=black]8.094[/color][/align][/td][td][align=center][color=black]6842709[/color][/align][/td][td][align=center][color=black]4.43[/color][/align][/td][td][align=center][color=black]7.218[/color][/align][/td][td][align=center][color=black]6038981[/color][/align][/td][td][align=center][color=black]3.71[/color][/align][/td][/tr][tr][td][align=center]TCAA[color=black](1)[/color][/align][/td][td][align=center][color=black]13.263[/color][/align][/td][td][align=center][color=black]32517[/color][/align][/td][td][align=center][color=black]6.73[/color][/align][/td][td][align=center][color=black]11.678[/color][/align][/td][td][align=center][color=black]30346[/color][/align][/td][td][align=center][color=black]7.05[/color][/align][/td][td][align=center][color=black]10.382[/color][/align][/td][td][align=center][color=black]26138[/color][/align][/td][td][align=center][color=black]6.19[/color][/align][/td][/tr][tr][td][align=center][color=black]ClO[/color][sub][color=black]4[/color][/sub][sup][color=black]-[/color][/sup][size=12px][color=black] (1)[/color][/size][/align][/td][td][align=center][color=black]22.878[/color][/align][/td][td][align=center][color=black]61905[/color][/align][/td][td][align=center][color=black]/[/color][/align][/td][td][align=center][color=black]20.073[/color][/align][/td][td][align=center][color=black]50148[/color][/align][/td][td][align=center][color=black]/[/color][/align][/td][td][align=center][color=black]17.979[/color][/align][/td][td][align=center][color=black]43194[/color][/align][/td][td][align=center][color=black]/[/color][/align][/td][/tr][/table]2.1.3 柱箱温度的确定 考察了30℃、35℃和40℃时各组分的分离效果,结果见表3,从表3可见,在30℃~40℃范围内,各组分均能较好的分离,其R值均在4.24以上,且随着柱温的升高组分的T稍微缩短,在保证各组分有适宜的R和T的前提下尽量使用较低的柱温,故本试验确定柱箱温度为35℃。[align=center]表3 柱箱温度对分离度和保留时间的影响(15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub],流量0.80 ml/min)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]30℃[/align][/td][td=2,1][align=center]35℃[/align][/td][td=2,1][align=center]40℃[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO[sub]4[/sub][sup][size=13px]2-[/size][/sup][/align][/td][td][align=center]8.076[/align][/td][td][align=center]4.24[/align][/td][td][align=center]8.094[/align][/td][td][align=center]4.25 [/align][/td][td][align=center]8.127 [/align][/td][td][align=center]4.43 [/align][/td][/tr][tr][td][align=center]TCAA[/align][/td][td][align=center]11.755[/align][/td][td][align=center]7.98[/align][/td][td][align=center]11.693[/align][/td][td][align=center]7.15 [/align][/td][td][align=center]11.549 [/align][/td][td][align=center]6.87 [/align][/td][/tr][tr][td][align=center]ClO[sub]4[/sub][sup]-[/sup][size=12px] [/size][/align][/td][td][align=center]21.102[/align][/td][td][align=center]/[/align][/td][td][align=center]20.157[/align][/td][td][align=center]/[/align][/td][td][align=center]19.129 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.2[color=black]线性方程、线性范围与检出限[/color]按照1.4.1配制标准系列,测定TCAA和ClO[sub]4[/sub][sup]-[/sup]的峰面积(S)和峰高(H),以S、H为纵坐标,以其质量浓度(C)为横坐标绘制标准曲线,进行线性回归。测定仪器30min的基线噪声[sup][9][/sup],以3倍基线噪声除以标准曲线的斜率(3N/b)计算TCAA和ClO[sub]4[/sub][sup]-[/sup]的最低检出限。其标准曲线的线性范围、回归方程、相关系数r(回归方程的截距、斜率和r均由仪器软件自动生成)、检出限列于表4。从表4可见,TCAA和ClO[sub]4[/sub][sup]-[/sup]的峰面积及峰高与其质量浓度均在0.10~3.0mg/L范围内呈良好的线性关系,相关系数r在0.9993~0.9998,TCAA和ClO[sub]4[/sub][sup]-[/sup]检出限(以峰面积计)分别为0.05mg/L和0.03mg/L。其中,2.0mg/L的TCAA和ClO[sub]4[/sub][sup]-[/sup]标准溶液色谱图见图1。[align=center]表4 标准曲线试验结果[/align][table][tr][td][align=center]组分[/align][/td][td][align=center]线性范围/mg/L[/align][/td][td][align=center]回归方程[/align][/td][td][align=center]相关系数/r[/align][/td][td][align=center]检出限/mg/L[/align][/td][/tr][tr][td=1,2][align=center]TCAA[/align][/td][td=1,2][align=center]0.10~3.0[/align][/td][td][align=center]S=37380C-1346[/align][/td][td][align=center]0.9994[/align][/td][td][align=center]0.05[/align][/td][/tr][tr][td][align=center]H=931C-10.51[/align][/td][td][align=center]0.9997[/align][/td][td][/td][/tr][tr][td=1,2][align=center]ClO[sub]4[/sub][sup]-[/sup][size=12px] [/size][/align][/td][td=1,2][align=center]0.10~3.0[/align][/td][td][align=center]S=74740C-2845[/align][/td][td][align=center]0.9993[/align][/td][td][align=center]0.03[/align][/td][/tr][tr][td][align=center]H=1329C-21.60[/align][/td][td][align=center]0.9998[/align][/td][td][/td][/tr][/table][align=center]图1 TCAA和ClO[sub]4[/sub][sup]-[/sup]的标准色谱图[/align]2.3 [color=black]共存物质的影响[/color]考察了F[sup]-[/sup]、Cl[sup]-[/sup]、NO[sub]2[/sub][sup]-[/sup]、Br[sup]-[/sup]、NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]、SO[sub]4[/sub][sup]2-[/sup]等7种常见阴离子对TCAA和ClO[sub]4[/sub][sup]-[/sup]测定结果的影响,结果见图2,从图2可知,在本试验条件下,[color=black]7种[/color]阴离子均在TCAA和ClO[sub]4[/sub][sup]-[/sup]前出峰,且F[sup]-[/sup]、Cl[sup]-[/sup]、NO[sub]2[/sub][sup]-[/sup]、Br[sup]-[/sup]的保留时间远小于TCAA和ClO[sub]4[/sub][sup]-[/sup],只有NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup]、SO[sub]4[/sub][sup]2-[/sup](三者合并为一个峰)与TCAA的保留时间较为接近,为此考察了[color=black]10.0mg/L的[/color]NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][color=black],200.0mg/L的[/color]SO[sub]4[/sub][sup]2-[/sup][color=black]对[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup](均为1.0[color=black]mg/L[/color])测定结果的影响,[color=black]结果见图3,[/color]从图3可知,200倍量的SO[sub]4[/sub][sup]2-[/sup]、1[color=black]0倍量的[/color]NO[sub]3[/sub][sup]-[/sup]、H[sub]2[/sub]PO[sub]4[/sub][sup]-[/sup][color=black]均不干扰[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup]的测定。[align=center]图2 TCAA和ClO[sub]4[/sub][sup]-[/sup]与常见阴[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]图[/align][align=center]图3 10mg/L的硝酸盐、磷酸盐和200mg/L的硫酸盐与1.0mg/L的TCAA和ClO[sub]4[/sub][sup]-[/sup]色谱图[/align]2.4 样品测定及回收率试验结果取水样按照1.4.2的方法测定TCAA和ClO[sub]4[/sub][sup]-[/sup]的含量,同时在水样中分别添加0.10、0.50和0.75[color=black]mg/L的[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup]并平行测定5次,计算加标回收率及测定结果的相对标准偏差(RSD),结果见表5。由表5可知,TCAA和ClO[sub]4[/sub][sup]-[/sup]的加标回收率分别为:90.0%~98.0%和91.6%~98.1%,测定结果的相对标准偏差分别为3.98%~5.00%和2.46~5.45%。其中,自来水加0.50[color=black]mg/L的[/color]TCAA和ClO[sub]4[/sub][sup]-[/sup]色谱图见图4,从图4可知,TCAA和ClO[sub]4[/sub][sup]-[/sup]与基体组分能完全分离。[align=center]图4 自来水加标样品色谱图[/align][align=center]表5样品测定及回收率试验结果[/align][table][tr][td][align=center]样品名称[/align][/td][td][align=center][color=black]组分[/color][/align][/td][td][align=center][color=black]本底值/(mgL[/color][sup][color=black]-1[/color][/sup][color=black])[/color][/align][/td][td][align=center]加入量/(mgL[sup]-1[/sup])[/align][/td][td][align=center][color=black]测得量/[/color][/align][align=center][color=black](mgL[/color][sup][color=black]-1[/color][/sup][color=black])[/color][/align][/td][td][align=center]回收率/%[/align][/td][td][align=center]RSD/%[/align][/td][/tr][tr][td=1,2][align=center]自来水[/align][/td][td][align=center]TCAA[sup]-[/sup][/align][align=center]ClO[sub]4[/sub][sup]-[/sup][/align][/td][td][align=center]0.05[/align][align=center]0.03[/align][/td][td][align=center]0.10[/align][align=center]0.10[/align][/td][td][align=center][color=black]0.103,0.100,0.091,0.095,0.101[/color][/align][align=center][color=black]0.091,0.093,0.092,0.085,0.097[/color][/align][/td][td][align=center]98.0[/align][align=center]91.6[/align][/td][td][align=center]5.00[/align][align=center]4.73[/align][/td][/tr][tr][td][align=center]TCAA[sup]-[/sup][/align][align=center]ClO[sub]4[/sub][sup]-[/sup][/align][/td][td][align=center]0.05[/align][align=center]0.03[/align][/td][td][align=center]0.50[/align][align=center]0.50[/align][/td][td][align=center][color=black]0.461,0.425,0.455,0.479,0.430[/color][/align][align=center][color=black]0.464,0.491,0.438,0.430,0.472[/color][/align][/td][td][align=center]90.0[/align][align=center]91.8[/align][/td][td][align=center]4.98[/align][align=center]5.45[/align][/td][/tr][tr][td][align=center]井水[/align][/td][td][align=center]TCAA[sup]-[/sup][/align][align=center]ClO[sub]4[/sub][/align][/td][td][align=center]0.05[/align][align=center]0.03[/align][/td][td][align=center]0.75[/align][align=center]0.75[/align][/td][td][align=center][color=black]0.668,0.694,0.736,0.678,0.674[/color][/align][align=center][color=black]0.745,0.757,0.723,0.742,0.712[/color][/align][/td][td][align=center]92.0[/align][align=center]98.1[/align][/td][td][align=center]3.98[/align][align=center]2.45[/align][/td][/tr][/table]3 小结本工作建立了以SH-AP-2型阴离子交换柱为分离柱,以15.0mmol/LNa[sub]2[/sub]CO[sub]3[/sub]溶液为淋洗液,流量为0.80mL/min等度洗脱抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定水样中TCAA和ClO[sub]4[/sub][sup]-[/sup]的新方法。方法重现性良好,可在25min以内完成高氯酸盐、三氯乙酸的同时测定,简便快速,测定结果准确可靠,适用环境水样中TCAA和ClO[sub]4[/sub][sup]-[/sup]的同时测定。参考文献1)王会霞.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定水中亚氯酸盐、氯酸盐和高氯酸盐[J].中国卫生检验杂志,2015,25(19):3250-32522)张振城,于雪荣,单晓梅,等. 饮用水中高氯酸盐的[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]测定法[J].职业与健康,2018,34(1):40-433)GB5749-2022.生活饮用水卫生标准[s]4)夏演,解焕英,林鑫.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定饮用水中二氯乙酸和三氯乙酸研究[J].环境科学与管理,2020,45(1):142-1465)郭学谦,魏娜.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定饮用水中二氯乙酸及三氯乙酸[J].中国卫生检验杂志,2021,31(24):2982-29856)[color=#333333]HJ1050-2019[/color].[color=#333333]水质 氯酸盐、亚氯酸盐、溴酸盐、二氯乙酸和三氯乙酸的测定 [/color][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法[s]7)《水质分析大全》编写组. 水质分析大全[M]. 重庆:科学技术文献出版社重庆分社,1989:115-1188)许春向,邹学贤.现代卫生化学[M].北京:人民卫生出版社,2000:491-4929)国家质量监督检验检疫总局.中华人民共和国国家计量检定规程 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]:JJG823-2014 [s].北京:中国质检出版社,2014[/s][/s][/s]
0.1%的TFA流动相常用,但是没有加三氟乙酸盐坐缓冲对,怎么起缓冲作用的
做的五氯苯酚,酯化后上机2ppm 浓度峰强度仅有70000多,远低于基线600000,这是哪里出的问题,方法检出限可是0.05ppm,这是用SIM做的原因吗?
2011年8月9日消息,印度标准局(BIS)日前更新了限制玩具中邻苯二甲酸盐(phthalates)含量的要求,以配合包括美国、加拿大及各欧盟成员国在内的30多个国家对邻苯二甲酸盐的限制。印度此项举措将紧跟由美国消费品安全委员会(CPSC)提出的指导方针,根据该方针规定,儿童玩具及儿童护理用品中各类禁止的邻苯二甲酸盐的含量不得超过0.1% 在此之前,印度标准局已规定玩具中邻苯二甲酸盐的总量不得超过0.1%;但是该规定指的是三类邻苯二甲酸盐的总和,其中包括邻苯二甲酸二辛(DEHP)、邻苯二甲酸二癸酯(DDP)、邻苯二甲酸二丁酯(DBP)或邻苯二甲酸二异壬酯(DINP、邻苯二甲酸二异癸酯(DIDP)和邻苯二甲酸二正辛酯(DNOP),而不是指每一项不超过0.1%。 印度玩具协会于7月在新德里举办了第5届国际玩具博览,而印度此次决定正是继美国玩具产业协会(TIA)和印度标准局在此博览会上讨论所决定的。玩具产业协会技术部副总裁Alan Kaufman曾与印度标准局的VijayMalik博士谈及印度邻苯二甲酸盐的规定,称此项举措有助于在全球范围内设立玩具安全标准。AlanKaufman还指出,印度修订了邻苯二甲酸盐的限制要求,意味着印度在玩具安全方面的努力又向前迈进了一步,希望通过对邻苯二甲酸盐的限制,玩具公司能开发出更安全的产品,并且更顺利地走出国门开拓新的市场。
各位大神,请问TCG的中文名称是什么,我上网查找有2种但CAS号都一样。一个是间氯苯乙酸乙酯,一个是3-氯乙酸苯酯。请教过一个工程师,他说3-氯乙酸苯酯不是,但百灵威给的就是这个3-氯乙酸苯酯。到底是哪个?用分液漏斗进行一个衍生化,开始前用自来水试漏,没问题,但之后放了乙酸酐,三乙胺,正己烷之后摇了10多秒就开始漏。凡士林也不管用。有什么好方法可以解决这个问题
我实验要在负离子模式下定量测定一种代谢物,但买到的对照品是三氟乙酸盐结合的形式,在论坛里看到说,三氟乙酸不能再负离子模式下使用,会抑制响应,那我的对照品就不能用了吗?应该怎么办呢?
请问液质联用做一种代谢物的定量分析时,买到的对照品是代谢物的三氟乙酸盐,如何在Q1扫描时将盐去掉,得到代谢物的母离子质核比?还是需要将对照品进行前处理?
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。 产品编号 产品名称 标准值 BW901263-1000-H乙腈中(易制爆)Cellulose Nitrate标准品,有证书 1000ug/mL BW901262-1000-H乙腈中氰胺/氨腈标准品,有证书 1000ug/mL BW901260-100-A-5PAK甲醇中2,4,6-三氯苯甲醚标准品,有证书 100ug/mL BW901260-100-A甲醇中2,4,6-三氯苯甲醚标准品,有证书 100ug/mL BW901259-5000-U叔丁基甲醚中2,4-二氯苯乙酸标准品,有证书 5000ug/mL BW901259-5000-A-10PAK甲醇中2,4-二氯苯乙酸标准品,有证书 5000ug/mL BW901259-200-A甲醇中2,4-二氯苯乙酸标准品,有证书 200ug/mL BW901259-2000-D-5丙酮中2,4-二氯苯乙酸标准品,有证书 2000ug/mL BW901259-2000-D丙酮中2,4-二氯苯乙酸标准品,有证书 2000ug/mL BW901259-100-U叔丁基甲醚中2,4-二氯苯乙酸标准品,有证书 100ug/mL BW901259-100-D-5PAK丙酮中2,4-二氯苯乙酸标准品,有证书 100ug/mL BW901259-100-D丙酮中2,4-二氯苯乙酸标准品,有证书 100ug/mL BW901259-100-A甲醇中2,4-二氯苯乙酸标准品,有证书 100ug/mL BW901259-1000-U叔丁基甲醚中2,4-二氯苯乙酸标准品,有证书 1000ug/mL BW901259-1000-D丙酮中2,4-二氯苯乙酸标准品,有证书 1000ug/mL BW901259-1000-A甲醇中2,4-二氯苯乙酸标准品,有证书 1000ug/L BW901258-100-A甲醇中脱乙基莠去津标准品,有证书 100ug/mL BW901258-1000-A甲醇中脱乙基莠去津标准品,有证书 1000ug/mL BW901257-5000-CL乙醇/水(1:1)中2-戊醇标准品,有证书 5000ug/mL BW901256-5000-D丙酮中邻苯二甲酸标准品,有证书 5000ug/mL BW901256-200-M二氯甲烷中邻苯二甲酸标准品,有证书 200ug/mL BW901256-100-MD二氯甲烷/丙酮(1:1)中邻苯二甲酸标准品,有证书 100ug/mL BW901256-1000-M-1二氯甲烷中邻苯二甲酸标准品,有证书 1000ug/mL BW901256-1000-M二氯甲烷中邻苯二甲酸标准品,有证书 1000ug/mL BW901256-1000-A甲醇中邻苯二甲酸标准品,有证书 1000ug/mL 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。[col
笔者获悉,近期市场上出现了“瘦肉精”的新品种—苯乙醇胺A,不法分子将这种物质添加到猪饲料当中,以期达到提高生猪瘦肉率的目的。据悉,2010年底,苯乙醇胺A已被农业部第1519号公告列为禁止在饲料和动物饮水中使用的物质。公告称,根据《饲料和饲料添加剂管理条例》有关规定,禁止在饲料和动物饮水中使用苯乙醇胺A等物质。各级畜牧饲料管理部门要加强日常监管和监督检测,严肃查处在饲料生产、经营、使用和动物饮水中违禁添加苯乙醇胺A等物质的违法行为。 那么,苯乙醇胺A是一种怎样的物质?作为“瘦肉精”的“新型”替代品,它对人体是否有着相似的危害呢?带着这些问题,笔者咨询了在食品检测领域具有丰富经验的第三方检测机构PONY谱尼测试。PONY谱尼测试专家告诉笔者,苯乙醇胺A又称为克伦巴胺,是一种人工合成的化学物质,具有同瘦肉精(克伦特罗)相同的作用和效果,属于β-激动剂的一种,具有营养再分配作用。这种物质是瘦肉精品种目录中的一种,与其他瘦肉精品种如莱克多巴胺等一样,可以用于猪肉、牛肉,刺激动物生长,加强蛋白质在动物体内沉积,提高基础代谢水平,使体脂趋于分解,促进生猪长速加快、皮红毛亮,提高瘦肉率。苯乙醇胺A对人体的危害较大。人食用了含这种瘦肉精的猪肉后,会出现恶心、头晕、四肢无力、手颤等中毒症状,特别是对心脏病、高血压患者危害更大。长期食用则有可能导致染色体畸变,会诱发恶性肿瘤。 苯乙醇胺A在生猪饲料中的大规模出现,不能不引起人们对猪肉市场的担忧,也再次把人们的目光聚焦到生猪饲料及在市场上销售的猪肉制品上。由此,PONY谱尼测试建议相关企业,一定要加强产品质量管理,并积极地到具有相关资质的第三方检测机构进行产品送检。只有保证了产品品质,才能赢得消费者的信任,才能使产品具有持久的生命力。
有没有老师做过苯乙醇和乙酸苯乙醇的TLG分离的。在展开剂方面给点意见吧。
用安捷伦7820GC ,检测器是FID,HP-5毛细柱,测三苯及乙苯苯乙烯的条件是什么啊?请前辈指点!
先看新闻[I]新华网北京10月30日电(记者 徐博、刘铮)国家质检总局30日发布消息说,从广东出入境检验检疫机构获悉,在从日本进口的日式酱油、芥末酱中检测出了甲苯和乙酸乙酯。 国家质检总局发布的消息说,有关食品产自3家日本生产企业。其中[B]甲苯的最高检出值为0.0053mg/kg,乙酸乙酯最高检出值为0.537mg/kg[/B]。进口上述产品的中国进口企业已开始对这三家企业生产的同类产品采取下架和批批检验措施,以确保消费者安全。 此前,有日本媒体报道,日本有人食用了检出甲苯和乙酸乙酯的食品出现过不适症状。[/I]甲苯的最高检出值为0.0053 mg/kg,乙酸乙酯最高检出值为0.537 mg/kg。乙酸乙酯用途很广。主要用作溶剂,及用于染料和一些医药中间体的合成。是食用香精中用量较大的合成香料之一,大量用于调配香蕉、梨、桃、菠萝、葡萄等香型食用香精.清香型白酒是以乙酸乙酯为主体香的一类酒。其工艺特点为:清蒸、清渣、地缸发酵、清蒸馏酒。代表酒有山西汾阳杏花村。优质酒的乙酸乙酯含量为100mg/100mL以上,汾酒高达300mg/100mL,一般白酒仅含50mg/100mL,液态白酒只含30mg/100mL左右。(注意单位哦,这里是mg/100mL,换算成mg/kg大约还要乘10的)估计搞食品的,听到乙酸乙酯就笑了.哈哈!!![B]再看甲苯,[/B]《生活饮用水卫生标准》 GB 5749--20062007-07-01 实施[B]甲苯(mg/L) 0.7[/B]苯(mg/L) 0.01苯乙烯(mg/L) 0.02氯苯(mg/L) 0.3甲苯0.0053个PPM,自来水0.7PPM,这就意味着,我国的自来水的国家标准对甲苯含量的要求,比日本这个酱油里的含量要高出132倍。四个字来形容这则新闻——自取其辱。天朝进来因三聚氰胺事件恼羞成怒企图绝地反击,可惜低能到如此程度,真是让倭寇笑得合不拢嘴。
[color=#444444]我用辛酸甲酯methyloctanoate (C9H18O2) 做[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]的内标物,绘制不同分析物的标准曲线,各个分析物的相对校正因子差别很大。实验室人告诉我,如果分析物和内标结构差不多,那么校正因子越接近1。这是对的,不过有的化合物化学式差不多,结构却相差很多,这样校正因子差别也很大,我要如何判断我做出来的标准曲线和相对校正因子是对的呢?[/color][color=#444444]比如,我用辛酸甲酯做内标,测了两个化合物,苯乙酸(C8H8O2,含苯环和羧酸)和香兰素(C8H8O3,含苯环,羰基,甲氧基和羟基)。其中苯乙酸相对辛酸甲酯差别不是很大,而香兰素差别就大了。所以他们的标准曲线分别是y=0.7311x-0.0525 R2=0.99998,y-1.1526x-0.1764 R2=0.9982。不知道它们的校正因子对不对?有大神帮忙分析一下吗?[/color]
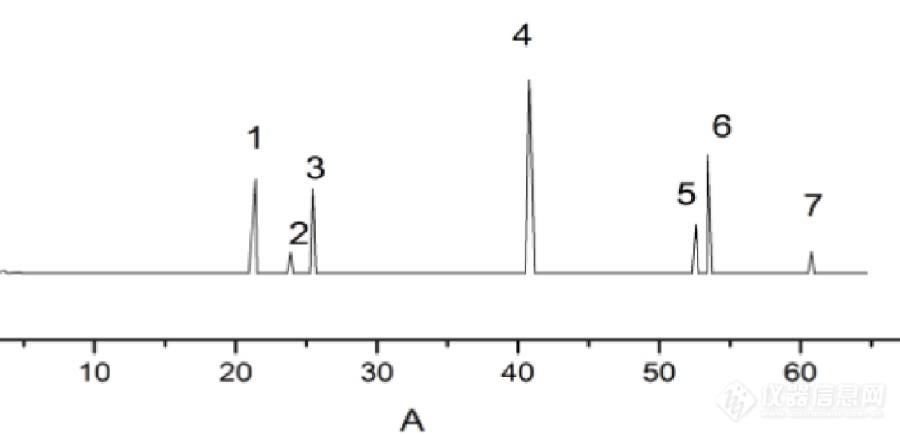
[align=center]一点红抗炎活性部位HPLC指纹图谱的研究[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:石珊[/align]1 仪器与药品 岛津LC-20AT高效液相色谱仪(SPD-20A紫外检测器、Inertsil ODS-SP C18柱);BILON-1000Y超声波细胞粉碎机,上海比朗仪器制造有限公司;Infinite F50酶标仪,瑞士Tecan公司; 乙腈,色谱纯;甲酸,分析纯;槲皮素(K1505114)、槲皮苷(A1526061)、木犀草素(C10016987)、咖啡酸(I1418166)、3,4-二羟基苯乙酸(A1513031)、对羟基苯乙酸(J1409049)、对羟基苯甲酸(B1505009)、HRP(K1506040)购于阿拉丁试剂(以上对照品纯度均≥98%,可作为分析标准品);鼠李素、AA(均购自Quality Control Chemicals INC,批号分别为:10-0106/0、U-71A-S28-Z);5-LOX(recomb ined human,购于cayman公司,Batch:0467742-1);TMB-HCL西宝生物科技股份有限公司;一点红药材购自广西各大药房,样品信息具体见表1。 表1 5批一点红药材信息[table][tr][td]NO.[/td][td]生产厂家[/td][td]产地[/td][td]生产批号[/td][/tr][tr][td]1[/td][td]桂林兴安县鑫鑫中药饮片有限公司[/td][td]广西桂林[/td][td]141125[/td][/tr][tr][td]2[/td][td]广西贵港市绿之源种养发展有限公司中药饮片厂[/td][td]广西贵港[/td][td]160601[/td][/tr][tr][td]3[/td][td]广西柳州百草堂药业有限公司中药饮片厂[/td][td]广西柳州[/td][td]20151214[/td][/tr][tr][td]4[/td][td]广西柳州百草堂药业有限公司中药饮片厂[/td][td]广西柳州[/td][td]20160301[/td][/tr][tr][td]5[/td][td]广西柳州中药材市场[/td][td]广西柳州[/td][td]/[/td][/tr][/table]2 实验与方法2.1一点红提取物的制备 称取一点红粉末(过40目筛)10g,加100mL石油醚75℃ 提取2h,每小时收集滤渣。再加入100mL 70%乙醇溶液用超声波细胞粉碎机超声30min,过滤,滤渣加100 mL 70%乙醇溶解并回流4h,每2小时收集滤液,合并两次滤液,减压浓缩至无乙醇味,加水,依次用乙酸乙酯、正丁醇反复萃取,旋蒸、干燥,备用。2.2 一点红提取物抗5-LOX活性2.2.1实验原理 花生四烯酸(AA)在5-LOX催化作用下生成5-羟基氧化物(5-HPETE),5-HPETE在HRP作用下使TMB氧化,产生蓝色阳离子根,加入终止剂H2SO4后,蓝色的阳离子根转变为黄色的联苯醌,在450nm波长处检测吸光度。2.2.2 实验方法Tris-HCL:0.1M pH=7.0;5-LOX:用前取10μL 原液(6.96mg/mL),缓冲液稀释,每孔用量10μL ,终浓度为1μg/孔;AA:(0.25mg/mL)配制成21mmol/L于-20℃下保存,临用时稀释,使其终浓度为100μmol/L;HRP:配制13.9mg/mL的储备液,于4℃冰箱保存,临时用稀释20倍。TMB:配制成7.4mg/mL储备液,避光保存,临用时稀释10倍;样品制备:将提取物溶于DMSO中,配制成含1mg/mL生药储备液。 ①空白组:180μL Tris-HCL、10μL HRP ②对照组:170μL Tris-HCL、10μL 5-LOX、10μL HRP ③样品空白组:170μL Tris-HCL、10μL 药品、10μL HRP ④样品组:160μL Tris-HCL、10μL 5-LOX、10μL 药品、10μL HRP 小心震荡酶标板使反应体系混匀,37℃避光孵育10min,依次加入10μL TMB、10μL AA以激活反应,15min,加入20μL 1M H2SO4终止反应,使用酶标仪450nm处测吸光度。抑制率(%)=(△AE-△A)/△AE×100%△AE-样品池中酶与底物反应后测定的吸光度(扣除相应背景空白)△A -加入样品抑制剂后所测定的酶与底物反应的吸光度值(扣除相应背景空白)2.3 一点红抗炎活性部位指纹图谱色谱条件:流动相为1% 甲酸乙腈- 1% 甲酸水,梯度洗脱(梯度洗脱条件见表2),流速1mL/min,检测波长326nm,进样量20μL,记录色谱图65min。 表2 梯度洗脱条件[table][tr][td=3,1]t/min 1% 甲酸乙腈/% 1% 甲酸水/%[/td][/tr][tr][td]0[/td][td] 5[/td][td] 95[/td][/tr][tr][td]7[/td][td] 8[/td][td] 92[/td][/tr][tr][td]17[/td][td] 15[/td][td] 85[/td][/tr][tr][td]45[/td][td] 30[/td][td] 70[/td][/tr][tr][td]55[/td][td] 50[/td][td] 50 [/td][/tr][tr][td]60[/td][td] 70[/td][td] 30[/td][/tr][tr][td]65[/td][td] 100[/td][td] 0[/td][/tr][/table]2.3.1 对照品溶液制备 准确称取各对照品适量溶于DMSO中,按照上述色谱条件依次测定,见图1. 按出峰时间依次为对羟基苯乙酸、咖啡酸、对羟基苯甲酸、槲皮苷、木犀草素、槲皮素、鼠李素。2.3.2 供试品溶液制备 准确称取一点红乙酸乙酯、正丁醇部位10mg,DMSO溶解,配制成1mg/mL溶液。按上述色谱条件测定。2.3.3 精密度试验 取同一供试品溶液连续进样6次,考察被确认共有峰的保留时间和峰面积。结果表明,各色谱峰的保留时间的RSD1%,峰面积的RSD3%。2.3.4 稳定性试验 取同一供试品溶液,分别在0,3,6,9,12,24h进样检测,考察被确认共有峰的保留时间和峰面积。结果表明,各色谱峰的保留时间RSD1%,峰面积RSD3%。2.3.5重复性试验 取同一供试品溶液5份,按上述方法制备和检测,考察被确认共有峰的保留时间和峰面积。结果表明,各色谱峰的保留时间RSD1%,峰面积RSD3%。2.3.6供试品溶液的制备 准确称取5个批次的一点红粉末(过40目筛)5g,加50%甲醇100 mL超声(40HZ,200W)提取60min,过滤收集滤液定容至100 mL,用0.45μm微孔膜滤过,待用。3结果3.1 一点红提取部位抗5-LOX活性 不同产地的一点红乙酸乙酯、正丁醇部位对5-LOX均有抑制作用。结果表明,一点红药材正丁醇提取部位抗5-LOX活性略高于乙酸乙酯部位。 表3为一点红不同活性部位抗5-LOX 活性[table][tr][td][align=center]厂家[/align][/td][td] 乙酸乙酯部位 正丁醇部位[/td][/tr][tr][td=2,1] 洪才 60±0.1% 64±0.1%[/td][/tr][tr][td=2,1] 绿之源 59.2±0.1% 65.6±0.1%[/td][/tr][tr][td=2,1] 百草堂(1) 59.4±0.1% 65±0.1%[/td][/tr][tr][td=2,1] 百草堂(2) 59±0.1% 65.2±0.1%[/td][/tr][tr][td=2,1] 中药材市场 59.5±0.1% 64.6±0.1%[/td][/tr][/table]3.2一点红乙酸乙酯部位HPLC指纹图谱与相似度分析 分析一点红乙酸乙酯部位和正丁醇部位HPLC指纹图谱,发现乙酸乙酯部位图谱重现性、精密度、稳定性良好,且该部位化学信息较多。确定了该部位7个色谱峰,按保留时间先后顺序依次为:对羟基苯乙酸(21.7min)、咖啡酸(25.1min)、对羟基苯甲酸(25.6min)、槲皮苷(41.0min)、木犀草素(52.7min)、槲皮素(53.3min)、鼠李素(60.8min)。其中,4号槲皮苷含量最多,6号槲皮素次之,1号对羟基苯乙酸含量最少(见图1)。[align=center][img=,690,333]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091742404389_6508_2904018_3.png!w690x333.jpg[/img][/align][align=center][img=,593,315]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091742523769_7471_2904018_3.png!w593x315.jpg[/img] B[/align]A 对照品HPLC图 B 乙酸乙酯部位HPLC图1.对羟基苯乙酸 2.咖啡酸 3.对羟基苯甲酸 4.槲皮苷 5.木犀草素 6.槲皮素 7.鼠李素 图1 一点红对照品混合溶液色谱图及其指纹图谱共有模式3.2.2 5批一点红药材乙酸乙酯部位样品溶液测定 对5个批次的一点红药材按上述方法提取得到乙酸乙酯部位并进行HPLC分析,得到5个批次一点红乙酸乙酯部位指纹图谱(见图2)。利用“中药色谱指纹图谱相似度评价系统2004A版”进行相似度评价,共标定了18个特征峰作为判别一点红抗炎部位质量的群体特征峰。不同来源一点红的HPLC乙酸乙酯部位指纹图谱相似度评价见表4。[align=center][img=,690,335]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091743032379_5760_2904018_3.png!w690x335.jpg[/img][/align] 图2 5批一点红乙酸乙酯部位HPLC指纹图谱 表4 不同厂家一点红药材相似度评价结果[table][tr][td] [/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td]厂家[/td][td][align=center]洪才[/align][/td][td][align=center]绿之源[/align][/td][td][align=center]百草堂(1)[/align][/td][td][align=center]百草堂(2)[/align][/td][td][align=center]中药材市场[/align][/td][/tr][tr][td]相似度[/td][td] 0.971[/td][td] 0.982[/td][td] 0.988[/td][td] 0.973[/td][td] 0.895[/td][/tr][/table]4.讨论早期研究表明,一点红水提物和甲醇提取物与阿司匹林相比,对蛋清蛋白引起的小鼠足肿胀有较好的抑制作用[sup][/sup]。一点红甲醇提取物及二氯甲烷提取物可通过抑制炎性介质和细胞因子IL-1β、TNF-α细胞因子和NO来减轻炎症反应[sup][/sup]。一点红在临床上用于治疗静脉炎效果强于喜疗妥软膏,是治疗静脉炎的理想药物[sup][/sup]。本实验通过一点红乙酸乙酯部位对5-LOX的抑制,从而阻止5-LOX途径,减轻炎性症状。本实验对比了超声波细胞粉碎0min、60min、120min乙酸乙酯、正丁醇提取率,表明随着超声时间的延长,石油醚、乙酸乙酯部位提取率逐渐减小,正丁醇部位几乎无影响。可能由于细胞粉碎时间过长,导致糖类、粘[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]等杂质的浸出,并附着于药材表面,影响乙醇的进入,从而影响石油醚、乙酸乙酯部位的提取率。考察乙醇加热回流2h、3h、4h,1h收集滤液以及回流4h,2h收集滤液。发现回流4h,2h收集滤液,各部位提取率最高。5-LOX体外抑制实验表明,一点红乙酸乙酯部位和正丁醇部位均具有良好的抗5-LOX活性,由于乙酸乙酯部位所含化学信息多,且谱图重现性、精密度、稳定性均良好。故建立了一点红乙酸乙酯部位HPLC指纹图谱,标定了18个共有峰,确定了该部位7个色谱峰,按保留时间先后顺序依次为:对羟基苯乙酸、咖啡酸、对羟基苯甲酸、槲皮苷、木犀草素、槲皮素、鼠李素。