有人做过2氨基丁酸的衍生吗?求助
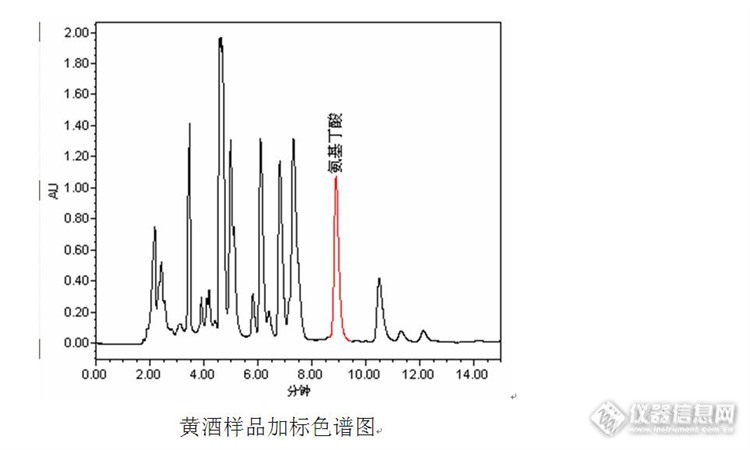
黄酒中γ-氨基丁酸含量测定的辛酸历程 近日实验室收到一批黄酒样品,该批黄酒是用发芽糙米为原料酿造而成,客户要求测定黄酒中的γ-氨基丁酸含量。由于之前实验室以丹磺酰氯为衍生试剂,建立了高效液相色谱法测定发芽糙米中γ-氨基丁酸含量的实验方法,并对实验方法的线性、精密度以及回收率进行了确认,均可以满足发芽糙米中γ-氨基丁酸含量测定要求,因此拿到黄酒样品后直接按照发芽糙米的前处理方法和色谱方法进行分析。链接如下:http://bbs.instrument.com.cn/shtml/20141226/5591256/。然而事与愿违,在测定的液相色谱图中压根就没有见到γ-氨基丁酸的色谱峰,反而在11.5min左右有个小的色谱峰,其峰高与发芽糙米中γ-氨基丁酸峰高有点相似,初步怀疑是保留时间发生了漂移,与发芽糙米样品色谱图对比后发现,在发芽糙米样品色谱图中该保留时间处也出现了一个相似的小峰,因此将该色谱峰是γ-氨基丁酸的可能性排除。http://ng1.17img.cn/bbsfiles/images/2014/12/201412311333_530568_1669358_3.jpghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412311334_530570_1669358_3.jpg 原本该实验到此结束,准备将实验结果反馈给客户:黄酒中γ-氨基丁酸的检测结果为“未检出”。为了保证数据的准确性和可靠性,在黄酒样品中进行加标实验,结果在加标的色谱图中也未在相应的保留时间出峰,而且11.5min左右的色谱峰也没有增大,因此决定先将“未检出”的结果搁置,并对实验方法进行分析。 经过对样品前处理过程和色谱方法的分析,觉得可能造成加标样品中γ-氨基丁酸未检出的原因可能有:(1)保留时间漂移。由于流动相需要调节pH值,同时样品前处理过程中也涉及到酸、碱溶液的使用,怀疑是流动相或者样品pH的改变导致保留时间的漂移,从而未在原有的保留时间出现应有的色谱峰。然而重新配制流动相和前处理样品,加标样品测定结果依然是“未检出”,对比加标和不加标样品的色谱图,两者几乎一样,也没有峰面积或峰高变化明显的色谱峰;(2)衍生试剂失效。丹磺酰氯对光和湿敏感,不稳定,放置时间久了会生产二氯亚砜并继续分解成其他物质,影响其在有机溶剂中的溶解度,也会影响结果。可是为了排除衍生试剂的问题,重新打开一瓶刚购置不久的丹磺酰氯试剂,并重新试验,结果仍然不理想;(3)衍生条件控制不当。之前用相似的方法测定牛磺酸含量以及测定发芽糙米中γ-氨基丁酸含量时曾出现过衍生过程条件控制不当造成衍生不完全或者不能衍生的情况,可是与黄酒样品同一批处理的γ-氨基丁酸标准溶液和发芽糙米样品均能衍生成功,并正常出峰,为何唯独黄酒样品不出峰呢?在百思不得其解之际,看到同事在滴定黄酒中总酸,忽然间若有所悟:黄酒中的γ-氨基丁酸需要在碱性条件下才能与丹磺酰氯发生衍生反应,而黄酒是酸性介质,pH值一般在3~5之间,同时黄酒为酿造产物,对酸碱性具有一定的缓冲能力。http://ng1.17img.cn/bbsfiles/images/2014/12/201412311336_530572_1669358_3.jpg 通过比较发现:黄酒为酸性样品,缓冲能力较强,按照发芽糙米样品前处理方法直接加入0.5mL 碳酸钠(pH9.8)可能不能达到合适的衍生反应条件,最终导致黄酒样品中γ-氨基丁酸“未检出”。 找到问题后调整实验方案,先将黄酒样品调整至中性,然后再按照发芽糙米样品方法进行前处理。调整实验方案后,黄酒样品中γ-氨基丁酸测定的色谱图如下图。从色谱图中可以发现,经过实验方案的调整黄酒样品中检出了γ-氨基丁酸的存在。http://ng1.17img.cn/bbsfiles/images/2014/12/201412311337_530573_166
[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]测氨基丁酸的文献
有哪位高人测过γ-氨基丁酸,我查到的标准是QB/T4587-2013,具体操作中,有哪位高人做过,帮忙指导一下,有哪些注意的,谢谢
请问专家:在南京哪个地方可以检测γ-氨基丁酸呢?
γ-氨基丁酸和α-羟基丙酸氢键核磁峰位置大概是多少?
请问专家:在成都哪个地方可以检测γ-氨基丁酸呢?
文献报道采用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url] (HPLC) 方法测定不同发酵食品中的 γ-氨基丁酸 (GABA) 和谷氨酸 (Glu) 含量。提取最佳溶剂是 75% EtOH 和水,再加上 4% 磺基水杨酸作为后处理。提取的氨基酸在室温下用邻苯二甲醛 (OPA) 衍生 2 分钟,并通过带有荧光检测器 (λex = 340 nm 和 λem = 455 nm) 的 HPLC 分析。与植物和大豆发酵产品相比,动物发酵产品的 GABA 含量更高。将 HPLC 方法获得的结果与分光光度法获得的结果比较,用 HPLC 法测得的所有 GABA 含量都远低于用分光光度法测得的值,这是由于分光光度法使用的着色剂与 GABA 以外的其他氨基酸的非特异性反应干扰测定。因此,食品中的 GABA 含量只能通过 HPLC 来测量。详见https://doi.org/10.1007/s12161-020-01734-2
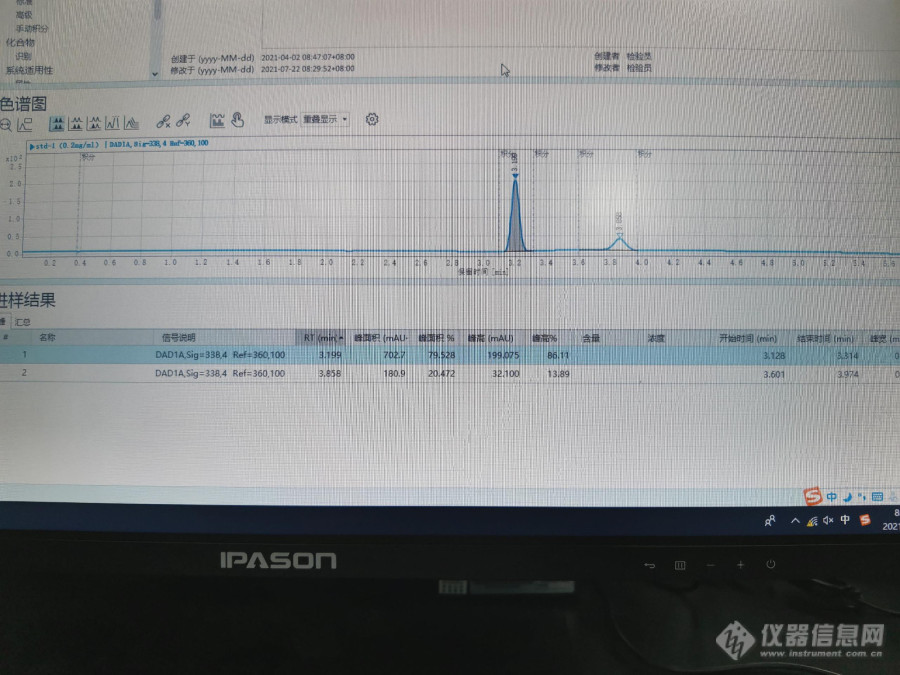
请教下各位老师,我们用QB/T 4587-2013检测r-氨基丁酸含量,然后遇到下面的问题对照和样品的色谱图会有2个峰,不能确定第一个峰是r-氨基丁酸的峰,还是第二个峰是r-氨基丁酸的峰。有没有哪位老师有做过该方法的,能帮忙解答下。对照品谱图如下:[img=,678,272]https://ng1.17img.cn/bbsfiles/images/2021/07/202107221103479791_7924_2022385_3.jpg!w690x517.jpg[/img]进水的谱图如下:[img=,684,207]https://ng1.17img.cn/bbsfiles/images/2021/07/202107221112238041_5481_2022385_3.png!w690x213.jpg[/img]进样品空白的谱图如下:[img=,684,215]https://ng1.17img.cn/bbsfiles/images/2021/07/202107221139206496_4010_2022385_3.png!w690x213.jpg[/img]进样品的谱图如下:[img=,690,229]https://ng1.17img.cn/bbsfiles/images/2021/07/202107221140208678_3330_2022385_3.png!w690x229.jpg[/img]
[font=-apple-system, sans-serif][color=rgba(0, 0, 0, 0.65)]3个月就能长高3厘米?氨基丁酸真的有用吗?[/color][/font]
哪位有R-3-氨基丁酸含量,单杂的液相检测方法,求分享
[size=4][color=#000080] 使用waters的AQC衍生氨基酸的人注意了[/color][/size][size=4][color=#000080] 脯氨酸与γ-氨基丁酸采用上述方法时,很难分离,从而对脯氨酸的测定产生一定影响。而γ-氨基丁酸又是人体内常见的神经递质,可由谷氨酸脱羧基生成,故广泛存在。对于来自生物提取物(工艺较滥时),这种情况尤为明显。[/color][/size][size=4][color=#000080] 另外,用大连伊利特的DNFB(2,4-二硝基氟苯)衍生氨基酸,结果脯氨酸和γ-氨基丁酸分离度也不好,大家注意一下。[/color][/size]
我用液谱检测γ-氨基丁酸,用异硫氰酸苯酯衍生反应,冻干后反应物成块状,不溶解.为什么呢 ?郁闷啊!请大侠指点迷津,不胜感激!
根据GBZ/T 160.67-2004 扩项工作场所MDI。原理:空气中MDI用冲击式吸收管采集,水解后成4.4’-二氨基二苯甲烷(MDA),在碱性条件下用甲苯萃取,经七氟丁酸酐衍生后,取甲苯溶液进样,经色谱柱分离,电子捕获检测器检测,以保留时间定性,峰面积定量。标准曲线的绘制:在5 只干燥的具塞离心管中,0.0、0.25、0.50、1.0和2.0ml MDA标准溶液,用甲苯稀释至2.0ml,配制成0.0、0.025、0.050、0.10和0.20mg/ml MDA标准系列,各管加30ul 七氟丁酸酐,振摇2min,放置5min,加1ml 缓冲液,振摇2min,以除去过剩的七氟丁酸酐,放置2min,将甲苯层转移入另一离心管中,供测定。色谱柱 DB-5 柱温230℃ 进样器270℃,检测器250℃,结果只出甲苯溶剂峰。参考了些文献七氟丁酸酐与胺反应有加热55℃70分钟的,也有反应30min的。标准里衍生反应很短时间怀疑衍生反应有问题!
脯氨酸与γ-氨基丁酸采用上述方法时,很难分离,从而对脯氨酸的测定产生一定影响。而γ-氨基丁酸又是人体内常见的神经递质,可由谷氨酸脱羧基生成,故广泛存在。对于来自生物提取物(工艺较滥时),这种情况尤为明显。
求助电子版二环己胺企业标准Q/SH1170019-2008
有老师做过GABA的DABS-Cl柱前衍生吗?最近在用HPLC测定这个,衍生后时候出现了沉淀,请问这是正常的吗?我没做过氨基酸衍生,不清楚这个现象
有谁知道哪里卖环氧丁酸对照呢?
使用ACCQ.TAG 氨基柱检测甘氨酸含量,内标物质α-氨基丁酸拖尾因子比较大(药典标准0.95-1.40),新柱子开始做拖尾因子就1.3多,做三四次后拖尾因子就超标准了,请教各位大神是什么原因?
最近需要用HPLC分析γ-氨基丁酸,正在选柱子,求问哪个牌子的柱子用来测GABA比较好????
现在所用的方法是酸碱滴定,不能准确的测定其含量,求环氧丁酸的准确检测方法。谢谢
本人是新手,最近想测一个样。里面还有氯化铵、氨基丁酸、丁二酸等分子,想测定其中的铵离子的浓度。我打算用邻苯二甲醛来衍生,然后用荧光检测。请问氨基丁酸的氨基会不会也和邻苯二甲醛反应啊?先谢谢诸位了。
本人在8月发表的一篇原创中提及”甘氨酸与组氨酸无法分离“的问题,在经过10多天的准备,已有不小的收获,现在分享。摘要 目的: 建立用高效液相色谱法测定人凝血因子VIII中氨基酸含量。方法: 采用6 - 氨基喹啉- N - 羟基琥珀酰亚氨基氨基甲酸酯( AQC) 为衍生剂,与氨基酸柱前衍生后,用Agilent 1200 高效液相色谱仪,AccQ·Tag C18柱( waters 150 mm ×3. 9 mm,4 μm) ,以水Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液和乙腈进行梯度洗脱,检测波长为248 nm,柱温37 ℃,进样量10μL。结果: 各氨基酸在32 min 内测定完毕,回收率为98.7% ~ 101.5%。RSD 均小于1. 5%。结论: 本法分离度好,快速、简便,可作为产品的质量控制方法。关键词: 6 - 氨基喹啉- N - 羟基琥珀酰亚氨基氨基甲酸酯; 人凝血因子VIII; 甘氨酸; 衍生物; 梯度洗脱; 高效液相色谱法;氨基酸; 含量测定人凝血因子VIII,本品对缺乏人凝血因子礓所致的凝血机能障碍具有纠正作用,主要用于防治甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状及这类病人的手术出血治疗。该药物制备过程中使用了氨基酸( 精氨酸、丙氨酸、甘氨酸、组氨酸、盐酸赖氨酸、脯氨酸 等) 做稳定剂,为了保证药品质量和用药安全,应对其中氨基酸的含量进行控制。该法依据过量的6 - 氨基喹啉基- N - 羟基琥珀酰亚氨基氨基甲酸酯( AQC) 在一定条件和氨基酸形成稳定的衍生产物( 柱前衍生) ,用高效液相色谱法测定衍生产物,根据衍生产物的含量计算人凝血因子中各氨基酸的含量。1 仪器和试药1200 高效液相色谱系统( 美国Agilent 公司) ,配置低压四元梯度泵、1314B 紫外吸收检测器、自动进样器、柱温箱、Chemistations 化学工作站; Sartorius CP225D 电子微量天平( 德国Sartorius 公司) ; SartoriusPB - 21 型pH 计( 德国Sartorius 公司) ; LDZ5 -2 低速自动平衡离心机( 上海医用离心机厂) 等。各标准品均来自于中国食品药品检定研究院2 色谱条件及系统适用性试验色谱柱: Waters AccQ·Tag C18色谱柱( 3. 9 mm ×150 mm) ; 流动相: 水为溶剂D,Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液( A) - 乙腈( B) - 水( D) ,柱温:37 ℃; 检测波长: 248 nm。精密量取对照品溶液与供试品溶液10 μL,分别注入液相色谱仪,记录色谱图32 min。3 溶液制备3. 1 Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液称取三水乙酸钠190. 4 g,加注射用水1000 mL,搅拌,溶解,用稀磷酸将pH 调至5. 2,加入乙二胺四乙酸二钠溶液( 称取乙二胺四乙酸二钠100 mg,加注射用水100 mL,摇匀使其溶解) 10 mL,加入叠氮化钠0. 1 g 及三乙胺23. 7 mL( 17. 2 g) ,用稀磷酸滴定至pH 4. 95,用0. 45 μm 的滤膜过滤,于4 ℃储存,备用( 此条件下可保存6 个月) 。量取该溶液100 mL,加注射用水稀释至1000 mL,混匀,即得Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液。3. 2 对照品储备液混合对照品储备液精密称取各氨基酸对照品适量,置同一100 mL量瓶中,以注射用水溶解并定容至刻度。制成含氨基酸含量均含5. 0 mg·mL - 1 的混合对照品溶液,即得。单个对照品储备液: 精密称取各含氨基酸的各对照品适量,分别置100mL 量瓶中,用注射用水溶解并定容至刻度。制成分别含各氨基酸的单个对照品溶液,即得。3. 3 供试品储备液3. 3. 1 加样回收率试验溶液精密称取各氨基酸各0. 3200,0. 4000,0. 4800 g 和辅料适量,加人凝血因子VIII原液7. 5 mL,肝素钠适量,用1. 0 mol·L - 1 盐酸调pH 至6. 9,加0. 01 mol·L - 1枸橼酸三钠溶液溶解并定容于20 mL。分别制备成16. 0, 20. 0, 24. 0 mg·mL - 1溶液。3. 3. 2 空白溶液 按公司处方,加入辅料的混合物,用注射用水制备各空白溶液3. 4 内标溶液精密称取α - 氨基丁酸( AABA)0. 4 g,加注射用水定容至100 mL。4 氨基酸衍生方法4. 1 精密量取供试品储备液、样品及对照品储备液各1. 0 mL,加1. 5%磺基水杨酸9. 0 mL,混匀静置2 h以上, 3000 r·min - 1离心10 min,留取上清液。4. 2 精密量取“4. 1”项下上清液1. 0 mL( 其中对照品储备液对应上清液分别精密量取0. 06, 0. 4,0. 8,1. 0, 1. 2, 1. 6 mL) ,分别置10 mL 量瓶中,用注射用水定容。制备成供试品溶液、样品溶液及浓度分别为1. 5, 10. 0, 20. 0, 25. 0, 30. 0,40. 0 mg·mL - 1 的对照品溶液。4. 3 精密量取“4. 2”项下溶液各100 μL,分别加注射用水0. 4 mL 及内标溶液20 μL,混匀备用。4. 4 精密量取“4. 3”项下溶液30 μL 放入衍生管中,加硼酸缓冲液( pH 8 ~ 10) 210 μL 涡旋混合,并加入AQC 衍生剂60 μL 涡旋混合15 s,即为各供试品溶液,待用。
参考NY/2890-2016,使用HPLC柱前衍生测GABA,发现GABA不溶于乙腈,方法里写的是乙腈溶液,请问有经验的老师是用什么溶解标准品的呀
BSA N,O-双(三甲基硅烷基)乙酰胺HFBA 七氟丁酸酐PFPA 五氟丙酸酐PSA 丙酸酐TFAA 三氟醋酸酐BSTFA 双三甲硅烷基三氟乙酰胺TBDMSTFA N-特丁基二甲硅烷基-N-甲基-三氟乙酰胺PFBBr 五氟苄基溴DEPA N,N-二乙基对苯二胺硫酸盐DDC N,N-二环己烷碳酰亚胺DMPA N,N-二甲基对苯二胺HMDS 六甲基二硅胺烷TMCS 三甲基氯硅烷
关于游离脂肪酸检测,我将游离脂肪酸丁酯化处理,使用硫酸/正丁醇然后发现检测结果丁酸丁酯含量很高,我做了空白以及拿没有丁酸的标品做丁酯化都发现有丁酸丁酯,这丁酸丁酯是怎样产生的啊?有什么方法避免这种情况发生?丁酸是我很重要的目标分析物这样就很难对其定量。(我完成了丁酯化的[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url]方法开发换方法不可能了)急需大神解答。
老师您好!关于环己烷氧化产物的分析我还有一个问题要请教:环己烷氧化的主要产物是环己醇、环己酮、己二酸以及己二酸二环己醇酯。我目前需要测定这些氧化产物的浓度,以确定氧化过程动力学方程。关于前两种产物,文献中已有现成的[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]分析法;关于后两种产物酸、酯的分析,却依然在采用误差比较大、费时比较久的化学滴定法。我想放弃化学分析法,而采用可能误差会小一些而且又切实可行的某种仪器分析法比如高效液相色谱,但不知是否可行而且也不知道该如何去寻找合适的色谱条件和具体分析方法。请前辈多多指教!
[size=3][font=宋体]氨基酸检测最早是用氨基酸分析仪,不过早过时了,现在用[/font][font=Times New Roman]HPLC[/font][font=宋体]的比较多,采用[/font][font=Times New Roman]HPLC[/font][font=宋体]柱后衍生的方法,不过弊端太多,做初步的检测还可以,但做科研课题就不行了。最好的方法是用质谱技术。多达[/font][font=Times New Roman]42[/font][font=宋体]种氨基酸的含量测定,采用质谱技术并使用[/font][font=Times New Roman]44[/font][font=宋体]种氨基酸同位素对内标,精确度和重复性都有很好的保证,和传统的毛细管电泳法、[/font][font=Times New Roman]HPLC[/font][font=宋体]法、氨基酸分析仪比较,无论是从精度上、还是检测的范围上和检测结果的准确度上都有了很大的提高和改善。[/font][/size][font=宋体][size=3]检测氨基酸的种类有:[/size][/font][font=宋体][size=3]一:必需氨基酸:[/size][/font][font=宋体][size=3]精氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸(蛋氨酸)、苯丙氨酸、苏氨酸、色氨酸、缬氨酸。[/size][/font][font=宋体][size=3]二:必需氨基酸衍生物(神经内分泌新陈代谢):[/size][/font][size=3][font=宋体]γ[/font][font=Times New Roman]-[/font][font=宋体]氨基丁酸、甘氨酸、丝胺酸、牛磺酸、酪氨酸。[/font][/size][size=3][font=宋体]三:氨[/font][font=Times New Roman]/[/font][font=宋体]能量新陈代谢:[/font][/size][size=3][font=Times New Roman]a-[/font][font=宋体]氨基已二酸、天门冬酰胺、天门冬氨酸、瓜氨酸、谷氨酸[/font][/size][font=宋体][size=3]、谷氨酰胺、鸟氨酸。[/size][/font][font=宋体][size=3]四:硫新陈代谢:[/size][/font][size=3][font=宋体]半胱氨酸、胱硫醚[/font][font=Times New Roman] [/font][font=宋体]、同型半胱氨酸。[/font][/size][font=宋体][size=3]五:附加代谢物:[/size][/font][size=3][font=宋体]α[/font][font=Times New Roman]-[/font][font=宋体]氨基正丁酸[/font][font=Times New Roman] [/font][font=宋体]、丙氨酸、鹅肌肽[/font][font=Times New Roman] [/font][font=宋体]、[/font][font=Times New Roman]b-[/font][font=宋体]丙氨酸、[/font][font=Times New Roman]b-[/font][font=宋体]氨基异丁酸、肌肽、乙醇胺、δ[/font][font=Times New Roman]-[/font][font=宋体]羟基赖氨酸[/font][font=Times New Roman] [/font][font=宋体]、羟化脯氨酸、[/font][font=Times New Roman]1-[/font][font=宋体]甲基组氨酸、[/font][font=Times New Roman]3-[/font][font=宋体]甲基组氨酸、磷酸乙醇胺、磷酸丝氨酸、脯氨酸、肌氨酸、精氨[/font][font=Times New Roman]([/font][font=宋体]基[/font][font=Times New Roman])[/font][font=宋体]琥珀酸、羟化瓜氨酸。[/font][/size][size=3][font=Times New Roman][/font][/size][size=3][font=Times New Roman] [/font][font=宋体]为了配合人体全谱氨基酸营养代谢组学的研究,公司成功开发出[b]《全谱氨基酸营养代谢组学分析系统》[/b]软件[/font][/size][font=宋体][size=3]随着科技的发展和人类的进步,营养代谢组学逐渐进人了现代科学的研究范畴,发展成一门很重要的学科。[/size][/font][size=3][font=宋体]代谢组学是继基因组学和蛋白质组学之后新近发展起来的一门学科,是系统生物学的重要组成部分。在营养支持方面代谢组学与系统生物学的其他技术一并用于研究营养表[/font][font=Times New Roman] [/font][font=宋体]型[/font][font=Times New Roman](nutritional phenotype)[/font][font=宋体],后者被定义为基因组、蛋白质组、代谢组、功能和行为因素的集成系统。[/font][font=Times New Roman] [/font][font=宋体]以前难以完成如此复杂的测定,而代谢组学技术的应用,可以测定许多营养代谢物与疾病及健康的关系。[/font][font=Times New Roman] [/font][font=宋体]因此,代谢组学是唯一适合探索营养与代谢复杂关系的研究方法。[/font][font=Times New Roman] [/font][font=宋体] [/font][/size][font=宋体][size=3]氨基酸是人类营养的基础,是最重要的营养组分,因此对氨基酸的研究又是营养组学中最为重要的一环。人类对氨基酸的研究比较广泛和系统。《全谱氨基酸营养代谢组学分析系统》软件正是汇集了这方面的研究资料,给客户一系统的分析参考。[/size][/font][size=3][font=宋体]《全谱氨基酸营养代谢组学分析系统》是和全谱氨基酸检测技术相配套的一套软件分析系统。通过对人体内[/font][font=Times New Roman]42[/font][font=宋体]种氨基酸的精确检测,来揭示人体内详细的氨基酸代谢状况。[/font][font=Times New Roman]42[/font][font=宋体]种氨基酸不仅包含了[/font][font=Times New Roman]8[/font][font=宋体]种必需氨基酸、[/font][font=Times New Roman]2[/font][font=宋体]种半必需氨基酸,同时也包含了[/font][font=Times New Roman]20[/font][font=宋体]种组成蛋白的基本氨基酸和各个代谢途径中重要的氨基酸,可以从不同的代谢路径中提示人体的健康状况。不管是神经内分泌系统、氨能量代谢系统或者是硫代谢等等,各种代谢途径都可以检测到。是截止目前国际上最科学、最系统、最完善的氨基酸营养代谢组学系统。[/font][/size][font=宋体][size=3]《全谱氨基酸营养代谢组学分析系统》通过对全谱氨基酸检测结果的科学分析,和目前科学提供的理论,给客户提示检测结果的临床意义和营养补充调节建议,同时专业医生或者营养师又可以通过软件提供的每种氨基酸的详细代谢图谱来分析各个代谢路径是否出了问题,来进一步的指导。[/size][/font][size=3][font=Times New Roman][/font][/size]
我要分析发酵产物中以下几种产物:丙酮、乙醇、丁醇、乙酸和丁酸。用的是“10% Carbowax-20 M, 0.10% H3PO4,support 80/100Chromosorb WAW” 玻璃填充柱和FID检测器。 因为发酵的底物中有一定浓度的糖类物质,所以采取别人的建议在衬管(liner)中填充了石英棉以阻止糖类物质进入柱子,否则糖类物质会很快的污染衬管而出现奇怪的峰。现在发现另外一个问题:那就是乙酸和丁酸总有残留,也就是说在测完一个样后,如果再测一个水样,会出现乙酸和丁酸的峰,而且峰面积比较大。不知道是乙酸和丁酸残留在柱子中,还是liner中或者其他什么地方?是否因为温度不够高?用的方法:进样口温度 225 oC;检测器温度:225 oC;柱温箱(oven)初始温度 40 oC,ramp 1: 40 oC/min for 3min, 最终温度 200 oC for 7 min; 不知有没有人有类似经历,可以给出您的建议解决这个问题?多谢!
根据《食品安全法》及其实施条例的规定,按照卫生部等7部门《关于开展食品包装材料清理工作的通知》(卫监督发〔2009〕108号)的要求,经组织专家评估,现公布聚己二酰丁二胺等107种可用于食品包装材料的树脂名单。 聚己二酰丁二胺等107种可用于食品包装材料的树脂名单序号CAS号中文名称通用类别名特定迁移量/最大残留量备注 1. 50327-22-5;50327-77-0聚己二酰丁二胺PA 2. 9010-94-02-甲基-2-丙烯酸甲酯与1,3-丁二烯、苯乙烯和2-丙烯腈的共聚物ABS6 mg/kg(1,2-丙烯酸-2-甲基甲酯:SML);1 mg/kg(1,3-丁二烯:QM)或 ND(1,3-丁二烯:SML,DL=0.020 mg/kg);ND(2-丙烯腈:SML,DL= 0.020 mg/kg) 3. 68441-52-11,3-丁二烯低聚的均聚物BDR1 mg/kg(丁二烯:QM);ND(丁二烯:SML,DL= 0.020 mg/kg 4. 68441-14-52-甲基-1,3-丁二烯与溴化-2-甲基-1-丙烯的聚合物 BIIR 5. 26007-43-2乙烯与二环庚-2-烯共聚物 E/NB0.05 mg/kg(二环庚-2-烯:SML)