组蛋白乙酰化组蛋白修饰通过改变组蛋白与DNA的亲和性使染色质结构发生改变,进而影响转录因子与DNA序列的结合和基因表达,包括乙酰化、甲基化、磷酸化等,其中乙酰化是最重要的修饰方式之一,其主要发生在组蛋白H3赖氨酸(Lysine, Lys)的位点上,在癌症进展中发挥双重作用,既参与肿瘤抑制基因的沉默,又增强癌基因的表达[11],它受组蛋白乙酰转移酶(Histone acetyl transferase,HAT)和组蛋白去乙酰化酶(Histone deacetylase,HDAC)调控。HDAC可移去Lys残基上的乙酰基,增强组蛋白的正电性,DNA(本身带有负电荷)与组蛋白结合紧密,转录因子不易于DNA结合,抑制抑癌基因的转录,HAT作用则相反,二者动态平衡才能使组蛋白乙酰化维持在正常水平。表观遗传学改变通过调控基因转录平衡组蛋白乙酰化和去乙酰化,从而影响细胞周期、凋亡和分化相关蛋白的表达水平[12]。2.1 组蛋白乙酰化水平与SCLC发生发展密切相关 一项实验研究表明,乙酰化组蛋白H3在SCLC和NSCLC细胞中的表达有显著性差异,以前者表达较高。Notch信号通路是SCLC发生发展和化疗耐药的主要调节通路之一[13],具有肿瘤抑制作用。此研究中,Notch1在SCLC细胞系(除H69AR、SBC-3)中失活,其表达水平与组蛋白H3乙酰化有关。Notch1阳性表达的细胞系中乙酰化组蛋白H3富集在Notch1启动子区域,表达水平较高,Notch1阴性表达的细胞系中Notch1启动子周围的乙酰化组蛋白H3水平较低。这说明组蛋白去乙酰化是Notch1基因在SCLC中表观失活的原因[14]915-918。此外,组蛋白H3赖氨酸23(histone 3 lysine 23, H3K23)乙酰转移酶KAT6B在SCLC中失活,若其活性恢复可对SCLC产生抑制作用,它的乙酰化水平降低是SCLC发生的重要标志[15]。由此可见,组蛋白去乙酰化可以调控相关基因的表达从而促进SCLC发生发展。2.2 组蛋白去乙酰化酶抑制剂 HDAC在许多癌症中过表达,干扰其活性、抑制其功能是有效的治疗手段。组蛋白去乙酰化酶抑制剂(Histone deacetylase inhibitor, HDACI)是重要的表观调控药物,高效低毒,通过靶向阻断HDAC去乙酰化、促进组蛋白乙酰化发挥抗肿瘤作用。根据化学结构的不同,HDACIs分为异羟肟酸(异羟肟酸酯)、短链脂肪(脂肪族)酸、环状四肽、苯甲酰胺和Sirt抑制剂5类[16]。在单药和/或与传统化疗药物联合使用时,HDACI可阻滞细胞周期,抑制迁移和侵袭[17],诱导癌细胞分化、自噬[18]、凋亡,抗血管生成。当前,伏立诺他(Vorinostat ,SAHA)、罗米地辛(Romidepsin)、帕比司他(Panobinostat)等被批准用于血液系统恶性肿瘤的治疗[19]。丙戊酸(valproic acid ,VPA)作为HDACI可抑制SCLC细胞生长,诱导细胞凋亡,阻滞SCLC细胞周期于G1期。以上抑制作用是通过降低HDAC4表达,增加组蛋白H4乙酰化实现的。同时发现,VPA激活了SCLC中Notch1、Notch靶基因HES1和P21的Notch信号通路。此外,它还可以上调生长抑素受体II(somatostatinreceptor2,SSTR2)并增强受体靶向细胞毒素的抑制作用[20]。在经曲古抑菌素A (Trichostatin A ,TSA)处理后的SCLC细胞系中, Notch1启动子区域H3乙酰化水平增加,从而导致Notch1蛋白表达。此外,经TSA处理后,SCLC细胞黏附增加,上皮间质转化标志物表达减少,细胞增殖减少,细胞凋亡激活,可能与TSA诱导Notch1表达有关[14]916-918。这些研究成果为HDACI在 SCLC治疗中的应用提供了依据。为了达到最好治疗效果,药物用量、联合用药及使用顺序仍需深入研究。
[size=20px] [/size][size=20px]组蛋白乙酰化[/size][size=16px]组蛋白修饰通过改变组蛋白与[/size][size=16px]DNA[/size][size=16px]的亲和性使染色质结构发生改变,进而影响转录因子与[/size][size=16px]DNA[/size][size=16px]序列的结合和基因表达[/size][size=16px],[/size][size=16px]包括乙酰化、甲基化、磷酸化等,其中乙酰化是最重要的修饰方式之一,其主要发生在组蛋白[/size][size=16px]H3[/size][size=16px]赖氨酸([/size][size=16px]Lysine, Lys[/size][size=16px])的位点上,在癌症进展中发挥双重作用,既参与肿瘤抑制基因的沉默,又增强癌基因的表达[/size][font='times new roman'][size=16px][11][/size][/font][size=16px],它受组蛋白乙酰转移酶([/size][size=16px]Histone acetyl transferase[/size][size=16px],[/size][size=16px]HAT[/size][size=16px])和组蛋白去乙酰化酶[/size][size=16px](Histone deacetylase[/size][size=16px],[/size][size=16px]HDAC)[/size][size=16px]调控。[/size][size=16px]HDAC[/size][size=16px]可移去[/size][size=16px]Lys[/size][size=16px]残基上的乙酰基,增强组蛋白的正电性,[/size][size=16px]DNA[/size][size=16px](本身带有负电荷)与组蛋白结合紧密,转录因子不易于[/size][size=16px]DNA[/size][size=16px]结合,抑制抑癌基因的转录,[/size][size=16px]HAT[/size][size=16px]作用则相反,二者动态平衡才能使组蛋白乙酰化维持在正常水平。表观遗传学改变通过调控基因转录平衡组蛋白乙酰化和去乙酰化,从而影响细胞周期、凋亡和分化相关蛋白的表达水平[/size][font='times new roman'][size=16px][12][/size][/font][size=16px]。[/size][size=20px]1[/size][size=20px] [/size][size=20px]组蛋白乙酰化水平与[/size][size=20px]SCLC[/size][size=20px]发生发展密切相关[/size][font='黑体'][size=14px] [/size][/font][font='黑体'][size=14px] [/size][/font][size=14px] [/size][size=16px]一项实验研究表明,乙酰化组蛋白[/size][size=16px]H3[/size][size=16px]在[/size][size=16px]SCLC[/size][size=16px]和[/size][size=16px]NSCLC[/size][size=16px]细胞中的表达有显著性差异,以前者表达较高。[/size][size=16px]Notch[/size][size=16px]信号通路是[/size][size=16px]SCLC[/size][size=16px]发生发展和化疗耐药的主要调节通路之一[/size][font='times new roman'][size=16px][13][/size][/font][size=16px],具有肿瘤抑制作用。此研究中,[/size][size=16px]Notch1[/size][size=16px]在[/size][size=16px]SCLC[/size][size=16px]细胞系(除[/size][size=16px]H69AR[/size][size=16px]、[/size][size=16px]SBC-3[/size][size=16px])中失活,其表达水平与组蛋白[/size][size=16px]H3[/size][size=16px]乙酰化有关。[/size][size=16px]Notch1[/size][size=16px]阳性表达的细胞系中乙酰化组蛋白[/size][size=16px]H3[/size][size=16px]富集在[/size][size=16px]Notch1[/size][size=16px]启动子区域,表达水平较高,[/size][size=16px]Notch1[/size][size=16px]阴性表达的细胞系中[/size][size=16px]Notch1[/size][size=16px]启动子周围的乙酰化组蛋白[/size][size=16px]H3[/size][size=16px]水平较低。这说明组蛋白去乙酰化是[/size][size=16px]Notch1[/size][size=16px]基因在[/size][size=16px]SCLC[/size][size=16px]中表观失活的原因[/size][font='times new roman'][size=16px][14]915-918[/size][/font][size=16px]。此外,组蛋白[/size][size=16px]H3[/size][size=16px]赖氨酸[/size][size=16px]23(histone 3 lysine 23, H3K23)[/size][size=16px]乙酰转移酶[/size][size=16px]KAT6B[/size][size=16px]在[/size][size=16px]SCLC[/size][size=16px]中失活,若其活性恢复可对[/size][size=16px]SCLC[/size][size=16px]产生抑制作用,它的乙酰化水平降低是[/size][size=16px]SCLC[/size][size=16px]发生的重要标志[/size][font='times new roman'][size=16px][15][/size][/font][size=16px]。由此可见,组蛋白去乙酰化可以调控相关基因的表达从而促进[/size][size=16px]SCLC[/size][size=16px]发生发展。[/size][size=20px]2 [/size][size=20px]组蛋白去乙酰化酶抑制剂[/size][font='黑体'][size=14px] [/size][/font][font='黑体'][size=14px] [/size][/font][size=16px]HDAC[/size][size=16px]在许多癌症中过表达,干扰其活性、抑制其功能是有效的治疗手段。组蛋白去乙酰化酶抑制剂([/size][size=16px]Histone deacetylase inhibitor, HDACI[/size][size=16px])是重要的表观调控药物,高效低毒,通过靶向阻断[/size][size=16px]HDAC[/size][size=16px]去乙酰化、促进组蛋白乙[/size][size=16px]酰化发挥抗肿瘤作用。根据化学结构的不同,[/size][size=16px]HDACIs[/size][size=16px]分为异羟肟酸(异羟肟酸酯)、短链脂肪(脂肪族)酸、环状四肽、苯甲酰胺和[/size][size=16px]Sirt[/size][size=16px]抑制剂[/size][size=16px]5[/size][size=16px]类[/size][font='times new roman'][size=16px][16][/size][/font][size=16px]。在单药和[/size][size=16px]/[/size][size=16px]或与传统化疗药物联合使用时,[/size][size=16px]HDACI[/size][size=16px]可阻滞细胞周期,抑制迁移和侵袭[/size][font='times new roman'][size=16px][17][/size][/font][size=16px],诱导癌细胞分化、自噬[/size][font='times new roman'][size=16px][18][/size][/font][size=16px]、凋亡,抗血管生成。当前,伏立诺他([/size][size=16px]Vorinostat ,SAHA[/size][size=16px])、罗米地辛([/size][size=16px]Romidepsin[/size][size=16px])、帕比司他([/size][size=16px]Panobinostat[/size][size=16px])等被批准用于血液系统恶性肿瘤的治疗[/size][font='times new roman'][size=16px][19][/size][/font][size=16px]。[/size][size=16px]丙戊酸[/size][size=16px](valproic acid ,VPA)[/size][size=16px]作为[/size][size=16px]HDACI[/size][size=16px]可抑制[/size][size=16px]SCLC[/size][size=16px]细胞生长,诱导细胞凋亡,阻滞[/size][size=16px]SCLC[/size][size=16px]细胞周期于[/size][size=16px]G1[/size][size=16px]期。以上抑制作用是通过降低[/size][size=16px]HDAC4[/size][size=16px]表达,增加组蛋白[/size][size=16px]H4[/size][size=16px]乙酰化实现的。同时发现,[/size][size=16px]VPA[/size][size=16px]激活了[/size][size=16px]SCLC[/size][size=16px]中[/size][size=16px]Notch1[/size][size=16px]、[/size][size=16px]Notch[/size][size=16px]靶基因[/size][size=16px]HES1[/size][size=16px]和[/size][size=16px]P21[/size][size=16px]的[/size][size=16px]Notch[/size][size=16px]信号通路。此外,它还可以上调生长抑素受体[/size][size=16px]II[/size][size=16px]([/size][size=16px]somatostatinreceptor2[/size][size=16px],[/size][size=16px]SSTR2[/size][size=16px])并增强受体靶向细胞毒素的抑制作用[/size][font='times new roman'][size=16px][20][/size][/font][size=16px]。在经曲古抑菌素[/size][size=16px]A (Trichostatin A ,TSA)[/size][size=16px]处理后的[/size][size=16px]SCLC[/size][size=16px]细胞系中,[/size][size=16px] Notch1[/size][size=16px]启动子区域[/size][size=16px]H3[/size][size=16px]乙酰化水平增加,从而导致[/size][size=16px]Notch1[/size][size=16px]蛋白表达。此外,经[/size][size=16px]TSA[/size][size=16px]处理后,[/size][size=16px]SCLC[/size][size=16px]细胞黏附增加,上皮间质转化标志物表达减少,细胞增殖减少,细胞凋亡激活,可能与[/size][size=16px]TSA[/size][size=16px]诱导[/size][size=16px]Notch1[/size][size=16px]表达有关[/size][font='times new roman'][size=16px][14]916-918[/size][/font][size=16px]。这些研究成果为[/size][size=16px]HDACI[/size][size=16px]在[/size][size=16px] SCLC[/size][size=16px]治疗中的应用提供了依据。为了达到最好治疗效果,药物用量、联合用药及使用顺序仍需深入研究。[/size]
我国“替尼类”(酪氨酸激酶抑制剂)抗肿瘤药的市场现状2012年1月FDA批准辉瑞公司小分子酪氨酸激酶抑制剂阿西替尼上市,开始了又一轮抗肿瘤靶向药物研究的新高潮。酪氨酸激酶在肿瘤的发生、发展过程中起着非常重要的作用,以酪氨酸激酶为靶点进行药物研发已成为国际上抗肿瘤药物研究的热点。酪氨酸酶抑制剂在临床上通过抑制肿瘤细胞的损伤修复、使细胞分裂阻滞在G1期、诱导和维持细胞凋亡、抗新生血管形成等多途径实现抗肿瘤效果;其抗癌谱广,已经成为治疗各种癌症疾病的一线用药。伊马替尼是基于癌细胞分子作用机理而开发的第一个抗癌新药,开创了肿瘤分子靶向治疗的时代。目前我国已有8个酪氨酸激酶抑制剂上市,包括伊马替尼、厄洛替尼、舒尼替尼等,此类药物的市场情况如下表,其中只有埃克替尼一个为国产产品,其它均为进口产品。表1:酪氨酸激酶抑制剂靶向抗肿瘤药在中国上市情况通用名 商品名 中国上市年份 在中国上市的首家公司 伊马替尼 格列卫 2002 诺华 吉非替尼 易瑞莎 2004 阿斯利康 厄洛替尼 特罗凯 2006 罗氏 索拉非尼 多吉美 2006 拜耳 舒尼替尼 索坦 2007 辉瑞 尼洛替尼 达希纳 2009 诺华 达沙替尼 施达赛 2011 百时美施贵宝 埃克替尼 凯美纳 2011 浙江贝达药业有限公司 靶向治疗,是在细胞分子水平上,针对已经明确的致癌位点(该位点可以是肿瘤细胞内部的一个蛋白分子,也可以是一个基因片段),来设计相应的治疗药物,药物进入体内会特异地选择致癌位点来相结合发生作用,使肿瘤细胞特异性死亡,而不会波及肿瘤周围的正常组织细胞。由于靶向制剂可以提高药效、降低毒性,从而增强了药品的安全性、有效性和病人用药的顺应性,所以日益受到国内外医药界的广泛重视。从2011年各大公司年报数据了解到,诺华的伊马替尼销售额最大,超过46亿美元,罗氏的厄洛替尼和辉瑞的舒尼替尼销售额都超过10亿美元。表2:2011年各大药企的酪氨酸激酶抑制剂产品全球销售额通用名 企业 2011年销售额 伊马替尼 诺华 46.59亿美元 厄洛替尼 罗氏 12.51亿瑞士法郎 舒尼替尼 辉瑞 11.87亿美元 索拉非尼 拜耳 7.25亿欧元 达沙替尼 达沙替尼 8.03亿美元 尼洛替尼 诺华 7.16亿美元 吉非替尼 阿斯利康 5.54亿美元 拉帕替尼 葛兰素史克 2.31亿英镑
有没有谁有比较好的检测酶抑制剂抑制效率的方法,也就是测Ki值的方法?谢谢
有没有针对乳酸菌的抑制剂?像脱氧剂能抑制细菌和霉菌等的生长,乳酸菌有这样的抑制剂吗
中国科技网讯 最近出版的国际肿瘤学权威期刊《美国国立癌症研究所杂志》发表了题为《转化生长因子β受体Ⅰ抑制剂高效安全抑制乳腺癌转移》的研究论文。该研究由国家“千人计划”入选者、华东师大生命医学研究所、上海市调控生物学重点实验室刘明耀教授领衔的课题组研发,发现了新型抗肿瘤体内生长和转移抑制剂。 随着全球肿瘤发病率的提高,我国已成为世界上肿瘤发病和死亡的大国。预计到2030年,世界上将有1320万人死于癌症,其中1/4在中国。针对这一严峻现状,近年来,学者一直在致力于战胜这个“恶魔”。分子靶向治疗,特别是寻找肿瘤转移的分子靶向治疗是近年来肿瘤治疗研究最为活跃的领域。肿瘤分子靶向治疗药物是一种小分子靶向治疗药物,就像子弹一样,可以直接命中癌细胞,而尽可能不损伤正常细胞,因其高效安全而备受瞩目。 课题组利用计算机模拟技术,构建了以抑制转化生长因子β受体活性为抗肿瘤药物靶点的虚拟筛选模型。利用该模型,从40万个小分子化合物库中筛选确定了100个左右的小分子。这些虚拟筛选出来的小分子在实际中是否真的能抑制癌细胞生长和迁移?这就需要再通过细胞抗癌功能筛选,从中找到1—2个抗癌效果最好的小分子。结合药物化学结构改造,这些小分子就改造成了能强烈抑制乳腺癌细胞迁移的新型转化生长因子β受体Ⅰ抑制剂。 课题组把实验小鼠分为乳腺癌原位转移组、乳腺癌肺转移组和骨转移组3种转移模型,利用治疗和预防两种给药方案,把这种抑制剂用于3种不同的动物模型。实验结果均表明,该抑制剂几乎能完全抑制乳腺癌的体内转移,并且对实验动物没有毒性。 专家认为,该项研究发现了一类新型转化生长因子β受体Ⅰ抑制剂,从多个角度证明其具有良好的抑制肿瘤转移效果,尤其在多种肿瘤转移动物模型中得到了令人印象深刻的结果。(张惠虹 记者王春) 《科技日报》(2013-02-18 一版)
[font='times new roman'][size=16px][color=#000000]组蛋白去乙酰化酶([/color][/size][/font][font='times new roman'][size=16px][color=#000000]HDAC[/color][/size][/font][font='times new roman'][size=16px][color=#000000])在[/color][/size][/font][font='times new roman'][size=16px][color=#000000]SCLC[/color][/size][/font][font='times new roman'][size=16px][color=#000000]治疗中的作用[/color][/size][/font][font='times new roman'][size=16px][color=#000000]自[/color][/size][/font][font='times new roman'][size=16px][color=#000000]20[/color][/size][/font][font='times new roman'][size=16px][color=#000000]世纪[/color][/size][/font][font='times new roman'][size=16px][color=#000000]80[/color][/size][/font][font='times new roman'][size=16px][color=#000000]年代起,肺癌逐步成为[/color][/size][/font][font='times new roman'][size=16px][color=#000000]威胁人类健康的第一大癌种,其[/color][/size][/font][font='times new roman'][size=16px][color=#000000]发病率和死[/color][/size][/font][font='times new roman'][size=16px][color=#000000]亡[/color][/size][/font][font='times new roman'][size=16px][color=#000000]率[/color][/size][/font][font='times new roman'][size=16px][color=#000000]常年位于第一[/color][/size][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]据[/color][/size][/font][font='times new roman'][size=16px]2020[/size][/font][font='times new roman'][size=16px]年全球癌症报告统计,肺癌新发病例约[/size][/font][font='times new roman'][size=16px]224[/size][/font][font='times new roman'][size=16px]万,占所有新发癌症病例的[/size][/font][font='times new roman'][size=16px]11.7%[/size][/font][font='times new roman'][size=16px],死亡病例约[/size][/font][font='times new roman'][size=16px]180[/size][/font][font='times new roman'][size=16px]万,约占癌症总死亡人数的[/size][/font][font='times new roman'][size=16px]18%[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]SCLC[/size][/font][font='times new roman'][size=16px]约占所有肺癌的[/size][/font][font='times new roman'][size=16px]15%[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px][color=#000000]5[/color][/size][/font][font='times new roman'][size=16px][color=#000000]年生存率仅为[/color][/size][/font][font='times new roman'][size=16px][color=#000000]7%[/color][/size][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px]它是一种神经内分泌瘤,具有早期转移、高度侵袭性、遗传不稳定性等特点。[/size][/font][font='times new roman'][size=16px][color=#000000]SCLC[/color][/size][/font][font='times new roman'][size=16px][color=#000000]目前的治疗方式主要有手术、化疗、放疗、靶[/color][/size][/font][font='times new roman'][size=16px][color=#000000]向治疗[/color][/size][/font][font='times new roman'][size=16px][color=#000000]和免疫治疗。[/color][/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC[/size][/font][font='times new roman'][size=16px]初期对放化疗敏感,但易产生耐药,多复发。关于[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC[/size][/font][font='times new roman'][size=16px]的治疗仍是一个难题。传统的化疗药物因其选择性低而易产生严重的毒副作用,不利于提高患者的生存质量。因此,为[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC[/size][/font][font='times new roman'][size=16px]找到更多的治疗靶点和高效低毒的靶[/size][/font][font='times new roman'][size=16px]向药物[/size][/font][font='times new roman'][size=16px]成为亟待解决的问题。[/size][/font][font='times new roman'][size=16px]基因突变和调控异常往往导致肿瘤的发生。[/size][/font][font='times new roman'][size=16px]表观遗传学变化是指在细胞分裂中可以遗传的基因表达改变,[/size][/font][font='times new roman'][size=16px]DNA[/size][/font][font='times new roman'][size=16px]序列不发生变化[/size][/font][font='times new roman'][size=16px],基因的转录和翻译受到[/size][/font][font='times new roman'][size=16px]调控[/size][/font][font='times new roman'][size=16px],主要[/size][/font][font='times new roman'][size=16px]包括[/size][/font][font='times new roman'][size=16px]DNA[/size][/font][font='times new roman'][size=16px]甲基化[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]组蛋白修饰和染色质重塑等。[/size][/font][font='times new roman'][size=16px]组蛋白修饰通过[/size][/font][font='times new roman'][size=16px]改变[/size][/font][font='times new roman'][size=16px]组蛋白与[/size][/font][font='times new roman'][size=16px]DNA[/size][/font][font='times new roman'][size=16px]的亲和性[/size][/font][font='times new roman'][size=16px]使[/size][/font][font='times new roman'][size=16px]染色质的结构状态[/size][/font][font='times new roman'][size=16px]紧密或松弛[/size][/font][font='times new roman'][size=16px],进而影响基因表达[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]包括乙酰化、甲基化、磷酸化等,其中乙酰化是最重要的修饰方式之一。组蛋白乙酰化主要发生在组蛋白[/size][/font][font='times new roman'][size=16px]H3 Lys[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]位点[/size][/font][font='times new roman'][size=16px]上,[/size][/font][font='times new roman'][size=16px]在癌症进展中发挥双重作用,[/size][/font][font='times new roman'][size=16px]既[/size][/font][font='times new roman'][size=16px]参与肿瘤抑制基因的沉默,[/size][/font][font='times new roman'][size=16px]又[/size][/font][font='times new roman'][size=16px]增强癌基因的表达[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]它受[/size][/font][font='times new roman'][size=16px]HAT[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]HDAC[/size][/font][font='times new roman'][size=16px]共同调控。[/size][/font][font='times new roman'][size=16px]HDAC[/size][/font][font='times new roman'][size=16px]去[/size][/font][font='times new roman'][size=16px]除[/size][/font][font='times new roman'][size=16px]Lys[/size][/font][font='times new roman'][size=16px]残基上的乙酰基,[/size][/font][font='times new roman'][size=16px]DNA[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]本身带有负电荷[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]与组蛋白[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]正电性[/size][/font][font='times new roman'][size=16px]增强)结合更加紧密[/size][/font][font='times new roman'][size=16px],转录调控蛋白不易[/size][/font][font='times new roman'][size=16px]与[/size][/font][font='times new roman'][size=16px]DNA[/size][/font][font='times new roman'][size=16px]结合[/size][/font][font='times new roman'][size=16px],从而抑制[/size][/font][font='times new roman'][size=16px]抑癌基因的[/size][/font][font='times new roman'][size=16px]转录[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]AT[/size][/font][font='times new roman'][size=16px]作用则相反,二者动态平衡才能使组蛋白乙酰[/size][/font][font='times new roman'][size=16px]化维持[/size][/font][font='times new roman'][size=16px]在正常水平。[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]DAC[/size][/font][font='times new roman'][size=16px]在多种肿瘤中过表达,干扰其活性、抑制其功能[/size][/font][font='times new roman'][size=16px]是有效[/size][/font][font='times new roman'][size=16px]的治疗手段[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]HDACI[/size][/font][font='times new roman'][size=16px]是重要的表观调控[/size][/font][font='times new roman'][size=16px]药物,[/size][/font][font='times new roman'][size=16px]高效低毒,通过靶向阻断[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]DAC[/size][/font][font='times new roman'][size=16px]去乙酰化、促进组蛋白乙酰[/size][/font][font='times new roman'][size=16px]化发挥[/size][/font][font='times new roman'][size=16px]抗肿瘤作用。根据化学结构的不同,[/size][/font][font='times new roman'][size=16px]HDACI[/size][/font][font='times new roman'][size=16px]分为异羟肟酸(异羟肟酸酯)、短链脂肪(脂肪族)酸、环状四肽[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]苯甲酰胺和[/size][/font][font='times new roman'][size=16px]Sirt[/size][/font][font='times new roman'][size=16px]抑制剂[/size][/font][font='times new roman'][size=16px]五类。[/size][/font][font='times new roman'][size=16px]在单[/size][/font][font='times new roman'][size=16px]药[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]或与传统化疗药物联合使用时,[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]DACI[/size][/font][font='times new roman'][size=16px]可[/size][/font][font='times new roman'][size=16px]阻滞细胞周期[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]抑制迁移和侵袭,诱导癌细胞分化[/size][/font][font='times new roman'][size=16px]、自噬[/size][/font][font='times new roman'][size=16px][[/size][/font][font='times new roman'][size=16px]7][/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]凋亡,[/size][/font][font='times new roman'][size=16px]抗血管生成等,对包括[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC[/size][/font][font='times new roman'][size=16px]在内的多种肿瘤均有抑制作用。[/size][/font][font='times new roman'][size=16px]VPA[/size][/font][font='times new roman'][size=16px]作为[/size][/font][font='times new roman'][size=16px]HDAC[/size][/font][font='times new roman'][size=16px]I[/size][/font][font='times new roman'][size=16px]可降低[/size][/font][font='times new roman'][size=16px]HDAC4[/size][/font][font='times new roman'][size=16px]表达[/size][/font][font='times new roman'][size=16px],增加组蛋白[/size][/font][font='times new roman'][size=16px]H4[/size][/font][font='times new roman'][size=16px]乙酰化,激活[/size][/font][font='times new roman'][size=16px]Notch1[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]Notch[/size][/font][font='times new roman'][size=16px]靶基因[/size][/font][font='times new roman'][size=16px]HES1[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]P21[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]Notch[/size][/font][font='times new roman'][size=16px]信号通路,阻滞[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC[/size][/font][font='times new roman'][size=16px]细胞周期[/size][/font][font='times new roman'][size=16px]于[/size][/font][font='times new roman'][size=16px]G1[/size][/font][font='times new roman'][size=16px]期,抑制细胞生长[/size][/font][font='times new roman'][size=16px],诱导细胞凋亡[/size][/font][font='times new roman'][size=16px][[/size][/font][font='times new roman'][size=16px]8][/size][/font][font='times new roman'][size=16px]。在丁酸钠作用下,[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC[/size][/font][font='times new roman'][size=16px]细胞系[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]446[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]G1[/size][/font][font='times new roman'][size=16px]期细胞增多[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]而[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]期和[/size][/font][font='times new roman'][size=16px]G[/size][/font][font='times new roman'][size=16px]2/M[/size][/font][font='times new roman'][size=16px]期细胞相对减少[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]出现[/size][/font][font='times new roman'][size=16px]G[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]期阻滞现象[/size][/font][font='times new roman'][size=16px],可能与其上调[/size][/font][font='times new roman'][size=16px]P21[/size][/font][font='times new roman'][size=16px]表达有关[/size][/font][font='times new roman'][size=16px]。当前[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]美国食品药品监督管理局批准[/size][/font][font='times new roman'][size=16px]SAHA[/size][/font][font='times new roman'][size=16px]、罗米地辛、帕[/size][/font][font='times new roman'][size=16px]比司他[/size][/font][font='times new roman'][size=16px]等[/size][/font][font='times new roman'][size=16px]用于[/size][/font][font='times new roman'][size=16px]血液系统恶性肿瘤[/size][/font][font='times new roman'][size=16px]的治疗[/size][/font][font='times new roman'][size=16px]。[/size][/font]
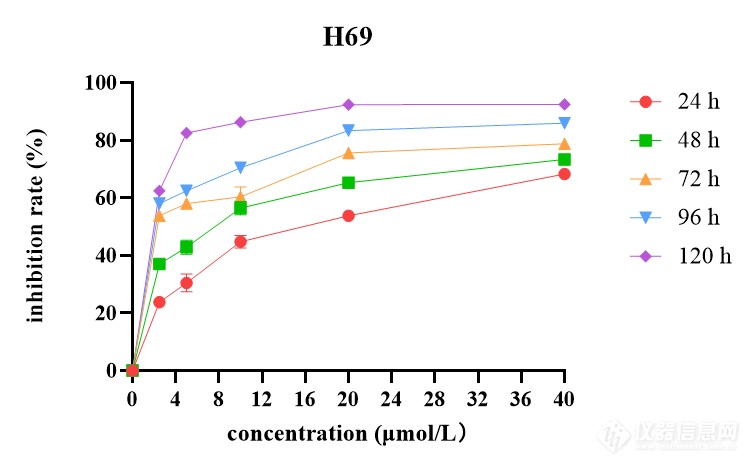
[align=left][size=18px]西达本胺促进[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系组蛋白乙酰化[/size][/align][align=left][size=18px] [/size][size=18px] [/size][size=16px]为验证西达本胺是否上调[/size][size=16px]SCLC[/size][size=16px]细胞系的乙酰化水平,我们使用[/size][size=16px]Western blot[/size][size=16px]检测了不同浓度([/size][size=16px]I[/size][size=16px]C10[/size][size=16px]、[/size][size=16px]IC20[/size][size=16px]、[/size][size=16px]IC50[/size][size=16px])西达本胺处理[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系中乙酰化组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平,并以组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平为对照。结果如图所示。在四种亚型细胞系中,总组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平无变化,乙酰化组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达量随加药浓度增大而增多,这证明了西达本胺对[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系组蛋白乙酰化的促进作用,这种作用呈剂量依赖性。[/size][/align][align=left][size=18px]A[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350400898_8640_5887180_3.png[/img][/align][align=left][/align][align=left][/align][align=left][/align][align=center][/align][align=left][size=18px] [/size][size=18px]西达本胺通过线粒体凋亡途径诱导[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系凋亡[/size][/align][align=left][size=16px]我们的功能实验表明,西达本胺[/size][size=16px]可剂量依赖的[/size][size=16px]促进[/size][size=16px]SCLC[/size][size=16px]细胞[/size][size=16px]系[/size][size=16px]凋亡[/size][size=16px],但其机制尚未明确。[/size][size=16px]依据国内外报道,西达本胺主要通过线粒体凋亡途径诱导细胞凋亡[/size][size=16px]。除此之外,[/size][size=16px]西达本胺[/size][size=16px]能[/size][size=16px]使[/size][size=16px]线粒体[/size][size=16px]DNA[/size][size=16px]双链断裂,发生损伤。[/size][size=16px]为探究其是否通过此途径在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系中发挥作用,我们检测了加药[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H[/size][size=16px]446[/size][size=16px]、[/size][size=16px]H[/size][size=16px]526[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]细胞中由线粒体介导的[/size][size=16px]C[/size][size=16px]aspase[/size][size=16px]信号通路相关蛋白[/size][size=16px]Bcl-2[/size][size=16px],[/size][size=16px]Bax[/size][size=16px],细胞色素[/size][size=16px]C[/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 9[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved Caspase 9[/size][size=16px],[/size][size=16px]P[/size][size=16px]ARP[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved [/size][size=16px]PARP[/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 3[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved Caspase 3[/size][size=16px]以及[/size][size=16px]D[/size][size=16px]NA[/size][size=16px]双链断裂标志物[/size][size=16px] [/size][size=16px]γH2AX[/size][size=16px]表达水平。[/size][size=16px]Western blot[/size][size=16px]结果显示,[/size][size=16px]Ca[/size][size=16px]spase 9[/size][size=16px],[/size][size=16px]P[/size][size=16px]ARP[/size][size=16px] [/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 3[/size][size=16px]表达水平无明显变化,[/size][size=16px]Bcl-2[/size][size=16px]表达下调,其余蛋白表达均上调。这些结果表明,在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞中,西达本胺可以通过线粒体凋亡途径诱导细胞凋亡。[/size][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][size=16px]A[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350402755_79_5887180_3.png[/img][/align][align=left][size=18px] [/size][size=18px]西达本胺通过抑制[/size][size=18px]C[/size][size=18px]yclin-CDK[/size][size=18px]复合物活性阻滞[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系周期[/size][/align][align=left][font='宋体'][size=16px]据文献报道,[/size][/font][size=16px]不同[/size][size=16px]HDACI[/size][size=16px]对不同细胞阻滞时相不一致。为验证西达本胺对[/size][size=16px]SCLC[/size][size=16px]细胞周期的作用,我们检测了[/size][size=16px]经[/size][size=16px]西达本胺[/size][size=16px]处理[/size][size=16px]48[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H446[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]细胞中细胞周期相关蛋白的表达水平,如图所示。[/size][size=16px]在[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞系中[/size][size=16px]P21[/size][size=16px]、[/size][size=16px]P27[/size][size=16px]表达上调,[/size][size=16px]C[/size][size=16px]yclin A2[/size][size=16px]与[/size][size=16px]C[/size][size=16px]DK[/size][size=16px]2[/size][size=16px]表达下调[/size][size=16px],[/size][size=16px]说明西达本胺阻滞[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]于[/size][size=16px]S[/size][size=16px]期。在[/size][size=16px]H446[/size][size=16px]细胞系中[/size][size=16px]C[/size][size=16px]yclin E1[/size][size=16px]与[/size][size=16px]C[/size][size=16px]DK2[/size][size=16px]表达下调[/size][size=16px],说明西达本胺阻滞其于[/size][size=16px]G[/size][size=16px]1[/size][size=16px]/S[/size][size=16px]期。[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350422585_1956_5887180_3.png[/img][size=16px] [/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350405804_8826_5887180_3.png[/img][/align][align=left][size=18px]小结[/size][/align][size=16px]1[/size][size=16px].[/size][size=16px]西达本胺可以增强[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系组蛋白乙酰化水平。[/size][size=16px]2.[/size][size=16px]西达本胺诱导[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞凋亡的机制可能与其激活线粒体介导的[/size][size=16px]caspase[/size][size=16px]凋亡途径有关。[/size][size=16px]3[/size][size=16px].[/size][size=16px]西达本胺可阻滞[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞周期,可能与其上调细胞周期蛋白激酶抑制剂表达、从而抑制[/size][size=16px]C[/size][size=16px]yclin-CDK[/size][size=16px]复合物活性有关。[/size]
想找提取胰蛋白酶和胰凝乳蛋白酶的文献,先谢谢各位了!1、猪胰蛋白酶、胰凝乳蛋白酶的分离和纯化,中国生化药物杂志,1988年 03期:1-5 2、胰岛素-胰酶联产工艺研究初报,生化药物杂志,1986年 04期:56-573、猪胰脏蛋白酶的生产,生化药物杂志,1984年 04期:1-44、亲和层析和离子交换组合技术分离胰脏中的蛋白酶及其抑制剂,生化药物杂志,1989年,1期:26-29。
请教高手,样品为复方硫酸盐溶液,含高浓度的钠3.5%、钾0.8%、镁0.2%,[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]怎样选择抑制剂,是否浓度太大,需要稀释多少倍合适?
[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]仪器,测金属铷离子已知浓度。测试时的吸光度保证其在0.3~0.4 可是测出来是的数据却不是已知浓度的值,10测得为6mg/L,发现不准后调节电解抑制剂,增大电解抑制剂的浓度量,结果测得的浓度高于原始浓度,现在不知道该怎么办。要求的电解抑制剂是2000mg/L,现在已经加倍为20000才能 测出的值是已知浓度,不知道这样做对吗,按照要求的电解抑制剂浓度的话,得不到已知浓度的值。怎么办呢,摸索了很久了.....
信号转导通路仍然是肿瘤研究、心脑血管疾病研究和免疫系统疾病研究的主要方向之一。该文章描绘了八个经常研究到的信号转导通路,并标出相关靶点的经典抑制剂,以便研究人员能更容易地判断自己所需的抑制剂。导读: 第一页 细胞凋亡信号转导通路第二页 DNA损伤信号转导通路第三页 JAK-STAT信号转导通路第四页 MAPK信号转导通路第五页 PI3K信号转导通路第六页 受体酪氨酸激酶信号转导通路第七页 TGF-beta/SMAD信号转导通路第八页 其他信号转导通路和因子对Wnt通路的影响
[size=14px] [/size] [size=14px]丹参酮是中药丹参的功效物质,丹参酮I(Tanshinone I,Tan I)是丹参酮的一个亚类,具有芳香二萜醌的结构,具有抗菌和抗炎活性。然而,其过高的亲脂性,效价较弱,溶解度低、不稳定等特质,极大地限制了丹参酮I的应用。因此,建立有效的化学演化机制,开发更有效的丹参酮Ⅰ衍生物具有重要意义。哌啶是一种重要的饱和杂环支架,是美国FDA批准的药物中最常用的氮杂环,具有良好的药理特性。该团队将丹参酮Ⅰ和哌啶的骨架杂交,得到了一类新型有效的NLRP3炎症小体抑制剂。2023年2月14日,浙江大学药学院的崔孙良和王毅团队在J Med Chem(IF=7.3)上发表题为“Scaffold Hybrid of the Natural Product Tanshinone I with Piperidine for the Discovery of a Potent NLRP3 Inflammasome Inhibitor”的文章,通过骨架杂交策略得到了一系列具有NLRP3抑制活性的丹参酮Ⅰ-哌啶杂化物,相较于丹参酮Ⅰ,这些化合物在活性、选择性和类药性具有显著改善。其中化合物5j、12a和12d对IL-1β的分泌有较强的抑制作用,在脓毒症小鼠模型中也具有较好的治疗效果。机制研究表明,这些化合物可以阻断ASC的寡聚化,抑制NLRP3炎症小体的激活,且化合物5j可与NLRP3蛋白直接结合,对NLRP3蛋白具有显著亲和力。本研究发现了一种全新结构的丹参酮Ⅰ衍生物,为NLRP3炎性体抑制剂的开发提供了新的思路。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]1、设计合成了36种Tan Ⅰ-哌啶杂化物前期研究发现Tan Ⅰ中的醌结构是其主要药效团,不宜进行结构修饰。因此研究团队从呋喃结构入手,通过支架杂交的策略,利用哌啶合成出了5个系列 36个Tan Ⅰ的衍生物。为了提升反应活性,在引入哌啶骨架前,研究团队将Tan Ⅰ中的醌并呋喃部分活化为富电子的苯并呋喃。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]2、体外生物学评价Tan Ⅰ-哌啶杂化物抗炎活性前期研究发现Tan Ⅰ具有抗炎活性,而NLRP3炎症小体作为炎症反应的核心,被证明与多种炎症性疾病相关。因此,作者选用小鼠腹膜巨噬细胞(PMs)开展了一系列体外生物学评价,首先通过MTT法发现36种Tan Ⅰ-哌啶杂化物在4 μΜ浓度无明显细胞毒性,随后发现与Tan-I相比,化合物5d、5j、10c、10f、10g、12a、12d在2 μΜ浓度下更能抑制IL-1β分泌,其中化合物12d与经典的NLRP3抑制剂MCC950活性相当。综合构效关系结果发现引入氢键受体或亲水基团可提升抑制活性(5j、12a、12d),于是作者选用化合物5j、12a、12d作为进一步的研究对象。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]3、化合物5j、12a和12d阻断NLRP3炎症小体激活,是广谱抑制剂NLRP3炎症小体通路包含准备和激活两个阶段,准备阶段pro-IL-1β和pro-caspase-1的表达升高,而激活阶段IL-1β和caspase-1分泌增加。作者发现化合物5j、12a、12d可抑制IL-1β和caspase-1的分泌,而对pro-IL-1β和pro-caspase-1的表达没有显著影响,表明它们通过阻断激活阶段而不是准备阶段来抑制NLRP3炎症小体活化。此外,5j、12a、12d也可以抑制尿酸钠晶体(MSU)、尼日利亚菌素(Nig)刺激的NLRP3炎症小体激活,表明5j、12a和12d是针对NLRP3炎症小体激活的广谱抑制剂。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]4、Tan Ⅰ-哌啶杂化物5j/12a/12d可抑制ASC寡聚化,5j可直接结合NLRP3蛋白ASC寡聚化可促进caspase-1的活化,是NLRP3炎症小体活化的标志之一。作者进一步研究化合物5j、12a、12d抑制NLRP3炎症小体的作用机制,通过免疫荧光实验发现在添加化合物5j、12a、12d和阳性药MCC950时,ASC寡聚化形成的斑点显著减少,表明它们均可抑制ASC寡聚化。接着利用表面等离子体共振分析(SPR)和细胞热位移测定(CETSA)实验证明化合物5j和NLRP3存在直接互作。[/size] [size=14px] [/size] [size=14px]5、Tan Ⅰ-哌啶杂化物在脓毒症小鼠模型的体内抗炎评价接着作者对Tan Ⅰ-哌啶杂化物5j、12a、12d进行了成药性评价,发现它们相较于Tan Ⅰ有极大的改善。进一步开展体内抗炎效果评价,发现在LPS诱导的炎症性脓毒症小鼠模型中,化合物5j、12a和12d预处理可以显著降低IL-1β的释放,显著改善肺组织病理损伤,如肺泡壁增厚明显减轻,粒细胞数量和炎症浸润显著减少。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]总结该研究通过骨架杂交策略得到了一系列具有NLRP3抑制活性的丹参酮Ⅰ-哌啶杂化物,与原型丹参酮Ⅰ相比,这些新的结构化合物在效力、选择性和类药性方面有显著改善,其中化合物5j、12a和12d对IL-1β的分泌具有高抑制活性。机制研究表明,这些化合物可以阻断ASC的寡聚化,抑制NLRP3炎症小体的激活,同时SPR和CETSA显示化合物5j可与NLRP3蛋白直接结合。体内研究表明它们对脓毒症小鼠模型具有较好的治疗效果,研究开发出了一种丹参酮I的简单结构修饰策略并提供了一类新的有效的NLRP3炎症小体抑制剂。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size] [size=14px] [/size]
最近听说国外有一种新型的抑制剂,只要添加了无论牛奶中加入多少氯霉素,用什么试剂盒都检测不出来,深受牛奶商家的欢迎,诸位对于这个有没有了解啊。
新人做论文,检测丁烯二酸的顺反异构体,由于峰形问题,要加入磷酸,作为离子抑制剂,但是老师要求换其他的试试,以便说明选择磷酸的好处,请教一下,还有哪些是属于竞争性抑制剂或变性剂??
甜味抑制剂可以降低人对糖的感觉,不使人感觉不腻(有的产品如果糖的含量低,外观就不好看)。降糖剂一般用于用于月饼,糖果等产品。只是什么一类化合物?
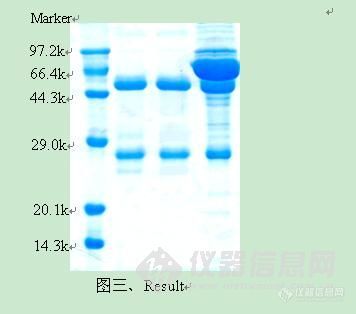
http://simg.instrument.com.cn/bbs/images/brow/em09511.gif一种新型的重组蛋白A柱 洗脱条件温和,充分防止蛋白变性蛋白A是一种金黄色葡萄球菌细胞壁蛋白质,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合。因而,将蛋白A与琼脂糖凝胶以一定的方式结合,可制备用于抗体纯化的亲和填料。早期的蛋白A柱结合的都是天然蛋白A。天然蛋白A由5个IgG结合域和其它未知功能的非Fc结合域组成,分子量约42KD,结构如图一所示。这种柱子对IgG的亲和能力很强,可以吸附大量的lgG。但同时,天然蛋白A的其他非结合域会和非目标蛋白结合,这样被洗脱下来的蛋白质纯度不够,会影响到后续的试验。为了解决这些问题,科学家们运用基因工程技术,克隆出蛋白A的基因,并对其进行改造,除去了一些不重要的非结合域。偶联这种重组蛋白A的琼脂糖凝胶柱在蛋白质纯化中,的确是提高了产物的纯度。目前,市场上绝大部分重组蛋白A柱都是这种产品。但是,纯化时所用的洗脱液一般为pH=2.7的甘氨酸溶液,如果洗脱效果不是很理想,还要降低pH,采用pH=1.9的甘氨酸溶液。由此可见,此法洗脱条件比较剧烈,最后收集的蛋白质很有可能变性,或者是复性困难。 这种洗脱条件剧烈的柱子结合的重组蛋白A一般具有5个串联结构域:E、D、A、B、C。虽然每个域均可以和IgG的Fc段结合,但不同的域结合强度略有差异。因此洗脱条件不均一,而且经常需要较低的pH值。GE的重组蛋白A柱即为这种类型,如图二所示。考虑到减少串联结构域的个数,并且采取同型结构域串联,就可以避免不同结构域与抗体Fc 段亲和性的差异从而使洗脱条件温和而均一,Putus研制出了含有三个串联B结合域的重组蛋白A,如图二所示。同时,我们用Putus重组蛋白A柱和GE重组蛋白A柱纯化人血浆,纯化的结果用于比较两种纯化柱的纯化效果,结果如图三所示。GE Putus 图二、重组蛋白A结构示意图待纯化样品:人血浆实验材料:GE公司的重组蛋白A柱(E、D、A、B、C结构域串联,见图二)Putus公司的重组蛋白A柱(3个B结构域串联,见图二)实验方法:分别按照每个公司的说明书来操作,洗脱条件分别为pH值3.0和4.5, SDS-PAGE检测结果如下: 上图从左边起,泳道1为标准蛋白Marker,泳道2为经过GE填料洗脱后抗体,泳道3为经过Putus填料洗脱抗体,泳道4为人血浆。从图中,我们可以看出,与GE 重组蛋白A填料从人血浆纯化抗体纯度比较,拥有3个同型结构域的Putus填料可以获得同样纯度的抗体。但是,后者的洗脱条件仅为4.5,高于前者的洗脱条件3.0。由此可见,使用具备较少B结构域的重组蛋白A柱也能获得高纯度的IgG,并且洗脱条件温和,能防止蛋白质聚集,保护蛋白质活性。http://cp00a3cee71b5f96adf6e669b5d7f56a9f11.jpg/http://C:\Documents and Settings\adim\桌面\001.jpghttp://ng1.17img.cn/bbsfiles/images/2017/01/201701191653_632703_1672347_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187444_1672347_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187445_1672347_3.jpg
问题描述:RNA 中含有逆转录抑制剂时,怎么处理?解答:[font=宋体]逆转录抑制剂包括:[/font][font=&]SDS[/font][font=宋体]、[/font][font=&]EDTA[/font][font=宋体]、甘油、焦磷酸钠、亚精胺和胍盐,可将质控[/font][font=&] RNA [/font][font=宋体]与样品核酸混合作为实验组(同时质控[/font][font=&] RNA [/font][font=宋体]同比稀释做为对照组),对比对照组与实验组[/font][font=&] Ct [/font][font=宋体]值以检测是否存在[/font][font=&]RNA [/font][font=宋体]抑制剂;若质控[/font][font=&] RNA [/font][font=宋体]与样品核酸混合后[/font][font=&] Ct [/font][font=宋体]变大([/font][font=&]ΔCt[/font][font=宋体]>[/font][font=&]2[/font][font=宋体]),则说明样品中存在逆转录抑制剂,可用[/font][font=&] 70%[/font][font=宋体]([/font][font=&]v/v[/font][font=宋体])乙醇对[/font][font=&] RNA [/font][font=宋体]沉淀进行清洗,以除去抑制剂。[/font]以上内容来自仪器信息网《PCR实战宝典》
[size=15px][font=宋体][color=black]水飞蓟宾([/color][/font][font=&][color=black]silybin[/color][/font][font=宋体][color=black])是一种是一种从水飞蓟科植物水飞蓟的果实和种子中分离得到的类黄酮木脂素,它具有保护肝脏、抗氧化、抗肿瘤和维持肝细胞膜稳定等广泛的药理活性,据报道是治疗肝脏疾病,包括非酒精性脂肪性肝病([/color][/font][font=&][color=black]non-alcoholic fatty liver disease[/color][/font][font=宋体][color=black],[/color][/font][font=&][color=black]NAFLD[/color][/font][font=宋体][color=black])的最有效的黄酮类化合物[i][/i],而水飞蓟宾的作用机制仍有待进一步明确。[/color][/font][/size] [size=15px][font=宋体][color=black]口服水飞蓟宾通过直接结合并抑制组蛋白去乙酰化酶[i][/i][/color][/font][font=&][color=black]2[/color][/font][font=宋体][color=black]([/color][/font][font=&][color=black]HDAC2[/color][/font][font=宋体][color=black])活性,增强[/color][/font][font=&][color=black]FXR[/color][/font][font=宋体][color=black]启动子区组蛋白乙酰化,促进回肠中[/color][/font][font=&][color=black]FGF-15/19[/color][/font][font=宋体][color=black]的表达,[/color][/font][font=&][color=black]FGF-15/19[/color][/font][font=宋体][color=black]进入循环发挥抗[/color][/font][font=&][color=black]NAFLD[/color][/font][font=宋体][color=black]作用。[/color][/font][font=&][color=black][/color][/font][/size] [img=,690,504]https://ng1.17img.cn/bbsfiles/images/2024/09/202409101438482204_1516_6561489_3.png!w690x504.jpg[/img] [size=15px][b][font=&][color=#4472c4]1[/color][/font][font=宋体][color=#4472c4]、水飞蓟宾通过非肝脏途径缓解小鼠[/color][/font][font=&][color=#4472c4]HFD[/color][/font][font=宋体][color=#4472c4]诱发的[/color][/font][font=&][color=#4472c4]NAFLD[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size] [size=15px][font=宋体][color=black]作者建立小鼠[/color][/font][font=&][color=black]HFD[/color][/font][font=宋体][color=black]诱发的[/color][/font][font=&][color=black]NAFLD[/color][/font][font=宋体][color=black]模型,探讨水飞蓟宾的治疗作用,发现灌胃水飞蓟宾治疗对[/color][/font][font=&][color=black]HFD[/color][/font][font=宋体][color=black]诱发的小鼠肝脏脂质堆积和损伤具有明确的恢复作用。随后采用[/color][/font][font=&][color=black][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[/color][/font][font=宋体][color=black]法测定了水飞蓟宾灌胃后的血清药物浓度和组织分布,发现其在肝脏和血清中的暴露量非常低,但在回肠中的暴露量相对较高。肝脏中分布的水飞蓟宾不足以减少肝细胞中的脂质蓄积,因此作者推测口服水飞蓟宾是通过肠道途径而不是吸收发挥抗[/color][/font][font=&][color=black]NAFLD[/color][/font][font=宋体][color=black]作用[/color][/font][/size] [size=15px][b][font=&][color=#4472c4]2[/color][/font][font=宋体][color=#4472c4]、水飞蓟宾促进[/color][/font][font=&][color=#4472c4]HFD[/color][/font][font=宋体][color=#4472c4]诱发的[/color][/font][font=&][color=#4472c4]NAFLD[/color][/font][font=宋体][color=#4472c4]小鼠回肠和结肠中[/color][/font][font=&][color=#4472c4]Fgf-15/19[/color][/font][font=宋体][color=#4472c4]表达[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size] [size=15px][font=宋体][color=black]大量数据已证实,一些细胞因子从肠道分泌,包括[/color][/font][font=&][color=black] FGF-15/19[/color][/font][font=宋体][color=black]、[/color][/font][font=&][color=black]GLP-1 [/color][/font][font=宋体][color=black]和[/color][/font][font=&][color=black] HGF[/color][/font][font=宋体][color=black],具有预防[/color][/font][font=&][color=black] NAFLD [/color][/font][font=宋体][color=black]的潜力,这促使作者探索水飞蓟宾是否能够诱导这些细胞因子的表达。结果显示水飞蓟宾治疗显著上调[/color][/font][font=&][color=black]HFD[/color][/font][font=宋体][color=black]诱发的[/color][/font][font=&][color=black]NAFLD[/color][/font][font=宋体][color=black]小鼠回肠和结肠中[/color][/font][font=&][color=black]Fgf-15[/color][/font][font=宋体][color=black]表达[/color][/font][font=宋体][color=black],上调大鼠肠上皮细胞及人结肠上皮细胞[/color][/font][font=&][color=black]FGF-19[/color][/font][font=宋体][color=black]表达[/color][/font][font=宋体][color=black]。[/color][/font][font=&][color=black][/color][/font][/size] [align=center] [/align] [size=15px][b][font=&][color=#4472c4]3[/color][/font][font=宋体][color=#4472c4]、特异性敲低肠道[/color][/font][font=&][color=#4472c4] FGF-15 [/color][/font][font=宋体][color=#4472c4]表达可逆转水飞蓟宾在小鼠体内的抗[/color][/font][font=&][color=#4472c4] NAFLD [/color][/font][font=宋体][color=#4472c4]作用[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size] [size=15px][font=宋体][color=black]为了更好地了解[/color][/font][font=&][color=black]FGF-15/19 [/color][/font][font=宋体][color=black]在水飞蓟宾治疗[/color][/font][font=&][color=black] NAFLD [/color][/font][font=宋体][color=black]中的作用和重要性,作者特异性地敲低小鼠肠道中[/color][/font][font=&][color=black]Fgf-15[/color][/font][font=宋体][color=black]的表达。结果显示敲低肠道中[/color][/font][font=&][color=black]Fgf-15[/color][/font][font=宋体][color=black]表达后,水飞蓟宾在小鼠体内的抗[/color][/font][font=&][color=black] NAFLD [/color][/font][font=宋体][color=black]作用消失,这些发现表明肠道来源的[/color][/font][font=&][color=black]FGF-15/19[/color][/font][font=宋体][color=black]在水飞蓟宾的抗[/color][/font][font=&][color=black]NAFLD[/color][/font][font=宋体][color=black]中起着至关重要的作用[/color][/font][font=宋体][color=black]。[/color][/font][font=&][color=black][/color][/font][/size] [align=center][img=图片,1,]data:image/svg+xml,%3C%3Fxml version='1.0' encoding='UTF-8'%3F%3E%3Csvg width='1px' height='1px' viewBox='0 0 1 1' version='1.1' xmlns='http://www.w3.org/2000/svg' xmlns:xlink='http://www.w3.org/1999/xlink'%3E%3Ctitle%3E%3C/title%3E%3Cg stroke='none' stroke-width='1' fill='none' fill-rule='evenodd' fill-opacity='0'%3E%3Cg transform='translate(-249.000000, -126.000000)' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E[/img][/align][align=center] [/align] [size=15px][b][font=&][color=#4472c4]4[/color][/font][font=宋体][color=#4472c4]、水飞蓟宾上调[/color][/font][font=&][color=#4472c4]NAFLD[/color][/font][font=宋体][color=#4472c4]小鼠回肠和结肠中[/color][/font][font=&][color=#4472c4]Fxr[/color][/font][font=宋体][color=#4472c4]([/color][/font][font=&][color=#4472c4]Fgf-15/19 [/color][/font][font=宋体][color=#4472c4]转录因子)表达[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size] [size=15px][font=宋体][color=black]转录因子[/color][/font][font=&][color=black]FXR[/color][/font][font=宋体][color=black]可能参与[/color][/font][font=&][color=black]FGF-15/19[/color][/font][font=宋体][color=black]的表达,作者研究了水飞蓟宾促进回肠和结肠中[/color][/font][font=&][color=black]Fgf-15/19[/color][/font][font=宋体][color=black]表达的作用机制。结果发现水飞蓟宾治疗可增加回肠和结肠中[/color][/font][font=&][color=black] Fxr[/color][/font][font=宋体][color=black]的表达,但不会增加十二指肠、空肠、肝脏和肾脏中的表达。在[/color][/font][font=&][color=black] IEC-6 [/color][/font][font=宋体][color=black]和[/color][/font][font=&][color=black] NCM460 [/color][/font][font=宋体][color=black]细胞中,水飞蓟宾也显示出促进[/color][/font][font=&][color=black] FXR[/color][/font][font=宋体][color=black]表达[/color][/font][/size] [size=15px][b][font=&][color=#4472c4]5[/color][/font][font=宋体][color=#4472c4]、[/color][/font][font=&][color=#4472c4]FXR[/color][/font][font=宋体][color=#4472c4]在水飞蓟宾介导的[/color][/font][font=&][color=#4472c4]FGF15/19 [/color][/font][font=宋体][color=#4472c4]表达和抗[/color][/font][font=&][color=#4472c4] NAFLD [/color][/font][font=宋体][color=#4472c4]作用中起重要作用[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size] [size=15px][font=宋体][color=black]为了进一步研究[/color][/font][font=&][color=black]FXR[/color][/font][font=宋体][color=black]在水飞蓟宾诱导肠上皮细胞[/color][/font][font=&][color=black]FGF-15/19[/color][/font][font=宋体][color=black]表达中的作用和重要性,作者用[/color][/font][font=&][color=black]siRNA[/color][/font][font=宋体][color=black]沉默[/color][/font][font=&][color=black]FXR[/color][/font][font=宋体][color=black]基因,结果显示敲低[/color][/font][font=&][color=black]FXR[/color][/font][font=宋体][color=black]后,水飞蓟宾促进[/color][/font][font=&][color=black]FGF-15/19[/color][/font][font=宋体][color=black]表达作用几乎消失[/color][/font][font=宋体][color=black],降低了水飞蓟宾对与[/color][/font][font=&][color=black] NAFLD [/color][/font][font=宋体][color=black]相关的参数的改善作用[/color][/font][font=宋体][color=black]。 [/color][/font][/size] [size=15px][b][font=&][color=#4472c4]6[/color][/font][font=宋体][color=#4472c4]、水飞蓟宾降低[/color][/font][font=&][color=#4472c4]HDAC2[/color][/font][font=宋体][color=#4472c4]活性促进小肠上皮细胞[/color][/font][font=&][color=#4472c4]FXR[/color][/font][font=宋体][color=#4472c4]和[/color][/font][font=&][color=#4472c4]FGF-15/19[/color][/font][font=宋体][color=#4472c4]的表达[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size] [size=15px][font=宋体][color=black]有报道称水飞蓟宾可以通过抑制组蛋白去乙酰化酶([/color][/font][font=&][color=black]HDAC[/color][/font][font=宋体][color=black])的活性,促进基因启动子区组蛋白乙酰化,从而上调基因表达。[/color][/font][font=&][color=black][/color][/font][/size] [size=15px][font=宋体][color=black]作者研究水飞蓟宾上调肠上皮细胞[/color][/font][font=&][color=black] FXR [/color][/font][font=宋体][color=black]表达的机制,通过[/color][/font][font=&][color=black]ChIP[/color][/font][font=宋体][color=black]发现水飞蓟宾和[/color][/font][font=&][color=black]TSA[i][/i][/color][/font][font=宋体][color=black](泛抑制剂,可抑制[/color][/font][font=&][color=black]HDAC[/color][/font][font=宋体][color=black])上调了[/color][/font][font=&][color=black]IEC-6 [/color][/font][font=宋体][color=black]细胞中[/color][/font][font=&][color=black]FXR [/color][/font][font=宋体][color=black]启动子的组蛋白[/color][/font][font=&][color=black] H3K27 [/color][/font][font=宋体][color=black]乙酰化水平。接着研究发现水飞蓟宾处理显著抑制了[/color][/font][font=&][color=black] IEC-6 [/color][/font][font=宋体][color=black]细胞中[/color][/font][font=&][color=black] HDAC [/color][/font][font=宋体][color=black]的活性而不不影响[/color][/font][font=&][color=black] HDAC1-3 [/color][/font][font=宋体][color=black]的蛋白质表达。这些数据表明,水飞蓟宾上调[/color][/font][font=&][color=black] FXR [/color][/font][font=宋体][color=black]启动子区组蛋白乙酰化,并通过抑制[/color][/font][font=&][color=black] HDAC [/color][/font][font=宋体][color=black]的活性而不是蛋白质表达来促进[/color][/font][font=&][color=black] FXR [/color][/font][font=宋体][color=black]的转录。[/color][/font][font=&][color=black][/color][/font][/size] [size=15px][font=宋体][color=black]为了确定水飞蓟宾影响的主要[/color][/font][font=&][color=black]HDAC[/color][/font][font=宋体][color=black]亚型([/color][/font][font=&][color=black]HDAC1/2/3[/color][/font][font=宋体][color=black]),作者观察了这三种抑制剂对[/color][/font][font=&][color=black] IEC-6[/color][/font][font=宋体][color=
[font=宋体][font=宋体]重组蛋白([/font][font=Calibri]recombinant protein[/font][font=宋体])是指应用重组 [/font][font=Calibri]DNA [/font][font=宋体]或重组 [/font][font=Calibri]RNA [/font][font=宋体]技术而获得的蛋白质。重组蛋白工程先应用基因克隆或化学合成技术获得目的基因([/font][font=Calibri]gene of interest[/font][font=宋体],[/font][font=Calibri]GOI[/font][font=宋体]),连接到适合的表达载体,导入到特定的宿主细胞,利用宿主细胞的遗传系统,表达出有功能的蛋白质分子。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白的产生是应用了重组[/font][font=Calibri]DNA[/font][font=宋体]或重组[/font][font=Calibri]RNA[/font][font=宋体]的技术从而获得的蛋白质。体外重组蛋白的生产主要包括四大系统:原核蛋白表达,哺乳动物细胞蛋白表达,酵母蛋白表达及昆虫细胞蛋白表达。生产的蛋白在活性和应用方法方面均有所不同。根据自身的下游运用选择合适的蛋白表达系统,提高表达成功率。[/font][/font][font=宋体] [/font][font=宋体]其获得途径可以分为体外方法和体内方法。两种方法的前提都是应用基因重组技术,获得连接有可以翻译成目的蛋白的基因片段的重组载体,之后将其转入可以表达目的蛋白的宿主细胞从而表达特定的重组蛋白分子。[/font][font=宋体] [/font][font=宋体][font=宋体][b]当前重组蛋白的生产主要有四大系统[/b]:原核表达系统:最常用的大肠杆菌蛋白表达,真核表达系统如酵母,哺乳动物细胞蛋白表达(常用的细胞[/font][font=Calibri]CHO[/font][font=宋体],[/font][font=Calibri]HEK293[/font][font=宋体])及、昆虫细胞蛋白表达系统。重组蛋白的产生尚可利用转基因动物的乳腺或者植物产生,产生的重组蛋白作为生物制药的产物,在医学中作用显著。利用基因工程技术,可以使细胞或者动物本身变成“批量生产药物的工厂”。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]以利用转基因动物的乳腺表达重组蛋白为例:其方法是将药用蛋白基因与乳腺蛋白基因的启动子等调控组件重组在一起,通过显微注射等方法,导入哺乳动物(哺乳动物才会泌乳)的受精卵中,然后,将受精卵送入母体内,使其生长发育成转基因动物。转基因动物进入泌乳期后,可以通过分泌的乳汁来生产所需要的蛋白质药品,因而称为动物乳腺生物反应器或乳房生物反应器。科学家已在牛和山羊等动物的乳腺生物反应器中表达出了抗凝血酶、血清白蛋白、生长激素和[/font][font=宋体]α[/font][font=Calibri]-[/font][font=宋体]抗胰蛋白酶等重要的医药产品。[/font][/font][font=宋体]重组蛋白在制药工业上主要是指表达获得的细胞因子、凝血因子或者人工设计的蛋白分子。[/font][font=宋体] [/font][font=宋体][font=宋体]目前,重组蛋白试剂已被广泛应用于生物药、细胞免疫治疗及诊断试剂的研发和生产中。其中重组蛋白药物是生物药物的重要组成成分,常被被广泛应用于医疗领域[/font][font=Calibri],[/font][font=宋体]包括肿瘤治疗、免疫调节、神经保护、结缔组织疾病、肾病治疗等。包括细胞因子类、抗体治疗性疫苗、激素及酶等。[/font][/font][font=宋体] [/font][font=宋体]义翘神州致力于提供[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白生产[/b][/url]、[url=https://cn.sinobiological.com/resource/protein-review/protein-expression][b]重组蛋白表达[/b][/url]及[url=https://cn.sinobiological.com/resource/protein-review/protein-production-systems][b]重组蛋白系统[/b][/url]详情的咨询与解决方案。为实验中特定的应用选择正确的表达系统是成功的关键所在。在选择表达系统时,蛋白溶解度、功能、纯化速度和产量通常是必须考虑的重要因素。此外,每个表达系统都有其独特的优势和挑战,这一点在选择时也需着重考虑。我们的专业团队将为您提供个性化的建议,以帮助您根据实验需求选择最合适的表达系统。[/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font][font=Calibri] [/font]
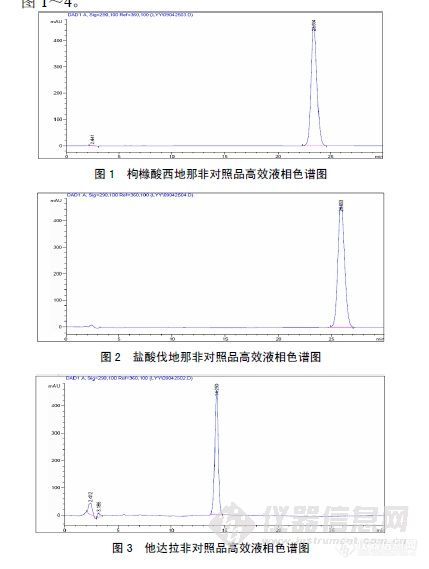
作者:倪晨;陈汀波;梁远园;王倩;(广东广州中医药大学;)摘要:目的建立快速、准确的检测中药保健品中非法添加磷酸二酯酶5(PDE5)抑制剂的方法。方法采用高效液相色谱法(HPLC)检测,DiamonsilC18色谱柱;流动相:乙腈-0.05mol·L-1三乙胺(用磷酸调PH至6.0)=40:60,流速1.0mL·min-1,检测波长290nm。结果该保健酒中未检出PDE5抑制剂:枸橼酸西地那非、盐酸伐地那非、他达拉非。结论该方法灵敏度高,重复性好,可用于PDE5抑制剂的定性检查。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208131450_383525_1606903_3.jpg
冶金冷轧中使用的抑制剂使用哪种测量仪表好啊 好着急啊
之前用原吸火焰测钾、钠,按行业标准规定的方法,加5%CsCl作为抗电离剂。现想用ICP-MS测试,因相关的行标还未发布,所以请教各位有经验的老师,ICP-MS测钾、钠需要加电离抑制剂吗?
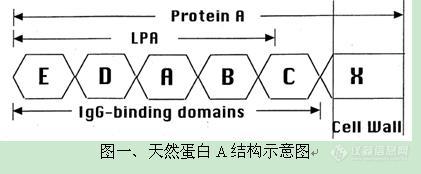
[em09511]一种新型的重组蛋白A柱 洗脱条件温和,充分防止蛋白变性蛋白A是一种金黄色葡萄球菌细胞壁蛋白质,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合。因而,将蛋白A与琼脂糖凝胶以一定的方式结合,可制备用于抗体纯化的亲和填料。早期的蛋白A柱结合的都是天然蛋白A。天然蛋白A由5个IgG结合域和其它未知功能的非Fc结合域组成,分子量约42KD,结构如图一所示。这种柱子对IgG的亲和能力很强,可以吸附大量的lgG。但同时,天然蛋白A的其他非结合域会和非目标蛋白结合,这样被洗脱下来的蛋白质纯度不够,会影响到后续的试验。为了解决这些问题,科学家们运用基因工程技术,克隆出蛋白A的基因,并对其进行改造,除去了一些不重要的非结合域。偶联这种重组蛋白A的琼脂糖凝胶柱在蛋白质纯化中,的确是提高了产物的纯度。目前,市场上绝大部分重组蛋白A柱都是这种产品。但是,纯化时所用的洗脱液一般为pH=2.7的甘氨酸溶液,如果洗脱效果不是很理想,还要降低pH,采用pH=1.9的甘氨酸溶液。由此可见,此法洗脱条件比较剧烈,最后收集的蛋白质很有可能变性,或者是复性困难。 这种洗脱条件剧烈的柱子结合的重组蛋白A一般具有5个串联结构域:E、D、A、B、C。虽然每个域均可以和IgG的Fc段结合,但不同的域结合强度略有差异。因此洗脱条件不均一,而且经常需要较低的pH值。GE的重组蛋白A柱即为这种类型,如图二所示。考虑到减少串联结构域的个数,并且采取同型结构域串联,就可以避免不同结构域与抗体Fc 段亲和性的差异从而使洗脱条件温和而均一,Putus研制出了含有三个串联B结合域的重组蛋白A,如图二所示。同时,我们用Putus重组蛋白A柱和GE重组蛋白A柱纯化人血浆,纯化的结果用于比较两种纯化柱的纯化效果,结果如图三所示。GE Putus 图二、重组蛋白A结构示意图待纯化样品:人血浆实验材料:GE公司的重组蛋白A柱(E、D、A、B、C结构域串联,见图二)Putus公司的重组蛋白A柱(3个B结构域串联,见图二)实验方法:分别按照每个公司的说明书来操作,洗脱条件分别为pH值3.0和4.5, SDS-PAGE检测结果如下: 上图从左边起,泳道1为标准蛋白Marker,泳道2为经过GE填料洗脱后抗体,泳道3为经过Putus填料洗脱抗体,泳道4为人血浆。从图中,我们可以看出,与GE 重组蛋白A填料从人血浆纯化抗体纯度比较,拥有3个同型结构域的Putus填料可以获得同样纯度的抗体。但是,后者的洗脱条件仅为4.5,高于前者的洗脱条件3.0。由此可见,使用具备较少B结构域的重组蛋白A柱也能获得高纯度的IgG,并且洗脱条件温和,能防止蛋白质聚集,保护蛋白质活性。[IMG]http://CP00A3CEE71B5F96ADF6E669B5D7F56A9F11.jpg[/IMG][URL=http://C:\Documents and Settings\adim\桌面\001.jpg]http://C:\Documents and Settings\adim\桌面\001.jpg[/URL][img]http://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187443_1672347_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187444_1672347_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187445_1672347_3.jpg[/img]
[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]测纯水抑制剂饱和再生液200mmol/l磷酸淋洗液5.0mmol/l碳酸钠+5.0mmol/l碳酸氢钠万通[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]色谱柱A5-250[img]https://ng1.17img.cn/bbsfiles/images/2022/12/202212060913444953_2987_5377725_3.png[/img]
待测物质为弱酸性物质,用缓冲溶液和混酸做为离子抑制剂有什么区别?谢谢[em0815]
一些蛋白质的分子量与Stokes半径:蛋白质 分子量(kD)Stokes半径(nm)乳清蛋白 12.4 2.01核糖核酸酶 13.7 1.92肌红蛋白 17.0 2.00大豆胰蛋白酶抑制剂 21.5 2.26碳酸酐酶 31.0 2.35辣根过氧化物歧化酶 40 3.00卵清蛋白 45 2.80血红蛋白(人)64.5 3.08牛血清白蛋白 70 3.65酵母醇脱氢酶 150 4.55血浆铜蓝蛋白 151 4.73谷氨酸脱氢酶 258 6.00甲状腺球蛋白 670 8.25芜菁花叶病毒 3500 ~12.0
谢谢,有谁可以告知本人BOD测量中的硝化抑制剂(ATH)的成分是什么。
我们长期专注于FERMENTEK公司是全球排名前100名的以色列著名生物科技公司,长期专著于提供真菌毒素/生物毒素/神经生物学和细胞信号传导和医药中间体产品。主要有:毒素/离子通道调节剂//神经营养因子、细胞内Ca2+及磷酸化抑制剂等高纯度信号转导研究用试剂Thapsigargin 肌浆网钙泵抑制剂(TG) Leptomycin B 细霉素BBafilomycin A1 巴佛洛霉素A1 Bafilomycin B1 巴佛洛霉素B1Geldanamycin 苯醌安莎霉索(GDM) Ionomycin, Ca salt 钙离子载体Ionomycin,free acid钙离子载体 A23187, 4-Bromo 钙离子载体 A23187, Mixed Ca/Mg salt A23187 (free acid) Paclitaxel (taxol) 紫杉醇 Docetaxel(toxotere) 多烯紫衫醇 Equol 雌马酚Thapsigargin肌浆网钙泵抑制剂(TG) Staurosporine星孢菌素Bisindolylmaleimides酪氨酸磷酸化-抑制剂 Phorbol Esters佛波醇酯4α-Phorbol Phorbol 12,13-Dibutyrate 蛋白激酶 c的激活剂咐噼醇基酯4α-Phorbol 12,13-Dibutyrate 4α-Phorbol 12,13-Didecanoate Phorbol 12-Myristate 13-Acetate 4α-Phorbol 12-Myristate 13-Acetate Tyrphostins Calyculin A 花萼海绵诱癌素CA细胞凋亡相关试剂:Brefeldin A 布雷菲尔得菌素 Hypericin金丝桃素Thapsigargin肌浆网钙泵抑制剂(胡萝卜类素) Cerulenin浅蓝菌素 7Amino-Actinomycin D 7氨基放线菌素 Valinomycin缬氨霉素 Parthenolide 小白菊内酯Fumonisin B2 伏马毒素B2 Leptomycin B 细霉素BActinomycin D (dactomycin) 放线菌素D/IV Cyclopiazonic Acid 环丙阿尼酸Ionomycin 钙离子载体 K252A特异性酪氨酸激酶抑制剂 Cyclosporin A环胞霉素A细胞松弛素类试剂:Cytochalasin A 细胞松弛素A Cytochalasin B 细胞松弛素BCytochalasin C 细胞松弛素C Cytochalasin D 细胞松弛素DCytochalasin E 细胞松弛素E各类抑制剂7AAD(7-Amino-Actinomycin D) 7氨基放线菌素17AAG(17-(Allylamino)-18-demethoxy- geldanamycin) 17-丙烯胺-17-去甲氧格尔德霉素17DMAG(17-dimethylaminoethylamino-18-demethoxy-geldanamycin) Hsp90抑制剂 Cyclopamine环巴胺 A23187, 4-Bromo 钙离子载体A23187, Mixed Calcium / Magnesium salt A23187 (free acid) Actinomycin D (Dactinomycin, Dactomycin) 放线菌素D/IVacivicin 细胞毒素/γ-GTP抑制剂 Apicidin 组蛋白脱乙酰酶抑制剂Radicicol Hsp90特异性之阻断剂 Thapsigargin(TG) 肌浆网钙泵抑制剂Thiolutin 硫藤黄素 Triacsin C 脂酰CoA合成抑制剂 Trichostatin A 曲古菌素ATunicamycin N-糖基化抑制剂 Wortmannin(WT) 磷脂酰肌醇4-激酶的特异性抑制剂Bisindolylmaleimide I 蛋白激酶C-PKC抑制剂Bisindolylmaleimide I,Hydrochloride 蛋白激酶C-PKC抑制剂盐酸盐Bisindolylmaleimide VIII,Acetate salt 酪氨酸磷酸化-抑制剂Bisindolylmaleimide IX,Methanesulfonate salt 酪氨酸磷酸化-抑制剂Bisindolylmaleimide X,Hydrochloride salt 酪氨酸磷酸化-抑制剂Bisindolylmaleimide XI,Hydrochloride salt 酪氨酸磷酸化-抑制剂Tyrphostin AG 1478 酪氨酸磷酸化抑制剂
目的要求(1)了解克隆基因表达的方法和意义。(2)了解重组蛋白亲和层析分离纯化的方法。实验原理克隆基因在细胞中表达对理论研究和实验应用都具有重要的意义。通过表达能探索和研究基因的功能以及基因表达调控的机理,同时克隆基因表达出所编码的蛋白质可供作结构与功能的研究。大肠杆菌是目前应用最广泛的蛋白质表达系统,其表达外源基因产物的水平远高于其它基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的80%。本实验中,携带有目标蛋白基因的质粒在大肠杆菌BL21中,在 37℃,IPTG诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白可用一种通过共价偶连的次氨基三乙酸(NTA)使镍离子(Ni2+)固相化的层析介质加以提纯,实为金属熬合亲和层析(MCAC)。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。试剂和器材一、试剂 LB液体培养基:Trytone 10g, yeast extract 5g, NaCl 10g, 用蒸馏水配至1000mL. 氨苄青霉素:100mg/mL 上样缓冲液:100 mM NaH2PO4, 10 mMTris, 8M Urea, 10 mM2-ME, pH8.0 Washing Buffer:100 mM NaH2PO4, 10 mM Tris, 8 M Urea, pH6.3 Elution Buffer:100 mM NaH2PO4, 10 mMTris, 8M Urea, 500 mM Imidazole, pH8.0 IPTG二、器材摇床,离心机,层析柱(1′10 cm)操作方法一、氯霉素酰基转移酶重组蛋白的诱导1. 接种含有重组氯霉素酰基转移酶蛋白的大肠杆菌BL21菌株于5mL LB液体培养基中(含100ug/mL 氨苄青霉素),37℃震荡培养过夜。2. 转接1mL过夜培养物于100mL(含100ug/mL 氨苄青霉素)LB液体培养基中,37℃震荡培养至OD600 = 0.6 - 0.8。取10ul 样品用于SDS-PAGE 分析。3. 加入IPTG至终浓度0.5 mmol/l, 37℃继续培养1-3h.4. 12,000rpm 离心10 min, 弃上清,菌体沉淀保存于-20℃或-70℃冰箱中。二、氯霉素酰基转移酶重组蛋白的分离、纯化1. NTA层析柱的准备:在层析柱中加入1mL NTA介质,并分别用8mL 去离子水,8mL上样缓冲液洗涤。2. 重组蛋白的变性裂解:在冰浴中冻融菌体沉淀,加入5mL上样缓冲液, 用吸管抽吸重悬,超声波破裂菌体,用振荡器等轻柔的混匀样品60min, 4℃ 12000rpm 离心 30 min, 将上清吸至一个干净的容器中,并弃沉淀。取10ul 上清样品用于SDS-PAGE 分析。3. 上清样品以10-15mL/h 流速上Ni2+-NTA柱,收集流出液,取10ul样品用于SDS-PAGE 分析。4. 洗脱杂蛋白:用Washing Buffer以10-15mL/h流速洗柱,直至OD280 = 0.01.分步收集洗脱液,约3-4h,取10ul洗脱开始时的样品用于SDS-PAGE 分析。5. 洗脱目标蛋白:用Elution Buffer洗柱,收集每1 mL 级分,分别取10ul样品用于SDS-PAGE 分析。