近日CFDA对低价销售银杏叶企业进行的飞行检查查处了部分违法违规生产银杏叶提取物的企业,引起行业内外广泛关注。蒲友分享的吴浈副局长专项会议讲话中说“银杏叶...的问题不是个别...问题,已经有系统性...的苗头,一旦处理不好,...后果和...影响将不亚于2012年铬...胶囊事件。”问题的范围和深度可见一斑。 应该注意的是,在此问题出现直至爆发前的较长一段时间内,被寄予希望为药品质量守门把关的药品标准并未能发挥应有的作用。按照官方说法“提取工艺由稀乙醇改为3%盐酸,会造成药品有效成分的分解,虽然尚未发现对人体有害,但是严重影响药品的疗效。”这里可以确定的是,我们现行的标准不但不能发现并控制有效成分分解产物,甚至对于有效成分本身也缺乏控制能力(否则检验会发现含量下降)。联想到之前爆出的用苹果皮生产板蓝根事件,基于这样的水平,我们仰仗的质量标准如何起到控制产品质量进而保护患者健康的作用呢? 药品标准的适用性不足,一方面来源于药品检验本身的局限性,另一方面来源于中药产品的复杂性。 药品检验方法适用的前提需要满足很多基本条件,最起码的一条是你要我检验样品“橙子”的时候确实给我一个“橙子”。卖橙子的时候拿一个尺子卡一下,太大、太小的剔除,剩下的是好橙子,这时候如果你拿一个不大不小的苹果放进去,按照尺寸标准来说,依然是一个好橙子......。在面对复杂样品的检验时,我们的标准就是这样无力,药品标准本身是由一个个“白马非马”的故事组成的,A药品酸度为5.0你不能说酸度为5.0的是A药品,A药品在254nm波长紫外线下有最大吸收你不能说在254nm有最大吸收的是A药品......,面对一个超出肉眼分辨极限的药品检验,我们制定的标准就像一个缺乏想象力的人来描述圆明园一样“很大、华美、艺术典范、皇家园林.....”然后咋听之下你知道说的是哪里吗? 如果说药品标准本身属于防君子不防小人的矮篱笆,中药又把这个管理难度放大了许多倍。具体成分不明确、具体结构不明确、作用机制不明确,甚至安全性也不够明确.....。以其昏昏使人昭昭,自己都没有搞清楚,却想去使别人明白,能做到吗? 因此,标准只是一个好药的入门条件,真正要控制好产品质量,功夫在标准之外。
此EXCEL表格是武汉市药品检验所周元姚所长编写的,收录了中国国内绝大多数药品(不包括中药)在中国药典、卫生部药品标准、进口药品注册标准、英国药典、美国药典、日本药局方的收载情况,对大家快速检索药品标准非常有帮助。目前更新到2004年,大家如果谁有时间及条件的话可在此基础上继续更新。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=9138]国内外药品标准检索表[/url]
本人正在做中药的生物碱提取,我之前看了资料,对样品进行了初步提取(最后一步是氯仿萃取),然后选择改良碘化铋钾、碘-碘化钾和磷钼酸进行定性,但是当我把这三种试剂分别滴到样品之后,问题来了:1、 理论说这三种试剂如果有阳性反应的话,是呈橘红色、棕黄色的,但我滴下去后,出现的是分层了,而没有沉淀出现。为什么大家都说加进去后会有沉淀呢?样品的溶剂是氯仿,而沉淀试剂的溶剂是稀冰醋酸,这两者是不相溶的,那何来的反应出现沉淀呢?2、我要提取的生物碱,目前还没有标准品可以购买,对于这种没有标准品的生物碱,要拿什么做对照品呢?请大家多多指教。我查了文献,也有其他人在做同样这种情况的实验(没有标准品的生物碱提取),但他们是用其他的生物碱作为对照品来鉴别的,可以这样的吗?这样做的依据是什么呢?好迷茫啊,希望大家多多回复啊!!!!谢谢了!
本人正在做中药的生物碱提取,我之前看了资料,对样品进行了初步提取(最后一步是氯仿萃取),然后选择改良碘化铋钾、碘-碘化钾和磷钼酸进行定性,但是当我把这三种试剂分别滴到样品之后,问题来了:1、 理论说这三种试剂如果有阳性反应的话,是呈橘红色、棕黄色的,但我滴下去后,出现的是分层了,而没有沉淀出现。为什么大家都说加进去后会有沉淀呢?样品的溶剂是氯仿,而沉淀试剂的溶剂是稀冰醋酸,这两者是不相溶的,那何来的反应出现沉淀呢?2、我要提取的生物碱,目前还没有标准品可以购买,对于这种没有标准品的生物碱,要拿什么做对照品呢?请大家多多指教。我查了文献,也有其他人在做同样这种情况的实验(没有标准品的生物碱提取),但他们是用其他的生物碱作为对照品来鉴别的,可以这样的吗?这样做的依据是什么呢?好迷茫啊,希望大家多多回复啊!!!!谢谢了!
药品标准是药品检验必须遵循的法定依据,是药品生产的法定技术准绳,并对临床用药发挥重要的指导作用。国务院食品药品监督管理部门设置的药典委员会负责药品质量标准的制定和修订。1. 采用和执行药品质量标准的现状药品质量标准主要分为《中华人民共和国药典》及其增补本;国务院药品监督管理部门颁布的国家药品标准(包括国家食品药品监督管理局药品注册批件或修订件);卫生部药品标准;药品注册标准;国家食品药品监督管理局药品检验补充方法和检验项目批准件等;省级中药材标准;省级中药饮片炮制规范;医疗机构制剂标准等。按照《药品管理法》第六条的规定,我国市(地)以上药品检验所承担着对上市药品质量的监督抽验任务。以北京为例,中国药品生物制品检验所和北京市药品检验所主要承担着药品的注册检验、进口药品的检验、生物制品和全国评价性药品的检验;大量的上市后药品的监督抽验主要由各区县所负责。以下谈谈采用和执行药品质量标准的现状。1.1药品质量标准难求 无论是从版本上还是从分类上,现行的药品质量标准都是一个庞大的标准库。对于每年颁发的新药和仿制药品标准、试行标准等,有关部门只将标准发送到研制单位和当地省级食品药品监督管理部门和省级药品检验所,基层药检所很难得到。笔者所在的北京市区级中心药品检验所在日常工作中经常遇到查找和索取药品标准的情况。为了履行自己的检验职责,基层所要自己向相关单位索取药品标准。但是能否及时要到标准,要来的标准是否就是真实有效的,基层药检所本身由于自身权限的局限,已经无能为力了。这种局面的长期存在对公众的用药安全构成潜在的风险。1.2检验方法参差不齐目前,国内不同药品生产企业生产的同一种药品,执行不同的药品标准的现象比较普遍,甚至有同一生产企业生产的同一种药品仅因为规格不同,执行的药品标准也有不同。对于同一种药品,有时检验的项目和参数不同;有时项目一样,具体的检验方法又不同。例如常用的OTC药品—健胃消食类制剂,尽管《中国药典》收录有健胃消食片,可是由于规格的改变或者生产厂家的不同,可能具体执行的就是单页标准。又如常用的抗感冒药复方氨酚烷胺类制剂,不同厂家做含量测定时,有的采用的是传统的化学滴定,有的采用高效液相色谱法。这会导致同一个名称的上市药品其内在质量其实各异,对于患者来说,很难获得同一的疗效和安全保障。1.3标准针对性待商榷例如,(1)中成药中非法添加西药是近年来打击的重点。有关部门也专门汇编了部分厂家部分品种的补充检验方法,所用的仪器相当一部分是液相色谱-质谱联用设备。目前,在北京地区的18个区县所中没有一家有该设备。即使遇到患者举报有类似情况时,我们就无能为力了。唯一的办法就是交给省(直辖市)药检所来做。(2)地高辛片是《中国药典》收录的品种,其质量标准项下既采用高效液相色谱法测定了含量均匀度,同时又采用高效液相色谱法测定含量。又如在很多中成药质量标准中既用HPLC法测定了某种成分的含量,又用TLC法做鉴别。这些检验项目单个来看,都是无可厚非的。但联合起来看则有重复检验的嫌疑。为了节约检验成本,同时也为了尽可能地实现低碳和环保的目的,不必过分追求检验项目的多和全。(3)新版《中国药典》中微生物限度采用方法验证试验,这在基层药检所的实际工作中不太适用,开展起来很困难。到目前为止,每年很少有检品做该项检验。2.对策
99.8%以上出口合格率的事实,证明了中国人在食品安全上可以做得很出色。这种给外人以优厚的高标准待遇,给自己人则按相对较低标准的做法,事实上是一种反向歧视。近日,国家质检部门有关负责人披露,中国食品出口合格率多年来一直保持在99.8%以上水平,由于“杰出努力”,凭借中国食品满足了全世界众多消费者对美食的追求。而与之形成对照的是,今年对1985家企业的抽查中,用于“内需”满足国人“美食追求”的食品批次抽样合格率只有93.5%。(新华网11月8日)食品的安全机制,是建立在“不合格零容忍”观念上,流通环节哪怕0.001%不合格,都会对消费者带来不容忽视的生命健康风险,一个负责任的制度设计应该是所有食品消费是安全的,不论是外国人独用还是国内人消费。国内人也拥有与外国人一样对安全美食享有平等的追求权。而“多年来保持99.8%以上出口合格率”这一“多年来”存在的事实,反复证明了中国人在食品安全上可以做得很出色,也一样能以同样出色的成绩回馈国内消费者的厚爱,从而消灭食品合格率“剪刀差”。然而,“多年来”这个愿望没有能实现。尤其是今年,地沟油、三聚氰胺重出江湖,二恶烷、聚二甲基硅氧烷等致癌物风波阵阵,数日前在辽宁查获的10.2吨“毒白菜”新闻及央视11月7日对中国食品滥用氢化油(“植物奶油”)现象的报道,表明国内食品安全依然堪忧,甚至从某一角度上讲,公众对93.5%“合格率水平”畸高也抱有怀疑。中国国内食品安全问题主因在于我们没有高水平的食品安全标准,也没有建立服务于此标准的检测技术能力。去年颁发了《中国食品安全法》,但作为最为重要的食品安全标准的制定权则留给了有关部门,使这一标准的基本定位权成为利益集团手中的橡皮泥,高标准甚至与欧盟标准看齐的努力几乎成了一句空话。没有高标准规范,法律的指引功能就无从发挥,反而会鼓励劣质企业,打击优质企业,形成生产质量恶性循环。与安全标准相对应的,就是建立严密的安全标准执行监督和检测机制,这同样需要通过上位立法,保障其预算投入,这样才能在检测技术研发和设备采购上不受地方或其他利益集团的掣肘,形成与时俱进的可持续监控能力。日本能对四百种农药残留物进行检测,而我国只有检测数十种农残的设备能力,一些速检蔬菜的检测方法,对韭菜等竟然毫无作用。99.8%以上出口合格率的事实,证明了中国人在食品安全上可以做得很出色。这种给外人以优厚的高标准待遇,给自己人则按相对较低标准的做法,事实上是一种反向歧视。近日,国家质检部门有关负责人披露,中国食品出口合格率多年来一直保持在99.8%以上水平,由于“杰出努力”,凭借中国食品满足了全世界众多消费者对美食的追求。而与之形成对照的是,今年对1985家企业的抽查中,用于“内需”满足国人“美食追求”的食品批次抽样合格率只有93.5%。(新华网11月8日)食品的安全机制,是建立在“不合格零容忍”观念上,流通环节哪怕0.001%不合格,都会对消费者带来不容忽视的生命健康风险,一个负责任的制度设计应该是所有食品消费是安全的,不论是外国人独用还是国内人消费。国内人也拥有与外国人一样对安全美食享有平等的追求权。而“多年来保持99.8%以上出口合格率”这一“多年来”存在的事实,反复证明了中国人在食品安全上可以做得很出色,也一样能以同样出色的成绩回馈国内消费者的厚爱,从而消灭食品合格率“剪刀差”。然而,“多年来”这个愿望没有能实现。尤其是今年,地沟油、三聚氰胺重出江湖,二恶烷、聚二甲基硅氧烷等致癌物风波阵阵,数日前在辽宁查获的10.2吨“毒白菜”新闻及央视11月7日对中国食品滥用氢化油(“植物奶油”)现象的报道,表明国内食品安全依然堪忧,甚至从某一角度上讲,公众对93.5%“合格率水平”畸高也抱有怀疑。中国国内食品安全问题主因在于我们没有高水平的食品安全标准,也没有建立服务于此标准的检测技术能力。去年颁发了《中国食品安全法》,但作为最为重要的食品安全标准的制定权则留给了有关部门,使这一标准的基本定位权成为利益集团手中的橡皮泥,高标准甚至与欧盟标准看齐的努力几乎成了一句空话。没有高标准规范,法律的指引功能就无从发挥,反而会鼓励劣质企业,打击优质企业,形成生产质量恶性循环。与安全标准相对应的,就是建立严密的安全标准执行监督和检测机制,这同样需要通过上位立法,保障其预算投入,这样才能在检测技术研发和设备采购上不受地方或其他利益集团的掣肘,形成与时俱进的可持续监控能力。日本能对四百种农药残留物进行检测,而我国只有检测数十种农残的设备能力,一些速检蔬菜的检测方法,对韭菜等竟然毫无作用。
用高效液相测生物碱,第一次标准品不出峰,换了根柱子问题解决了,可没过几天,标准品又不出峰了,怎么回事流动相(乙腈:水+0.1%乙二胺=60:40)标准品用乙腈定容样品分别用甲醇、乙醚、二氯甲烷定容
欧洲药典标准品介绍可提供1900多个参考标准品欧洲药典个论规定并正式有效:化学物质、生物制品和对照图谱。新:可在线查阅参考标准品批号有效期说明(BVS)。这个工具便于用户保证上批标准品效期的可追踪性。新启用参考标准品清单也同时在线公布。 欧洲药典:质量和可靠性的保证EDQM实验室按EP个论规定方法选择和检查参考标准品批号及其制备, 其官方报告由欧洲药典委员会批准。网址:http://crs.edqm.eu/需注意,欧洲药典标准品由于已通过欧洲药品委员会认证,故标准品不随带证书(见《欧洲药典关于标准品证书的声明》),纯度和有效期见以下介绍。欧洲药典关于纯度和有效期的说明:关于有纯度:一般可作为100%使用,详见以下描述。TOPICS : 03- Ph.Eur. REFERENCE STANDARDS (CRS/BRP) / 01- General / 05. How can I find out the assay/content of a CRS? You can obtain it from our catalogue of reference standards, which is available at http://CRS.edqm.eu. If the content is not required to perform the test(s) described in the Ph.Eur. monograph (see also the FAQ about "What is the intended use of CRS/BRP?"), it is not indicated in the catalogue or on the label (or on the leaflet) and you cannot assume the content of a CRS to be 100% for a quantitative test.However, when an impurity reference standard is used in a related substances test for the control of impurity, if no assigned content is stated on the label, the purity of the reference standard, for the purpose of this estimation, is considered to be 100 per cent.关于有效期:TOPICS : 03- Ph.Eur. REFERENCE STANDARDS (CRS/BRP) / 01- General / 04. How do we find out the Expiry date of CRS/BRP? No expiry date is indicated as European Pharmacopoeia Reference Standards are monitored regularly. It is down to the user to demonstrate that the CRS/BRP used in an official Ph. Eur. test or assay was current at the time of use. The “information” column of the catalogue may indicate an official date on which the batch is no longer valid as a CRS/BRP. Therefore, it is recommended to purchase only a sufficient amount for immediate need and to use the products as soon as possible. Moreover, the stability of the contents of opened vials or ampoules cannot be guaranteed.[em0812]
最近,我老师让我做一种上市药物的质量检测方法研究,但是需要这种药的质量标准做参考,我在药典里面查了下,没有这种药的信息,倒是有一个国家食品药品监督管理局颁布的执行标准。可是这个执行标准的内容貌似查不到,找了很久都查不到内容,难道这个执行标准是保密的?
农药残留检测需要标准物质或对照品来校准仪器和验证检测结果的准确性。这些标准物质或对照品是已知农残浓度的样品,用于进行定量分析和比较。 在农药残留检测中,常用的标准物质或对照品包括有机磷农药、氨基甲酸酯类农药以及其他常见农药的标准品。这些标准品应具有确定的化学结构、纯度和稳定性,以确保检测结果的准确性和可靠性。 通过与标准物质或对照品进行比对,可以验证快速检测结果的准确性和可靠性。同时,标准物质或对照品还可以用于建立检测方法的灵敏度和特异性,以及评估检测方法的性能。 需要注意的是,不同的农药残留检测方法可能需要不同的标准物质或对照品。因此,在选择和使用标准物质或对照品时,应根据具体的检测方法和要求来确定,并遵循相关的标准和规范。 此外,标准物质或对照品的来源和质量也是影响检测结果的重要因素。建议选择正规、有资质的供应商购买标准物质或对照品,并遵循正确的保存和使用方法,以确保检测结果的准确性和可靠性。 总之,标准物质或对照品在农药残留检测中扮演着至关重要的角色,它们是确保检测结果准确性和可靠性的重要保障。
[center]药品标准与药品批准文号综述[/center]1 国家药品标准1.1 建国以来,卫生部和SDA颁布的国家药品标准《中华人民共和国药典》 (以下简称中国药典)有1953年版、1963年版、1977年版、1985年版、 1990年版、1995年版、2000年版和2005年版, 1985年版以后的各版《中国药典》都颁布有增补本。1.2 卫生部颁布的国家药品标准有1963年版抗菌素部颁标准,以后数年大多颁布的是单行本的部颁药品标准。 1.3 1989年5月31日,卫生部发布《关于颁布第一批“乙肝扶正胶囊”等一百七十种中成药“卫生部药品标准”的通知》[卫药发(89)第28号],即《部颁标准“中药成方制剂” (第一册)》,该《通知》规定:《部颁标准“中药成方制剂”(第一册)》从1991年1月1日起开始执行,升为部颁标准后的同品种原地方药品标准即停止使用。从此以后,卫生部共颁布了中成药部颁标准1~20册、化学药品部颁标准1~6册。这些药品标准目前正在使用。 1.4 1998年SDA和2003年SFDA成立后,共颁布了局颁中药标准1—14册、化学药品标准1~16册、局颁新药转正标准1~45册。这些药品标准目前正在使用。 2 地方药品标准 2.1 1978年7月30日,国务院颁布《药政管理条例》(试行)(国发[1978]154号),该《条例》第十九条规定:“药品标准是国家对药品质量规格和检验方法所作的技术规定,必须遵照执行。药品标准分为三类:第一类:国家标准,即中华人民共和国药典(简称《中国药典》);第二类:卫生部颁发的药品标准(简称部颁标准);第三类:,地方标准,即各省、市、自治区卫生局审批的药品标准”。地方药品标准的法律地位首次以法规的形式予以明确规定,与中国药典、部颁标准一样作为药品生产、经营、使用、检验和药品监督管理部门共同遵循的法定依据。 2.2 1980年9月10日,卫生部颁布《药品标准工作管理办法》,该《办法》对中国药典、部颁标准、地方药品标准各自应收载的药品范围作了具体的划分。之后,各省级卫生厅(局)相继发布地方药品标准。 2.3 1984年9月20日,全国人大常委会六届七次会议通过的1985年7月1日实施的《中华人民共和国药品管理法》(以下简称《药品管理法》)第二十三条规定:“药品必须符合国家标准和省、自治区、直辖市药品标准。”地方药品标准又由国家以法律的形式确定其法律地位。2.4 1986年,卫生部开始进行地方药品标准的再评价工作,对中西药地方药品标准分期分批地开展整顿,拟逐步形成以国家药品标准为主体的药品标准。整顿的主要原因是各省之间制定的地方药品标准的技术规定差距较大,地方药品标准过多过滥。整顿的内容主要为同方异名、同名异方、药品组方不合理、药品疗效不确切等问题。 2.5 1994年8月17日,卫生部发布《关于中成药整顿工作有关问题的通知》[卫药发(1994)第 30号],该《通知》第二条规定: “根据我部卫药字(90)第?号文件精神,全面推行中成药国家标准,加速省(区、市)标准逐步过渡到国家药品标准的进程,争取1995年上半年完成中成药整顿全部品种的医学审查工作,1996年完成药学审查和部颁标准的颁布工作”。 2.6 1995年10月6日,卫生部发布《关于中成药国家标准问题的通知》 [卫药发(1995)第69号],该《通知》第1条规定: “根据卫药发 (1994)第30号文‘1996年完成药学审查和部颁标准的颁布工作’和卫药字(90)第7号文‘对治疗性中成药在1996年以后将全部实行国家药品标准的做法’的要求,请各地和药典会加快部颁标准的起草和审核工作,以使中成药品种由地方标准过渡到国家标准顺利进行”。第3条规定:“凡国家已颁布的中药品种质量标准,任何单位和个人必须坚决执行,同时原质量标准废止。如发现不按国标生产,或在流通和使用时发现与国标不符的药品,一律按《药品管理法》有关规定以劣药论处”。2.7 2001年2月16日,SDA发布《关于强化中成药国家标准管理工作的通知》(国药监注[2001] 83号),该《通知》就解决中成药地方标准的基本原则、方法和要求作了具体规定,并规定从2003年1月1日起,地方药品标准品种不得在市场上流通。 2.8 2001年2月28日,全国人大常委会九届二十次会议通过的2001年12月1日实施的《药品管理法》(修订)第三十二条规定:“药品必须符合国家标准”。“国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准”。明确地取消了地方药品标准。 2.9 2001年11月30日,SDA发布《关于有关地方药品标准执行问题的公告》 (国药管注[2001] 522号),《公告》的事项是《国务院办公厅关于施行(药品管理法有关药品标准延期执行问题的复函》(国办函[2001]68号):“从2001年12月1日起至2002年11月30日,国家药品监督管理局应当对《药品管理法》修订前各省、自治区、直辖市药品监督管理部门按照当时实行的地方药品标准批准生产的药品品种,逐个进行审查,经审查,对符合《中华人民共和国药品管理法》有关规定的,纳入国家药品标准,可以继续生产;对不符合规定的,立即停止该品种的生产并撤销其批准文号”。 2.10 按照地方标准生产药品的使用期限 2.10.1 2001年3月25日,SDA印发《关于妥善处理地方标准品种问题的通知》(国药监注(20013 96号),该《通知》规定:“(一)未纳入国家药品标准管理的地方药品标准品种应立即停止生产、销售和使用。(二)已纳入国家药品标准管理的原地方药品标准品种,有关药品生产企业应按我局颁布的国家药品标准组织生产;尚未换发批准文号的,可以使用原地方批准文号。按照国家药品标准生产的药品,可以在药品的有效期内流通和使用。(三)已纳入国家药品标准管理的原地方药晶标准品种,按照原地方药品标准生产的药品,可流通和使用至 2003年12月31日”。 2.10.2 SDA和SFDA2003年底以前共公布了三批停止使用的化学药品地标品种,规定被停止使用的化学药品标准从发文之日起,不再具有法律效力。在此之前生产并在市场上流通的品种,由生产企业在6个月内自行收回销毁。
[size=3][b]国家药品标准包括的类别探讨[/b][/size]国家药品标准包括:1)中国药典2000年版、2005年版;中国药典2002、2004年增补本; 中国药典2005年版勘误; 2006年、2009年增补本; 2)卫生部中药成方制剂一至二十册、二十一册(中药保密品种); 3)卫生部化学、生化、抗生素药品第一分册;4)卫生部药品标准(二部)一册至六册;6)卫生部药品标准藏药第一册、蒙药分册、维吾尔药分册; 7)卫生部新药转正标准1至75册; 8) 国家药品标准化学药品地标升国标一至十六册;国家药品标准化学药品地标升国标一至十六册勘误;9)国家中成药标准汇编内科心系分册、内科肝胆分册、内科脾胃分册、内科气血津液分册、内科肺系(一)、(二)分册、内科肾系分册、外科妇科分册、骨伤科分册、口腔肿瘤儿科分册、眼科耳鼻喉皮肤科分册、经络肢体脑系分册;10)国家药监局和国家药典委员会颁布的新药批件及修订批件;11) 进口药品复核标准汇编;12)进口药品单页标准不知除此之外还有什么标准吗,望补充
各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局: 根据国家卫生计生委食品司《关于食品用香精等标准有关问题的复函》(国卫食品标便函〔2014〕184号,详见附件),食品安全国家标准《食品添加剂食品用香精》(GB30616-2014)替代《食品添加剂乳化香精》(GB10355-2006)和《咸味食品香精》(QB/T2640-2004),替代《食用香精》(QB/T1505-2007)中食品用香精的内容,不包括QB/T1505-2007中的饲料用香精、接触口腔与嘴唇用香精等内容。食品安全国家标准《食品添加剂聚二甲基硅氧烷及其乳液》(GB30612-2014)替代原卫生部发布的食品添加剂乳化硅油产品标准。请各级食品药品监管部门在食品添加剂监管工作中遵照执行。 附件:国家卫生计生委食品司《关于食品用香精等标准有关问题的复函》(国卫食品标便函〔2014〕184号) 国家食品药品监督管理总局办公厅 2014年9月17日
在做药品检测中,检验依据容易出现疑问。同一种药品,同一处方,出现两个或者两个以上的药品检验标准,我们使用那一个,请各位老师说出自己的高见,谢谢!!!例如:脑心舒口服液,一个标准是:卫生部颁药品标准(中药成方制剂第二十册);一个标准是:国家药品监督局颁布的,国家中成药标准汇编(经络肢体 脑系分册)。
所有的药品对应的检查标准都可以通过这书方便的查询,希望能用的上[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=112138]药品标准检索2007[/url]
[color=#444444]要定标准检测坚果大豆,杏仁,碧根果酸价,过氧检测,样品需要去多少克?[/color]
http://www.sina.com.cn 2007年10月30日04:42 中国新闻网 中新网10月30日电 据国家食品药品监管局网站消息:日前,国家食品药品监管局新修订的《药品GMP认证检查评定标准》(以下简称《标准》)出台。新《标准》提高了GMP认证检查评定标准,进一步强化了软件管理。 新《标准》由原来的225条修改为259条,其中关键项目(条款号前加“*”)由56条调整为92条,一般项目由169条调整为167条。主要增加了对企业在人员资质、生产过程、质量控制、验证文件等软件管理方面的技术要求,以进一步加强对药品生产企业质量管理薄弱环节的监管,确保药品质量。 据了解,新《标准》的认证检查评定标准更加严格,按照原来的《标准》,如果认证检查发现严重缺陷少于3条,可以限期整改后通过认证,但新《标准》规定,如有严重缺陷将不予通过认证。同时,为有效制止药品生产企业在GMP认证中存在的弄虚作假行为,新《标准》规定,“在检查过程中,发现企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。检查组应调查取证,详细记录”。 在软件管理上,新《标准》进一步提高和完善了人员、质量、生产、物料和文件管理的检查项目。增加了“主管生产和质量管理的企业负责人应对本规范的实施和产品质量负责”、“企业负责人和各级管理人员应定期接受药品管理法规培训”、 “从事药品质量检验的人员应具有基础理论知识和实际操作技能”等内容。同时,新《标准》还强调了质量管理部门的独立性,赋予了质量管理部门对物料供应商选择的质量否决权等更多职责,规定“质量管理部门应制定和执行偏差处理程序,所有偏差应有记录,重大偏差应具有调查报告”、“企业应根据工艺要求、物料的特性以及对供应商质量体系的审核情况,确定原料药生产用物料的质量控制项目”、“物料应按批取样检验”等内容。 此外,新《标准》还强调与药品注册文件要求相匹配,要求原料药和制剂必须按注册批准的工艺生产。 新《标准》自2008年1月1日起施行。
如题。一直以来困扰我呐。为什么药厂的客户总是钟情于中检所,药典的标准品呢?有次一个药厂的客户因为中检所的产品断货,和我们买了一大批Dr.的罗红霉素,结果说是不合适,测下来的纯度不够,我们和供应商反映,最终无果。药厂的贴友多说说,必须使用药典系统的产品么?
近来想购买一些标准品,在中国药品生物制品鉴定所标准物质查询时,好几个都检索不到了,不知怎么回事,这些怎么购买啊,比如:咖啡因、红霉素等。大家说说如何解决啊?

国家食品药品监督管理局《直接接触药品的包装材料和容器标准》中国食品药品检定研究院包装材料与药用辅料检定所2012 年12 月资料简介:pdf电子书,可以复制粘贴,434页。主要内容: 《国家药品安全的“十二·五”规划》,把提高药品的质量标准作为一项重要的任务。在规划中,首次将新型药包材开发的关键技术列入其中,药包材标准的提高因此也被提上工作日程,以确保药品的质量和用药安全。 在国家局的正确领导下,在中检院领导的直接关怀下,在各参与兄弟单位的共同努力协助下,中国食品药品检定研究院包装材料与药用辅料检定所组织汇总形成了此次勘误修订后的《直接接触药品的包装材料和容器标准》汇编草稿。 本次标准汇编依照药包材的产品类别和标准内容,按照玻璃类(代号0)、金属类(代号1)、塑料类(代号2)、橡胶类(代号3)、预灌封组合件(代号4)、其他类(代号5)、方法类(代号6)六大类对129个药包材的标准进行了重新整理、勘误、修订和汇编。http://ng1.17img.cn/bbsfiles/images/2013/03/201303151701_430380_2400095_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/03/201303151701_430381_2400095_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/03/201303151701_430382_2400095_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/03/201303151701_430383_2400095_3.jpg
我的样品都是用溴化钾压片发做的IR,为了保证图谱的准确性,我想是不是应该跟标准图谱对照一下啊?!如果哪位有关于中药标准品的IR图谱集能赐给一下吗?在此感激不尽![em0808]
请问大家的农药标准品是那买的啊?国家标准物质中心还是环境科研监测所?我们是学校做科研,不是公司,所以推荐性价比高的哈
当前,随着医药产业的快速发展,我国药品标准的提升也在加速推进,制药企业应对此给予足够的重视,将其作为一种提升企业竞争实力、塑造品牌的有利手段。日前,在2007中国(海口)国际医药高峰论坛上,国家药典委员会副秘书长周福成对制药企业透露了这一信息。 产业进,标准升 周福成表示,当前我国的药品标准正在与医药产业一同发展,企业应更加重视药品标准。随着我国药品注册管理办法的再次修订,3月6日,国家药典委员会也发布了《关于为进一步修订完善国家药品标准征集意见的函》(国药典化发[2007]45号)。这个函就是国家药典委员会结合新版中国药典和药典增补本的编制工作,就现行国家药品标准中仍存在的各种问题,向各药品生产企业、检验机构及相关单位收集相关品种的国家药品标准的相关信息或有关资料,对国家药品标准进一步修订。 周福成认为,药品标准与产业发展密切相关。因为药品标准是技术监督的核心,而药品技术监督是行政市场监管的重要依据。随着科学技术的发展,人们对药品内在的认识也不断加深,对药品的安全要求也就越来越高,相应地必然带来药品标准的提升,而药品标准的提升又会带来产业的整体提升。如在鱼腥草注射液的研究中,技术人员发现较易出现致敏性的不良反应是一种辅料“吐温80”所致,作为一种助溶剂,今后需要考虑使用更加安全的替代品,同时,也需要考虑在药品标准中添加对致敏辅料的限量指标监测。此外,在日趋紧密的药品国际贸易中,我国标准应与国际尽快接轨,避免成为产业发展障碍。而面向未来,还需发展绿色药品标准,加强环境保护和技术人员保护。 重安全,促发展 周福成透露,国家药典委员会正在从以下几个方面抓紧药品标准完善工作。首先,起草注射剂型的安全性标准,主要考虑生物安全性,已经初步定下在药典委员会下设注射剂专项委员会,加深对相关药品标准的研究。周福成还提醒企业,按照修订中的新《药品注册管理办法》,企业药品注册标准获批即自动成为国家标准,药品标准也将成为药企的新竞争力手段,企业可以在自己注册的产品中自主增加更高技术要求的检验项目。比如天津天士力就考虑在新提交的药品标准中引入指纹图谱的项目。此外,企业可随时提出申请修改标准,经审批通过的会在药典增补本标准中列入。这一点对于企业走名牌战略,凭借技术创造领先优势将会有很大的促进作用,甚至有望在未来逐步建立起国家药品标准的竞争机制。 此外,周福成还透露,根据《药品管理法》,我国有关中药提取物的标准、辅料标准、民族药标准、濒危物种入药的替换品等软课题,药典委员会都在研究和准备中,会在今后陆续推出。另据周福成介绍,准备已久的《中药标准薄层彩色图谱》、《中药材红外图谱集》已经进入最后编订阶段,这两本标准已经受到了国际同行的高度关注。
07版国家药品注册管理办法:国家药品标准,是指国家食品药品监督管理局颁布的《中华人民共和国药典》、药品注册标准和其他药品标准,其内容包括质量指标、检验方法以及生产工艺等技术要求。1、药品注册试行标准属国家标准吗?2、其它药品标准具体哪些标准?
关于“已有国家标准”这个词汇,其实SFDA无意中闹了点笑话。SFDA的“已有国家标准”想要说的意思其实是:“建国以来卫生部和之后的药监局批准过并公布了标准的国产品种”以及“1998年药监局成立之后批准过的进口品种”,可是,确实很难用一个简单的词概括上述范围,于是,SFDA在缺乏对相关法规研究的情况下,就使用了“已有国家标准”这个词——这是不妥当的。首先,我们不妨来说说,什么是“标准”,“标准”这个词,所对应的英文即是“specification”,ICH的相关指南中已经明确的定义了,观其精髓,在于:由生产商提出并验证;由药监管理机构批准;是批准产品的必要条件。由这个定义可知,药品的“标准”其实相当于中国质监管理中的所谓“企业标准”。——我们知道,按现代的工业生产质量控制和监督的理念,任何产品都是要有 “标准”,所谓的“合格产品”也就是符合“标准”要求的产品,“不合格产品”则是不符合“标准”规定的产品,没有“标准”则无从谈质量监督,更无从谈责任和管理,是以任何产品都必须有标准。然而,标准在国内是分不同等级的,通常来说即“国家标准”、“地方标准”、“行业标准”、以及“企业标准”。具体法规可研读《中华人民共和国标准化法》和《中华人民共和国标准化法实施条例》,为了节省大家的时间,我简单概括整理一下,如下:国家标准和行业标准理论上有“强制性”和“推荐性”之分(我们常见到的“GB/T”打头的标准代号,其中的“GB”就是“国家标准”的代号,“T”就是 “推荐”的代号),但是,法规又说了:“可能危及人体健康和人身、财产安全的工业产品,必须符合保障人体健康和人身、财产安全的国家标准、行业标准。” (见:《中华人民共和国产品质量法(2000年修正)》)——你想想,所有工业产品中,不可能“危及健康和人身、财产安全的”还真没有几件,绝大多数产品细究起来,都是“可能危及人体健康和人身、财产安全”的,——也就是说,管你是什么产品,实际操作中您也别看啥推荐不推荐,统统的去按照国标和行标办事准没错,否则难免自误。注意:按《标准化法》的规定,药品的国家和行业标准,是强制标准。在没有国家标准的情况下,各省\自治区\直辖市可以就工业产品的“安全、卫生要求”方面制定地方标准,该标准在当地是强制性的,例如北京质监部门制定的《奥运会食品安全执行标准和适用原则》就属于“地方标准”。——一旦有相应国家标准出台,则地方标准自动废止。若是没有相应国家标准和行业标准的产品,企业必须提交自己制定的“企业标准”,而有国标和行标的话,国家鼓励企业制定比国家标准和行业标准更高的企业标准,在企业内部施行。必须注意的是这段法规,“工程建设、药品、食品卫生、兽药、环境保护的国家标准,分别由国务院工程建设主管部门、卫生主管部门、农业主管部门、环境保护主管部门组织草拟、审批;其编号、发布办法由国务院标准化行政主管部门会同国务院有关行政主管部门制定。”也就是说,我们制药行业的标准制定、标准出版、产品生产、质量监督都是独立的,不是由质监部门而是由药监部门来负责。但在根源上,所谓国家标准的定义还是按照《标准化法实施条例》所述的“由国务院标准化行政主管部门编制计划,组织草拟,统一审批、编号、发布的标准”,这才是“已有国家标准”的真正含义,由此可见,SFDA的05版《药品注册管理办法》所说的“已有国家标准”药品,其实和《标准化法》中“国家标准”的概念不一致的。例如,SFDA认为98年后批准进口的药品也属于“已有国家标准”,这是法理的错误,所谓的进口药品,所提交的仅仅是“进口标准”,也就是相当于“企业标准”,作为区区一介外企,其提交的进口标准,怎能认为是“国家标准”?前面说过,必须是“由国务院标准化行政主管部门编制起草审批”的标准,才能是“国家标准”。而且,根据《标准出版发行管理办法》国家标准是必须要出版公布的,但我们知道,大家是无法从正规渠道搞到进口药品的标准的,这些进口标准是不出版不公开的,它们其实只是“企业标准”而已,作为企业标准,由于其涉及企业的商业秘密,企业在提交时就有权要求保密。——搞清楚了这一点,我们就能更清楚的明了为什么《药品注册管理办法》的“已有国家标准”的提法不合适。
问下各位老师和专家,今天又跟vcningmeng版主在讨论这个问题了,为什么兽药标准品可以提供的公司较少?而且兽药混标也比较少?是因为兽药本身不稳定吗?还是配成溶剂时不稳定?双方没有达成共识,欢迎各位版友分享宝贵的意见。http://simg.instrument.com.cn/bbs/images/default/em09507.gif
药品GMP认证检查评定标准
从“已有国家标准”药品谈起——纪念可能即将废除的“已有国家标准”一词 关于“已有国家标准”这个词汇,其实SFDA无意中闹了点笑话。 SFDA的“已有国家标准”想要说的意思其实是:“建国以来卫生部和之后的药监局批准过并公布了标准的国产品种”以及“1998年药监局成立之后批准过的进口品种”,可是,确实很难用一个简单的词概括上述范围,于是,SFDA在缺乏对相关法规研究的情况下,就使用了“已有国家标准”这个词——这是不妥当的。 首先,我们不妨来说说,什么是“标准”,“标准”这个词,所对应的英文即是“specification”,ICH的相关指南中已经明确的定义了,观其精髓,在于: ① 由生产商提出并验证; ② 由药监管理机构批准; ③ 是批准产品的必要条件。 由这个定义可知,药品的“标准”其实相当于中国质监管理中的所谓“企业标准”。——我们知道,按现代的工业生产质量控制和监督的理念,任何产品都是要有“标准”,所谓的“合格产品”也就是符合“标准”要求的产品,“不合格产品”则是不符合“标准”规定的产品,没有“标准”则无从谈质量监督,更无从谈责任和管理,是以任何产品都必须有标准。 然而,标准在国内是分不同等级的,通常来说即“国家标准”、“地方标准”、“行业标准”、以及“企业标准”。具体法规可研读《中华人民共和国标准化法》和《中华人民共和国标准化法实施条例》,为了节省大家的时间,我简单概括整理一下,如下: ① 国家标准和行业标准理论上有“强制性”和“推荐性”之分(我们常见到的“GB/T”打头的标准代号,其中的“GB”就是“国家标准”的代号,“T”就是“推荐”的代号),但是,法规又说了:“可能危及人体健康和人身、财产安全的工业产品,必须符合保障人体健康和人身、财产安全的国家标准、行业标准。”(见:《中华人民共和国产品质量法(2000年修正)》)——你想想,所有工业产品中,不可能“危及健康和人身、财产安全的”还真没有几件,绝大多数产品细究起来,都是“可能危及人体健康和人身、财产安全”的,——也就是说,管你是什么产品,实际操作中您也别看啥推荐不推荐,统统的去按照国标和行标办事准没错,否则难免自误。 注意:按《标准化法》的规定,药品的国家和行业标准,是强制标准。 ② 在没有国家标准的情况下,各省\自治区\直辖市可以就工业产品的“安全、卫生要求”方面制定地方标准,该标准在当地是强制性的,例如北京质监部门制定的《奥运会食品安全执行标准和适用原则》就属于“地方标准”。——一旦有相应国家标准出台,则地方标准自动废止。 地方标准在医药领域自有一席之地,容后再议。 ③ 若是没有相应国家标准和行业标准的产品,企业必须提交自己制定的“企业标准”,而有国标和行标的话,国家鼓励企业制定比国家标准和行业标准更高的企业标准,在企业内部施行。 ④ 必须注意的是这段法规,“工程建设、药品、食品卫生、兽药、环境保护的国家标准,分别由国务院工程建设主管部门、卫生主管部门、农业主管部门、环境保护主管部门组织草拟、审批;其编号、发布办法由国务院标准化行政主管部门会同国务院有关行政主管部门制定。” ——也就是说,我们制药行业的标准制定、标准出版、产品生产、质量监督都是独立的,不是由质监部门而是由药监部门来负责。 但在根源上,所谓国家标准的定义还是按照《标准化法实施条例》所述的“由国务院标准化行政主管部门编制计划,组织草拟,统一审批、编号、发布的标准”,这才是“已有国家标准”的真正含义,由此可见,SFDA的05版《药品注册管理办法》所说的“已有国家标准”药品,其实和《标准化法》中“国家标准”的概念不一致的。例如,SFDA认为98年后批准进口的药品也属于“已有国家标准”,这是法理的错误,所谓的进口药品,所提交的仅仅是“进口标准”,也就是相当于“企业标准”,作为区区一介外企,其提交的进口标准,怎能认为是“国家标准”?前面说过,必须是“由国务院标准化行政主管部门编制起草审批”的标准,才能是“国家标准”。 而且,根据《标准出版发行管理办法》国家标准是必须要出版公布的,但我们知道,大家是无法从正规渠道搞到进口药品的标准的,这些进口标准是不出版不公开的,它们其实只是“企业标准”而已,作为企业标准,由于其涉及企业的商业秘密,企业在提交时就有权要求保密。——搞清楚了这一点,我们就能更清楚的明了为什么《药品注册管理办法》的“已有国家标准”的提法不合适。 再从另一个角度看,《标准化法》是由国务院发布的“法律”,《药品注册管理办法》仅仅是由国务院下属的SFDA发布的“部门规定”,毫无疑问《药品注册管理办法》应该服从《标准化法》,其“国家标准”的概念应该与《标准化法》一致。 ⑤ 可喜的是,当前正在征求意见的新《药品注册管理办法》已经取消了所谓“已有国家标准”这一提法,而替之以“仿制药”。——这是正确的,然而,对哪些才算是“仿制”依旧没有严密的范围界定,且后半段的征求意见稿可能是行文仓促,居然个别地方又冒出“已有国家标准”这个词来,则是需要改正的。希望这次的立法更严谨些,让以后的药政法规不再累累的发布补充规定了。 ——我们的药政法规,这多年来总是喜欢补丁叠补丁,像极了微软的操作系统,在法规的修改完善方面应该学习欧洲的立法,欧盟发布的有关药政的指令,其在不断增添修改的过程中,总会阶段性的把累积起来的补丁整合修订入核心的指令中,使得该指令能够在不断更新中保持完整连续,不至于让企业还要一个一个的去翻看多年的补丁规定。 ⑥ 前面说了说地方标准,则又涉及到有关药政管理的两个问题,一个是中药材,一个是药用辅料。 按照05版《药品注册管理办法》规定,中药申请时,要求其药味得是有“法定标准”的中药材,这个法定标准就包括了地方标准,否则,就要按照2类(新发现的药材)论处,研发成本就海了去了,而地方标准各地零散,不好搞到,这让搞冷僻植物的中药研发的同志们很苦恼,当然也有聪明的,主动的去本地申请一个“地方标准”,于是就堂而皇之简简单单的解决了这个问题,当然,此举也是无奈——颇有点逼良为娼之嫌,但愿新注册管理法规能够给传统中药的研发更合适的空间,如果能够有比较合理的康庄大道,相信谁也不会愿意弯弯曲曲的走旁门左道。 至于药用辅料,问题则比较复杂,很长一段时间以来药用辅料的监管都在亚真空状态,一方面,以前地方就可以批准药用辅料,导致各地审批混乱,散乱不堪;另一方面,由于过去的实际申报中,食品级的辅料也能作为合法来源采用,甚至化工级的物料,企业只要做个精制的内控标准,也能够通过审批,如此一来,谁还吃饱了撑着自找麻烦注册成“药用辅料”? 后来SFDA也意识到问题的严重性,若辅料的质量没有保证,制剂的质量也不可能有保障,于是,05年酝酿着要提高药用辅料的要求,也发布了征求意见稿和暂时的执行意见,见《关于《药用辅料管理办法》(征求意见稿)网上征求意见的函》和《关于印发药用辅料注册申报资料要求的函》,可是一些新的问题也随之而来:例如,除了《药典》二部的第二部分正文所列的那些辅料标准外,还有按照国标(GB开头的)执行的十几个辅料标准,更有地方药监局多年来批准的数量不详的辅料标准,最后连SFDA自己都不晓得到底批准了多少辅料标准,也因此有了2004年11月的《关于开展药用辅料地方标准摸底调查的通知》······这么乱的标准情况,使得如今的药用辅料注册无所适从,根据《关于印发药用辅料注册申报资料要求的函》,当前辅料注册也是按照有无“国家标准”来审评的,如果没有“国家标准”则要求做临床,这投资就太大了,国产的还好说,不规范的继续不规范,反正被查到的可能性比较小;而进口辅料的注册却被无端限制了,毕竟药典收载的和GB国标收入的辅料没几个,很多辅料事实上已经在中国制药领域使用了多年,却没有收入药典和国标,进口时难以按“已有国家标准”办理。后来,SFDA有出了个《关于药用辅料使用地方批准文号有关问题的复函》,顺着这个意思看,SFDA貌似也承认辅料的地方标准的有效性,可以作为“已有国家标准”看待,然而,天知道中国这许多省市几十年来都批准了啥辅料,连个切实可靠的搜索途径都没有,药用辅料之路,难,难,难。
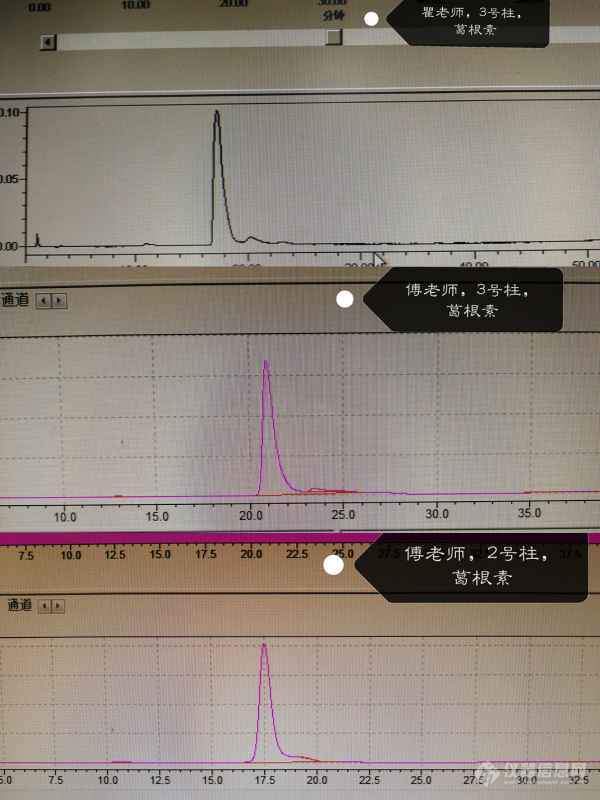
[color=#444444]我要做一个复方的质量标准研究,待测品溶液里面已经指认出了葛根素,大豆苷,原儿茶醛等峰。是以纯甲醇为媒,乙腈水为流动相。然而,每一个标准品的主峰后面都会紧挨着一个小峰。试过用另外一只色谱柱和另外一台液相仪器,均无法改善。也尝试过用100%甲醇,30%甲醇,10%乙腈来溶解葛根素,还是不行。把水相换成0.1%磷酸,0.4%的磷酸,发现加酸只会让主峰后面的小峰更加明显(标准品和待测品溶液都是这种情况)。而且也用过药典葛根素的方法,葛根素标准品还是会有一个小峰。看主峰和小峰色谱图,都是比较类似的。[/color][color=#444444]求求大神帮我指点迷津。[/color][color=#444444][img=,600,800]https://ng1.17img.cn/bbsfiles/images/2019/06/201906111101484131_8651_1739275_3.jpg!w600x800.jpg[/img][img=,595,793]https://ng1.17img.cn/bbsfiles/images/2019/06/201906111101489341_7010_1739275_3.jpg!w595x793.jpg[/img][img=,600,800]https://ng1.17img.cn/bbsfiles/images/2019/06/201906111101492592_8525_1739275_3.jpg!w600x800.jpg[/img][img=,600,800]https://ng1.17img.cn/bbsfiles/images/2019/06/201906111101499802_5391_1739275_3.jpg!w600x800.jpg[/img][img=,595,793]https://ng1.17img.cn/bbsfiles/images/2019/06/201906111101507963_7989_1739275_3.jpg!w595x793.jpg[/img][img=,595,793]https://ng1.17img.cn/bbsfiles/images/2019/06/201906111101495942_9773_1739275_3.jpg!w595x793.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2019/06/201906111101502645_5411_1739275_3.jpg!w690x517.jpg[/img][/color]
现在有个比较棘手的问题,之前我们用的标准品是日本关东化学农药混合标准品。现在在中国购买不到了。混合农药品种大约有100多种。请问我应该怎样找替代品啊?