如题,采用平板计数琼脂 菌落总数中到底包不包括酵母菌与霉菌?谢谢
三糖铁琼脂培养基( l )成分 蛋白胨 20g 硫酸亚铁 0.2g 牛肉浸出粉 5g 硫代硫酸钠 0.2g 乳糖 10g 002%酚磺酞指示液 12.5ml 蔗糖 10g 琼脂 12~15g 葡萄糖 1g 水 1000ml 氯化钠 5g ( 2 )制法 除乳糖、蔗糖、葡萄糖、指示液、琼脂外,取上述成分,混合,加热使溶解,调pH 值使灭菌后为7.3 士0.1 ,加入琼脂,加热溶胀后,再加入其余成分,摇匀,分装,121 ℃ 灭菌15 分钟,制成高底层(2 ~3cm ) 短斜面。( 3 )用途 用于初步鉴别肠杆菌科细菌对糖类的发酵反应和产生硫化氢试验。 方法和结果观察:取可疑菌落或斜面培养物,做高层穿刺和斜面划线接种,置35 ℃ 培养24~ 48 小时,观察结果。培养基底层变黄色为葡萄糖发酵阳性,斜面层变黄色为乳糖、蔗糖发酵阳性;底层或整个培养基呈黑色表示产生硫化氢。
琼胶是由石花菜及其他数种红藻类植物中浸出并经脱水干燥的黏[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url],又名琼脂。由于其十分稳定的特性,在食品行业及组织培养中作为增稠剂、安定剂而得到了广泛应用。琼胶的制造原料来源于天然藻类,在国际市场上倍受青睐。在高速发展的同时也出现了问题,在出口琼胶中分离到一株短芽胞杆菌,经研究,证实该菌来源于车间空气中,是出口琼胶细菌超标的主要污染菌。该菌在琼胶中表现出较强的耐热性,采用增大杀菌强度的方法不能有效鳃决污染问题,而改进车间卫生则是一项简便有效的控制技术。[align=center][img]http://5b0988e595225.cdn.sohucs.com/images/20180326/21f9fadc687c4df38f768da6aec8ebc9.jpeg[/img][/align]近年来,随着人们对食品卫生质量的重视,国际上对琼胶的质量的卫生质量也提出了十分严格的要求,以欧美发达国家的要求为例,较之国家标准Cm975---19SO(食品添加剂琼胶》,就新增了多项微生物学指标,即:菌落总数≤1000个/g,大肠杆菌lg中不得检出,沙门氏菌25g中不得检出,霉菌和酵母菌≤300个/g。目前我国琼胶存在的主要卫生质量问题是细菌污染超标,一般产品中的细菌数通常在1×l01个/g以上,即使是出口加工厂也很难控制在1000个/g以内,由于细菌污染问题一直未能得到研究解决,我国琼胶的出口市场一直局限在日、韩等国,很难进一步拓展。在对琼胶生产流程进行取样检测的基础上,济南辰宇环保科技有限公司研究出引起琼胶细菌超标的原因,分析了琼胶卫生质量控制的关键点,通过改进生产工艺,提高了产品的卫生质量,并使之符合出口要求。[align=center][img]http://5b0988e595225.cdn.sohucs.com/images/20180326/ba51c82497d447b18d36560c25fc007b.jpeg[/img][/align]在生产流程细菌污染的检测可以看出,琼胶中细菌总数的有一定的变化规律。先是在晾干过程中,细菌总数有个突增高峰,过程首尾相差46倍,经烘干后,菌数减少了90%以上,再经过粉碎后,细菌数进一步下降,但是在过筛包装后,细菌数又突然大幅上升,达6.6×103远远超过国际上的卫生要求。琼胶经过泡碱、蒸胶等工艺处理后,其中的营养物质极少,细菌不可能利用它在数个小时内达到数个世代的增殖量,因此琼胶中的细菌污染显然是以外界的沾染为主。从菌相分析结果来看,琼胶中的主要污染菌与车间空气中的优势菌群是一致的,车间空气中的细菌总数远远超过了国家标准规定的室内空气的卫生要求即45cfu/皿,甚至已达到了轻污染的程度,因此可以判定琼胶的细菌污染主要来自于车间空气。由此将车间空气和烘干程序确定为琼胶卫生质量控制的关键点。[align=center][img]http://5b0988e595225.cdn.sohucs.com/images/20180326/e121b500d0ae4dad813d9a7467656ee5.jpeg[/img][/align]在原有生产环境条件下,无论是采用105℃保温60min还是采用105℃保温120min的烘干程序,最后成品的细菌数均超过1000个/g,不能满足出口要求。而当采用121℃保温60min的工艺时,虽然琼胶的卫生质量能达到要求,但其凝胶强度和色泽却又达不到等级。因此不宜通过改变烘于程序来达到有效控制污染的目的,而当用奥克泰士消毒剂进行消毒这一环节后,发现车间空气已完全达到清洁空气标准(29cfu/皿),琼胶各项指标均达到出口要求。可见环境卫生质量对产品的品质和卫生质量都起着十分重要的作用。采用奥克泰士消毒在相对密封的环境下,扩散均匀,包容性、通透性好,克服了紫外线杀菌存在的消毒死角的问题,达到全方位、快速、高效的消毒杀菌目的。另外,由于它的灭菌广谱性,既可以杀灭细菌繁殖体、芽胞、病毒、真菌和原虫孢体等多种微生物,还可以破坏肉毒杆菌和毒素及立克次氏体等,同时还具有很强的除霉、腥、臭等异味的功能。因而更能有效杀灭芽胞菌,从而使车间卫生状况更好,产品的卫生质量更可靠,因此本文把奥克泰士当作最终选取的控制污染的技术条件。[align=center][img]http://5b0988e595225.cdn.sohucs.com/images/20180326/185d96aac7454ac3b0528edd446c3f61.jpeg[/img][/align]BUDICH国际有限公司总部位于德国,1882年成立,创建至今已拥有130多年的传承,专业从事空间环境消毒事业,具备卓越的设计研发能力和世界领先的生产制造工艺,经过多年研发,研制出奥克泰士。该杀菌溶液的名称是oxytech杀菌溶液,是一款食品级高浓缩型杀菌消毒产品,在欧盟已注册商标,并获得多个国际权威机构的认证。如ISO9001、ISO14001管理体系认证,IFS食品检测认证,欧盟EMAS检测认证德国莱茵TUV检测认证等。奥克泰士是目前国际上公认的高效、广谱、快速、安全、无残留、不污染环境的杀菌消毒剂。它对人无害,无致癌、致畸、致突变性,是一种安全可靠的消毒剂。产品的主要成分是过氧化氢银离子,是一款高效广谱的生产车间空间专用消毒杀菌剂,能够高效杀灭空气环境中的细菌孢子、真菌孢子、放射菌、分支杆菌、酵母菌、霉菌、病毒在内的所有类型的微生物,彻底解决因生产车间空间环境微生物污染所面临的困扰。所采用的氧化剂为过氧化物,它与稳定剂结合形成复合溶液。作为催化剂添加的痕量银离子可以保持长久的效用。银离子的杀菌作用是基于单价银离子通过共价键和配位键来与细菌蛋白质牢固结合,从而使细菌钝化或沉淀。奥克泰士是过氧化氢银离子的复合物,在生产中的优势逐渐凸显,相对普通消毒清洗剂,克服了后者不稳定、对光和热敏感易分解、保存期短的缺点,奥克泰士采用了食品级的过氧化氢、银离子两种普通的消毒剂成分通过科学配比和特殊工艺混合在一起,产生协同作用后,效果是各自单独使用时杀菌效果的50~100倍,在生产车间空间环境消毒中与细菌、病毒等微生物发生反应后的产物是水和氧气,不产生有害残留,安全环保。[align=center][img]http://5b0988e595225.cdn.sohucs.com/images/20180326/7be902c6d3ee4cc1911cdd52d61c989d.jpeg[/img][/align]解决细菌污染的常用手段是加大杀菌强度,在琼胶车间环境条件较差的情况下,即使延长105℃的保温杀菌时间,也不能控制细菌超标问题,而采用121~C的高温烘干程序,虽然能保证细菌不超标,但却降低了产品的其他指标,失去应有的商业价值。所以最有效最简便的方法还是改进车间的环境卫生,这也是HACCP体系和GNP规程中的一项基本要求。通过奥克泰士空间微生物的控制技术,琼胶的卫生质量和品质质量均超过了出口要求,最终取得了进入欧美发达国家的通行证。招商合作:济南辰宇环保科技有限公司诚招全国各行业合作商!德国130年精工企业专注环保杀菌消毒剂的生产与研发,解决各行业生产企业有害物生物困扰,提供具体行业使用方案。诚邀各行业领袖,科研机构,企业单位参与方案制定与产品研发。期待您的来电。
有做过海水1.发酵法和滤膜发的粪大肠菌群检测吗,最近在做海水微生物的扩项,要买菌株做阴阳性对照吗?有没有做过的请教一下
菌落培养平板计数琼脂灭菌后,为什么是深红色,跟以前不一样颜色?琼脂也没有过期,灭菌是121℃,20分钟。问题出在哪里,这样的琼脂还能用吗?
KF链球菌琼脂培养基[img]http://img.foodmate.net/bbs/static/image/smiley/default/cry.gif[/img] 称取本品71.5g加入蒸馏水或去离子水1L,搅拌加热煮沸溶解,勿高压灭菌,冷至50度左右,倾注无菌培养皿.那么请教各位大侠那这个培养基如何灭菌,是否可以直接将过滤好的滤膜放入培养基中培养.
上周五灭菌的营养琼脂培养基一周天后一瓶长菌了?咋回事?请教高手帮忙。 我按照厂家说明书上要求配置和灭菌,115℃灭菌30分钟,灭菌完后等待冷凝了,放在4℃的冰箱中,每次微波炉加热熔化后使用都废弃,这几次实验时,偶尔出现异常现象,查找污染原因,稀释剂没问题,最后拿剩下的两瓶未使用的培养基直接培养,其中一瓶长菌了,我真不晓得咋回事? 配制培养基那一周做过菌液配制,但是所有的玻璃容器都灭菌的,除了装营养琼脂培养基的瓶子,觉得只是倒培养基,应该不会被菌种污染,所以没有灭菌。一直配营养琼脂培养基的锥形瓶都是这几个瓶子。一直以来我们都是我按照厂家说明书上要求配置和灭菌,115℃灭菌30分钟,灭菌完后等待冷凝了,放在4℃的冰箱中,都没有发生过培养基长菌。
海水检测指标 GB17378.7-2007中的菌落总数平板计数法,在数据处理中,乘于稀释倍数后,还有除于取样量的0.1mL吗?方法中说稀释到适宜倍数后取0.1mL接种培养,那我选取符合30~300菌落数的平皿计数后,再乘于稀释倍数后得到的值还需要除于0.1mL吧?虽然方法中没有涉及体积的换算,但我认为应该是需要除的,还请大佬们不吝赐教。
最近公司在做霉菌和酵母菌的计数分离,用的是添加了氯霉素的虎红琼脂,请问标准酵母菌在该琼脂平板上是什么形态,最好能有图片。 沙门氏菌经过BS和DHL选择性分离后,用法国科玛嘉显色培养基培养,同时使用环凯的生化鉴定盒鉴定(10只一套那种),有时候显色培养基不显紫色可是生化鉴定却是阳性,请问如何判断,请教各位有没有标准沙门氏菌属在该生化鉴定套装中反应的图片,十分感谢!!
卫生部关于《食品添加剂琼脂(琼胶)》等97项食品安全国家标准的公告(2010年 第19号) 根据《中华人民共和国食品安全法》和《食品安全国家标准管理办法》的规定,经食品安全国家标准审评委员会审查,现发布《食品添加剂琼脂(琼胶)》(GB1975-2010)等97项食品安全国家标准。其编号和名称如下:GB 1975-2010食品添加剂 琼脂(琼胶)GB 1900-2010食品添加剂 二丁基羟基甲苯(BHT)GB 3150-2010食品添加剂 硫磺GB 4479.1-2010食品添加剂 苋菜红GB 4481.1-2010食品添加剂 柠檬黄GB 4481.2-2010食品添加剂 柠檬黄铝色淀GB 6227.1-2010食品添加剂 日落黄GB 7912-2010食品添加剂 栀子黄GB 8820-2010食品添加剂 葡萄糖酸锌GB 8821-2010食品添加剂 β-胡萝卜素GB 12487-2010食品添加剂 乙基麦芽酚GB 12489-2010食品添加剂 吗啉脂肪酸盐果蜡GB 13481-2010食品添加剂 山梨醇酐单硬脂酸酯(司盘60)GB 13482-2010食品添加剂 山梨醇酐单油酸酯(司盘80)GB 14750-2010食品添加剂 维生素AGB 14751-2010食品添加剂 维生素B1(盐酸硫胺)GB 14752-2010食品添加剂 维生素B2(核黄素)GB 14753-2010食品添加剂 维生素B6(盐酸吡哆醇)GB 14754-2010食品添加剂 维生素C(抗坏血酸)GB 14755-2010食品添加剂 维生素D2(麦角钙化醇)GB 14756-2010食品添加剂 维生素E(dl-α-醋酸生育酚)GB 14757-2010食品添加剂 烟酸GB 14758-2010食品添加剂 咖啡因GB 14759-2010食品添加剂 牛磺酸GB 14888.1-2010食品添加剂 新红GB 14888.2-2010食品添加剂 新红铝色淀GB 15570-2010食品添加剂 叶酸GB 15571-2010食品添加剂 葡萄糖酸钙GB 17512.1-2010食品添加剂 赤藓红GB 17512.2-2010食品添加剂 赤藓红铝色淀GB 17779-2010食品添加剂 L-苏糖酸钙GB 25531-2010食品添加剂 三氯蔗糖GB 25532-2010食品添加剂 纳他霉素GB 25533-2010食品添加剂 果胶GB 25534-2010食品添加剂 红米红GB 25535-2010食品添加剂 结冷胶GB 25536-2010[td=1,1,30
.4 水质的细菌学检测 9.4.1 水中细菌总数的检测 9.4.1.1 目的和原理 水中细菌总数往往同水体受有机物污染的程度呈正相关,它是评价水质污染程度的一个重要指标之一。由于重金属及某些其它有毒物质对细菌有杀灭或抑制作用,因此总细菌数少的水样,并不能排除已被这些物质所污染。本试验采用标准平皿法对水样中细菌作计数,这是一种测定水中好氧的和兼性厌氧的异养细菌密度的方法,由于细菌在水体中能以单独个体、成对、链状,成簇或成团的形式存在,此外没有单独的一种培养基或某一环境条件能满足一个水样中所有细菌的生理要求,所以由此法所得的菌落数实际上要低于被测水样中真正存在的活细菌的数目。细期总数是指1毫升水样在营养琼脂培养基中,37℃、24小时培养后所生长的菌落数。一般规定,1毫升自来水中总菌数不得超过 100个。 9.4.1.2 材料和器皿 (1)培养基①营养琼脂培养基②2216E培养基:蛋白胨 5.0克 酵母膏 1.0克 FePO4 0.01克 琼脂 18.0克 陈海水 1000毫升 pH 7.6~7.8 (2)无菌采样瓶、灭菌移液管、灭菌培养皿,盛有90ml及 9mL灭菌蒸馏水的锥形瓶和试管。 9.4.1.3 方法和步骤 (1)采集水样。(2)吸取10 ml水样(河水、污水、游泳池水或港湾水等),注入盛有90ml无菌水或无菌海水的三角瓶中,混匀成10-1稀释液,在吸水样前,水样应彻底搅动均匀。(3)按10倍稀释法将水样稀释成10-2、10-3、10-4。(4)根据水样的洁净程度,污染严重者选取10-2、10-3、10-4稀释度;中等的选取10-1、10-2、10-3稀释度,每个稀释液分别注入两个培养皿,每皿 1ml。稀释度的选择是本试验精确度的关键,选择适宜者,平皿上菌落总数介于30—300个之间。(5)注入彻底融化,然后冷却到45℃的营养琼脂培养基(用于河水样)或2216E培养基(用于海水、港湾水样)约15ml,立即旋摇培养血,充分混匀,水平放置至固化。(6)接种河水的培养皿,倒置于37℃培养24小时。接种海水样,港湾水样的培养皿,应倒置后于18—20℃下培养到长出明显菌落(5天左右)止。 9.4.1.4 结果与分析 取同一稀释度的平板培养物,依菌落计算原则进行计算。(1)菌落计算原则平皿菌落的计算,可用肉眼观察,必要时用放大镜检查,防止遗漏,也可借助于菌落计数器计数。对长得相当接近,但不相触的菌落,应予以—一计数。对链状菌落,应当作为一个菌落来计算。平皿中若有较大片状菌落时则不宜采用,若片状菌落少于平皿的一半时,而另一半中菌落分布又均匀,则可将其菌落数的2倍作为全皿的数目。算出同一稀释度的平均菌数,供下一步计算时用。(2)计算方法①首先选择平均菌落数在30~300者进行计算。当只有一个稀释度的平均菌落数符合此范围时,即可用它作为平均值乘其稀释倍数(见表5-9的例1)。②若有两个稀释度的平均菌落数都在30—300之间,则应按两者的比值来决定。若其比例小于2,应报告两者的平均数;若大于2,则报告其中较小的数字(见表7-例2和例3)。③如果所有稀释度的平均菌落数均大于300,则应按稀释度最高的平均菌落数乘以稀释倍数报告之(见表5-9例4)④若所有稀释度的平均菌落数均小于30,则应按稀释度最低的平均菌落数乘以稀释倍数报告之(见表5-9例5)。⑤如果全部稀释度的平均菌落数均不在30—300之间,则以最接近300或30的平均菌落数乘以稀释倍数报告之(见表5-9例6)。③菌落计数的报告,菌落在100以内时,按实有数报告;大于100时,采用二位有效数字,在二位有效数字后面的数值,以四舍五入方法计算,为了缩短数字后面的零数也可用10的指数来表示(见表5-9的“报告方式”栏)。 表5-9 稀释度选择及菌落报告方式 例次 不同稀释度的平均菌落数两个稀释度菌落数之比 菌落总数(个/ml)报告方式(个/ml) 10 -1 10 -2 10-3 1136016420-1640016000或1.6×104 22760295 461.63775038000或3.8×104 3289027160 2.22710027000或7×104 4无法计数4651513-513000510000或5.1×105 527 11 5 -270 270或2.7×102 6无法计数305 12- 30500 31000或3.1×104
国家“863计划”现代农业技术领域研制了一批海水鱼重要病原菌高效疫苗,4种疫苗进行了安全性初步评价,2种基因重组疫苗已获得农业部批准进入安全性评价阶段,有望成为我国海水鱼病害的新型治疗药物。 构建了包括迟钝爱德华氏菌基因缺失减毒活疫苗、拟态弧菌基因缺失减毒活疫苗、嗜水气单胞菌溶血素ISCOMs疫苗等6种具有良好免疫保护效果的高效疫苗;建立了3种疫苗的中试生产技术工艺;对鳗弧菌基因缺失减毒活疫苗、创伤弧菌及嗜水气单胞菌ISCOMs疫苗、海水鱼哈维氏弧菌病重组外膜蛋白疫苗等4种疫苗进行了安全性评价,初步结果显示四种疫苗具有良好的安全性、稳定性;鳗弧菌基因缺失减毒活疫苗、海水鱼哈维氏弧菌病重组外膜蛋白疫苗的转基因生物安全评价中间试验已获得农业部批准,有望成为我国海水鱼病害的新型治疗药物。
一、凝胶制备1. 微波炉溶解琼脂糖时,胶液沸腾冲溢出三角锥瓶微波炉加热时胶液可能发生剧烈沸腾,(1)总液体量不宜超过三角锥瓶的50%容量。(2)2%以上胶液设置中火加热。 (3)胶液剧烈沸腾时,停止加热,移开三角锥瓶,请戴上防热手套,小心摇动三角锥瓶,然后再次加热,胶液沸腾直至胶液清澈,保证琼脂糖完全溶解。 2. 琼脂糖电泳图像背景模糊不清:琼脂糖没有完全溶解会造成电泳图像背景模糊不清。完全溶解的琼脂糖胶液清澈,三角锥瓶内壁应没有粘附琼脂糖颗粒。 3.加热后水分蒸发,如需要应加入热的蒸馏水,补足到原来的重量,摇匀。 二、电泳1. DNA条带模糊,拖尾。 (1)DNA降解。避免核酸酶污染。 (2)DNA上样量过多。减少凝胶中DNA上样量。 (3)电泳缓冲液陈旧:电泳缓冲液多次使用后,离子强度降低,pH值上升,缓冲能力减弱,从而影响电泳效果。建议经常更换电泳缓冲液。 (4)电泳条件不合适。电泳时电压不应超过20 V/cm,温度<30℃,巨大DNA链,温度应<15℃,核查所用电泳缓冲液是否有足够的缓冲能力。 (5)DNA样含盐过高。泳前通过乙醇沉淀去除过多的盐。 (6)有蛋白污染。电泳前抽提去除蛋白。 (7)DNA变性。电泳前勿加热,用20 mM NaCl缓冲液稀释DNA。[/c
求助海水弧菌,细菌总数的监测方法
请问有没有海水中肠球菌,大肠杆菌和霍乱弧菌检测标准,或者检测方法也行,谢谢
做了一小段时间的琼脂糖凝胶电泳, 有一些体会给新手们参考, 不当之处也请专家们指正.1. 加热时, 一定要煮沸, 以保证琼脂糖的完全溶解.2. 待溶液冷却至不烫手, 感觉温暖舒适时加EB. 一定要在通风柜里.3. 倒胶时, 可用干净的纸巾拭去气泡.4. 胶凝固后先倒入些电泳缓冲液以方便取梳子.5. 保证缓冲液淹过胶的边沿, 边沿部分常高出1-2mm.6. 有时需要大的上样孔, 可用胶带把几个相邻的梳齿粘在一起, 这种情况下, 尽量让胶液冷一些再倒胶.7. 如果只是为了看一下结果(不需要照相), 同一块胶可重复用1-3次. 有一次我跑了4遍, 条带很弱, 用加了EB的缓冲液(约10ul EB in 50ml 缓冲液)泡半小时后就如正常了.8. 要保存胶到第二天用, 可以保鲜膜包裹后放入4 度冰箱.9. TAE 电泳缓冲液也可重复使用, 至少10次没有问题.10. 为了防止电泳时两极缓冲液槽内pH和离子强度的改变,可在每次电泳后合并两极槽内 的缓冲液,混匀后再用。
最近在淘宝上看到有这款螺口蓝盖的三角瓶,想在做菌落总数的实验中,能不能用它替代掉我们经常用的普通三角瓶加硅胶塞加牛皮纸的装营养琼脂的,如果可以,应该省事很多,各位觉得可以吗?就是下面这个图片的东西[img]http://ng1.17img.cn/bbsfiles/images/2017/08/201708241106_01_2795804_3.jpeg[/img]
[em09511]请问各位,琼脂糖凝胶在什么地方运用比较多啊?我们公司自主研发了琼脂糖系列凝胶。有谁需要试用的吗?我可以提供样品。
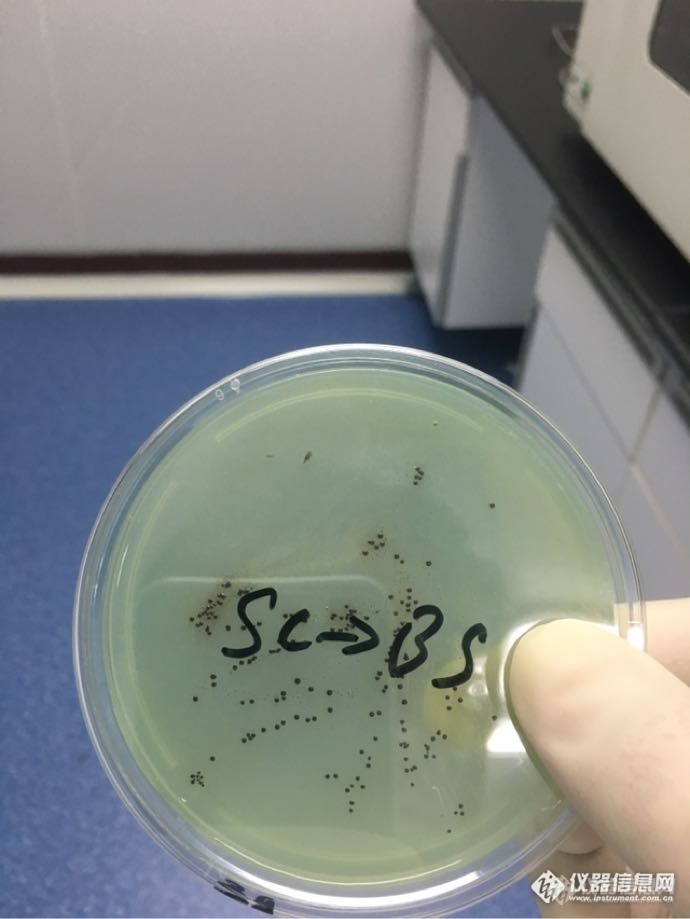
沙门氏菌检测中,ttb和sc划线到bs琼脂都是这种黑色,这个需要进行生化鉴定吗[img]http://ng1.17img.cn/bbsfiles/images/2017/08/201708251750_01_1503784_3.png[/img]
电泳基本原理 迁移率(或泳动度)是指带电颗粒在单位电场强度下泳动的速度,可用下列公式计算: U =υ/E =(d/t)/(V/l) =dl/Vt U为迁移率(cm2•V-1•min-1);υ为颗粒泳动速度(cm•s-1);E 为电场强度( V•cm-1);d为颗粒泳动的距离(cm);l为滤纸有效长度(cm);V为实际电压(V);t为通电时间(s或min)。通过测量d, l, V, t, 即可计算出被分离物质的迁移率。 1迁移率单位= 10-5 cm2•V-1•min-1在确定的条件下,某物质的迁移率为常数,是该物质的化学特征常数。 颗粒带净电荷多,直径小而接近于球形,则在电场中泳动速度快,反之则泳动速度慢。 迁移率还与分子的形状,介质粘度,颗粒所带电荷有关,迁移率与颗表面电荷成正比,与介质粘度及颗粒半径成反比。 影响琼脂糖电泳迁移的主要因素 电场强度 溶液的pH值 溶液的离子强度 电渗现象 温度的影响 支持物的影响 按分离原理分类: 1.区带电泳 2.移界电泳 3.等速电泳 4.聚焦电泳 按有无固体支持物分类 1. 纸上电泳 2. 醋酸纤维素膜电泳 3. 薄层电泳 4. 非凝胶性支持物区带电泳(支持物有:淀粉、纤维素粉、玻璃粉、硅胶) 5. 凝胶支持区带电泳(淀粉凝胶、聚丙稀酰胺凝胶、琼脂糖凝胶) 影响琼脂糖电泳迁移的主要因素 DNA的大小 DNA的构象 琼脂糖浓度 缓冲液 不同构像质粒 缓冲液 TAE:乙酸盐缓冲液 TBE:硼酸盐缓冲液 TPE:磷酸盐缓冲液 实验操作 1. 用胶带将洗净、干燥的水平板的边缘封住,形成一个胶模并水平放置。 2. 按水平板的长×宽×0.5cm胶厚,量取0.5×TBE,并按0.7%的浓度称取agarose琼脂糖,在微波炉或电炉上加热至全熔(清澈透明)。 3. 等凝胶温度降至大约50-60以下时,加入1 mg/L溴化乙锭(EB)至终浓度为0.5ug/mL ;摇匀并轻快地倒入水平板中,除掉气泡,插入梳子。 4. 凝固后,将梳子轻轻拔出。 5.去掉胶带,将水平板放入加有0.5×TBE电泳缓冲液的电泳槽中,并且使电泳缓冲液高出凝胶约1mm。 6.在parafilm膜上依次加: ddH2O 6ul,上样Buffer 2ul ,DNA 4ul 分别混匀后点样,记录点样次序。 7. 在水平板两边的点样孔中分别加入6 μ l的λΔΝΑ/EcoRI+HindIII marker。 8. 盖好电泳槽盖子,选择适当的电泳电压(≤5V/cm)及电泳方向(DNA阴极阳极),开始电泳。 9. 当色素接近胶的先端,停止电泳,样品在紫外灯下观察、成像℃
[font=SimSun, STSong, &]营养琼脂高压灭菌完可以拿来直接实验吗?[/font]
我有个试验需要带霉菌的琼脂,不知道如何培养,望各位大虾指导,先谢了。
[size=10px][b]一、琼脂糖凝胶电泳原理[/b] 琼脂糖凝胶电泳是一种重要的分子生物学研究方法,?它利用琼脂糖凝胶的网络结构,?通过电场作用使带电颗粒(?如DNA或RNA)?在凝胶中移动,?根据分子大小和电荷性质的不同实现分离。?这种技术不仅操作简单迅速,?而且具有高分辨率,?因此在基因操作中扮演着关键角色,[font='PingFang SC']其[b]原理主要基于DNA分子的两大特性:电荷效应和分子筛效应。[/b][/font] ?琼脂糖是一种天然的长链状聚合分子,它在沸水中溶解,当温度降至45℃时开始凝固并形成多孔刚性立体网状结构,其孔径的大小取决于琼脂糖的浓度。 [b]分子筛效应[/b]指的是琼脂糖凝胶由琼脂糖分子交联形成的网状结构,其孔径大小与琼脂糖浓度成反比。当DNA分子通过凝胶时,会受到凝胶孔径的阻碍。较小的DNA片段可以通过凝胶孔隙,而较大的DNA片段则会被阻挡,导致迁移速率降低。?? [/size][align=center][size=10px] [/size][/align][size=10px][b]电荷效应[/b]指的是DNA分子在碱性条件下(pH7)会电离,带负电荷。当DNA样品置于电场中时,在外加电场的作用下受到电场力的作用,向正极方向移动。DNA分子的迁移速率与其所带的电荷量成正比,而电荷量又与DNA片段的长度成正比。因此,在相同电场条件下,较长的DNA片段迁移速率较慢,而较短的DNA片段迁移速率较快。不同DNA的分子量大小及构型各不相同,因此它们在电泳中的迁移率也会有所不同,从而可分离出不同的区带。[b]为什么核酸条带显示荧光?[/b]主要便于观察,对核酸进行了染色。溴化乙锭EB是一种扁平状分子,在紫外光照射下能发射荧光。当EB与DNA分子形成EB-DNA复合物后,其发射的荧光强度比游离状态的EB提高10倍以上,且荧光强度与DNA的含量呈正比。 [b]二、?琼脂糖凝胶电泳的详细操作步骤(1%琼脂糖凝胶电泳为例) [font='Times New Roman', 'serif']1.安装制胶模具[/font][font='Times New Roman','serif']:[/font][/b]利用电泳托盘,安装制胶模具,水平放置于试验桌上。 [b][font='Times New Roman', 'serif']2.[/font]制备琼脂糖凝胶:[/b]将琼脂糖粉末溶解于缓冲液中,加热煮沸,冷却后凝固成凝胶。(根据电泳所需要的分辨率准备琼脂糖-电泳缓冲液凝胶溶液)[font='Times New Roman','serif'](1)[/font]称取[font='Times New Roman','serif']1g[/font]琼脂糖,放入盛有[font='Times New Roman','serif']100mL 0.5×TBE[/font]缓冲液的[font='Times New Roman','serif']500mL[/font]三角瓶中,摇匀用天平称量其重量,摇匀。在微波炉中,使琼脂糖完全溶解,放回天平上,加入蒸馏水补齐至初始重量。冷却至不烫手([font='Times New Roman','serif']55℃[/font]左右),加入[font='Times New Roman','serif']100μL[/font][font='Times New Roman','serif']0.5mg/mL EB[/font]溶液(终浓度为[font='Times New Roman','serif']0.5 μg/mL[/font]),或加入[font='Times New Roman','serif']5-10μL[/font][font='Times New Roman','serif']StarGreen DNA Dye(GenStar)[/font],摇匀。 [font='Times New Roman','serif'](2) [/font]将凝胶溶液倒入安装好的制胶模具中,凝胶厚度应在[font='Times New Roman','serif']3-5mm[/font]。 [font='Times New Roman','serif'](3) [/font]选择合适的梳子,梳子的插入深度应使齿的底部和板的表面距离在[font='Times New Roman','serif']0.5[/font]到[font='Times New Roman','serif']1.0mm[/font]。要检查梳子齿下方或之间是否有气泡,在室温下冷却凝固。 [font='Times New Roman','serif'](4) [/font]待凝胶充分凝固后,垂直向上小心拔出梳子,以保证点样孔完好。 [font='Times New Roman','serif'](5)[/font]将凝胶置入电泳槽中,加入[font='Times New Roman','serif']0.5×TBE[/font]缓冲液[font='Times New Roman','serif'],以浸没凝胶约1mm为合适。[/font] [/size] [size=10px][b][font='Times New Roman','serif']3[/font][font='Times New Roman','serif'].[/font]制备DNA样品:[/b]将DNA样品与上样缓冲液混合。[/size] [size=10px]把DNA样品和上样缓冲液混合,利用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]把电泳样品加到没入缓冲液中凝胶槽中,在凝胶的两侧样品槽内加入合适的分子量标准品。[/size] [size=10px]上样量的多少根据样品中DNA片断的多少和大小而定,已知浓度的DNA用于估测样品质粒DNA的浓度。 [b][font='Times New Roman','serif']4.[/font]电泳:[/b]将DNA样品加载到凝胶上的样品孔中,在电场的作用下进行电泳。[/size] [size=10px]盖上电泳槽的盖子,正确连结电泳槽上的导线。电泳电压以正负电极的距离的一到五倍为合适(1到5V/cm)。如果电泳线连接正确,那么在进行电泳时可以看到有气泡从电泳槽内电极导线处产生,同时,在几分钟后,可见溴酚蓝条带从负极向正极移动,从上样槽内移入胶体。[/size] [size=10px][b]5.观察:[/b]当核酸样品移动到距离胶板下沿约1cm处时,停止电泳。电泳结束后,利用紫外灯观察DNA片段的迁移情况。当DNA样品在凝胶内移动到合适的距离时,关闭电源,去除电泳导线和电泳槽盖子。在室温下,用电泳缓冲液或水配制的EB溶液(0.5 μg/ml)对凝胶进行染色[b][font=-apple-system, helvetica, sans-serif]。[/font] 三、琼脂糖凝胶电泳的主要应用[/b] [/size] [size=10px][b]1.DNA片段的鉴定:[/b]通过比较DNA片段的迁移距离,与标准品进行对照,可以判断DNA片段的大小。[/size] [size=10px][b]2.DNA片段的分离:[/b]利用不同大小DNA片段的迁移速率差异,可以将DNA片段进行分离。[/size] [size=10px][b]3.DNA的纯化:[/b]通过电泳将目的DNA片段与其他杂质分离,得到纯化的DNA片段。(割胶回收)[/size] [size=10px][b]四、操作技巧和注意事项[/b][/size] [b][font='Times New Roman','serif'][size=10px]1.EB毒性[/size][/font][/b] [size=10px]EB是一种很强的诱变剂。在接触含有EB溶液时,应该全程戴手套和口罩。[/size] [size=10px]电泳中使用的溴化乙锭(EB)为中度毒性、强致癌性物质,务必小心,勿沾染于衣物、皮肤、眼睛、口鼻等。所有操作均只能在专门电泳区域操作,戴一次性手套,并及时更换。[/size] [b][font='Times New Roman','serif'][size=10px]2. 加热熔化琼脂糖[/size][/font][/b] [size=10px]用微波炉加热熔化琼脂糖时,溶液体积不能超过三角瓶容量的1/3,以免煮沸时溶液溢出。同时,琼脂糖必须完全熔化,否则可能导致电泳图像模糊不清。[/size] [b][font='Times New Roman','serif'][size=10px]3.凝胶厚度[/size][/font][/b] [size=10px]凝胶的厚度一般为4-6nm,若太厚可能会影响检测的灵敏度。待凝胶充分凝固后才能拔出梳子,以保证点样孔形状完好,防止漏样。[b][font='Times New Roman','serif']4.上样[/font][/b][/size] [size=10px]上样时,须先除去点样孔中的气泡,并且加样操作需小心谨慎,以免漏样或损坏胶孔。[/size] [b][font='Times New Roman','serif'][size=10px]5.电泳电压[/size][/font][/b] [size=10px]选择适当的电泳运行条件很重要,包括电压和距离。推荐的电压范围是4-6V/cm,电压太低会降低迁移率,电压太高会降低分辨率。[/size]
[color=#c001cb][size=4][color=#000000][back=rgb(245, 100, 254)] 去年下半年做了些实验,把实验数据和各位交流一下.由于食品菌落总数[/back][back=rgb(245, 100, 254)]测定[/back][back=rgb(245, 100, 254)]已改用平板计数琼脂,水质,公共场所等样品还是用原来的营养琼脂,因此内容有点滞后,仅供参考,举一反三吧![/back][back=rgb(245, 100, 254)] 先说一下结论:营养琼脂[/back][back=rgb(245, 100, 254)]质量[/back][back=rgb(245, 100, 254)],样品本身的菌相及其细菌损伤状态是影响菌落总数结果的三个重要因素。[/back][back=rgb(245, 100, 254)] 再说一下[/back][back=rgb(245, 100, 254)]讨论[/back][back=rgb(245, 100, 254)]:[/back][back=rgb(245, 100, 254)] 速冻食品和鸡精在[/back][back=rgb(245, 100, 254)]生产[/back][back=rgb(245, 100, 254)]过程中分别经过冷冻和干燥处理,河水中的细菌则遭受紫外线照射等,导致这三类样品中不同程度地含有损伤的活菌,即亚致死性损伤细菌。由于不同类别的样品菌相构成不一样,加上引起细菌损伤的因素不同,导致细菌损伤的数量、部位和程度不同。因此,不同类别样品中存在的损伤性细菌具有各自相应的特点,对营养琼脂[/back][back=rgb(245, 100, 254)]培养基[/back][back=rgb(245, 100, 254)]的营养要求和理化指标等条件也存在一定的差异性。此次实验结果也表明:三类存在损伤性细菌的样品分别在某一种不同的营养琼脂培养基上生长最好,没有一种营养琼脂培养基能满足各类样品中细菌的最佳生长要求。[/back][back=rgb(245, 100, 254)] 损伤性细菌已引起国际普遍关注。几乎所有各种食品[/back][back=rgb(245, 100, 254)]加工[/back][back=rgb(245, 100, 254)]过程,均可引起食品中细菌遭受损伤。对于含有损伤性细菌的样品,所得样品的菌落计数,以及[/back][back=rgb(245, 100, 254)]卫生[/back][back=rgb(245, 100, 254)]指标菌和致病菌的[/back][back=rgb(245, 100, 254)]检测[/back][back=rgb(245, 100, 254)],若不考虑受伤细菌因素并探讨其相应有效的[/back][back=rgb(245, 100, 254)]检验[/back][back=rgb(245, 100, 254)]方法,则取得的结果将有脱离实际的危险 。SN/T1538.1-2005《培养基制备指南第一部分:[/back][back=rgb(245, 100, 254)]实验室[/back][back=rgb(245, 100, 254)]培养基制备质量保证通则》中也明确指出:如果食品中含有受损的[/back][back=rgb(245, 100, 254)]微生物[/back][back=rgb(245, 100, 254)]细胞,还应考虑培养基在受损[/back][back=rgb(245, 100, 254)]微生物[/back][back=rgb(245, 100, 254)]恢复方面的适用性。而不同厂家生产的营养琼脂培养基所含有的营养成份存在较大差异,对损伤细菌具有的恢复能力不同。同时,培养基中可能含有的抑制损伤细菌生长的因素不同,如PH值等,对损伤细菌生长的影响较大。可见,对营养琼脂质量和性能进行评价时,应充分考虑到检测样品的菌相及可能存在的损伤性细菌等因素。仅仅采用单一的、处于正常生长状态的标准菌株来评价营养琼脂的质量,存在一定的局限性。[/back][/color][back=rgb(245, 100, 254)][color=#000000] 此次实验中将营养琼脂培养基对不同类别样品菌落总数结果计算计数分值,其中三种培养基的计数总分值较高,并且比较接近,分别为77、74、69.5,可以认为这三家厂家生产的营养琼脂培养基总体质量接近,适宜多数细菌生长。而有一种培养基对各类样品的计数分值均非常低,提示该厂家生产的营养琼脂培养基可能存在质量问题,对细菌的生长存在较大的影响[/color]。[/back][/size][/color]
求助 海水中大肠菌群的检测方法谢谢
请想问一下各位老师,如果在SDA上培养的菌总数(需氧菌+霉菌和酵母菌)超过了规定范围,再用玫瑰红琼脂培养基检测产品结果合格,那么最终结果数据是采用SDA培养的还是用玫瑰红琼脂培养基的?
我想要用葡聚糖凝胶色谱来分离纯化半刀豆球蛋白分子量是104000,它本身会结合葡萄糖,那用葡聚糖凝胶色谱还能不能分来,如果不行的话,琼脂糖凝胶可以不?琼脂糖凝胶我还没有用过,所以不知道DEAE琼脂糖凝胶 FF能不能用来分离,谢谢大家了!
请问在沙门氏菌的检测中如果BS琼脂平板上只培养了30小时会不会有影响?比如说沙门没长起来这种情况?

[font=宋体][size=10.5000pt]琼脂糖预制胶电泳试剂盒是一种非常适合核酸[/size][/font][font=宋体][size=10.5000pt]PCR[font=宋体]实验、酶切反应实验等的一种可以直接进行核酸凝胶电泳实验的试剂盒,电泳实验效率大大提高,可以节约大量时间。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]此款琼脂糖电泳试剂盒跟其它琼脂糖试剂盒有区别,因此使用方法也有一些区别,不需要再四处采购琼脂糖、核酸染料、电泳液和[/font]loading buffer[font=宋体]等试剂;而且琼脂糖预制胶是经过核酸染料预染的,既不用进行繁琐的制胶,也不用电泳液染色或后染色,即开即用;再加上配备的高压快速电泳液,电泳速度远远快与传统的[/font][font=Calibri]TAE[/font][font=宋体]或[/font][font=Calibri]TBE[/font][font=宋体]电泳液。[/font][/size][/font][img=,519,396]https://ng1.17img.cn/bbsfiles/images/2020/07/202007101051212160_1649_3880864_3.jpg!w519x396.jpg[/img][font=宋体][size=10.5000pt]使用方法:[/size][/font][font=宋体][size=10.5000pt]1. [/size][/font][font=宋体][size=10.5000pt][font=宋体]在低温条件下高压快速电泳有时会有结晶析出,请[/font]65[font=宋体]℃水浴加热溶解,用去离子水稀释[/font][font=Calibri]100[/font][font=宋体]倍,用作电泳液,倒入电泳槽中。本产品配置的电泳液可重复使用两三次,如果大电泳槽次数更多。[/font][/size][/font][font=宋体][size=10.5000pt]2. [/size][/font][font=宋体][size=10.5000pt][font=宋体]取出琼脂糖凝胶,剪刀剪开,标签面即孔突出面朝上,公测端为负极,放入高压快速电泳液中,没过胶面[/font]1mm[font=宋体],如有孔内有气泡,设法除去。[/font][/size][/font][font=宋体][size=10.5000pt]3. [/size][/font][font=宋体][size=10.5000pt][font=宋体]在[/font]DNA[font=宋体]样品中加入[/font][font=Calibri]1μl[/font][font=宋体]的[/font][font=Calibri]6[/font][font=宋体]× [/font][font=Calibri]loading buffer[/font][font=宋体]混匀,用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url][/color][/url]将混合液缓慢加入凝胶加样孔,同时加入[/font][font=Calibri]Marker[/font][font=宋体]。[/font][/size][/font][font=宋体][size=10.5000pt]4. [/size][/font][font=宋体][size=10.5000pt][font=宋体]开启电源,红色为正极,黑色为负极,注意[/font]DNA[font=宋体]样品有负极向正极电泳移动。[/font][/size][/font][font=宋体][size=10.5000pt]5. [/size][/font][font=宋体][size=10.5000pt]根据迁移距离及指示剂迁移的位置,判断是否终止电泳。[/size][/font][font=宋体][size=10.5000pt]6. [/size][/font][font=宋体][size=10.5000pt][font=宋体]电泳完毕,关电源,将凝胶放在成像仪中观察电泳条带及其位置,并与[/font]Marker[font=宋体]比较被扩增产物的大小。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]以上是德晟琼脂糖预制胶电泳试剂盒的具体使用方法以及在高压快速电泳时需要注意的一些小细节,虽然与其他试剂盒相比也一些差异,但是在核酸[/font]PCR[font=宋体]或者酶切反应等对分辨率要求不高的实验中,是非常适合的,而且省去了大量时间和金钱成本。[/font][/size][/font]
请问有谁知道怎么可以让琼脂凝胶溶化,不用加热的方法。有没有什么化学药品能溶琼脂的? 谢谢啦!