各位色友: 你们好! 请问,你们有用watersHPLC,C18柱检测过茶中的洛伐他汀/?
近期,国内仿制药物的一致性评价工作开展的如火如荼,辛伐他汀作为重要品种也受到十分关注。2016年5月26日,国家食品药品监督管理总局发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告,明确规定2018年底前须完成仿制药一致性评价品种目录,共计289个化合物,其中辛伐他汀位于第91个。 辛伐他汀是洛伐他汀的甲基化衍生物,由美国默克公司研制并于1988年首次上市,是目前全球应用最广泛的5个他汀类药物之一。国内生产各种剂量剂型的辛伐他汀片、胶囊的药企约有178家,是口服降血脂药物的重要品种。 生物等效性试验的分析检测方法通常是利用三重四极杆质谱仪([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)来测定血浆中的药物浓度来进行的。[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS的定性定量能力都非常好,同时为了满足生物等效性试验中样品分析的快速性,通常希望下能够进行准确定量的前提下,分析方法时间越短越好。 Kromasil采用3.5μm颗粒大小的色谱填料的短色谱柱2.1*50mm,开发了血浆中辛伐他汀的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS的快速检测方法,在3.5min内能够完成一个样品的检测,并能与洛伐他汀完全分离,非常适合于BE研究方案中样品的检测。[b]相关图在附件~[/b]
1.从引物自身着手,重新设计引物,这是最根本解决这一问题的办法。2.可能模板有问题,模板浓度过小,适当加大模板量。3.Taq酶,引物,Mg2+浓度可能过高,可降低它们的浓度。4.将上下引物混合后,在100℃的沸水中煮5分钟,然后迅速拿出至于冰块之上瞬时冷却,这时再加入反应体系当中,引物二聚体就会消失的。理由:引物可能会发生发夹结构,自身环化等结构,在100℃的沸水中煮5分钟可使引物变为单链,以减少二聚体。不过有人认为在PCR仪上95度变性5min也同样达到目的,而且成功试过通过延长退火时间也可以消除引物二聚体。5.所配MIX中加5%的甘油或者5%的DMSO,可以增强特异性。6.PCR反应体系的配制在冰上进行,最后加Taq酶,PCR结束后,产物勿放置在室温下过长时间,有人认为室温下有些Taq酶会将多余的引物合成为二聚体。7.增加循环数。8.降低退火温度后有条带,则应逐渐提高温度,若提高温度的同时产物量减少,则考虑增加Mg2+浓度(根据扩增片断长度而定,片段长则相应镁离子浓度应该高一些)。9.若降低退火温度,发现还是只有引物二聚体,而且镁离子的浓度在20-25mmol/l没有区别,则考虑Buffer等试剂没有完全融解、混匀,导致吸取的试剂浓度不对。10.以上次的PCR产物作模板二次PCR,可以提高引物与模板的特异性,减少引物二聚体,如果两次时间间隔短的话,可以把原产物稀释100-1000倍,如果间隔较长可以稀释50-100倍。
我的化合物是属于含金属锂离子的复合物,然后又加了溴离子,(即得到了这样的二聚体,其他实验已证实该二聚体的存在),做了高分辨质谱发现了双电荷的峰,这个双电荷的 峰正好是显示含2个锂离子的二聚体的分子量那么我能不能判断我的东西在加了溴离子之后可以形成二聚体注:我的化合物不能络合两个金属锂离子,不加溴离子之前的高分辨质谱中也没发现二聚体的峰
附件是原料巯基丙酮用酒精稀释后进的gcms,请问巯基丙酮二聚体的峰到底是14.866还是22.072,或者说两者都是?还有,根据香料通则,这个东西的含量要达到95%,根据图上看有个很大的巯基丙酮,含量应该不到95%,巯基丙酮是本来就有的呢还是二聚体分解出来的?大家做原料控制的时候怎么做的呢?
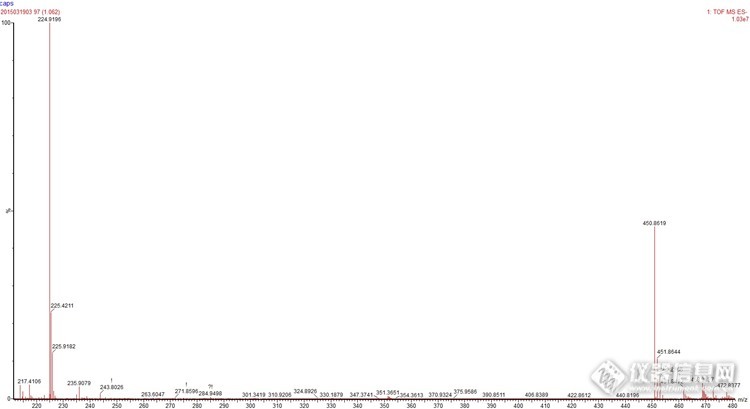
ES-做的,224.9同位素相差是0.5,450.9同位素相差1,这个是二聚体吗?分子量是452?大神解释下http://ng1.17img.cn/bbsfiles/images/2015/03/201503201055_538947_2359430_3.jpg
如题,乙偶因二聚体在气相上能出得来不?如何测定乙偶姻中二聚体的含量?
求二聚酸中单体、二聚体、三聚体含量测定方法?
甲基环戊二烯二聚体有没有异构体?在[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]上出几个峰?用什么色谱柱?
在解析ESI低分辨时,如何区分有二倍关系的是二具体,还是因为出现了多点带电,比如说,我打了个ESI+低分辨300-500有个离子峰M/Z=415.2,响应强度为2.40e3。而600-1000范围有两个较强的离子峰M/Z=785.4,M/Z=807.4,响应强度为681。从785.4和807.4可判断出807.4为加Na,785.4为加H,415.2也是加Na。那么分子量到底是多少,按二聚体算的话,分子量应该为392,。如果说是415.2带了两个电荷,那么分子量是不是应该就是784。(请高手给讲讲,这ESI源打质谱如何判断分子量)图上传不上
请各位老师谈谈方向,我想试试GC测三氧化硫以及二聚体三聚体的含量。
[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]如何检测乙偶姻二聚体?查沸点279,出峰却很早,与乙偶姻出峰在一个位置上。
我想从猪肝中分离纯化金属硫蛋白,样品经过Sephadex G-75凝胶柱后,提出其中MT二聚体的蛋白峰,分子量14000左右,经过浓缩后上弱阴离子交换柱,采用0.01-1.0M醋酸铵缓冲液线性梯度洗脱,PH8.3,但是经过一次实验后溶液的PH降低,大量洗脱平衡后仍不能达到8.3,现在我该怎么办?请赐教.
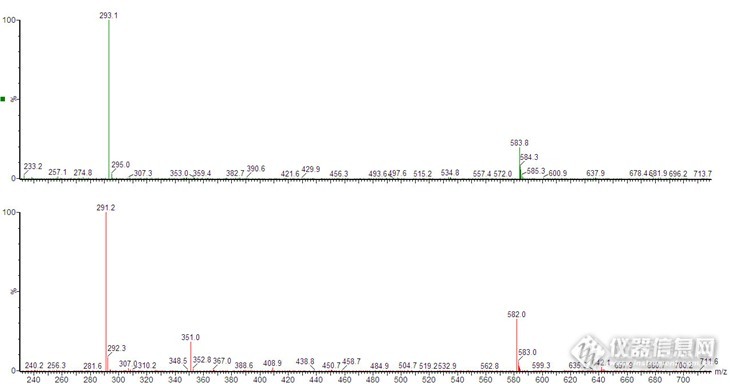
我有一个质谱图,已知分子离子峰在不同模式下分别为291和293,那么二聚体峰如何解释呢?见附图。data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAABPwAAAKfCAYAAAD6jdY4AAAgAElEQVR4AezdPVLb2v84/uP/ZAtQ3CY1A8VtswAYuuyBCRuAJt3nf7vbkA3AZA+3y8AC0n4LGGqaFGYR/kmyjy3JkiwbA/LhxUyip/P4OrIs3uhhNMl+gh8CBAgQIECAAAECBAgQIECAAAECBJIQ+P+S6IVOECBAgAABAgQIECBAgAABAgQIECBQCAj42REIECBAgAABAgQIECBAgAABAgQIJCQg4JfQYOoKAQIECBAgQIAAAQIECBAgQIAAAQE/+wABAgQIECBAgAABAgQIECBAgACBhAQE/BIaTF0hQIAAAQIECBAgQIAAAQIECBAgIOBnHyBAgAABAgQIECBAgAABAgQIECCQkICAX0KDqSsECBAgQIAAAQIECBAgQIAAAQIEBPzsAwQIECBAgAABAgQIECBAgAABAgQSEhDwS2gwdYUAAQIECBAgQIAAAQIECBAgQICAgJ99gAABAgQIECBAgAABAgQIECBAgEBCAgJ+CQ2mrhAgQIAAAQIECBAgQIAAAQIECBAQ8LMPECBAgAABAgQIECBAgAABAgQIEEhIQMAvocHUFQIECBAgQIAAAQIECBAgQIAAAQICfvYBAgQIECBAgAABAgQIECBAgAABAgkJCPglNJi6QoAAAQIECBAgQIAAAQIECBAgQEDAzz5AgAABAgQIECBAgAABAgQIECBAICEBAb+EBlNXCBAgQIAAAQIECBAgQIAAAQIECAj42QcIECBAgAABAgQIECBAgAABAgQIJCQg4JfQYOoKAQIECBAgQIAAAQIECBAgQIAAAQE/+wABAgQIECBAgAABAgQIECBAgACBhAQE/BIaTF0hQIAAAQIECBAgQIAAAQIECBAgIOBnHyBAgAABAgQIECBAgAABAgQIECCQkICAX0KD+SG78nwXLkejMJr9u3koKZS3Xd6F59Km8HAzzzMaXYa7ysZywtJ8Ud5NKFdR2mqWAAECBAgQIECAAAECBAgQIDAIAQG/QQyDRmwm8BBu9k/Cwf0kTCbZv/vrcH4Ug3fTbeF2XGwbn/4K+zEamAfujh6zTTHfQTjZXxXIm5b3Y7OGykWAAAECBAgQIECAAAECBAgQeDMBAb83o1bR1gUefofzi9vw9XBW8uHXcHvxIzyNs+XnP+ExXIez471i497xWbg+/zm9km/vOFxNrsJsUwiHX7KUj+FPy1V+z3eX2dWAR+Hx+jpcbL0TCiRAgAABAgQIECBAgAABAgQIbFdAwG+7nkp7S4HDb2FydRymIb284nF42uASvOe7n1ng8DT8vSio2ou/zsI4u4Lw6uvn6npLBAgQIECAAAECBAgQIECAAIEBCgj4DXBQNGkzgWngbnbF395f4SCch9+zB+4V28Ls6r9Y/OwZf9ldweH2ezlwGBNMp3uHh6WgYnWbJQIECBAgQIAAAQIECBAgQIDA0AQE/IY2ItqzkUB+2+3+yUG4n1/xdxi+jW/D49H0hR7/hrPsdt9a0cWtvfmz//o8w6+W1yIBAgQIECBAgAABAgQIECBAYKACAn4DHRjN6i8wDfZlV+mNv4X4OL8idwzo5bfjHofsdt+L8Hm/odwVz/BryGEVAQIECBAgQIAAAQIECBAgQGCwAp8G2zINI9BDYH5l36QW7KvnLV7icRC+tD2nr57eMgECBAgQIECAAAECBAgQIEBgRwV6XOH3HO4uR+Fm9iy0RT+n60ej6S2Tl3f1V5yu2r4oyRyBjQSyZ/D9mz9/r35lX1HYQ7gZXU7fypstP/x3En5cf5leAfhwk7119ybMd+k8GNj10o6NGicTAQIECBAgQIAAAQIECBAgQOB9BFYE/PKg3X44WXrz6Wz9wX2YZLdLTib34eBkPyyCfqu2v09n1ZqWQBHEy17EcbI/DTrH4PM0OJ09w694Nt9029HjbRh/m93wm73dd3z7GI5mwerR/lM4mz/7LwsO3oxK+3JaZnpDgAABAgQIECBAgAABAgQIpC8wygJ2k6ZuTm+VzCJ9F9fhOnvbaTibhBgvCfnbTfd/hdPxVTiOt0jmV039/BzGeeBk1famCq0jQIAAAQIECBAgQIAAAQIECBAgQODFAh1X+J2G+/zqvauv4XO9mvFT+FG/BXL/c7j48RTGedpV2+vlWSZAgAABAgQIECBAgAABAgQIECBAYCsCrQG/vePj6htPS9U9/3ksLZVnH8Of7FF+q7aXc5gnQIAAAQIECBAgQIAAAQIECBAgQGB7Aq0Bv+1V0VxSfN5a07Q5h7UEtisw+me03QKVRoAAAQIECBAgQIAAAQIECBAYgMCnTdqw99dBS7aD8Ff2TL9V2/PMTY8OzIN/fggQIECAAAECBAgQIECAAAECBAgQ2Fxgsyv8ys/ri3UXz+37HPbz5VXbYx5TAgQIECBAgAABAgQIECBAgAABAgS2KrBZwG/v73B6cR6Obh5mjXkIN0fn4eL071C8tHfV9q12QWEECBAgQIAAAQIECBAgQIAAAQIECESBzQJ+WVjv+Gocbh+PwvQZfEfh8XYcro6LcF9W9qrtsXpTAgQIECBAgAABAgQIECBAgAABAgS2KTDKnqU32WaBLykrPsNvQE16SXfkHbhA/tKOyf8Gs/sPXEvzCBAgQIAAAQIECBAgQIAAgV0R2PAKv13pnnYSIECAAAECBAgQIECAAAECBAgQ+FgCAn4fa7z1lgABAgQIECBAgAABAgQIECBAIHEBAb/EB1j3CBAgQIAAAQIECBAgQIAAAQIEPpaAgN/HGm+9JUCAAAECBAgQIECAAAECBAgQSFxAwC/xAdY9AgQIECBAgAABAgQIECBAgACBjyUg4PexxltvCRAgQIAAAQIECBAgQIAAAQIEEhcQ8Et8gHWPAAECBAgQIECAAAECBAgQIEDgYwkI+H2s8dZbAgQIECBAgAABAgQIECBAgACBxAUE/BIfYN0jQIAAAQIECBAgQIAAAQIECBD4WAICfh9rvPWWAAECBAgQIECAAAECBAgQIEAgcQEBv8QHWPcIECBAgAABAgQIECBAgAABAgQ+loCA38cab70lQIAAAQIECBAgQIAAAQIECBBIXEDAL/EB1j0CBAgQIECAAAECBAgQIECAAIGPJSDg97HGW28JECBAgAABAgQIECBAgAABAgQSFxDwS3yAdY8AAQIECBAgQIAAAQIECBAgQOBjCQj4fazx1lsCBAgQIECAAAECBAgQIECAAIHEBQT8Eh9g3SNAgAABAgQIECBAgAABAgQIEPhYAgJ+H2u89ZYAAQIECBAgQIAAAQIECBAgQCBxAQG/xAdY9wgQIECAAAECBAgQIECAAAECBD6WgIDfxxpvvSVAgAABAgQIECBAgAABAgQIEEhcQMAv8QHWPQIECBAgQIAAAQIECBAgQIAAgY8lIOD3scZbbwkQIECAAAECBAgQIECAAAECBBIX+DSE/o1GoyE0QxsIECBAgAABAgQIECBAgAABAgQI7LzAIK7wm0wmIf/nhwABAgQIECBAgAABAgQIECBAgACBlwkMIuD3si7ITYAAAQIECBAgQIAAAQIECBAgQIBAFBDwixKmBAgQIECAAAECBAgQIECAAAECBBIQEPBLYBB1gQABAgQIECBAgAABAgQIECBAgEAUEPCLEqYECBAgQIAAAQIECBAgQIAAAQIEEhAQ8EtgEHWBAAECBAgQIECAAAECBAgQIECAQBQQ8IsSpgQIECBAgAABAgQIECBAgAABAgQSEBDwS2AQdYEAAQIECBAgQIAAAQIECBAgQIBAFBDwixKmBAgQIECAAAECBAgQIECAAAECBBIQEPBLYBB1gQABAgQIECBAgAABAgQIECBAgEAUEPCLEqYECBAgQIAAAQIECBAgQIAAAQIEEhAQ8EtgEHWBA
【序号】:1【作者】: Mehta, Tushar N.; Patel, Atul K.; Kulkarni, Gopal M.; Suubbaiah, Gunta【题名】:Determination of Rosuvastatin in the Presence of Its Degradation Products by a Stability-Indicating LC Method【期刊】:Journal Of AOAC International [J AOAC Int【年、卷、期、起止页码】:Volume 88, Number 4, July 2005 , pp. 1142-1147(6)【全文链接】:http://chinesesites.library.ingentaconnect.com/content/aoac/jaoac/2005/00000088/00000004/art00021
我正在制备双特异抗体,采用半分子互换方法,即一半A 一半B,但是交联后,仍有少量的A和B的污染,因为我是想得到需要的双特异性抗体,因此需要纯化,请问如何才能做到? 据说可以用分析型CIEX实现 不知道具体的方法和原理如何 望指教,谢谢 我的联系方式时 13936179062 微信 电子邮件是 13936179062@139.com
Waters 2695测洛伐他汀洛伐他汀标样有一个小的杂峰呀,肿么搞的呀,有朋友做过洛伐他汀没~~
PTA与EG发生聚合反应,产品PET发灰!是用乙二醇锑作为催化剂。什么原因?如何解决? 初步推断,原因可能如下: 1、其它金属(如反应釜中的铁)置换锑离子为锑元素; 2、乙二醇锑与乙醛发生有机还原,生成了金属锑; 3、产生了新的络合物 。 哪位高师,可以指点迷津啊? 望赐教! 非常感谢!
多方求助无果,希望有高人指点。急急我们实验室在做重组人复合α干扰素(cIFN)的聚合与降解研究。cIFN单体中有两条分子内二硫键,它们在巯基乙醇作用下可以被还原打开,并且在空气中会形成分子间二硫键,进而引起cIFN聚合。再向这些聚合体中添加过量巯基乙醇后绝大多数的聚合体都被离解成单体,但是通过还原SDS-PAGE仍可以看到有微量的二聚体。理论上还原条件下二硫键是不存在的,所以我们推测这个二聚体应该是其他化学键引起的。我想知道的是:1、蛋白质除了二硫键是否还有其他的化学键可以引起蛋白质共价聚合体。2、用什么方法可以鉴定蛋白质聚合体中单体间的化学键?[em0812][em0812][em0811][em0811][em0811]
我测洛伐他汀,流动相甲醇-水73-27,甲醇和水分两个通道走,保留时间29,5左右,当我把流动相按照73-27混合在一个瓶子里,走一个通道,保留时间是24.6min,两种情况保留时间相差5min,这种情况正常吗,如果新仪器会出现这种情况吗,我用的是二手液相。安捷伦的1200系列。请各位大神说说有没有遇到这种情况的。
现知道正丁基锂能用于洛伐他汀合成中的甲基化试剂,还有其他的用途吗?其他的他汀类药物也用到正丁基锂吗?
http://ng1.17img.cn/bbsfiles/images/2016/01/201601032253_580610_1621538_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/01/201601032253_580611_1621538_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/01/201601032253_580612_1621538_3.jpg帮一个同学问的:自己合成的样品,用液相色谱法分离,总是分不开。一个大峰,峰形不太好看,件图1.色谱柱:sugar-Ca;色谱柱要求见图2。分析标准品可以分开,见图3.现在流动相为水和乙醇,流速和柱温都调整了,还是分不开,请大家指点。
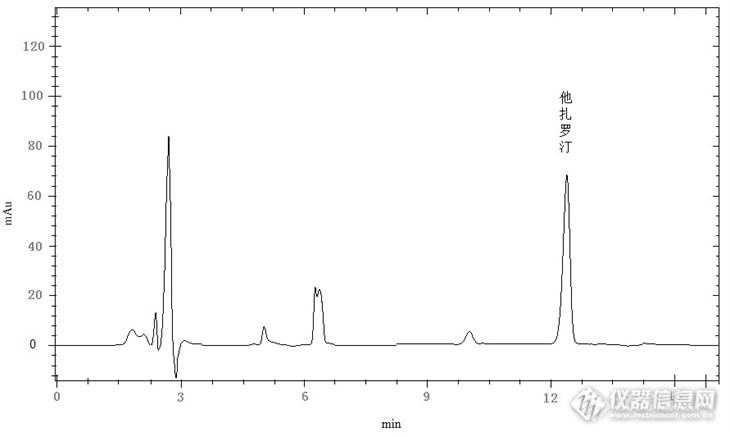
药物检测之他扎罗汀乳胶检测 药品作为治病救人的良方,关系到国人的健康,关系到民众的安危。药品的作用和地位现在被认为是很高的,可以和食品相提并论,提上日程。国家和民众现在对药品的要求也越来越高,检测的种类和项目也越来越多,越来越严。药典中涉及到的药物检测内容大家都有目共睹。其中采用高效液相色谱法分析、检测的占有相当大的比例,广新增加的检测项目就有900多种。可见高效液相色谱在药物分析中的地位不一般。所以在药物分析中高效液相色谱法不可小视,学习和掌握这种方法是非常必要的。 他扎罗汀是一种第一个受体选择性、第三代芳香维A酸类临床药物药物,临床安全、有效,在治疗银屑病等皮肤病、痤疮、角化异常性疾病、毛囊皮脂腺疾病、皮肤癌前期病变,临床开发应用前景非常广阔,而且对基因活化、调节转录很有作用。 本文是中华人民共和国药典(2010 版)中的检测项目,他扎罗汀乳膏中他扎罗汀含量的高效液相色谱测定方法。方法具有准确、灵敏、简单的特点。 仪器高效液相色谱仪,包括紫外检测器,柱温箱,等度泵离心机超声波溶剂过滤器电子分析天平试剂乙腈(色谱纯)异丙醇(色谱纯)乙醇(分析纯)纯净水色谱条件色谱柱:VenusilXBP C18 (250×46mm,5μm)柱温:35℃流动相:异丙醇:乙腈:水=38:27:35检测波长:325nm流速:1.0mL/min进样体积:20μL色谱图http://ng1.17img.cn/bbsfiles/images/2013/07/201307302156_454832_2621067_3.jpg 他扎罗汀对照品色谱图 http://ng1.17img.cn/bbsfiles/images/2013/07/201307302157_454833_2621067_3.jpg他扎罗汀供试品色谱图结论: 采用该方法检测他扎罗汀,检出限为0.10μg/mL,定性重复性0.35%,定量重复性0.50%,线性范围在1μg/mL~200μg/mL时,r=0.9998,加标回收率在85-95%。所有测试结果完全满足中华人民共和国药典中“他扎罗汀”标准要求。 该方法检测他扎罗汀简单、灵敏、准确,适合检测他扎罗汀乳胶中他扎罗汀的含量。
各位师兄好。身为一名实验猿,能有如此平台同各位师兄交流,感谢此平台。同时在下在仪器信息网也学到许多知识,遇到些许问题与众位进行探讨,列位师兄热情指点,犹为激动。话不多说,如今遇一棘手难题,在下着实难以解决,特来寻求帮助,还请各位师兄不吝指点!在下手头有台waters UPLC H-class,配TUV、FLR检测器。常用此仪器做水溶性维生素VB族b1、b2、b6、叶酸。b1、b6、叶酸三物质TUV出峰,b2为FLR出峰。近日发现,梯度洗脱TUV重现性极差,可以说是10针只有4-5针是正常出峰图谱,而不靠谱的图谱中在需要的时间段是一条平线。此现象是一阵一阵的出现,经常是今天往死了折腾都是不靠谱;明天,同样的流动相,同样的样品,图谱完美,重现性极好。在下分步排查,1)怀疑过比例阀问题。软件端显示已梯度,有机相越来越高,实际比例阀故障,一直是水相在冲柱,如此可以解释不靠谱图谱为何是基线,洗脱能力弱,洗脱不下来嘛。按照这个思路排查,将常用CD通道换成AB通道,故障依旧。另外梯度时盯着控制台,发现有机相水相比例曲线还是看上去像那么回事的,对此部分还是存在疑问。2)怀疑进样系统问题。用过UPLC的师兄知道(没有任何歧义,小弟是半路出家,边用边学),UPLC的控制台样品管理器有“定性针头密封”“密封状态测试”“渗漏测试”三个测试,在下把这三个测试都走了遍,均显示通过状态;另外走等度洗脱进了6针洛伐他汀的对照,峰面积RSD很是不错。对此部分暂时没有疑问。3)怀疑色谱柱有问题。更换了预柱,更换后第一针跑出来的图谱是正常所需图谱,(没换预柱之前是针针不靠谱,针针走基线)但是第二针开始又是走基线。因为VB的色谱条件梯度前期水相比例达到97%,手头只有那一根色谱柱,我担心换别的柱子97的水太高,柱子吃不消,所以这个色谱条件没有替换柱子排查是不是柱子的原因。但是我换过色谱系统,换过检测项目,就是之前提到的洛伐他汀(等度洗脱),做了个留样再测,测得值与当初值略低(一年前产品,可以接受);同时VB柱用于此系统也能出洛伐他汀的峰,由于时间关系并未验证VB柱所测样品含量。总结一二,换过预柱,无明显效果;换过色谱柱,等度洗脱可正常使用。是否是色谱柱问题,请看下段。4)怀疑检测器问题。之前说过,此色谱条件b1、b6、叶酸三物质TUV出峰,b2为FLR出峰,如今TUV紫外检测器出现重现性极差的问题,那串联的FLR荧光呢?在下本着这个思路,查看了荧光的图谱。因为产品是多种维生素片(题外话,是何产品就不做广告了,以后再探讨这部分内容,我们接着将问题),维生素为上海某厂家提供的多种维生素预混料,原料我是都测过的,符合出场报告,那么现在紫外没有峰,可以理解为没有投料吗?非也。因为根据荧光图谱,b2含量符合企业标准,从而应证上面提到的色谱柱问题,个人觉得色谱柱分离效果没有问题,色谱柱那段疑问可以放下,如果色谱柱存在问题那FLR荧光也不会正常出峰。其实就检测器这段我也咨询过售后,售后让我查看下灯能量,在售后指点下我于230nm处,流通池纯甲醇,查得灯能量 样品/参比为 60/109,比值约为55%,售后工程师说灯能量比值最好在70%,建议我冲洗参比池。我已用纯水,纯甲醇冲洗,但效果仍不明显,明天打算换异丙醇、30%硝酸冲洗。现在怀有一疑问,梯度重现性差是不是因为流通池脏导致?那为何等度就没有此问题?流水账似的说了这么多,总结一二。就输液系统、进样系统、分离系统、检测系统四部分进行排查,各细节见上,但是还是没有头绪,如果哪位师兄有什么建议还请指出,另外就在下那个疑问,有类似经验的师兄还请指点一二!我在这里先谢过了!另外,有一工程师指出,他怀疑是哪个阀关不紧,时灵时不灵导致重复性差,我对阀的认识只停留在v1v2v3v4,哪个对应什么作用还没理清,提出这个可以给各位师兄一个思考的头绪。
在制备阿托伐他汀钙中间体A7过程中,色谱发现了有个含量极高的异构体,但不清楚具体是什么。现在想把这个异构体分离出来,我们已经通过结晶去掉了成品,现在通过减压蒸馏脱掉溶剂,里面异构体含量约70~80%,但没办法得到固体。现在问题是:通过什么方法能将成品与异构体分离并对异构体进行提纯呢?
(求助)阿托伐他汀中间体的合成文献

97.1 高效液相色谱-质谱联用法测定人血浆中洛伐他汀的浓度 郁韵秋1,黄建明1,翁伟宇2,顾丽华1,王以俭1,张莉1(1.复旦大学药学院药物分析教研室,上海200032;2.复旦大学药学院药剂学教研室,上海 200032) 洛伐他汀;色谱法,高压液相;光谱法,质量,电喷雾电离http://ng1.17img.cn/bbsfiles/images/2012/09/201209232006_392431_2432394_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/09/201209232006_392432_2432394_3.jpg
进行这项计算的最根本的目的是,希望通过理论计算,指导生产实际中微量元素的添加量,避免每个配方都重复进行实验。进一步的,是在聚磷酸铵、磷酸一铵的比例为给定值时,添加最大量的七水硫酸锌,而不致产生沉淀。计算过程中遇到的大问题有如下几个 :一,理论基础差,直到现在,我还不敢保证所有计算中使用的关于络合物的理论是完全正确的;二,聚磷酸铵是一种混合物,我们使用的是水溶性聚磷酸铵,由二聚体、三聚体、四聚体……组成,n(聚合度)最高不超过20,论坛里初晶古恒老师指出,不同聚合度的聚磷酸铵,其络合能力是不一样的,我在处理中,忽略了这一因素,而是把聚磷酸铵当成某一分子量的“纯物质”,不知道这个近似对最终结果的影响有多大;三,聚磷酸铵-锌络合物的组成不确定,我在论坛里的上一个帖子http://bbs.instrument.com.cn/shtml/20120716/4144753/ 中,认为聚磷酸铵与锌离子是1:1反应,但是在后面的实验和计算中,我又推翻了这个假设。在本文里我对聚磷酸铵-锌络合物的配位数进行了探讨,尚且不敢打包票说是正确的。我参考了马娟等的“水溶性聚磷酸铵制备微量元素螯合物的实验研究”,对聚磷酸铵-锌络合物的配合物有一定的指导,但是不能彻底解决上述问题。背着这“三座大山”,我再度开始了实验与计算。我的思路如下:根据各物质的添加量,计算出溶液中“聚磷酸根”、磷酸根(认为磷酸一铵完全解离)、锌离子的表观浓度(mol/L)(不知道表观浓度这个词语用的对不对啊),认为溶液中的磷酸根全部是游离的,根据磷酸锌的离子积(9.0*10^-33),计算出溶液中游离锌离子的浓度A,全部的锌离子减去游离的锌离子,就是参与络合反应的锌离子B;再根据锌离子与聚磷酸铵络合的配位数(下文详述),计算出参与络合反应的聚磷酸根的量C,总量扣除参与络合反应的聚磷酸根的量,即为游离聚磷酸根的量D;据此计算出聚磷酸合锌的不稳定常数。不同实验数据,得出的聚磷酸合锌的不稳定常数,应该是一致的。实验数据共有四组,考虑到锌的添加量很小时,相对误差较大,因此只要前两组数据计得的不稳定常数一致,即认为方法成立。不稳定常数的计算公式:K=2+]*[PP][sup]n/[ZnPP],式中2+]为体系中游离锌离子的浓度A,[PP]为游离聚磷酸根的浓度(按单体算)D,n为锌与聚磷酸根络合反应的配位数,[ZnPP]为聚磷酸锌的浓度B。实验中使用的聚磷酸铵纯度为85%,另外15%为磷酸一铵。对于前两组实验数据,设n分别为8、7、6、5、4,计算聚磷酸锌的不稳定常数,发现当n为4时,计得的不稳定常数值最为接近。再对实验数据进行微调,可使得到的不稳定常数一致。又据查阅文献,一般没有三配位数的络合物,锌也几乎不存在二配位数的可能,因此认为该络合物的配位数为四。至此,络合物组成和不稳定常数都得出了结论。并根据得到的数据,预测了聚磷酸铵为15g,磷酸一铵为5g及聚磷酸铵为14g,磷酸一铵为7g时,应添加的七水硫酸锌的量,经实验,实验结果与计算值较接近。另外,较通用的络合物组成的实验方法为分光光度法,本实验还需用分光光度法进行验证。所有实验数据及计算过程见下图。实验中所有组合的溶解方法均为20g磷肥加400毫升水。
岛津HPLC(型号10A)在测定白蛋白多聚体的时应新药典要求进行系统适应性试验之分离度的计算class-LC10工作站中提供了直接计算的功能,但此项功能多数情况下不能给出二聚体峰与单体峰之间的分离度R,观察多张图谱得出只要是两峰中任一峰无理论塔板数则R无数值显示,即使是两峰在图谱上可明显观察到已分离,不明白为什么会出现此情况。PS:测定白蛋白成品时分析时间为70min,在单体峰(28min)之后会出一乙酰色氨酸峰(50min)而此两峰间R可达16左右。成品之前有一组分Ⅴ(生产中间体)样品也会测定其中多聚体含量,因其内不含乙酰色氨酸,故分析时间为50min,奇怪的就是恰恰因为这个原因使得每次单体峰与二聚体峰均可达到药典要求(R2.5)其实组分Ⅴ与成品组成几乎相同,仅仅只是纯度不及后者本人实在是不明白既然R是有公式计算得的,有峰存在,即有公式中的参数值即使是R很下,但也该有个数值吧!请高手帮忙解决一下,不胜感激!~
辛伐他汀,在MS/MS条件下(AB400,thermo TSQ)主要是加钠峰(m/z 441),而纠结于辛伐他汀钠(分子量458.6),现在是正离子条件下,也是有441的峰,理论情况下,应该是m/z 437,可是现在这个峰基本不强,为什么?各位仁兄姊妹提点建议啊