扫描电镜用4%戊二醛溶液干什么?
GB/T 5750.8 里面的戊二醛有人做过吗?标品买的是衍生好的,做加标回收是用的的未衍生的标品,按照方法上的衍生方式去做的。我做出来最高的回收率才是20多。
那位朋友有“消毒剂戊二醛的测定方法”?[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]、液相、紫外比色法均可。我在这里先谢了!
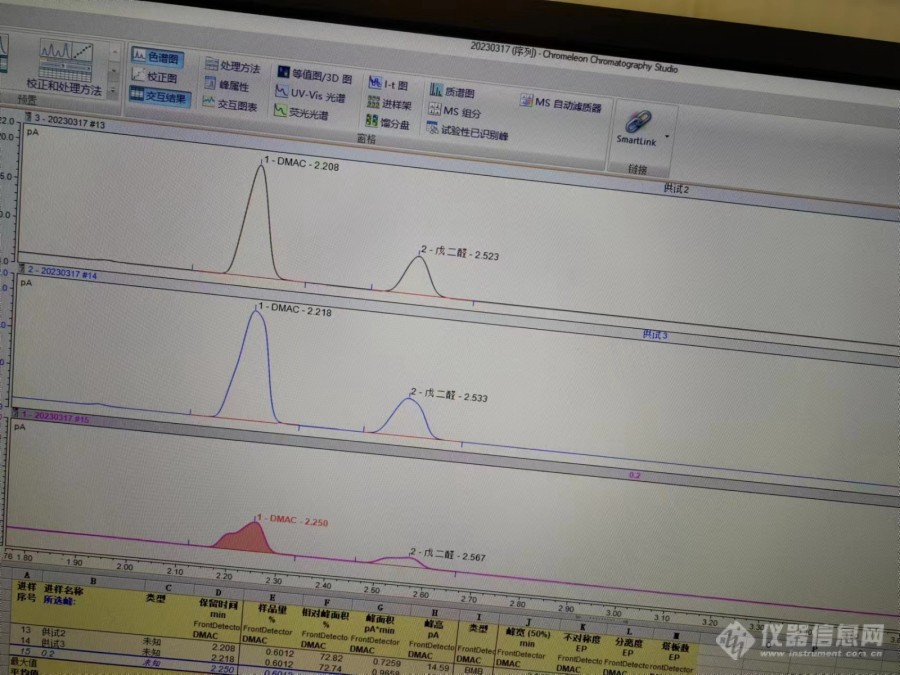
[img=,690,517]https://ng1.17img.cn/bbsfiles/images/2023/03/202303171335002009_2786_3420861_3.jpg!w690x517.jpg[/img]请教啊,戊二醛溶液,我同一个样品进了三针,同样测试条件,出来的峰为什么差别这么大?
脱水后的叶片怎样用叔丁醇置换?尊敬的各位老师大家好!我现在正在做生物样品,一种花的叶片,我们实验室只配备了冷冻干燥机。因此,我处理样品过程如下:样品经过2.5%戊二醛固定、系列乙醇脱水,叔丁醇中置换,但是怎么用叔丁醇置换很让我头疼。我们实验室的叔丁醇是固态的,请问叔丁醇怎样使用,是放在热水中加热使它融化了之后再将叶片浸泡进来吗?叔丁醇凝固以后可以直接放在冷冻干燥机中干燥吗?不用冻干机直接在空气中自然干燥可以吗?谢谢!
各位高手,我是tem的新手,我的细胞样品想攒到一起做,所以把不同时期的样品固定,我想求助各位高手,细胞样品戊二醛固定后能保存多久?保存条件是什么啊?谢谢
两材料都是白色,加入戊二醛以后,就开始变成淡黄色,颜色逐渐加深,这是什么原因?我在加热搅拌条件下,合成的。是我温度太高了吗?
请教各位大虾,戊二醛和环氧氯丙烷能用一根色谱柱分开吗?如果能,用什么条件啊?
请教:乙烯基甲醚、丙烯醛、二甲氧基二氢吡喃、戊二醛这几种物质可否有[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]检测?用什么样的柱子和检测条件?
1.酶标抗体的制备2.取材 将培养细胞或悬浮细胞用0.1Mol/L PBS液冲洗,离心沉淀后,立即转入固定液(2%甲醛液或2%戊二醛液均可)pH 7.2,4℃固定5min~30min(依抗原性质所定)。如病料为组织块,则取适当大小,先固定1h然后取出,以新的双面刀片切成50~100µm的薄组织再行固定1h~2h。3.漂洗 以PBS液漂洗过夜,换液3~4次。4.血清孵育,25℃1h或4℃过夜,孵育的标本放置于加盖的瓷盘内,底层垫数层纱布。防止抗血清干燥凝固,不易洗脱,造成非特异性吸附。5.PBS冲洗3~4次,每次10min。6.2.5%戊二醛再固定15min~30min。7.PBS液冲洗3~4次每次10min。8.酶标记抗体孵育;用适当稀释的酶标抗体(即工作浓度)于25℃湿盆内孵育1h或4℃过夜。9.PBS液冲洗3~4次每次10min或4℃漂洗过夜。10.酶显色处理 将漂洗后的标本浸入DAB-H2O2底物溶液中,20℃,10min~30min。显色强弱与戊二醛的固定有关。若显色弱则可减少甚至取消戊二醛的固定时间。冲洗时必须注意防止非特异漂浮的沉积。11.常规包埋、切片、电镜观察 在经过脱水包埋确定抗原性不致引起失活的前提下可在包埋切片后做标记染色,切片一般在2µm~4µm,切片后染色不存在通透困难的问题。无论在标记染色后切片还是在切片后标记染色,最好在光镜下定位选择后,再做电镜定位包埋,这样目的性强,可减少工作量。
1.酶标抗体的制备2.取材 将培养细胞或悬浮细胞用0.1Mol/L PBS液冲洗,离心沉淀后,立即转入固定液(2%甲醛液或2%戊二醛液均可)pH 7.2,4℃固定5min~30min(依抗原性质所定)。如病料为组织块,则取适当大小,先固定1h然后取出,以新的双面刀片切成50~100µ m的薄组织再行固定1h~2h。3.漂洗 以PBS液漂洗过夜,换液3~4次。4.血清孵育,25℃1h或4℃过夜,孵育的标本放置于加盖的瓷盘内,底层垫数层纱布。防止抗血清干燥凝固,不易洗脱,造成非特异性吸附。5.PBS冲洗3~4次,每次10min。6.2.5%戊二醛再固定15min~30min。7.PBS液冲洗3~4次每次10min。8.酶标记抗体孵育;用适当稀释的酶标抗体(即工作浓度)于25℃湿盆内孵育1h或4℃过夜。9.PBS液冲洗3~4次每次10min或4℃漂洗过夜。10.酶显色处理 将漂洗后的标本浸入DAB-H2O2底物溶液中,20℃,10min~30min。显色强弱与戊二醛的固定有关。若显色弱则可减少甚至取消戊二醛的固定时间。冲洗时必须注意防止非特异漂浮的沉积。11.常规包埋、切片、电镜观察 在经过脱水包埋确定抗原性不致引起失活的前提下可在包埋切片后做标记染色,切片一般在2µ m~4µ m,切片后染色不存在通透困难的问题。无论在标记染色后切片还是在切片后标记染色,最好在光镜下定位选择后,再做电镜定位包埋,这样目的性强,可减少工作量。来源:生物秀
大家好: 我想利用免疫电镜检测热应激前后小鼠囊胚中热休克蛋白70的定位情况,有两种方案:1.包埋前免疫电镜:胚胎经多聚甲醛-戊二醛混合液固定后,然后清洗,渗透,封闭,分别与一抗和二抗反应,然后再用锇酸固定,脱水,812包埋。2.包埋后的免疫电镜:胚胎经多聚甲醛-戊二醛混合液固定后,脱水,体温包埋剂渗透,包埋,聚合,超薄切片,最后进行免疫染色。 第一种方案:不知道热休克蛋白70的抗原性保存如何?另外,不知道免疫标记效果如何就进行包埋,是不是有点盲目? 第二种方案 超微结构和抗原性都保存较好,试验重复性好。但是包埋剂比较贵,而且本试验室没有聚合用的低温冰箱和紫外灯。 请各位大虾帮帮我!
如题,用聚乳酸羟基乙酸通过静电纺丝制成的膜状材料,想用扫描电镜观察材料的表面性状,我的制备程序是:1 戊二醛锇酸固定;2 乙醇梯度脱水;3 乙酸异戊酯置换…… 重点是,第三步100%乙酸异戊酯置换后可以用空气干燥法吗?(注:没有临界干燥法的仪器,且材料是由纤维组成的,电镜主要看纤维的排列) 请各位高手指点
由于扫描电镜观察的是样品表面或断面等超微结构,与透射电镜样品制作有所不同,一般不需要进行切片处理。需要注意的是,在整个样品制作过程中必须保护好观察面避免人为污染和损伤。 扫描电镜样品制备操作流程:取材( 做好样品观察面的标志 ) —— 漂洗( 生理盐水或缓冲液 ) —— 固定( 2.5% 戊二醛 2 小时以上 ) —— 漂洗( 0.1M 磷酸缓冲液, 3 次, 45 分钟 ) —— 后固定( 1% 锇酸, 2 小时 ) —— 脱水( 50% 、 70% 、 80% 、 90% 、 95% 各 15 分钟,换醋酸异戊酯 15 分钟或叔丁醇 15 分钟 ) —— 干燥( 零界点干燥或冷冻干燥 ) —— 镀膜( 真空镀膜仪或离子溅射仪 ) (一)取材: 由于扫描电镜对样品表面的要求非常严格,清洗时要注意保护观察面不受任何损伤,且保持干净,否则,可导致观察困难或错误判断。做好观察面标记,以免样品制作过程中分不清观察面所在的位置。 取材时要做到“快、冷、准”三要点: 快,就是取材动作要快,一般要求在 2 、 3 分钟之内将组织浸入 2.5% 戊二醛内。 冷,就是取材的器械、固定液要事先放在冰箱内预冷。 准,就是取材部位必须准确,否则容易造成取材失败。 样品大小长宽一般不超过 5cm ,高度不超过 3cm 为宜。此外,实验动物取材部位不宜多,这样会延误取材时间,导致组织自溶等人为假象的发生。 (二)前固定:固定前清洗的组织离体后应在 1 ~ 2 分钟清洗完毕并投入固定液内;固定后清洗的组织离体后应在 1 分钟以内投入固定液。固定液要预冷。 (三)漂洗:用 0.1M 磷酸缓冲液漂洗 3 次,每次 15 分钟。 (四)后固定: 1% 锇酸固定液室温下固定 1 小时左右,夏天稍短,冬天稍长。 (五)脱水:利用不同浓度乙醇梯度脱水,由 50% 、 70% 、 80% 、 90% 、 95% 各 15 分钟,换醋酸异戊酯 15 分钟或叔丁醇 15 分钟。 (六)干燥:可采用零界点干燥法和冷冻干燥法两种。 (七)镀膜:利用真空喷镀仪或离子溅射仪对样品观察表面进行镀膜,一般用金钯作为镀膜材料。 (八)电镜观察:观察者事先要熟悉所要观察样品的结构,做好观察记录,拍摄图象要及时存盘,并做好光盘刻录。
如题,用聚乳酸羟基乙酸通过静电纺丝制成的膜状材料,想用扫描电镜观察材料的表面性状,我的制备程序是:1 戊二醛锇酸固定;2 乙醇梯度脱水;3 乙酸异戊酯置换…… 重点是,第三步100%乙酸异戊酯置换后可以用空气干燥法吗?(注:没有临界干燥法的仪器,且材料是由纤维组成的,电镜主要看纤维的排列) 请各位高手指点
由于扫描电镜观察的是样品表面或断面等超微结构,与透射电镜样品制作有所不同,一般不需要进行切片处理。需要注意的是,在整个样品制作过程中必须保护好观察面避免人为污染和损伤。 扫描电镜样品制备操作流程:取材( 做好样品观察面的标志 ) —— 漂洗( 生理盐水或缓冲液 ) —— 固定( 2.5% 戊二醛 2 小时以上 ) —— 漂洗( 0.1M 磷酸缓冲液, 3 次, 45 分钟 ) —— 后固定( 1% 锇酸, 2 小时 ) —— 脱水( 50% 、 70% 、 80% 、 90% 、 95% 各 15 分钟,换醋酸异戊酯 15 分钟或叔丁醇 15 分钟 ) —— 干燥( 零界点干燥或冷冻干燥 ) —— 镀膜( 真空镀膜仪或离子溅射仪 ) (一)取材: 由于扫描电镜对样品表面的要求非常严格,清洗时要注意保护观察面不受任何损伤,且保持干净,否则,可导致观察困难或错误判断。做好观察面标记,以免样品制作过程中分不清观察面所在的位置。 快,就是取材动作要快,一般要求在 2 、 3 分钟之内将组织浸入 2.5% 戊二醛内。 冷,就是取材的器械、固定液要事先放在冰箱内预冷。 准,就是取材部位必须准确,否则容易造成取材失败。样品大小长宽一般不超过 5cm ,高度不超过 3cm 为宜。此外,实验动物取材部位不宜多,这样会延误取材时间,导致组织自溶等人为假象的发生。 (二)前固定:固定前清洗的组织离体后应在 1 ~ 2 分钟清洗完毕并投入固定液内;固定后清洗的组织离体后应在 1 分钟以内投入固定液。固定液要预冷。 (三)漂洗:用 0.1M 磷酸缓冲液漂洗 3 次,每次 15 分钟。 (四)后固定: 1% 锇酸固定液室温下固定 1 小时左右,夏天稍短,冬天稍长。(五)脱水:利用不同浓度乙醇梯度脱水,由 50% 、 70% 、 80% 、 90% 、 95% 各 15 分钟,换醋酸异戊酯 15 分钟或叔丁醇 15 分钟。 (六)干燥:可采用零界点干燥法和冷冻干燥法两种。 (七)镀膜:利用真空喷镀仪或离子溅射仪对样品观察表面进行镀膜,一般用金钯作为镀膜材料。 (八)电镜观察:观察者事先要熟悉所要观察样品的结构,做好观察记录,拍摄图象要及时存盘,并做好光盘刻录。
扫描电镜作为观察物体表面或断面超微结构的工具,在生物组织细胞研究中越来越受到重视,特别是一些分析配件的介入(如能谱仪等),更加使扫描电镜的应用范围进一步扩大,这也使得扫描电镜样品制作技术也要不断创新,跟上现代研究的步伐。以下为取材相关内容:一.组织和器官取材法: 事先准备好所需的器械和固定液,并把它放在4度冰箱内备用。 取材时,首先用锋利的刀片将组织从机体内取下,放在预先滴有固定液的蜡板上,利用双刀法进行修块。如果以观察组织细胞表面结构为主的样品,应特别要注意保护好观察面,尽量避免取材器械与待观察面的接触,样品可以大一些,但其直径不宜超过5毫米,高度在3毫米左右。如果以观察细胞内部超微结构的样品,样品大小在直径2毫米以内,高度在3毫米左右。同时要做好样品观察面的标记,否则,经过后续处理后会难以辨别观察面的位置。另外,移动样品可用无齿镊子或用牙签转移,特别是观察表面结构的样品必须用牙签转移。二.标本清洗:1.固定前清洗法:是指表面覆盖有大量黏液和杂质的组织,在3%戊二醛固定之前进行清洗。清洗之前可用低浓度蛋白水解酶(胰蛋白酶、糜蛋白酶等)或其他具有水解作用的溶液(N-乙酰半胱氨酸)对样品进行黏液处理,之后再选择等渗生理盐水或缓冲液在震荡器中进行清洗或用注射器加压冲洗,冲洗时间可根据样品附着物的情况来定。2.固定后清洗法:是指表面比较干净的组织,取材后经过戊二醛固定2小时之后,用等渗生理盐水或缓冲液进行冲洗。3.离心清洗法:是指游离细胞、微生物以及其他微小生物样品的清洗。具体步骤如下:将固定好的样品放入离心管内,注入等渗生理盐水或缓冲液(样品体积20倍的量),轻轻摇匀后,置4000转/分钟的转速下离心3——5分钟,弃去上清夜,再注入上述清洗液,同样操作3——4次即可。三.注意事项:1.由于扫描电镜对样品表面的要求非常严格,必须清洗干净,否则,可导致观察困难或错误判断。2.取材时要做到“动作快、环境冷、部位准”。固定前清洗的组织离体后应在2—3分钟清洗完毕并投入固定液内;固定后清洗的组织离体后应在1分钟以内投入固定液。固定液要预冷,取材部位必须准确。3.实验动物取材部位不宜多,否则会延误取材时间,导致组织自溶等人为假象的发生。四.以下为扫描电镜样品制作的简单流程取材(做好样品观察面的标志)——漂洗(生理盐水或缓冲液)——固定(3%戊二醛2小时以上)——漂洗(0.1M磷酸缓冲液,3次,45分钟)——后固定(1%锇酸,2小时)——酒精脱水(50%、70%、80%、90%、95%各15分钟,换醋酸异戊酯15分钟或叔丁醇15分钟)——干燥(零界点干燥或冷冻干燥)——镀膜(真空镀膜仪或离子溅射仪)
要在学校分校区新建一个电镜室,所以要买很多的耗材和工具,但是本人新手绝大多数的东西都不知道从哪里买请大家帮帮我,帮我提供一下下面这些试剂或者工具的生产厂家以及在广州地区的代理(附上我查到的信息):锇酸(EMS SIGMA)戊二醛(EMS SIGMA)多聚甲醛(EMS SIGMA)环氧丙烷(EMS SIGMA) 用量很大最好能找到国产的分析纯以上的厂家包埋剂(epon 812)(EMS SIGMA)包埋板火棉胶膜染色用的夹板(英文:Hiraoka staining kit)醋酸双氧铀(EMS SIGMA)柠檬酸铅(EMS SIGMA)磷钨酸(EMS SIGMA)电镜用的尖头镊子(EMS)铜网架(英文:Grid storage box)顺便说下,我们的电镜室主要是以超薄切片和负染为主要方式观察生物样品的。所装的电镜为日本电子1400 配CCD(牌子忘了,因为还没安装)谢谢!
电镜样品取材方法1 动物及人体组织的取材动物组织的取材,应在麻醉(1%戊巴比妥钠按5ml/kg体重腹腔注射)或断头急性处死,解剖出所需器官,用解剖剪刀剪取一小块组织,放在干净的纸板上,滴一滴冷却的固定液,用新的、无油污锋利的(双面)刀片将材料切成大约1㎜宽,2~3㎜长的小块,从中挑选损伤小的小条,再将其切成1㎜3的小块,最后用牙签将这些小块逐一放入盛有冷的新鲜固定液的有盖青霉素小瓶里,放入冰箱冷藏室低温固定(0~4℃)。2 体外培养细胞的取材生长在培养瓶中的体外培养细胞取材时,先倒出培养液,接着到入适量的戊二醛固定液,在冰浴上放置3~5min,然后用刮刀轻轻刮下瓶壁上的细胞,将含有细胞的固定液转移到离心管中,普通离心机低速离心(2000转/分钟)15min,使细胞聚成团块,弃去上清夜,换上新鲜固定液继续固定。3 植物组织的取材植物组织的取材比较容易,它的细胞离体后变化不象动物细胞那样迅速,但植物细胞的细胞壁阻碍着固定液的迅速渗透。因此,植物材料的取材宜切成薄片状,经适当固定后再切成小方块。电镜样品取材的基本要求⑴ 快 取材的动作要迅速,最好在材料离体后1min内就进入固定液;解剖器械要锋利,避免牵拉和挤压,尽量减少取材中的机械损伤。 ⑵ 准 取材要准确。① 器官要准确 ② 部位要准确:如脑垂体的前叶和后叶要分清,其结构和功能各不相同。⑶ 冷 取材过程应尽量在低温下进行(0~4℃),以降低酶的活性,减少细胞内结构的损失。⑷ 小 所取材料体积要小,一般不超过1㎜3。因为固定剂的渗透力较弱,若组织块太大,块的内部将得不到良好的固定。 电镜制样中常用固定剂的配制方法⑴ 缓冲液的配制A、磷酸缓冲液(0.2M)的配制方法如下:甲液:Na2HPO4.12H2O 71.64g 加蒸馏水溶解成 1000ml乙液:NaH2PO4.2H2O 31.21g 加蒸馏水溶解成 1000ml按下表混合甲、乙两液即得所需PH的磷酸缓冲液表1:0.2M的磷酸缓冲液的配制(50ml) PH 6.4 6.6 6.8 7.0 7.2 7.4甲液(ml) 13.3 18.8 24.5 30.5 36.0 40.5乙液(ml) 36.7 31.2 25.5 19.5 14.0 9.5磷酸盐缓冲液对细胞无毒性作用,常用于配制戊二醛固定液,并适于作灌注固定。本缓冲液的缺点是固定时容易产生沉淀,并容易生长细菌,不能长期储存。B、 二甲胂酸盐缓冲液(0.2M)甲液:二甲胂酸钠 4.28g加蒸馏水至 100ml乙液:0.2N盐酸按表2混合甲、乙两液后,将总体积稀释成200ml即可获得不同PH的缓冲液表2:二甲胂酸钠缓冲液的配制 PH 6.4 6.6 6.8 7.0 7.2 7.4甲液(ml) 50 50 50 50 50 50乙液(ml) 18.3 13.3 9.3 6.3 4.2 2.7本缓冲液比较稳定,不易生长细菌,可长期保存,与低浓度的钙质(1-3mM)不发生沉淀反应。缺点是胂有毒性、有臭味,配制时应在通风橱中进行。
扫描电镜技术原理及方法: 原理:从电子枪阴极发出的直径20(m~30(m的电子束,受到阴阳极之间加速电压的作用,射向镜筒,经过聚光镜及物镜的会聚作用,缩小成直径约几毫微米的电子探针。在物镜上部的扫描线圈的作用下,电子探针在样品表面作光栅状扫描并且激发出多种电子信号。这些电子信号被相应的检测器检测,经过放大、转换,变成电压信号,最后被送到显像管的栅极上并且调制显像管的亮度。显像管中的电子束在荧光屏上也作光栅状扫描,并且这种扫描运动与样品表面的电子束的扫描运动严格同步,这样即获得衬度与所接收信号强度相对应的扫描电子像,这种图象反映了样品表面的形貌特征。第二节扫描电镜生物样品制备技术大多数生物样品都含有水分,而且比较柔软,因此,在进行扫描电镜观察前,要对样品作相应的处理。扫描电镜样品制备的主要要求是:尽可能使样品的表面结构保存好,没有变形和污染,样品干燥并且有良好导电性能。一.样品的初步处理(一) 取材取材的基本要求和透射电镜样品制备相同。但是,对扫描电镜来说,样品可以稍大些,面积可达8mm×8mm,厚度可达5mm。对于易卷曲的样品如血管、胃肠道粘膜等,可固定在滤纸或卡片纸上,以充分暴露待观察的组织表面。(二) 样品的清洗用扫描电镜观察的部位常常是样品的表面,即组织的游离面。由于样品取自活体组织,其表面常有血液、组织液或粘液附着,这会遮盖样品的表面结构,影响观察。因此,在样品固定之前,要将这些附着物清洗干净。(三) 固定固定所用的试剂和透射电镜样品制备相同,常用戊二醛及锇酸双固定。由于样品体积较大,固定时间应适当延长。也可用快速冷冻固定。(四) 脱水样品经漂洗后用逐级增高浓度的酒精或丙酮脱水,然后进入中间液,一般用醋酸异戊酯作中间液。二.样品的干燥扫描电镜观察样品要求在高真空中进行。无论是水或脱水溶液,在高真空中都会产生剧烈地汽化,不仅影响真空度、污染样品,还会破坏样品的微细结构。三.样品的导电处理生物样品经过脱水、干燥处理后,其表面不带电,导电性能也差。用扫描电镜观察时,当入射电子束打到样品上,会在样品表面产生电荷的积累,形成充电和放电效应,影响对图象的观察和拍照记录。
常规电镜样品制备包括常温化学双固定、常温脱水包埋、常规超薄切片、普通电镜观察几个步骤。样品制备过程历时约一周,超薄切片经醋酸双氧铀和柠檬酸铅染色后,电镜观察。所有操作均按照以下流程进行。 试剂 0.2 mol/ L磷酸盐缓冲液 Na2HPO4·2H2O 35.61 g 或Na2HPO4·7H2O 53.65 g / Na2HPO4·12H2O 71.64 g NaH2PO2·H2O 27.60 g 或NaH2PO4·2H2O 31.21 g 加双蒸水(ddH2O)到1000 mL 0.1 mol/ L磷酸盐缓冲液(PBS) 0.2 mol/ L磷酸盐缓冲液 250 mL 加双蒸水到500 mL 2 % 低温琼脂 低温琼脂 1.0 g 加双蒸水到 50 mL 加热到沸腾,溶液均匀后备用 1 % 戊二醛固定液 25 %(m/v)戊二醛水溶液 2 mL 0.2 mol/ L磷酸盐缓冲液 25 mL 加双蒸水到50 mL 1 % 锇酸固定液 2 %(m/v)锇酸水溶液 10 mL 0.2 mol/ L磷酸盐缓冲液 10 mL 包埋剂A液 Epon 812 树脂 50 mL 十二烷基琥珀酸酐(modecenyl succinic anhydride, DDSA) 80 mL 包埋剂B液 Epon 812 树脂 50 mL 六甲酸酐(methyl nadic anhydride, MNA) 44.5 mL 2,4,6 - 三甲氨基甲基苯酚(2, 4, 6 - tridimethylamino methyl phenol, DMP-30) 甲苯胺蓝染液 甲苯胺蓝 1 g 1 mol/ L NaOH 10 mL 加双蒸水到50 mL 混匀过滤后使用 1 % 醋酸双氧铀染液 醋酸双氧铀 0.2 g 加双蒸水到10 mL 封口膜封口,4℃避光保存 1 % 柠檬酸铅染液 硝酸铅 0.265 g 柠檬酸钠(含2分子结晶水) 0.352 g 加双蒸水到10 mL① ① 配制铅染液时,要先加水6 mL,超声震荡30 min,使乳白色柠檬酸铅悬液充分混匀。然后滴加1 mol/L NaOH,并不是晃动,直至溶液变清亮。最后定容至10 mL。 ② 细胞样品处理和藻类及其他游离样品处理流程可相互参照,即细胞样品可以酌情使用琼脂铸模法取材固定,藻类及其他游离样品也可以使用血清预包埋法取材固定,总体视样品密度及其对于温度的耐受等条件而定。 封口膜封口,4℃保存 仪器 修块机 Leica EM TRIM 切片机 Leica EM UC6 光学显微镜 Nikon 80i 及配套拍照系统DS-L1 透射电子显微镜 JEOL-1230 Gatan Bioscan Camera 792 实验流程一、 取材与固定 A. 植物样品 1. 自来水冲洗表面泥尘后,使用灭菌水清洗2-3次,置于铺有预湿滤纸的培养皿中。 2. 使用干净锋利的刀片切取目标材料,所取材料体积不大于3 mm3。切取样品时应注意动作迅速、减小损伤,避免来回切拉;使用的灭菌水及器具应4℃预冷,并在操作中尽量保持低温以降低组织细胞活性。 3. 将切下材料放入装有预冷的戊二醛固定液的青霉素小瓶中后抽气,抽几次后轻摇小瓶,并打开瓶盖。重复2-3次,直到样品沉入瓶底。 4. 室温静置1h,或摇床轻摇1h。 5. PBS清洗3次,10min/次。 6. 1%锇酸固定液固定1h。 7. PBS清洗3次,10min/次。 B. 动物样品 1. 4℃预冷生理盐水冲洗组织块,迅速切取组织块,体积不大于3 mm3 2. 将切取的组织块投入装有预冷戊二醛固定液的青霉素小瓶中,并抽气直至样品沉底。 3. 室温静置1h,或摇床轻摇1h。 4. PBS清洗3次,10 min/次。 5. 1%锇酸固定液固定1 h。 6. PBS清洗3次,10 min/次。 C. 单层培养细胞或悬浮培养细胞样品② 1. 3000 rpm离心5 min,收集细胞样品,尽量多的吸弃培养液上清。 2. 加入4℃预冷PBS液,充分吹吸混匀,静置4 min,3000 rpm离心5 min,吸弃上清。 ① 配制铅染液时,要先加水6 mL,超声震荡30 min,使乳白色柠檬酸铅悬液充分混匀。然后滴加1 mol/L NaOH,并不是晃动,直至溶液变清亮。最后定容至10 mL。 ② 细胞样品处理和藻类及其他游离样品处理流程可相互参照,即细胞样品可以酌情使用琼脂铸模法取材固定,藻类及其他游离样品也可以使用血清预包埋法取材固定,总体视样品密度及其对于温度的耐受等条件而定。 3. 重复步骤2一次。 4. 加入预冷的血清或蛋清,充分吹吸混匀,3000 rpm离心10 min,吸弃大部分上清,留少部分,吹吸悬浮沉淀细胞。(或离心后吸弃上清,留少部分上清,不悬浮沉淀细胞,视样品浓度而定) 5. 缓慢加入戊二醛固定液,小心放入4℃冰箱,固定过夜。 6. 吸弃上清,刀片小心划开离心管壁,用钳子拉开离心管,小心取出已凝成固体的血清包埋块。 7. 使用干净的单面刀片或手术刀,将血清包埋块切成2 mm3左右的小块,取3-5个富集细胞样品效果较好的包埋小块继续下面实验。 8. PBS清洗3次,10 min/次。 9. 1%锇酸固定液固定1 h。 10. PBS清洗3次,10 min/次。 D. 藻类及其他游离培养样品 1. 吸取2%低温琼脂液200μL到0.2mL离心管,并将离线管置于冰上,取10μL枪头迅速插入琼脂中并保持离心管竖直,且枪头竖直靠中的包裹在琼脂中。 2. 静置1 min,待琼脂凝固后,小心拔出枪头,形成琼脂空腔,待用。 3. 3000 rpm离心5 min,收集样品,尽量多的吸弃培养液上清。 4. 加入4℃预冷PBS液,充分吹吸混匀,静置4min,3000 rpm离心5min,吸弃上清。 5. 重复步骤2清洗,吸弃大部分上清,留极少部分上清液,吹吸悬浮样品。 6. 使用10μL 移液器小心将样品加入已经制备好的琼脂空腔中,使样品充满空腔大部分,添加过程中尽量避免气泡出现。 7. 吸取50μL溶化的琼脂,快速滴加到空腔琼脂上封口,冰浴5 min,待琼脂完全凝固。 8. 使用单面刀片小心划开离心管壁,用钳子拉开离心管,小心取出已凝成固体的琼脂包埋块,稍作修葺。 9. PBS清洗3次,10 min/次。 10. 1%锇酸固定液固定1 h。 11. PBS清洗3次,10 min/次。二、 脱水 1. 按丙酮与灭菌水体积比3:7配制30%脱水剂。吸弃样品管/瓶中的PBS,快速加入现配的脱水剂(脱水换液过程禁止出现样品暴露空气中现象,可不全部吸完,略有剩余,使样品浸润;动作应迅速准确),室温放置或摇床轻摇45 min。加入按30%、50%、70%、90%、100%(v/v)的浓度梯度进行脱水。 2. 配制50%脱水剂,快速换液,室温轻摇45 min。 3. 配制70%脱水剂,快速换液,室温轻摇45 min。 4. 配制90%脱水剂,快速换液,室温轻摇45 min。 5. 使用纯丙酮快速换液,室温轻摇30 min③。 6. 重复步骤5一次。三、 渗透包埋 在此步脱水操作完成后即可开始配制渗透用包埋剂,以免安排不周。样品浸泡在纯丙酮中时间不宜过久,以免造成样品较脆,不利于超薄切片。 1. 配制渗透用树脂包埋剂 1) 取干净的10 mL注射器,拔去活塞,用封闭针头堵住注射口,放于通风橱中。 2) 小心倾倒B液9 mL到注射器中;然后再小心倾倒A液1 mL。 3) 插入活塞,堵住注射器后,颠倒摇匀至液体颜色均匀,无丝状液体。 4) 小心拔去活塞,通风橱中操作,缓慢滴加14滴DMP-30。 5) 插入活塞,堵住注射器后,颠倒摇匀至液体颜色完全均匀,无丝絮状分色,竖直放置待用。 2. 按照包埋剂与丙酮体积比3:7配制30%渗透剂,快速吸弃样品管中纯丙酮并加入渗透剂,轻摇渗透3 h。 3. 按照包埋剂与丙酮体积比7:3配制70%渗透剂,快速换液,轻摇渗透过夜。 4. 重新配制包埋剂,并小心推按注射器,将包埋剂挤到包埋模具中至液面
[color=blue][b]透射电镜标本制备方法[/b][/color] 由于电镜电子束穿透能力的限制,必须把标本切成厚度小于0.1um以下的薄片才适用,这种薄片称为超薄切片。常用的超薄切片厚度是50-70nm。 在透射电镜的样品制备方法中,超薄切片技术是最基本、最常用的制备技术。超薄切片的制作过程基本上和石蜡切片相似,需要经过取材、固定、脱水、浸透、包埋聚合、切片及染色等步骤。 一 取材的基本要求 组织从生物活体取下以后,如果不立即进行适当处理,会由于细胞内部各种酶的作用,出现细胞自溶现象。此外,还可能由于污染,微生物在组织内繁殖使细胞的微细结构遭受破坏。因此,为了使细胞结构尽可能保持生前状态,必须做到快、小、准、冷:(1).动作迅速,组织从活体取下后应在最短时间内 (争取在1分钟内) 投入2.5%戊二醛固定液。(2).所取组织的体积要小,一般不超过1mm×1mm×1mm。也可将组织修成1mm×1mm×2mm大小长条形。因为固定剂的渗透能力较弱,组织块如果太大,块的内部将不能得到良好的固定。(3).机械损伤要小,解剖器械应锋利,操作宜轻,避免牵拉、挫伤与挤压。(4).操作最好在低温(0℃~4℃)下进行,以降低酶的活性,防止细胞自溶。(5).取材部位要准确。 取材方法:将取出的组织放在洁净的蜡版上,滴一滴预冷的固定液,用两片新的、锋利的刀片成“拉锯式”将组织切下并修小,然后用牙签或镊子将组织块移至盛有冷的固定液的小瓶中。如果组织带有较多的血液和组织液,应先用固定液洗几遍,然后再切成小块固定。
扫描电镜以观察样品的表面形态为主。扫描电镜样品的制备,必须满足以下要求:①保持完好的组织和细胞形态;②充分暴露欲观察的部位;③良好的导电性和较高的二次电子产额;④保持充分干燥的状态。 某些含水量低且不易变形的生物材料,可以不经固定和干燥而在较低加速电压下直接观察,如动物毛发、昆虫、植物种子、花粉等,但图像质量差,而且观察和拍摄照片时须尽可能迅速。对大多数的生物材料,则应首先采用化学或物理方法固定、脱水和干燥,然后喷镀碳与金属以提高材料的导电性和二次电子产额。 化学方法制备样品 其程序通常是:清洗→化学固定→干燥→喷镀金属。 清洗 某些生物材料表面常附血液、细胞碎片、消化道内的食物残渣、细菌、淋巴液及粘液等异物,掩盖着欲观察的部位,因而,需要在固定之前用生理盐水或等渗缓冲液等把附着物清洗干净。亦可用 5%碳酸钠冲洗或酶消化法去除这些异物。 固定 通常采用醛类(主要是戊二醛和多聚甲醛)与四氧化锇双固定,也可用四氧化锇单固定。四氧化锇固定不仅可良好地保存组织细胞结构,而且能增加材料的导电性和二次电子产额,提高扫描电子显微图像的质量。这对高分辨扫描电子显微术是极端重要的。为增强这种效果,可用四氧化锇-单宁酸或是四氧化锇-珠叉二胼等反复处理材料,使其结合更多的重金属锇,这就是导电染色。 干燥 固定后通常采用临界点干燥法。其原理是:适当选择温度和压力,使液体达到临界状态(液态和[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]间界面消失),从而避免在干燥过程中由水的表面张力所造成的样品变形。对含水生物材料直接进行临界点干燥时,水的临界温度和压力不能过高(37.4℃,218帕)。通常用乙醇或丙酮等使材料脱水,再用一种中间介质,如醋酸戊酯,置换脱水剂,然后在临界点干燥器中用液体或固体二氧化碳、氟利昂 13以及N2O等置换剂置换中间介质,进行临界干燥。 喷镀金属 将干燥的样品用导电性好的粘合剂或其他粘合剂粘在金属样品台上,然后放在真空蒸发器中喷镀一层50~300埃厚的金属膜,以提高样品的导电性和二次电子产额,改善图像质量,并且防止样品受热和辐射损伤。如果采用离子溅射镀膜机喷镀金属,可获得均匀的细颗粒薄金属镀层,提高扫描电子图像的质量。 冷冻方法制备样品 低温扫描电子显微术是80年代迅速发展和广泛应用的方法。它包括生物样品的冷冻固定、冷冻干燥、冷冻割断和冷冻含水样品的扫描电子显微术等。 冷冻固定 将生物材料投入低温的致冷剂中,如液氦、液氮、液体氟利昂及丙烷等。快速冷冻可使生物组织细胞的结构和化学组成接近于生活状态。被冷冻固定的生物样品,可以在低温条件下转移到具有低温样品台的扫描电子显微镜中直接观察无需进一步处理或仅在冷冻样品表面喷镀一薄层金属。这种方法不仅快速简便,而且可以排除由于干燥法造成收缩的假象,特别适合于研究含水量很高的生物材料。 冷冻干燥 生物样品经冷冻固定后,其中的水分冻结成冰,表面张力消失;再将冷冻样品放于真空中,使冰渐渐升华为水蒸气。这样获得的干燥样品在一定程度上避免了表面张力造成的形态改变。由于水冷冻而形成的冰晶会破坏组织结构,冰在真空中升华速度很慢,同时需要大型复杂的冷冻干燥装置,所以冷冻干燥法没有临界干燥法应用广泛。如果在冷冻前用有机溶剂置换样品中的水,而后,冷冻干燥,则可消除冰晶对结构的破坏,并大大缩短干燥时间;也无需特殊装置。 冷冻割断 为了观察脏器或细胞内部结构,可切断冷冻样品,再经化学固定、导电染色、脱水和临界点干燥及喷镀金属,用扫描电镜观察割断表面暴露出的内部结构。冷冻割断又包括乙醇割断法、二甲基亚砜割断法及冷冻断裂法等多种。用冷冻割断法可获得高分辨的组织细胞内部三维构造的扫描电镜图像。

[font=&][size=16px][color=#808080]FEI Quanta 200环境扫描电子显微镜主要用于生物样品、(185-----8847-----5442 ) 材料样品表面精细形貌和结构的观察和分析。图像具有高分辨率和高放大倍数,富于立体感,可真实、生动地显示样品的三维结构。广泛应用于生命科学、医学、材料学等诸多学科。在环境保护和环境监测中,扫描电镜也发挥了不可替代的作用。扫描电镜图像生动、真实地显示了在污水处理中,颗粒污泥、絮状污泥和各种载体上生物膜的生长情况,为深入研究微生物在污水处理、环境保护中的作用、机理和效果提供了有力依据。1. 分辨率:3.5nm (高真空模式,30kv);2. 3.5nm (低真空模式,30kv);3. 3.5nm (ESEM环境真空模式, 30kv);、4. 15 nm (低真空模式,3kv);5. 放大倍数: 50-50,000x;6. 最大象素: 3584 x 3094。 广泛应用于各种导电材料、绝缘材料、生物材料及含水材料等固体材料的形貌观察;2. 非导电样品不需要表面导电处理,可直接在低真空和环境真空模式下进行成像;3. 多种样品台可提供多种选择;4. 配置冷台,可低温观察样品;5. 真空可控,可在特定真空下观察样品形貌。[img=,302,310]https://ng1.17img.cn/bbsfiles/images/2022/03/202203251441045078_6019_5567805_3.jpg!w302x310.jpg[/img][/color][/size][/font]
现需购买二手扫描电镜或透射电镜,无特殊要求。价格面议。希望有信息者回帖或发送邮件至yuanlang_gd@126.com谢谢各位。
处理流程如下:10 mM pH7.4的PBS洗两遍,后3%的戊二醛固定4小时,30、50、70、90、100的乙醇脱水10min,乙酸异戊酯置换15min,拍照时发现细胞破了个洞 请问是哪一步出现的问题呢

[color=#333333]扫描电镜(SEM)是介于透射电镜和光学显微镜之间的一种微观性貌观察手段,可直接利用样品表面材料的物质性能进行微观成像。扫描电镜的优点是,①有较高的放大倍数,20-20万倍之间连续可调;②有很大的景深,视野大,成像富有立体感,可直接观察各种试样凹凸不平表面的细微结构;③试样制备简单。目前的扫描电镜都配有X射线能谱仪装置,这样可以同时进行显微组织性貌的观察和微区成分分析,因此它是当今十分有用的科学研究仪器。[/color][color=#333333]对于扫描电镜我也仅是局限于对基本操作略知一二,其更专业的相关知识知之甚少,碰巧最近接了一个用扫面电镜观察大肠杆菌的实验,就借此机会互相讨论学习一下大肠杆菌在描电镜观察中的制样方法。[/color][color=#333333]制样过程可大体分为四步:[/color][color=#333333]1[/color][color=#333333]、[/color]取样:取大量样品离心(转速3000r-4000r),去除上清液,加入适当PH(7.2-7.4)的1[color=#333333]XPBS[/color][color=#333333]清洗三遍;清洗时,菌体温柔悬浮,离心,去上清。[/color]1、[color=#333333]固定:2.5%戊二醛固定3h(1-12都可),离心,之后用PBS清洗三遍,离心,去上清。[/color][color=#333333]2[/color][color=#333333]、脱水用乙醇水溶液按30%、50%、70%、80%、90%的浓度梯度对样品进行脱水,每步约15min,[/color]离心,之后在100%乙醇中脱水15minX2次,离心,去上清,再将样品置于乙醇和叔丁醇1:1的混合液中15min,去上清;然后用纯叔丁醇置换酒精2次,每次15min,最后吸取混匀的细菌-叔丁醇悬浮液滴在盖玻片上。3、干燥 载有样品的盖玻片置-80℃冰箱冷冻后,放入冷冻干燥机中进行冷冻干燥。4、喷金 样品充分干燥后,将盖玻片粘附到贴好导电胶带的样品台上,镀金。5、电镜下观察。附图:[align=center][img=,690,507]http://ng1.17img.cn/bbsfiles/images/2017/09/201709050924_01_3224499_3.png[/img][/align] [align=center][img=,690,506]http://ng1.17img.cn/bbsfiles/images/2017/09/201709050924_02_3224499_3.png[/img][/align][align=center][img=,690,506]http://ng1.17img.cn/bbsfiles/images/2017/09/201709050924_03_3224499_3.png[/img][/align][align=center][img=,690,488]http://ng1.17img.cn/bbsfiles/images/2017/09/201709050925_01_3224499_3.png[/img][/align]制样过程比较简单,但是比较耗时,特别是脱水的过程。制样过程有多次离心,为防止多次离心后大肠杆菌样品损失过多,离心要充分,并且倾倒上清液时要小心缓慢,防止倒出样品。另外,冷冻的叔丁醇特别容易液化,将载有大肠杆菌-叔丁醇悬浮液的盖玻片拿出低温冰箱后要迅速放入冷冻干燥机内进行冷冻干燥。通过此次实验既学到了细菌在扫面电镜观察下的制样过程,又学习了扫面电镜的使用及其操作细节和注意事项,令我受益匪浅。
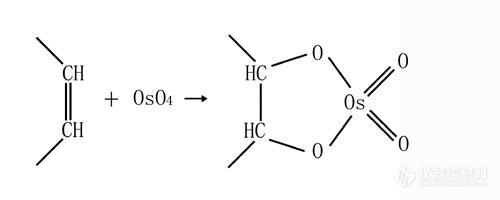
几种常用的固定剂固定剂最先应用在光学显微技术中,但光学显微镜中使用的沉淀凝集蛋白性的固定剂对电镜并不特别适用。于是人们引入四氧化锇和中性甲醛进行固定。早期的电镜生物样品化学固定法都采用四氧化锇单一固定,但四氧化锇不能很好地保存糖原和其它碳水化合物,而且四氧化锇在组织中的渗透速度比较慢(约2mm/h)。而早期使用的中性甲醛也令人很不满意,因为早期使用的甲醛很不纯,含有甲酸和甲醇的残留(一般有10-15%),甲醇的存在对样品的保存很不利,于是后来人们改进了甲醛的制备方法,使用多聚甲醛新鲜配制甲醛,提高了它的纯度。1963年Sabatini、Bensch和Barrnett推荐使用醛类(特别是戊二醛)作为初级固定剂。使用戊二醛或戊二醛-多聚甲醛初步固定后再使用四氧化锇后固定的双重化学固定对大多数动物和植物组织都十分有效,因而成为目前大多数实验室常规的固定方法。 电镜中使用的固定剂都有毒性,操作时都要很小心,尽可能在通风橱中完成操作。如果实验室中发生固定剂泄漏,必须立即用大量奶粉覆盖泄漏出来的溶液,待反应充分后收集处理。 四氧化锇(Osmium tetroxide) 四氧化锇是一种很强的氧化剂,呈浅黄色结晶,分子量254,饱和水溶液的浓度为7.24%,它的水溶液为中性,有极大毒性。市售有密封的四氧化锇晶体和四氧化锇水溶液两种。四氧化锇晶体溶于水的速度很慢,必要时可以使用超声波设备来加速溶解。市面上也有已经配制好的2%四氧化锇水溶液出售,使用相当方便。但要特别注意的是无论是四氧化锇晶体还是水溶液都会挥发出四氧化锇气体,因此应将四氧化锇置于密闭容器(玻璃容器)中保存。四氧化锇气体对呼吸系统有刺激,对眼睛有严重的破坏作用,因此在使用时应特别小心,尽可能在通风橱中进行,并且严格控制用量。废弃的四氧化锇溶液应加入酒精水溶液或硫酸亚铁溶液,使四氧化锇转化为黑色沉淀,以降低毒性方便收集处理。 四氧化锇作为固定剂有如下优点: 1,四氧化锇可以与脂类、糖类和蛋白质反应。其对脂类的固定作用可以补充醛类固定剂对脂类固定不足的缺点。其反应方程式如下: [img]http://ng1.17img.cn/bbsfiles/images/2006/12/200612021950_34195_1634962_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2006/12/200612021950_34196_1634962_3.jpg[/img]2,能增加膜的反差,起到"电子染色"作用。用四氧化锇固定的材料,往往细胞膜结构比较清晰。这是由于被还原的锇沉积在细胞膜结构上,而锇是一种原子序数较高的元素,能加强它们的电子散射(质量密度大),所以四氧化锇作为固定剂的同时,又可作为电子染料,使被固定的样品图像有较好的反差。 3,四氧化锇会破坏大部分细胞膜的半透膜特性,配制四氧化锇固定液不用考虑渗透压。四氧化锇虽然具有以上优点,但它也存在不少缺点: 四氧化锇渗透力弱,所以组织块要小。否则,将从组织块表面到中间形成一个固定梯度,致使内部自溶过程继续进行引起组织块内部固定不好。 不能保存糖原也不能有效固定核酸,而且对微管固定效果也不理想。 固定的时间不宜太长。时间过长,会使组织变脆,给切片带来困难。此外四氧化锇与蛋白质、不饱和脂肪酸交联形成的复合体都是易溶于水的物质,特别是在长时间的固定后,更易溶解。因此,使用四氧化锇固定样品,时间控制在12小时较为适宜。 四氧化锇能与乙醇或醛类起氧化-还原反应,生成沉淀。所以,醛类处理过的样品转入四氧化锇固定之前或四氧化锇固定之后转入乙醇溶液脱水之前都必须用相应的缓冲液充分漂洗干净。 四氧化锇是酶的钝化剂,不能用于细胞化学的研究。醛类固定剂 甲醛(formaldehyde) 甲醛分子中只有一个碳原子,含有一个醛基,分子式为$CH_2O$,分子量为30。市面上虽然有多种形式的甲醛溶液出售,但它们含有少量的甲酸和甲醇,对被固定的样品产生不良影响,适合电镜固定使用的只有通过由多聚甲醛(paraformaldehyde)新鲜制备的甲醛溶液。甲醛溶液的毒性很大,即使是稀释液也要格外小心操作。甲醛溶液对皮肤有硬化作用,长时间接触可能导致皮肤破裂、皮炎或是过敏症状;甲醛极易挥发,它对呼吸道也有影响,长时间暴露在甲醛气体中会使嗅觉敏感度降低;此外甲醛对眼睛也有影响,而且还被认为是致癌物质。因此在操作甲醛粉末或溶液时都必须很小心,带上手套并在通风橱中进行。少量废弃的醛类试剂(甲醛、戊二醛和丙稀醛等)可以直接在大量流水冲稀的情况下倒进水池内(但要注意有关部门的有关规定),当然少量的醛类试剂与过量的1M甘氨酸混合后,再在大量流水冲稀的情况下倒进水池,会更安全。通常100ml的甲醛(1%)需要50ml的1M甘氨酸,100ml1%戊二醛则需要35ml,而丙稀醛需要40ml。大量的醛类试剂必须集中回收处理。 甲醛作为固定剂有如下特点: 由于甲醛的分子量小,它的穿透能力比戊二醛强,反应温和,可用于细胞组织化学研究的前固定。而且它不象戊二醛有两个醛基,引入较少的游离醛基到组织细胞中,因而在一些细胞组织化学研究中更有利。但它的反应是部分可逆的,对细胞基质保存差,脱水后大部分基质丢失,所以不少实验室不单独使用甲醛来固定样品,而将它与戊二醛配制成混合固定液使用。 甲醛对生物样品的作用与戊二醛相似,主要引起蛋白质交联。在水溶液中,单个的甲醛分子以HO − CH2 − OH的形式存在。反应如下: [img]http://ng1.17img.cn/bbsfiles/images/2006/12/200612021952_34197_1634962_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2006/12/200612021953_34198_1634962_3.jpg[/img]与戊二醛不同,甲醛既与DNA又与核蛋白反应,但这些反应都是部分可逆的。另外,甲醛固定脂类的能力不强,可以与脂类相连的蛋白质作用。 戊二醛(glutaraldehyde) 戊二醛是一种五碳醛,含有两个醛基。分子式为$C_5H_8O_2$,分子量为100。电镜固定通常用市售的25%的戊二醛水溶液稀释成需要的浓度。其pH为4.0$\sim$5.0。氧气、高温、中性或碱性pH均能使戊二醛发生聚合失去醛基,并降低交联效力,所以平时这种原液应保存在低温处。此外戊二醛存放时间过长时,pH值会降低,颜色变黄,固定效力也大大降低,若戊二醛pH值降至3.5以下或含有其它杂质时,必须纯化后才能使用。戊二醛对皮肤有硬化作用,但它的挥发性较甲醛弱,最好能在通风橱中操作。 戊二醛作为固定剂有如下特点: 它的反应速度快,是优良的前固定剂。但它的渗透速度较慢,必要时配合甲醛使用效果更佳。 它是蛋白质的强固定剂。它能快速而不可逆地与氨基反应,和甲醛相似,戊二醛的一个醛基与氨基反应,脱水后生成不稳定的Schiff键化合物。其反应的可能途径如下: [img]http://ng1.17img.cn/bbsfiles/images/2006/12/200612021954_34199_1634962_3.jpg[/img]

[img]https://simg.instrument.com.cn/bbs/images/default/em09502.gif[/img]大家好!后续争取每周都来论坛和大家分享、讨论电镜圈的信息百态,欢迎大家参与讨论,增进信息互动!也欢迎电镜届大咖在电镜版块积极发帖![img]https://simg.instrument.com.cn/bbs/images/default/em09502.gif[/img]近年来,中国电镜产业化发展轰轰烈烈,从电镜整机到电镜原位系统,再到周边配套设备、核心部件等都呈现多点开花。诸多国产电镜品牌接连成立,从2017年以来,仅从电镜整机产品来看,国产各品牌就推出电镜新品超过[b][color=#ff0000]10台[/color][/b]!且从台式电镜、钨灯丝扫描电镜、场发射扫描电镜、扫描透射电镜、半导体专用电镜等多产品类型领域均有涉猎。此背景下,2020年4月23日,由中国电子显微镜学会和仪器信息网共同发起并的“首届中国电镜产业化发展论坛”在无锡召开,百余参会代表中就包含了国内电镜产业链超30家生产企业或研发团队!中国电镜产业化迎来黄金发展期。[align=center][img=https://img1.17img.cn/17img/images/202203/uepic/7e2baa99-f004-49e8-87ad-c5a00e7140c3.jpg,411,274]https://ng1.17img.cn/bbsfiles/images/2022/04/202204011730145273_4748_2817550_3.jpg!w690x460.jpg[/img][/align]2020-2021年,[b][color=#ff0000]中国电镜圈头条事件频发[/color][/b]:日立高新收购天美科仪(天美集团子公司)100%股权,更加直接支持和服务中国及东南亚地区市场和服务;欧波同结束与蔡司(电镜和光镜的工业领域)的渠道合作,转而与赛默飞电镜牵手合作(主要电镜工业领域);国产电镜品牌后起之秀聚束科技正值快速发展期,一分为三;国仪量子则凭借雄厚资本招兵买马,迅速扩大规模;中科科仪则布局苏州中科科仪高端仪器装备项目,规划年产150台扫描电镜……目前,能够生产场发射扫描电镜的国产品牌已超[b][color=#ff0000]5家[/color][/b],且据悉,赛默飞也将在今年不久后推出[b][color=#ff0000]2款“国产”[/color][/b]扫描电镜!中国电镜产业化竞争已经加速![b][img]https://simg.instrument.com.cn/bbs/images/default/em09505.gif[/img]是机遇也是挑战,目前中国电镜产业化局面你怎么看?欢迎留言补充、互动哈![img]https://simg.instrument.com.cn/bbs/images/default/em09505.gif[/img][/b][font=宋体][b][/b][/font][b][color=#ff6600]插播一条信息:[/color][/b]由于疫情原因,“第二届中国电镜产业化发展国际论坛”延期至6月24日,地点还是曾经举办过APEC的北京怀柔的北京雁栖湖国际会展中心,欢迎参加。具体信息见一轮通知:[url=https://www.instrument.com.cn/news/20220311/608888.shtml][color=#3333ff]https://www.instrument.com.cn/news/20220311/608888.shtml[/color][/url]
FEI透射电镜双倾杆铍垫圈,就是有两个小耳朵的那个,今天要了一下报价,接近1万5,怎么这样贵啊,大家有买过吗?感觉价格太夸张了,就一个小东西。。。。。。