乳腺癌是世界范围内女性最常见的致死性恶性肿瘤,据统计,2020年女性乳腺癌已超越肺癌成为全球癌症发病率最高的癌种[1-2]。其中三阴性乳腺癌(triple-negative breast cancer,TNBC)是雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)均呈阴性表达的乳腺癌亚型,占所有乳腺癌的15%~20%[3],具有侵袭力强、转移率高、术后复发率高、预后差的特点[4]。由于TNBC内分泌治疗的不确定性及靶向治疗的不应答性,导致临床上的治疗效果不理想[5-6]。因此,寻找有效抑制TNBC增殖转移的药物、降低患者的病死率一直是乳腺癌基础研究的一个重要方向[7-8]。 石蒜碱是石蒜Lycoris radiata (L'Hér.) Herb.、文殊兰Crinum asiaticum L. var. sinicum (Roxb. et Herb.) Baker、朱顶红Hippeastrum rutilum (Ker.-Gawl.) Herb.等石蒜属植物鳞茎中含量较高的异喹啉类生物碱,具有抗肿瘤、抗病毒、抗菌、抗炎镇痛、保肝等药理活性[9-10],近年来石蒜碱的抗肿瘤作用受到众多研究者的关注。有文献报道石蒜碱对人乳腺癌MCF-7细胞[11]、人宫颈癌Hela细胞[12-13]、人肝癌HepG-2细胞[13-16]、人胃癌SGC-7901细胞[17]、人结肠腺癌LoVo细胞[18-19]具有显著的抑制作用,但对其作用机制的研究仍然处于初始阶段。本研究以人乳腺癌MDA-MB-231细胞为研究对象,主要通过体外实验从细胞水平和分子水平探讨石蒜碱对MDA-MB-231细胞的体外抑制活性及其通过线粒体氧化损伤诱导肿瘤细胞自噬及凋亡的机制,为今后石蒜碱抗肿瘤新药的深入研发和临床实践提供理论基础和实验参考。 1 材料 1.1 细胞株 MDA-MB-231细胞由国家教育部抗肿瘤天然药物工程技术研究中心提供。 1.2 药品与试剂 石蒜碱(批号34296,质量分数98%)购自阿拉丁试剂有限公司;胎牛血清(批号0201021)购自浙江杭天生物科技公司;RPMI 1640细胞培养基(批号AD123707271)购自美国HyClone公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号20200901)购自天津中和盛泰化工有限公司;Hoechst 33258染液(批号C1011)、SDS-PAGE蛋白上样缓冲液(批号P0015)、吉姆萨染液(批号C0131)、CCK-8试剂盒(批号C0043)、活性氧(reactive oxygen species,ROS)检测试剂盒(批号S0033S)、PMSF(批号ST505)、HRP标记的山羊抗大鼠IgG二抗(批号A0192)、Western blotting及IP细胞裂解液(批号072318180723)、30% Acr-Bis(批号093018181017)购自碧云天生物技术研究所;碘化丙啶(propidium iodide,PI)染液(批号R20285)、Rhodamine 123(批号R8004)购自美国Sigma公司;台盼蓝(批号72-52-1)购自美国默克公司;Reagent A染液(批号5000113)购自北京诺博莱德科技有限公司;聚山梨酯20(批号20190207)购自美国Biotopped公司;Tris(批号181127)购自美国Amresco公司;兔抗半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号WL02512)、兔抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号WL01506)、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号WL02385)、兔抗细胞色素C(cytochrome-C,Cyt-C)抗体(批号WL04963)、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号WL01114)购自沈阳万类生物科技有限公司;兔抗线粒体内膜转位酶(translocase of inner membrane,TIM)抗体(批号PSI-RF16109)、兔抗线粒体外膜转位酶(translocase of outer membrane,TOM)抗体(批号PSI57577)、兔抗E3泛素连接酶(E3 ubiquitin protein ligase,PARKIN)抗体(批号PSI50248)、兔抗PTEN诱导的激酶1(PTEN induced putative kinase 1,PINK1)抗体(批号PSI7859)、兔抗微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3-B)抗体(批号BS79705)、兔抗p62抗体(批号p196-269)购自艾美捷科技有限公司。 1.3 仪器 ECO-170P-230型细胞培养箱、Model 680型酶标仪(美国NBS公司);Adventurer型万分之一电子天平(美国OHAUS公司);EPICS-XL型流式细胞仪、AllegraTM 64R型低温高速离心机(美国Beckman-Coulter公司);CKX-41-32型倒置显微镜(日本Olympus公司);荧光显微镜、TCS-SP2激光共聚焦扫描显微镜(德国Leica公司);680型全自动酶标仪(美国Bio-Rad公司);P型微量[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url](芬兰百得公司);标准型PB-10 pH计(德国Sartorius公司);GIS-2019型Tannon凝胶成像系统(天能科技有限公司);DYY-7C型电泳仪、M344039型垂直电泳转印槽(北京六一仪器厂)。 2 方法 2.1 细胞培养 MDA-MB-231细胞复苏后接种于含10%胎牛血清的RPMI 1640培养基中,置于5% CO2、37 ℃恒温培养箱中培养,待细胞长势良好时进行传代,取对数生长期的细胞进行实验。 2.2 CCK-8法检测细胞增殖活性 MDA-MB-231细胞以2×103个/孔接种于96孔板中,细胞培养24 h后,给药组每孔加入不同浓度(2、4、8、16、32 μmol/L)的石蒜碱100 μL,对照组加入100 μL细胞培养基,每组均设置6个平行孔,处理48 h后,每孔加入10 μL CCK-8试剂,继续培养4 h。采用酶标仪检测490 nm处的吸光度(A)值,计算各组细胞的增殖抑制率与石蒜碱对MDA-MB-231细胞的半数抑制浓度(half inhibitory concentration,IC50)。 2.3 倒置显微镜、荧光显微镜、激光共聚焦扫描显微镜观察细胞形态变化 MDA-MB-231细胞以3×103个/孔分别接种于2块6孔板中,细胞培养24 h后,根据石蒜碱对MDA-MB-231细胞的IC50设定3个给药剂量,分别以3、6、12 μmol/L的给药浓度每孔加入石蒜碱1 mL,对照组加入1 mL细胞培养基,继续处理48 h。取1块板用倒置显微镜观察并拍照后,每孔加入1 mL多聚甲醛固定1 h,冲洗后加入200 μL Hoechst 33258染液,37 ℃孵育30 min后,用荧光显微镜观察并拍照;取另1块板收集各组细胞,用预冷的PBS重悬细胞并弃去上清液,加入Annexin V-FITC于37 ℃避光孵育15 min,冲洗后加入PI染液于4 ℃避光孵育15 min后,用激光共聚焦扫描显微镜观察并拍照。 2.4 集落实验检测细胞克隆能力 MDA-MB-231细胞以1×103个/孔接种于6孔板中,细胞培养24 h后,按“2.3”项下方法对细胞进行分组和给药,连续培养7 d后弃去培养基。PBS洗涤后用甲醇固定10 min,冲洗后加入吉姆萨染液染色后,用倒置显微镜观察细胞集落形成率并拍照。 2.5 划痕实验检测细胞迁移能力 MDA-MB-231细胞以1×105个/孔接种于6孔板中,细胞培养24 h,细胞融合至70%~80%后,用200 μL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]倚靠直尺,枪头垂直于每孔底部竖直划痕。PBS冲洗后,按“2.3”项下方法对细胞进行分组和给药,培养48 h后,用倒置显微镜观察细胞的迁移情况并拍照记录,比较各组间的划痕宽度,使用Image J软件测量并计算划痕愈合率。 2.6 流式细胞仪检测细胞凋亡率 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入70%冷乙醇2 mL于4 ℃固定24 h后离心。弃去上清液,PBS冲洗后,加入800 μL PI染液,4 ℃避光孵育30 min,经尼龙网滤过后,采用流式细胞仪进行检测,激发波长为488 nm。 2.7 流式细胞仪检测ROS水平 按“2.3”项下方法对细胞进行分组和给药,培养48 h,收集各组细胞,PBS洗涤后加入5 μmol/L DCFH-DA染液0.2 mL,37 ℃避光孵育20 min,经尼龙网滤过后,采用流式细胞仪进行检测。 2.8 流式细胞仪检测线粒体膜电位 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,PBS洗涤后,避光加入Rhodamine 123染料,避光孵育30 min后离心弃去上清液,用PBS洗涤并混匀细胞,经尼龙网滤过后,采用流式细胞仪进行检测。 2.9 激光共聚焦扫描显微镜检测线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)活性 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入37 ℃预热的Reagent A染液500 μL,离心后弃去上清液。37 ℃避光加入染色工作液,混匀后孵育20 min,离心去除上清液,将细胞吹打混匀后,经尼龙网滤过,采用激光扫描共聚焦显微镜检测并进行拍照。 2.10 Western blotting检测线粒体自噬相关蛋白TIM、TOM、PARKIN、PINK1、LC3-B、p62和凋亡相关蛋白Caspase-3、Bax、Bcl-2、Cyt-C表达 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入含PMSF的细胞裂解液,冰上裂解30 min后将细胞加入EP管中,离心15 min。取上清液,煮沸使蛋白变性,采用BCA试剂盒定量蛋白浓度。采用SDS-PAGE凝胶电泳,转至PVDF膜,5%脱脂奶粉封闭2 h后,加入一抗,4 ℃孵育过夜。TBST洗膜后加入二抗,37 ℃孵化2 h,洗膜后加入化学发光试剂,采用凝胶成像系统拍照并进行分析。 2.11 统计学分析 用SPSS 21.0软件进行统计分析,数据以表示,多样本均数比较采用One-way ANOVA分析,通过Graphpad Prism 8软件绘图。 3 结果 3.1 石蒜碱对MDA-MB-231细胞增殖的影响 如图1所示,石蒜碱对MDA-MB-231细胞具有显著的增殖抑制作用(P<0.01),且呈浓度相关性。石蒜碱对MDA-MB-231细胞的IC50为6.21 μmol/L,并参考IC50值设定后续石蒜碱给药浓度分别为3、6、12 μmol/L。 3.2 石蒜碱对MDA-MB-231细胞形态的影响 采用倒置显微镜、荧光显微镜、激光共聚焦显微镜观察石蒜碱对MDA-MB-231细胞形态的影响,如图2所示,与对照组比较,石蒜碱给药后,随着给药浓度增加,细胞生长逐渐变稀疏,细胞膜破裂现象更加明显,细胞间轮廓更加模糊,细胞核固缩形成凋亡小体,发出较强荧光。 3.3石蒜碱对MDA-MB-231细胞克隆、迁移的影响 集落实验结果表明,石蒜碱可以抑制MDA-MB-231细胞的克隆能力(图3-A),且随着浓度的增加细胞集落数量逐渐减少,且呈浓度相关性。划痕实验结果显示,石蒜碱可以显著抑制MDA-MB-231细胞的迁移能力(P<0.01,图3-B、C),呈剂量相关性。 3.4 石蒜碱对MDA-MB-231细胞凋亡率、ROS水平的影响 如图4-A、B所示,经流式细胞仪PI单染法检测出现明显的凋亡峰,表明DNA的合成受到抑制,且随着给药浓度增加,凋亡峰越明显,凋亡率也呈上升趋势,与对照组比较有显著性差异(P<0.01),且呈浓度相关性。如图4-C、D所示,随着给药浓度增加,细胞内ROS水平逐渐升高,具有显著性差异(P<0.01),且呈浓度相关性。 3.5 石蒜碱对MDA-MB-231细胞线粒体膜电位和MPTP的影响 如图5-A、B所示,经流式细胞仪检测,随着石蒜碱给药浓度增加,细胞内线粒体膜阳性表达率逐渐降低,具有显著性差异(P<0.01),且呈浓度相关性。如图5-C、D所示,应用激光扫描共聚焦显微镜结合AM染色技术对不同浓度的石蒜碱作用48 h后的MDA-MB-23细胞进行检测,激光扫描共聚焦显微镜扫描得到的荧光象素强度反映出细胞膜通透性的改变,随着给药浓度增加,细胞内线粒体膜通透性逐渐升高,具有显著性差异(P<0.01),且呈浓度相关性。 3.6 石蒜碱对MDA-MB-231线粒体自噬和凋亡相关蛋白表达的影响 应用凝胶成像系统分析MDA-MB-231细胞中线粒体自噬和凋亡相关蛋白表达的情况。如图6所示,随着石蒜碱浓度增加,细胞自噬相关蛋白TIM、TOM和p62蛋白表达量逐渐降低,PARKIN、PINK1和LC3-B蛋白表达量逐渐升高,均具有显著性差异(P<0.01)。如图7所示,随着石蒜碱浓度增加,细胞凋亡相关蛋白Bcl-2蛋白表达量逐渐降低,Bax、Caspase-3和Cyt-C蛋白表达量逐渐升高,均具有显著性差异(P<0.01)。 4 讨论 乳腺癌已成为全球最常见的恶性肿瘤,与乳腺癌的其他分子亚型相比,TNBC最具侵袭性和高度异质性[20-22],使其在临床上难以得到有效治疗。因此如何有效抑制TNBC侵袭、增殖和转移是目前亟待解决的问题。近年来,有研究表明中药在抗肿瘤方面具有显著的优势[23-25]。石蒜碱是异喹啉类生物碱,广泛分布于石蒜属植物鳞茎中,具有较强的抗肿瘤活性[26-27]。基于石蒜碱的抗肿瘤作用,结合课题组前期研究中TNBC细胞活性筛选,发现石蒜碱对MDA-MB-231细胞较为敏感,故选择MDA-MB-231细胞作为研究对象,本研究结果发现石蒜碱对MDA-MB-231细胞的增殖和迁移具有显著抑制作用,且呈浓度相关性。 ROS水平升高和线粒体功能障碍是诱导肿瘤细胞自噬和凋亡的重要途径[28]。研究发现,过量ROS的产生会诱发肿瘤细胞的损伤、自噬及凋亡并降低细胞的多药耐药性[29]。此外,肿瘤细胞对外源性ROS比正常细胞更敏感且ROS具有一定的细胞毒性。因此,促进ROS水平升高的药物可表现出一定的抗癌活性。有研究表明,线粒体功能障碍与多种恶性肿瘤的发生及ROS的过量产生密切相关[30]。本研究通过激光共聚焦显微镜和流式细胞仪检测结果表明,石蒜碱可以显著提高MDA-MB-231细胞凋亡率和ROS水平,并使线粒体膜电位下降,MPTP开放。这表明石蒜碱诱导细胞自噬和凋亡作用可能与线粒体的氧化损伤有关。 TOM及TIM是线粒体膜蛋白,当线粒体自噬增强时,其细胞内表达水平下降。研究表明线粒体损伤会使线粒体膜电位降低,导致PINK1在线粒体外膜上表达,从而使PINK1-PARKIN依赖性线粒体自噬反应被激活[31]。LC3-B是自噬体形成的特异性标志物,其含量与自噬泡数量成正比,因此被广泛用于监测细胞自噬。p62作为自噬降解的产物,自噬增强,p62水平会下降。p62还可与自噬体膜上的LC3-B蛋白及泛素化的蛋白形成复合物,在自噬溶酶体内完成降解[32]。ROS的过度累积,会触发MPTP开放,导致线粒体膜电位下降,引起Cyt-C从线粒体释放并进入细胞质中,进而激发Caspase的级联反应并启动细胞线粒体凋亡[33]。Bcl-2为抗凋亡蛋白,Bax为促凋亡蛋白,当接收到凋亡刺激信号后可转位至线粒体膜上,Bcl-2和Bax可形成二聚体或多聚体,从而增加细胞线粒体膜的通透性,进一步激活Caspase级联反应,Caspase-3可通过抑制凋亡抑制物,从而破坏细胞结构使蛋白丧失功能[34]。本研究通过Western blotting检测自噬相关蛋白和凋亡相关蛋白的表达,结果显示石蒜碱能够上调PARKIN、PINK1、LC3-B、Caspase-3、Bax和Cyt-C蛋白表达,下调TIM、TOM、p62和Bcl-2蛋白表达,表明石蒜碱可通过线粒体的氧化损伤介导MDA-MB-231细胞的自噬及凋亡。 综上,石蒜碱对MDA-MB-231细胞具有生长抑制作用,并可通过调控线粒体氧化损伤介导MDA-MB-231细胞的自噬及凋亡。本研究为石蒜碱抗肿瘤新药的深入研发和临床实践提供理论基础。
肝癌(hepatocellular carcinoma,HCC)是发病率高、治疗困难、死亡率高的恶性肿瘤,全球每年有1000000人死于肝癌。我国肝癌的死亡率在所有恶性肿瘤中居第二位,年死于肝癌的人数占全世界肝癌年死亡总数的53%。虽然肝癌的诊断和治疗有了长足的进步,但生存率在总体水平上变化不是很明显。迄今已建立的一系列人肝癌细胞系(cell line)和人肝癌细胞系的动物模型,为肝癌的发病机理和治疗研究奠定了良好的基础。咱们坛子里是否有做这方面工作的战友,分享一下相关文献。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=122088]人肝癌细胞系研究进展[/url]
http://www.stdaily.com/stdaily/pic/attachement/jpg/site2/20120113/00241d8fef0e1079d1f91e.jpg美国陆军开发出超级抗癌药物腾讯科技讯(亮亮/编译) 据国外媒体报道,来自美国陆军部队的专家近日在位于德克萨斯州的圣安东尼奥市军事医疗中心成功研制出一种名为“E-75”的超级抗癌药物,对多种肿瘤的治疗都具有很好的效果。据了解,研究人员研制这种化学药物最开始的初衷是为了降低乳腺癌的再发率,但在研究的过程中,研究人员却意外的发现这种药物同时还具有其他的功效。因为,那些吞服了这种药物的人们与服用普通控制药物的人们相比,前者患上结肠癌、前列腺癌、肺癌的概率有了明显的降低。研究人员在实验中选择了一些经基因测试或医疗审定后,被断定为有患上乳腺癌危险的女性,并将其分为两组,一组吞服控制性药物,另一组吞服了“E-75”药物。研究结果显示,吞服“E-75”药物的研究对象的乳腺癌再发率仅有10%,而吞服控制药物的一组竟高达20%。这就意味着超级抗癌药物“E-75”具有着正面积极的保护作用。研究人员之所以会选择这样的研究方法,是因为避免出现类似人们在感染流感后再注射流感疫苗的现象。研究人员解释说,抗癌药物“E-75”的“工作方式”相对来说较为简单,它能够成功的在人们体内建立一个特有的免疫系统,这种系统能够搜寻、识别以及确认呈现在多种类型癌细胞表面的蛋白质,从而对应的进行免疫。但是并不是所有肿瘤都是由分泌这种蛋白质分子的细胞组成的,这也是为何抗癌药物“E-75”不能治疗目前所有癌症类型的主要原因。而且,抗癌药物“E-75”在人体内所建立的特有免疫系统不能击败所有癌症细胞的主要原因之一,还因为有一些癌细胞具有“欺骗”免疫系统的功能,以至于当免疫系统进行识别时,会把这些癌细胞误认为是人体的一部分。但是一旦免疫系统“揭穿”这些癌细胞的“伪装面具”,它们就会毫不留情的对这些癌细胞进行消灭,不留任何一个“活口”。但是即便这样,研究人员仍然坚信,只要在该药物的基础上继续进行研究,未来一定会出现治疗癌症的新型药物和治疗方法,它们定会拥有帮助全世界数百万人改善生活质量的巨大潜力。研究人员表示,它们在过去几十年的主要研究任务就是激活该独特的免疫系统,这也是与癌症“战斗”的主要方法之一。该军队的陆军上校补充解释道,现在出现的关键问题是大多数癌症疫苗在被发现时,癌症患者往往已经处于癌症末期或晚期,因此通过直观的方式去检查是没有意义的。(中国科技网)
http://photocdn.sohu.com/20120710/Img347740451.jpg 加州大学洛杉矶分校的工程师们开发了一种全新的光学显微镜,显微镜上配备了世界上最快速的相机,可用于探测“流氓”癌细胞。 【搜狐科学消息】据国外媒体报道,美国加州大学洛杉矶分校(UCLA)的工程师们近日研制出了一款世界上最快速的相机,可用于探测难以捉摸的“流氓”癌细胞。这一科研成果的研究报告发表在了最新一期的《美国国家科学院院刊》上。 从大量各类正常细胞中识别和分离出一些罕见细胞对于某些疾病的早期发现、监测和治疗来说正在变得越来越重要。这些罕见细胞中,在体内自由移动的癌细胞就是一个很好的例子。通常情况下,在10亿个健康细胞中也只有一小撮癌细胞,然而它们会抢先转移,癌细胞扩散导致癌症患者的死亡率高达约90%。这样的“流氓”细胞除了癌细胞以外,还包括用于再生医学的干细胞及其它类型的细胞。不幸的是,检测这样的细胞是很困难的。要取得良好的统计准确性需要一台自动化、高通量的仪器,可以在相当短的时间内对数以百万计的细胞进行检测。配备了数码相机的显微镜是目前分析细胞的唯一设备,但是该设备对于这项研究来说速度显得太慢了。 现在,美国加州大学洛杉矶分校(UCLA)的工程师们开发了一种全新的光学显微镜,可以让这项艰巨的任务变得轻松许多。加州大学洛杉矶分校电气工程学院的工程师巴赫拉姆•贾拉利(Bahram Jalali)说:“为了抓拍到这些难以捉摸的细胞,相机必须具备在非常高的帧速率下持续捕获并对数百万张图像进行数字化处理的能力。传统的CCD和CMOS摄像头达不到这样的速度和灵敏度,因为从像素阵列读取数据需要时间,它们在速度极快的情况下对光变得不那么敏感。” 目前的流式细胞仪具有较高的通量,但是因为它依靠单点的光散射而不是拍照,在检测非常罕见的细胞类型时还不够灵敏,比如对于那些目前处于早期阶段或癌细胞转移前的癌症患者不适用。为了克服这些限制,巴赫拉姆•贾拉利和UCLA的的生物工程学副教授迪诺•迪•卡罗( Dino Di Carlo)领导的一个包括生物技术、光学、高速电子和微流体的跨学科研究团队开发出了高通量流式光学显微镜,这款显微镜非常灵敏,具备实时探测含量为百万分之一的罕见细胞的能力。 贾拉利的团队以他们在2009年创建的光子时间飞梭相机技术为基础,研制出了世界上最快的连续运行的相机。贾拉利、迪•卡罗和他们的同事在报告中描述了他们如何将这台相机与先进的微流体和实时图像处理技术进行整合,以对血液样本中的细胞进行分类。新的血液筛查技术每秒可筛查10万个细胞,比传统的基于成像的血液分析仪高出约100倍的通量。迪•卡罗说:“这项科研成果需要与一些尖端技术进行整合,通过生物工程部门、电气工程部门和加州纳米技术研究院的合作,并采用了UCLA细胞诊断学部门开发的重要的技术基础设施。”贾拉利和迪•卡罗均是加州大学洛杉矶分校的加州纳米技术研究院的成员。 他们的研究演示了如何实时辨别血液中罕见的乳腺癌癌细胞。初步结果表明,这种新技术有可能迅速地在大量血液中检测到极稀少的循环癌细胞,并将提高癌症早期检测、监测药物和放射治疗的效率。加州大学洛杉矶分校的电气工程和生物工程的项目经理本田惠介(Keisuke Goda)说:“这项技术可以大大减少错误,并将降低医疗诊断成本。” 研究人员通过将实验室生长的癌细胞与模拟现实生活中的病人的不同比例的血液进行混合得到了检测结果。加州纳米技术研究院的一名成员格达(Goda)说:“为了进一步验证该技术的临床应用效果,我们目前正在与临床医生合作进行临床试验。这项技术也将可能用于进行尿液分析、水质监测和相关的应用。”(尚力)
《自然》公布乳腺癌耐药性与FOXA1相关最近一期的生命科学前沿杂志《自然》公布了一项乳腺癌研究结果,结果显示,部分乳腺癌患者对常规乳腺癌标准激素治疗产生极强的耐药性,是因为雌激素受体在受到一种名为FOXAI蛋白质的干扰,在这种蛋白的感受下雌激素受体“工作路线”发生改变,导致雌激素受体与DNA链条上的基因结合紊乱,这一紊乱造成了乳腺癌激素治疗的耐受。 激素与乳腺癌的关系 ER影响基因引发连锁致癌 新桥医院肿瘤生物治疗中心的专家告诉我们雌激素作为一种生理性激素,一旦水平升高,会延长雌激素对乳腺上皮的刺激,改变体内内分泌环境,导致细胞恶变,从而造成乳腺癌发生。因此乳腺癌的发生、发展与雌激素密切相关。 1896年,Bentson就发现乳腺细胞的增生及癌变与激素密切相关,并观察到切除卵巢可使进展期乳腺癌消退。 1967年,Jensen发现人类乳腺癌细胞中含有雌激素受体(ER),这是一种能与基因结合的物质,通过与基因结合,从而改变基因的表达。 大多乳腺癌患者,由于雌激素受体(ER)影响DNA的正常表达,引发了癌症的连锁反应。这种不正常的受体与DNA的结合物随后移位到细胞核与成千上万的基因结合并激活它们,从而产生生物学效应,肿瘤生产的帕多啦从此被打开。 但在这个过程中部分细胞会保留正常的受体系统,肿瘤细胞含有激素受体的功能与正常细胞相似,该肿瘤细胞的生长,仍然依赖原来的激素环境调节,这类肿瘤称为激素依赖性肿瘤,临床上称为ER阳性肿瘤;相反,有些肿瘤在癌变过程中,其受体系统保留很少或完全丧失,不能再作为激素的靶细胞,其生长不再受激素的控制与调节,此乃非激素依赖性肿瘤。 新桥医院肿瘤细胞免疫治疗中心的专家说:临床上我们把这种肿瘤细胞内激素受体含量水平,作为乳腺癌内分泌治疗预后的指标,对于激素依赖性乳腺癌患者,内分泌治疗非常重要,临床中约有60%—70%的乳腺癌是“激素依赖性”,如雌激素受体(ER)阳性和孕激素受体(PR)阳性的乳腺癌被认为是激素依赖性肿瘤,此类复发转移乳腺癌患者内分泌治疗有效率可达30%—50%,早期术后患者接受内分泌治疗可以减少约二分之一的复发危险和三分之一的死亡危险。在内分泌治疗的同时结合自体免疫细胞治疗,可起到巩固内分泌治疗的作用。 FOXA1的研究 揭示乳腺癌耐受的根源 对FOXA1蛋白质的研究,这是一个很重要的研究课题,可能揭示一些激素依赖性乳腺癌患者为何产生耐药。 一般来说,雌激素受体会和基因组上固定的一些位点结合,从而产生生物学效应,一些药物就是抑制这种结合,达到治疗肿瘤的目的。而根据研究报告,在FOXA1蛋白的作用下,雌激素受体改变了“工作线路”,不再结合到常规的基因组位点上,而与其他基因组位点结合,这样就导致了原本针对性的药物作用降低甚至失去效应,导致药物无效。了解了这一原理,对乳腺癌用药具有指导意义。 从FOXA1入手 能够攻克乳腺癌 能否针对FOXA1蛋白,开发出特定的药物,改善乳腺癌治疗效果? 新桥医院肿瘤专家表示有这个可能,但需要一个过程。因为从细胞学研究到临床转化是一个长期的过程。但我们在这段过程中要时刻留意患者的耐受情况,发现耐受应迅速更换方案,寻求一种肿瘤标志物引导的更科学的生物治疗方案。
美国梅奥诊所一项最新研究显示,拥有致密型乳腺和乳腺小叶未退化的女性罹患乳腺癌的风险显著提高。梅奥诊所研究人员在新一期美国《国家癌症研究所杂志》(JNCI)网络版上报告说,他们对2666名年龄在18至85岁患有良性乳腺病的妇女进行了超过13年的追踪调查,其间共有172名妇女患上乳腺癌。结果发现,致密型乳腺和乳腺小叶未退化是诱发乳腺癌的两项独立风险因素。与拥有非致密型乳腺以及乳腺小叶完全退化的妇女相比,同时具有致密型乳腺和乳腺小叶未退化两项风险因素的妇女患乳腺癌的几率显著提高。据介绍,致密型乳腺是指乳房拥有较多的胸腺组织和导管,而脂肪含量较少,这意味着癌细胞将有更多发展和隐藏区域;乳腺小叶退化是乳腺上皮细胞的正常生理萎缩,并随着年龄的增长而加快。梅奥诊所研究人员在此前一项研究中发现,乳腺癌变通常发生在乳腺小叶,如果乳腺小叶随着年龄增长而逐渐退化,妇女患乳腺癌的风险将会降低。
广州中山大学研究发现天然病毒M1可杀灭癌细胞中新网广州10月13日电(许青青 蔡珊珊) 记者13日从广州中山大学获悉,该校中山医学院颜光美教授课题组研究发现天然病毒M1能选择性地感染并杀伤包括肝癌、结直肠癌、膀胱癌、黑色素瘤在内的多种体外培养的癌细胞,而对正常细胞无毒副作用。全球癌症发病率呈现快速增长态势,现有的治疗手段远远未能满足临床需求。颜光美教授课题组发现,M1病毒是一种从中国海南岛分离得到的天然病毒,能选择性地感染并杀伤包括肝癌、结直肠癌、膀胱癌、黑色素瘤在内的多种体外培养的癌细胞,而对正常细胞无毒副作用。整体动物实验表明,经尾静脉注射的M1病毒能显著富集在肿瘤组织并抑制肿瘤生长,正常器官则不受影响。除细胞水平及动物实验之外,课题组还使用临床标本离体活组织培养模型进一步证实了上述新型溶瘤病毒的有效性和特异性。据悉,该研究成果对阐明新型天然溶瘤病毒M1选择性杀伤肿瘤细胞的机制和研发新型靶向抗肿瘤药物都具有重要意义。相关资料:癌细胞增殖方式癌细胞是一种变异的细胞,是产生癌症的病源,癌细胞与正常细胞不同,有无限生长、转化和转移三大特点,也因此难以消灭。癌细胞由“叛变”的正常细胞衍生而来,经过很多年才长成肿瘤。“叛变”细胞脱离正轨,自行设定增殖速度,累积到10亿个以上我们才会察觉。癌细胞的增殖速度用倍增时间计算,1个变2个,2个变4个,以此类推。1912年8月13日,法国医生发现癌细胞。
新华社华盛顿11月20日电 (记者林小春)美国研究人员20日在美国《科学转化医学》杂志上报告说,他们开发出的一种微芯片可简单、快速地检测人体体液中是否存在癌细胞,这一成果将有助于早期的癌症诊断。 癌变细胞的变形能力要比正常细胞大得多。研究人员利用癌变细胞的这一特征开发出一种有多个小孔的微芯片,从胸水提取的细胞进入这些小孔后会撞上芯片的“墙壁”弹回而发生变形,变形程度会被高速成像设备记录下来,以每秒100个细胞的速度分析,从而判断是否存在癌细胞。 领导研究的美国加利福尼亚大学洛杉矶分校教授饶建宇对新华社记者说,他们利用微芯片检测了100多个样本,结果100%地找出了癌变样本。而现有的癌症检查方法通常只能检测出80%到90%。下一步,他们将开展更大规模的临床试验。 饶建宇说,目前的癌症检查往往是间接地判断癌变细胞的一些行为特征,如浸润性和转移能力、对药物的敏感性等,一般要先对细胞进行固定处理再染色,或提取DNA及蛋白成分等进行分析,程序多而复杂,但所得结果往往是片面和间接的。 而微芯片技术则是直接判断癌变细胞的物理及行为特征,无需对细胞处理或染色,因此简单而快速,也更加精确。饶建宇说:“这就好像判断一个人的角斗能力,光看高矮胖瘦或家庭背景等也许有一些帮助但不够,而直接的比赛是最管用的。” 他说:“人们谈癌色变往往是由于癌细胞具有浸润和转移的共性,同时又有千变万化的个性,因此以直接的方法来判断癌细胞的物理及行为特征尤为重要,这使得我们对癌细胞的认识更直接、全面和准确,对癌症的诊断由此上了一个新平台。”
【西班牙《国家报》1 0月26日报道】巴塞罗那瓦尔德希伯伦大学附属医院的一个研究小组日前宣布,确认了癌细胞的一种基因物质能够使恶性肿瘤不老化并失控地增殖。 玛蒂尔德·列奥纳特医生领导的这项研究成果刊登在《医学研究评论》杂志上。研究报告指出,小核糖核酸(m icroARNs)对细胞不死发挥了突出的作用。 核糖核酸在蛋白质的生成过程中起到重要作用,但此前对小核糖核酸的功用实际上并不了解。最新研究表明,小核糖核酸与另一种遗传物质之间相互作用,阻断或激活细胞的增殖过程。瓦尔德希伯伦大学的研究小组已经确认了28种能使癌细胞继续增殖的小核糖核酸。研究人员认为,对这些小核糖核酸采取行动会为阻止甚至消除癌细胞的这种特性打开大门,是在抗击癌症方面的一大显著进步。癌细胞会不停地分裂和增殖,而健康细胞能够进行40-60次分裂,然后就停止分裂,最终死亡。 癌细胞的有害之处正是其不老化的能力,这种能力使其成为一种不死组织,因为它在不会自我消灭的同时还毫无控制地成倍增加。新研究成果确认了造成这种不死特性的小核糖核酸,便于今后研究出一种能够阻断这种能力,让癌细胞像健康细胞一样老化和自我毁灭的机制。 (来源: 新华国际)
[font=Arial,Helvetica,sans-serif]据日本共同社网站6月12日报道,日本群马大学副校长竹内利行(内分泌代谢专业)等人近日成功研发出了通过有机EL材料使体内的癌细胞发出红色可视光的新技术。极为细小的癌细胞若仅靠肉眼经常容易被忽视。据称,该技术在内视镜检查的配合下,有助于发现胃和肠等器官表面上细小的癌细胞。 据竹内等人介绍,有机EL材料“铱络化物”在特殊光线的照射下,在与空[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]同的氧气浓度约20%的环境下不会发光,而在浓度低于10%时则会发光。癌细胞因扩散速度快而经常处于低氧状态,因此在“铱络化物”的作用下可以发光。 竹内等人将“铱络化物”注射到带有癌细胞的白鼠的静脉中,成功令发生癌变的部位发光。据称,实验中即使仅2毫米的癌细胞也可以识别,只要距离表面深度1厘米以内均可以发现。 该技术应用于人体时,通过从内视镜的前端喷射“铱络化物”,被消化道吸收后即可凭借发光与否识别癌细胞。与目前癌细胞检查所使用的正电子发射断层成像装置(PET)和磁共振成像装置(MRI)相比,此项技术的费用相对较低。[/font]
美国北卡罗莱纳大学教堂山分校文理学院的首席化学教授约瑟夫—德西蒙博士领导的研究小组发现,人体中的一种正常的良性蛋白质,如果和纳米粒子相结合,就能瞄准并杀死癌细胞,而无须负载那些携带化疗药物的粒子。此前,研究人员曾认为,纳米粒子只有携带了有毒的化学载体才能达到这样的效果。转铁蛋白是人体血液中数量第四多的蛋白质,近20年来一直被作为肿瘤靶向载体用以递送治癌药物。纳米粒子通常也是无毒的,需要通过负载标准化疗药物来治疗癌症。然而,结合转铁蛋白的“打印”纳米粒子,不仅能识别它们,还能诱导癌细胞死亡。而不与任何纳米粒子结合的自由转铁蛋白,能从拉莫斯癌细胞中获得养料生长,即使在很高浓度下也不会杀死任何拉莫斯癌细胞。然而令人吃惊的是,转铁蛋白附着在纳米粒子表面后,其能有效地筛选标靶,攻击并杀死B细胞淋巴瘤。在许多迅速生长的癌细胞表面,蛋白质受体被过度表达,于是和转铁蛋白配体结合的治疗就能找到并瞄准它们,而结合转铁蛋白的纳米粒子被认为是安全且无毒的。德西蒙实验室发明了一种“打印”技术,能人为造出尺寸精确且形状符合预期的纳米颗粒。他们采用这种技术制作出一种可与人类转铁蛋白相结合的生物相容性纳米粒子,其能安全且精确地识别广谱癌症,除了B细胞淋巴瘤外,还能有效地指向非小型细胞,如肺、卵巢、肝脏和前列腺的癌细胞。研究人员目前正在进一步研究,携带转铁蛋白的纳米粒子如何及为何对于拉莫斯癌细胞是有毒的,而对其他细胞却无毒。化学治疗和放射治疗曾被认为是癌症的最有效疗法,但这些疗法通常会损害健康组织和器官。这一发现将可能发展出一种全新的策略来治疗某种类型的淋巴瘤,而副作用更小。不过,德西蒙承认,该研究也会引起一些人对不可预期后果的担忧,即一个设计好的针对某类癌症的靶向化疗载体是否会偏离目标。
中医药可整体布局防乳腺癌转移 乳腺癌是最常见的恶性肿瘤之一,其发病率已居女性恶性肿瘤发病率的首位,严重威胁着妇女身体健康。目前,手术切除仍然是乳腺癌的主要治疗方法,但术后的并发症、复发或转移是威胁患者生存的主要原因,中医药扶正固本、祛邪,在术前、术中及术后的运用,在改善术后患者体力、调动机体抗病能力、减轻放化疗毒副反应、提高生活质量、控制肿瘤复发转移、延长生存期方面有着重要作用和独特优势。 在乳腺癌手术前给予患者中医药治疗,可改善机体一般状况,增强体质,调理因疾病引起的脏腑功能障碍,减轻手术对患者机体的损伤,有利于手术进行,对控制肿瘤的发展和潜在的转移及术后患者体质的恢复,有很好的帮助。 在乳腺癌手术中,由于麻醉、创伤出血等易导致机体耗气伤阴、气血两虚,中医常予益气滋阴、清热养血、健脾益气等方法治疗,使手术造成的损伤尽早康复,以利于接受其他治疗。 乳腺癌手术后,通过中药辅助治疗,可防止和减少复发、转移,延长生存时间。临床与实验研究初步证实,长期使用中药治疗可达到这一目的。扶正中药可以改善机体免疫功能,活血化瘀中药可降低血液黏度、血小板聚集,抑制肿瘤灶周围新生血管形成,使癌细胞不能集聚停留,增加了宿主细胞的杀灭机会。其他如对肿瘤基质降解酶、血小板黏附蛋白表达等的研究也显示了中药抗浸润、抗转移作用的可能性。 中医药防治乳腺癌转移是多步骤、多环节与多途径的整体防治,不同于西医仅是单环节的阻断某一个转移步骤或途径,相比之下,有着整体的优势和丰富的治疗途径。中药在抗乳腺癌复发转移方面首先表现在改变癌毒特性,最大限度杀灭癌毒;其次能整体调控,提高机体抗癌能力,又能改善病理瘀滞,阻断转移途径,是从肿瘤病因病理基础上起效。如对肝转移者,在化疗基础上,加用健脾益气、活血化瘀药物,通过扶正与祛邪结合,既有支持强壮作用,又有明显的抗癌效果,对提高乳腺癌患者的生存质量具有明显疗效,对化疗减毒亦有较好的作用。摘自人民网
记者5月26日从南开大学获悉,该校物理科学学院田建国、刘智波研究组利用全内反射下石墨烯对介质折射率异常敏感的光学现象,实现了超灵敏单细胞实时流动传感。这一成果可以使癌细胞在形成之初即被精确“光测”出来,将为癌症预防提供一条新途径。 石墨烯是一种呈蜂巢状排列的单层碳原子结构,是目前已知的最薄、最坚硬的纳米材料。在全内反射这种特殊的结构下,对于介质折射率异常灵敏是石墨烯材料的重要特性之一。田建国、刘智波领导的研究组发现,折射率的灵敏度与石墨烯的层数有极大关系,并且层数有一个最优值。他们通过与南开大学化学学院陈永胜课题组合作,不断控制石墨烯的层数,最终制出厚度为8个纳米的石墨烯材料,其折射率的灵敏度和分辨率达到目前国际上最高水平。 在此基础上,课题组结合微流体技术和病变细胞的折射率差异,将这一超高的折射率灵敏度成功应用于单细胞传感。记者在实验室看到,实验人员将制备出的8纳米厚石墨烯均匀铺于一块三棱镜的一面,紧贴石墨烯上方建有一条细胞通道。实验时,一束光从棱镜一面射入,穿透石墨烯照射在细胞通道上,反射光从棱镜另一面射出。实验人员通过光电转化,即可得到一份波形图。如果细胞通道中存在癌细胞,则波形图上将会呈现出明显的波峰。即使数千个正常细胞中有一个发生了病变,这种“光测”方法都可以将其准确识别出来。 该课题组论文已在国际纳米科学技术领域权威刊物《Nano Letters》上发表,美国著名的纳米技术与纳米科学网进行了同步报道。
噪音可抑制癌细胞的生长速度!是真的吗?
石榴汁的成分能抑制癌细胞迁移 在美国细胞生物学会于费城召开的第50届年会上公布了这项研究根据今天在美国细胞生物学会(American Society for Cell Biology)于费城举行的第50届年会上公布的一项研究,加州大学里弗赛德分校(UCR)的科研人员发现石榴汁中的一些成分似乎能够抑制癌细胞的运动并且削弱它们被一种化学信号吸引的能力,这种信号已经被证明能够促进前列腺癌向骨的转移。加州大学里弗赛德分校(UCR) Manuela Martins-Green博士实验室的科研人员打算在一个前列腺癌体内模型中进行进一步的测试,从而确定这两种成分的剂量依赖性效应和副作用。石榴汁对前列腺癌恶化的作用即便存在,也是有争议的。在2006年的一项针对每天饮用一杯8盎司石榴汁的前列腺癌患者的研究中,加州大学洛杉矶分校(UCLA)的科研人员检测到了前列腺特异性抗原(PSA)水平的下降,这提示癌症恶化可能减缓。加州大学洛杉矶分校(UCLA)的科研人员并没有设法描述该研究中石榴汁效应背后可能的生物机制。
转铁蛋白与纳米粒子结合就可瞄准并杀死拉莫斯癌细胞,而无需负载其他化疗药物,此项发现将有望发展出癌症靶向治疗的新策略。 相关研究成果发表在本周的《美国化学协会杂志》上。 美国北卡罗莱纳大学教堂山分校文理学院的首席化学教授约瑟夫德西蒙博士领导的研究小组发现,人体中的一种正常的良性蛋白质,如果和纳米粒子相结合,就能瞄准并杀死癌细胞,而无须负载那些携带化疗药物的粒子。此前,研究人员曾认为,纳米粒子只有携带了有毒的化学载体才能达到这样的效果。 转铁蛋白是人体血液中数量第四多的蛋白质,近20年来一直被作为肿瘤靶向载体用以递送治癌药物。纳米粒子通常也是无毒的,需要通过负载标准化疗药物来治疗癌症。然而,结合转铁蛋白的“打印”纳米粒子,不仅能识别它们,还能诱导癌细胞死亡。而不与任何纳米粒子结合的自由转铁蛋白,能从拉莫斯癌细胞中获得养料生长,即使在很高浓度下也不会杀死任何拉莫斯癌细胞。 然而令人吃惊的是,转铁蛋白附着在纳米粒子表面后,其能有效地筛选标靶,攻击并杀死B细胞淋巴瘤。在许多迅速生长的癌细胞表面,蛋白质受体被过度表达,于是和转铁蛋白配体结合的治疗就能找到并瞄准它们,而结合转铁蛋白的纳米粒子被认为是安全且无毒的。 德西蒙实验室发明了一种“打印”技术,能人为造出尺寸精确且形状符合预期的纳米颗粒。他们采用这种技术制作出一种可与人类转铁蛋白相结合的生物相容性纳米粒子,其能安全且精确地识别广谱癌症,除了B细胞淋巴瘤外,还能有效地指向非小型细胞,如肺、卵巢、肝脏和前列腺的癌细胞。 研究人员目前正在进一步研究,携带转铁蛋白的纳米粒子如何及为何对于拉莫斯癌细胞是有毒的,而对其他细胞却无毒。 化学治疗和放射治疗曾被认为是癌症的最有效疗法,但这些疗法通常会损害健康组织和器官。这一发现将可能发展出一种全新的策略来治疗某种类型的淋巴瘤,而副作用更小。 不过,德西蒙承认,该研究也会引起一些人对不可预期后果的担忧,即一个设计好的针对某类癌症的靶向化疗载体是否会偏离目标。(科技日报)
维吉尼亚马里兰大学兽医学院科学家发表的文章称感染鸡的病毒有望能够治疗人类前列腺癌。纽卡斯尔病毒对鸡类有害但是不影响人类。科学家改造该病毒发现能够杀死各种类型的前列腺癌细胞。该文章发表在4月份Journal of Virology上。近六分子一的男人会发展成前列腺癌。通常采用激素疗法或化疗方法治疗前列腺癌病人,但是两者都有副作用。马里兰大学兽医系教授Elankumaran Subbiah博士希望开发出新的更高效并副作用小的治疗方法。纽卡斯尔病毒感染家禽和野生禽类,特别是鸡。尽管该病毒能引起人类轻度结膜炎和感冒样症状,但是并不对人类健康有很大危害。
如何用普通生物显微镜拍清楚非小细胞肺癌细胞的细胞膜呢
MSI1在人小细胞肺癌细胞系中的表达及MSI1低表达细胞模型的构建实验方法与步骤 细胞的复苏 1.复苏前的准备:打开水浴锅,设置温度37℃;紫外线将超净台消毒30 min;配置完全培养基。 2.将要复苏的H69、H446细胞从液氮取出,用一次性PE手套包裹冻存管,迅速放入水浴锅中震荡,使其快速融化。 3.在15 mL离心管中加入5 mL完全培养基及融化的细胞悬液,900 r/min离心8分钟,弃去上清,得到细胞沉淀。 4.在25 cm2的培养瓶中加入5 mL完全培养基,并用1 mL培养基将沉淀的细胞重悬并加入准备好的培养瓶中,放入CO2恒温培养箱中继续培养。 细胞的传代 1.选取在悬浮培养瓶中生长至90%的H69细胞,用移液枪将细胞悬液移入15 mL离心管中,选取在贴壁培养瓶中生长至90%的H446细胞,用PBS溶液将细胞吹至漂浮,并移入15 mL离心管中,两种细胞均900 r/min离心8分钟,弃掉上清。 2.分别在3个25 cm2培养瓶中加入5 mL完全培养基,在细胞沉淀中加入3 mL培养基并充分吹打混匀,将3 mL细胞悬液平均放入3个培养瓶中并混匀,放入培养箱中继续培养。 MSI1低表达细胞模型的构建1.从-80℃冰箱取出慢病毒载体冰上融化,将慢病毒用空白培养基稀释为滴度2×108,充分混匀,准备好病毒感染增强液。2.将25 cm2悬浮培养瓶中H69细胞移入15 mL离心管中并用移液枪充分吹打混匀,取其中500 μL放入细胞计数仪中计数,取出1.2×106个细胞置入新的离心管中,加入空白培养基至6 mL。3.在12孔板中以MOI=10的病毒滴度进行感染,培养16 h。4.16 h后将细胞悬液离心,换成不加双抗的完全培养基继续培养,72 h后观察荧光。5.待细胞生长至状态良好,加入1 μg/mL嘌呤霉素筛选至90%以上细胞均产生荧光。荧光实时定量PCR(Q-PCR)检测MSI1在mRNA水平的表达 总RNA的提取分别将细胞离心,PBS缓冲液清洗2次,900 r/min离心8 min,得到细胞沉淀。分别加入1 mL Trizol,用移液枪吸打至细胞完全破裂,加入200 μL氯仿,震荡30 s,室温静置10 min,以有效分离无机相和有机相,随后4℃,12,000 g/min离心15 min。将上清移至高压过的1.5 mL离心管中,加入与上清等体积的异丙醇,轻柔颠倒震荡数次,室温静置10 min,随后4℃,12,000 g/min离心10 min。弃去上清,加入75%无水乙醇,4℃,12,000 g/min离心5 min。弃去上清,沉淀置于冰上自然干燥,但不可完全干燥。用30 μL DEPC水溶解总RNA。用NanoDrop One超微量分光光度计进行定量和纯度检测,用1%琼脂糖凝胶电泳进行完整性检测。 cDNA的合成逆转录体系试剂名称使用量模板RNAMonScriptTM 5*RT111 All-in-One MixMonScriptTM dsDNaseNuclease-Free Water1 μg4 μL1 μLup to 20 μL将混合液轻柔吹打混匀,瞬时离心,37℃ 2 min,55℃ 15 min,85℃ 5 min,得到cDNA。 Q-PCR检测MSI1 mRNA的表达GAPDH引物序列:Forward primer:Reverse primer:5’-GGTCGGAGTCAACGGATTTG-3’5’-ATGAGCCCCAGCCTTCTCCAT-3’MSI1引物序列:Forward primer:Reverse primer:5’-GAACCATCCCGTCCTGTATCA-3’5’-GAAACCATGAAGCCCCAACC-3’Q- PCR反应体系:Q-PCR反应体系试剂名称使用量cDNAForward primerReverse primerMonAmpTM Chemhs qPCR MixLow ROXNuclease-Free Water50 ng0.2 μL0.2 μL5 μL0.1μLup to 10 μLQ-PCR反应程序: Q-PCR反应程序反应步骤反应温度反应时间循环次数预变性95℃10 min1变性95℃10 s40退火55-65℃10 s延伸72℃30 s溶解曲线溶解曲线按仪器默认溶解曲线 结果采用t检验,用Graphpad prism5计算MSI1在mRNA水平的表达量。 Western blot检测MSI1在蛋白水平的表达总蛋白的提取将对数生长期的H69-NC、H69-shMSI1细胞移入15 mL离心管中,900 r/min离心8 min,并用PBS溶液洗涤2次,以去除培养基中血清影响。分别加入含PMSF的蛋白裂解液100 μL,与细胞充分混匀。4℃裂解1小时后,4℃,12000 g/min离心15 min,将上清移至新的离心管中,得到细胞总蛋白。 BCA法测定蛋白浓度 将Solution A和Solution B以50:1的体积比配置BCA工作液,充分混匀。将2 mg/mL蛋白标准品等比稀释,最小浓度为125 μg/mL,并分别与配置好的200 μL BCA工作液混匀,铺入96孔板中。37℃孵育30 min,测定波长562 nm处OD(光密度值)值,并绘制蛋白标准曲线。取适量H69-NC、H69-shMSI1细胞总蛋白,20:1稀释后,与200 μL BCA工作液混合均匀。37℃孵育30 min,用酶标仪测定波长562 nm处OD值,根据标准曲线计算出样品中的蛋白浓度。Western blot检测MSI1蛋白的表达 分别收集对数生长期的H69-NC、H69-shMSI1细胞总蛋白,加入相应体积4×SDS Loading Buffer,沸水浴煮5 min,分别取40 μg细胞总蛋白,在提前配制的10% SDS-PAGE分离胶电泳。电泳结束后,将蛋白转至PVDF膜上。用含5%脱脂牛奶的封闭液 37℃封闭1.5 h。弃去封闭液,用TBST缓冲液洗3次,每次10 min,加入MSI1兔单克隆抗体(1:1000),并以GAPDH为内参,加入GAPDH鼠单克隆抗体(1:5000);4℃孵育过夜,次日用TBST缓冲液洗膜3次,每次10 min。在敷有MSI1抗体的膜上加入辣根酶标记山羊抗兔IgG(1:5000),在敷有GAPDH抗体的膜上加入辣根酶标记山羊抗鼠IgG(1:5000),37℃敷育1 h,TBST 缓冲液洗膜3次,每次10 min。用增敏化学发光底物试剂检测,暗室曝光显影。在GAPDH表达量相同的情况下比较MSI1的表达情况。多次重复,应用ImageJ计算出各个蛋白条带的灰度对比,结果采用t检验,并应用Graphpad prism5作出柱状图。 MSI1在人小细胞肺癌细胞系中高表达 提取人正常肺上皮细胞BEAS-2B、小细胞肺癌细胞H446、H69的RNA,利用Q-PCR检测MSI1在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图2-1显示,MSI1在小细胞肺癌细胞系H446、H69中的表达远远高于正常肺上皮细胞。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428158_6718_5389809_3.png1 MSI1 mRNA在小细胞肺癌细胞系中的表达(**代表与正常肺上皮细胞相比,小细胞肺癌细胞MSI1表达量增高具有统计学意义,P0.01)。 MSI1低表达细胞模型的构建本实验选取人小细胞肺癌细胞系H69细胞,使用慢病毒感染技术敲低MSI1的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选,然后在荧光显微镜下观察如图2-2,可见H69-NC、H69-shMSI1细胞均产生绿色荧光,表明人小细胞肺癌H69细胞慢病毒感染成功。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428036_9359_5389809_3.png MSI1低表达细胞模型的构建。应用shMSI1慢病毒载体感染H69细胞,利用嘌呤霉素筛选,并在荧光显微镜下观察。 荧光实时定量PCR(Q-PCR)检测MSI1的mRNA表达水平提取对数生长期的H69-NC、H69-shMSI1细胞的RNA,并测量RNA浓度及完整性,用1%琼脂糖凝胶电泳检测完整性可见,RNA有三条带,从上到下依次为28S rRNA、18S rRNA和5S rRNA,且28S rRNA的亮度是18S rRNA的两倍。用NanoDrop One超微量分光光度计测定人总RNA的A260/A280的值为2.00左右,A260/A230的值为2.30左右,说明提取的RNA质量和完整性很好,可以用于后续试验。利用Q-PCR技术检测各细胞内MSI1 mRNA相对表达量,结果如图2-3所示,与对照组相比,H69-shMSI1组MSI1 mRNA表达量明显降低(P0.01),抑制率约为75%。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434330_8277_5389809_3.png MSI1在RNA水平的表达(***代表与对照组相比,H69-shMSI1组MSI1 mRNA表达量下降具有统计学意义,P0.001)。 Western blot检测MSI1蛋白表达水平将BSA标准品(2 mg/mL)进行等比稀释,最低浓度为125 ug/mL,并应用BCA蛋白质浓度测定试剂盒测定在波长562 nm下的OD值,以OD值为纵坐标,对应蛋白质浓度(μg/mL)为横坐标,绘制标准蛋白曲线如图2-4所示。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201435248_4142_5389809_3.png图2-4 标准蛋白曲线分别提取H69-NC、H69-shMSI1细胞的总蛋白质,利用Western blot技术检测各细胞内MSI1蛋白的表达情况。结果如图2-5所示,与对照组相比,MSI1蛋白表达在H69-shMSI1细胞中明显降低。表明MSI1低表达细胞模型构建成功。ahttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201437240_855_5389809_3.pngbhttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434999_3303_5389809_3.png图2-5 MSI1蛋白水平表达:(a)MSI1蛋白表达条带;(b)MSI1蛋白的相对表达量。(*表示与对照组相比,H69-shMSI1组MSI1蛋白表达下降具有统计学意义,P0.05)。首先验证MSI1在小细胞肺癌细胞系中的表达情况,利用Q-PCR技术检测在RNA水平,MSI1在肺正常上皮细胞及小细胞肺癌细胞系中的表达,结果显示,MSI1在小细胞肺癌细胞中的表达明显高于正常肺上皮细胞。随后以人经典型小细胞肺癌细胞系H69细胞为研究对象,构建MSI1低表达细胞模型,应用shMSI1慢病毒载体感染H69亲本细胞,同时设置对照组除外病毒本身对细胞产生的影响,利用Q-PCR及Western blot验证MSI1在RNA及蛋白水平的表达,结果显示,H69-shMSI1组MSI1的mRNA及蛋白的表达明显降低。表明MSI1低表达细胞模型构建成功,可以用于后续实验。
我们体内所有的正常细胞都配备一种自动的自我摧毁机制:在经过大约60次分裂之后,它们都死亡。这种内在时钟引起癌症研究人员的极大兴趣,这是因为大多数类型的癌症在这种天生的定时机制上存在缺陷。癌细胞的分裂发生差错而不受控制,因而它们能够继续无限分裂下去而导致肿瘤快速生长。在一项新研究中,瑞士研究人员发现一种蛋白复合物参与这种不受控制的过程。2012年7月4日,相关研究成果发表在《自然》杂志上。http://www.bioon.com/biology/UploadFiles/201207/2012070615373433.jpg
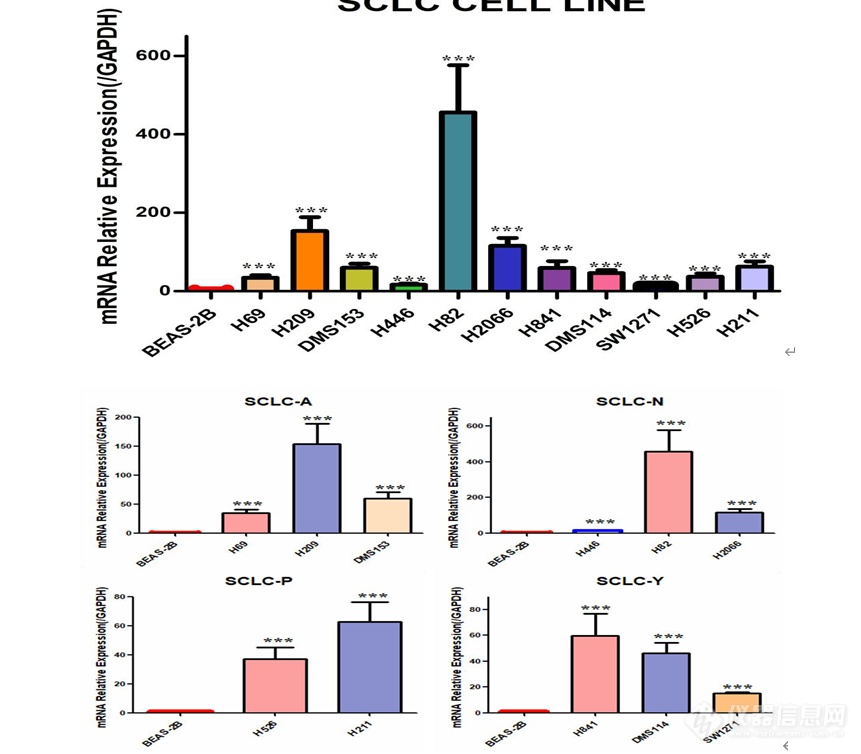
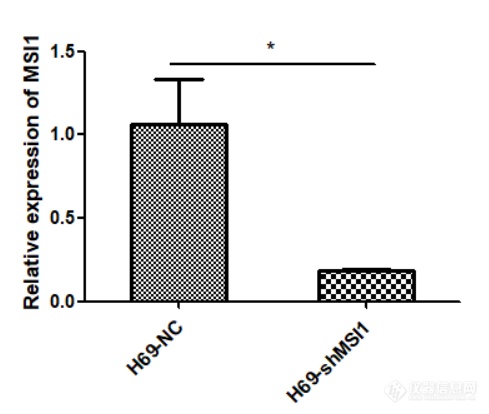
[font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]在人小细胞肺癌细胞系中的表达及[/color][color=#000007] [/color][font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]低表达[/color][color=#000000]细胞模型的构建[/color]MSI1 在人小细胞肺癌细胞系中高表达提取人正常肺上皮细胞 BEAS-2B,SCLC-A 型 H69、H209、DMS153 细胞,SCLC-N 型 H446、H82、H2066 细胞,SCLC-P 型 H526、H211 细胞,SCLC-Y 型 H841、DMS114、SW1271 细胞的 RNA,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 检测 MSI1 在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图 2-1 显示,MSI1 在小细胞肺癌细胞系中的表达远远高于正常肺上皮细胞,综合分析,选取了 H69、H82、H526 及 SW1271 细胞用于后续实验。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326443512_4838_5389809_3.png[/img]图 小细胞肺癌细胞系中 MSI1 mRNA 的表达(***P0.001)MSI1 低表达细胞模型的构建本实验选取人小细胞肺癌细胞系 H69、H82、H526、SW1271 细胞,使用慢病毒感染技术敲低 MSI1 的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选, 然后在荧光显微镜下观察如图 , 可见 H69-NC 、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2细胞均产生绿色荧光,表明人小细胞肺癌细胞慢病毒感染成功。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326451025_2121_5389809_3.png[/img]图 慢病毒感染后 4X 荧光显微镜下图片(H69、H82、H526、SW1271 明场及荧光照片) 敲低 MSI1 后转录和蛋白水平验证分别提取对数生长期的 H69-NC 、H69-shMSI1-1 、H69-shMSI1-2 、H82-NC 、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞的 RNA 和蛋白,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 技术分别检测各细胞 MSI1 mRNA 相对表达量,结果如图 所示,与对照组相比,H69-shMSI1-1、 H69-shMSI1-2 、 H82-shMSI1-1 、 H82-shMSI1-2 、 H526-shMSI1-1 、 H526-shMSI1-2 、SW1271-shMSI1-1、SW1271-shMSI1-2 组 MSI1 mRNA 表达量明显降低(P0.01), 抑制率约为 75%。利用 Western blot 技术检测各细胞内 MSI1 蛋白的表达情况。结果如图 2-3 所示,与对照组相比,MSI1 蛋白表达在 H69-shMSI1-1、H69-shMSI1-2、H82-shMSI1-1、H82-shMSI1-2、H526-shMSI1-1、H526-shMSI1-2、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞中明显降低。表明 MSI1 低表达细胞模型构建成功。[img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326454704_2148_5389809_3.png[/img]图 敲低 MSI1 在转录水平和蛋白水平的验证(***P0.001)
有研究说足够浓度的维生素C可以杀死一类顽固癌细胞,对治疗胰腺癌、结肠癌和卵巢癌有疗效。所以多吃富含维生素C的蔬菜对健康很有帮助。
近日来自哈佛大学、麻省理工学院以及瑞士苏黎世联邦高等工业学院的研究人员在新研究中成功地将生物“计算机”诊断网络导入到人类细胞中,这种生物网络通过对5种肿瘤特异性分子进行逻辑组合分析识别出了特异的癌细胞,并触发了这些癌细胞的毁灭过程。这一研究成果在线发表在9月2日的《科学》(Science)杂志上。文章的通讯作者是哈佛大学系统生物学中心的生物工程学家Yaakov Benenson及麻省理工大学的Ron Weiss教授。Benenson长期致力于开发在活体细胞内运作的生物计算机。生物计算机是一种完全由DNA、RNA及蛋白质构成的分子自动机(molecular automata),它们的“输入”是细胞质中的RNA、蛋白质以及其他化学物质,“输出”的则是很容易辨别的分子信号。由于生物计算机能够探测和监控基因突变等细胞内一切活动的特征信息,因此它们可以确定癌细胞等病变细胞。此外,它们还能够自动激发微小剂量的治疗行为。利用这些“分子医生”将有望引发人类医学的重大变革——明确地对人体病变细胞或组织进行治疗,而健康的细胞完全不会受到干扰。不过,要最终实现这一目标,还有很长的路要走。科学家近期进行的一些相关研究,大都是尝试以不同方式开发具有多种用途的生物计算机。在这篇文章中,研究人员成功构建了一个多基因合成“电路”,此电路负责鉴别肿瘤细胞与正常细胞,进而靶向性摧毁识别的肿瘤细胞。其具体工作原理是:对细胞内5种肿瘤特异性分子及出现频率进行抽样及综合分析。是由当5种因子同时在细胞内出现时,该电路才做出正识别响应。这使得肿瘤检测的精确性大大增高。研究人员希望这一成果能为开发出特异的抗癌治疗奠定基础。随后科学家们用这一多基因合成网络对实验室中培养的两种人类细胞Hela细胞(一种子宫颈癌细胞)和正常细胞进行了检测。当遗传生物计算机被导入到这两种不同的细胞类型中时,只有Hela细胞被摧毁,而正常细胞则安然无恙。获得这一结果并非易事,研究人员为之投入了大量的基础工作。Benenson及同时首先针对正常健康细胞和Hela细胞中的miRNA分子进行了高通量筛查,最终确定了能将Hela细胞从健康细胞中鉴别出的5种特定的miRNA组合。“这些miRNA分子被导入到细胞中进行检测。新型的生物计算机利用诸如‘是’与‘非’的逻辑运算对这五种miRNA分子进行组合。只有当对所有分子的整体运算结果为逻辑‘真’时才会生成需要的结果——即促使细胞死亡,”Benenson说。目前研究人员已确定这一生物计算机网络在活细胞中能够非常稳定地工作,准确组合所有细胞内因子并生成正确答案,这代表着研究者们在该领域又向前迈进了重要的一步。 http://www.bioon.com/biology/UploadFiles/201109/2011090911135106.jpgdoi:10.1126/science.1205527 PMC:PMID:Multi-Input RNAi-Based Logic Circuit for Identification of Specific Cancer CellsZhen Xie, Liliana Wroblewska, Laura Prochazka, Ron Weiss, Yaakov BenensonEngineered biological systems that integrate multi-input sensing, sophisticated information processing, and precisely regulated actuation in living cells could be useful in a variety of applications. For example, anticancer therapies could be engineered to detect and respond to complex cellular conditions in individual cells with high specificity. Here, we show a scalable transcriptional/posttranscriptional synthetic regulatory circuit—a cell-type “classifier”—that senses expression levels of a customizable set of endogenous microRNAs and triggers a cellular response only if the expression levels match a predetermined profile of interest. We demonstrate that a HeLa cancer cell classifier selectively identifies HeLa cells and triggers apoptosis without affecting non-HeLa cell types. This approach also provides a general platform for programmed responses to other complex cell states.
医学研究证明,长期处于高电磁辐射的环境中,会使血液、淋巴液和细胞原生质发生改变。电磁辐射过度还会影响人体的循环系统、免疫、生殖和代谢功能,严重的还会诱发癌症,并加速人体的癌细胞增长。专家提醒消费者——由于电脑产品具有生产组装过程相对简单,市场需求较大的特点,吸引了很多企业加入电脑的生产行业。目前国家信息技术设备电磁兼容性标准要求在生活环境中使用的电脑产品辐射干扰指标要达到《信息技术设备的无线电骚扰限值和测量方法》中B级限值的要求。非生活环境中使用的电脑产品辐射干扰指标要达到A级限值的要求。抽查结果表明,一些企业在批量生产时产品一致性没有很好的控制,致使被抽样品电磁兼容辐射干扰指标达不到B级限值的要求。辐射干扰是台式电脑工作时向空间发射的一种电磁波干扰。医学研究证明,长期处于高电磁辐射的环境中,会使血液、淋巴液和细胞原生质发生改变。此外,电磁辐射过度会影响人体的循环系统、免疫、生殖和代谢功能,严重的还会诱发癌症,并加速人体的癌细胞增长。这种电磁辐射污染已经成为室内环境污染的新威胁。庭用户要尽量避免把家电摆放得过于集中,以免使自己暴露在超限量辐射的危险之中。特别是一些易产生电磁波的家电,如电脑、电视、冰箱、收音机等,最好不要集中摆放在卧室里。要避免长时间使用家用电器、手机等,还要尽量避免同时启用多种家电。与家电保持安全距离很有必要,距离越远,受电磁波侵害就越小。另外,必须长期处于高电磁辐射环境中工作的人需要多食用胡萝卜、豆芽、西红柿、油菜、海带、卷心菜、瘦肉、动物肝脏等富含维生素A、C和蛋白质的食物,以此加强机体抵抗电磁辐射的能力。
水果树莓可明显抑制肝癌细胞系增殖,使肝癌细胞血管内皮生长因子(VEGF)的表达减弱,并使抑癌基因野生p53的表达增强。由哈医大附属第四医院刘明博士完成的一项国家自然基金课题,首次成功锁定树莓预防肝癌生长的两个特异性蛋白质作用靶点,为果蔬预防原发性肝癌提供了重要的理论依据。这一成果近日获得2008年度黑龙江省医药卫生科技进步一等奖。 2000年,刘明博士赴美国康奈尔大学研修深造期间,尝试将树莓中的鞣化酸与肝癌细胞混合培养,发现前者能显著抑制后者的生长。近年来,他从医学、营养学等角度开展了“树莓预防及抑制肝癌机制的研究”。 研究结果表明,随着树莓中植物化学物质浓度的增加,总抗氧化自由基清除能力也随之增强。0.25毫克/毫升至10毫克/毫升的树莓提取物对肝癌细胞系HepG-2的抑制率呈逐渐增加趋势,最高抑制率可达90%%左右。 在利用化学毒物黄曲霉毒素和二乙基亚硝胺建立的稳定大鼠原发肝癌模型上,随着树莓提取物浓度的增高,实验组大鼠肝脏上的瘤径变小,肿瘤的数量减少,成瘤率减低,结节程度减轻;肝癌细胞VEGF、增殖细胞核抗原表达的程度亦明显降低。同时,实验组大鼠血清在两种特异蛋白(M2597、M4513)质峰上与树莓干预组及正常大鼠血清差异明显,说明蛋白质峰M2597、M4513极有可能为树莓预防肝癌的蛋白质作用靶点。 专家评价,今后,利用树莓中提取的植物化学成分,进行合理搭配及组成预防剂,十分有助于防范肝癌的发生,并能抑制肝癌的发展,提高患者生存率。
西达本胺通过信号通路调节促进癌细胞凋亡在我国,西达本胺已获批作为PTCL临床用药。西达本胺属于苯酰胺类化合物,是我国自主研发的首个亚型选择性口服HDACI,国家食品药品监督管理局已批准其用于临床试验,其选择性抑制I类HDAC1、2、3亚型和II类HDAC10亚型,可抑制肿瘤细胞增殖、促进凋亡,阻滞周期、引发DNA损伤,还可以增强抗肿瘤免疫反应。与其他抗肿瘤药物相比,西达本胺疗效好、选择性高、不良反应少。西达本胺可激活死亡受体途径和线粒体凋亡途径诱导细胞凋亡,其中最为主要的是线粒体凋亡途径,该途径受Bcl-2家族介导的细胞色素C释放通路调控。抗凋亡蛋白Bcl-2表达受到抑制,促凋亡蛋白Bax表达上调,使线粒体膜电位降低,细胞色素C释放到细胞质中,Caspase途径被激活,细胞发生凋亡。例如:西达本胺增强B淋巴瘤细胞组蛋白H3、H4 乙酰化水平,使线粒体膜电位降低随后激活Caspase 3,促进细胞凋亡;在肾癌中,它可以下调Bcl-2表达,上调Bax表达,随着药物浓度增加引起786-O 细胞凋亡。西达本胺可以调控ROS水平。HDACI可以上调ROS水平,导致DNA双链损伤。研究证明,西达本胺作用于白血病细胞后,诱导细胞内ROS产生,细胞凋亡增加[17]。此外,在胰腺癌细胞系中,西达本胺明显增强细胞内ROS的产生,上调γH2AX(DNA双链断裂的标志物)表达水平,诱发细胞DNA损伤。西达本胺通过调控细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(Cyclin-dependent kinases,CDKs)以及细胞周期蛋白依赖性激酶抑制剂(Cyclin-dependent kinases inhibition,CDKI)的表达阻滞细胞周期。例如,西达本胺使MM细胞系P21、P27的表达量增高,CDK4、CDK6、Cyclin D2表达量下降,阻滞MM细胞系于G1期[19]。在NK/T细胞淋巴瘤中,西达本胺上调P21表达,下调Cyclin E表达,诱导细胞发生G0/G1期阻滞,从而抑制细胞的增殖。
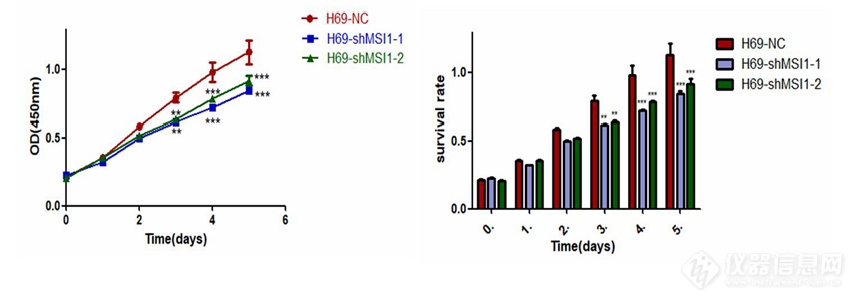
[align=center][size=18px]敲低[/size][size=18px] MSI1 对小细胞肺癌细胞生长增殖的影响[/size][/align][size=16px]检测 MSI1 对人小细胞肺癌细胞生长增殖的影响[/size][size=16px]收集[/size][size=16px] H69、H82、H526、SW1271 的对照组和实验组[/size][size=16px]细胞细胞[/size][size=16px]离心,并用完全培养基调整细胞浓度,H69-NC、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、[/size][size=16px] [/size][size=16px]H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2 以每孔 1×104 [/size][size=16px]个[/size][size=16px]细胞平铺于 96 孔板中,SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2,以每孔 1.3×[/size][size=16px]104 [/size][size=16px]个[/size][size=16px]细胞平铺于 96 孔板中,37℃ 恒温培养箱中培养。铺板后,分别于 24 h、48 h、72 h、96 h、120h 在每孔加入 10 [/size][size=16px]μL[/size][size=16px] CCK-8 溶液,37℃ 恒温培养箱中孵育 4h。并用酶标仪测定波长 450 nm 处 OD 值,利用 [/size][size=16px]Graphpad[/size][size=16px] prism5 计算增殖情况。[/size][size=16px]检测 MSI1 对人小细胞肺癌细胞药物敏感性的影响[/size][size=16px]收集[/size][size=16px] H69 、H82 、H526 、SW1271 的对照组和实验组细胞, 其中 H69-NC 、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、[/size][size=16px]H526-shMSI1-1、H526-shMSI1-2 细胞系以 1×104 [/size][size=16px]个[/size][size=16px]细胞/孔的细胞密度接种于 96 孔板中,SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 以 1.3×104 [/size][size=16px]个[/size][size=16px]细胞/孔的细[/size][size=16px]胞[/size][size=16px]密度接种于[/size][size=16px] 96 孔板中。待细胞融合率约 80%,加入不同浓度顺[/size][size=16px]铂[/size][size=16px]。每组均设置对照组及空白组(仅有同体积培养基)。H69、H82、H526 的对照组和实验组[/size][size=16px]加药浓度梯度为 0、1、2、4、8、16、32、64 nmol/mL,SW1271 对照组和实验组细胞加药浓度梯度为 0、2、4、8、16、32、64、128、256 nmol/mL,(加药浓度梯度根据细胞类型、前期预实验结果及细胞对药物的敏感程度而定)。每种浓度设 6 [/size][size=16px]个[/size][size=16px]复孔,每孔总体积为 100 [/size][size=16px]μL[/size][size=16px],培养 24、48、72、96、120 h 后[/size][size=16px]分别检测细胞活力。每孔加入[/size][size=16px] 10 [/size][size=16px]μL[/size][size=16px] 的 CCK-8[/size][size=16px](避光),培养箱中孵育[/size][size=16px] 4 h 后取出,使用酶标仪测定波长为 450 nm 的吸光度(OD 值)。利用公式:抑制率=(加药组-空白组)/(对照组-空白组)计算增殖抑制率。实验重复 3 次,取平均值。以药物浓度为横坐标,细胞增殖抑制率为纵坐标,利用[/size][size=16px]Graphpad[/size][size=16px] prism5 绘图。[/size] [size=16px]敲低[/size][size=16px] MSI1 对人小细胞肺癌细胞增殖能力的影响[/size][size=16px]CCK-8 是一种基于 WST-8 而广泛应用于细胞增殖和细胞毒性的快速、高灵敏度、无放射性的比色检测试剂盒。WST-8 在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的甲[/size][size=16px]瓒[/size][size=16px],生成的甲[/size][size=16px]瓒[/size][size=16px]物的数量与活细胞的数量呈正比,因此可以直接进行细胞增殖和毒性分析。[/size][size=16px]CCK-8 法 测 生 长 曲 线 实 验 结 果 如 图[/size] [size=16px]3-1 显 示 , 实 验 组 H69-shMSI1-1 、[/size][size=16px]H69-shMSI1-2 、 H82-shMSI1-1 、 H82-shMSI1-2 、 H526-shMSI1-1 、 H526-shMSI1-2 、[/size][size=16px]SW1271-shMSI1-1、SW1271-shMSI1-2 细胞的 OD [/size][size=16px]值明显[/size][size=16px]低于对照组。[/size][size=16px]表明敲低[/size][size=16px] MSI1[/size][size=16px]抑制了[/size][size=16px] SCLC 细胞的生长增殖。[/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302321138249_2126_5887180_3.png[/img][size=16px] [/size][size=16px]图[/size][size=16px] [/size] [size=16px]MSI1 低表达对 H69、H82、H526、SW1271 对照组和实验组细胞增殖的抑制情况。应用 [/size][size=16px]Graphpad[/size][size=16px] prism5 作图所示(*P0.05,**P0.01,***P0.001,表示与对照组相比,[/size][size=16px]敲低组[/size][size=16px] OD 值减小[/size][size=16px]具有统计学意义)。[/size] [size=16px]测敲低[/size][size=16px] MSI1 对人小细胞肺癌细胞药物敏感性的影响[/size][size=16px]药敏实验结果如图[/size][size=16px] 3-2 所示,与对照组相比,实验组 H69-shMSI1-1、H69-shMSI1-2、H82-shMSI1-1、H82-shMSI1-2、H526-shMSI1-1、H526-shMSI1-2、SW1271-shMSI1-1、[/size][size=16px]SW1271-shMSI1-2 经不同浓度[/size][size=16px]顺铂处理[/size][size=16px] 24、48、72、96、120 h 后细胞的药物敏感性无明显变化。[/size][size=16px] [/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302321124223_9282_5887180_3.png[/img]
[size=15px][color=#595959]在全球范围内,[/color][/size][b][size=15px][color=#595959]乳腺癌[/color][/size][/b][size=15px][color=#595959]是女性中最常见的[/color][/size][b][size=15px][color=#595959]恶性肿瘤[/color][/size][/b][size=15px][color=#595959],也是中国女性中最常见的癌症,是第五大癌症死亡原因。此外,乳腺癌已成为威胁全世界妇女健康的严重疾病。目前,乳腺癌的主要治疗方法是手术、放疗和化疗。化疗是不能接受手术的乳腺癌患者最重要的治疗方法之一。然而,[/color][/size][b][size=15px][color=#595959]放化疗[/color][/size][/b][size=15px][color=#595959]的严重副作用往往会阻碍治疗计划的实施,导致治疗效果不理想。[/color][/size] [size=15px][color=#595959]许多研究表明,中药在治疗癌症方面具有独特的优势,可以改善乳腺癌患者的[/color][/size][b][size=15px][color=#595959]生活质量[/color][/size][/b][size=15px][color=#595959]。因此,研究中药的抗乳腺癌作用及其分子机制对乳腺癌的治疗具有重要意义。[b]小柴胡汤(XCH)[/b]是中药经典方剂,最早载于《伤寒论》,并已载入《中华人民共和国药典》。在中国,XCH在临床上用于治疗多种肿瘤,如[/color][/size][b][size=15px][color=#595959]肺癌[/color][/size][size=15px][color=#595959]、[/color][/size][size=15px][color=#595959]结直肠癌[/color][/size][size=15px][color=#595959]、[/color][/size][size=15px][color=#595959]肝癌[/color][/size][/b][size=15px][color=#595959]等,也包括乳腺癌。然而,其潜在的作用机制尚不明确。[/color][/size] [size=15px][color=#595959][/color][/size][size=15px][color=#595959]采用[b]Q - Exactive Orbitrap[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-质谱联用技术([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)[/b]对XCH煎剂中的化学成分进行鉴定。然后,从中药系统药理学数据库与分析平台(TCMSP)中筛选XCH汤的有效成分和靶点。接下来,利用Cytoscape和metscape构建了一个活性成分-靶标-疾病网络,其中包括蛋白质-蛋白质相互作用(PPI)网络、GO富集分析和京都基因与基因组百科全书(KEGG)途径分析。最后通过分子对接和体外实验对[b]网络药理学[/b]分析结果进行验证。[/color][/size][size=15px][color=#595959][/color][/size] [align=center] [/align] [size=15px][color=#595959][/color][/size][size=15px][color=#595959]通过Q Exactive Orbitrap [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析,鉴定出70多种主要化合物。共鉴定出XCH煎剂与乳腺癌相关的162种有效成分和153个靶点,构建复方靶点-疾病网络。GO和KEGG分析显示,XCH煎剂调节[b]药物反应、细胞凋亡过程、肿瘤通路和PI3K/Akt信号通路[/b]。分子对接和实验验证表明,XCH汤通过调节凋亡相关蛋白的表达,[b]抑制PI3K/Akt通路,抑制乳腺癌细胞增殖,诱导细胞凋亡[/b]。[/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size] [b][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][/b][size=15px][color=#595959]该研究提示XCH煎剂可通过抑制细胞增殖、诱导细胞凋亡、下调PI3K/Akt信号通路来治疗乳腺癌,为XCH汤在乳腺癌治疗中的临床应用提供了理论依据。[/color][/size]
肝癌是全球第3大癌症死亡原因,其中肝细胞癌约占所有肝癌类型的80%[1]。据世界卫生组织统计,每年因肝细胞癌死亡的人数高达83万例,且其发病率和死亡率仍呈现上升趋势,严重损害人类生命健康[2]。在慢性肝病的基础上,基因突变、表观遗传变化、信号通路失调和血管生成异常等分子机制相互作用,共同推动慢性肝病向肝细胞癌过程的发展[3]。目前肝细胞癌治疗的一线药物主要是索拉菲尼、仑伐替尼等靶向药及阿替利珠单抗、贝伐珠单抗等免疫治疗药物[4]。然而,靶向药及免疫治疗药的耐药性和不良反应导致肝细胞癌的5年生存率仍然不高。因此,亟需寻找安全性高、不良反应少的治疗药物,为肝细胞癌患者提供更有效、安全的治疗选择。 近年来,随着对肝细胞癌研究的不断深入,自噬在肝细胞癌中的作用逐渐被关注。在肝细胞癌的发展过程中,自噬一方面通过维持细胞内稳态来抑制肿瘤起始,另一方面通过影响信号通路的效应因子来抑制早期肝细胞癌的进程[5]。自噬受到多种机制的严格调控和影响,涉及自噬的几条重要信号通路有Wnt/β-catenin、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p53通路等[6],这些通路在肝细胞癌中异常激活,参与肝癌细胞的增殖、凋亡和自噬等生物学行为。研究表明,mTOR通路在自噬调控机制中发挥至关重要的作用[7],mTOR是自噬的负性调控因子,可以与UNC-51样激酶1(Unc-51 like autophagy activating kinase 1,ULK1)的丝氨酸结合抑制自噬的启动过程,也可以通过磷酸化使自噬调节复合物失活影响自噬小体的发生,磷酸化自噬相关蛋白14(autophagy-related protein 14,Atg14)、自噬和Beclin-1调节器1(activating molecule in beclin-1 regulated autophagy protein 1,AMBRA1)和核受体结合因子2(nuclear receptor binding factor 2,NRBF2)直接调节自噬的成核步骤[8]。因此,针对自噬及其机制开展治疗可能是肝细胞癌的有效对抗策略。 地榆为蔷薇科植物地榆Sanguisorba officinalis L.的干燥根,具有凉血止血、解毒敛疮的功效。地榆皂苷II是从地榆中提取的一种三萜皂苷类化合物,现代药理学研究发现,地榆皂苷II不仅具有抗炎、抗氧化、免疫调节的药理作用,同时具有广泛的抗肿瘤活性[9-11],能通过多种途径抑制多种癌症的发生和发展,其机制可能与阻滞细胞周期、促进细胞凋亡和细胞自噬有关[12-15]。课题组前期研究发现,地榆皂苷II能够抑制小鼠肝细胞癌的发展[15]。然而,地榆皂苷II是否能通过影响Akt/mTOR通路诱导凋亡和自噬抑制肝细胞癌尚不明确。本研究中选择人肝癌HepG2细胞和小鼠肝癌Hepa1-6细胞作为研究对象,探究地榆皂苷II对肝癌细胞增殖、自噬和凋亡的影响,探讨地榆皂苷II在抗肝细胞癌方面的潜在作用机制,为将来用于临床治疗提供数据支持。 1 材料 1.1 细胞 HepG2细胞购自中国科学院上海细胞生物学研究所,Hepa1-6细胞购自上海富衡生物科技有限公司。 1.2 药品与试剂 地榆皂苷II(批号MUST-11051204,质量分数≥98%)购自上海源叶生物科技有限公司;PVDF膜(批号IPVH00010)购自美国Sigma公司;青霉素-链霉素(批号S11JV)购自上海源培生物科技股份有限公司;DMEM培养基(批号C11995500BT)、胎牛血清(批号A3160801)购自美国Gibco公司;PBS(批号WHB823K091)购自武汉普诺赛生命科技有限公司;0.25%胰酶消化液(批号C0203)、RIPA组织/细胞裂解液(批号P0013C)、蛋白酶抑制剂混合物(批号P1050-1)、磷酸酶抑制剂混合物(批号P1050-2)、EdU-555细胞增殖检测试剂盒(批号C0075S)购自上海碧云天生物技术有限公司;CCK-8试剂盒(批号A311-02)、BCA蛋白浓度测定试剂盒(批号E112-01)、高敏型ECL化学发光检测试剂盒(批号E412-01)、相对分子质量为1.8×105的蛋白marker(批号MP-102AA)购自南京诺唯赞生物科技股份有限公司;一抗稀释液(批号G2025)、二抗稀释液(批号G2009)、高相对分子质量marker(批号26625)购自武汉赛维尔生物科技有限公司;7.5% PAGE凝胶快速制备试剂盒(批号PG111)、10% PAGE凝胶快速制备试剂盒(批号PG112)、12.5% PAGE凝胶快速制备试剂盒(批号PG113)购自上海雅酶生物医药科技有限公司;β-actin、Beclin1抗体(批号分别为20536-1-AP、11306-1-AP)购自美国Proteintech公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、p62抗体(批号分别为ab196495、ab56416)购自英国Abcam公司;Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、Caspase-8、cleaved Caspase-3、Akt、p-Akt、mTOR、p-mTOR抗体(批号分别为5023T、9662S、4790T、9664T、4685S、4060T、2972S、5536T)购自美国CST公司;甲醇(批号10014118)购自国药集团化学试剂有限公司;山羊抗兔二抗(批号RS0002)购自美国ImmunoWay公司;Annexin V-FITC染色液(批号E-CK-A211)购自武汉伊莱瑞特生物科技股份有限公司。 1.3 仪器 AL104型电子分析天平(瑞士梅特勒-托利多有限公司);HH-S型恒温水浴锅(北京市永光明医疗仪器厂);CKX53型倒置生物显微镜、IX73倒置荧光显微镜(日本Olympus公司);3111型CO2培养箱、Multiskan Go-1510型全波长酶标仪(美国Thermo Fisher Scientific公司);Centrifuge 5424R型微量离心机(德国Eppendorf公司);SDS PAGE凝胶电泳及转膜电泳仪(美国Bio-Rad公司);BETS-M5型转移微型翘板摇床(海门市其林贝尔仪器制造有限公司);XH-C型涡旋混合器(金坛市医疗仪器厂);MINI-4K型微型离心机(杭州米欧仪器有限公司);5200型全自动化学发光图像分析系统(上海天能科技有限公司);CytoFLEX流式细胞仪(美国贝克曼库尔特有限公司);ThermoCell恒温金属浴(杭州博日科技股份有限公司)。 2 方法 2.1 CCK-8实验 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于96孔板中,贴壁生长24 h,设置对照组、不同剂量地榆皂苷II组,对照组仅加入培养基,其余各组分别加入5、10、15、20、30、40、60、80、100 μmol/L相应药物,继续培养24 h,用CCK-8试剂盒测定各组吸光度(A)值,计算细胞存活率。 细胞存活率=(A实验-A空白)/(A对照-A空白) 2.2 EdU实验 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于96孔板中,贴壁生长24 h,设置对照组和地榆皂苷II(10、20、40 μmol/L)组,给药组给予相应药物,对照组仅加入培养基,继续培养24 h。将EdU稀释到2×EdU工作液(20 μmol/L),预热后等体积加入96孔板中,孵育细胞2 h后去除培养液,加入100 μL固定液(4%多聚甲醛),孵育10 min后去除固定液,用100 μL洗涤液洗涤细胞3次后每孔加入100 μL通透液(含0.3% Triton X-100的PBS),室温孵育15 min。去除通透液,每孔用1 mL洗涤液洗涤细胞2次,每次5 min。参考说明书配制Click反应液。每孔加入50 μL Click反应液,轻轻摇晃培养板后室温避光孵育30 min。洗涤液洗涤3次,吸除洗涤液后,每孔加Hoechst 33342溶液100 μL,室温避光孵育10 min。用洗涤液洗涤3次,每次3~5 min,随后进行荧光检测。 2.3 细胞凋亡检测 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于6孔板中,贴壁生长24 h,设置对照组和地榆皂苷II(10、20、40 μmol/L)组,给药组给予相应药物,对照组仅加入培养基,继续培养24 h。用胰酶消化细胞,300×g离心5 min,弃上清,收集细胞,PBS洗涤,轻轻重悬细胞,300×g离心5 min,弃上清。用PBS洗涤细胞,离心后弃上清,加入Annexin V Binding Buffer重悬细胞。细胞悬液中加入Annexin V-FITC Reagent和5 μL的碘化丙啶(PI),轻柔涡旋混匀后,室温避光孵育15~20 min,立即上机检测。 2.4 Western blotting检测相关蛋白表达 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于6孔板中,贴壁生长24 h,设置对照组和地榆皂苷II(10、20、40 μmol/L)组,给药组给予相应药物,对照组仅加入培养基,继续培养24 h。加入RIPA中强度缓冲液裂解后收集细胞,使用BCA蛋白定量试剂盒检测蛋白浓度。蛋白样品经凝胶电泳,转至PVDF膜,加入5%脱脂奶粉,封闭1.5 h,加入一抗,4 ℃孵育过夜;洗膜3次后加入二抗,4 ℃孵育1.5 h;最后使用ECL化学发光检测试剂盒,用化学发光图像分析系统显影。 2.5 统计学分析 采用GraphPad Prism 9统计软件对实验数据进统计学分析,计量资料以表示,多组间比较采用单因素方差分析(One-way ANOVA)。 3 结果 3.1 地榆皂苷II对HepG2和Hepa1-6肝癌细胞增殖的影响 如图1所示,与对照组比较,随着地榆皂苷II浓度的升高,HepG2和Hepa1-6肝癌细胞的存活率明显降低,且呈剂量相关性。经GraphPad Prism 9软件分析,地榆皂苷II对HepG2、Hepa1-6细胞的IC50值分别为26.94、26.18 μmol/L,因此以10、20、40 μmol/L作为后续地榆皂苷II的给药剂量。 图片 3.2 地榆皂苷II对HepG2和Hepa1-6肝癌细胞增殖的影响 EdU-555阳性表示细胞正处于增殖状态,Hoechst33342阳性指示细胞为活细胞,EdU-555/Hoechst33342表示细胞的增殖率。如图2所示,与对照组比较,地榆皂苷II给药后HepG2和Hepa1-6细胞的EdU-555/Hoechst33342值明显降低(P<0.05、0.001),表明地榆皂苷II能够抑制肝癌细胞的增殖。 图片 3.3 地榆皂苷II对HepG2和Hepa1-6肝癌细胞凋亡的影响 如图3所示,与对照组比较,地榆皂苷II给药组HepG2和Hepa1-6细胞凋亡率显著升高(P<0.01、0.001)。凋亡蛋白(包括调控凋亡的激活因子和执行凋亡的效应因子)参与细胞凋亡的过程。采用Western blotting检测地榆皂苷II对HepG2细胞和Hepa1-6细胞凋亡相关蛋白表达的影响,如图4所示,与对照组比较,地榆皂苷II给药组Caspase-3、Caspase-8、Caspase-9、Bcl-2蛋白表达量显著降低(P<0.05、0.01、0.001),cleaved Caspase-3、Bax蛋白表达量显著升高(P<0.05、0.01)。以上结果说明地榆皂苷II促进HepG2和Hepa1-6细胞的凋亡。 图片 图片 3.4 地榆皂苷II对HepG2和Hepa1-6肝癌细胞自噬的影响 采用Western blotting检测细胞中代表自噬的核心蛋白LC3II、LC3Ⅰ、Beclin1、p62表达量,如图5所示,与对照组比较,地榆皂苷II给药组LC3Ⅱ/LC3Ⅰ值明显升高(P<0.05、0.01、0.001),Beclin1蛋白表达量上升(P<0.05、0.01),p62蛋白表达量明显下降(P<0.05、0.01),表明地榆皂苷II促进HepG2和Hepa1-6肝癌细胞的自噬。 图片 3.5 地榆皂苷II对HepG2和Hepa1-6细胞中Akt/mTOR信号通路蛋白表达的影响 采用Western blotting检测地榆皂苷II给药后Akt/mTOR信号通路蛋白表达量,如图6所示,与对照组比较,地榆皂苷II给药组p-Akt/Akt、p-mTOR/mTOR值明显下降(P<0.05、0.01、0.001),表明地榆皂苷II能够抑制Akt/mTOR信号通路。 图片 4 讨论 肝细胞癌具有高发病率、高病死率的特点,虽然目前肝细胞癌研究备受关注,但其5年生存率仍为14.1%[16]。因此,迫切需要发现新的治疗策略和候选药物。近年来,地榆皂苷II在抗肿瘤方面的研究不断深入,研究发现地榆皂苷II抑制肿瘤与细胞自噬和凋亡存在紧密的关联,地榆皂苷II可通过诱导细胞凋亡来显著抑制乳腺癌MDA-MB-435细胞和胃癌BGC-823细胞的增殖[14-15],诱导自噬显著抑制结直肠癌细胞增殖[17]。课题组既往研究证明,地榆皂苷II可在体内抑制肝细胞癌,其机制可能与抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路有关[15]。然而,目前关于地榆皂苷II是否通过自噬和凋亡抑制肝细胞癌及其机制尚不明确。因此,本研究利用体外实验对地榆皂苷II刺激后肝癌细胞的增殖、自噬、凋亡及相关机制进行探究,结果表明,地榆皂苷II能抑制肝癌细胞的增殖,促进肝癌细胞的凋亡和自噬,其机制与抑制Akt/mTOR通路有关。 自噬又被称为II型程序性死亡,负责真核生物细胞质中细胞器、蛋白质和大分子的降解和回收。细胞中降解和回收的底物被吞噬后形成自噬体,自噬体与溶酶体结合形成自噬酶体最后降解。本研究检测了自噬中具有代表性的LC3、p62和Beclin1蛋白。Beclin1蛋白是一种自噬启动子,帮助自噬过程中囊泡的形成[18],地榆皂苷II作用于肝癌细胞后,Beclin1蛋白表达量上升,促进自噬启动,囊泡形成增多,从而自噬水平升高。在自噬形成时,LC3I通过泛素激活酶E1和泛素结合酶E2与磷脂酰乙醇胺偶联,生成LC3II,LC3II存在于自噬体的表面,负责膜的融合和选择性降解过程[19],p62在自噬体表面与LC3II相互作用后包裹进自噬体降解,与LC3II共同调节选择性降解过程[20]。地榆皂苷II给药后LC3II/LC3I值增高,p62蛋白表达量下降,促进自噬过程中自噬囊泡的融合和降解,进而促进自噬。Beclin1是自噬过程中的核心因子,已有研究证明Beclin1可以与抗凋亡因子Bcl-2相互作用,从而对凋亡过程产生影响[21]。细胞凋亡是一种生理性或病理性的程序性的死亡过程,近年来通过诱导促进癌细胞的凋亡来控制癌症一直是抗肿瘤的热点。Caspase级联反应是细胞凋亡过程的关键步骤,其启动受到抗凋亡因子和促凋亡因子Bcl-2和Bax的调节。在Caspase级联反应中,启动性Caspase包括Caspase-8、Caspase-9被激活后调控下游执行性Caspase如Caspase-3进而引起凋亡反应[22-24]。地榆皂苷II作用于肝癌细胞后,细胞中的Bcl-2蛋白表达量减少,Bax蛋白表达量增多,Bax蛋白在线粒体表面形成孔道,释放细胞色素C,引发Caspase级联反应,Caspase-8、Caspase-9激活进而诱导下游的Caspase-3活化为cleaved Caspase-3,切割下游多种底物,促进细胞凋亡典型形态变化。 Akt/mTOR信号通路在正常细胞生理过程中发挥关键作用,同时在多种癌症中,该通路的异常激活对自噬、细胞凋亡、化疗耐药性及转移过程产生重要影响[25]。诸多研究证据表明,Akt/mTOR途径是调控癌症细胞自噬反应的核心通路[26-28]。地榆皂苷II作用于肝癌细胞后,Akt和mTOR蛋白的磷酸化水平显著下降,Akt/mTOR信号通路被抑制,激活肝癌细胞凋亡和自噬,抑制肝癌细胞的增殖(图7,由Figdraw绘制)。 图片 上述体外研究结果初步解析了地榆皂苷II抑制肝细胞癌的机制,即地榆皂苷II通过抑制Akt/mTOR信号通路诱导肝癌细胞的凋亡和自噬,抑制肝癌细胞增殖,为地榆皂苷II在肝细胞癌治疗的药物研究开发中提供了药理学证据。
自然杀伤细胞是免疫系统中的即时杀手,能够即时杀灭外来侵入物和癌细胞。尽管科学家就如何利用这些细胞的潜在能力所开展研究已经有三十多年,但对这些自然杀伤细胞是如何从非免疫细胞转化而来的这个问题几乎没有取得任何进展。目前,研究者发现了一种酶,能够利用一种外遗传途径(一种能够修改细胞中DNA的读取方式,而不改变其基因蓝图)来促进自然杀伤细胞的生长及其功能的形成。自然杀伤细胞可能有助于癌症的免疫治疗。这些免疫系统卫士时刻都在履行其警戒的职责,因此,人们认为它们能够消除那些偶遇的且经常躲过化疗的肿瘤细胞。目前,正在进行的二十几项旨在提高自然杀伤细胞应对癌症的能力的临床试验正在进行中。然而,正在开发的这类药物当中,没有一种采用外遗传途径。根据今天发表在美国国家科学院院刊的一份研究报告,这种情况也许是个错误。来自洛杉矶的南加州大学-诺里斯综合癌症中心的一个由陈思毅(Si-Yi Chen)带领的团队的研究表明,酶MYSM1(代表 Myb-like, SWIRM 和 MPN 结构域蛋白 1)控制了自然杀伤细胞通过表观遗传变异达到成熟的最后步骤。他们认为,这种酶水平的提高将有助于通过增加成熟自然杀伤细胞的数量来与癌细胞作斗争。来自北得克萨斯大学健康科学中心的癌症免疫学家普鲁诺罗尔·马修(Porunelloor Mathew)说:“这对我们理解自然杀伤细胞的发育非常重要”。他本人并未参加这项研究。一种使肿瘤细胞自毁的新型癌症治疗方法一种新型化疗药物将其目标指向癌细胞的组织结构,可导致所有类型的恶性肿瘤自我毁灭。澳大利亚新南威尔士大学的研究人员开发了一种万灵抗癌新药。这种药名为TR100,该药的原理是摧毁构成癌细胞结构的蛋白质而不会对健康细胞造成任何损害。研究人员在实验室中对老鼠进行了试验,研究结果发表在本月的“癌症研究”期刊上。就像一栋建筑物,细胞要保持其形状就必须有一定的支撑结构。两种分别称为肌动蛋白和肌球蛋白的蛋白质为癌细胞提供结构支持;它们就像一些较长的结实且互锁的线缆。健康的人体肌肉细胞,包括构成心脏的细胞也利用肌动蛋白和肌球蛋白。由于这个原因,多数研究人员已经放弃了将肌动蛋白和肌球蛋白作为化疗的目标,针对这些蛋白质的药物的开发在过去的25年中几乎停滞不前。然而,国际肌球蛋白专家Dr. 彼得﹒冈宁(Peter Gunning)始终在不断推进这项研究,而目前,他的研究已取得一些成果。他和其他研究人员已经能够分离两种特定类型的肌球蛋白,称为原肌球蛋白。只有癌细胞需要利用这些蛋白,而健康的肌肉细胞并不需要它们。他与本论文的首席作者贾斯汀·史丹(Justine Stehn)共同开发了TR100这种药物。程序性细胞死亡:致使肿瘤发生内爆“我们已经对癌细胞的内部构架或结构的核心组件进行了跟踪,”一位来自新南威尔士大学医疗科学系,肿瘤学研究室的研究人员史丹(Stehn),在一次健康热线的专访中说道,“当细胞察觉到其构架出现重大错误时,它将会出现程序性细胞死亡的情况。”程序性细胞死亡是一种遗传性定时炸弹,潜伏在每个人体细胞中。如果细胞被损坏、被感染或运转失常,人体能够对它发出自毁信号。“它就像我们看到的大楼坍塌那样”,史丹(Stehn)说,“如果一个大楼的结构和支架被移除,它就会自己坍塌。”程序性死亡导致细胞自身分裂成为小块的碎片,这些碎片能够被其它细胞所吸收、回收并重新利用。