我正在做细胞色素C 胰蛋白酶酶解后[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]测序,我想请教一下酶解的条件。酶的用量,时间,温度,pH,还有缓冲溶剂的配置
我以ITO导电玻璃作为电极,其表面经过3-氨丙基三乙氧基硅烷进行了修饰,然后浸在细胞色素c的磷酸盐缓冲溶液(pH=7)中经过一段时间的吸附。然后以此修饰了的ITO作为工作电极,铂为对电极,参比电极为甘汞电极,电解液为磷酸盐缓冲溶液(pH=7),做出的循环伏安曲线很漂亮。但是我发现随着扫描速的增加,其氧化还原电位差越来越大,也就是说两个峰都随着扫描速度的增加往两端移动,不知道是什么原因。理论上,其峰电位应该是不变的,希望各位大侠们不吝赐教,谢谢!!我用的是CHI660a。
大家有没有用LC-MS-MS测定细胞色素C吗?有这样的参考资料也好呀。多谢!
有没有一种环境毒物或者是药物会使得人或动物的细胞色素C发生变异啊?跪求那位高人能告诉我!
农残检测版块我看大部分作品都是仪器检测方面的内容,可是农药残留现在不单单是残留本身的问题了,还有对作物本身的影响及这些受影响的作物人体摄入后又有哪些变化呢?很少提及!另外,农药残留如果单从仪器检出方面来评估的话,可能对整个地区的横断面的描述缺乏论据,如果我们能找出一个预警的信号,根据这个信号有针对性的检测,相比工作效率事半功倍,而且对这个地区农残的危害可以有一个预见作用。 因此,出于以上考虑,我把自己近期的一个课题摘要,跟大家分享一下,欢迎批评指正,也希望对大家有所启发。探讨细胞色素P450酶系作为农药残留生物标志物的可行性目的和意义农药使用范围不断地扩大,新型农药不断涌现,这必然造成对农作物和环境的污染。因此及时、准确地对污染情况进行分析、监测,减少和防止对农作物和环境的污染以及对污染情况进行评估显得刻不容缓。传统的监测和评估是利用现代化仪器和手段进行准确定量的理化分析,但有些农药代谢分解迅速不易检出,而且仅凭含量无法反映这些农药对生物的效应,要检测和评估其对生物和环境质量的影响,就要研究在农药作用下生物体内各种指标的变化。生物标志物(biological marker)就适应了这种需要。生物标志物是指生物体由于接触外源毒物后而产生可在生物介质中测定到的细胞、生物化学和生物分子的改变,主要包括机体酶系统、细胞内的DNA、蛋白质、、谷胱甘肽、抗坏血酸以及结构生理生化功能等。细胞色素P450酶系是生物体中最重要的一组代谢酶,可由许多内源性和外源性的化学物质诱导。利用P450酶系的诱导作用,可以将其作为毒物污染机体在分子水平上敏感的生物标记物。农药作为外源性毒物,生物体在遭受其污染后会诱导P450酶系进行解毒。因此,本研究项目探索细胞色素P450酶系作为农药污染生物标志物的可行性。拟用常用农药胁迫生物体,检测生物体内细胞色素P450酶系总量的变化,搞清常用农药不同浓度胁迫生物体后与生物体内细胞色素P450酶系剂量-效应关系以及细胞色素P450酶系各个家族、亚家族的诱导效应,找出农药污染后体内细胞色素P450酶系中变化较特异的家族或亚家族,作为农药污染后特异的诊断评估工具,可为我国环境质量评价、化学物毒性评价、生态风险评价与预警系统提供理论依据国内外研究进展细胞色素P450酶系是生物体中最重要的一组代谢酶,根据酶的氨基酸序列相似性,细胞色素P-450酶系被分类并命名为家族(CYP1,2,3)、亚家族(A,B,C…)、单个基因(A1,2,3…),当前发现的P450基因超家族包括36个基因家族,其可由许多内源性和外源性的化学物质诱导。利用P450酶系的诱导作用,可以将其作为毒物污染机体在分子水平上敏感的生物标记物。目前国内外非常重视污染物监测的生物标志物研究,肝细胞色素P450酶系的诱导已被提出作为评价环境污染状况的最灵敏的生物学反应之一。国内外很多学者研究了野生动物、鱼类、蚯蚓、小麦等生物细胞色素P450酶系对多环芳烃(PAHs)、多氯联苯(PCBs)污染的指示作用,对哺乳动物和鱼类研究主要集中肝细胞色素P4501A1,因为与该细胞色素结合的EROD(乙氧基异酚唑酮)便于检测,而对于植物细胞色素P450酶研究则集中考察其总量的变化上。有关生物体细胞色素P450酶系作为常用农药污染的生物标志物的研究少见报道,有些只研究特定农药污染水体后葱属植物的EROD的指示作用。对所涉及的细胞色素P450酶系各个家族对农药污染后指示作用的系统研究未见报道。对于农药污染后体内细胞色素P450 酶系总量及各个家族亚家族含量变化较特异的指示生物的研究亦未见报道,对生物体细胞色素P450酶系作为农药污染空气、土壤、水体的生物标志物的系统研究尚属空白。技术发展趋势:1. 细胞色素P450将作为农药残留的长期生物效应的诊断工具,考察农药残留的危害性。[/
胡萝卜中含有大量的β-胡萝卜素,摄入人体消化器官后,可以转化成维生素A,是目前最安全补充维生素A的产品 (单纯补充化学合成维生素A,过量时会使人中毒)。它可以维持眼睛和皮肤的健康,改善夜盲症、皮肤粗糙的状况,有助于身体免受自由基的伤害。不宜与醋等酸性物质同时服用。作用与功能1、维持皮肤粘膜层的完整性,防止皮肤干燥,粗糙;2、构成视觉细胞内的感光物质;3、促进生长发育,有效促进健康及细胞发育,预防先天不足。促进骨骼及牙齿健康成长;4、维护生殖功能;5、维持和促进免疫功能。数据介绍,胡萝卜具有预防和抑制肺癌的作用。胡萝卜所含的胡萝卜素进入人体后,会转化成维生素A。每一个胡萝卜分子可以转化成2 个维生素A 分子。胡萝卜素是一种具有生理活性的物质,在动物体内可转化成维生素A,可治疗夜盲症,干眼病及上皮组织角化症;具有抑制免疫活性细胞过度反应,淬灭引起免疫抑制的过氧化物,维持膜的流态流动性,有助于维持免疫功能必需的膜受体状态,对免疫调节分子的释放起作用。通过上述机制,增强了淋巴细胞、巨嗤细胞或NK细胞等的抗肿瘤功能,尤其对肺癌、食道癌、鳞癌等有显著的预防和改善的效果,故具有防癌、抗癌、抗衰老作用,在医药工业上可做抗癌药;由于具有抵抗自由基的作用,对心血管病及其他慢性病有治疗作用。应用β—胡萝卜素作为一种食用油溶性色素,其本身的颜色因浓度的差异,可涵盖由红色至黄色的所有色系,因 此受到食品业相当热烈的欢迎。其非常适合油性产品及蛋白质性产品的开发,做食用橙色色素和营养强化剂,如:人造奶油、胶囊、鱼浆炼制品、素食产品、速食面的调色等。而经过微胶囊处理的β—胡萝卜素,可转化为水溶性色素,几乎所有的食品都可应用。另外,β—胡萝卜素在饲料、化妆品等方面有重要用途。
中国首款针对黑色素瘤、脑癌、神经胶质瘤等恶性肿瘤的硼药完成中试,最快30分钟杀死癌细胞,预计2023年用于临床.
使用色素以来源的不同,可分为两大类,分别是人工色素和天然色素。食用的人工合成色素通常以煤焦油来制成,各国或地区对对人工色素的使用有严格的限制。天然色素主要来源有三方面是植物,动物,和微生物。天然色素总的来说,安全性高,大部份是源自植物。但是以素食者来说,看见产品注明是天然或是有机,就以为是素食的话,是很不安全的。介定为天然色素的:胭脂虫红色E120, 紫胶红色素(Lac Red)、虾売色素等都是动物性的,素食者忌食。还有等同天然的分类,即是化学合成的色素,其成份和功效与天然提取物完全相同,所以视为等同天然(Nature Identical)看待。就以广受香港人欢迎的斋卤味来说,就分别有人工色素和天然色素。斋卤味可以分为红色的酸斋,黄色的咖喱斋,深色的素蚝油斋。素蚝油斋的色素由蚝油而来,蚝油的色来自焦糖,是深褐色,属于天然色素。咖喱斋的色来自咖喱粉,是香料本身的天然色素。红色的酸斋,可以用茄汁调色,但很多都用人工的红色,因为人工色素,价钱平,颜色靓,不易褪色,这一点后重要,如果容易褪色,食完之后,棚牙都染到红色,就不太好了。不过这些红色不会是花红粉,因为这是工业用的,香港是禁止用在食品上的。人工的煤焦油色素,香港准许用的有十七种左右,英国和欧盟大约二十种,美国约十种,日本十一种,中国有九种。中国准许使用的合成色素有:胭脂红,苋菜红,赤藓红,新红,红色40,柠檬黄,日落黄,靛蓝,亮蓝。不同的国家对食用色素都有自己的名称和编排系统,同一种色素在不同的国家或地区可能用不同的编号。例如,柠檬黄,又叫酒石黄,台湾叫食用黄色4号,美国叫黄色5号,日本又叫黄色4号,英国叫黄色17号,而欧盟叫E102。为咗避免混乱,国际上出咗一套颜色索引编号(Color Index),简称C I ,每一种色素的编号可以对照。所以现在我们在超市,都会发现一些货品有C I 号码。
[font=SimSun, STSong, &]首先请您看看正在使用的色素的配料表,如果您看到以下关键词,[/font][font=SimSun, STSong, &]代表您已经选用了合成食用色素:亮蓝、诱惑红、日落黄、柠檬黄、赤[/font][font=SimSun, STSong, &]藓红等。所以,您会开始关注更健康的选择:天然色素!接下来,我们[/font][font=SimSun, STSong, &]先来聊聊食用色素:[/font][font=SimSun, STSong, &]一、食用色素的安全分析和隐患:[/font][font=SimSun, STSong, &]1.食用色素的功能:改善食品色泽,引起人产生食欲,给人以味道的联[/font][font=SimSun, STSong, &]想,造成美味感。影响人们对风味、口感的感觉;判断食物是否新鲜的[/font][font=SimSun, STSong, &]依据之一。[/font][font=SimSun, STSong, &]2.食用色素的分类:天然色素、人工合成色素。[/font][font=SimSun, STSong, &]【天然色素】是由天然资源获得的食用色素,主要从动物和植物组织及[/font][font=SimSun, STSong, &]微生物(培养)中【提取】,其中植物性着色剂占多数。[/font][font=SimSun, STSong, &]1.天然色素对人体无毒害,安全性高。中国是目前世界上允许使用天然[/font][font=SimSun, STSong, &]色素最多的国家;[/font][font=SimSun, STSong, &]2.大部分天然色素有一定的营养成分。[/font][font=SimSun, STSong, &]3.天然色素能更好地模仿天然物的颜色,着色时的色调比较自然;[/font][font=SimSun, STSong, &]4.天然色素部分品种具有特殊的芳香气味,添加到食品中能给人带来愉[/font][font=SimSun, STSong, &]快的感觉;[/font][font=SimSun, STSong, &]5.成本高,坚牢度较差,强酸强碱、高温、光照等会影响其稳定性。[/font][font=SimSun, STSong, &]6.较难自行调配出任意色调; [/font][font=SimSun, STSong, &]7.在加工及流通过程中,受外界因素的影响易劣变;[/font][font=SimSun, STSong, &]8.由于共存成分的影响,有的天然色素有异味。[/font][font=SimSun, STSong, &]【合成色素】是人工化学合成方法所制得的有机与无机色素,主要是指[/font][font=SimSun, STSong, &]以煤焦油中分离出来的苯胺染料为原料制成的有机色素。[/font][font=SimSun, STSong, &]1.成本低、价格廉。具有色泽鲜艳,着色力强,易溶解,易调色。大多[/font][font=SimSun, STSong, &]以煤焦油为原料制成,其化学结构属偶氮化合物,可在体内代谢生成β[/font][font=SimSun, STSong, &]—萘胺和α—氨基-1-1萘酚,这两种物质具有潜在的致癌性。[/font][font=SimSun, STSong, &]2.人工合成色素不仅不能向人体提供必要的营养物质,而且有些还会危[/font][font=SimSun, STSong, &]害人体健康。比如,苏丹红能造成人类肝脏细胞的DNA突变。其他的人工[/font][font=SimSun, STSong, &]合成色素也会对人体造成伤害,会引发过敏、腹泻、结石,甚至有致突[/font][font=SimSun, STSong, &]变、致癌、致畸作用。[/font][font=SimSun, STSong, &] 总的来说,天然色素和合成色素各有优缺点,选择使用哪种色素需[/font][font=SimSun, STSong, &]要根据具体应用和需求来决定。在食品、医药、化妆品等领域,通常更倾[/font][font=SimSun, STSong, &]向于使用天然色素,因为它们更安全、更稳定。[/font]
广州中山大学研究发现天然病毒M1可杀灭癌细胞中新网广州10月13日电(许青青 蔡珊珊) 记者13日从广州中山大学获悉,该校中山医学院颜光美教授课题组研究发现天然病毒M1能选择性地感染并杀伤包括肝癌、结直肠癌、膀胱癌、黑色素瘤在内的多种体外培养的癌细胞,而对正常细胞无毒副作用。全球癌症发病率呈现快速增长态势,现有的治疗手段远远未能满足临床需求。颜光美教授课题组发现,M1病毒是一种从中国海南岛分离得到的天然病毒,能选择性地感染并杀伤包括肝癌、结直肠癌、膀胱癌、黑色素瘤在内的多种体外培养的癌细胞,而对正常细胞无毒副作用。整体动物实验表明,经尾静脉注射的M1病毒能显著富集在肿瘤组织并抑制肿瘤生长,正常器官则不受影响。除细胞水平及动物实验之外,课题组还使用临床标本离体活组织培养模型进一步证实了上述新型溶瘤病毒的有效性和特异性。据悉,该研究成果对阐明新型天然溶瘤病毒M1选择性杀伤肿瘤细胞的机制和研发新型靶向抗肿瘤药物都具有重要意义。相关资料:癌细胞增殖方式癌细胞是一种变异的细胞,是产生癌症的病源,癌细胞与正常细胞不同,有无限生长、转化和转移三大特点,也因此难以消灭。癌细胞由“叛变”的正常细胞衍生而来,经过很多年才长成肿瘤。“叛变”细胞脱离正轨,自行设定增殖速度,累积到10亿个以上我们才会察觉。癌细胞的增殖速度用倍增时间计算,1个变2个,2个变4个,以此类推。1912年8月13日,法国医生发现癌细胞。
用途: 流式细胞仪是对细胞进行自动分析和分选的装置。它可以快速测量、存贮、显示悬浮在液体中的分散细胞的一系列重要的生物物理、生物化学方面的特征参量,并可以根据预选的参量范围把指定的细胞亚群从中分选出来。多数流式细胞计是一种零分辨率的仪器,它只能测量一个细胞的诸如总核酸量,总蛋白量等指标,而不能鉴别和测出某一特定部位的核酸或蛋白的多少。也就是说,它的细节 分辨率为零。 流式细胞仪主要由四部分组成。它们是:流动室和液流系统;激光源和光学系统;光电管和检测系统;计算机和分析系统 参数测量原理荧光信号主要包括两部分:①自发荧光,即不经荧光染色细胞内部的荧光分子经光照射后所发出的荧光;②特征荧光,即由细胞经染色结合上的荧光染料受光照而发出的荧光,其荧光强度较弱,波长也与照射激光不同。自发荧光信号为噪声信号,在多数情况下会干扰对特异荧光信号的分辨和测量。在免疫细胞化学等测量中,对于结合水平不高的荧光抗体来说,如何提高信噪比是个关键。一般说来,细胞成分中能够产生的自发荧光的分子(例核黄素、细胞色素等)的含量越高,自发荧光越强;培养细胞中死细胞/活细胞比例越高,自发荧光越强;细胞样品中所含亮细胞的比例越高,自发荧光越强。 减少自发荧光干扰、提高信噪比的主要措施是:①尽量选用较亮的荧光染料;②选用适宜的激光和滤片光学系统;③采用电子补偿电路,将自发荧光的本底贡献予以补偿。仪器的操作和使用 ①打开电源,对系统进行预热; ②打开气体阈,调节 压力,获得适宜的液流速度;开启光源冷却系统; ③在样品管中加入去离子水,冲洗液流的喷嘴系统; ④利用校准标准样品,调整仪器,使在激光功率、光电倍增管电压、放大器电路增益调定的基础上,0和90散射的荧光强度最强,并要求变异系数为最小; ⑤选定流速、测量细胞数、测量参数等,在同样的工作条件下测量样品和对照样品;同时选择计算机屏上数据的显示方式,从而能直观掌握测量进程; ⑥样品测量完毕后,再用去离子水冲洗液流系统; ⑦因为实验数据已存入计算机硬盘(有的机器还备有光盘系统,存贮量更大),因此可关闭气体、测量装置,而单独使用计算机进行数据处理; ⑧将所需结果打印出来。热销细胞网是采用Accuri 型2号流式细胞仪,指示符®软件和工作站电脑供应在对市场价格领先的系统的一小部分的功能齐全的流式细胞仪的所有功能。在C6系统包括蓝色和红色激光,四色探测器和正向和侧向散射检测器加上软件,非常直观,你通常将和内收到您的Accuri小时运行的系统。
西达本胺通过信号通路调节促进癌细胞凋亡在我国,西达本胺已获批作为PTCL临床用药。西达本胺属于苯酰胺类化合物,是我国自主研发的首个亚型选择性口服HDACI,国家食品药品监督管理局已批准其用于临床试验,其选择性抑制I类HDAC1、2、3亚型和II类HDAC10亚型,可抑制肿瘤细胞增殖、促进凋亡,阻滞周期、引发DNA损伤,还可以增强抗肿瘤免疫反应。与其他抗肿瘤药物相比,西达本胺疗效好、选择性高、不良反应少。西达本胺可激活死亡受体途径和线粒体凋亡途径诱导细胞凋亡,其中最为主要的是线粒体凋亡途径,该途径受Bcl-2家族介导的细胞色素C释放通路调控。抗凋亡蛋白Bcl-2表达受到抑制,促凋亡蛋白Bax表达上调,使线粒体膜电位降低,细胞色素C释放到细胞质中,Caspase途径被激活,细胞发生凋亡。例如:西达本胺增强B淋巴瘤细胞组蛋白H3、H4 乙酰化水平,使线粒体膜电位降低随后激活Caspase 3,促进细胞凋亡;在肾癌中,它可以下调Bcl-2表达,上调Bax表达,随着药物浓度增加引起786-O 细胞凋亡。西达本胺可以调控ROS水平。HDACI可以上调ROS水平,导致DNA双链损伤。研究证明,西达本胺作用于白血病细胞后,诱导细胞内ROS产生,细胞凋亡增加[17]。此外,在胰腺癌细胞系中,西达本胺明显增强细胞内ROS的产生,上调γH2AX(DNA双链断裂的标志物)表达水平,诱发细胞DNA损伤。西达本胺通过调控细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(Cyclin-dependent kinases,CDKs)以及细胞周期蛋白依赖性激酶抑制剂(Cyclin-dependent kinases inhibition,CDKI)的表达阻滞细胞周期。例如,西达本胺使MM细胞系P21、P27的表达量增高,CDK4、CDK6、Cyclin D2表达量下降,阻滞MM细胞系于G1期[19]。在NK/T细胞淋巴瘤中,西达本胺上调P21表达,下调Cyclin E表达,诱导细胞发生G0/G1期阻滞,从而抑制细胞的增殖。
1.什么是色素:使各种物质产生各种颜色的物质就是色素,我们日常看到五颜六色的各种食品,就是因为含有各种不同的色素,所以我们才看到了各种不同颜色的食品,如果食品不含色素,那我们看到的食品都将是透明的或者白色的。2.食品中为何要添加色素:食品讲究色、香、味,颜色排在第一位,说明了色素在食品中的重要性,色、香、味俱佳的食品,能通过视觉感官刺激增强食欲,为了吸引人们的食欲,食品中添加了各种颜色来吸引消费者,据了解橙色的食品最能使人有食用的欲望。3.色素属于食品添加剂么:色素是食品添加剂,属于食品添加剂中的着色剂类别。4.色素的分类:食品中添加的色素分为人工合成色素和天然色素,各种色素通过红、黄、蓝三原色的不同比例的复配,可以生成无数种各种各样的颜色。5.色素的来源:合成色素是指用人工化学合成方法所制得的有机色素,主要是以煤焦油中分离出来的苯胺染料为原料制成的,按结构分,人工合成色素可分为偶氮类、氧蒽类和二 苯甲烷类色素;天然色素是指以植物、动物、微生物或矿物质为原料通过物理方法,再不改变色素分子结构的情况下提取分离出来的色素,从溶解性分可分为水溶 性、油溶性、醇溶性色素。6.色素的危害:合理合法使用各种色素是没有危害的。但大量研究表明过量食用合成色素会在肝脏沉积,可造成生育力下降、畸胎,有些合成色素在人体内可能转换成致癌物质, 可引起儿童发育障碍、多动症,在化妆品中使用有引起炎症,甚至癌变的可能;天然色素也不是没有危害,过量食用也会并不是就安全,比如连续大量食用柑橘类、 或萝卜之类的食品,会使或萝卜属类物质过量,造成皮肤泛黄等症状,不过停止食用一段时间就会自动恢复正常。7.我国允许在食品中使用合成色素种类:到2015年10月24日止GB2760里面允许使用的合成色素是:赤藓红及其铝色淀,靛蓝及其铝色淀,二氧化钛,蕃茄红,核黄素,β-胡萝卜素,喹啉 黄,亮蓝及其铝色淀,柠檬黄及其铝色淀,日落黄及其铝色淀,酸性红(又名偶氮玉红),苋菜红及其铝色淀,新红及其铝色淀,胭脂红及其铝色淀,氧化铁黑,氧 化铁红,诱惑红及其铝色淀等十七种。8.我国允许食品中使用天然色素种类:到2015年10月24日止GB2760里面允许使用的天然色素是:β-阿朴-8’-胡萝卜素,番茄红素,柑橘黄,黑豆红,黑加仑红,红花黄,红米红, 红曲红,红曲黄,天然β-胡萝卜素,花生衣红,姜黄素,焦糖色,金樱子棕,菊花黄浸膏,可可壳色,辣椒橙,辣椒红,辣椒油树脂,蓝靛果红,萝卜红,落葵 红,玫瑰茄红,密蒙黄,葡萄皮红,桑葚红,沙棘黄,酸枣色,天然苋菜红,橡子壳棕,胭脂虫红,胭脂树橙,杨梅红,叶黄素,叶绿素铜,叶绿素铜钠盐,叶绿素 铜钾盐,玉米黄,越橘红,藻蓝,栀子黄,栀子蓝,植物炭黑,紫草红,紫甘薯色素,紫胶红,高粱红,甜菜红等四十八种。9.色素的功能或生理活性:几乎所有人工合成色素都不能给人体提供营养物质,也没有什么有益的生理功能;部分天然色素本身也是保健品原料,对人体有保健作用和一定的生理功能,比如 番茄红素、胡萝卜素、花青素等的抗氧化、去除自由基功效、叶黄素对视黄斑的保护修复作用、姜黄素的消炎生肌、抗肿瘤功效等。
[size=14px] [/size] [size=14px]黑色素合成是一个复杂过程,由三种主要的色素合成酶催化:酪氨酸酶(TYR)、TYR相关蛋白1(TYRP1)和多巴胺互变异构酶(DCT)。TYR、TYRP1和DCT属于TYR蛋白家族(TYRs)。成熟的TYRs在胞内被转运定位于黑色素体中,进而促进合成黑色素。虽然这三种酶都参与黑色素合成,但只有TYR是黑色素生成所必需的。[/size] [size=14px] [/size] [size=14px]淫羊藿中一种含量高、低性毒的黄酮类成分——朝藿定B(EB),并初步证明了EB是一种黑色素生成强诱导剂和TYRs激活剂。然而,尚不清楚EB促进黑色素合成的具体机制。[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]1)首次对EB在色素合成药理活性进行了探究;[/size] [size=14px]2)通过体内外多种色素脱失模型上评估EB色素合成作用;[/size] [size=14px]3)EB从表达、活性和稳定性三方面靶向TYRs,从而发挥色素合成作用。[/size] [size=14px]1、EB促进黑色素产生[/size] [size=14px] [/size] [size=14px] [/size] [size=14px]作者首先使用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)对淫羊藿提取物进行鉴定,朝藿定B(EB)是主要生物活性成分,对黑素生成和TYR激活表现出最高的效果。随后通过不同浓度(25、50和100μM)的EB处理两种黑色素瘤细胞系并检测黑色素含量,IBMX为阳参,发现EB以剂量依赖性方式显著增加细胞内黑色素含量(图1)。[/size] [size=14px]图片[/size] [size=14px]图1 EB以浓度依赖方式促进黑色素产生[/size] [size=14px]进一步在不同时间点(0、12、24、48和72小时)检查黑色素含量,发现EB以时间依赖性方式诱导的黑色素生成(图2)。[/size] [size=14px]图片[/size] [size=14px]图2 EB以时间依赖方式促进黑色素产生[/size] [size=14px]2、EB促进黑素体生物合成[/size] [size=14px]接着收集并检查了人体皮肤组织样本进一步验证 EB的促黑色素生成作用,发现EB在原代黑素细胞、人类皮肤器官培养物中诱导显著的黑色素生成作用。黑色素在黑素体中合成并储存,然后分布到周围的角质形成细胞,黑素体的数量、大小和成熟阶段反映了黑素细胞的黑色素生成能力。作者发现EB 治疗组中存在比对照组更多的黑素体,此外EB通过增加黑素体数量并促进黑素体成熟来刺激黑色素生物合成。接着对EB处理和未处理的人类原代黑素细胞进行了转录组分析,差异基因显著富集在“黑色素生物合成过程”、“黑素体/黑素体膜”等,这些数据证实了 EB 在黑色素生物合成和黑素体形成中的调节作用(图3)。[/size] [size=14px]图片[/size] [size=14px]图3 EB增加黑色素体的数量和成熟促进黑色素合成[/size] [size=14px]3、EB增加TYR表达[/size] [size=14px]为了阐明EB诱导黑素生成的机制,作者研究了TYR的参与,发现EB诱导的TYR在mRNA和蛋白质水平上的双重正向调节。MITF是众所周知的TYR关键调节因子,也是黑素生成的主要调节因子。作者发现EB刺激后MITF的mRNA和蛋白表达水平显著上调,表明EB通过经典的 MITF 依赖性机制上调黑素生成中TYR的表达。此外,EB可以影响转运相关基因的mRNA表达,特别是OCA2和SLC45A2,表明EB在黑素体生物发生和成熟中调节复杂的过程,这可能解释黑素体增加的变化黑素体中黑色素的数量和含量(图4)。[/size] [size=14px]图片[/size] [size=14px]图4 EB增加TYR表达[/size] [size=14px]黑色素的产生是由多种信号系统启动和调节的,作者接着研究了EB对黑素生成的上游信号通路的影响,发现cAMP水平和PKA表达不受EB影响,表明经典的cAMP-PKA-MITF色素沉着途径不参与EB诱导的黑素生成。相比之下,PI3K/AKT 信号通路的级联,以及MAPK途径受到影响。这些数据证明EB 控制多种色素途径来影响黑色素的产生(图5)。[/size] [size=14px]图片[/size][size=14px]图5 EB影响多条信号通路[/size] [size=14px]4、EB促进TYR活性[/size] [size=14px]在黑色素合成中,TYR是催化限速步骤(L-酪氨酸羟基化为L-多巴)的关键酶。作者接着研究了EB对TYR催化活性的影响,发现EB体外可以加速TYR与底物左旋多巴的反应速率,在细胞内以剂量依赖性方式显著增强TYR活性。进一步在斑马鱼和小鼠中开发了两种使用TYR抑制剂的脱色模型,确定了EB可以作为TYR激活剂并在体内发挥重新色素沉着作用。此外,在HQ引起的色素脱失模型中, EB有效地重新激活了皮肤TYR活性。数据表明EB通过在体外和体内促进TYR活性来发挥色素沉着作用(图6)。[/size] [size=14px]图片[/size] [size=14px]图6 EB促进TYR活性来发挥色素沉着作用[/size] [size=14px]5、EB对抗莫诺苯宗诱导的色素脱失[/size] [size=14px]莫诺苯宗是一种临床局部脱色剂,可以通过TYR和黑素体降解机制诱导白癜风样色素脱失。因此,作者使用单苯宗来研究EB是否发挥再色素作用并影响TYR和黑素体异常降解,发现EB 显著改善了两种黑色素瘤细胞和人类原代黑素细胞中单苯宗诱导的黑色素生成功能障碍,EB治疗可有效防止培养皮肤组织中单苯宗诱导的TYR和黑素体减少。此外,经单苯宗处理后,TYR、TYRP1、DCT和Melan-A的蛋白表达降低,而在用单苯宗和EB共同处理期间,TYR和Melan-A的表达显著上调。值得注意的是,单苯酮诱导的黑素生成抑制和TYR表达减少并不依赖于TYR活性抑制或MITF、TYR、TYRP1和DCT mRNA 表达水平的下降(图7)。[/size] [size=14px]图片[/size] [size=14px]图7 EB对抗莫诺苯宗诱导的色素脱失[/size] [size=14px]6、EB提高TYR和TYRP1稳定性[/size] [size=14px]莫诺苯宗会导致TYR降解,但不影响TYR转录水平。为了研究EB是否对TYR稳定性有影响,作者使用CHX抑制蛋白质合成,以排除EB本身,诱导新的合成TYR。WB发现莫诺苯宗显著降低了TYRs的稳定性,而EB处理可以有效防止这种情况,这表明EB改善了莫诺苯宗诱导的TYRs稳定性。进一步机制研究发现EB通过防止莫诺苯宗诱导的异常 TYR、TYRP1 形成、在内质网中的保留以及泛素-蛋白酶体降解系统的增强来提高 TYR、TYRP1 稳定性(图8)。[/size] [size=14px]图片[/size] [size=14px]图8 EB提高TYR和TYRP1稳定性[/size] [size=14px]7、EB 改善小鼠单苯酮诱导的色素脱失[/size] [size=14px]最后,作者建立了40%莫诺苯宗诱导的色素脱失模型,并同时用EB处理小鼠,探讨EB是否对单苯酮处理的小鼠体内具有再色素沉着功能,结果发现用单苯酮和EB共同治疗的小鼠在不同程度上明显改善了脱色的背毛形成,此外,单苯宗对皮肤TYR活性具有抑制作用,而与EB联合治疗可以促进皮肤TYR活性,此外,TYR、TYRP1、DCT和PMEL的mRNA水平被证实不受单苯宗影响,强调单苯宗诱导的脱色与转录调控无关。同时,EB增加了皮肤TYR、TYRP1、DCT和PMEL的mRNA表达。因此,EB可以改善经单苯酮处理的C57BL/6小鼠的TYR降解和色素脱失(图9)。[/size] [size=14px]图片[/size] [size=14px]图9 EB改善小鼠单苯酮诱导的色素脱失[/size] [size=14px]总结[/size] [size=14px]研究发现EB在体内外表现出良好的色素合成效果,其机制研究为:1)EB通过调节GSK3β/β-catenin、p-p70S6激酶、MAPK等信号通路增加TYR的表达,并增加黑素体数量和促进黑素体成熟;2)EB促进TYR的活性;3)EB抑制泛素-蛋白酶体途径增强TYR和TYRP1的稳定性。这表明EB可靶向TYRs发挥色素合成作用(图10)。[/size]
最近碰到化妆品工厂出口US 的化妆品,因为添加了FDA禁止的色素,货被扣在海关了,在这跟大家分享下US 化妆品色素的要求。美国化妆品色素没有禁用清单,只有允许使用清单,除了这个清单意外的都是禁止使用的。详细的内容和要求,可以查US FDA 网站:http://www.fda.gov/ForIndustry/ColorAdditives/ColorAdditiveInventories/default.htm
食品中的着色剂 Colorants in Foods食用色素是指本来存在于食物或添加剂中的发色物质。 食用色素分天然食用色素和合成食用色素,天然食用色素是指天然食物中的色素物质,由于其对光、热、酸、碱等敏感,所以在加工、贮存过程中很容易褪色和变色,影响了其感官性能。因此在食品中有时添加合成色素。 色素的分类①来源:天然色素和人工合成色素;动物色素(红血素、虾青素等)、植物色素(叶绿素、胡箩卜素、花青素等)、微生物色素(红曲色素);②溶解性:脂溶性和水溶性;③结构:吡咯类色素(叶绿素、红血素等)、多烯类(类胡箩卜素)、酚类(花青素、儿茶素、花黄素等)、醌酮类(红曲色素、姜黄素、虫胶色素等)、其他。合成色素的特点: 色泽鲜艳、色调多、性能稳定、着色力强、坚牢度大、调色易、使用方便成本低廉、应用广泛用量和使用范围受到严格限制 天然色素的特点: 在色素含量和稳定性等方面不如合成色素因多来自水果、蔬菜和动植物,因而对人体的安全性较高能更好地模仿天然物的颜色,色调较自然成本较高保质期短天然色素直接来自动植物,除藤黄外,其余对人体无毒害。但国家对每一种天然食用色素也都规定了最大使用量,以策安全。目前允许使用的天然色素有姜黄、红花黄色素、辣椒红色素、虫胶色素、红曲米、酱色、甜菜红、叶绿素铜钠盐和β—胡萝卜素。天然色素安全上优于合成色素并可使用于所有食品种类。因此认为,为了给食品添加色素,最好选用天然色素,即使成本提高,消费者还是乐意接受的。

http://ng1.17img.cn/bbsfiles/images/2011/04/201104240015_290546_2185349_3.jpg用色素来给食物染色不是现代食品工业的创造——在中国,早就有用蔬菜汁来染色鸡蛋羹的做法。不过,合成色素的应用,确实是现代食品工业发展的结果。跟其他现代食品工业的技术和成分一样,合成食品色素自从诞生那天就充满了争议。
感受态细胞的制备(一)制备新鲜或冷冻的大肠杆菌感受态细胞 下述操作方案是由Hanahan(1983)提供的,所制备的大肠杆菌DHl、DH5和MM249感受态细胞培养物能使每微克超螺旋DNA以≥5x108转化菌落的频率进行转化,其他大多数大肠杆菌菌株的最高转化率大约只有前述菌株的1/10-1/5。尽管如此,实际上对所有克隆方面的用途来说,这已绰绰有余。一些大肠杆菌菌株(如MC1061)不适于此法。下列有3个因素对于获得持续高的转化频率来说是至关重要的:(1)转化缓冲液中试剂的纯度 务必使用所能得到的最高质量的试剂,这些试剂应分装成小份,避光保存于冷处。(2)细胞的生长状态 由于一些不清楚的原因,直接用贮存于-70┴冰冻培养基中的贮存原种搠种而进持培养的细菌,所得到的转化效率最高,不应使用在实验中的贮存原咱接种崦进持培养的细菌,所得到的转效率最高,不应使用在实验室中连续传代,贮存于4℃或贮存于室温的培养物。(3)玻璃和塑料器皿的清洁度 痕量的去污剂或其他化学物质的存在可能大大地降低细菌的论效率,所以最好拨出一批玻璃器皿专用于制备感受态细菌,而不作它用。这些玻璃器皿应用手洗刷,再灌满纯水(Milli-Q级或与其相当的级别),然后高压灭菌,临用前方把水倒掉。细心操作的话,几乎总是可以获得转化效率高的感受态细胞,每微克超螺旋DNA可能得到5x107-1x108个转化菌落。然而甚至经验最为丰富的工作者也不可能保证持有必要用标准的螺旋质粒DNA制品来检测每一批新的感受态细胞的转化效率。制备感受态细胞前,先制备一大批黧的螺旋质粒DNA,分装成许多小份贮存于-70℃。这些标准制品可用来检验每一批新的感受态细胞的转化效率,并检查每一个实验的转化效率。设立这样一个阳性对照后,如果某一次实验得不到转化菌落,就可以根据对照的情况查明宣究竟是感受态细菌方面有庇漏,还是DNA制品间有差异。分装的感受态细菌可在-70℃保存几个月而转效率无明显下降。1)用无菌铂丝直接蘸取冻存有大肠杆菌DHl株(或DH5株、MM249株原种)(贮存于-70℃的冻培养基上,见附录A),在SOB琼脂平板表面划线, 于37℃培养16小时。将冰冻的细菌融化,铂丝在冻存细菌原种的表面划过时,已带上足量的细菌,因此一管冻存细菌原种可使用多次。2)将4-5个分隔良好的菌落转移到1ml含20mmol/L MgSo4的SOB中,菌落直径为1-2mm。中速振荡使细菌分散,然后在1L锥瓶中用30-100ml含20mmol/LMgSO4的SOB稀释培养物。3)于37℃将细菌培养0.5-3.0小时,为达到高效转化,活细胞数务必少于108细胞/ml,可每隔20-30分钟测定OD600值来检测培养物的生长情况。在菌株与菌株之间,OD600值和每毫升中活细胞数间的关系变化很大,因此有必要通过测量特定大肠杆菌菌株的生长培养物在生长周期的不同时相的OD600值,并将各稀释度的培养物铺于无抗生素的LB琼脂平皿以计算每时相的活细胞数,从而使分光光度读数得到标化。4)在无菌条件下将细菌转移到一个无菌、一次性使用的、用冰预冷的50ml聚丙烯管(Falcon 2070)中,在冰上放置10分钟,使培养物冷却至0℃。切记:下述所有步骤均需无菌操作。5)于4℃用Sorvall GS3转头(或与其相当的转头)以4000转/分离心10分钟, 回收细胞。6)倒出培养液,将管倒置1分钟以使最后残留的痕量培养液流尽。7)用约20ml(每个50ml管)用冰预冷的转化缓冲液(对于TFB''见表1.3;对于FSB,可参见表1,4)轻轻振荡,重悬沉淀(若制备需立即使用的感受态细胞可用TFB:若制备需要贮存于-70℃的感受态细胞则用FSB),将重悬细胞冰浴10分钟。8)于4℃用Sorvall GS3转头或与其相当的转头)以4000转.分离心10分钟,回收细胞。9)倒出培养液,将管倒置1分钟以使最后残留的痕量培养液流尽。10)用4ml(每个50ml管)用冰预冷的TFB或FSB轻轻振荡重悬沉淀。按步骤11)a给出的操作程序制备立即使用的感受态细胞,而步骤11)b制德贮存于-70℃留待以后使用的感受态细胞。11)a.新鲜感受态细胞的制备a)将140μl DnD溶液加到每一悬液的中心,立即轻轻旋转以混匀悬液,然后在冰上放置15分钟。DnD溶液二硫苏糖醇(DTT) 1.53gDMSO 9.0ML1mol/L乙酸钾(pH78.5) 100μl水至 10MLDnD溶液作可耐受人机溶剂的Millex SR膜(Millipore)过滤除菌,将DnD溶液分装成160μl小份放入0.5ml的无菌微量离心管中,密封管口,贮存于-20℃。DMSO的氧化产物,据推测可能是二甲硫醚,是转化的掏物。为避免这个问题,应购买质量最好的DMSO。应将所购试剂分装成10ml小份,放入无菌试管,密封管口,贮存于-70℃。每小份只用1次,用后弃去。1mol/L乙酸钾(pH7.5)的配法。b)每管再加140μlDnD溶液,轻轻旋转混匀之,将悬液置于冰上,再放15分钟。c)将小份悬液分装到冷却的无菌聚丙烯管(Falcon 2059''17x100mm)中,将管置于冰上。就大多数克隆方面的用途来说,50μl感受细胞悬液已绰绰有余。然而,如需要更大量的转化菌落(如构建cDNA文库),每小份感受态细胞的量可能需要加大些.加入DNA后,于42℃短暂加热感受态细胞,这是一个关键步骤,务必以正确的升温速度使细胞加温到正确的温度。下面给出的所有时间和温度是用Falcon 2059型管获得的数据,其他类型的管未必可产生相同的结果。b.冻存的感受态细胞的制备a)每4ml重悬细胞加140 μl DMSO,轻轻旋转混匀之,将悬液置冰上15分钟。b)每份悬液再加140μl DMSO,轻轻旋转混匀之,重新放入冰浴中。c)迅速将悬液分装到冷却的无菌的微时离心管中,封紧管口,没入液氮中快速冰冻感受态细胞。贮存于-70℃备用。就大多数克隆方面的用途来说,50μl感受态细胞悬液已绰绰有余。然而,如需要更大量的转化菌落(如构建cDNA文库),每小份感受态细胞的量可能需要加大些。d)需要时,从-70℃冰箱中取出一管感受态细胞,把管握于手民主,融化细胞。细胞一经融化,立即把管转移至冰浴中,在冰上放置10分钟。e)用一冷却的无菌吸头把感受态细胞转移到冷却的无菌聚丙烯管中(Falcon2059''17x100mm)中,放置在冰浴上。加入DNA后,于42℃短暂加热感受态细胞,这是一个关链步骤,务必以正确的升温速度使细胞如温到正确的温度。下面给出的所有时间和温度是用Falcon 2059试管获者的数据,其他类型的管未必可产生相同的结果。12)将DNA加入到感受态细胞中,轻轻旋转几认混匀内容物。在冰上放置30分钟。为得到最佳结果,DNA溶液的体积不应超过感受态细胞体积的5%。转化体的数量相对于所加入的DNA量近妣例地增加,直至系统达到饱和,尽管感受态细胞在不同批次之间有一些差异,50μl感受态细胞通常可被约lng超粒DNA所饱和。虽然再加DNA也不影响转化体的总产量,但使用过多的DNA将降低系统的效率(以每微克DNA所获转化体的数量来衡量)。当所转化的DNA很难得时(如用从相对难得的样品中提取mRNA而合成的cDNA),这就显得格外重要。为最大限度地提高转化菌落的数目,可把现有DNA分置于几小份感受态细胞中,以期系统不致饱和。试验中一定包括下面的对照:a.加入已知量的标准超螺旋质粒DNA制品的感受态细胞。b.完全不加质粒DNA的感受态细菌。13)将管放入预加温到42℃的循环水浴中放好的试管加架上,恰恰放置90秒,不要摇动试管。14)快速将管转移到冰浴中,使细胞冷却1-2分钟。15)每管加800μl SOC培养基(见附录A)。用水浴将培养基加温至37℃,然后将管转移到37℃摇床上,温育43分钏使细菌复苏并表达质粒编码的抗生素抗性标记基因。为最大限度地提高转化效率,复苏期中应温放地摇动细胞(转速225转/分)。16)将适当体积(每个90m平板达200μl)已转化的感受态细胞转移到含20mmol/L MgSO4和相应抗生素的SOB琼脂培养基上。如培养物体积太小(〈10μl),可再加肉汤培养基,用一无菌的弯头玻棒轻轻地将转化的细胞涂到琼脂平表面。如在一个90mm平板上铺200μl以上的感受态细胞,应离心浓缩细胞(于室温用Sorvall SS34转头(或与其相当的转头)以4000转/分离心10分钟),然后用适量SOC轻轻重悬细胞。如用四环素抗性作为选择标记,全部的转化混合物可以铺在一个单独的平皿上(或铺在软琼脂中)。然而如选用氨苄青霉素抗性,则只能将一部分培养物(根据实验决定)铺在单独的平皿上,氨苄青霉素抗性菌落数的曾加与平皿上所加细菌数的增加并无线性比例关系,这可能是因为被抗生素杀死的细胞可释放生长抑制物质的缘故。\par 17)将平板置于室温直至液体被吸收。18)倒置平皿,于37℃培养,12-16小时后可出现菌落。如检查氨苄青霉素抗性,用转化细胞铺平板时密度应较低(每个90mm平板不超过104菌落),于37℃培养平板时不应超过20小时。氨苄青霉素抗性的转化体可将β-内酰胺酶分泌到培养基中,迅速灭活菌落周围区域中的抗生素。这样,铺平板时懊度太高或培养时间太长都会导致出现对氨苄青霉敏感的卫星菌落。在造
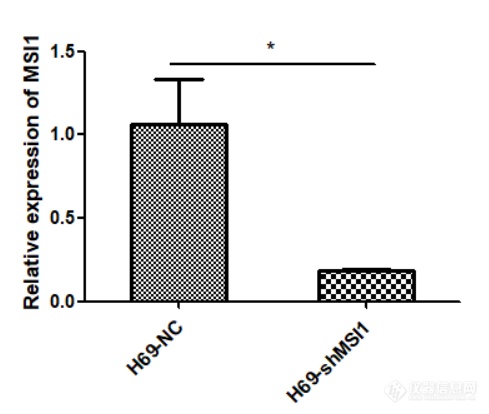
MSI1在人小细胞肺癌细胞系中的表达及MSI1低表达细胞模型的构建实验方法与步骤 细胞的复苏 1.复苏前的准备:打开水浴锅,设置温度37℃;紫外线将超净台消毒30 min;配置完全培养基。 2.将要复苏的H69、H446细胞从液氮取出,用一次性PE手套包裹冻存管,迅速放入水浴锅中震荡,使其快速融化。 3.在15 mL离心管中加入5 mL完全培养基及融化的细胞悬液,900 r/min离心8分钟,弃去上清,得到细胞沉淀。 4.在25 cm2的培养瓶中加入5 mL完全培养基,并用1 mL培养基将沉淀的细胞重悬并加入准备好的培养瓶中,放入CO2恒温培养箱中继续培养。 细胞的传代 1.选取在悬浮培养瓶中生长至90%的H69细胞,用移液枪将细胞悬液移入15 mL离心管中,选取在贴壁培养瓶中生长至90%的H446细胞,用PBS溶液将细胞吹至漂浮,并移入15 mL离心管中,两种细胞均900 r/min离心8分钟,弃掉上清。 2.分别在3个25 cm2培养瓶中加入5 mL完全培养基,在细胞沉淀中加入3 mL培养基并充分吹打混匀,将3 mL细胞悬液平均放入3个培养瓶中并混匀,放入培养箱中继续培养。 MSI1低表达细胞模型的构建1.从-80℃冰箱取出慢病毒载体冰上融化,将慢病毒用空白培养基稀释为滴度2×108,充分混匀,准备好病毒感染增强液。2.将25 cm2悬浮培养瓶中H69细胞移入15 mL离心管中并用移液枪充分吹打混匀,取其中500 μL放入细胞计数仪中计数,取出1.2×106个细胞置入新的离心管中,加入空白培养基至6 mL。3.在12孔板中以MOI=10的病毒滴度进行感染,培养16 h。4.16 h后将细胞悬液离心,换成不加双抗的完全培养基继续培养,72 h后观察荧光。5.待细胞生长至状态良好,加入1 μg/mL嘌呤霉素筛选至90%以上细胞均产生荧光。荧光实时定量PCR(Q-PCR)检测MSI1在mRNA水平的表达 总RNA的提取分别将细胞离心,PBS缓冲液清洗2次,900 r/min离心8 min,得到细胞沉淀。分别加入1 mL Trizol,用移液枪吸打至细胞完全破裂,加入200 μL氯仿,震荡30 s,室温静置10 min,以有效分离无机相和有机相,随后4℃,12,000 g/min离心15 min。将上清移至高压过的1.5 mL离心管中,加入与上清等体积的异丙醇,轻柔颠倒震荡数次,室温静置10 min,随后4℃,12,000 g/min离心10 min。弃去上清,加入75%无水乙醇,4℃,12,000 g/min离心5 min。弃去上清,沉淀置于冰上自然干燥,但不可完全干燥。用30 μL DEPC水溶解总RNA。用NanoDrop One超微量分光光度计进行定量和纯度检测,用1%琼脂糖凝胶电泳进行完整性检测。 cDNA的合成逆转录体系试剂名称使用量模板RNAMonScriptTM 5*RT111 All-in-One MixMonScriptTM dsDNaseNuclease-Free Water1 μg4 μL1 μLup to 20 μL将混合液轻柔吹打混匀,瞬时离心,37℃ 2 min,55℃ 15 min,85℃ 5 min,得到cDNA。 Q-PCR检测MSI1 mRNA的表达GAPDH引物序列:Forward primer:Reverse primer:5’-GGTCGGAGTCAACGGATTTG-3’5’-ATGAGCCCCAGCCTTCTCCAT-3’MSI1引物序列:Forward primer:Reverse primer:5’-GAACCATCCCGTCCTGTATCA-3’5’-GAAACCATGAAGCCCCAACC-3’Q- PCR反应体系:Q-PCR反应体系试剂名称使用量cDNAForward primerReverse primerMonAmpTM Chemhs qPCR MixLow ROXNuclease-Free Water50 ng0.2 μL0.2 μL5 μL0.1μLup to 10 μLQ-PCR反应程序: Q-PCR反应程序反应步骤反应温度反应时间循环次数预变性95℃10 min1变性95℃10 s40退火55-65℃10 s延伸72℃30 s溶解曲线溶解曲线按仪器默认溶解曲线 结果采用t检验,用Graphpad prism5计算MSI1在mRNA水平的表达量。 Western blot检测MSI1在蛋白水平的表达总蛋白的提取将对数生长期的H69-NC、H69-shMSI1细胞移入15 mL离心管中,900 r/min离心8 min,并用PBS溶液洗涤2次,以去除培养基中血清影响。分别加入含PMSF的蛋白裂解液100 μL,与细胞充分混匀。4℃裂解1小时后,4℃,12000 g/min离心15 min,将上清移至新的离心管中,得到细胞总蛋白。 BCA法测定蛋白浓度 将Solution A和Solution B以50:1的体积比配置BCA工作液,充分混匀。将2 mg/mL蛋白标准品等比稀释,最小浓度为125 μg/mL,并分别与配置好的200 μL BCA工作液混匀,铺入96孔板中。37℃孵育30 min,测定波长562 nm处OD(光密度值)值,并绘制蛋白标准曲线。取适量H69-NC、H69-shMSI1细胞总蛋白,20:1稀释后,与200 μL BCA工作液混合均匀。37℃孵育30 min,用酶标仪测定波长562 nm处OD值,根据标准曲线计算出样品中的蛋白浓度。Western blot检测MSI1蛋白的表达 分别收集对数生长期的H69-NC、H69-shMSI1细胞总蛋白,加入相应体积4×SDS Loading Buffer,沸水浴煮5 min,分别取40 μg细胞总蛋白,在提前配制的10% SDS-PAGE分离胶电泳。电泳结束后,将蛋白转至PVDF膜上。用含5%脱脂牛奶的封闭液 37℃封闭1.5 h。弃去封闭液,用TBST缓冲液洗3次,每次10 min,加入MSI1兔单克隆抗体(1:1000),并以GAPDH为内参,加入GAPDH鼠单克隆抗体(1:5000);4℃孵育过夜,次日用TBST缓冲液洗膜3次,每次10 min。在敷有MSI1抗体的膜上加入辣根酶标记山羊抗兔IgG(1:5000),在敷有GAPDH抗体的膜上加入辣根酶标记山羊抗鼠IgG(1:5000),37℃敷育1 h,TBST 缓冲液洗膜3次,每次10 min。用增敏化学发光底物试剂检测,暗室曝光显影。在GAPDH表达量相同的情况下比较MSI1的表达情况。多次重复,应用ImageJ计算出各个蛋白条带的灰度对比,结果采用t检验,并应用Graphpad prism5作出柱状图。 MSI1在人小细胞肺癌细胞系中高表达 提取人正常肺上皮细胞BEAS-2B、小细胞肺癌细胞H446、H69的RNA,利用Q-PCR检测MSI1在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图2-1显示,MSI1在小细胞肺癌细胞系H446、H69中的表达远远高于正常肺上皮细胞。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428158_6718_5389809_3.png1 MSI1 mRNA在小细胞肺癌细胞系中的表达(**代表与正常肺上皮细胞相比,小细胞肺癌细胞MSI1表达量增高具有统计学意义,P0.01)。 MSI1低表达细胞模型的构建本实验选取人小细胞肺癌细胞系H69细胞,使用慢病毒感染技术敲低MSI1的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选,然后在荧光显微镜下观察如图2-2,可见H69-NC、H69-shMSI1细胞均产生绿色荧光,表明人小细胞肺癌H69细胞慢病毒感染成功。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428036_9359_5389809_3.png MSI1低表达细胞模型的构建。应用shMSI1慢病毒载体感染H69细胞,利用嘌呤霉素筛选,并在荧光显微镜下观察。 荧光实时定量PCR(Q-PCR)检测MSI1的mRNA表达水平提取对数生长期的H69-NC、H69-shMSI1细胞的RNA,并测量RNA浓度及完整性,用1%琼脂糖凝胶电泳检测完整性可见,RNA有三条带,从上到下依次为28S rRNA、18S rRNA和5S rRNA,且28S rRNA的亮度是18S rRNA的两倍。用NanoDrop One超微量分光光度计测定人总RNA的A260/A280的值为2.00左右,A260/A230的值为2.30左右,说明提取的RNA质量和完整性很好,可以用于后续试验。利用Q-PCR技术检测各细胞内MSI1 mRNA相对表达量,结果如图2-3所示,与对照组相比,H69-shMSI1组MSI1 mRNA表达量明显降低(P0.01),抑制率约为75%。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434330_8277_5389809_3.png MSI1在RNA水平的表达(***代表与对照组相比,H69-shMSI1组MSI1 mRNA表达量下降具有统计学意义,P0.001)。 Western blot检测MSI1蛋白表达水平将BSA标准品(2 mg/mL)进行等比稀释,最低浓度为125 ug/mL,并应用BCA蛋白质浓度测定试剂盒测定在波长562 nm下的OD值,以OD值为纵坐标,对应蛋白质浓度(μg/mL)为横坐标,绘制标准蛋白曲线如图2-4所示。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201435248_4142_5389809_3.png图2-4 标准蛋白曲线分别提取H69-NC、H69-shMSI1细胞的总蛋白质,利用Western blot技术检测各细胞内MSI1蛋白的表达情况。结果如图2-5所示,与对照组相比,MSI1蛋白表达在H69-shMSI1细胞中明显降低。表明MSI1低表达细胞模型构建成功。ahttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201437240_855_5389809_3.pngbhttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434999_3303_5389809_3.png图2-5 MSI1蛋白水平表达:(a)MSI1蛋白表达条带;(b)MSI1蛋白的相对表达量。(*表示与对照组相比,H69-shMSI1组MSI1蛋白表达下降具有统计学意义,P0.05)。首先验证MSI1在小细胞肺癌细胞系中的表达情况,利用Q-PCR技术检测在RNA水平,MSI1在肺正常上皮细胞及小细胞肺癌细胞系中的表达,结果显示,MSI1在小细胞肺癌细胞中的表达明显高于正常肺上皮细胞。随后以人经典型小细胞肺癌细胞系H69细胞为研究对象,构建MSI1低表达细胞模型,应用shMSI1慢病毒载体感染H69亲本细胞,同时设置对照组除外病毒本身对细胞产生的影响,利用Q-PCR及Western blot验证MSI1在RNA及蛋白水平的表达,结果显示,H69-shMSI1组MSI1的mRNA及蛋白的表达明显降低。表明MSI1低表达细胞模型构建成功,可以用于后续实验。
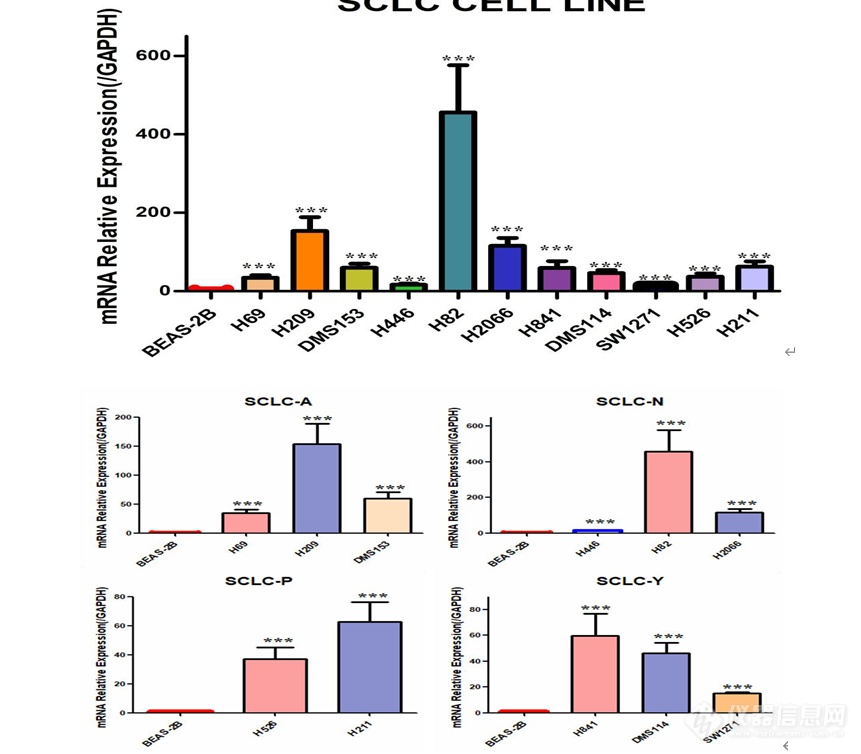
[font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]在人小细胞肺癌细胞系中的表达及[/color][color=#000007] [/color][font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]低表达[/color][color=#000000]细胞模型的构建[/color]MSI1 在人小细胞肺癌细胞系中高表达提取人正常肺上皮细胞 BEAS-2B,SCLC-A 型 H69、H209、DMS153 细胞,SCLC-N 型 H446、H82、H2066 细胞,SCLC-P 型 H526、H211 细胞,SCLC-Y 型 H841、DMS114、SW1271 细胞的 RNA,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 检测 MSI1 在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图 2-1 显示,MSI1 在小细胞肺癌细胞系中的表达远远高于正常肺上皮细胞,综合分析,选取了 H69、H82、H526 及 SW1271 细胞用于后续实验。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326443512_4838_5389809_3.png[/img]图 小细胞肺癌细胞系中 MSI1 mRNA 的表达(***P0.001)MSI1 低表达细胞模型的构建本实验选取人小细胞肺癌细胞系 H69、H82、H526、SW1271 细胞,使用慢病毒感染技术敲低 MSI1 的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选, 然后在荧光显微镜下观察如图 , 可见 H69-NC 、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2细胞均产生绿色荧光,表明人小细胞肺癌细胞慢病毒感染成功。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326451025_2121_5389809_3.png[/img]图 慢病毒感染后 4X 荧光显微镜下图片(H69、H82、H526、SW1271 明场及荧光照片) 敲低 MSI1 后转录和蛋白水平验证分别提取对数生长期的 H69-NC 、H69-shMSI1-1 、H69-shMSI1-2 、H82-NC 、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞的 RNA 和蛋白,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 技术分别检测各细胞 MSI1 mRNA 相对表达量,结果如图 所示,与对照组相比,H69-shMSI1-1、 H69-shMSI1-2 、 H82-shMSI1-1 、 H82-shMSI1-2 、 H526-shMSI1-1 、 H526-shMSI1-2 、SW1271-shMSI1-1、SW1271-shMSI1-2 组 MSI1 mRNA 表达量明显降低(P0.01), 抑制率约为 75%。利用 Western blot 技术检测各细胞内 MSI1 蛋白的表达情况。结果如图 2-3 所示,与对照组相比,MSI1 蛋白表达在 H69-shMSI1-1、H69-shMSI1-2、H82-shMSI1-1、H82-shMSI1-2、H526-shMSI1-1、H526-shMSI1-2、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞中明显降低。表明 MSI1 低表达细胞模型构建成功。[img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326454704_2148_5389809_3.png[/img]图 敲低 MSI1 在转录水平和蛋白水平的验证(***P0.001)
[font=宋体]流式细胞分析是一种在生物学和医学领域广泛应用的实验技术,它可以实现对细胞群体的快速、准确分析和分类。本文将详细介绍流式细胞分析的步骤和流式免疫检测的应用,帮助读者全面了解这一技术的原理、方法和应用。[/font][font=宋体] [/font][b][font=宋体][font=宋体]流式细胞分析方案主要分为[/font][font=Calibri]4[/font][font=宋体]个步骤: [/font][/font][/b][font=宋体] [/font][font=宋体]①样品制备:应通过机械分离方法或化学解离技术制备单细胞悬液,如采用酶溶液或钙螯合试剂。[/font][font=宋体] [/font][font=宋体][font=宋体]②封闭:通常采用抗[/font][font=Calibri]Fc[/font][font=宋体]抗体稀释液悬浮细胞,防止一抗非特异性结合。[/font][/font][font=宋体] [/font][font=宋体]③抗体孵育:流式细胞分析的孵育步骤涉及多种组分,包括一抗、二抗、链霉亲和素和荧光染料。[/font][font=宋体] [/font][font=宋体]④流式细胞仪检测:将处理后的细胞通过流式细胞仪进行检测和分析,获取细胞的各项指标数据。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]适当的对照[/b][/font][font=宋体]除了目标细胞之外,每次进行流式细胞实验还应包含以下对照:[/font][font=宋体] [/font][font=宋体]至少一份未染色样品,与试样同时进行每一步的缓冲液孵育,以优化实验的流速和电压。[/font][font=宋体] [/font][font=宋体]一份适当的阴性对照样品,与试样基本相同,但用在一抗的宿主种属中生产的同型对照替代试样中的一抗。该对照用于非特异性结合二抗。[/font][font=宋体] [/font][font=宋体]如有需要也可准备一份已知表达所有目标抗原的细胞组成的阳性对照,并与试样共同孵育,但仅用单色检测。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]流式免疫检测方法与应用[/b][/font][font=宋体]同其他免疫检测应用一样,流式细胞分析也可通过多种方法利用抗体探测特定的细胞基元。两大常用方法为:直接检测法和间接检测法。[/font][font=宋体] [/font][font=宋体]直接检测法[/font][font=宋体][font=宋体]直接检测法采用一步染色工艺,仅需一抗即能特异性结合目标抗原,无需额外步骤,可直接与支持成像或其他结合状态检测的分子结合。在探测细胞表面抗原时,应避免固定细胞,因为固定可能导致抗体探针无法与目标抗原充分接触。因此,保持细胞活力对于数据采集至关重要。若需查找适用于直接检测法的抗体,推荐使用[/font][font=Calibri]Antibody Explorer[/font][font=宋体]抗体搜索工具,将搜索范围限定为“仅限一抗”,并将应用选择为“流式细胞分析”。这样,您将能够快速找到适合您实验需求的抗体。[/font][/font][font=宋体] [/font][font=宋体]间接检测法[/font][font=宋体] [/font][font=宋体][font=宋体]间接检测法首先使用纯化抗体与目标抗原进行结合,然后使用荧光染料标记的二抗(能够特异性靶向一抗的宿主同型)与一抗进行特异性结合,形成一抗[/font][font=Calibri]-[/font][font=宋体]荧光二抗复合物。通过将纯化的一抗与各种波长(或颜色)的荧光染料标记的二抗(特异性针对产生一抗的宿主同型)进行搭配,可以增强抗体库的模块化程度。这种方法能够提高实验的灵敏度和特异性,同时减少背景干扰和误差。[/font][/font][font=宋体] [/font][font=宋体][b]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service]流式细胞检测技术服务[/url],其优势:[/b][/font][font=宋体][font=宋体]①具有 [/font][font=Calibri]20,000 [/font][font=宋体]次以上流式抗体筛选鉴定经验及多年流式诊断抗体研发经验,在实验方案设计、样品制备、数据分析等方面确保科学性、准确性和可靠性[/font][font=Calibri] [/font][/font][font=宋体][font=宋体]②拥有 [/font][font=Calibri]1,000 [/font][font=宋体]余株自产精品流式抗体,覆盖细胞膜、胞内、核内及分泌抗原;[/font][/font][font=宋体][font=宋体]③自产 [/font][font=Calibri]Annexin V/7-AAD [/font][font=宋体]凋亡检测试剂盒,并储备多种流式检测常用试剂,大大节约购买试剂的等待时间和实际费用;[/font][/font][font=宋体][font=宋体]④可以提供近 [/font][font=Calibri]200 [/font][font=宋体]种细胞系选择,省去细胞样本寄送过程中的风险,并可以免费提供健康人外周血细胞对照品。[/font][/font][font=宋体][font=宋体]详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font]
一、对照组的设置:在流式细胞术中所测得的量都是相对值,不是绝对值。如需知道绝对值 时必须设置对照组样品。对照组样品包括有阴性对照和阳性对照。1. 阴性对照的设置① 在实验过程中,如做间接标记法,可设置与一抗无关的实验,即在 实验中不加一抗而只加上带有荧光标记的第二抗体作为阴性对照 管,作为阴性对照。② 在实验过程中,假设做直接标记法,可设置理论上的阴性细胞作为 阴性对照管, 实验过程及步骤与实验组务必相同。 (做间接标时记,法 同样也可同时设置“阴性细胞”的阴性对照管作为阴性对照。③ 在实验过程中,假设做直接标记法,可将实验组细胞,取一管,加上与实验抗体所标记的荧光颜色相同的同型对照来作为阴性对照。2. 阳性对照的设置:在实验过程中如涉及到表达缺失或减少的实验,应设置阳性对照组,其设置方法与阴性对照设置相同。二、几点建议:1. 在实验过程中,在保证实验的科学性和准确性的基础上,应尽量减少实验工 序和过程。由于间接标记法的工序多,实验过程长,如再加之操作的不熟练, 细胞更容易丢失和受损,而造成实验结果的误差。因此,在条件允许的范围 内,建议尽量做直接标记法而不去做间接标记法,以保证实验的真实性和准 确性。2. 建议送检细胞一定要足够量,一般要求 1×106 个细胞。不要过少。因为,如 细胞太少检测时样本流量相对会增大从而影响变异系数,结果也不可信。细 胞量也不宜过多,因细胞量太多加入的抗体或染料相对不足,结果也由此受影响。3. 同一种细胞需同时做双标记时,须做双标记的同型对照,且两种抗体所标记 的荧光颜色务必不同
科技日报讯 据物理学家组织网近日报道,美国斯克里普斯研究所开发出一种“液体活组织检查”技术,通过检查血液中有没有一种叫做循环内皮细胞(CECs)的特殊标记,能确认病人是否处于心脏病发作的高风险中。相关论文发表在最新一期的英国物理学会(IOP)刊物《生物医学》上。 血管内皮细胞排列在动脉壁上,当它们在血液中循环时,就和心脏病发作的进程密切相关。研究人员认为,这些循环内皮细胞所到之处会出现病变斑块、组织断裂和溃疡,造成动脉发炎。这些损害会形成血管阻塞,妨碍血液在动脉中流通,最终导致心脏病发作。 预测检查技术的原理是用健康的对照组来识别循环内皮细胞(CECs),并找出那些最近曾因心脏病发作而接受过治疗的病人。为此,研究人员开发出一种叫做“高清循环内皮细胞”(HD-CEC)化验的程序,探测并描绘出79名病人血液样本中的CEC特征。这些病人已经历过一次心脏病发作。他们用了两个控制对照组作为对比,包括25个健康人士和7个身患血管病并经过治疗的病人。该检测能从外形上以及循环内皮细胞与特殊抗体的反应中识别出它们,经过心脏病发作的人循环内皮细胞水平明显升高。 “在经历一次心脏病发作后,病人体内能可靠地探测到循环内皮细胞,而健康对照组中却没有。研究论文的目标是建立证据,我们已成功做到了这一点。”负责该研究的斯克里普斯研究所副教授彼得·库恩说,“相比于健康对照组,我们的结果非常明显。下一步就是要评估这项检测在心脏病发作早期识别中的有用性了。” 研究人员认为,这种技术现已能对那些显出征兆但尚未心脏病发作的人进行检测。此前尚无针对心脏病的预测检查,至少预测准确性无法令人满意。 他们还把检测结果与一种已经商业化的CellSearch检查进行了对比,CellSearch已获美国食品和药物管理局批准,用于检查癌症病人肿瘤细胞的数量。HD-CEC测试对循环内皮细胞显示出了更高的特异性,因为它用的是直接分析法,避免了浓缩阶段的偏差。“我们的检测能有效分析数百万个细胞,效率更高,但要保证你分析的是病人所有的可疑细胞。”(常丽君)来源:中国科技网-科技日报 2014年01月21日
请问专家,我们在按照国标用电位溶出仪做食品色素时,样品没有去除天然色素的步骤,请问天然色素会影响结果吗?
【关键词】 色素添加剂 食品安全检测 食品检测标准物质 苋菜红 柠檬黄 靛蓝标准品 食品的色彩是食品感观品质的一个重要因素。人们在制作食品时常使用一种食品添加剂-食用色素。目前使用的食用色素有天然食用色素和合成食用色素两大类。在1850年英国人发明第一种合成食用色素苯胺紫之前,人们都是用天然色素来着色。早在公元10世纪以前,古人就开始利用植物性天然色素给食品着色,最早使用色素的是大不列颠的阿利克撒人,当时他们用茜草植物色素做成玫瑰紫色糖果。以后,美洲的托尔铁克人与阿芒特克族人相继从雌性胭脂虫中提取胭脂虫红,用于食品着色。 我国自古就有将红曲米酿酒、酱肉、制红肠等习惯。西南一带用黄饭花、江南一带用乌饭树叶捣汁染糯米饭食用。 合成食用色素(合成色素)由于成本低廉,色泽鲜艳,着色力强,对光、热、氧气和pH稳定,但它有一个大缺点,即具毒性(包括毒性、致泻性和致癌性)。这些毒性源于合成色素中的砷、铅、铜、苯酚、苯胺、乙醚、氯化物和硫酸盐,它们对人体均可造成不同程度的危害。我国1982年公布了《食品添加剂使用卫生标准》,其中规定了只能使用5种合成色素,并定出了最大使用量,如合成色素的纯色素含量不得低于85~99%,1公斤合成色素中砷的含量应在1毫克以下,铅在10毫克以下,铜在20毫克以下,每100克色素中,苯酚不应超过5毫克,苯胺不应超过4毫克,各种氯化物不应超过0.5%等,这些规定是为了限制色素中的杂质,以减少对人体的毒害。目前我国允许使用的合成色素有苋菜红、胭脂红、柠檬黄、日落黄和靛蓝。它们分别用于果味水、果味粉、果子露、汽水、配制酒、红绿丝、罐头,以及糕点表面上彩等。 这些合成色素的确把食品表面装扮的格外惹人喜爱,但是,它们禁止用于下列食品:肉类及其加工品(包括内脏加工品)、鱼类及其加工品、水果及其制品(包括果汁、果脯、果酱、果子冻和酿造果酒)、调味品、婴幼儿食品、饼干等大幅度下降。在国际上,自美国1976年禁止使用合成色素苋菜红之后,就逐步重视对天然色素的开发和应用。 天然食用色素大部分取自于植物,部分取自动物和矿物。在〃绿色运动〃呼声越来越高的今天,天然食用色素的发展前景更加看好。并且世界各国相继制定法规,淘汰大部分有毒的化学合成色素。目前,“天然、营养、多功能”已成为天然食用色素的发展方向。 天然色素直接来自动植物,除藤黄外,其余对人体无毒害。但国家对每一种天然食用色素也都规定了最大使用量,以策安全。目前允许使用的天然色素有姜黄素、红花黄色素、辣椒红素、虫胶色素、红曲米、酱色、甜菜红、叶绿素铜钠盐和β—胡萝卜素。其中酱色(也称糖色)的使用要引起注意。酱色是将蔗糖酱和麦芽糖酱在160~180℃高温下加热3小时,使之焦糖化,再加碱中和而成。焦糖本身没有毒,但如在制作过程中加入铵盐,使焦糖中有含氮的杂环化合物4—甲基味唑,这种物质有强烈的致惊厥作用,若含量过大,对人体有害。因此我国规定只允许使用不加铵盐制作的酱色。天然色素能用于上述合成色素可使用的所有食品种类。 因此认为,为了给食品添加色素,最好选用天然色素,即使成本提高,消费者还是乐意接受的。在天然色素中,有两种与日常饮食关系较密切。一是β—胡萝卜素,它是人类食品的正常成份之一,又是一种必需营养素,用作食品添加剂,不仅无害,反有益处。家庭自制奶油蛋糕时,以它着色,两全其美。二是红曲米,它是我国传统使用的天然色素之一,主要用于制作红腐乳和红香肠。由于它对蛋白质着色好,耐热性也好,一般家庭可用它制作熟肉制品。 近年来,世界各国都趋向充分利用天然色素,凡是对热、光、氧化作用稳定,又不容易受金属离子或其他化合物质影响的天然色素,只要对人体确无危害,应当设法提取,为我所用。这样就可以弥补天然色素颜色不够鲜艳和色素浓度较低的不足。食用色素是用于食品着色的一类添加剂,包括合成色素和天然色素,总数逾60种。
胆固醇稳态对机体正常的细胞和系统功能至关重要,胆固醇平衡失调是心血管疾病、神经退行性疾病和癌症等其他疾病的基础[1]。胆固醇代谢包括内源性胆固醇合成、吸收和排泄等环节。研究表明,胆固醇在体内不能被降解,有效排泄是维持其稳态的重要环节[2]。体内积累的胆固醇最终通过肠道以粪便消除胆固醇和胆汁酸的形式达到平衡,目前已知的胆固醇排泄途径包括了胆固醇逆转运(reverse cholesterol transport,RCT)途径和经肠胆固醇排泄(transintestinal cholesterol excretion,TICE)途径;前者是肝脏将胆固醇转化为胆汁酸后经肠排出,后者是由血直接经肠道分泌和排出血浆脂蛋白来源的胆固醇,二者交汇于肠道,因此,肠道在胆固醇稳态中发挥了重要作用[3-4]。调血脂治疗是防治体内高胆固醇含量诱导的相关疾病的有效方法,目前临床常用调血脂药物他汀类的作用是通过降低低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)以限制内源性胆固醇合成,从而防治心血管等疾病的发生发展,但其相关发病率和死亡率仅降低了30%[5]。这意味着需要更多策略来解决这个严重的公共卫生事件。 雷公藤红素(celastrol,CeT)是一种从传统中药雷公藤Tripterygium wilfordii Hook. f.中提取分离出的活性成分,具有抗炎、抗癌和抗动脉粥样硬化等多种药理活性[6],且具有良好的成药性,被《Cell》杂志列为最可能转化为现代药物的5种有潜力传统药物之一[7]。Zhang等[8]前期研究发现,体外有效成分为CeT的南蛇藤能够通过在促进RCT减少脂质蓄积方面具有积极作用,其机制主要是通过激活清除剂受体B类成员1(scavenger receptor class B member 1,SRB1)、ABC转运体和细胞色素P450家族7亚家族A成员1(cytochrome P450 family 7 subfamily A member 1,CYP7A1)途径促进胆固醇代谢。然而,有关CeT调控胆固醇代谢的作用机制探索尚不完善。此外,迄今为止,并无有关CeT通过调控肠道TICE途径介导胆固醇代谢的相关研究。因此,本研究采用网络药理学和系统生物学理论,通过构建“CeT-靶点-肠道胆固醇代谢”多层次网络,初步预测CeT调控肠上皮细胞胆固醇代谢的作用机制[9-10],并结合实验深入探讨和验证CeT调控肠上皮细胞胆固醇代谢的作用及机制,旨在为维持体内胆固醇稳态提供新的方向和理论依据。 1 材料 1.1 细胞 大鼠小肠隐窝上皮IEC-6细胞(批号ZQ0783)由中国科学院上海细胞库提供。 1.2 药品与试剂 CeT(批号C0869)购自美国Sigma公司;肝X受体α(liver X receptor α,LXRα)抑制剂GSK2033(批号HY-108688)、Bodipy荧光染色(批号HY-W090090)购自美国MCE公司;0.25%胰蛋白酶(批号PB180229)购自美国Hyclone公司;DMEM高糖完全培养基(批号ZQ-121)、DMEM基础培养基(批号09122)购自上海中乔新舟生物科技有限公司;磷酸酶抑制剂(批号CW2383S)、蛋白酶抑制剂(批号CW2200S)、BCA试剂盒(批号CW0014S)、SDS-PAGE试剂盒(批号CW0022S)、Loading buffer(批号CW0028S)液购自康为世纪生物科技股份有限公司;CCK-8试剂盒(批号C0037)、RIPA裂解液(批号P0013B)、ECL化学发光试剂盒(批号P0018S)购自碧云天生物技术股份有限公司;油红O染色试剂盒(批号G1262-4)购自北京索莱宝科技有限公司;PVDF膜(批号ISEQ00010)购自美国Millipore公司;兔抗三磷酸腺苷结合盒转运蛋白G5(adenosine triphosphate-binding cassette transporters G5,ABCG5)抗体(批号27722-1-AP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号10494-1-AP)、山羊抗兔二抗(批号SA00001-2)购自美国Proteintech公司;兔抗ATP结合盒转运蛋白G8(ATP-binding cassette transporters G8,ABCG8)抗体(批号A01482-2)购自武汉博士德生物工程有限公司;兔抗NPC1样细胞内胆固醇转运蛋白1(NPC1 like intracellular cholesterol transporter 1,NPC1L1)抗体(批号PA5-116672)购自美国Thermo Fisher Scientific公司;兔抗LXRα抗体(批号ab41902)、DAPI染液(批号ab228549)购自英国Abcam公司。 1.3 仪器 ix 73型倒置荧光显微镜(日本Olympus公司);FC型酶标仪、Forma 3系列CO2培养箱、EVOS fl auto全自动荧光倒置荧光学显微镜(美国Thermo Fisher Scientific公司);ChemiDoc XRS+化学发光成像系统、Mini-PROTEAN Tetra蛋白电泳系统(美国Bio-Rad公司)。 2 方法 2.1 网络药理学研究 将PubChem(https://pubchem.ncbi.nlm.nih.gov/)得到的CeT 3D结构导入PharmMapper(http://www. lilab-ecust.cn/pharmmapper/)进行药物靶点预测。通过NCBI(https://www.ncbi.nlm.nih.gov/)得到肠道和胆固醇代谢靶点。并与CeT靶点取交集得到共有靶点;通过STRING(https://STRING-db.org)进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建,并导入Cytoscape 3.9.1软件构建网络模型并分析;通过DAVID(https://david. ncifcrf.gov/)进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;利用PDB(https://www.rcsb.org/)筛选并下载分辨率小于0.25 nm的靶点的结晶复合式,结合上述得到的CeT 3D结构,采用Autodock进行分子对接,运用PyMol可视化处理。 2.2 实验验证 2.2.1 IEC-6细胞培养 IEC-6细胞用DMEM高糖完全培养基于37 ℃、5% CO2的恒温培养箱中常规培养。 2.2.2 CCK-8法检测细胞存活率 将对数生长期的IEC-6细胞接种于96孔板中,5×103个/孔。每孔加入100 μL含不同浓度(0.05、0.10、0.20、0.40、0.80 μmol/L)CeT的培养基,另设置加入无药物培养基的对照组,每组设置5个复孔,培养箱中培养24、48 h。每孔加入10 μL CCK-8试剂,于培养箱中孵育1~2 h后,采用酶标仪在450 nm处检测吸光度(A)值,计算细胞存活率。 细胞存活率=A给药/A对照 2.2.3 油红O染色评估CeT对肠上皮细胞胆固醇的影响 设置对照组、模型组和CeT(0.05、0.10、0.20 μmol/L)组,除对照组外,其余各组加入DMEM基本培养基配制的胆固醇胶束(cholesterol micelles, C-M,10 mmol/L)构建肠上皮细胞高胆固醇模型[11],给药组加入不同浓度的CeT溶液,对照组加入不含药物的培养基。干预24 h后,加入ORO Fixative固定液固定细胞;加入1 mL 60%异丙醇浸洗;加入油红O染液(ORO Stain A∶ORO Stain B=3∶2),洗涤至孔内无红色剩余;加入Mayer苏木素染色液,洗涤;加入油红O染液缓冲液;加入蒸馏水覆盖细胞并拍照,使用Image-Pro Plus软件以脂滴与整个图像的面积比进行定量。 2.2.4 Bodipy荧光标记法 按“2.2.3”项下方法进行分组和给药,干预24 h后,PBS洗涤,室温下多聚甲醛固定30 min;每孔加入2 μmol/L Bodipy染色液,于37 ℃细胞培养箱中孵育15 min;弃去染色液,PBS洗涤;DAPI复染核5 min,PBS洗涤;观察并拍照。使用Image-Pro Plus软件以荧光强度进行统计。 2.2.5 Western blotting检测TICE相关蛋白表达 按“2.2.3”项下方法进行分组和给药,干预24 h后,收集细胞;PBS洗涤后使用蛋白裂解液提取总蛋白质,BCA定量法测定蛋白质浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶封闭3 h,用TBST洗涤后加入一抗,4 ℃孵育过夜;洗涤后加入二抗,室温孵育2 h;洗涤后进行显影,使用Image-Pro Plus软件分析条带灰度值。 2.2.6 免疫荧光检测LXRα/ABCG8和LXRα/ NPC1L1通路相关蛋白的影响 设置对照组、模型组、CeT(0.1 μmol/L)组、GSK2033(10 μmol/L)组和CeT+GSK2033组,除对照组外,其余各组加入DMEM基本培养基配制的胆固醇胶束(10 mmol/L)构建肠上皮细胞高胆固醇模型,各给药组加入相应药物,对照组加入不含药物的培养基。干预24 h后,PBS洗涤3次;4%多聚甲醛固定30 min,PBS洗涤3次后加入Trition X-100,室温下通透10 min;PBS洗涤3次后,加入免疫染色封闭液封闭60 min,吸去多余的牛血清白蛋白;分别滴加100 μL LXRα(1∶200)、ABCG8(1∶200)、NPC1L1(1∶200)一抗,4 ℃孵育过夜;回收一抗,PBS浸洗3次,滴加100 μL二抗(1∶300),室温避光孵育60 min;PBS洗涤3次,滴加DAPI复染核15 min,PBS洗涤3次;滴加抗淬灭剂10 μL,扣片,正面朝下盖在载玻片上,荧光显微镜下观察并拍照。使用Image-Pro Plus软件分析荧光强度。 2.2.7 统计学分析 采用GraphPad Prism 9.0和SPSS 26.0软件进行统计分析,数据以表示。两组间数据分布的正态性和方差齐性分别以Kolmogo? rov-Smirnov和Levene检验确定。组间均数比较采用t检验;多组间均数比较采用单因素方差分析,组间有差异进一步采用SNK-q检验进行两两比较。 3 结果 3.1 网络药理学研究 3.1.1 CeT-肠道胆固醇代谢靶点 通过TCMSP等数据库得到94个CeT相关靶点。通过NCBI Gene等数据库得到15 415个肠道相关靶点、14 177个胆固醇代谢相关靶点。并构建韦恩图预测CeT-肠道胆固醇代谢共有靶点,见图1。 图片 3.1.2 CeT-靶点-肠道胆固醇代谢网络构建 将PPI导入Cytoscape 3.8.1软件进行可视化,发现1个关键的子网络,见图2。 图片 3.1.3 CeT-肠道胆固醇代谢的GO功能富集分析 对CeT调控肠道胆固醇代谢的作用及机制进行GO富集分析,分别得到855个生物进程、17个细胞组成、53个分子功能,根据P<0.05,选出排名前10的条目,见图3。 图片 3.1.4 CeT-肠道胆固醇代谢的KEGG通路富集分析 CeT调控肠道胆固醇代谢的通路涉及34条,根据P<0.05,选出排名前10的通路,见图4。其中,主要涉及脂肪的消化和吸收、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)等信号通路。其中,肠道脂质代谢的关键通路(fat digestion and absorption)的靶点(ABCG5、ABCG8、NPC1L1)主要涉及CeT-靶点-肠道胆固醇代谢网络的关键网络之一(图5)。并且该网络主要涉及胆固醇排泄的关键途径——TICE途径。 图片 图片 3.2 分子对接分析 CeT与NR1H3(LXRα)结合能为?28.131 4 kJ/mol,可视化显示,匹配度良好,化合物与靶点结合的最优构象以氢键的方式呈现,结合活性良好,见图6。 图片 3.3 体外实验研究 3.3.1 CeT浓度筛选 不同浓度(0.05、0.1、0.2、0.4、0.8 μmol/L)的CeT分别干预IEC-6细胞24、48 h后,如图7所示,干预24 h时随着CeT浓度的增加细胞存活率降低,CeT的半数抑制浓度(half inhibitory concentration,IC50)为0.2 μmol/L。本研究在探索CeT安全浓度调控IEC-6细胞胆固醇代谢活性的同时,为了更进一步研究CeT在IC50时是否较安全浓度的效果更好,因此,选择0.05、0.10、0.20 μmol/L的CeT处理细胞24 h进行后续研究。 图片 3.3.2 CeT对IEC-6细胞内脂质的影响 如图8所示,油红O染色与Bodipy荧光标记结果均显示,与对照组比较,胆固醇胶束干预显著增加脂滴染色和荧光强度(P<0.001),表明造模成功;与模型组比较,各剂量CeT均显著抑制IEC-6细胞中脂质积累(P<0.05、0.01、0.001)。 图片 3.3.3 CeT对TICE途径关键蛋白的影响 NPC1L1是胆固醇吸收的重要蛋白,ABCG5/G8与胆固醇流出密切相关。如图9所示,与对照组比较,模型组NPC1L1蛋白表达水平显著升高(P<0.05),ABCG5和ABCG8蛋白表达水平显著降低(P<0.05、0.01);与模型组比较,CeT(0.2 μmol/L)组NPC1L1蛋白表达水平显著降低(P<0.05),CeT(0.1、0.2 μmol/L)组ABCG5和ABCG8蛋白表达水平显著升高(P<0.05、0.01)。因此,CeT可能通过抑制NPC1L1,促进ABCG5、ABCG8的表达,调控TICE途径介导的胆固醇摄取和流出。 图片 3.3.4 LXRα是CeT调控TICE途径的关键蛋白 如图10所示,与对照组比较,模型组LXRα、ABCG8表达显著降低(P<0.01),NPC1L1表达显著增加(P<0.001);与模型组比较,CeT组LXRα、ABCG8表达显著增加(P<0.001),NPC1L1表达显著降低(P<0.01),LXRα抑制剂GSK2033组ABCG8表达显著降低(P<0.01),NPC1L1表达显著增加(P<0.05);与CeT组比较,CeT+GSK2033组LXRα、ABCG8表达显著降低(P<0.01),NPC1L1表达显著增加(P<0.01)。因此,CeT可能通过促进LXRα的表达,调控TICE途径中的关键蛋白NPC1L1、ABCG8介导的胆固醇摄取和流出。 图片 4 讨论 胆固醇广泛存在于机体中,具有广泛的生理作用,是组织细胞中不可缺少的重要物质,它不仅参与细胞膜的形成,也是合成胆汁酸、维生素D及甾体激素的重要原料,但当其过量时便会导致高胆固醇血症,研究表明,心血管疾病、胆石症和肿瘤与高胆固醇血症密切相关[12-13]。胆固醇在体内不能被降解,机体有效排泄胆固醇是维持胆固醇稳态的重要环节[2]。因此,促进体内胆固醇排泄以维持体内胆固醇的动态平衡可能是治疗胆固醇失衡相关疾病的新策略。 基于此,本研究通过网络药理学方法,探讨CeT通过调控肠上皮细胞胆固醇代谢的潜在靶点及相关机制。PPI网络发现,CeT调控肠上皮细胞胆固醇代谢涉及1个核心子网络。其中,ABCG5/8与NPC1L1为胆固醇摄取与流出相关的核心靶点。本研究通过体外构建和模拟肠上皮细胞高胆固醇环境,探索CeT调控肠上皮细胞胆固醇代谢的机制,油红O和Bodipy结果均显示,CeT能够呈浓度相关性地降低胆固醇胶束干预的肠上皮细胞内的脂质积蓄。进一步通过结合KEGG通路分析发现,该子网络中的核心靶点与肠道脂质代谢的关键通路(fat digestion and absorption)相匹配,通过深度分析该通路发现,其主要涉及肠上皮细胞摄取与流出胆固醇中的TICE途径。已有研究表明,胆固醇从体内排出的唯一途径是通过粪便直接排出或转化为胆汁酸后排出,粪便排泄可通过2种独立途径进行,第1种途径是胆汁分泌,该途径已被广泛描述和研究。第2种途径是通过TICE途径[14]。在2009年Van团队初步研究估计,TICE对野生型小鼠体内排出的粪便中性固醇总量的贡献约为30%[15]。接下来,该团队在2010年通过实验得出在小鼠中TICE途径占粪便中性甾醇排泄的70%[16]。在人体生理情况下,TICE途径排泄的胆固醇占粪便胆固醇排泄总量的35%[2,17]。TICE指由血直接经肠道分泌和排出血浆脂蛋白来源的胆固醇。包括肝源性含载脂蛋白B的脂蛋白被基底膜侧低密度脂蛋白受体(low density lipoprotein receptor,LDLR)和其他可能受体吸收、内化,最终通过ABCG5/G8以及其他可能的转运体从顶端膜流出排泄到肠腔[18]。另有研究发现,利用Ezetimibe抑制NPC1L1介导的胆固醇摄取可显著增强TICE途径[2]。而本研究表明,CeT干预处于高胆固醇环境中的肠上皮细胞后,NPC1L1被抑制,而ABCG5、ABCG8被激活。提示,CeT主要通过抑制NPC1L1减少肠上皮细胞胆固醇摄取和促进ABCG5、ABCG8增加胆固醇流出。 LXRα由于其抗动脉粥样硬化、去除胆固醇和抗炎活性,在胆固醇稳态的转录调控中发挥极其关键作用[19]。研究发现,LXRα可调控NPC1L1在肠上皮细胞中的表达,降低肠道胆固醇的吸收[20]。此外,ABCG5和ABCG8是LXRα的直接靶基因,常形成异二聚体ABCG5/G8发挥作用,负责将细胞内胆固醇泵入肠腔并最终通过粪便排出体外[21]。PPI子网络表明,NPC1L1、ABCG5以及ABCG8主要由LXRα交联。因此,在上述研究的基础上,通过分子对接模拟了CeT与LXRα的对接模式,结合活性良好。采用LXRα抑制剂GSK2033处理,结果显示,NPC1L1和ABCG5/G8主要受LXRα调控。提示,CeT可能通过LXRα/ABCG5/ABCG8和LXRα/ NPC1L1途径分别介导IEC-6细胞胆固醇摄取和流出,进而促进TICE途径介导的胆固醇排泄。 本研究通过网络药理学和相关实验发现,CeT可能通过抑制肠上皮细胞胆固醇摄取和促进胆固醇流出维持机体胆固醇稳态,这一效应与核心靶点LXRα密切相关,本研究拓展了CeT调控体内胆固醇代谢的机制,为维持体内胆固醇稳态和胆固醇失衡相关疾病的新药研发提供了新思路。
10多年来,干细胞疗法一直被认为能够给那些遭受遗传和退行性疾病折磨的人带来希望。而就在几天前,随着两个研究团队在于日本横滨召开的国际干细胞研究学会(ISSCR)年会上宣告了他们在人类临床研究中取得的成果——一项聚焦于罕见的遗传神经病,另一项则着眼于老年人的视力丧失,这一希望又朝着现实迈出了一步。 美国加利福尼亚州纽瓦克市干细胞公司报告了用人体神经干细胞治疗梅氏病(PMD)所取得的鼓舞人心的研究成果。PMD是一种渐进式的致命疾病,该病通过基因突变抑制了髓鞘的正常生长,后者是大脑中包裹神经纤维的一种保护物质。缺乏髓鞘,神经信号便会流失;病人,通常是婴儿,便会经历运动协调能力退化以及其他神经病症状。据干细胞公司负责研究的副总裁Ann Tsukamoto介绍,该公司之所以选择PMD来测试其神经干细胞技术,缘于目前尚没有这种疾病的治疗方法,且通过基因检测和磁共振成像能够确诊这种疾病。她说:“这便为最有效的早期介入创造了一个机会。” 该公司建立了一个从成熟神经组织中分离出的高度纯化的神经干细胞库。研究人员将这些神经干细胞注入啮齿动物体内后,它们并没有形成肿瘤,事实上,这些细胞在小鼠的大脑中游走,并分化成不同类型的神经细胞,其中就包括分泌能够保护神经纤维的髓鞘的细胞。Tsukamoto介绍说,当神经干细胞被注入小鼠后,它们表现出了“强大的移植和迁移能力,并形成新的髓鞘”。 该公司如今正赞助对4名PMD婴幼儿患者进行该技术的初期安全试验。加利福尼亚大学旧金山分校的研究人员,向每位患者大脑中的4个区域中的每一个区域移植了7500万个神经干细胞,并随之进行了免疫抑制治疗,这样受体才不会排斥外来的细胞。Tsukamoto报告说,在试验过程中并没有出现安全隐患。此外,在18个月后进行的磁共振成像显示,在轴突周围形成了新的髓鞘,并且对患者进行的临床观察表明,他们的运动机能保持稳定或出现了小幅提升。干细胞公司如今正计划进行更大规模的试验。Tsukamoto表示,一旦这种疗法被证明是有效的,它将带来多发性硬化、大脑性麻痹和阿尔茨海默氏症的神经干细胞新疗法。 在这次会议上,神户市日本理化研究所(RIKEN)发育生物学中心的干细胞研究人员Masayo Takahashi,报告了她的研究小组在针对与年龄相关的黄斑变性(AMD)的临床前研究所取得的进展。在AMD中,视网膜色素上皮(RPE)细胞的生长出现了问题,并且位于视网膜下部的血管出现了渗漏。这些情况导致眼睛中心部位的视力下降。Takahashi的研究小组研制出一种方法,即用外科手术摘除有问题的血管,同时用源自病人自身细胞的新RPE细胞替代受损的RPE细胞。利用被称为细胞再编程的一项技术,研究人员采集了病人的皮肤细胞,并将其转化为所谓的诱导多能干(iPS)细胞,这种细胞能够分化成人体中的所有细胞。研究人员随后将iPS细胞转化为RPE细胞。由于iPS方法使用的是病人自身的细胞,因此避免了对免疫抑制药物的需求。 由Takahashi小组生成的RPE细胞表现出了真正人体RPE细胞的特征结构和基因表达模式。她报告说,将它们注入小鼠并没有引发肿瘤,并且这些细胞在移植到猴子体内后存活了6个多月。Takahashi希望在得到必要的批准后,能够在1年内开展人体试验。 英国剑桥研究学院癌症中心的干细胞研究人员Fiona Watt指出,在ISSCR上发表的这些研究结果将帮助该领域“积攒力量”。而美国哈佛医学院的干细胞科学家George Daley则更为乐观。他说,记住这次年会上报告的这些进展;并表示对明年在波士顿召开的2013年ISSCR年会充满期待。
六. 流式细胞仪主要构造和工作原理 信号检测系统 当测定标本在鞘流液约束下细胞成单行排列依次通过激光检测区时产生散射光和荧光信号,散射光分为前向角散射(Forward Scatter, FS)和侧向角散射或900散射(Side Scatter, SS),散射光是细胞的物理参数与细胞样本的制备(如染色)无关;荧光信号也有两种,一种是细胞自发荧光它一般很微弱,一种是细胞样本经标有特异荧光素的单克隆抗体染色后经激光激发发出的荧光,它是我们要测定的荧光,荧光信号较强,这两种荧光信号的同时存在是我们测定时需要设定阴性对照的理由,以便从测出的荧光信号中减去细胞自发荧光和抗体非特异结合产生的荧光。前向角散射(FS)反映被测细胞的大小,它由正对着流动室的光电二极管装置接收并转变为电信号;侧向角散射或900散射(SS)反映被测细胞的细胞膜、细胞质、核膜的折射率和细胞内颗粒的性状, 它由一个光电倍增管(PMT) 接收并转变为电信号,这些电信号存储在流式细胞仪的计算机硬盘或软盘内。流式细胞仪测定常用的荧光染料有多种,他们分子结构不同,激发光谱和发射光谱也各异,选择荧光染料时必须依据流式细胞仪所配备的激光光源的发射光波长(如氩离子气体激光管,它的发射光波488ηm,氦氖离子气体激光管发射光波长633ηm)。488ηm激光光源常用的荧光染料有FITC(异硫氰酸荧光素)、PE(藻红蛋白)、PI(碘化丙啶)、CY5(化青素)、preCP(叶绿素蛋白)、ECD(藻红蛋白-得克萨斯红)等。他们的激发光和发射光波长分别是: [/col
细胞在体外进行培养,失去了机体的调节和控制。因此,除满足营养的要求外,还必须使细胞生存环境尽量接近活体的环境。外环境的培养条件如温度、渗透压、酸碱度等均能影响细胞的生长。 一、温度 一般哺乳类及禽类细胞体外培养的适宜温度是37~38℃。温度过高或过低都会影响到细胞的生长。细胞耐受低温的能力比抗热的能力强,在低温下,细胞的代谢活力及核分裂降低。温度不低于0℃时,虽影响细胞代谢,但并无伤害作用;把细胞置于25~35℃时,细胞仍能生存和生长,但速度减缓;放在40℃数小时后,再置回37℃培养细胞仍能继续生长。但如果在40℃下暴露时间太长,对细胞生长不利,甚至变圆脱落于瓶壁。若温度过低,在降到冰点以下时,细胞因胞外水和胞质结冰而受损死亡。但若向培养液中加入甘油或二甲亚砜等保护剂,封入安瓿中后,置于液氮中,可起保护作用,此时细胞可耐受-70℃以下温度,能长期储存,解冻后细胞复苏,仍能继续生长增殖,细胞生物性状不受任何影响。此为保存细胞的主要手段。 高温对细胞培养不利。细胞在39~40℃培养1小时,能受到一定损伤,但仍有可能恢复,但不能忍受温度再升高2℃,持续数小时,即在41~42℃中培养1小时,细胞损伤严重,温度至43℃以上时细胞多数被杀死。高温主要引起酶的灭活、类脂质破坏,核分裂的破坏,产生凝固酶使细胞发生凝固,另外使蛋白质变性。因此,体外培养细胞时一定要避免高温。 二、渗透压 细胞在高渗溶液或低渗溶液中,可以立即发生皱缩或肿胀、破裂。所以,渗透压是体外培养细胞的重要条件之一。哺乳动物和其他动物组织细胞体外培养的渗透压的维持主要与NaCl有关,但不能忽视其他电介质渗透压的关系。渗透压与单位体积溶媒内溶质的分子数和离子数成正比。为此,按一定比例控制培养液中离子平衡,维持正常渗透压是很重要的。这不仅是为了维持细胞张力,而且是为了调节细胞的代谢。因为细胞外离子输送和离子浓度改变着其他营养物质的输送(如氨基酸、蔗糖等),直接影响细胞基本合成系统。 理想的渗透压因细胞的类型及种族而异,人血浆渗透压为290mmol/L,被视为是体外培养人类细胞的理想渗透压。哺乳类动物细胞的渗透压一般为290~300mmol/L。人胚肺成纤维细胞为250~325mmol/L,鼠则为310mmol/L左右。在实际应用中,260~320mmol/L的渗透压可适于大多数细胞。
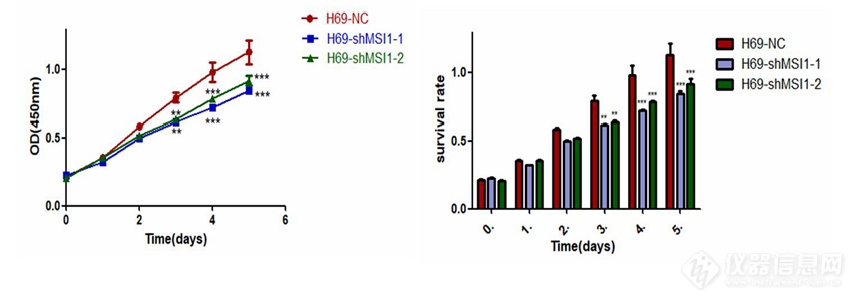
[align=center][size=18px]敲低[/size][size=18px] MSI1 对小细胞肺癌细胞生长增殖的影响[/size][/align][size=16px]检测 MSI1 对人小细胞肺癌细胞生长增殖的影响[/size][size=16px]收集[/size][size=16px] H69、H82、H526、SW1271 的对照组和实验组[/size][size=16px]细胞细胞[/size][size=16px]离心,并用完全培养基调整细胞浓度,H69-NC、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、[/size][size=16px] [/size][size=16px]H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2 以每孔 1×104 [/size][size=16px]个[/size][size=16px]细胞平铺于 96 孔板中,SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2,以每孔 1.3×[/size][size=16px]104 [/size][size=16px]个[/size][size=16px]细胞平铺于 96 孔板中,37℃ 恒温培养箱中培养。铺板后,分别于 24 h、48 h、72 h、96 h、120h 在每孔加入 10 [/size][size=16px]μL[/size][size=16px] CCK-8 溶液,37℃ 恒温培养箱中孵育 4h。并用酶标仪测定波长 450 nm 处 OD 值,利用 [/size][size=16px]Graphpad[/size][size=16px] prism5 计算增殖情况。[/size][size=16px]检测 MSI1 对人小细胞肺癌细胞药物敏感性的影响[/size][size=16px]收集[/size][size=16px] H69 、H82 、H526 、SW1271 的对照组和实验组细胞, 其中 H69-NC 、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、[/size][size=16px]H526-shMSI1-1、H526-shMSI1-2 细胞系以 1×104 [/size][size=16px]个[/size][size=16px]细胞/孔的细胞密度接种于 96 孔板中,SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 以 1.3×104 [/size][size=16px]个[/size][size=16px]细胞/孔的细[/size][size=16px]胞[/size][size=16px]密度接种于[/size][size=16px] 96 孔板中。待细胞融合率约 80%,加入不同浓度顺[/size][size=16px]铂[/size][size=16px]。每组均设置对照组及空白组(仅有同体积培养基)。H69、H82、H526 的对照组和实验组[/size][size=16px]加药浓度梯度为 0、1、2、4、8、16、32、64 nmol/mL,SW1271 对照组和实验组细胞加药浓度梯度为 0、2、4、8、16、32、64、128、256 nmol/mL,(加药浓度梯度根据细胞类型、前期预实验结果及细胞对药物的敏感程度而定)。每种浓度设 6 [/size][size=16px]个[/size][size=16px]复孔,每孔总体积为 100 [/size][size=16px]μL[/size][size=16px],培养 24、48、72、96、120 h 后[/size][size=16px]分别检测细胞活力。每孔加入[/size][size=16px] 10 [/size][size=16px]μL[/size][size=16px] 的 CCK-8[/size][size=16px](避光),培养箱中孵育[/size][size=16px] 4 h 后取出,使用酶标仪测定波长为 450 nm 的吸光度(OD 值)。利用公式:抑制率=(加药组-空白组)/(对照组-空白组)计算增殖抑制率。实验重复 3 次,取平均值。以药物浓度为横坐标,细胞增殖抑制率为纵坐标,利用[/size][size=16px]Graphpad[/size][size=16px] prism5 绘图。[/size] [size=16px]敲低[/size][size=16px] MSI1 对人小细胞肺癌细胞增殖能力的影响[/size][size=16px]CCK-8 是一种基于 WST-8 而广泛应用于细胞增殖和细胞毒性的快速、高灵敏度、无放射性的比色检测试剂盒。WST-8 在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的甲[/size][size=16px]瓒[/size][size=16px],生成的甲[/size][size=16px]瓒[/size][size=16px]物的数量与活细胞的数量呈正比,因此可以直接进行细胞增殖和毒性分析。[/size][size=16px]CCK-8 法 测 生 长 曲 线 实 验 结 果 如 图[/size] [size=16px]3-1 显 示 , 实 验 组 H69-shMSI1-1 、[/size][size=16px]H69-shMSI1-2 、 H82-shMSI1-1 、 H82-shMSI1-2 、 H526-shMSI1-1 、 H526-shMSI1-2 、[/size][size=16px]SW1271-shMSI1-1、SW1271-shMSI1-2 细胞的 OD [/size][size=16px]值明显[/size][size=16px]低于对照组。[/size][size=16px]表明敲低[/size][size=16px] MSI1[/size][size=16px]抑制了[/size][size=16px] SCLC 细胞的生长增殖。[/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302321138249_2126_5887180_3.png[/img][size=16px] [/size][size=16px]图[/size][size=16px] [/size] [size=16px]MSI1 低表达对 H69、H82、H526、SW1271 对照组和实验组细胞增殖的抑制情况。应用 [/size][size=16px]Graphpad[/size][size=16px] prism5 作图所示(*P0.05,**P0.01,***P0.001,表示与对照组相比,[/size][size=16px]敲低组[/size][size=16px] OD 值减小[/size][size=16px]具有统计学意义)。[/size] [size=16px]测敲低[/size][size=16px] MSI1 对人小细胞肺癌细胞药物敏感性的影响[/size][size=16px]药敏实验结果如图[/size][size=16px] 3-2 所示,与对照组相比,实验组 H69-shMSI1-1、H69-shMSI1-2、H82-shMSI1-1、H82-shMSI1-2、H526-shMSI1-1、H526-shMSI1-2、SW1271-shMSI1-1、[/size][size=16px]SW1271-shMSI1-2 经不同浓度[/size][size=16px]顺铂处理[/size][size=16px] 24、48、72、96、120 h 后细胞的药物敏感性无明显变化。[/size][size=16px] [/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302321124223_9282_5887180_3.png[/img]