
10,抽取5个版友);中奖名单:千层峰(注册ID:jxyan)大川之子,纵横四海(注册ID:chuangu120)m3071659(注册ID:m3071659)莫名其妙(注册ID:moyueqiu)sunpengwjh(注册ID:sunpengwjh)http://ng1.17img.cn/bbsfiles/images/2016/09/201609281518_612452_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/09/201609281518_612453_1610895_3.jpg【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================美洛昔康片方法:HPLC基质:药品应用编号:101386化合物:美洛昔康固定相:Diamonsil C18(2)色谱柱/前处理小柱:Diamonsil C18(2) 5u 150 x 4.6mm样品前处理:【有关物质】 取本品细粉,加碱性甲醇溶液(取40%甲醇溶液100 ml,加0.4 mol/L氢氧化钠溶液6 ml,混匀)溶解并稀释成每1 ml中约含有1 mg的溶液,滤过,取续滤液作为供试品溶液;精密量取1 ml,置100 ml量瓶中,用上述碱性甲醇溶液稀释至刻度,摇匀,作为对照溶液。色谱条件:检测器:UV 270 nm 流动相:0.1 mol/L 乙酸铵溶液-甲醇(50:50) 进样量:20 ul文章出处:P611关键字:美洛昔康,2010版中国药典,HPLC,含量测定,钻石二代,Diamonsil C18(2)谱图:http://www.dikma.com.cn/Public/Uploads/images/meiluoxikang.GIF
请大家帮忙找找看有没有最新国外美洛昔康的红外光谱图,或者告诉我哪里能够找到,谢谢
[font=Times New Roman][b][color=#f10b00]央视《经济半小时》8月8日播出节目“揭秘乳品安全国家标准”,以下为节目实录:[/color][/b][/font] 今年6月1号起,由卫生部批准公布的乳品安全国家标准正式实施,其中共包括66项具体标准,涉及生乳、巴氏杀菌乳、灭菌乳等所有乳类和乳制品。这是2008年“三聚氰胺事件”发生后,有关部门对1986年颁布的乳品标准进行的一次重大修订,因此也被称为乳品新国标。然而,正是这个新国标却在行业内外引发了一场激烈争论。 这是2008年“三聚氰胺事件”发生后,有关部门对乳液新标准进行的一次重大修订。然而,新国标从标准正式发布到实施,引发无数争论。争论焦点之一是蛋白质含量,新国标中,蛋白含量每100克含2.8克,这个数字低于国际标准3.0克,也低于1986年旧国标的2.95克;争论焦点之二是每毫升牛奶中的菌落总数,新标准由原来的50万上升到了200万,比美国、欧盟10万的标准高出20倍,被业界惊呼为一夜倒退25年。更有舆论指出,这个乳业新国标让“中国原奶质量降到了全世界最低”。 [b][color=#f10b00]新国标制定专家起草组组长 国家疾控中心营养与食品安全所副所长王竹天[/color][/b] 王竹天:这个标准是适合于我们国家现在的这种养殖方式下的一个标准 [b][color=#f10b00]中国畜产品加工研究会名誉会长农业部(奶类)顾问 骆承庠[/color][/b] 骆承庠:中国的乳品工业恐怕要完了。 [b][color=#f10b00]中国奶业协会乳品工业委员会副主任、卫生部原乳品订标组副组长副组长 曾寿瀛[/color][/b] 曾寿瀛:不能像某些领导所讲的,这个标准是相互协调,相互照顾,这样的一个产物。 围绕乳品新国标,我们听到了两种针锋相对的声音。争论第一大焦点就是1986年颁布的生鲜牛乳收购标准和2003年卫生部的鲜乳卫生标准,都要求蛋白质含量为2.95%,新国标却把蛋白质含量降低为2.8%。那么,这项标准究竟是怎么定下来的?能否保证今后原奶的质量呢?我们再来看看专家的分析。 [b][color=#f10b00]中国农科院北京畜牧兽医研究所副所长 王加启[/color][/b] 王加启:不是说这个蛋白质的含量从2.95降到2.8以后,这个牛奶就不能喝了, [b][color=#f10b00]中国奶业协会乳品工业委员会副主任 全国乳与乳制品订标组 副组长 曾寿瀛[/color][/b] 曾寿瀛;国际上没有一个标准,原料奶、生奶是2.8的,没有。 对于蛋白质标准,支持者和反对者各执一词,记者注意到,我国1986年的“国标”2.95与国际标准已有明显差距,2010年的标准在其基础上为何又降到了2.8呢?参与这次国标制定的中国农科院北京畜牧兽医研究所副所长王加启告诉记者,影响奶蛋白含量的因素很多,饲料是其中最关键的一个因素,而目前中国奶业有76%都是散户养殖,在精饲料投入不足,这不可避免地影响了奶蛋白含量。1986年制定标准时,我国以国营农场为主,奶牛数量少,都是集中养殖,2.95的指标就当时的情况来说并不高。而现在的情况已经大不一样了。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=20021]大口径石英毛细管柱测定美洛昔康中残留溶剂的方法[/url]
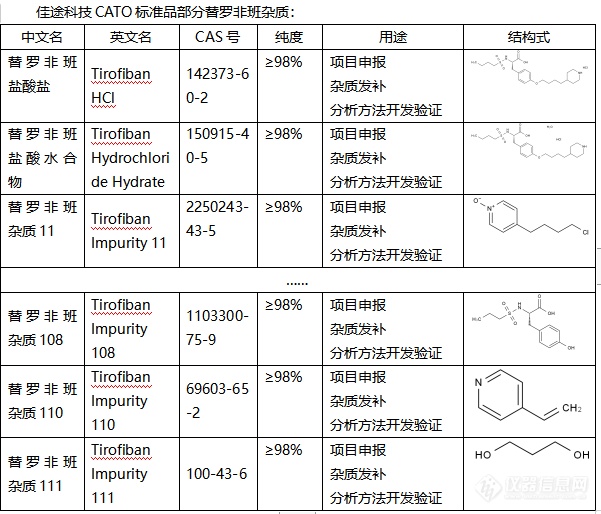
在当今的医疗领域,药物的质量控制至关重要,直接关系到患者的生命健康。替罗非班是一种广泛应用于心血管疾病治疗的药品,其质量控制尤为重要。而杂质分析作为药物质量控制的关键环节,能够准确评估药物的安全性和有效性。本文将重点探讨替罗非班杂质分析与CATO标准品应用研究的重要性。首先,杂质分析是确保药物质量的重要手段。在替罗非班的制备过程中,可能会产生一系列杂质,这些杂质的存在可能对药物的疗效和安全性产生不良影响。CATO标准品作为一种有效的分析工具,能够准确鉴定和量化替罗非班中的杂质,为药物的质量控制提供科学依据。其次,CATO标准品的应用有助于深入了解杂质的来源和性质。通过与标准品的比对分析,研究人员可以追溯杂质的产生途径,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。此外,CATO标准品在指导药物生产和改进方面也具有重要意义。通过对替罗非班中杂质的准确分析,生产商可以针对性地优化生产工艺、加强质量控制,从而提高药物的纯度和安全性。这不仅有助于保障患者的用药安全,还有助于提升企业的生产效益和市场竞争力。综上所述,替罗非班杂质分析与CATO标准品应用研究在药物质量控制中发挥着关键作用。通过深入研究替罗非班中的杂质,并借助CATO标准品这一强大工具,我们能够更好地了解杂质的来源、性质和影响,从而优化药物的生产工艺、提升药物的安全性和有效性。[img=,601,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021849065001_3752_6381568_3.png!w601x514.jpg[/img]欢迎有需要的各位联系
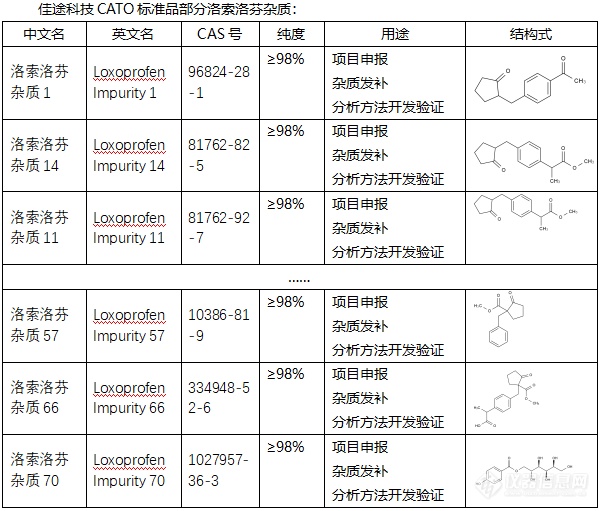
◇关于洛索洛芬杂质 洛索洛芬杂质是一种[font=Arial][color=#333333][font=宋体]非甾体抗炎[/font][/color][/font]杂质,具有镇痛、抗炎症以及解热作用。索洛芬钠杂质主要通过以下机制发挥药效:一、抑制环氧化酶:这种酶在炎症过程中起着重要作用,通过抑制它能够减少前列腺素的生成。二、[font=.pingfang sc]阻断前列腺素合成:洛索洛芬钠片通过作用于环氧合酶([/font]COX)的特定位置,阻止了前列腺素的合成,从而起到了抗炎和镇痛的效果。[font=UICTFontTextStyleBody] [/font][font=UICTFontTextStyleBody]CATO[/font]标准品提供的[font=宋体]洛索洛芬杂质[/font][font=宋体],有着广泛的作用,其中它的镇痛效果十分显著。[img=,601,511]https://ng1.17img.cn/bbsfiles/images/2024/02/202402041058193581_5312_6381607_3.png!w601x511.jpg[/img][/font]
请问糠氨酸标准品哪里有卖?麻烦告知糠氨酸的中英文化学名以及结构式。谢谢!
对照品:用于鉴别、检查、含量测定和校正检定仪器性能的标准物质;对照品由国家药品检定机构审查认可,其标准应不低于制品的质量标准。 标准品:用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。 对照品与标准品概念不清?对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质。标准品:用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已,造成错误的原因,可能是有的药品既有对照品,又有标准品。 例如:当用微生物法测定头孢克罗效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品。即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的。
[color=#333333]对照品与标准品概念[/color][color=#333333]对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质,而标准品系指用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示.文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已[1,2],造成错误的原因,可能是有的药品既有对照品,又有标准品.例如,当用微生物法测定头孢克罗效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品.即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的.[/color]

[font=宋体] 阿戈美拉汀杂质是在阿戈美拉汀的生产或保存过程中产生的非目标化合物。这些杂质可能会影响阿戈美拉汀的纯度和药效。阿戈美拉汀[/font][font=宋体]在临床上[/font][font=宋体][font=宋体]是一种治疗抑郁症的药物,属于褪黑素受体激动剂和[/font][font=Calibri]5-[/font][font=宋体]羟色胺受体拮抗剂。[/font][/font][font=宋体][font=宋体] 阿戈美拉汀杂质有多种类型,每一种都具有不同的化学特性,如[/font][font=Calibri]CAS[/font][font=宋体]号、分子式、分子量等。例如,阿戈美拉汀杂质[/font][font=Calibri]7-Desmethyl-3-hydroxyagomelatine[/font][font=宋体]([/font][font=Calibri]3-Hydroxy-7-desmethyl agomelatine[/font][font=宋体])是[/font][font=Calibri]Agomelatine[/font][font=宋体]的代谢产物,其[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]166526-99-4[/font][font=宋体],纯度为[/font][font=Calibri]98%[/font][font=宋体],具有特定的化学结构和性质。另一种阿戈美拉汀杂质是[/font][font=Calibri]AgoMelatine DiMer Urea[/font][font=宋体],其[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]185421-27-6[/font][font=宋体]。[/font][font=Calibri]CATO[/font][font=宋体]标准品提供的阿戈美拉汀全套的杂质[/font][/font][font=宋体],[/font][font=宋体]这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分[/font][font=宋体]。[img=,606,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402182106267012_9724_6381607_3.png!w606x514.jpg[/img][/font][font=宋体][color=#05073b][back=#fdfdfe] 广州[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]佳途科技[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]股份有限公司[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]深知药物研发与质量控制的重要性[/back][/color][/font][font=宋体][font=宋体],[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供阿戈美拉汀全套[/font][/font][font=宋体]的[/font][font=宋体]杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展[/font][font=宋体],[/font][font=宋体]以满足客户在药物研发和质量控制方面的需求。[/font]
韩国拟定修改健康或功能食品标准和禁用成分相关法规来源:中国技术性贸易措施网 2009年10月12日,韩国发布通报:韩国食品药物管理局拟定修改健康/功能食品标准规范。本拟定法规制定和增加包括食物纤维在内的32种健康/功能食品吸收成分提示的相关规定。它还制定了卵磷酯、瓜尔胶/瓜尔胶水解物、葡甘露聚糖、阿拉伯树胶及聚葡萄糖内的铅含量规范,增加了瓜尔胶/瓜尔胶水解物及抗麦芽糖糊精的功效要求。此外,准许蜂胶提取物成品制成软胶囊。 韩国食品药物管理局拟定修改健康/功能食品禁用成分相关法规。 本拟定法规扩大健康/功能食品禁用植物成分的范围。本拟定措施还将减肥药、糖尿病药物及其它同类物质纳入健康/功能食品禁用植物成分清单。
请问怎样用紫外可见分光光度计测乌洛托品的含量,标准曲线的溶液如何配制?
菌落总数是食品中重要的安全卫生指标,表示食品受细菌污染的程度。但很多人确不知道食品落菌总数的标准,上海尼那环保科技有限公司企业管理部摘录下,仅供参考。1、膨化食品的落菌总数标准依据国家强制性标准GB17401-2003《膨化食品卫生标准》规定,膨化食品的菌落总数应为≤10000cfu/g、大肠菌群应为≤90MPN/100g,超过国家标准规定可判断为不合格膨化食品。2、固体饮料的落菌总数标准依据国家强制性标准GB7101-2003《固体饮料卫生标准》规定,固体饮料产品的菌落总数应≤1000cfu/g;大肠菌群应≤90MPN/100g;霉菌应≤50cfu/g,超过国家标准规定可判断为不合格固体饮料。3、糕点、面包、月饼的落菌总数标准依据国家强制性标准GB 7099-2003《糕点、面包卫生标准》规定,月饼产品中菌落总数不得超过1500cfu/g,大肠菌群不得超过30MPN/100g,霉菌计数不得超过100cfu/g;蛋糕生产的标准要求:菌落总数≤10000cfu/g,大肠菌群≤300MPN/100g,霉菌≤150cfu/g,超过国家标准规定可判断为不合格糕点类产品。4、食醋的落菌总数标准依据国家强制性标准GB2719-2003《食醋卫生标准》规定,食醋中菌落总数不得超过10000cfu/mL ,超过国家标准规定可判断为不合格食醋。5、冷冻饮品的落菌总数标准依据国家强制性标准GB2759.1-2003《冷冻饮品卫生标准》规定,含淀粉或果类的冷冻饮品菌落总数应≤3000cfu/g,大肠菌群应≤100MPN/100g;含乳蛋的冷冻饮品的菌落总数应≤25000cfu/g,大肠菌群应≤450MPN/100g,超过国家标准规定可判断为不合格雪糕或冷饮。6、饼干的落菌总数标准依据国家强制性标准GB7100-2003《饼干卫生标准》规定,非夹心饼干的菌落总数不得超过750cfu/g,夹心饼干菌落总数不得超过2000cfu/g;饼干产品的霉菌计数不得超过50cfu/g,超过国家标准规定可判断为不合格饼干。7、巴氏杀菌、灭菌乳的落菌总数标准依据国家强制性标准GB19645 -2005《巴氏杀菌、灭菌乳卫生标准》规定,灭菌乳菌落总数不得超过10cfu/g,大肠菌群不得超过3MPN/100g,超过国家标准规定可判断为不合格乳制品。8、蜜饯的落菌总数标准依据国家强制性标准GB14884-2003《蜜饯卫生标准》规定,蜜饯食品中菌落总数不得超过1000cfu/g;霉菌不得超过50cfu/g,超过国家标准规定可判断为不合格乳蜜饯产品。9、调味品的落菌总数标准 依据SB/T10371-2003《鸡精调味料》标准规定,鸡精调味料中大肠菌群不得超过90MPN/100g,超过国家标准规定可判断为不合格鸡精产品。10、瓶装水的落菌总数标准依据国家强制性标准GB17324-2003《瓶装饮用纯净水卫生标准》规定,饮用纯净水的菌落总数应≤20cfu/ml,大肠菌群≤3MPN/100ml;强制性国家标准GB19298-2003《瓶(桶)装饮用水卫生标准》规定,饮用水的菌落总数应≤50 cfu/ml,大肠菌群应≤3MPN/100ml;强制性国家标准GB8537-1995《饮用天然矿泉水》规定,天然矿泉水的菌落总数为50cfu/ml,大肠菌群为0。若超过国家标准规定可判断为不合格纯净水或矿泉水。11、酱腌菜的落菌总数标准依据国家强制性标准GB2714-2003《酱腌菜卫生标准》规定,酱腌菜产品的大肠菌群不得超过30MPN/100g,若超过国家标准规定可判断为不合格酱腌菜。12、食糖的落菌总数标准依据国家强制性标准GB13104-2005《食糖卫生标准》规定,白砂糖、绵白糖的菌落总数不得超过100cfu/g,超过国家标准规定可判断为不合格糖制品。13、肉干、肉铺的落菌总数标准依据强制性国家标准GB2726-2005《熟肉制品卫生标准》规定,肉制品中大肠菌群不得超过30MPN/100g,超过国家标准规定可判断为不合格肉制品。14、油炸小食品的落菌总数标准依据国家强制性标准GB16565-2003 《油炸小食品卫生标准》规定,油炸类炒货大肠菌群为≤30MPN/100g,超过国家标准规定可判断为不合格炒货制品。15、果、蔬汁饮料的落菌总数标准依据国家强制性标准GB19297-2003《果、蔬汁饮料卫生标准》规定,果(蔬)汁及果(蔬)汁饮料产品的菌落总数不得超过100cfu/mL,酵母不得超过20cfu/mL,超过国家标准规定可判断为不合格果、蔬汁饮料。16、果冻的落菌总数标准依据国家强制性标准GB19299-2003《果冻卫生标准》规定,果冻中菌落总数≤100cfu/g、大肠菌群≤30MPN/100g,超过国家标准规定可判断为不合格果冻产品。17、黄酒的菌落总数标准依据国家强制性标准GB2758-2005《发酵酒卫生标准》规定,黄酒产品的菌落总数应≤50cfu/ml,超过国家标准规定可判断为不合格黄酒。18、芝麻酱的菌落总数标准依据国家标准规定芝麻酱产品的大肠菌群应≤90个/100g,超过国家标准规定可判断为不合格芝麻酱。19、碳酸饮料的菌落总数标准依据国家强制性标准GB2759.2-2003《碳酸饮料卫生标准》规定,碳酸饮料产品的酵母应≤10cfu/mL,菌落总数应≤100cfu/mL,大肠菌群应≤6MPN/100mL;超过国家标准规定可判断为不合格碳酸饮料。20、熟肉制品的菌落总数标准强制性国家标准GB2726-2005《熟肉制品卫生标准》规定,菌落总数标准限量值为≤30000cfu/g,超过国家标准规定可判断为不合格熟肉制品。21、豆制品及面筋的菌落总数标准依据国家强制性标准GB2711-2003《非发酵性豆制品及面筋卫生标准》规定,定型包装非发酵豆制品的菌落总数为≤750 cfu/g;依据国家强制性标准GB2712-2003《发酵性豆制品卫生标准》规定,定型包装发酵性豆制品的大肠菌群为≤30MPN/100g。若超过国家标准规定可判断为不合格豆制品或面筋。22、方便面的菌落总数标准依据国家强制性标准GB17400-2003《方便面卫生标准》规定,方便面的面块+调料菌落总数为≤50000cfu/g,大肠菌群为≤150 MPN/100g,超过国家标准规定可判断为不合格方便面。
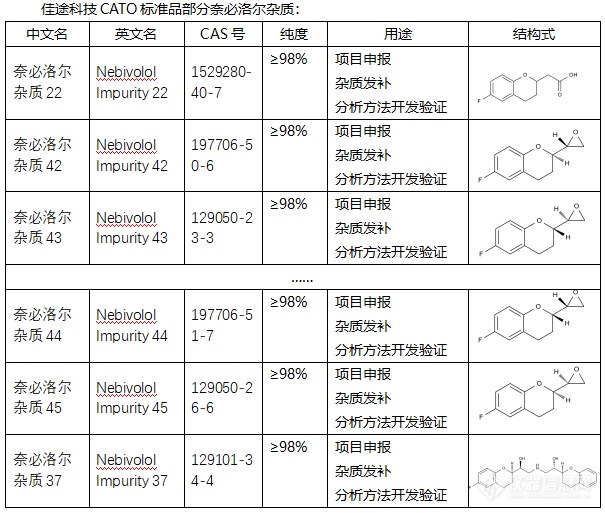
[font=宋体]◇[/font][b][font=宋体]奈必洛尔[/font][/b][font=宋体]杂质[/font][font=宋体][font=宋体] 奈必洛尔杂质是指在奈必洛尔([/font][font=Calibri]Nebivolol[/font][font=宋体])的生产或保存过程中产生的非目标化合物。奈必洛尔杂质有多种,包括但不限于以下几种:奈比洛尔杂质([/font][font=Calibri]L-[/font][font=宋体]奈必洛尔),英文名称为[/font][font=Calibri](-)-Nebivolol[/font][font=宋体],[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]118457-16-2[/font][/font][font=宋体];[/font][font=宋体][font=宋体]奈必洛尔杂质[/font][font=Calibri]9[/font][font=宋体],[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]920275-23-6[/font][/font][font=宋体];[/font][font=宋体][font=宋体]奈必洛尔杂质[/font][font=Calibri]C[/font][font=宋体](非对映体混合物),英文名为[/font][font=Calibri]Nebivolol Impurity C (Mixture of Diastereomers)[/font][/font][font=宋体];[/font][font=宋体][font=宋体]奈必洛尔杂质[/font][font=Calibri]B[/font][font=宋体],英文名为[/font][font=Calibri]Nebivolol impurity B[/font][font=宋体],[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]119365-25-2[/font][/font][font=宋体];[/font][font=宋体][font=宋体]去氟奈必洛尔,英文名为[/font][font=Calibri]Desfluoro Nebivolol[/font][/font][font=宋体];[/font][font=宋体][font=宋体]奈必洛尔杂质[/font][font=宋体]Ⅰ和奈必洛尔杂质Ⅱ等。[/font][/font][font=宋体][font=Calibri] CATO[/font][font=宋体]标准品提供的[/font][/font][b][font=宋体]奈必洛尔[/font][/b][font=宋体]全套的杂质[/font][font=宋体],[/font][font=宋体]这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分[/font][font=宋体]。[/font][img=,605,513]https://ng1.17img.cn/bbsfiles/images/2024/02/202402182153192686_9605_6381607_3.png!w605x513.jpg[/img][font=宋体][color=#05073b][back=#fdfdfe] 广州[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]佳途科技[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]股份有限公司[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]深知药物研发与质量控制的重要性[/back][/color][/font][font=宋体][font=宋体],[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供[/font][/font][b][font=宋体]奈必洛尔[/font][/b][font=宋体]全套[/font][font=宋体]的[/font][font=宋体]杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展[/font][font=宋体],[/font][font=宋体]以满足客户在药物研发和质量控制方面的需求。[/font]
[b]Q:[b][b][b][/b][/b]吡罗昔康注射液的检测,应用编号是?[/b]A:103260===============================================================【活动内容】1、每个工作日上午10:00左右发布一个关于应用数据库的应用问答题,版友根据题目给出自己理解的答案。2、每个工作日下午15:10公布参考答案。【活动奖励】幸运奖:抽奖软件,当天随机抽取3个或5个回答正确的版友ID号(最后一个ID号,截止至下午15:00),每人奖励[color=#ff0000]2钻石币[/color](抽奖人数≤10,抽取3个版友;抽奖人数>10,抽取5个版友);中奖名单:zimeng3211(注册ID:zimeng3211)初心(注册ID:m3170710)yifan1117(注册ID:yifan1117)yy_0324(注册ID:yy_0324)zengzhengce163(注册ID:zengzhengce163)[img=,690,388]https://ng1.17img.cn/bbsfiles/images/2018/11/201811201514021392_9421_1610895_3.png!w690x388.jpg[/img][img=,690,388]https://ng1.17img.cn/bbsfiles/images/2018/11/201811201514045012_1219_1610895_3.png!w690x388.jpg[/img]积分奖励:所有回答正确的版友奖励[color=#ff0000]10个积分[/color](幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次[/b][align=left][color=#ff0000][b]PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。[/b][/color][/align][align=left][color=#ff0000][b] 下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。[/b][/color][/align][align=center]=======================================================================[/align]方法:HPLC基质:标准溶液应用编号:103260化合物:吡罗昔康色谱柱:[url=http://www.dikma.com.cn/product/details-817.html]Leapsil C18 2.7μm 100 x 4.6mm[/url]样品前处理:对照品溶液:取吡罗昔康对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含40μg的溶液。色谱条件:色谱柱:Leapsil C18 100*4.6 mm,2.7 μm (Cat#:86002)流动相:乙腈:0.05 mol/L磷酸二氢钾溶液(磷酸调pH=3.0)=35:65流速: 1 mL/min柱温: 30 ℃检测器: UV 246 nm (含量测定) 230 nm (有关物质)进样量: 20 μL文章出处:天津应用实验室关键字:吡罗昔康注射液、吡罗昔康、2015药典、Leapsil C18、HPLC摘要:Leapsil C18检测吡罗昔康。图谱:[img]http://www.dikma.com.cn/u/image/2014/09/16/1410847870119331.png[/img][img]http://www.dikma.com.cn/u/image/2014/09/16/1410847874126173.png[/img]
食品微生物检测,菌落总数限量标准规定样品中蛋白质含量大于40%时,菌落总数限量为40000,如果是氨基酸含量大于40%是否适用于这一限量标准呢?(正常情况下的限量标准是1000)
关于勘误“抗饥消渴片”药品标准有关内容的函更新日期: 2014年9月26日 下午1:36 各省(自治区、直辖市)食品药品监督管理局:“抗饥消渴片”(标准编号为WS3-B-0280-90-1)为中药增加规格转正品种。经我委核对,该标准中【功能与主治】项下“抗津止渴”应更正为“抗饥止渴”。特此勘误,请及时通知辖区内相关企业遵照执行。国家药典委员会2014年9月26日
2011年2月15日,新西兰食品安全局(NZFSA)公布了2011年食品农化物最大残留限量标准。此次涉及的农化物包括阿维菌素、乙酰甲胺磷、阿苯达唑、氯氨吡啶酸、双甲脒、氨基三唑、阿莫西林、氨苄青霉素、安普罗铵、阿泊拉霉素、艾维激素、阿扎康唑、甲基谷硫磷、三唑锡、嘧菌酯、巴喹普林等256种化学物质,涵盖的食品范围包括鳄梨、猕猴桃、梨果、草莓;牛脂肪、牛肝脏、牛肉、绵羊脂肪、绵羊肾、绵羊肝、绵羊肉等126种,其中涉及最多的三类食品依次为梨果(43种),葡萄(34种),马铃薯(32种)。此次规定了食品中氯霉素的最大残留限量标准为0.0003mg/kg,是被允许的最大残留限量值中最低的。
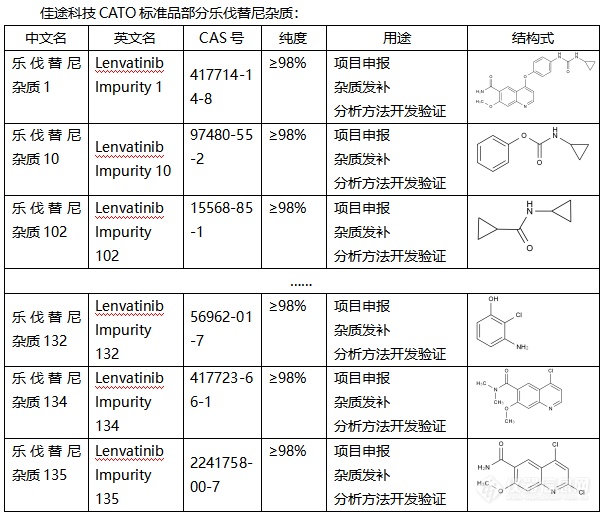
乐伐替尼,作为现代医学的瑰宝,广泛应用于肿瘤治疗领域。然而,就像其他药物一样,乐伐替尼在生产过程中也可能会产生杂质。这些微小的杂质,虽然量少,却可能对药物的疗效和安全性产生不可忽视的影响。为了确保乐伐替尼的纯净与安全,科学家们引入了CATO标准品进行杂质分析。CATO标准品,就像一把精准的尺子,能够帮助研究人员准确地检测和衡量乐伐替尼中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这项应用研究不仅提升了乐伐替尼的生产质量,更为患者的安全用药提供了有力保障。借助CATO标准品,我们能够及时发现并控制杂质,确保每一颗乐伐替尼都是纯净、有效的。未来,随着科学技术的不断进步,我们期待看到更多关于乐伐替尼杂质分析的研究成果,为患者带来更加安全、可靠的治疗方案。同时,也期待CATO标准品在更多药物杂质分析中发挥重要作用,守护人类的健康与安全。[img=,603,515]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021836237186_8744_6381568_3.png!w603x515.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,我们目前库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并支持溯源。我们公司已经通过了国内外双ISO 17034质量体系认证,欢迎广大客户选购。
小弟想请问一下打开后的抗生素标准品该如何存放啊?谢谢大家
食品安全国家标准食品微生物学检验 菌落总数测定
求购β—胡萝卜素标准品,急需!
[font=SimSun, STSong, &]2024年3月12日,国家卫生健康委员会发布了《食品安全国家标准 食品添加剂使用标准》(GB 2760-2024),并将于2025年2月8日实施。食品伙伴网将2024版GB 2760与2014版及其纳入新版标准中的增补公告进行了比对分析,以下概述了2024版GB 2760较2014版的整体变化及各个附表的主要变化,供相关食品企业参考。[/font][font=SimSun, STSong, &]一、纳入了增补公告批准使用的添加剂[/font][font=SimSun, STSong, &]为了方便标准使用者查询,GB 2760-2024纳入了GB 2760-2014实施以来国家卫生健康委以公告形式批准使用的食品添加剂品种和使用规定,截至国家卫生健康委2023年第5号公告。[/font][font=SimSun, STSong, &]二、正文的修订情况[/font][font=SimSun, STSong, &](1)修订食品添加剂定义,在定义中增加了营养强化剂的内容,并明确营养强化剂的使用应符合《食品安全国家标准 食品营养强化剂使用标准》(GB14880)和相关规定。[/font][font=SimSun, STSong, &](2)修订INS和CNS定义,并明确说明当CAC的INS号发生变化时以CAC的INS号为准。[/font][font=SimSun, STSong, &](3)“4食品分类系统”的修改:删除“如允许某一食品添加剂应用于某一食品类别时,则允许其应用于该类别下的所有类别食品,另有规定的除外”内容,将其体现在附录A的A.3中。[/font][font=SimSun, STSong, &](4)增加了“8食品添加剂的功能类别”“9附录A中食品添加剂使用规定索引”“10营养强化剂”“11胶基糖果中基础剂物质”内容。[/font][font=SimSun, STSong, &]三、附录A的修订情况[/font][font=SimSun, STSong, &](1)修改附录A中食品添加剂使用规定的查询方式。将2014版标准中表A.3的内容体现到表A.1和表A.2中,原表A.2合并入表A.1。2024版标准中表A.2规定了表A.1中例外食品编号对应的食品类别。[/font][font=SimSun, STSong, &](2)修订食品添加剂的使用规定。进一步明确继承原则和完善相同色泽着色剂、防腐剂、抗氧化剂总和不超过1原则的描述,实质性要求未变化。[/font][font=SimSun, STSong, &]2024版标准规定“表A.1列出的食品添加剂按照规定的使用范围和最大使用量使用。如允许某一食品添加剂应用于某一食品类别时,则允许其应用于该类别下的所有类别食品,另有规定的除外。下级食品类别中与上级食品类别中对于同一食品添加剂的最大使用量规定不一致的,应遵守下级食品类别的规定”。[/font][font=SimSun, STSong, &]1、表A.1的修订情况[/font][font=SimSun, STSong, &](1)修订部分食品添加剂品种和/或使用规定。删除了落葵红、密蒙黄、酸枣色、2,4-二氯苯氧乙酸、海萝胶、偶氮甲酰胺;删除了罐头类食品中防腐剂的使用规定,涉及ε-聚赖氨酸盐酸盐、乳酸链球菌素、山梨酸及其钾盐、稳定态二氧化氯;删除食醋中冰乙酸、果蔬汁浆中纳他霉素、蒸馏酒中β-胡萝卜素和双乙酰酒石酸单双甘油酯、凉果类和话梅类中滑石粉、“16.07其他(发酵工艺)”中聚氧乙烯木糖醇酐单硬脂酸酯等的使用规定;[/font][font=SimSun, STSong, &](2)修改了部分食品添加剂的使用要求。增加了阿斯巴甜、安赛蜜与天门冬酰苯丙氨酸甲酯乙酰磺胺酸等在相同食品类别中共同使用时的总量要求;完善了饮料类别中液体饮料与相应的固体饮料食品添加剂使用的对应关系,修改备注为“以即饮状态计,相应的固体饮料按稀释倍数增加使用量”。修订了二氧化硫、脱氢乙酸及其钠盐等在部分食品类别中的使用规定;将原标准中归类为“其他类”的部分食品类别重新进行了归类,并调整了相应的食品添加剂使用规定等;[/font][font=SimSun, STSong, &](3)修改了部分食品添加剂的基本信息。例如修改了苯甲酸及其钠盐等食品添加剂的中文名称、中国编码(CNS号);爱德万甜等食品添加剂的英文名称和国际编码(INS号)等。[/font][font=SimSun, STSong, &]2、表A.2的修订情况[/font][font=SimSun, STSong, &]2024版表A.2为表A.1中例外食品编号对应的食品类别,相对于2014版GB2760的表A.3,其主要变化如下:[/font][font=SimSun, STSong, &](1)修订食品类别名称:如将“灭菌乳”修订为“灭菌乳和高温杀菌乳”,在该分类下增加了“高温杀菌乳”;将“白糖及白糖制品(如白砂糖、绵白糖、冰糖、方糖等)”修订为“白砂糖及白砂糖制品、绵白糖、红糖、冰片糖”,将原11.01.02 的红糖、冰片糖整合至11.01.01。删除了“等”字,说明除已在11.01.01名称中列明的,其他的全部转入11.01.02类别中的“其他糖”。[/font][font=SimSun, STSong, &](2)细分部分食品分类:如2014版“02.01(基本不含水的脂肪和油)”大类修改为02.01的细分类“02.01.01.01(植物油)、02.01.01.02(氢化植物油)、02.01.02(动物油脂(包括猪油、牛油.鱼油和其他动物脂肪等))、02.01.03(无水黄油、无水乳脂)”。[/font][font=SimSun, STSong, &]四、附录B的修订情况[/font][font=SimSun, STSong, &](1)修订食品用香料、香精使用原则。进一步明确具有其他食品添加剂功能或其他食品用途的食品用香料的使用要求,应配制成食品用香精用于食品加香。如:苯甲酸、肉桂醛、瓜拉纳提取物、双乙酸钠(又名二醋酸钠)、琥珀酸二钠、磷酸三钙、氨基酸类等。[/font][font=SimSun, STSong, &]1、表B.1的修订情况[/font][font=SimSun, STSong, &]2024版表B.1为不得添加食品用香料、香精的食品名单,相对于2014版GB 2760,其主要变化如下:[/font][font=SimSun, STSong, &](1)修订食品类别名称:将“灭菌乳”修订为“灭菌乳和高温杀菌乳”,在该分类下增加了“高温杀菌乳”;[/font][font=SimSun, STSong, &](2)新增食品分类:增加“13.02 婴幼儿辅助食品”类别,通过新增食品类别从而进一步明确禁止“婴幼儿辅助食品”使用香精香料。[/font][font=SimSun, STSong, &]2、表B.2、B.3的变化[/font][font=SimSun, STSong, &]修改完善了部分食品用香料品种。梳理了表B.2和表B.3的食品用香料名单,进行以下调整:[/font][font=SimSun, STSong, &](1)删除了多个香料品种。删除了枯茗油、葫芦巴、玫瑰茄、石榴果汁浓缩物、玉米穗丝、3-乙酰基-2,5-二甲基噻吩、氨基乙酸(羟基乙腈法)。其中,枯茗油、葫芦巴已为香辛料,玫瑰茄、石榴果汁浓缩物、玉米穗丝已为普通食品,3-乙酰基-2,5-二甲基噻吩行业已不再使用。[/font][font=SimSun, STSong, &](2)非洲竹芋提取物由合成香料调整为天然香料。[/font][font=SimSun, STSong, &](3)大茴香脑、根皮素由天然香料调整为合成香料。[/font][font=SimSun, STSong, &](4)多项香料修改或增加的中英文名称、FEMA编号、编码。例如:葡萄糖基甜菊糖苷、非洲竹芋提取物、6-甲基辛醛、香兰醇、4-癸烯酸等。[/font][font=SimSun, STSong, &]五、附录C的修订情况[/font][font=SimSun, STSong, &]1、表C.1、C2的修订情况[/font][font=SimSun, STSong, &]2024版表C.1为可在各类食品加工过程中使用,残留量不需限定的加工助剂名单(不含酶制剂),表C.2为需要规定功能和使用范围的加工助剂名单(不含酶制剂),相对于2014版GB 2760,其主要变化如下:[/font][font=SimSun, STSong, &](1)明确过氧化氢的使用范围。将过氧化氢从表C.1中删除,列入表 C.2,并规定其功能为“脱硫剂、脱色剂、去碘剂”,使用范围为“淀粉糖和淀粉加工工艺、油脂加工工艺、海藻加工工艺、胶原蛋白肠衣加工工艺、乳清粉和乳清蛋白粉的加工工艺”。[/font][font=SimSun, STSong, &](2)删除了1,2-二氯乙烷、矿物油、磷酸铵、抗坏血酸、抗坏血酸钠5个加工助剂品种。根据JECFA最新评估结果,同时参考美国、欧盟的规定,删除了1,2-二氯乙烷品种和使用规定。将矿物油使用规定与白油(液体石蜡)的使用规定进行整合。将磷酸铵使用规定与磷酸氢二铵和磷酸二氢铵进行整合。将抗坏血酸和抗坏血酸钠纳入附录A进行规定。[/font][font=SimSun, STSong, &](3)修订部分加工助剂的功能和使用范围。例如,删除了β-环状糊精用于巴氏杀菌乳、灭菌乳的规定;增加离子交换树脂用于糖处理工艺的规定;删除了白油(液体石蜡)功能中的“被膜剂”功能,增加了“防黏剂”功能。[/font][font=SimSun, STSong, &](4)统一规范了消泡剂的使用规定。删除了表A.1中丙二醇和吐温类中的消泡剂功能,在表 C.2 丙二醇的功能中增加消泡剂,删除了表A.1中吐温类用于豆类制品的使用规定,在表 C.2 中吐温类的使用范围中增加“豆类制品(最大使用量为0.05g/kg,最大使用量以每千克黄豆的使用量计)”。[/font][font=SimSun, STSong, &](5)修订部分加工助剂的中英文名称表述。例如,氮气修改为“氮气(液氮)”,6号轻汽油(植物油抽提溶剂)修改为“植物油抽提溶剂”,植物活性炭(稻壳活性炭)修改为“植物活性炭(稻壳来源)”。[/font][font=SimSun, STSong, &]2、表C.3的修订情况[/font][font=SimSun, STSong, &]2024版表C.3为食品用酶制剂及其来源名单,相对于2014版GB 2760,其主要变化如下:[/font][font=SimSun, STSong, &](1)新增1中酶制剂。新增“普鲁兰酶(Pullulanase),来源为李氏木霉Trichodermareesei,供体为Aspergillusnishimurae”。[/font][font=SimSun, STSong, &](2)删除1种酶制剂。删除了“溶血磷脂酶(磷脂酶B)Lysophospholipase (lecithinase B),来源为李氏木霉Trichoderma reesei,共体为Aspergillus nishimurae”。[/font][font=SimSun, STSong, &](3)修订部分酶制剂的中英文名称。例如,果糖基转移酶(又名β-果糖基转移酶)修改为“蔗糖1-果糖转移酶(又名果糖基转移酶 )”,纤维二糖酶修改为“β-葡萄糖苷酶(又名纤维二糖酶)”,果胶酯酶修改为“果胶酯酶(果胶甲基酯酶)”,葡糖异构酶修改为“葡糖异构酶(木糖异构酶)”。[/font][font=SimSun, STSong, &](4)修订部分酶制剂来源或供体名称、供体的描述。[/font][font=SimSun, STSong, &]六、附录D的修订情况[/font][font=SimSun, STSong, &](1)附录D中增加了营养强化剂的编号D.16,并根据GB 14880的规定增加了营养强化剂的定义。[/font][font=SimSun, STSong, &](2)根据GB 30616-2020中关于食品用香料的定义,将D.21食品用香料定义修改为“添加到食品产品中以产生香味、修饰香味或提高香味的物质”。[/font][font=SimSun, STSong, &]七、附录E的修订情况[/font][font=SimSun, STSong, &]为了使食品分类描述更加科学合理,进一步规范了部分食品类别的描述,表E.1的主要变化如下:[/font][font=SimSun, STSong, &]2024版表E.1为食品分类系统,相对于2014版GB 2760,其主要变化如下:[/font][font=SimSun, STSong, &](1)新增7个食品类别。在相关食品类别中增加兜底的其他类别,如06.03.02.06其他小麦粉制品(如面筋等)、06.05.02.05其他淀粉制品(如凉粉等)、06.12其他粮食制品、08.02.03肉丸类、08.02.04其他预制肉制品、12.10.03.05其他液体复合调味料;增加了16.05食品加工用菌种制剂(16.04除外)。[/font][font=SimSun, STSong, &](2)为与相关食品产品的食品安全国家标准保持协调一致,修改了部分食品类别。删除12.03.01酿造食醋、12.03.02配制食醋、12.04.01酿造酱油、12.04.02配制酱油、12.05.01酿造酱,将配制酱油和配制食醋归入12.10.03液体复合调味料;删除12.05.02配制酱,将其归入12.10.02 半固体复合调味料,并将大类12.05食品类别名称修改为“酿造酱”。并对相应的食品添加剂使用规定进行修改。[/font][font=SimSun, STSong, &](3)调整部分食品类别。例如:1.01分类中增加了“高温杀菌乳”;修改了蜜饯凉果的食品分类;调整食糖、调味酱的分类;删除半起泡葡萄酒食品分类;将原08.03.07.03 肉脯类调整至08.03.02“熏、烧、烤肉类(熏肉、叉烧肉、烤鸭、肉脯等);将09.02.03分类的名称由“冷冻鱼糜制品(包括鱼丸等)修改为“冷冻水产糜及其制品(包括冷冻丸类产品等)”;[/font][font=SimSun, STSong, &](4)修订部分食品分类号。将“面糊(如用于鱼和禽肉的拖面糊)、裹粉、煎炸粉”的食品分类号由“06.03.02.04”调整为“06.11”。[/font]
大家有没有用过中检所的抗生素标准品的?如头孢氨苄、阿莫西林等,我正在用,结果用液质联用检测出两个色谱峰,质谱结果显示,这两个峰都是同一种物质,猜测标准品不纯,是同分异构体的混合物,大家有没有类似的遭遇?
纺织品抗菌和防霉测试标准应该从哪个网站上查找能得到最新有效版本?
全球首个每日一次给药的蛋白酶抑制剂锐艾妥(阿扎那韦)日前被中国国家食品药品监督管理局批准在中国上市。锐艾妥是由百时美施贵宝公司自主研发的新型蛋白酶抑制剂,具有持续强效抑制HIV病毒、低耐药、用药方便、对脂肪代谢副作用小等特点。 蛋白酶是HIV病毒复制所必需的物质,而蛋白酶抑制剂能有效阻断HIV蛋白酶的合成。作为一种强效的蛋白酶抑制剂,锐艾妥与其他抗病毒药物联合应用于艾滋病的抗病毒治疗,在从未接受过抗病毒治疗的初治患者中,临床试验研究至今,耐药率只有2%。自2003年6月在美国获准上市,截止到2006年底,仅在美国就已有约13万名患者受益于锐艾妥。 “在抗病毒初治的艾滋病患者中,含有锐艾妥的方案疗效相当于目前的标准治疗方案,但是锐艾妥由于每日一次给药、对脂肪代谢副作用小、耐药率低、且与其他蛋白酶抑制剂无交叉耐药等特点,使其更具优势。”中国疾病预防控制中心性病艾滋病预防控制中心主任、锐艾妥在中国的临床试验主要研究者张福杰医生说。 “在抗病毒经治患者中,锐艾妥需要与利托那韦联合使用,与目前的标准治疗方案,如克力芝相比,疗效相当;而锐艾妥在现有蛋白酶抑制剂中对脂肪代谢的副作用最小。”对脂肪代谢的副作用增大可引起患者血脂升高,可能增加心血管疾病的危害性。 据张福杰医生介绍,在中国,每年大约新增5000至10000名从未接受过治疗的HIV/AIDS病人,政府免费诊治的病人数已超过36000人,并以每年6000人左右的速度递增,其中约20%的患者对一线的治疗方案产生耐药而需要二线治疗药物。 “百时美施贵宝公司是全球三大抗艾药物研发和生产厂商之一。继在中国上市抗艾药物赛锐特TM(司坦夫定)和惠妥滋(去烃肌苷)后,我们很高兴今天又能上市代表全球范围内最新医学成果的抗艾新药锐艾妥。”百时美施贵宝公司(中国)总裁柯彼呐先生说,“希望这一创新药物能够为更多的中国艾滋病患者提供更好的治疗选择。” 据联合国艾滋病规划署和世界卫生组织的最新统计,自世界上首例艾滋病于1981年6月被美国疾病控制中心(CDC)确认以来,截止2003年,艾滋病已在全球范围内夺走约3000万人的生命,而HIV感染的成人及儿童已逾4000万人,每年新增500多万HIV感染病例。若不能有效的预防控制,预计20年后HIV感染者将达2亿人。 自我国在1985年发现首例艾滋病人以来,据卫生部发表的通报显示,截止2006年10月31日,全国历年累计报告艾滋病达183,733例,其中艾滋病病人40,667例;死亡12,464例。 关于锐艾妥 一项对锐艾妥II和III期试验的关键数据的分析显示,锐艾妥除了在血脂代谢方面具有独特的优点外,还有独特的耐药性表现。资料表明,如果初治患者中出现锐艾妥耐药性,总会发生特异性的I50L突变。这种特异突变导致病毒对锐艾妥的敏感性下降,与其他蛋白酶抑制剂无交叉耐药,且在体外对其他蛋白酶抑制剂的敏感性增强。对于首次用药的患者,先用锐艾妥保留未来使用其他蛋白酶抑制剂的可能性。 一项III期研究(AI424-034)的结果显示,在初治患者中,经过48周的治疗后,锐艾妥+拉米夫定+齐多夫定(n=405)的抗病毒疗效与SUSTIVA(依发韦仑)+拉米夫定+齐多夫定的标准治疗方案(n=405)相似。 另一项III期试验(AI424-045)中,比较了增强的锐艾妥300mg+两种核苷类逆转录酶抑制剂(NRTIs)的联合用药方案(n=120)和用利托那韦增强的洛匹那韦+两种NRTIs的联合用药方案(n=120)在接受过治疗的患者中的应用。在这项研究中,含有增强的锐艾妥的治疗方案不亚于标准治疗方案克力芝方案(洛匹那韦/利托那韦),且含有锐艾妥的治疗方案脂肪代谢的副作用明显少于克力芝方案。对于抗病毒初治患者,锐艾妥的推荐用量为400mg(两粒200mg的胶囊),每天一次,餐后给药,与其他抗逆转录病毒药物联用。更多信息请登录www.reyataz.com 查阅完整的处方药资料。 锐艾妥不能治愈HIV或阻止HIV的传播。
在抗生素类的标准物质使用时,经常会遇到标准品和对照品的概念。关于这二者的区别,现在比较流行的说法是在做HPLC时使用的标准物质应为对照品。摘录典型观点如下:[B]“标准品都是按效价单位(或μg)计,以国际标准品进行标定。标准品的标示量是按生物活性来计算的,不是按纯度来标示,此种标示法对单组分或多组分物质均适用,尤适用于多组分物质,如乙酰螺旋霉素标准品,是由4种有效成分组成,若欲于一个纯度来标示其含量是不可能的,但用效价(即生物活性)来标示是可行的;对照品的标示量则必定是某单一组分的纯度指标。所以日常工作中,标准品和对照品在定量时是不可相互替代的。以罗红霉素为例,现今是国家标准品与对照品并存,以抗生素微生物检定法测其含量时,必须使用罗红霉素标准品;但以HPLC法测定其含量时,又必须使用罗红霉素对照品,不可混淆。”[/B]但是我见过一些行业标准,比方说HPLC测土霉素残留中,在说到标准液的配制时,写得就是“土霉素标准品”。难道这里面的“标准品”是“对照品”的错误用法?[em0716] 请大家发表一下看法
请问大家是如何称取微量的抗生素标准品的:用0.0000g的天枰称取5-10mg能准确吗?还有是能用药勺取药品吗?网上有人说使用药勺可能导致标准品污染
请问哪位老师知道抗芯吸测试标准?包括测试纱线抗芯吸性能以及纺织品抗芯吸性能的标准。谢谢。

[font=宋体]◇培美曲塞杂质[/font][font=宋体][font=宋体] 培美曲塞杂质是在培美曲塞的生产或保存过程中产生的非目标化合物。培美曲塞杂质有多种类型,每一种都具有不同的化学特性,如[/font][font=Calibri]CAS[/font][font=宋体]号、分子式、分子量等。例如,培美曲塞杂质[/font][font=Calibri]D[/font][font=宋体]([/font][font=Calibri]Pemetrexed Impurity D[/font][font=宋体])的[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]155405-79-1[/font][font=宋体],英文名称为[/font][font=Calibri]Pemetrexed Impurity D[/font][font=宋体],别名包括培美曲塞[/font][font=Calibri]EP[/font][font=宋体]杂质[/font][font=Calibri]D[/font][font=宋体]、培美曲塞杂质[/font][font=Calibri]04[/font][font=宋体](单体)等。培美曲塞杂质[/font][font=Calibri]10[/font][font=宋体]的[/font][font=Calibri]CBNumber[/font][font=宋体]为[/font][font=Calibri]CB02508197[/font][font=宋体],分子式为[/font][font=Calibri]C19H17N5O5[/font][font=宋体],分子量为[/font][font=Calibri]395.37[/font][font=宋体]。培美曲塞杂质[/font][font=Calibri]12[/font][font=宋体]的[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]155405-79-1[/font][font=宋体],英文名称为[/font][font=Calibri]Pemetrexed Impurity 12[/font][/font][font=宋体]。[/font][font=宋体][font=Calibri] CATO[/font][font=宋体]标准品提供的培美曲塞全套的杂质[/font][/font][font=宋体],[/font][font=宋体]这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分[/font][font=宋体]。[/font][img=,610,513]https://ng1.17img.cn/bbsfiles/images/2024/02/202402182201065910_2598_6381607_3.png!w610x513.jpg[/img][font=宋体][color=#05073b][back=#fdfdfe] 广州[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]佳途科技[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]股份有限公司[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]深知药物研发与质量控制的重要性[/back][/color][/font][font=宋体][font=宋体],[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供培美曲塞全套[/font][/font][font=宋体]的[/font][font=宋体]杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展[/font][font=宋体],[/font][font=宋体]以满足客户在药物研发和质量控制方面的需求[/font][font=宋体]。[/font]