
LC-MSMS做拉米夫定标准品,不知为啥一直有个明显肩峰。图谱在附件里http://ng1.17img.cn/bbsfiles/images/2013/09/201309051141_462516_2167114_3.bmp
我需要拉米夫定的标准红外谱图!自己做了一张,但是和客户的那一张对不起来,所以恳请好心人帮忙了.如果有此标准谱图的请发到我的邮箱:wuai-111@163.com先谢谢了!
拉米夫定由英国葛兰素史克公司(GlaxoSmithKline)开发研制生产,1995年首次在加拿大、美国上市销售,1998年在中国上市,商品名贺普丁。目前,在我国市场上销售的拉米夫定及其复方制剂是由史克公司独家销售。拉米夫定及其片剂和口服液于1999年4月10日授权在中国获得药品行政保护,保护期将于2006年10月终止。拉米夫定全球专利将于2006年9月到期。拉米夫定是近年新上市的一种抗乙肝病毒新药,其英文名称为Lamivudine,又称3—TC。是一种核苷类抗病毒药,对人类免疫缺陷病毒和乙型肝炎病毒均具有显著的抑制活性,是治疗艾滋病和乙型肝炎的具有显著疗效的药物。拉米夫定是第一个经美国FDA以及中国食品药品监督管理局批准的口服抗乙肝病毒药物。由于拉米夫定问世时间早,很长一段时间都是临床药物研究的“宠儿”,又由于其临床相对比较安全,应用较为广泛。现阶段,拉米夫定是乙肝病毒感染的一线治疗药物。拉米夫定的缺点:拉米夫定易出现耐药现象。但并未影响该药的销售额。据中国医药商业协会最新报道,2003年全国 28家主要医药批发公司畅销药品中,拉米夫定排名第13位,销售额为3.06亿元,在46种抗感染药品中占4.33%。2002年贺普丁世界性销售额为2.95亿英镑,2003 年为2.93亿英镑,折合4.8亿美元。2003年,贺普丁在我国16城市样本医院销售额排名41位,用药金额8011万元,其中进口药品占60.62%,是英国葛兰素和WELLCOME(UK)两家公司,该药在全国市场的销售额约为8亿多元。2004年为7311.43万元,仍占全身用抗病毒药物的38%,而在全国医院销售额已达到6亿~8亿元的市场规模。2005年上半年样本医院购入药物是苏州葛兰素史克、英国葛兰素史克和WELLCOME(UK)公司的药物,各厂商分别占据了51.03%、47.92%和1.05%的份额。迄今为止,全球每年约有80万人使用贺普丁,拉米夫定目前在中国的终端销售额达到10亿元人民币左右,在中国药品市场单品销售排行榜上位列第二。 拉米夫定原料药及其制剂目前均为进口药品。目前原料药及其制剂,国内尚未有生产厂家上市销售,也未有公司进行国内新药申报。另外英国GlaxoSmithKline公司在中国分公司(葛兰素史克制药(苏州)有限公司)也在中国已经获得生产批件,批准文号:国药准字H20030581。目前国内有,拉米夫定原料药以及拉米夫定片(两种规格)、拉米夫定口服液(两种规格)两种进口剂型上市销售。
阿德福韦酯是由美国Gilead Science公司开发的新型核苷类抗乙型病毒性肝炎药物,已在国外进行了Ⅱ、Ⅲ期临床试验。国外的临床研究资料表明,阿德福韦能有效地抑制HBV DNA的复制,使HBV DNA滴度迅速降低,而且在出现拉米夫定耐药的患者中阿德福韦能继续有效地抑制变异株。我国药品监督管理局于2000年12月批准该药在中国进行临床试验,目前,Ⅰ期临床试验已结束,Ⅱ期临床试验也已在2002年12月正式启动。 一、作用机制 阿德福韦酯是腺嘌呤磷酸酯化合物阿德福韦的前药,其分子式为C20H32N5O8P,分子量为501.48。口服后,在体内转化为阿德福韦发挥抗病毒作用。阿德福韦是单磷酸腺苷的核苷酸类似物,在体内通过细胞激酶作用被磷酸化为具有活性作用的二磷酸阿德福韦,二磷酸阿德福韦抑制HBV DNA多聚酶或逆转录酶作用机制包括:(1)竞争脱氧腺苷三磷酸底物;(2)终止病毒DNA链延长。二磷酸阿德福韦对HBV DNA多聚酶的抑制常数为0.1mmol/L;对人类DNA多聚酶α和γ的抑制作用较弱,其抑制常数分别为1.18mmol/L和0.97mmol/L,因此,治疗剂量对正常细胞没有毒性。 二、药效和毒理 在体外实验中,阿德福韦抑制HBV转染人肝细胞瘤细胞株HepG2和HB611细胞病毒复制的半数抑制浓度(IC50)分别为0.2~2.5mmol/L和0.2~1.2mmol/L。二磷酸阿德福韦在细胞内的T1/2为30h,故作用较持久,可以每天给药一次。 拉米夫定耐药株涉及HBV DNA聚合酶M552V、M552I、L528M、L552M/M552V位点的突变。在体外实验中发现这些突变体对阿德福韦仍敏感,与野生株比较,它们的抑制常数增加了不到2.2倍,而拉米夫定对变异株的抑制常数则增加了8~25倍。这些资料表明,阿德福韦可以治疗对拉米夫定耐药的HBV,而且与拉米夫定联合治疗可以有效控制对拉米夫定的耐药。同时,体外实验也发现阿德福韦对泛昔洛韦耐药株也较敏感。 在体内实验中,发现阿德福韦能有效地抑制鸭乙型肝炎病毒和土拨鼠肝炎病毒(WHV)的复制。给予慢性感染WHV的成年土拨鼠每日口服5mg/kg、15mg/kg的阿德福韦或安慰剂治疗12周,治疗后5mg/kg剂量组WHV DNA水平减少了260倍,而15mg/kg剂量组则下降了1000倍以上。 四、国外临床研究进展 阿德福韦已在美国、欧洲、澳大利亚及东南亚进行了Ⅱ、Ⅲ期临床试验。临床试验涉及HBeAg阳性和考虑有前C区变异的HBeAg阴性的慢性乙型肝炎患者、对拉米夫定耐药的代偿性肝病患者、合并人类免疫缺陷病毒感染的拉米夫定耐药患者、肝移植前或移植后对拉米夫定耐药的失代偿性肝病患者。 早期进行的针对HBeAg阳性、ALT异常或正常的二项双盲、安慰剂对照的Ⅱ期临床试验,疗程为12周,并随访24周。ALT异常临床研究的患者,接受剂量为5mg/d、30mg/d和60mg/d。治疗12周后,5mg剂量组血清HBV DNA较基线下降1 Log10,30mg和60mg剂量组血清HBV DNA下降3~4 Log10,而安慰剂组无显著变化;36周后,30mg和60mg剂量组HBeAg转阴率为27%,HBeAg血清转化率为20%,血清转化率增高与基线时ALT水平呈正相关。ALT正常的临床研究患者,接受剂量为30mg/d。治疗12周后,30mg剂量组血清HBV DNA较基线下降3Log10,而安慰剂组无显著变化。所有接受治疗的患者在治疗12周后进行基因检测,没有发现与阿德福韦耐药有关的变异产生。在这二项研究中,30mg和60mg剂量组均出现部分患者的肾功能损害,表现为尿素氮和肌酐的升高,出现肾功能损害的比例与剂量呈正相关,故在以后的延续试验中以10mg剂量组而代替60mg剂量组。 在一项随机、双盲、安慰剂对照的临床试验中,共有515例HBeAg阳性的患者进入研究。在前48周,患者被随机分入阿德福韦30mg组(173例)、阿德福韦10mg组(172例)或安慰剂组(170例)。48周后,30mg组接受安慰剂治疗至96周,安慰剂组接受阿德福韦10mg治疗至96周,10mg组则再次随机按1:1接受安慰剂或继续阿德福韦10mg治疗至96周。所有患者在第一次随机前6月内接受第一次肝活检,在治疗48周、96周后接受第二、三次肝活检。所有患者治疗96周后随访24周。治疗48周后,10mg组和30mg组组织学改善率(组织学改善定义为Knodell坏死炎症计分下降32分,且Knodell肝纤维化计分无恶化)分别为53%和59%,显著高于安慰剂组25%;10mg组和30mg组治疗后血清HBV DNA较基线时下降3.52 Log10和4.76 Log10,安慰剂组为0.55 Log10;10mg组HBeAg阴转率为24%,HBeAg血清转化率为12%,显著高于安慰剂组的6%和11%;10mg组ALT复常率为48%,安慰剂组则为16%。研究中,发现基线ALT水平与肝组织学改善和HBeAg血清转化呈正相关。另一项随机、双盲、安慰剂对照的临床试验,共有185例考虑有前C区变异的HBeAg阴性的患者按2:1比例进入阿德福韦10mg组或安慰剂组。治疗48周后,10mg组组织学改善率为64%,显著高于安慰剂组33%;10mg组治疗后血清HBV DNA较基线时下降3.91 Log10,51%患者HBV DNA转阴,安慰剂组HBV DNA较基线时下降1.35 Log10,没有患者HBV DNA转阴;10mg组ALT复常率为72%,著高于安慰剂组29%。目前本项研究仍在进行中。 五、耐药和病毒变异 阿德福韦较少产生耐药的分子学基础包括:(1)阿德福韦与自然底物dATP在结构上非常相像;(2)阿德福韦具有灵活的开链连接;(3)具有磷酸键。 629例患者在治疗48周后接受了病毒变异的检测,结果未发现产生阿德福韦耐药的病毒变异。2003年美国肝病年会上,Gilead公司报道,238例患者在治疗96周时有4例发现N236T位点的变异,发生率为1.7%,并证实N236T变异与阿德福韦耐药有关。另一可能与阿德福韦耐药有关的A181V位点突变,96周时的发生率为0.8%。另外一项研究是早期进行的针对HBeAg阳性、ALT异常或正常的二项双盲、安慰剂对照研究的延续。患者在治疗中没有出现血清转化,也没有出现与治疗相关的毒性反应,患者自愿继续接受治疗。剂量开始为30mg/d,后改为10mg/d。在长达136周的观察中,阿德福韦对野生株和前C区变异的慢性乙型肝炎具有持续的抗病毒作用,而且没有发现与阿德福韦耐药相关的病毒变异。 七、国内的研究状况 我国食物药品监督管理局于2000年12月批准该药在中国进行Ⅰ期临床试验。2001年6月~9月进行Ⅰ期临床试验,Ⅰ期临床试验包括3个研究方案:(1)在健康中国男性志愿者中,对单次口服阿德福韦片剂的安全性和耐受性进行评估的一项Ⅰ期、单中心、随机、双盲、安慰剂对照的研究;(2)在健康中国男性志愿者中,对阿德福韦片剂的药代动力学进行评估的一项Ⅰ期、单中心、开放、拉丁方设计的研究;(3)在健康中国志愿者中,就连续6d,1次/d,口服阿德福韦片剂的安全性、耐受性和药代动力学进行评估的一项Ⅰ期、单中心、随机、双盲、安慰剂对照的研究。I期研究结果显示在健康中国志愿者中口服阿德福韦片剂的安全性、耐受性良好;10mg剂量下,未观察到肾功能损害;药代动力学参数与国外研究结果相似。2002年10月国家药品监督管理局批准该药在中国进行Ⅱ期临床试验。Ⅱ期临床试验在中国的总病例数为480例,均为HBeAg阳性、HBV DNA阳性、ALT增高的患者。全国有12个中心参与。目前,Ⅱ期临床试验已在2002年12月正式启动,2003年2月底已完成最后一例患者入组。
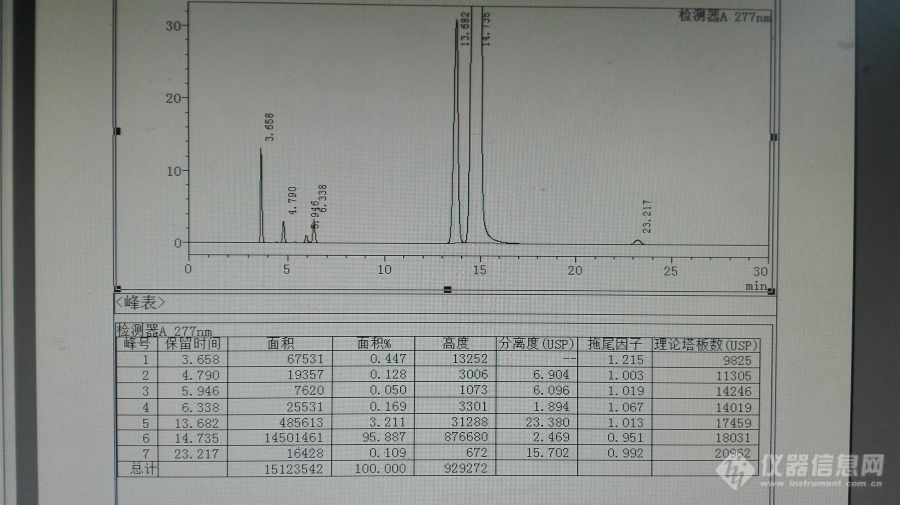
来自中国的自信,月旭Welchrom C18测定拉米夫定有关物质[b]除非经大量试验比较市面主流厂家的色谱柱均不能达到要求,最好不要把色谱柱的品牌定下来。[/b]拉米夫定(Lamivudine)对乙型肝炎病毒和HIV有明显的抑制作用。口服吸收后,拉米夫定可在HIV感染细胞和正常细胞内代谢生成拉米夫定三磷酸盐,它是拉米夫定的活性形式。后者通过竞争抑制作用,终止DNA链的延长,从而抑制HIV和HBV的反转录酶和HBV聚合酶,阻止HIV和HBV的DNA合成和病毒复制。体外实验中与齐多夫定联合,对HIV病毒有协同作用。下面为中国药典2015年版收载的质量标准,其中提到的色谱柱,我们咨询了价格比较贵,我们就用手上的月旭色谱柱进行了探索研究。参照了EP8.0质量标准,进行了系统适用性试验,其中EP8.0质量标准有关物质项下为:Related substances. Liquid chromatography (2.2.29).Test solution. Dissolve 50.0 mg of the substance to beexamined in the mobile phase and dilute to 100.0 mL withthe mobile phase.Reference solution (a). Dilute 1.0 mL of the test solution to100.0 mL with the mobile phase. Dilute 1.0 mL of this solutionto 10.0 mL with the mobile phase.Reference solution (b). Dissolve 5 mg of salicylic acid R in themobile phase and dilute to 100.0 mL with the mobile phase.Dilute 1.0 mL of the solution to 100.0 mL with the mobilephase.Reference solution (c). Dissolve 50.0 mg of lamivudine CRSin the mobile phase and dilute to 100.0 mL with the mobilephase.Reference solution (d). Dissolve 5 mg of cytosine R and 5 mg ofuracil R in the mobile phase and dilute to 100.0 mL with themobile phase. Dilute 2.0 mL of the solution to 10.0 mL withthe mobile phase.Reference solution (e). Dissolve 5 mg of lamivudine for systemsuitability 1 CRS (containing impurities A and B) in 2 mL ofthe mobile phase. Add 1.0 mL of reference solution (d) anddilute to 10.0 mL with the mobile phase.Column:- size: l = 0.25 m, Ø = 4.6 mm - stationary phase: base-deactivated octadecylsilyl silica gel forchromatography R (5 μm) - temperature: 35 °C.Mobile phase: mix 5 volumes of methanol R and 95 volumes ofa 1.9 g/L solution of ammonium acetate R, previously adjustedto pH 3.8 with glacial acetic acid R.Flow rate: 1.0 mL/min.Detection: spectrophotometer at 277 nm.Injection: 10 μL.Run time: 3 times the retention time of lamivudine.Identification of impurities: use the chromatograms obtainedwith reference solutions (b) and (e) to identify the peaks dueto impurities A, B, E, F and C.[b]Relative retention with reference to lamivudine (retentiontime = about 9 min): impurity E = about 0.28 impurity F = about 0.32 impurity A = about 0.36 impurity B = about 0.91 impurity J = about 1.45 impurity C = about 2.32.[/b]System suitability: reference solution (e):- resolution: minimum 1.5 between the peaks due toimpurities F and A minimum 1.5 between the peaks dueto impurity B and lamivudine.Limits:- correction factors: for the calculation of content,multiply the peak areas of the following impurities bythe corresponding correction factor: impurity E = 0.6 impurity F = 2.2 impurity J = 2.2 - impurity A: not more than 3 times the area of the principalpeak in the chromatogram obtained with referencesolution (a) (0.3 per cent) - impurity B: not more than twice the area of the principalpeak in the chromatogram obtained with referencesolution (a) (0.2 per cent) - impurity C: not more than the area of the principal peakin the chromatogram obtained with reference solution (b)(0.1 per cent) any other impurity: for each impurity, not more than thearea of the principal peak in the chromatogram obtainedwith reference solution (a) (0.1 per cent) - total: not more than 6 times the area of the principal peakin the chromatogram obtained with reference solution (a)(0.6 per cent) - disregard limit: 0.5 times the area of the principal peak inthe chromatogram obtained with reference solution (a)(0.05 per cent).中文名拉米夫定外文名lamivudineCAS号134678-17-4分子式C8H11N3O3S[img=,690,400]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302020_01_1621890_3.png!w690x400.jpg[/img][img=,690,388]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302026_01_1621890_3.png!w690x388.jpg[/img][img=,690,388]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302027_01_1621890_3.png!w690x388.jpg[/img][img=,690,388]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302028_01_1621890_3.png!w690x388.jpg[/img][img=,690,388]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302029_01_1621890_3.png!w690x388.jpg[/img]以上均为参照中国药典2015年收载的拉米夫定片质量的截图,然后进行系统适用性试验,进行流动相微调,其典型色谱图见下图:[img=,690,353]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302137_01_1621890_3.png!w690x353.jpg[/img]初步统计色谱峰保留时间,其他色谱图参数很好,理论板数都超级好,分离度和拖尾因子也超级好! [table=167][tr][td]相对保留时间(RRT)[/td][td]保留时间(min)[/td][/tr][tr][td]0.25 [/td][td]3.658[/td][/tr][tr][td]0.33 [/td][td]4.79[/td][/tr][tr][td]0.40 [/td][td]5.946[/td][/tr][tr][td]0.43 [/td][td]6.338[/td][/tr][tr][td]0.93 [/td][td]13.682[/td][/tr][tr][td]1.00 [/td][td]14.735[/td][/tr][tr][td]1.58 [/td][td]23.217[/td][/tr][/table]其中水杨酸的色谱峰如下:[img=,690,338]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302144_01_1621890_3.png!w690x338.jpg[/img]另外最好控制柱温,最好是液相自动控温装置,不要外接质量差的柱温箱,因为在升温的过程有±5℃的差异,会引起水杨酸色谱峰保留时间和峰型变化较大,使其用相对保留时间定位出现偏差,建议用水杨酸对照品同时定位,因为其价格便宜易得,其典型色谱图如下:[img=,690,320]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302159_01_1621890_3.png!w690x320.jpg[/img]拉米夫定对照品定位溶液主峰典型色谱图如下:[img=,690,405]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302150_01_1621890_3.png!w690x405.jpg[/img][img=,690,409]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302211_01_1621890_3.png!w690x409.jpg[/img]以上拉米夫定对照品出峰保留时间基本上变化不大,但是浓度较大是有较大差异,15分钟在14.4分钟变化。其变化情况见下面系统色谱图。但是其相对于水杨酸的变化幅度较小。系统进针另外图谱:[img=,690,375]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302207_01_1621890_3.png!w690x375.jpg[/img][img=,690,415]http://ng1.17img.cn/bbsfiles/images/2017/11/201711302209_01_1621890_3.png!w690x415.jpg[/img]总结:我们没有用到中国药典的色谱柱,但是从色谱图及其系统适用性试验结果,其系统各杂质均能有效分离,和EP8.0提到的主峰保留时间差距很大,约6分钟差异,估计是色谱柱填料性能差异引起,从研究角度来讲,[b]中国产的色谱柱完全适用于本品的有关物质检测和含量测定,为我们后续的研究增强了自信心。作为权威的中国药典,不知道什么原因把色谱柱的品牌给定下来了,个人愚见,除非经大量试验比较市面主流厂家的色谱柱均不能达到要求,最好不要把色谱柱的品牌定下来。作为国产优良色谱柱的生产商月旭公司不得不由衷给个赞![/b]
请教一下各位:中检所是不是不能定标准品了呢?
做外标法时,要配制标准品溶液,如何判定标准品的浓度是否准确?如何才能提高准确度?
请教各位老师,食品中重金属测定的判定标准除了2762还有什么啊?
大家好,自来水的MIB(霉味)一般都是感官的,如果想测定自来水中MIB的具体数值,选用什么方法?大家有这方面的测定标准吗?
[color=black]CNAS在申请和标识使用时有些困惑,求坛友们指点[/color][color=black]1,CNAS申请时必须将判定标准一起申请吗?[/color][color=black]2,客户指定有判定标准,如果不申请认可该判定标准,能否在检验报告上盖CNAS章?[/color][color=black]3,如果申请认可判定标准,那客户的判定标准经常变换是不是很麻烦,还得重新申请?[/color][color=black]4,CANS标识使用里有一个要求不太明白,如下[[color=black]5.3.14[/color][color=black]根据检测或校准结果,与规范或客户的规定限量做出的符合性判断,不属于本规则所规定的[/color][color=black]“[/color][color=black]意见和解释[/color][color=black]”[/color][color=black]。实验室签发的报告或证书中仅包含判定标准(无具体的检测或校准方法)时,不得在报告或证书上使用认可标识或声明认可状态。[/color]][/color][color=black]字面意思是:报告中只标识有判定标准(不含检测方法)时不能盖章;那么报告中包含判定标准(未申请认可)和检测标准(已申请认可)时能否给客户盖章?还是二者都要过认可才能盖章?[/color]
讨论:各类食品中重金属、有害元素、微量元素等等的测定标准,欢迎大家分享与讨论!大家平时在食品检验工作中测定最多的元素又是哪些呢?
因公司项目停止,购买的法定标准品(EP和USP)现全部闲置,都是现行批号,有证书,现全部低价处理,有需要的全部拿走 联系QQ:342832185声明一下,不能开票哦
在《QB/T 2739-2005 洗涤用品常用试验方法 滴定分析(容量分析)用试验溶液的制备》这份标准中提到“3.5 标定标准滴定溶液的浓度时,应两人进行操作,规定为标三复二”,有点不明白“标三复二”这个概念,不知有人能够帮忙解释下吗?谢谢了!
药品GMP认证检查评定标准
日本厚生劳动省20日汇总了食品中放射性铯含量标准值的新方案,以取代现行的暂定标准值。新方案中将食品分类由现行的5种改为4种,其中“一般食品”的标准上限为每千克100贝克勒尔,“牛奶”以及新增的“婴儿食品”分类为50贝克勒尔,“饮用水”为10贝克勒尔。 各分类的新标准均比暂定标准值(200贝克勒尔或500贝克勒尔)更为严格。厚劳省将于年内咨询文部科学省的辐射审议会,明年4月起实施新标准。但是,大米、牛肉等食品由于告知消费者及生产者需要时日,将设置6~9个月的过渡期并继续实施暂定标准。 “饮用水”由于人人饮用且无法替代,将遵照世界卫生组织标准将年辐射量上限定为0.1毫希,标准值定为每千克10贝克勒尔。 此外新标准还考虑到了儿童更易受放射性物质影响这一因素,将奶粉、婴儿食品、服药辅助果冻粉等“婴儿食品”,以及儿童摄取量较高的“牛奶”(包括加工乳制品及乳饮料)标准值设为每千克50贝克勒尔,仅为“一般食品”的一半。
[size=16px]GB 19295《食品安全国家标准 速冻面米与调制食品》标准更新啦,2021版与原2011版标准相比,修改了标准的范围、术语和定义、理化指标、微生物限量等,接下来小C将根据新旧标准的主要内容变化给大家做个详细的对比及解读,便于与标准相关的生产经营企业做好相关的质量控制。[/size][b][size=18px](一)标准名称[/size][/b][size=16px]原名称:《食品安全国家标准 速冻面米制品》[b]新名称:《食品安全国家标准 速冻面米与调制食品》[/b][/size][b][size=18px](二)适用范围[/size][/b][align=center][img]http://www.cttlab.com/examjob/php/upload/20210923/1632359070767.png[/img][/align][b][size=18px](三)术语和定义[/size][/b][size=16px]相隔10年,新版的标准结合了目前行业中的主要产品形式、一般原料组成和工艺流程,参考有关标准,提出了[b][color=#ff0000]速冻调制食品[/color][/b]的定义,并对速冻面米食品、生制品、熟制品的概念进行了修订,使得定义更加清晰明确。[/size][align=center][size=14px][img]http://www.cttlab.com/examjob/php/upload/20210923/16323590508381.png[/img][/size][/align][b][size=18px](四)感官指标[/size][/b][size=16px]感官指标中将旧版标准中的“组织形态”和“杂质”结合,形成新的检测项目“状态”。[/size][align=center][size=14px][img]http://www.cttlab.com/examjob/php/upload/20210923/1632359085665.png[/img][/size][/align][b][size=18px](五)理化指标[/size][/b][size=16px]通过对行业监测数据的分析,进一步明确过氧化值指标适用的产品。理化指标“过氧化值”的适用范围修改为[color=#ff0000]“以动物性食品、坚果及籽类食品为馅料/辅料,或经油脂调制的速冻面米食品和速冻调制食品。”[/color]其中,“经油脂调制的产品”主要指油脂含量相对较高的油条、手抓饼、炒饭、炒面等另外,过氧化值的检测方法因适用范围的扩充,新版标准中修改为GB 5009.227。[/size][align=center][img]http://www.cttlab.com/examjob/php/upload/20210923/16323591586588.png[/img][/align][align=center][img]http://www.cttlab.com/examjob/php/upload/20210923/16323591586892.png[/img][/align][b][size=18px](六)微生物限量[/size][/b][size=14px][/size][size=16px]新版标准中要求致病菌指标仍然按GB 29921执行。此外,在原标准的基础上,增加了对即食生制品中菌落总数和大肠菌群的要求,修改了即食熟制品中大肠菌群的指标要求。[/size][align=center][b][size=16px]微生物限量修订对比表[/size][/b][/align][align=center][b][size=16px][img]http://www.cttlab.com/examjob/php/upload/20210923/16323591863811.png[/img][/size][/b][/align][align=center][b][size=16px][img]http://www.cttlab.com/examjob/php/upload/20210923/16323592007088.png[/img][/size][/b][/align][align=center][b][size=16px][img]http://www.cttlab.com/examjob/php/upload/20210923/1632359739570.png[/img][/size][/b][/align][b][size=18px](七)标识[/size][/b][size=16px][/size][size=16px]在原标准的基础上,本标准要求产品标识增加[b][color=#ff0000]“即食”、“非即食”[/color][/b]的标注要求,以指导消费者食用前采用正确的方式。[/size][size=14px][/size][size=16px][color=#ff0000]该标准将于2022年03月07日起实施,针对标准的更新及变化,小C温馨提示:[/color]①企业内及时开展新标的宣贯培训,让研发和生产人员更深入了解标准技术内容;②企业尽快按照新标准要求生产,确保标准实施后生产及销售的产品符合新标准。参考资料来源:食品安全国家标准数据检索平台[/size]
谁有食用菌原辅料pH值测定标准?
《药品注册现场核查要点及判定标准》课件-11-14版(幻灯片)药品注册现场核查工作方案1106 药品注册现场核查要点及判定标准发文报表7个(附表1药品注册撤回申请表,附表2药品注册申请撤回汇总报表,附表3药品注册自查报告表,附表4药品注册全面现场核查报告表,附表5药品注册全面现场核查汇总报表,附表6药品注册现场核查委托表,附表7药品注册现场核查委托报告表)[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=52224]都在这一个包里了[/url]
各会员单位: 近日,国家卫生部和质检总局发布2011年第6号公告,再次重申食品添加剂的标准包括使用安全标准和产品质量规格标准,且均纳入食品安全国家标准管理范围。公告规定,食品添加剂生产企业应依据相应国家标准或指定标准组织生产,生产企业不需要制定食品添加剂产品企业标准,地方卫生行政部门和标准化行政主管部门亦不再对食品添加剂产品企业标准进行备案;对于生产尚没有国家质量规格标准的食品添加剂产品,可依据卫生部等九部门《关于加强食品添加剂监督管理的通知》(卫监督发89 号)的规定,提出参照国际组织和其它国家标准(含质量要求、检验方法)的资料,报中国疾病预防控制中心,作为指定标准的依据。 在我国现行生产监管体制下,国家标准和指定标准是企业组织产品生产的重要技术文件,也是食品添加剂生产企业申领生产许可证的必要条件之一。为此,协会希望各生产企业进一步重视标准方面的工作,对企业所生产的食品添加剂产品的标准进行认真梳理,对于没有国家或行业标准的产品,按照公告的规定,尽快向卫生部委托的中国疾病预防控制中心营养与食品安全所上报参照国际组织和其它国家标准制定产品指定标准(含质量要求、检验方法)的文本和国内外相关标准的资料,便于中国疾病预防控制中心营养与食品安全所组织专家研究,缩短指定标准颁布实施的时间,减少因缺失标准造成对企业正常生产经营的影响。联系方式:一、中国疾病预防控制中心营养与食品安全所地址:北京市朝阳区潘家园南里7 号,邮编:100021电话:010-87776914 传真:010-67711813电邮:GB2760@gmail.com二、中国食品添加剂和配料协会地址:北京市朝阳区朝外大街甲6 号万通中心3 座1402 室,邮编:100020电话:010-59795833 传真:010-59071335电邮:cfaa2003@yahoo.com.cn 二○一一年四月六日
机织物gbt 4668 1995机织物密度的测定标准中以10厘米为标准,但实际我们客户都是以英寸为标准,那么我们出报告,检测方法还可以为这个标准吗?
哪位有傅立叶变换红外光谱仪的国家鉴定标准?谢谢了
供参考。新标准更严了感觉上借鉴了些 欧洲GMP的要求[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=78840]药品GMP认证检查评定标准[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=34469]药品GMP认证评定标准及发展变化[/url]看看吧
GB601标准中规定标定标准溶液时,每人四平行测定结果的极差与平均值之比与两人测定结果平均值之差分别应符合( )。 A、≤0.1%和≤0.2% B、≤0.2%和≤0.1% C、均应≤0.1% D、均应≤0.2%
乳与乳制品中蛋白质测定标准发布有助于三聚氰胺等非蛋白含氮物不再被误判为蛋白质本报讯 近日,作为我国农业行业标准,《乳与乳制品中蛋白质的测定 双缩脲比色法》(NY/T 1678-2008)标准发布并实施。 该标准的发布,标志着在利用其进行乳与乳制品中蛋白质测定的前提下,三聚氰胺等非蛋白含氮物将不会再被误判为蛋白质,也不会再出现蛋白质测定值虚高的问题。 该标准由中国农业大学食品学院牵头,农业部乳品质量监督检验测试中心、农业部奶及奶制品质量监督检验测试中心(北京)、农业部食品质量监督检验测试中心(上海)共同完成。 据悉,早在2004年,中国农业大学研究人员就开展了鉴别在食品中非法添加“非蛋白含氮物”的研究,奠定了研发此项技术的基础。中国农业大学食品学院侯彩云教授表示,新标准的出台,为堵塞乳与乳制品中恶意造假行为提供了必要的技术支撑,但乳品质量安全保障还需要标准体系的进一步完善,以及食品安全长效保障机制的进一步健全。(记者赵陕雄) 信息来源:中国质量报 发布时间:2008-11-21

[center]产品销售与回收《药品GMP认证检查评定标准》08版[/center][img]http://ng1.17img.cn/bbsfiles/images/2009/04/200904030735_142125_1626679_3.jpg[/img][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=142126]产品销售与回收《药品GMP认证检查评定标准》08版[/url]
有没有冶标炭素制品中灰份、挥发份测定标准最新版的。请用附件形式发给我,谢谢
在纺织品pH值测定标准中,很多都限定取三分样品,第一份样品作为辅助测试不记录,第二、三份样品测定数据取平均即为样品的pH值,这么做的道理是怎样的?如果只取一份样品,将萃取液分为三分,第一份作为辅助测试不记录,第二、三份萃取液测定数据取平均作为样品的pH值,这样做的话可不可行?为什么?谢谢各位的回答,但我还是不明白,纺织品的标准中(比如AATCC81)却不用三个样品,难道这个方法中就不用避免样品不均或污染带来的影响?还有其他材料的pH测定标准中(比如皮革的ISO4045)也没有要求三个样品,难道皮革也不用去避免这些影响吗?虽然说他们的处理方式不同,但是如果样品被污染到了或者样品不均,不管哪种方法都应该是无法彻底消除这些因素带来的影响的。
GMP培训资料--药品_GMP认证检查评定标准http://www.instrument.com.cn/download/download.asp?id=128702
[color=red][size=4]假如你是制定标准的人,你该如何制定---《食品防护计划建立与实施指南 食品生产企业》的国家标准?[/size][/color]《食品防护计划建立与实施指南 食品生产企业》的国家标准目前正在征求广大用户的意见~欢迎广大的仪器人和关心食品的人前来PK~也许您的意见会被制定标准的人采纳噢~有好的建议和意见的人,论坛将给予一定积分奖励~希望大家积极参与~