哪里有头孢噻呋标准品?
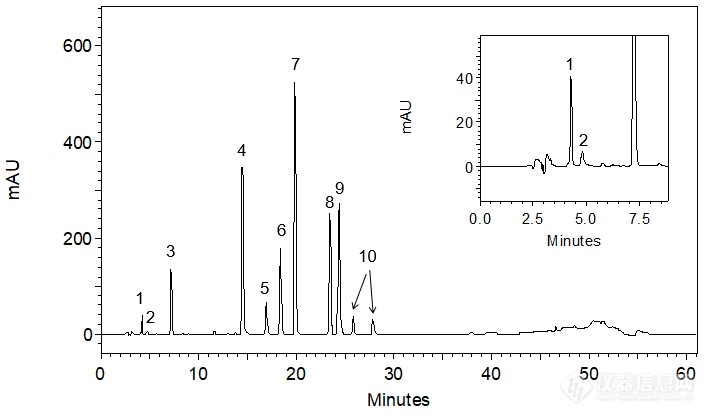
[align=center][b]头孢克洛有关物质——与9种杂质的共同分析[/b][/align]头孢克洛(cefaclor)为白色至微黄色粉末或结晶性粉末的化学品,微臭,本品在水中微溶,在甲醇、乙醇、三氯甲烷或二氯甲烷中几乎不溶,分子式:C15H14ClN3O4S。头孢克洛是β-内酰胺类抗生素,头孢菌素类药,是第二代头孢菌素,主要适用于敏感菌所致的急性咽炎、急性扁桃体炎、中耳炎、支气管炎、肺炎等呼吸道感染、皮肤软组织感染和尿路感染等。[align=center][img=,144,171]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140859582934_5220_2222981_3.gif!w144x171.jpg[/img][/align][align=center]头孢克洛[/align][align=center]M.W.: 367.81[/align]本实验对客户提供的头孢克洛原料药以及9种杂质(杂质A、B、C、D、E,7-ACCA,头孢克洛δ-3异构体,α-苯甘氨酸,苯甘氨酸甲酯盐酸盐)进行分析,希望得到杂质混合对照溶液及供试品溶液中各杂质的良好分离。客户反馈,将流动相磷酸盐体系的pH值由4.0提高到4.5可得到杂质混合对照溶液中7-ACCA和α-苯甘氨酸之间的良好分离,但头孢克洛与其相邻杂质E峰之间分离较难。客户前期使用了CAPCELL PAK C[sub]18 [/sub]MGII S3 4.6 mm i.d. × 250 mm色谱柱进行分析,在此基础上,我们尝试了其他填料的几款色谱柱进行分离尝试,分别为CAPCELL PAK C[sub]18[/sub] AQ(S3& S5)、CAPCELL PAK ADME(金刚烷基)、SUPERIOREX ODS、CAPCELL PAK PFP(五氟苯基)、CAPCELL PAK CN(氰基)。首先,参考客户提供的液相条件,使用高极性色谱柱[b]CAPCELL PAK C[sub]18 [/sub]AQ[/b]对杂质混合对照溶液进行分析尝试;为了得到杂质间的更好分离,粒径选择3 μm,如图1,[color=#2F5496]各杂质间均能得到良好的分离结果,头孢克洛与杂质[/color][color=#2F5496]E[/color][color=#2F5496]的分离度为[/color][color=#2F5496]2.70[/color][color=#2F5496],达到基线分离。[/color][color=#2F5496][/color][align=center][img=,690,405]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140902184290_9307_2222981_3.png!w690x405.jpg[/img][/align][align=center]图1 AQ S3 分析杂质混合对照溶液结果[/align][align=center] [/align][align=center]1.α-苯甘氨酸 2. 7-ACCA 3. 杂质A 4. 杂质B 5. 苯甘氨酸甲酯盐酸盐 6.杂质C[/align][align=center]7. 头孢克洛δ-3异构体 [color=#ff0000]8. 头孢克洛 9. 杂质E [/color]10.杂质D[/align][color=#2F5496][img=,555,311]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140902187828_2715_2222981_3.png!w555x311.jpg[/img][/color]进一步分析供试品溶液,如图2,由于样品浓度较高,导致头孢克洛主峰向后展宽,进而将杂质E包于其中。[color=#2F5496][/color][align=center][color=#2F5496][img=,659,441]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140915544228_5404_2222981_3.png!w659x441.jpg[/img][/color][/align][align=center]图2 AQ S3 分析供试品溶液结果[/align][align=center][/align][align=left]为使头孢克洛和杂质E之间得到更好的分离,我们尝试对色谱条件进行调整。[/align][align=left][/align][align=left][b]1.调整柱温[/b][/align][align=left][b][/b]首先对温度进行调整:实验过程中发现柱温对头孢克洛与杂质E的出峰行为有较大影响——当柱温设置为20 ℃时,头孢克洛和杂质E之间能够得到良好分离;将温度提高到30℃时,杂质E向前移动趋势较大。为使杂质E峰出在头孢克洛峰前,避免由于供试品中头孢克洛峰的展宽而使杂质E被包于其内,进一步将柱温提高到40℃,发现头孢克洛与杂质E峰重合;最终,将柱温提高到45℃,此时杂质E峰移至头孢克洛峰前,但未能得到理想的分离结果。[/align][align=left][/align][align=center][img=,659,430]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140916597550_373_2222981_3.png!w659x430.jpg[/img][/align][align=center]图3 不同柱温条件下AQ S3分析杂质混合对照溶液结果[/align][align=center][/align][align=left][b]2.调整流动相[/b][/align][align=left][b][/b][/align][align=left]考虑到提高柱温对色谱柱寿命的影响,仍选择初始使用的20℃,对流动相梯度条件进行调整。在增强整体保留时间的同时,发现[color=#538135]头孢克洛和杂质[/color][color=#538135]E[/color][color=#538135]的出峰顺序发生了颠倒[/color],且[color=#538135]分离良好[/color],进而有效避免了杂质E被包于头孢克洛主峰中的问题;而在主峰后出峰的杂质D与头孢克洛之间分离度亦较高,即使供试品溶液中的头孢克洛峰展宽,也不会出现将杂质D包于其中的问题。[/align][align=left]因此我们在此梯度条件下进一步对供试品溶液进行分析,如图4,头孢克洛与各杂质峰之间均能得到良好的分离结果。[/align][align=left][/align][align=center][img=,679,417]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140917450308_6331_2222981_3.png!w679x417.jpg[/img][/align][align=center]图4 AQ S3分析杂质混合对照溶液及供试品溶液结果(调整梯度)[/align][align=center] [/align][align=center]1.α-苯甘氨酸 2. 7-ACCA 3. 杂质A 4. 杂质B 5. 苯甘氨酸甲酯盐酸盐 6.杂质C[/align][align=center]7. 头孢克洛δ-3异构体 [color=#ff0000]8. 杂质E 9. 头孢克洛[/color] 10.杂质D[/align][align=left][img=,587,335]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140918136074_9375_2222981_3.png!w587x335.jpg[/img][/align][align=left][/align][align=left]为使客户有更多的色谱柱选择,本实验室也尝试使用键合金刚烷基的高极性色谱柱CAPCELL PAK ADME分析杂质混合对照溶液和供试品溶液,如图5,在分析杂质混合对照溶液时,能够得到各组分的良好分离,同时发现杂质E和头孢克洛出峰顺序发生颠倒,但同时也发现头孢克洛峰与其后相邻杂质D峰之间分离度较低(Rs=1.71);因此,如图6,在分析供试品溶液时,由于色谱峰向后展宽,使得杂质D被包于头孢克洛主峰中,未能得到理想分离结果。[/align][align=left][/align][align=center][img=,690,426]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140918484278_6616_2222981_3.png!w690x426.jpg[/img][/align][align=center]图5 ADME 分析杂质混合对照溶液结果[/align][align=center] [/align][align=center]1.α-苯甘氨酸 2. 7-ACCA 3. 杂质A 4. 杂质B 5. 苯甘氨酸甲酯盐酸盐 6.杂质C[/align][align=center]7. 头孢克洛δ-3异构体 [color=#ff0000]8. 杂质E 9. 头孢克洛[/color] 10.杂质D[/align][align=left][/align][align=center][img=,689,417]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140918485898_9906_2222981_3.png!w689x417.jpg[/img][/align][align=center]图6 ADME 分析杂质混合对照溶液结果[/align][align=left][img=,585,336]http://ng1.17img.cn/bbsfiles/images/2018/06/201806140919331328_5070_2222981_3.png!w585x336.jpg[/img][/align][align=left][/align][align=left][/align][align=left]之后,我们也尝试使用了CN(氰基柱)和PFP(五氟苯基)以及高碳载量的SUPERIOREX ODS色谱柱,在客户提供的色谱条件下对杂质混合对照溶液进行分析,均未能得到更理想的分离结果。[/align]
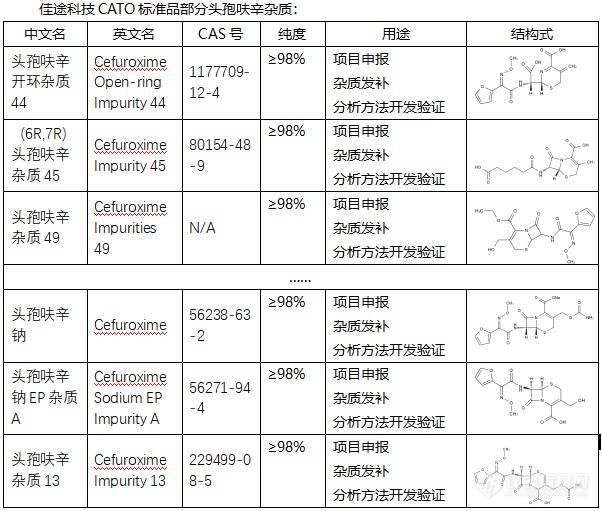
头孢呋辛是一种广泛使用的抗生素,主要用于治疗由敏感细菌引起的各种感染。在生产、储存和使用头孢呋辛的过程中,可能会产生一些杂质。这些杂质的存在可能会影响头孢呋辛的纯度和疗效,因此了解和控制这些杂质对于确保药物的安全性和有效性至关重要。头孢呋辛的杂质有多种,其中一些具有特定的CAS号、化学式和分子量。例如,头孢呋辛杂质33(Cefuroxime Impurity 33)的CAS号为929531-94-2,分子式为C16H16N4O9S,分子量为440.38。此外,还有其他一些头孢呋辛杂质,如头孢呋辛杂质A、B、C、D、E、F、G、H等。 CATO标准品提供的头孢呋辛全套的杂质,这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分。[img=,602,511]https://ng1.17img.cn/bbsfiles/images/2024/02/202402192104451830_7644_6381607_3.png!w602x511.jpg[/img] 广州佳途科技股份有限公司深知药物研发与质量控制的重要性,CATO标准品厂家,提供头孢呋辛全套的杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展,以满足客户在药物研发和质量控制方面的需求。[list][*]原创检测区[/list]◇头孢呋辛杂质头孢呋辛是一种广泛使用的抗生素,主要用于治疗由敏感细菌引起的各种感染。在生产、储存和使用头孢呋辛的过程中,可能会产生一些杂质。这些杂质的存在可能会影响头孢呋辛的纯度和疗效,因此了解和控制这些杂质对于确保药物的安全性和有效性至关重要。头孢呋辛的杂质有多种,其中一些具有特定的CAS号、化学式和分子量。例如,头孢呋辛杂质33(Cefuroxime Impurity 33)的CAS号为929531-94-2,分子式为C16H16N4O9S,分子量为440.38。此外,还有其他一些头孢呋辛杂质,如头孢呋辛杂质A、B、C、D、E、F、G、H等。CATO标准品提供的头孢呋辛全套的杂质,这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分。广州佳途科技股份有限公司深知药物研发与质量控制的重要性,CATO标准品厂家,提供头孢呋辛全套的杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展,以满足客户在药物研发和质量控制方面的需求。
求购头孢地尼E-异构体对照品头孢地尼做分析方法验证,其中有关物质头孢地尼E-异构体标准品买不到。很多销售公司都有但是资质不全我不能买他们的。请教各位大侠们,帮个忙吧。急用!!谢谢!!!!
有没有朋友做头孢克洛的液相分析,我们在测有关物质时,在42——50min都有两个大包,是怎么回事,7月份测时还没有,现在是进了两针后就有了,我们试剂和水都换过了,就是除不掉,有没有人知道还有什么办法吗? 流动相A:7.8%磷酸二氢钠缓冲液(用磷酸调PH为4.0) 流动相B:7.8%磷酸二氢钠缓冲液(用磷酸调PH为4.0)/乙腈=275/225 梯度:t/min 0 30 45 50 51 61 A% 95 25 0 0 95 95
[color=#333333]对照品与标准品概念[/color][color=#333333]对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质,而标准品系指用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示.文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已[1,2],造成错误的原因,可能是有的药品既有对照品,又有标准品.例如,当用微生物法测定头孢克罗效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品.即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的.[/color]
对照品:用于鉴别、检查、含量测定和校正检定仪器性能的标准物质;对照品由国家药品检定机构审查认可,其标准应不低于制品的质量标准。 标准品:用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。 对照品与标准品概念不清?对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质。标准品:用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已,造成错误的原因,可能是有的药品既有对照品,又有标准品。 例如:当用微生物法测定头孢克罗效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品。即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的。
头孢克洛干混悬剂检测报告一.样品分子结构中文名英文名分子结构头孢克洛干混悬剂Cefaclor见附件http://ng1.17img.cn/bbsfiles/images/2013/12/201312141606_481995_1621890_3.gif二. 样品来源记录样品化学名:头孢克洛干混悬剂样品商品名:上市品头孢克洛干混悬剂(希刻劳)样品测定描述:有关物质检测生产厂家:礼来苏州制药有限公司三. 液相方法条件方法来源:中国药典2010年版二部具体方法:色谱柱:月旭Welchrom C18, 5μm, 4.6×250mm(货号:00310-02043;序列号:w13211564)波长:220nm流动相/梯度洗脱:流动相A:0.78%磷酸二氢钠溶液(取磷酸二氢钠7.8g,加水溶解并稀释至1000ml,用磷酸调节pH值至4.0),流动相B:0.78%磷酸二氢钠溶液(pH4.0)-乙腈(55:45);按下表进行线性梯度洗脱。时间(分钟)流动相A(%)流动相B(%)095530752545010050010051[align=ce
进口兽药质量标准硫酸头孢喹肟注射液Liusuan Toubaokuiwo ZhusheyeCefquinome sulfate Injection本品为硫酸头孢喹肟与油酸乙酯等配制而成的混悬注射液。含头孢喹肟(C23H24N6O5S2)应为标示量的90.0%~105.0%。【性状】 本品为类白色至浅褐色混悬液体;久置分层。【鉴别】(1)含量测定项下记录的色谱图中,供试品主峰的保留时间应与对照品峰的保留时间一致。(2)取摇匀后的供试品2 ml,加水5 ml,稀盐酸1 ml,混匀,置超声浴中超声10分钟,弃去有机层,溶液显硫酸盐的鉴别反应(附录15页)。【检查】有关物质 照含量测定项下的方法。取摇匀后的供试品1.0 ml,加入流动相25.0 ml,置超声浴中超声5分钟,弃去有机层,取水层滤过,取续滤液10µ l,注入液相色谱仪,记录色谱图,2,3-环己基吡啶与头孢喹肟相对保留时间为0.20。按峰面积归一化法计算,2,3-环己基吡啶应不得过3.0%,其他单一杂质应不得过0.50%,杂质总量应不得过4.0%。水分 取本品,照水分测定法(附录58页,第一法)检查,含水分不得过0.2%。细菌内毒素 取摇匀后的供试品2 ml与细菌内毒素检查用水3 ml混匀,分成2等份,振摇30秒,离心15分钟(2000g),吸取水层1 ml,加1 mol/L氢氧化钠溶液0.06 ml调节pH值至6.5~7.5。用细菌内毒素检查用水按1:10稀释后,照细菌内毒素检查法(附录73页)检查,每1 mg头孢喹肟中含细菌内毒素的量应小于0.1 EU。无菌 取供试品8瓶,混合均匀,加入含6%吐温-80的蛋白胨缓冲液(1g/L)400ml,混匀,加入800×106单位青霉素酶(每1ml供试品溶液,加2×106单位青霉素酶),充分振摇,将供试品倒置,在37℃放置4小时;取供试品溶液,依法检查(附录79页,直接接种法),应符合规定。分散性 取本品1瓶,振摇30秒,将供试品转移置玻璃容器中,不得观察到结块或沉淀物。沉降 取本品1瓶,振摇30秒,取供试品10 ml置刻度试管中(内径1.0~1.5 cm),10分钟内不得沉淀。粒度 取摇匀后的供试品,置显微镜下检查,颗粒直径在5µ m以下应不得少于80%,10µ m以下不得少于90%,20µ m以下不得少于95%,50µ m以下不得少于100%。装量 按最低装量检查法(附录67页)检查,应符合规定。【含量测定】 照高效液相色谱法(附录24页)测定。色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;取一水合高氯酸钠3.45g溶于1000 ml水中,加磷酸12 ml和乙腈90 ml,用三乙胺调节pH至3.6为流动相;检测波长为270 nm。取头孢噻肟约25 mg,溶于100.0 ml流动相中,另取头孢喹肟约25 mg,置25 ml量瓶中,精密加入上述头孢噻肟溶液1 ml,用流动相稀释至刻度。精密量取10µ l注入液相色谱仪,记录色谱图;计算头孢喹肟与头孢噻肟的分离度,应大于1.0。
美国药典标准测定头孢地尼含量色谱条件溶液A:14.2mg/ml无水磷酸氢二钠溶液B:13.6mg/ml磷酸二氢钾缓冲溶液:将溶液A与溶液B按2:1混合(pH7.0)溶液C:0.1%四甲基氢氧化铵水溶液,用1/10稀磷酸调节pH至5.5溶液D:37.2mg/mlEDTA二钠流动相:乙腈、甲醇、溶液C、溶液D (350:200:4500:2)系统适应性溶液:用缓冲溶液配制每0.2mg/ml头孢地尼RS和0.5mg/ml头孢地尼有关物质A RS标准溶液:用缓冲溶液配置0.2mg/ml头孢地尼RS标准品样品溶液:用缓冲溶液配制0.2mg/ml头孢地尼样品色谱柱:C18柱(5um,4.6*150mm)推荐:YMC-Pack ODS-AM(P/N:AM12S05-1546WT)检测波长:254nm柱温:40摄氏度流速:1.0ml/min进样量:5ul系统适应性样品:系统适应性溶液和标准溶液(注:头孢地尼有关物质A RS有4个色谱峰)拖尾因子:以头孢地尼峰计不得超过1.5(系统适应性溶液)分离度:头孢地尼有关物质A RS的第二个峰与头孢地尼峰的分离度不得小于1.2
最近在做头孢检测,方法回收率一直不好,以下几个标准有做过的吗?怎么样?讨论下吧GB-T 21314-2007 动物源性食品中头孢匹林、头孢噻呋残留量检测方法 液相色谱-质谱/质谱法GBT 22942-2008 蜂蜜中头孢唑啉 头孢匹林 头孢氨苄 头孢洛宁 头孢喹肟残留量的测定 液相色谱-串联质谱法SNT 1988-2007 进出口动物源食品中头孢氨苄、头孢匹林和头孢唑啉残留量检测方法
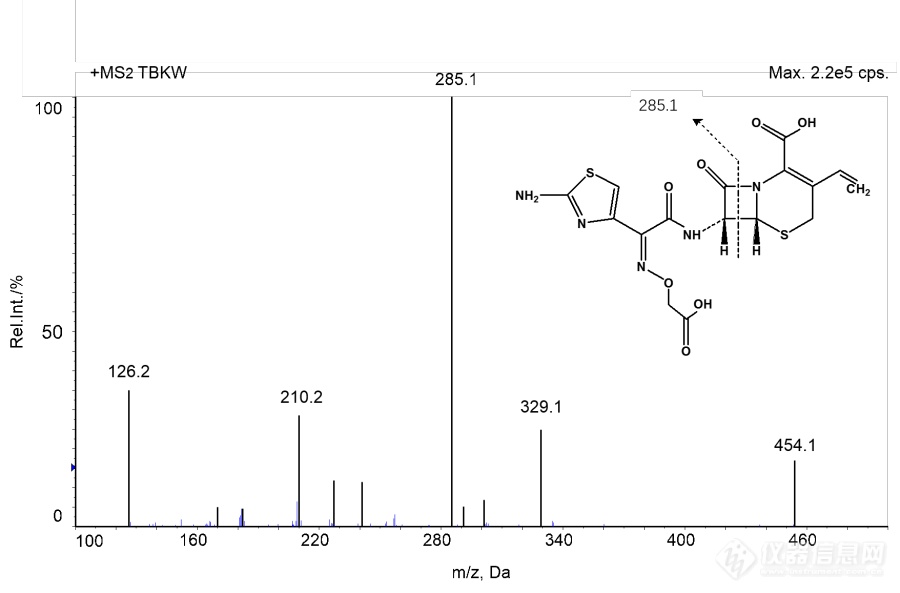
[align=left][b][size=32px][color=#ff0000]本篇文章暂不授权任何公众号发布[/color][/size][/b][/align][align=center][b]高脂肪饮食对头孢克肟片的药动学影响 [/b][/align][align=left][b]摘要:[/b]目的:研究比较空腹和高脂餐后单剂量口服用头孢克肟的药代动力学和生物利用度。方法:采用双交叉给药实验设计,12名健康男性受试者空腹及餐后单剂量口服1mg头孢克肟片,以头孢他美为内标,HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定血药浓度,DAS 2.0软件处理药动学参数。结果:头孢克肟空腹和餐后单剂量给药的主要药动学参数为:Cmax分别为([color=black]3.805 ±0.710[/color])μg/ml和([color=black]1.604 ±0.483[/color]) μg/ml,Tmax 分别为([color=black]4.792±0.582[/color]) h和([color=black]4.000±1.225[/color]) h,AUC[sub]0-t [/sub]分别为([color=black]32.923±7.804[/color]) μghmL[sup]-1[/sup]和([color=black]12.785±4.688[/color]) μghmL[sup]-1[/sup],AUC[sub]0-[/sub][sub][color=#231f20]∞[/color][/sub]([color=black]33.955±8.484[/color]) μghmL[sup]-1[/sup]和([color=black]13.082±4.932[/color]) μghmL[sup]-1[/sup]。两种给药方案的Cmax和AUC取自然对数后经方差分析,Tmax经非参数检验,发现Cmax,AUC和Tmax的差异有统计学意义(P<0. 05)。结论;与空腹组给药相比,餐后组吸收速率减慢,消除半衰期延长,生物利用度降低。[/align][align=left][b]关键词:[/b]头孢克肟;药动学;空腹餐后;生物利用度;[/align][align=left]头孢克肟(Cefixime)是一种重要的头孢菌素类抗生素,属于可口服的第三代头孢菌素类抗生素,临床上应用于敏感菌引起的肺炎、支气管炎、泌尿道感染、淋病、胆囊炎、胆管炎、猩红热、中耳炎、副鼻窦炎等。本研究参考有关人血浆中头孢克肟的定量方法,志愿者在空腹和餐后两种情况下服用进口头孢克肟片后取血,采用灵敏的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析技术评价饮食对头孢克肟在人体内的药动学影响,为临床用药提供指导。[/align][align=left][b]材料与方法[/b][/align][align=left][b]1 仪器与试药[/b][/align][align=left]API4000型三重四级杆串联离子肼质谱仪,美国Applied Biosystem Sciex公司;Aglient 1260型液相色谱系统,包括G1312B二元泵,G1322A在线脱气机,G1316A柱温箱,Aglient Technology公司; NASCA F5100型自动进样器,日本SHISEIDO公司;资生堂CAPCELL PAC ADME柱(2.1*100mm,3mm,日本SHISEIDO公司);保护柱:Phenomenex C18(4*3.0mm,5mm,Torrance,CA,USA);梅特勒-托利多AG135电子天平,梅特勒-托利多仪器上海有限公司;Heraeus Multifuge XIR型离心机,美国Thermo Fisher公司;IKA VIBRAX VXR型振荡器;KQ5200DE型数控超声清洗机,昆山市超声仪器有限公司;Eppendorf可调式及自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]电动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url][/color][/url],德国Eppendorf公司。[/align][align=left]头孢克肟标准品(批号:130503-201716,纯度:89.2%,中国食品药品检定研究院);头孢他美(批号:130564-201601,纯度>99.8%,中国食品药品检定研究院);甲醇:美国Fisher公司,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] 级,批号:LOT180821;甲酸:美国MREDA公司,色谱纯,批号:LOT095224;乙腈:美国Fisher公司,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] 级,批号:LOT180821;超纯水:屈臣氏重蒸水,批号:20180815.[/align][align=left][b]2 试验方法[/b][/align][align=left][b]2.1 试验方案[/b][/align][align=left][b]2.1.1 受试对象[/b][/align][align=left]12名健康男性受试者,年龄在18-45岁,体重指数在19-24范围内,健康,无心血管、肝脏、肾脏、消化道、精神神经等疾病史,无药物过敏史。试验前详细询问既往病史,作全面的体格检查及实验室检查,心电图、血压、肝肾功能及血尿常规检查均正常,试验前两周未用任何药物。所有受试者均签署知情同意书,试验方案经本院伦理委员会审批同意。[/align][align=left][b]2.1.2 给药方案与样品采集[/b][/align][align=left] 试验采用双交叉设计。12名受试者随机分成两组,每组6人。1组为空腹组,另1组为餐后组。受试者在试验前1 d的17:00进人I期临床试验病房,晚上统一清淡饮食,并禁食10h,但不禁水。次日晨1组空腹口服药物,用250mL水送服。另1组则统一进食高脂标准餐,进餐时程为30 min,后即用250 ml温开水送服试验药物。0, 0.5,1,1. 5,2,2.5,3,3.5,4,4.5,5,6.5,7,8,10,12,15和24小时,抽取静脉血4 ml,置肝素化抗凝试管中,分离血浆于-80℃贮存,待测。[/align][align=left][b]2.2 色谱及质谱条件[/b][/align][align=left]色谱条件:流动相:乙腈(0.5%甲酸):水(0.5%甲酸)=40:60等度洗脱;柱温:40℃;流速:0.2 mL/min;进样量:5 mL;运行时间:4min。洗针程序:50%甲醇洗针5s,超声洗针5s(纯水),再次用50%甲醇洗针5s。[/align][align=left]质谱条件:离子源:电喷雾(ESI);扫描方式:多反应监测(MRM);离子化方式:正离子;检测离子对:TBKW m/z454.2/285.1;内标:389.2/241.1.离子源电压:4800V;离子源温度:400℃;气帘气:15psi;碰撞气:4psi 雾化气:60psi;辅助气:55psi;解簇电压:70V;碰撞诱导解离电压:TBKW:28V,TBTM :21V。[/align][align=left][b]2.3 溶液配制及样品处理[/b][/align][align=left][b]2.3.1溶液配制[/b][/align][align=left]对照品溶液:精密量取头孢克肟对照品11.21 mg,置于15 mL EP管中,用自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]精密加入10 mL甲醇溶解,得到1 mg/mL的对照品储备液,置于-20℃备用。用50%甲醇-水配制成系列头孢克肟标准工作液,浓度分别0.5,1,5,10,20,50,100,160 mg/mL。4℃冰箱避光保存。[/align][align=left]质控工作液:精密量取头孢克肟对照品11.15 mg,置于15 mL EP管中,用自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]精密加入10 mL甲醇溶解,得到1 mg/mL的对照品储备液,置于-20℃备用。用50%甲醇-水配制成系列头孢克肟标准工作液,浓度分别1,5, 20,130mg/mL。4℃冰箱避光保存。[/align][align=left]内标工作液:精密量取头孢他美对照品10.02 mg,置于15 mL EP管中,用自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]精密加入10 mL甲醇溶解,得到1 mg/mL的内标储备液,置于-20℃备用。用纯甲醇稀释至500 ng/mL,4℃冰箱避光保存。[/align][align=left][b]2.3.2生物样本处理方法[/b][/align][align=left]a.血浆标准品及质控样品处理方法:取药前血浆190 uL,加10 uL适当浓度的标准溶液,混匀,加400 uL甲醇(含内标500 ng/mL),涡旋2min,离心(4℃,14000r/min)15min, 取100 uL上清液,加流动相A相200uL混匀,取5μL进样。[/align][align=left]血浆标准曲线范围: 0.025,0.05,0.25,0.5,1,2.5,5,8 u g/ml。[/align][align=left]质控样品浓度为: 0.075,1,6.5μg/ml 最低定量限: 0.075 ng/mL。[/align][align=left]b.血浆样品处理方法:取给药血浆200 uL,加400 uL甲醇(含内标500ng/mL),涡旋2min,离心(4℃, 14000 r/min) 15min, 取100 μL上清液,加流动相A相200μL混匀,取5μL进样。[/align][align=left][b]2.3.3数据统计处理方法[/b][/align][align=left]使用AB Secix公司Analyst 1.5.2软件采集处理数据。[/align][align=left][b]3方法学确证[/b][/align][align=left]对建立的方法进行方法验证, 参照中国药典2015版《生物样品定量分析方法指导原则》(草案),从方法的选择性、标准曲线和定量下限、精密度和准确度、稳定性、回收率、基质效应、残留效应和同位素效应等各方面进行方法验证。[/align][align=left][b]3.1选择性 [/b]分别取6份不同来源的人空白血浆样品以及相应人空白血浆配制的LLOQ 样品进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析测定,考察空白血浆中的内源性物质是否干扰待测物及其内标的测定。接受标准为:空白血浆中待测物保留时间处色谱峰面积不高于LLOQ色谱峰面积的20%;空白血浆中内标保留时间处色谱峰面积不高于内标色谱峰面积的5%。[/align][align=left][b]3.2 标准曲线[/b] 标准曲线设计8个浓度点, 头孢克肟血浆浓度分别为0.025, 0.05,0.25,0.5,1,2.5,5,8 u gmL-1, 按“血浆标准品及质控样品处理方法”项下操作, 以每个待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权 ([i]W [/i]= 1/[i]x[/i]2) 最小二乘法进行回归运算, 求得的直线回归方程即为标准曲线。接受标准为:校正标样回算的浓度一般应该在标示值的±15%以内,定量下限处应该在±20%内;至少75%校正标样,含最少6个有效浓度,应满足上述标准标准;曲线的相关系数的值r≥0.990。[/align][align=left][b]3.3 残留考察 [/b]在标准曲线最高浓度点后连续进样2个空白样品, 考察样品与内标的残留效应。接受标准为:空白血浆中待测物保留时间处色谱峰面积不高于LLOQ色谱峰面积的20%;空白血浆中内标保留时间处色谱峰面积不高于内标色谱峰面积的5%。[/align][align=left][b]3.4 定量下限 [/b]根据血浆标准品处理方法,配制头孢克肟定量下限浓度的血浆样品6份(2.50ng/mL) ,考察其准确度和精密度。[/align][align=left][b]3.5 精密度与准确度[/b] 按“血浆标准品及质控样品处理方法”项下操作,配制最低定量限、低、中、高4个浓度的血浆样品,每浓度进行6个样本分析,分别在3日内测试,根据当日标准曲线计算质控样品的测得浓度,根据结果计算本法的日内、日间精密度与准确度。接受标准:批内精密度:低、中、高浓度批内变异系数≤15%,定量下限的变异系数≤20%。批间精密度:低、中、高浓度批间变异系数≤15%,定量下限的变异系数≤20%。准确度:所有质控样品准确度均值一般应在标示值的±15%之内,定量下限准确度应在标示值的±20%之内。[/align][align=left][b]3.6 回收率和基质效应 [/b]取6份不同来源的空白人血浆,加入人脂肪,制备不同来源的含20%的高脂肪血浆,另取同样6份不同来源的空白人血浆,加入人全血,制备不同来源的含4%的溶血血浆,按比例加入内标溶液和沉淀蛋白溶剂,混匀,离心,取上清,将基质提取出来,分别加入低,中,高浓度质控溶液,经流动相稀释进样分析,测定血浆,高脂血浆,溶血血浆三种处理后的基质下的低、中、高浓度质控样品TBKW及其内标的峰面积。 [/align][align=left]取6份不同来源的空白人血浆及6份水,按“血浆标准品及质控样品处理方法”项下操作,测定空白血浆,标准溶液状态下的低、中、高浓度质控样品TBKW及其内标的峰面积。 [/align][align=left]基质因子(效应)=处理后的空白血浆归一化后的峰面积/标准溶液归一化的峰面积*100% [/align][align=left]提取回收率=未处理空白血浆归一化后的峰面积/处理后的空白血浆归一化后的峰面积*100%。[/align][align=left]接受标准:提取回收率不一定需要满足接近100%,但是必需是稳定而可重现的。基质因子不一定需要接近100%,但是在不同个体的基质中应是稳定而可重现的。不同来源的内标归一化基质因子精密度应≤15%。[/align][align=left][b]3.7 溶液稳定性 [/b]按“血浆标准品及质控样品处理方法”项下操作,新鲜配制头孢克肟储备液并用50%甲醇稀释到低,高质控溶度,每个浓度各3个;取-20℃存放7天,30天的储备液稀释到高质控浓度3个以及4℃对应存放7天,30天储存的低,高浓度质控工作液各3个,进样分析,分别评价储备液和工作液溶液7天,30天的稳定性。接受标准:各储备条件下和对照(新鲜配制)的溶液的归一化峰面积的比值偏差在±15%之间。[/align][align=left][b]3.8 血浆样品稳定性 [/b]室温放置:取多份空白血浆适量,分别加入相应浓度的TBKW标准溶液,配制低、中、高三个浓度血浆样品室温放置5h、处理后的样本室温放置6h、冰箱4°C放置20h,按“血浆标准品及质控样品处理方法”项下操作,进样分析,考察血浆质控样品室温放置稳定性。另取精密度试验第二批三个浓度血浆样品,测定后于自动进样器(10°C)中放置16h后再进样分析,考察血浆质控样品于自动进样器(10℃)中放置16h后稳定性。[/align][align=left]冻融:取多份空白血浆适量,分别加入定量的TBKW标准溶液,配制低、中、高三个浓度血浆样品放置-30°C至少12h,分别经1次冻融、2次冻融、3次冻融冷冻解冻循环,每次溶解时流动自来水溶解不超过15min,放置室温15 min后冷冻,按“血浆标准品及质控样品处理方法”项下操作,处理后进样分析,观察各次循环后稳定性。[/align][align=left] 长期冷冻:取多份空白血浆适量,分别加入定量的TBKW标准溶液,配制低、中、高三个浓度血浆样品,于-30°C放置3天、8天和27天,按“血浆标准品及质控样品处理方法”项下操作,处理后进样分析,观察-30°C条件下冷冻保存稳定性。接受标准:各储备条件下每一浓度水平测定值的精密度≤15%,准确度应在±15%之内。[/align][align=left][b]3.9 批分析 [/b]将精密度实验组样本中最低定量限、低、中和高四个浓度的样品进行了8轮进样,在实验样品开始前证实生物分析方法的效能。[/align][align=left][b]4实验结果[/b][/align][align=left][b]4.1 质谱结果 [/b]由于 TBKW 的结构中既含有碱性氮原子, 也含有羧基, 所以本实验比较了正、负两种离子检测。结果发现, TBKW 的甲醇-水 (50∶50) 溶液 (在正离子模式下响应约为负离子的10倍, 故优先选择ESI 源下正离子检测方式。在正离子检测模式下,TBKW 及内标 TBTM 分别主要生成 m/z454.2 和m/z389.2 的 [sup]+[/sup]峰, 选择性对 [sup]+[/sup]峰进行产物离子扫描分析, TBKW 生成的主要碎片离子分别为[i]m/z [/i]285.1 ,[i]m/z[/i]126.1和[i]m/z[/i]210.1,TBTM生成的主要碎片离子有[i]m/z [/i]241.1。但实验过程中发现,[i] m/z[/i]126.1和[i]m/z[/i]210.1 的碎片离子响应弱, 且噪音高, 故最终选择[i]m/z [/i]285.1 和[i]m/z [/i]241.1 分别作为TBKW 及内标 TBTM 定量分析时的产物离子。待测物及内标的[sup]+[/sup]产物离子全扫描质谱图及相应出峰时间见图1-4。[/align][align=center] [img=,562,319]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241116590213_28_3255306_3.png!w562x319.jpg[/img] [/align][align=center]图1 TBKW二级特征碎片质谱图[/align][align=center][img=,555,315]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241117114646_9141_3255306_3.png!w555x315.jpg[/img] [/align][align=center]图2 TBTM二级特征碎片质谱图[/align][align=center][img=,559,296]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241117239993_3223_3255306_3.png!w559x296.jpg[/img] [/align][align=center]图3 TBKW色谱质谱图[/align][align=center][img=,567,326]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241117339148_8729_3255306_3.png!w567x326.jpg[/img] [/align][align=center]图4 TBTM色谱质谱图[/align][align=left][b]4.2 方法学验证结果[/b][/align][align=left][b]4.2.1 选择性 [/b]结果表明, 空白人血浆中的内源性物质不干扰头孢克肟和内标头孢他美的测定, 且同位素内标头孢他美不干扰头孢克肟的测定。[/align][align=left][b]4.2.2 标准曲线[/b] 用加权 ([i]W [/i]= 1/[i]x[/i][sup]2[/sup])最小二乘法进行回归运算, 求得的标准曲线的相关系数 ([i]r[/i][sup]2[/sup]) 均大于0.99。根据标准曲线,头孢克肟的线性范围为0.025~8 ug/ml。典型标准曲线如下所示: [i]y [/i]= 0.828 [i]x [/i]+4.35e[sup]-3[/sup]([i]r[/i][sup]2[/sup]= 0.9994)。[/align][align=left][b]4.2.3 残留考察 [/b]结果显示,样品与内标保留时间处均未出现干扰杂质峰, 在本实验选择的色谱和质谱条件下, 待测物及内标无残留。[/align][align=left][b]4.2.4 定量下限[/b] 其准确度和精密度见“精密度与准确度”项下。[/align][align=left][b]4.2.5 精密度与准确度[/b] 头孢克肟每一浓度水平的QC样品的日内、日间平均准确度均在15%之内,相对标准偏差均<15%,日内、日间精密度与准确度结果符合生物样本测定要求。相关数据见表1。[/align][align=center]Table 1 Precision and accuracy of TBKW (n=18).[/align][align=center] [img=,610,133]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241121176922_9541_3255306_3.png!w610x133.jpg[/img][/align][align=left][b]4.2.6 回收率和基质效应 [/b]待测物TBKW基质效应的平均值为27.7-42.9% 内标TBTM基质效应的平均值为2.1-52.1%,经内标归一化计算后得出TBKW内标归一化基质效应平均为59.1-62.8%,RSD符合要求。待测物TBKW高脂血浆基质效应的平均值为25.3-28.4% 内标TBTM的高脂血浆基质效应平均为41.9-47.6%,经内标归一化计算后得出TBKW内标归-化高血脂基质效应平均值为59.0-60.4%,RSD均符合要求。待测物TBKW溶血血浆基质效应的平均值为22.0-25.5%,内标TBTM的高血脂基质效应平均为38.6-43.9%,经内标归一化计算后得出TBKW内标归一化高血脂基质效应平均值为55.9-62.6%,RSD均符合要求。表明在试验选择的样品处理、色谱与质谱条件下,待测物和内标均表现出较强的基质效应,均表现出较强的离子抑制作用,特别是TBKW,但该机制效应对待测物和内标作用方向致、稳定,经内标校正后,虽然还存在基质效应,但对分析结果不会产生明显影响。TBKW及其内标TBTM的提取回收率结果,分别见表7-3。待测物TBKW在低、中、高三个QC浓度水平上提取回收率的平均值在138.2%-148.2%之间,内标的提取回收率的平均值在124.0%-130.4%之间,内标校正后提取回收率的平均值在110.4-114.1%之间,RSD符合要求。待测物和内标物在不同浓度水平的提取回收率结果是精密和可重现的,相关数据见表2。[/align][align=center]Table 2 Extraction recoveryand matrix effect of TBKW (n = 6).[img=,631,234]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241121399474_1836_3255306_3.png!w631x234.jpg[/img][/align][align=left][b]4.2.7 溶液稳定性[/b] 用甲醇配制的TBKW储备液1mg/mL-20℃冻存7、22天后的含量均值为新鲜配制的TBKW的106.5%和106.0%,未见降解;TBKW工作液储备液75、6500ng/mL 4℃冷藏7、30天后的含量均值分别为新鲜配制的TBKW的94.5%,113.4% 和89.8%,109.2%,不存在明显降解。[/align][align=left][b]4.2.8 血浆样品稳定性 [/b]TBKW血浆样品在室温放置5h、处理好的血浆样本室温放置6h、自动进样器放置16h,冻融3次、长期冷冻(27天,高于待测样本保存时间)试验条件下,各浓度质控样本的准确度均值在85-115%之间,RSD%均小于15%,表明TBKW血浆样品在上述所考察的情况下稳定。血浆样品稳定性测试结果满足人体血浆样本检测需求。[/align][align=left][b]4.2.9 批分析 [/b]对8轮试验数据进行了比较。结果表明在同一进样批中,每浓度含 48个样本,共计192个样本,其中LLOQ中有6个点准确度20%,少于总样品数的20% (12.5%),且LLOQ准确度和精密度平均值均15%,QC-L、 QC-M 和QC-H的准确度和精密度平均值均15%,总进样时间约18小时。即除血浆标准曲线外和质控点,同批次测定 180个样本能够满足生物样本分析要求.[/align][align=left][b]4.3 药时曲线[/b] 12名志愿者单剂量空腹及餐后口服300 mg头孢克肟胶囊后,平均药-时曲线见图5[/align][align=center][img=,507,279]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241122298854_2799_3255306_3.png!w507x279.jpg[/img] [/align][align=center]图5 12名健康受试者在空腹和餐后口服单剂量头孢克肟后平均药-时曲线 [/align][align=left][b]4.4药代动力学参数及统计结果 [/b]见表3。[/align][align=center]Table 3 Mainpharmacokinetic parameters of cefixime capsules taken on an empty stomach andafter meals[/align][align=center] [img=,546,175]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241122478527_4468_3255306_3.png!w546x175.jpg[/img][/align][align=left][b]5 讨论[/b][/align][align=left]比较空腹和高脂餐后口服头孢克肟的血药浓度的达峰时间[color=black]Tmax,[/color]达峰浓度[color=black]Cmax[/color][color=black]及曲线下面积[/color]AUC的数值,发现餐后口服头孢克肟的达峰时间推迟约0.792 h,达峰浓度约为空腹时的42.2%,餐后相对于空腹给药的相对生物利用度为39%,证明食物对头孢克肟的吸收速率、消除半衰期及吸收总量等药动学参数有显著的影响,故推荐头孢克肟片剂饭前空腹服用。[/align][align=left]饮食因素对口服药物的影响常为病人所忽视,为了避免药物对胃肠道的刺激常喜饭后服药,但餐后服药易受食物等因素的影响。本文结果提示:头孢克肟片不宜餐后服药,较合理的给药方案应是在空腹或饭前2h服用。[/align][align=left]食物降低头孢克肟的吸收速率及吸收程度的原因可能有以下几点: ①食物的存在降低了胃排空速率,使药物在胃中停留时间延长,使胃中的药物浓度降低,药物的吸收减慢,从而导致达峰时间延长 ②头孢克肟为弱酸性药物,主要在小肠吸收,食物会使肠液的 pH 减小,降低了头孢克肟的溶解性和溶出度,从而导致头孢克肟的吸收量降低。这些研究结果为头孢克肟片在临床安全合理用药提供重要的参考依据。[/align][align=left][b]参考文献[/b][/align][align=left]张羽长,李明铭,隋欣蕙,赵春杰.头孢克肟胶囊人体药动学研究及生物等效性评价.药学服务与研究,2008,8(06):429-431.[/align][align=left] Meng, Fang, et al."Sensitive liquid chromatography-tandem mass spectrometry method for thedetermination of cefixime in human plasma: Application to a pharmacokineticstudy." Journal of Chromatography B 819.2 (2005): 277-282.[/align][align=left]KREMER JM,WESTHOVENSR ,LEON M ,et al .Treatment of rheumatoid arthritis by selective inhibition ofT-cell activation with fusion protein CTLA4lg. N Engl J Med ,2003,349(20):1907 - 1915.生物样品定量分析方法指导原则(草案),中国药典,2015。[/align]
新人有难,还请各位大仙帮助。我需头孢妥仑匹酯片的进口标准,有货源的给新人说声,感谢!我的邮箱ahwuyan@live.cn。
GB/T 22942-2008 蜂蜜中头孢唑啉、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定 液相色谱-串联质谱法
有谁做过头孢噻肟钠 俄罗斯标准的,溶解度和化学鉴别中的试药是什么?
请问哪位能提供一下头孢布烯和其制剂的质量标准内容?将不胜感激!
本人急需注射用头孢他啶(Ceftazidime)和注射用头孢米诺钠(Cefminox sodium)EP6.0的标准,复印件也行,谢谢!
请教各位前辈,我看到标准品和对照品的定义不同“——[url=https://baike.baidu.com/item/%E5%AF%B9%E7%85%A7%E5%93%81]对照品[/url]和标准品一样是指国家药品标准中用于鉴别、检查、含量测定、杂质和有关物质检查等标准物质,它是国家药品标准不可分割的组成部分。国家[url=https://baike.baidu.com/item/%E8%8D%AF%E5%93%81%E6%A0%87%E5%87%86%E7%89%A9%E8%B4%A8]药品标准物质[/url]是国家药品标准的物质基础,它是用来检查药品质量的一种特殊的专用量具;是测量药品质量的[url=https://baike.baidu.com/item/%E5%9F%BA%E5%87%86]基准[/url];也是作为校正[url=https://baike.baidu.com/item/%E6%B5%8B%E8%AF%95%E4%BB%AA%E5%99%A8]测试仪器[/url]与方法的物质标准。在药品检验中,它是确定药品真伪优劣的对照,是控制药品质量必不可少的工具。[url=https://baike.baidu.com/item/%E5%AF%B9%E7%85%A7%E5%93%81]对照品[/url]:是指用于鉴别、检查、含量测定的标准物质,由国务院[url=https://baike.baidu.com/item/%E8%8D%AF%E5%93%81%E7%9B%91%E7%9D%A3%E7%AE%A1%E7%90%86]药品监督管理[/url]部门指定的单位制备、标定和供应。标准品系是用于生物测定、抗生素或生化药品中含量或效价测定的标准物质,以国际标准品进行标定;对照品除另有规定外,按干燥进行计算后使用。[color=#333333]对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已,造成错误的原因,可能是有的药品既有对照品,又有标准品。例如,当用微生物法测定[/color][url=https://baike.baidu.com/item/%E5%A4%B4%E5%AD%A2%E5%85%8B%E7%BD%97]头孢克罗[/url][color=#333333]效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品。即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的。”[/color][color=#333333]这一大段文字看了还是不甚明白,这样说来,标准品的要求更严格,应该都很贵的,我看一个检测方法还有类似文献的时候,都说用物质A的标准品3.0g,配制标准品溶液~~~~~感觉用量太大了。[/color]那我现在用液相做物质A的含量检测时,外标法,这个时候用标准品还是对照品呢?购买试剂的时候,看到纯度97%的某化合物,这个可用用来液相含量检测吗?我感觉特别混乱了,谢谢各位了
用盐酸克伦特罗配制克伦特罗标准溶液,是否要出去盐酸根离子称取标准品质量。
求购头孢地尼E-异构体对照品头孢地尼做分析方法验证,其中有关物质头孢地尼E-异构体标准品买不到。很多销售公司都有但是资质不全我不能买他们的。请教各位大侠们,帮个忙吧。急用!!谢谢!!!!

近日接触到一个药品——头孢拉定胶囊。其中检查项目有项是检查头孢氨苄的含量。见下图。http://ng1.17img.cn/bbsfiles/images/2014/09/201409051634_512996_0_3.jpg下图是头孢拉定项下的做法http://ng1.17img.cn/bbsfiles/images/2014/09/201409051637_512998_0_3.jpg 对此的疑问如下: 1、头孢拉定胶囊中为何要检查头孢氨苄,是否说明在生产头孢拉定中不可避免的会有头孢氨苄呢? 2、在检查中测定出头孢氨苄含量,还得测定出头孢拉定含量,这样才能计算出结果是吗? 3、标准规定的好奇怪,直接在胶囊剂的检查项下规定“含头孢氨苄不得过5.0%(举例说个数字啊,也可以是6.0%)”这样不就可以了吗,为何要规定成“含头孢氨苄不得过头孢拉定和头孢氨苄总量的6.0%”
[center]丁基胶塞监管加强 头孢曲松钠缓慢恢复[/center] 为解决头孢类注射剂澄清度问题,保证产品质量,保障公众用药安全,日前,国家食品药品监督管理局就进一步加强对使用丁基胶塞生产头孢类注射剂的监督管理有关问题下发通知,要求各省(区、市)食品药品监督管理部门要在落实《关于做好注射用头孢曲松钠处理工作的通知》的基础上,加强对药品生产企业使用丁基胶塞的监管。 胶塞相容性检验有标准 通知称,在确保药品质量的同时,为保证注射用头孢曲松钠的供应,国家局委托中检所制定了注射用头孢曲松钠与丁基胶塞相容性加速实验方法。要求各省(区、市)食品药品监督管理部门将此方法转发辖区内头孢类注射剂药品生产企业并加强监督。注射用头孢曲松钠生产企业应依据此方法,在选择丁基胶塞生产药品时进行相容性实验,并对购入的每批丁基胶塞和生产的每批药品出厂前,依此方法进行检验,合格后方可出厂。对于其他头孢类注射剂,药品生产企业可参考该方法,自行建立适宜的快速验证方法。 通知规定,药品生产企业应根据产品注册时经相容性实验确定的丁基胶塞生产药品,若变更丁基胶塞的生产厂家,应对药品与变更的丁基胶塞相容性进行实验验证,符合要求并报所在地省(区、市)食品药品监督管理部门备案后方可使用。 通知强调,各地食品药品监督管理部门要加大对2009年1月1日以后生产的头孢类注射剂,特别是注射用头孢曲松钠的抽验力度,重点对生产环节产品的澄清度开展监督抽验,监督药品生产企业严格执行有关规定,确保产品的质量。对违法违规生产的,一经查实,依法处理。 小胶塞影响不小 一些企业界人士表示,此通知下发的主要目的是为了保证药品的质量安全。对购入的每批丁基胶塞和生产的每批药品出厂前进行注射用头孢曲松钠与丁基胶塞相容性加速实验也许会增加成本,但是此类检验是必要的,而且毫无疑义是正确的,毕竟药品质量安全是第一位的,必须要予以保证。 同时有观点认为,此通知对于企业来说未尝不是一件好事,在确定丁基胶塞相容性上有了标准的实验方法,才能切实操作。 此前,由于头孢曲松钠与丁基胶塞的相容性问题导致的溶液浑浊,国家食品药品监督管理局曾下发《关于做好注射用头孢曲松钠处理工作的通知》(食药监市函[2008]118号),要求注射用头孢曲松钠生产企业自查自检,并于2008年12月1日前收回由于丁基胶塞原因而有可能导致澄清度不合格的产品。对2008年12月1日以后在药品流通、使用环节发现澄清度不合格注射用头孢曲松钠,按《药品管理法》相关规定进行查处。 这一纸公文对于国内众多头孢曲松制剂企业无疑是当头棒喝。许多企业因此关闭头孢曲松钠生产线或转产。自1998年罗氏芬专利期满后,头孢曲松在我国得到迅猛发展。因其市场需求量大、产品附加值高、临床疗效突出,迅速崛起为全身抗感染用药金额之首。同时它的成长改变了头孢类抗生素产业格局,扩大了上游中间体7-ACA的需求,成为头孢抗生素的核心品种。此次的查处,加之受困于反倾销等贸易壁垒及头孢曲松钠与含钙溶液同时使用时产生的安全性不良事件等信息,2008年,头孢曲松钠在多重打击下份额锐减。 质量、成本、份额存矛盾 “丁基胶塞质量参差不齐,而药品多种多样,针对性的选择缺乏标准和办法一直是困扰生产企业的突出问题。”中国化学制药工业协会秘书长周燕表示。 专家指出,药品的性质千差万别,要想使一种丁基胶塞的配方适用于所有药品是不太可能的,应该根据各种药品性质的不同以及胶塞与药物的相容性(稳定性)试验,来选择与药物匹配的胶塞产品。头孢曲松只是其中比较突出的一个例子,其他一些药品也有存在此类问题。我国目前胶塞配方品种较少,还不能满足很多药品的包装要求。 业内人士表示,实际上使用复膜胶塞是解决头孢曲松钠药品相容性的一个比较简单的方法,并且该胶塞有数据证实其在药品有效期内的稳定性。但由于国内头孢曲松钠处于低价竞争状态,出于成本原因,复膜胶塞并未被业内普遍接受。 分析认为,头孢曲松钠从1999年的200元左右直到今天的几元钱一支,产品的利润空间不断缩小,目前几近无利可图的情况下,提高质量与降低成本、扩大市场份额之间的矛盾激化。 “头孢曲松钠正在缓慢恢复中。”健康网首席研究员吴惠芳则表示。 信息来源:医药经济报
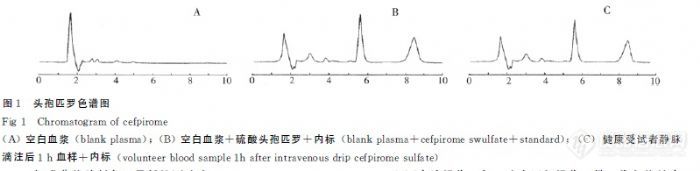
作者:方既明; 刘世坤;(湖南省岳阳市第一人民医院; 中南大学湘雅三医院;)摘要:目的建立高效液相色谱法测定人血浆中硫酸头孢匹罗的含量。方法采用Diamonsil C18色谱柱,流动相为0.03mol.L-1磷酸二氢铵缓冲液(pH 3.3)-乙腈(9∶1);流量为1.0mL.min-1,检测波长为270nm。结果硫酸头孢匹罗浓度在0.3~20.0μg.mL-1呈良好的线性关系,最低检测浓度为100ng.mL-1,日间、日内精密度均80%。结论本方法简单快速,准确灵敏,适用于注射用硫酸头孢匹罗在人体内的药物动力学研究。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208061032_381712_1606903_3.jpg
我是新手,求助头孢托罗活性酯的液相条件,我用水和甲醇,水和乙腈,甲醇跟20Mmol每L的的乙酸胺都试过,就是不出峰,峰型很不好看。用的柱子是XDB-c18的。
[align=left][color=black]头孢克肟(Cefixime)是β-内酰胺类抗生素,为口服用的第三代头孢菌素类抗生素,适用于治疗敏感菌所致的呼吸、泌尿和胆道等部位的感染。[/color][/align][img=,619,248]https://ng1.17img.cn/bbsfiles/images/2019/03/201903271729327584_7997_2222981_3.jpg!w619x248.jpg[/img][color=black] [/color][color=black]ADME(adamantane)[/color][color=black]是笼状结构的金刚烷基团,通过“新型官能团”和特有的包被型填料表面“控制技术”,使该款色谱柱兼具疏水性和高极性的特点;由于金刚烷特有的笼状结构所带来的立体选择性,还赋予了ADME分离结构类似化合物的能力。头孢克肟极性较强,故选用键合金刚烷基团的高表面极性色谱柱CAPCELL PAK ADME进行分析。[/color][align=left][img=,400,222]https://ng1.17img.cn/bbsfiles/images/2019/03/201903271729553114_5586_2222981_3.jpg!w744x413.jpg[/img][/align][align=left][color=black]金刚烷基ADME填料表面示意图[/color][/align][color=black]使用CAPCELL PAK ADME色谱柱在0.1%甲酸水/乙腈体系下对混合对照品和血浆样品进行分析,头孢克肟峰形良好,保留时间为1.66 min。在混合对照品中,阿莫西林在该检测离子下显示为两个峰,头孢他美保留时间1.71,峰形正常,可考虑选做内标物。血浆样品能够正常检测目标物质峰。[/color][align=left][img=,500,310]https://ng1.17img.cn/bbsfiles/images/2019/03/201903271730190277_4380_2222981_3.jpg!w877x545.jpg[/img][/align][align=left][color=black]图1 混合对照品[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]分析图[/color][/align][align=left][img=,500,311]https://ng1.17img.cn/bbsfiles/images/2019/03/201903271730350327_5592_2222981_3.jpg!w879x547.jpg[/img][/align][align=left][color=black]图2 血浆样品[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]分析图[/color][/align][align=left][img=,500,261]https://ng1.17img.cn/bbsfiles/images/2019/03/201903271730528955_449_2222981_3.jpg!w818x427.jpg[/img][/align][color=black]综上所述,使用CAPCELL PAK ADME S3 2.1 mm i.d. × 100 mm色谱柱对头孢克肟混合对照品和血浆样品进行分析,可得到良好的分析结果。[/color]
请教大家一个问题,最近参照SN/T1924-2011法,做肉中克伦特罗残留检测。其中,标准上给出了标准溶液的配制方法,但是小弟有一个疑惑,标准中给出的标准中间液是10mg/L,但是克伦特罗的标准曲线按照标准上说要在0.5ng/ml-5ng/ml。是用标准中间液一步稀释到曲线要求的浓度吗?还是逐级稀释呢?大家做的过程中有什么问题也可以讨论一下。。。

Venusil XBP C18(L)分析头孢噻肟钠的分析报告摘要:本实验按照头孢噻肟钠2010版中国药典方法进行测定,以含量测定和有关物质检测方法共同进行色谱柱的筛选。在选定的色谱柱上,进一步考察了该色谱柱用于头孢噻肟钠系统适用性、含量、有关物质等项测试的结果,并初步考察了色谱柱的使用寿命,结果表明VenusilXBP C18(L)适用于头孢噻肟钠的分析:(1)系统适用性溶液中共检出7个杂质,分离度均符合标准要求;(2)对照品平行进样6针RSD为0.13%,保留时间17.039分钟,柱效5068,拖尾因子1.116,均符合标准要求;(3)含量测定中,头孢噻肟钠保留时间16.936分钟,柱效4779,拖尾因子1.118,符合标准要求;(4)有关物质测定中共检出6个杂质,分离度均符合标准要求;(5)用于头孢噻肟钠含量测试时,连续进样300针,保留时间、柱效和拖尾因子均无显著变化,表明VenusilXBP C18(L)对该样品和流动相有较好耐受性。关键词:头孢噻肟钠;VenusilXBP C18(L);2010版药典;液相色谱法前言头孢噻肟钠为中国药典2010版二部收录品种,本实验按照该标准进行测试,通过测试得出VenusilXBP C18(L)适用于头孢噻肟钠分析,其测试结果令人满意。实验部分试剂材料超纯水、甲醇、无水磷酸氢二钠、磷酸高效液相色谱柱:Venusil XBP C18(L);5 μm,150 Å,4.6 × 150mm样品制备系统适用性溶液制备:取头孢噻肟对照品适量,加流动相溶解并稀释制成每1 ml约含1 mg的溶液,作为系统适用性试验溶液。实验结果系统适用性测定结果表1. Venusil XBP C18(L)用于头孢噻肟钠系统适用性溶液测定结果http://ng1.17img.cn/bbsfiles/images/2017/10/2015082410220596_01_2864683_3.png表2.Venusil XBP C18(L)用于头孢噻肟钠对照品溶液测定结果http://ng1.17img.cn/bbsfiles/images/2017/10/2015082410251562_01_2864683_3.png含量测定结果表3. Venusil XBP C18(L)用于头孢噻肟钠含量测定结果http://ng1.17img.cn/bbsfiles/images/2017/10/2015082410281917_01_2864683_3.png有关物质测定结果表4.Venusil XBP C18(L)用于头孢噻肟钠有关物质测定结果http://ng1.17img.cn/bbsfiles/images/2017/10/2015082410305808_01_2864683_3.png色谱柱批次验证结果表5. Venusil XBP C18(L)批次验证结果http://ng1.17img.cn/bbsfiles/images/2017/10/2015082410355084_01_2864683_3.png色谱柱寿命测试结果表6.Venusil XBP C18(L)用于头孢噻肟钠寿命测试结果http://ng1.17img.cn/bbsfiles/images/2015/08/201508241038_562414_2864683_3.png
中国药典增补版今年10月1号实施的,里面有关于头孢拉定中2-萘酚的检测,但是并未买到2-萘酚标准品,在此请教众位老师2-萘酚可不可以用试剂去做
请问怎样用紫外可见分光光度计测乌洛托品的含量,标准曲线的溶液如何配制?
菌落总数是食品中重要的安全卫生指标,表示食品受细菌污染的程度。但很多人确不知道食品落菌总数的标准,上海尼那环保科技有限公司企业管理部摘录下,仅供参考。1、膨化食品的落菌总数标准依据国家强制性标准GB17401-2003《膨化食品卫生标准》规定,膨化食品的菌落总数应为≤10000cfu/g、大肠菌群应为≤90MPN/100g,超过国家标准规定可判断为不合格膨化食品。2、固体饮料的落菌总数标准依据国家强制性标准GB7101-2003《固体饮料卫生标准》规定,固体饮料产品的菌落总数应≤1000cfu/g;大肠菌群应≤90MPN/100g;霉菌应≤50cfu/g,超过国家标准规定可判断为不合格固体饮料。3、糕点、面包、月饼的落菌总数标准依据国家强制性标准GB 7099-2003《糕点、面包卫生标准》规定,月饼产品中菌落总数不得超过1500cfu/g,大肠菌群不得超过30MPN/100g,霉菌计数不得超过100cfu/g;蛋糕生产的标准要求:菌落总数≤10000cfu/g,大肠菌群≤300MPN/100g,霉菌≤150cfu/g,超过国家标准规定可判断为不合格糕点类产品。4、食醋的落菌总数标准依据国家强制性标准GB2719-2003《食醋卫生标准》规定,食醋中菌落总数不得超过10000cfu/mL ,超过国家标准规定可判断为不合格食醋。5、冷冻饮品的落菌总数标准依据国家强制性标准GB2759.1-2003《冷冻饮品卫生标准》规定,含淀粉或果类的冷冻饮品菌落总数应≤3000cfu/g,大肠菌群应≤100MPN/100g;含乳蛋的冷冻饮品的菌落总数应≤25000cfu/g,大肠菌群应≤450MPN/100g,超过国家标准规定可判断为不合格雪糕或冷饮。6、饼干的落菌总数标准依据国家强制性标准GB7100-2003《饼干卫生标准》规定,非夹心饼干的菌落总数不得超过750cfu/g,夹心饼干菌落总数不得超过2000cfu/g;饼干产品的霉菌计数不得超过50cfu/g,超过国家标准规定可判断为不合格饼干。7、巴氏杀菌、灭菌乳的落菌总数标准依据国家强制性标准GB19645 -2005《巴氏杀菌、灭菌乳卫生标准》规定,灭菌乳菌落总数不得超过10cfu/g,大肠菌群不得超过3MPN/100g,超过国家标准规定可判断为不合格乳制品。8、蜜饯的落菌总数标准依据国家强制性标准GB14884-2003《蜜饯卫生标准》规定,蜜饯食品中菌落总数不得超过1000cfu/g;霉菌不得超过50cfu/g,超过国家标准规定可判断为不合格乳蜜饯产品。9、调味品的落菌总数标准 依据SB/T10371-2003《鸡精调味料》标准规定,鸡精调味料中大肠菌群不得超过90MPN/100g,超过国家标准规定可判断为不合格鸡精产品。10、瓶装水的落菌总数标准依据国家强制性标准GB17324-2003《瓶装饮用纯净水卫生标准》规定,饮用纯净水的菌落总数应≤20cfu/ml,大肠菌群≤3MPN/100ml;强制性国家标准GB19298-2003《瓶(桶)装饮用水卫生标准》规定,饮用水的菌落总数应≤50 cfu/ml,大肠菌群应≤3MPN/100ml;强制性国家标准GB8537-1995《饮用天然矿泉水》规定,天然矿泉水的菌落总数为50cfu/ml,大肠菌群为0。若超过国家标准规定可判断为不合格纯净水或矿泉水。11、酱腌菜的落菌总数标准依据国家强制性标准GB2714-2003《酱腌菜卫生标准》规定,酱腌菜产品的大肠菌群不得超过30MPN/100g,若超过国家标准规定可判断为不合格酱腌菜。12、食糖的落菌总数标准依据国家强制性标准GB13104-2005《食糖卫生标准》规定,白砂糖、绵白糖的菌落总数不得超过100cfu/g,超过国家标准规定可判断为不合格糖制品。13、肉干、肉铺的落菌总数标准依据强制性国家标准GB2726-2005《熟肉制品卫生标准》规定,肉制品中大肠菌群不得超过30MPN/100g,超过国家标准规定可判断为不合格肉制品。14、油炸小食品的落菌总数标准依据国家强制性标准GB16565-2003 《油炸小食品卫生标准》规定,油炸类炒货大肠菌群为≤30MPN/100g,超过国家标准规定可判断为不合格炒货制品。15、果、蔬汁饮料的落菌总数标准依据国家强制性标准GB19297-2003《果、蔬汁饮料卫生标准》规定,果(蔬)汁及果(蔬)汁饮料产品的菌落总数不得超过100cfu/mL,酵母不得超过20cfu/mL,超过国家标准规定可判断为不合格果、蔬汁饮料。16、果冻的落菌总数标准依据国家强制性标准GB19299-2003《果冻卫生标准》规定,果冻中菌落总数≤100cfu/g、大肠菌群≤30MPN/100g,超过国家标准规定可判断为不合格果冻产品。17、黄酒的菌落总数标准依据国家强制性标准GB2758-2005《发酵酒卫生标准》规定,黄酒产品的菌落总数应≤50cfu/ml,超过国家标准规定可判断为不合格黄酒。18、芝麻酱的菌落总数标准依据国家标准规定芝麻酱产品的大肠菌群应≤90个/100g,超过国家标准规定可判断为不合格芝麻酱。19、碳酸饮料的菌落总数标准依据国家强制性标准GB2759.2-2003《碳酸饮料卫生标准》规定,碳酸饮料产品的酵母应≤10cfu/mL,菌落总数应≤100cfu/mL,大肠菌群应≤6MPN/100mL;超过国家标准规定可判断为不合格碳酸饮料。20、熟肉制品的菌落总数标准强制性国家标准GB2726-2005《熟肉制品卫生标准》规定,菌落总数标准限量值为≤30000cfu/g,超过国家标准规定可判断为不合格熟肉制品。21、豆制品及面筋的菌落总数标准依据国家强制性标准GB2711-2003《非发酵性豆制品及面筋卫生标准》规定,定型包装非发酵豆制品的菌落总数为≤750 cfu/g;依据国家强制性标准GB2712-2003《发酵性豆制品卫生标准》规定,定型包装发酵性豆制品的大肠菌群为≤30MPN/100g。若超过国家标准规定可判断为不合格豆制品或面筋。22、方便面的菌落总数标准依据国家强制性标准GB17400-2003《方便面卫生标准》规定,方便面的面块+调料菌落总数为≤50000cfu/g,大肠菌群为≤150 MPN/100g,超过国家标准规定可判断为不合格方便面。