我想做的是三磷酸腺苷二磷酸腺苷和磷酸腺苷,应该用什么柱子合适?
目的:介绍腺苷蛋氨酸的临床应用及研究进展,为其临床应用提供参考。方法:对近年来国内外的代表性文献进行归纳、总结。结果与结论:腺苷蛋氨酸除作为治疗肝病的常用药物外,还可用于胰腺炎、骨关节炎和抗抑郁等治疗,但其临床疗效和作用机制还有待进一步研究。同时还需注意其引起严重过敏反应和低血钾的不良反应。[em0805]
正在做萘的异丙基化反应,因为2,6-二异丙基萘和2,7-二异丙基萘标样太贵了,请教各位大牛,这两种物质在色谱中出峰顺序哪个在前?哪个在后? 非常感谢!!
用高效液相做腺苷谱图,什么展开剂适合?
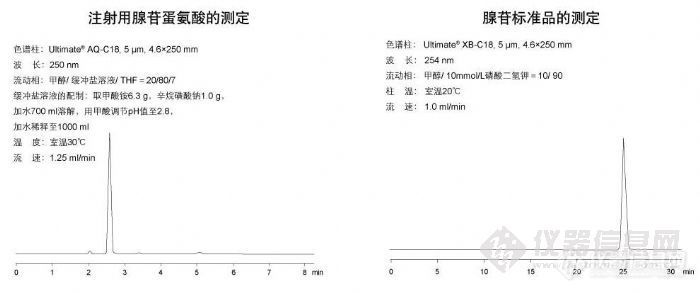
注射用腺苷蛋氨酸的测定和腺苷标准品的测定[img]http://ng1.17img.cn/bbsfiles/images/2009/11/200911021842_180183_1896702_3.jpg[/img]
三磷酸腺苷二钠如何定性啊?我的样品是白色晶体,如何确定里面含有三磷酸腺苷二钠,十万火急,完望大侠们救我[em14] [em14] [em14]
双(2-氯异丙基)醚和双(1-氯异丙基)醚是一个物质吗?因为双(1-氯异丙基)醚没有写CAS号所以查不到,也搜不到它[img]https://ng1.17img.cn/bbsfiles/images/2020/03/202003091131393926_7679_3974884_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/03/202003091131397330_1037_3974884_3.png[/img]
【序号】:1【作者】:申艳红 张文升 刘启宾 渠桂荣 【题名】:环磷腺苷的合成【期刊】:《中国医药工业杂志》 【年、卷、期、起止页码】:2004年03期【全文链接】:http://www.cnki.com.cn/Article/CJFDTotal-ZHOU200403001.htm【序号】:2【作者】:张今 刘兰英 沈雨生 【题名】:3′,5′-环化腺苷酸的合成【期刊】:《吉林大学学报(理学版)》 【年、卷、期、起止页码】:1979年02期 【全文链接】: http://www.cnki.com.cn/Article/CJFDTotal-JLDX197902008.htm 【序号】:3【作者】:张今 刘兰英 沈雨生 【题名】: 3′,5′-环化腺苷酸合成的改进【期刊】:《中国医药工业杂志》 【年、卷、期、起止页码】:1979年04期 【全文链接】:http://www.cnki.com.cn/Article/CJFDTotal-ZHOU197904002.htm谢谢!谢谢!
买了二异丙基萘混合标准(7种),跑出来,检索发现都是2,6-DINP出现在前2位,如何鉴定是其他的异构体呢?先上传全扫描附件,请老师帮忙确定,谢谢!
最近做二异丙基萘含量测定,由于购买的只是一种混合物(含7种异构体),但是只有一个cas登记号,按照标准方法(内标法),确实发现并确定了7种组分流出顺序,根据标准方法只是计算二异丙基萘的总量。但是突然想计算不同异构体的具体含量,这又该如何计算呢?由于异构体中有几种是很难找到(买到)单标的,此时可用面积归一化法计算可以吗?是否需要通过面积归一化法来单独建立不同异构体的标准曲线?这样算出来的结果具有说服力吗?如何不行,该如何计算呢?望老师赐教,谢谢!
内标法检测二异丙基萘(7种同分异构体),按方法要求分别精确称取5份不同质量的二异丙基萘(7种同分异构体)配成溶液进行GCMS分析。做标线时遇到了困难,只知道二异丙基萘(7种同分异构体)的质量,不知道各同分异构体的质量,这标线怎么做?工作站能实现这7种同分异构体峰面积加和吗?能的话操作步骤是?请各位牛人赐教!谢谢!
本人因为做实验求购s-腺苷-L-高胱氨酸,请有供应者与0510-83591618转8058胡继清联系哪位版友有用过该药品的可以提供药品供应商的联系方式吗?非常感谢!
请各位朋友提供一下环磷酸腺苷测定结果的计算方法,谢谢!
椰油酰胺丙基甜菜碱——两性离子表面活性剂由于两性表面活性剂具有良好的表面活性剂性能、低刺激性以及被称为解毒性的刺激缓和性能(A.L.L. Hunting, 1985 ; G. Panzer, 1980),故它们被广泛地应用于温和的无泪香波和敏感的皮肤清洁剂。然而,在过去几年中,由于对两性表面活性剂基本特性的不断关心,人们进行了深入的研究;其结果显示,除了固有的特性之外,两性表面活性剂有着更多的功能属性。罗地亚公司的研究结果显示,通常被看作是杂质的副产品在控制化妆品配方发泡性和流变性方面发挥着十分重要的作用。从而人们可以通过调整产品组分,提供特制的性能。
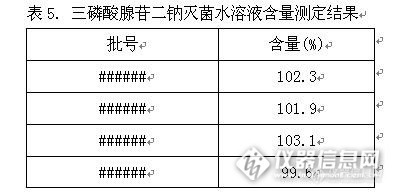
三磷酸腺苷二钠注射液含量方法学研究 三磷酸腺苷二钠的重量比 照高效液相色谱法(中国药典2010年版附录V D)测定。1.色谱条件与系统适用性试验 用十八烷基键合硅胶为填充剂;以0.2mol/L磷酸盐缓冲液(取磷酸氢二钠35.8g,磷酸二氢钾13.6g,加水900ml溶解,用1mol/L氢氧化钠溶液调节pH值至7.0,加入四丁基溴化铵1.61g,加水至1000ml,摇匀)-甲醇(95:5)为流动相;柱温为35℃;检测波长为259nm;理论板数按三磷酸腺苷二钠峰计算应大于1500;各色谱峰的分离度应符合规定。出峰次序依次为一磷酸腺苷钠、二磷酸腺苷二钠与三磷酸腺苷二钠。测定法 取精密量取A液适量,用流动相制成每1ml中含0.2mg的溶液;取20ml注入高效液相色谱仪,记录色谱图,按下式计算: http://ng1.17img.cn/bbsfiles/images/2012/12/201212272334_416487_2583865_3.jpg2. 测定三磷酸腺苷二钠的重量比溶液稳定性试验将供试品溶液在室温放置8小时,记录液相色谱图峰面积,结果见表1。 http://ng1.17img.cn/bbsfiles/images/2012/12/201212272335_416489_2583865_3.jpg验结果表明:本品溶液在8小时内测定稳定。3. 测定三磷酸腺苷二钠的重量比溶液重复性试验取供试品溶液连续进样6针,结果见表2。http://ng1.17img.cn/bbsfiles/images/2012/12/201212272336_416490_2583865_3.jpg试验结果表明:本品重复性良好。4. 测定三磷酸腺苷二钠的重量比溶液精密度试验精密量取040413批A液6份,用流动相制成每1ml中含0.2mg的溶液,分别测定重量比,结果见表3。 http://ng1.17img.cn/bbsfiles/images/2012/12/201212272336_416491_2583865_3.jpg试验证明,本方法测定三磷酸腺苷二钠重量比的精密度良好。5. 回收率试验精密称取三磷酸腺苷二钠约0.4g、0.5g、0.6g各三份,分别置10ml量瓶中,分别加入处方量的辅料空白溶液,超声助溶后,加水稀释至刻度,摇匀,滤过,量取续滤液1.0ml,加0.1mol/L磷酸盐缓冲液制成每1ml中含20μg的溶液,照分光光度法测定259nm波长处的吸收度,计算出总核苷酸。另取续滤液1.0ml,用流动相制成每1ml中含0.2mg的溶液,摇匀,精密量取20μl注入液相色谱仪,记录色谱图,计算三磷酸腺苷二钠重量比。含量按下式计算。测定结果见表4。三磷酸腺苷二钠含量(%)=总核苷酸×三磷酸腺苷二钠重量比 http://ng1.17img.cn/bbsfiles/images/2012/12/201212272337_416492_2583865_3.jpg平均回收率为99.84%;RSD为0.17%结论:由以上结果知,本品含量测定方法准确度较高。6. 含量测定取本品A液1.0ml,加0.1mol/L磷酸盐缓冲液制成每1ml中含20μg的溶液,照分光光度法测定259nm波长处的吸收度,计算出总核苷酸。另取本品A液1.0ml,用流动相稀释制成1ml中约含0.2mg的溶液,取20μl注入液相色谱仪,记录色谱图,计算三磷酸腺苷二钠重量比。按下式计算三磷酸腺苷二钠含量,结果见表5。http://ng1.17img.cn/bbsfiles/images/2012/12/201212272338_416494_2583865_3.jpg 计算公式:三磷酸腺苷二钠含量(%)=总核苷酸×三磷酸腺苷二钠重量比。
食品安全国家标准 食品营养强化剂 5’单磷酸腺苷
昨天我在检测n-异丙基苯胺时出现个比较令人头疼的问题。用的是单点外标,配样方法是取适量样品用乙腈定容。一开始,我配好标样跟样就开始走序列,结果走下来,样品标出102%的含量;个人以为是标样的配制有出入,于是重新配标样,初步测试了下(即先走了一针,跟之前走的样品算含量)样品含量为100.5%,符合规定,于是再重新走序列,谁知奇怪的事情出现了,原本的同一个样,自动进样器打下来2针面积都比之前少了20万,含量也变成98%,也就是说不合格了。不知道是哪出了问题,希望各位前辈能给与指点!谢谢!
求助检测异丙基硫杂蒽酮(ITX)(CAS:5495-84-1)的检测方法,或者是有关的参考文献
如何鉴定三磷酸腺苷二钠啊,哪位大侠帮帮我啊

10,抽取5个版友);中奖名单:999youran(注册ID:999youran)zgx3025(注册ID:v2844608)m3071659(注册ID:m3071659)馨语(注册ID:huangdm)莫名其妙(注册ID:moyueqiu)http://ng1.17img.cn/bbsfiles/images/2016/09/201609261647_612177_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/09/201609261647_612178_1610895_3.jpg【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================三磷酸腺苷二钠注射液方法:HPLC应用编号:101389基质:药品应用编号:101389化合物:三磷酸腺苷二钠固定相:Platisil ODS色谱柱/前处理小柱:Platisil ODS 5u 150 x 4.6 mm样品前处理:【含量测定】三磷酸腺苷二钠的重量比 取本品适量,精密称定,加流动相溶解并定量稀释成每1ml中含0.4mg的溶液。色谱条件:检测波长:UV 259 nm 流动相:0.2mol/L磷酸盐缓冲溶液-甲醇(95:5) 缓冲溶液:取磷酸氢二钠35.8g、磷酸二氢钾13.6g,加水900ml溶解,用1mol/L氢氧化钠溶液调pH至7.0,加入四丁基溴化铵1.61g,加水至1000ml,摇匀。 洗脱方式:等度 柱温:35℃ 进样量:10 ul文章出处:P29关键字:三磷酸腺苷二钠注射液,2010版中国药典,HPLC,含量测定,铂金,Platisil ODS谱图:http://www.dikma.com.cn/Public/Uploads/images/atp(1).PNG图例:1. 一磷酸腺苷二钠;2. 二磷酸腺苷二钠;3. 三磷酸腺苷二钠
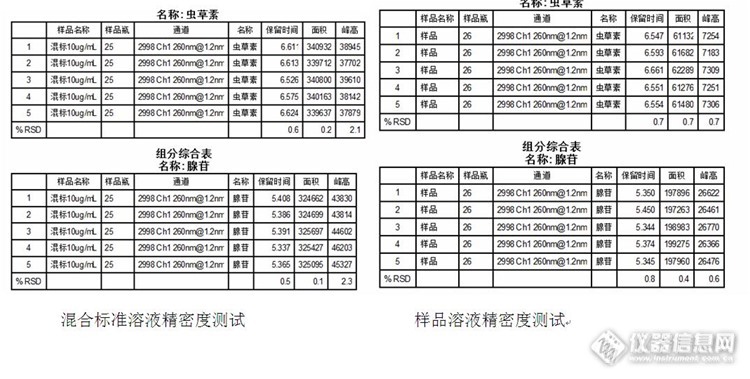
1 前言 蛹虫草也叫北冬虫草,俗名不老草,是虫,菌结合的药用真菌,现代珍稀中草药。北虫草不仅含有丰富的蛋白质和氨基酸,而且含有30多种人体所需的微量元素,是上等的滋补佳品。蛹虫草中富含虫草素和腺苷,对调节人体内分泌和增强免疫功能等显著作用. 腺苷是一种遍布人体细胞的内源性核苷,可直接进入心肌经磷酸化生成腺苷酸,参与心肌能量代谢,同时还参与扩张冠脉血管,增加血流量。腺苷对心血管系统和肌体的许多其它系统及组织均有生理作用。腺苷是用于合成三磷酸腺苷(ATP)、腺嘌呤、腺苷酸、阿糖腺苷的重要中间体。 虫草素是一种天然来源的药物,具有中医医理中冬虫夏草一样的阴阳同补和双向调节人体平衡的功能;它在护肝、保肾、润肺方面由于成分更纯效果更好,而且大补气血,能消除现在不能治愈的痛经、偏头痛、颈椎增生等疾病。从西医医理角度看虫草素具有抗肿瘤、抗衰老、抗菌、抗病毒、免疫调节、改善新陈代谢、清除自由基等多种药理作用,有良好的临床应用前景。 天然虫草资源已日益匮乏,然而蛹虫草更容易人工栽培 , 因此蛹虫草目前被选为冬虫夏草的最佳替代品 , 已进行了规模化的人工栽培和应用现多用人工虫草来满足市场的需求。注:以上部分内容摘自“百度百科”http://ng1.17img.cn/bbsfiles/images/2014/10/201410311605_521149_1669358_3.jpg 本文采用CNW Athena C18-WP色谱柱测定人工蛹虫草中的腺苷和虫草素,并对检测方法进行简单优化,该方法具有简单、快速、重复性好等优点,对人工蛹虫草以及该类保健品的质量控制极为重要。2 实验方法2.1 仪器与试剂Waters e2695液相色谱仪(主要包括2998光电二极管矩阵检测器,柱温箱,自动进样器);超声波清洗机实验中乙腈为色谱纯;水为超纯水系统制得, 18MΩ•cm,25 ℃虫草素和腺苷标准品,美国Sigma公司2.2 色谱条件色谱柱:CNW Athena C18-WP(250mm×4.6mm,5μm);流动相:乙腈:水=10:90;流速:1.0mL/min;柱温:30℃;进样量:10μL检测波长:260nm。2.3 样品预处理 称取粉碎均匀的人工蛹虫草样品0.50g于150mL烧杯中,加入约30mL50℃左右的温水,在50℃下超声提取30min,过滤,收集滤液于100mL容量瓶中。用水将滤纸上的样品小心地转移至烧杯中,再重复提取2次,合并提取液,并用水定容至刻度,冷却至室温。吸取少量提取液,用0.45μm滤膜过滤后进样分析。2.4 标准溶液的配制 分别准确称取10.0mg腺苷和虫草素标准品,用水配制成浓度为100μg/mL的标准储备液。临用前,再吸取一定体积的上述标准储备液,配成相应浓度的混合标准溶液。3 结果和讨论3.1 检测波长的确定 利用2998光电二极管矩阵检测器的3D通道扫描的功能,在200~600nm波长范围内对混合标准溶液进行3D光谱扫描。从图中可以看出,腺苷和虫草素在此波长范围内均有吸收,而且都有两个较强的特征吸收波长。在相应的出峰时间提取光谱,从提取的光谱图中可以看到,腺苷的最大吸收波长为205.3nm,次级吸收波长为259.6nm;虫草素的最大吸收波长为206.5nm,次级吸收波长为259.6nm。对比206nm和260nm吸收波长处的色谱图,当检测波长为206nm时,腺苷和虫草素的响应值最大,然而对样品的检测过程中发现,样品中干扰物质在此波长也有很好的吸收,从而影响腺苷和虫草素的定性和定量分析;当检测波长为260nm时,干扰组分少,定性和定量更为准确,综合考虑,选择260nm为腺苷和虫草素的检测波长。http://ng1.17img.cn/bbsfiles/images/2014/10/201410311609_521156_1669358_3.jpghttp://ng1.17img.cn/bbsfiles/images/2014/10/201410311610_521157_1669358_3.jpg3.2 流动相条件的优化 流动相中有机相种类和含量对待测组分的分离以及检测时间具有重要的影响。实验中发现,当流动相中乙腈含量为20%时,腺苷和虫草素的出峰时间较早,且未完全分离,不利于样品的检测;当流动相中乙腈含量为10%时,腺苷和虫草素的出峰时间和分离度都比较合适;当流动相中乙腈含量为5%时,虽然腺苷和虫草素也得到了很好的分离,但是大大延长了样品的检测时间,同时响应值也大幅下降,影响待测物质的检出限。结合对样品的检测,最终选择乙腈和水比例为10:90http://ng1.17img.cn/bbsfiles/images/2014/10/201410311612_521158_1669358_3.jpg3.3标准曲线的测定 吸取适量体积上述混合标准溶液,用水稀释配成浓度为4.0、[/

2010年版药典(一部)中,对益母草中盐酸水苏碱的测定有如下描述(以丙基酰胺键合硅胶为填充剂):http://ng1.17img.cn/bbsfiles/images/2011/01/201101080907_272670_801_3.jpg那么为什么要用丙基酰胺柱来测盐酸水苏碱呢?丙基酰胺硅胶基质的柱子是什么柱子呢? 首先我们要了解盐酸水苏碱的特性,盐酸水苏碱的极性极大,普通的反相色谱对它的保留分离能力较弱,通常在死时间里流出而无法得到分离,而亲水作用色谱HILIC能为极强性的化合物提供良好的保留,在此类化合物上应用广泛。 目前已有多种商品化的HILIC色谱柱,多为硅胶基质,键合不同极性基团,如丙基酰胺基,酰胺基,聚琥珀亚酰胺等极性基团,氨基键合硅胶柱由于使用寿命较短,键合相容易流失,造成保留 丙基酰胺键合硅胶克服了传统正相色谱柱在水相条件下不稳定的缺点,其常使用流动相是和反相色谱相同的水相缓冲液( 40%)及有机溶剂,但是其梯度条件通常是初始为高比例有机相,逐步加大水相含量;极性丙基酰胺键合硅胶的HILIC色谱柱在反相条件下,可以有效的保留极性化合物,是一种崭新的极性化合物HPLC分离解决方式.博纳艾杰尔推出的Venusil HILIC (丙基酰胺键合硅胶),就是一样一款非常适合于益母草中盐酸水苏碱测定的柱子,测定方法及谱图如下:色谱柱:Venusil HILIC (丙基酰胺键合硅胶),4.6×250mm,5µm,100Å(订货号:VH952505-0)流动相:乙腈-0.2%冰醋酸(80:20)流速:0.5mL/min柱温:25℃进样体积:20μL检测器:ELSD蒸发光散射检测器http://ng1.17img.cn/bbsfiles/images/2010/11/201011291710_262707_801_3.jpg益母草供试品含量测定色谱图(主峰保留时间:22.697min)
如何用红外光谱区别乙基和异丙基
在农药残留检测中需要用到“PSA试剂:乙二胺-N-丙基硅烷”,请问:PSA试剂是什么,有什么作用,有很多种类吗?乙二胺-N-丙基硅烷的CAS号是什么?有哪些供应商?
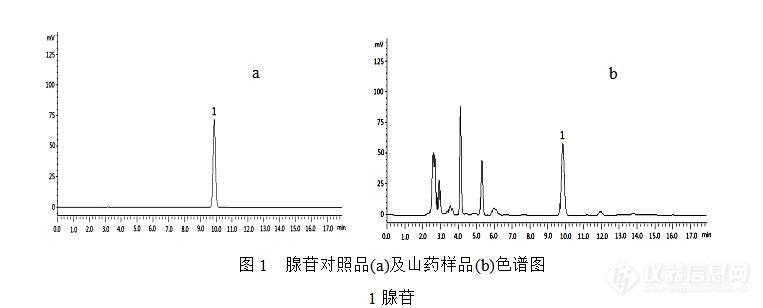
[align=center][b]HPLC测定不同来源山药中腺苷和脱氢表雄酮的含量[/b][/align] 山药(Dioscoreae Rhizoma)是薯蓣科植物薯蓣([i]Dioscorea opposita [/i]Thunb.)的干燥块茎,具有补脾养胃、生津益肺、补肾涩精的功能,是国家卫生部公布的药食两用的中药。然而在2015版《中国药典》一部中只收载了性状、鉴别、检查和浸出物等项目,缺少含量测定项指标,不足以对山药质量进行全面有效的控制。DHEA是人体肾上腺素的一种,国内外研究已经证实,DHEA对预防和治疗心血管疾病、增强免疫力、延缓衰老等均有一定效果,是山药中的重要活性成分之一。另外,腺苷具有舒张血管、降低血压、减慢心律、抑制血小板聚集、松弛血管平滑肌等生理活性。长期以来,由于对山药品种的评价和改良工作进展缓慢,目前仍然存在山药种植品种杂乱,缺乏综合性优良的品种。因此,本研究对包括野生山药在内的不同来源山药中的腺苷、DHEA含量进行测定,旨在为山药质量标准建立提供参考依据,也为山药品种驯化和选育提供一定的研究基础。[b][b]1 仪器和试药[/b][/b]LC-20AD高效液相色谱仪,配备紫外可见检测器(日本,岛津公司);ME204电子天平(德国Mettler Toledo公司),KQ-E型超声波清洗器(昆山市超声仪器有限公司)。脱氢表雄酮标准品(阿拉丁,批号为H1408213),腺苷标准品(中国食品药品检定研究院,批号为110879-200202);甲醇为色谱纯,水为娃哈哈纯净水,其他试剂均为分析纯。山药样品采自河南省温县山药种植基地。[b][b]2 方法与结果2.1标准储备溶液的制备[/b][/b]精密称取腺苷对照品6.61 mg置25 mL容量瓶中,加15 %甲醇溶解稀释至刻度,摇匀,配制成浓度为264.40 μgmL[sup]-[/sup][sup]1[/sup]的腺苷标准品储备溶液。精密称取DHEA对照品7.62 mg置50 mL容量瓶中,加甲醇溶解稀释至刻度,摇匀,配制成浓度为152.40 μgmL[sup]-[/sup][sup]1[/sup]的DHEA标准品储备溶液。[b][b]2.2样品的处理[/b][/b]2.2.1 腺苷样品的处理取本品粉末(过3号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入15%甲醇l0 mL,密塞,摇匀,称定质量,超声处理30 min,放冷,再称定质量,用15%甲醇补足减失的重量,12000 rmin[sup]-[/sup][sup]1[/sup]离心15 min,取上清液,0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液。2.2.2 DHEA样品的处理取本品粉末(过3号筛)约3.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇l5 mL,密塞,摇匀,称定质量,超声处理1 h,放冷,再称定质量,用甲醇补足减失的重量,摇匀,0.45μm微孔滤膜滤过,取续滤液作为供试品溶液。[b][b]2.3 色谱条件[/b][/b]2.3.1 腺苷色谱条件:色谱柱:Aglient Extend XDB C18柱(4.6 mm×250 mm,5 μm);流动相:磷酸盐缓冲液(pH6.5) -甲醇(94:6,[i]v/v[/i]);流速:1 mLmin[sup]-[/sup][sup]1[/sup];柱温:30 °C; 检测波长:260 nm;进样量:10 μL。HPLC图见图1。2.3.2 DHEA色谱条件:色谱柱:Welch Ultimate XB-C18柱(4.6 mm×250 mm,5 μm);流动相:甲醇-水(62:38,[i]v/v[/i]);流速:0.6 mLmin[sup]-[/sup][sup]1[/sup];柱温:30 °C; 检测波长:204 nm;进样量:10 μL。HPLC图见图2。[img=,690,278]https://ng1.17img.cn/bbsfiles/images/2019/07/201907031540228286_5423_3451954_3.jpg!w690x278.jpg[/img][img=,690,300]https://ng1.17img.cn/bbsfiles/images/2019/07/201907031540280876_3707_3451954_3.jpg!w690x300.jpg[/img][b][b]2.4标准曲线的绘制[/b][/b]精密吸取腺苷标准品储备溶液0.5,1,3,5,8,10 mL分别置于10 mL量瓶中,加甲醇定容至刻度,摇匀,按上述色谱条件进样,以峰面积值 Y为纵坐标,腺苷浓度X为横坐标绘制标准方程为:[i]Y[/i]=34197.2[i] X[/i]+25515.1,[i]r[/i]=0.9999,表明腺苷在13.22 ~ 264.40 μgmL[sup]-[/sup][sup]1[/sup]浓度内与峰面积线性关系良好。精密吸取DHEA标准品储备溶液1 mL置于10 mL量瓶中,加甲醇定容至刻度,摇匀,得15.24 μgmL[sup]-[/sup][sup]1[/sup]的DHEA使用溶液。分别精密吸取DHEA使用溶液0.5,1,3,5,8,10 mL置于10 mL量瓶中,加甲醇定容至刻度,摇匀,按上述色谱条件进样,以峰面积值 Y为纵坐标,DHEA浓度X为横坐标绘制标准方程为:[i]Y[/i]=13042.7 [i]X[/i]-1836.3,[i]r[/i]=0.9999,表明DHEA在0.76 ~ 15.24 μgmL[sup]-[/sup][sup]1[/sup]浓度内与峰面积线性关系良好。[b][b]2.5 重复性试验[/b][/b] 取同一供试品粉末6份,精密称定,按“2.2”项下方法处理,按“2.3”项下色谱条件测定峰面积。结果腺苷和DHEA峰面积的RSD分别为1.87 %和1.91 % (n=6),表明方法重复性良好。[b][b]2.6 精密度试验[/b][/b]精密吸取同一供试品溶液10 μL,按上述色谱条件连续进样6次,测定腺苷、DHEA峰面积值,其RSD分别为0.92 %和1.03 % (n=6),表明仪器及进样精密度良好。[b][b]2.7 稳定性试验[/b][/b] 精密吸取同一供试品溶液,室温放置,分别在0,2,4,8,12,24,48 h进样分析。测定腺苷、DHEA峰面积值,其RSD分别为2.07 %和1.65 % (n=6),表明供试品溶液在48 h内稳定性良好。[b][b]2.8 回收率[/b][/b]分别称取已知含量的样品6份,精密称定,分别加入相当含量的腺苷和DHEA对照品溶液,按“2.2”项下供试品溶液的制备方法制备供试品溶液,分别进行测定,计算回收率。结果腺苷、DHEA平均加样回收率为98.10 % (RSD=1.40 %)和97.72 % (RSD=1.15 %),结果见表1、2。[align=center][b]表1 山药样品中腺苷的加样回收率实验结果(n=6)[/b][/align][table][tr][td][align=center]取样量/g[/align][/td][td][align=center]样品中量/mg[/align][/td][td][align=center]添加量/mg[/align][/td][td][align=center]测得量/mg[/align][/td][td][align=center]回收率/%[/align][/td][td][align=center]平均回收率/%[/align][/td][td][align=center]RSD/%[/align][/td][/tr][tr][td][align=center]0.5014[/align][/td][td][align=center]0.1604 [/align][/td][td][align=center]0.1586[/align][/td][td][align=center]0.3141[/align][/td][td][align=center]96.88 [/align][/td][td=1,6][align=center]98.10[/align][/td][td=1,6][align=center]1.40[/align][/td][/tr][tr][td][align=center]0.5011[/align][/td][td][align=center]0.1604 [/align][/td][td][align=center]0.1586[/align][/td][td][align=center]0.3201[/align][/td][td][align=center]100.72 [/align][/td][/tr][tr][td][align=center]0.4989[/align][/td][td][align=center]0.1596 [/align][/td][td][align=center]0.1586[/align][/td][td][align=center]0.3147[/align][/td][td][align=center]97.76 [/align][/td][/tr][tr][td][align=center]0.4997[/align][/td][td][align=center]0.1599 [/align][/td][td][align=center]0.1586[/align][/td][td][align=center]0.3141[/align][/td][td][align=center]97.22 [/align][/td][/tr][tr][td][align=center]0.5001[/align][/td][td][align=center]0.1600 [/align][/td][td][align=center]0.1586[/align][/td][td][align=center]0.3159[/align][/td][td][align=center]98.28 [/align][/td][/tr][tr][td][align=center]0.5012[/align][/td][td][align=center]0.1604 [/align][/td][td][align=center]0.1586[/align][/td][td][align=center]0.3154[/align][/td][td][align=center]97.74 [/align][/td][/tr][/table][align=center][b]表2 山药样品中DHEA的加样回收率实验结果(n=6)[/b][/align][table][tr][td][align=center]取样量/g[/align][/td][td][align=center]样品中量/mg[/align][/td][td][align=center]添加量/mg[/align][/td][td][align=center]测得量/mg[/align][/td][td][align=center]回收率/%[/align][/td][td][align=center]平均回收率/%[/align][/td][td][align=center]RSD/%[/align][/td][/tr][tr][td][align=center]1.5013[/align][/td][td][align=center]0.0293 [/align][/td][td][align=center]0.0305[/align][/td][td][align=center]0.0589[/align][/td][td][align=center]97.13 [/align][/td][td=1,6][align=center]97.72 [/align][/td][td=1,6][align=center]1.15 [/align][/td][/tr][tr][td][align=center]1.5024[/align][/td][td][align=center]0.0293 [/align][/td][td][align=center]0.0305[/align][/td][td][align=center]0.0591[/align][/td][td][align=center]97.72 [/align][/td][/tr][tr][td][align=center]1.4997[/align][/td][td][align=center]0.0292 [/align][/td][td][align=center]0.0305[/align][/td][td][align=center]0.0597[/align][/td][td][align=center]99.86 [/align][/td][/tr][tr][td][align=center]1.5001[/align][/td][td][align=center]0.0293 [/align][/td][td][align=center]0.0305[/align][/td][td][align=center]0.0589[/align][/td][td][align=center]97.21 [/align][/td][/tr][tr][td][align=center]1.4987[/align][/td][td][align=center]0.0292 [/align][/td][td][align=center]0.0305[/align][/td][td][align=center]0.0587[/align][/td][td][align=center]96.64 [/align][/td][/tr][tr][td][align=center]1.5011[/align][/td][td][align=center]0.0293 [/align][/td][td][align=center]0.0305[/align][/td][td][align=center]0.0591[/align][/td][td][align=center]97.80 [/align][/td][/tr][/table][b][b]2.9 结果分析[/b][/b]精密称取不同来源的山药粉末,按“2.2”项下方法制备供试品溶液,分别进样,记录峰面积积分值,外标法计算腺苷及DHEA的含量。结果如下表3所示。[align=center][b]表3 不同来源山药药材中腺苷及DHEA的含量([i]n[/i]=3)[/b][/align][table][tr][td][align=center]编号[/align][/td][td][align=center]样品来源[/align][/td][td][align=center]腺苷含量/%[/align][/td][td][align=center]DHEA含量/mg/kg[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]种植铁棍山药[/align][/td][td][align=center]0.032[/align][/td][td][align=center]19.50 [/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]野生山药1[/align][/td][td][align=center]0.027[/align][/td][td][align=center]5.38 [/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]野生山药2[/align][/td][td][align=center]0.024[/align][/td][td][align=center]3.29[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]驯化野生山药雌株[/align][/td][td][align=center]0.037[/align][/td][td][align=center]24.05 [/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]驯化野生山药雄株[/align][/td][td][align=center]0.040[/align][/td][td][align=center]62.25 [/align][/td][/tr][tr][td][align=center]6[/align][/td][td][align=center]紫山药[/align][/td][td][align=center]ND[/align][/td][td][align=center]ND[/align][/td][/tr][/table] 从测定结果看,不同来源山药中腺苷和DHEA含量差别较大,可能由于品种及生长环境的差异造成。研究表明,驯化野生山药雄株中腺苷和DHEA含量最高,显著高于野生山药中的含量,说明驯化过程对野生山药的改良起到了很好的积极作用。另外,驯化野生山药雄株中DHEA含量比公认的营养成分较高的铁棍山药高出3倍左右,进一步说明该山药品质的优异性。 另外,紫山药中并未检测到腺苷和DHEA两种成分的存在,这可能由于紫山药自身品种差异有关。[b][b]3 小结和讨论[/b][/b]3.1 DHEA提取条件优化 在DHEA测定前处理时,本实验曾根据李军等人的优化方法,采用甲醇-丙酮(6:4)超声提取、水浴蒸干、二氯甲烷多次萃取等主要工序对山药中DHEA进行提取,该方法提取效果较好,DHEA可以被较好的富集和检测。但是由于提取过程复杂,实验重复性和加样回收率较难控制。本实验采用甲醇、乙醇、甲醇-丙酮(1:1,[i]v/v[/i])等溶剂对山药样品进行超声1h提取,结果发现,四种溶剂提取效果没有明显差异,因此选用甲醇做为最终提取溶剂。 本实验采用的方法大大简化了山药中DHEA的提取过程,减少了有毒试剂的使用,缩短了提取时间,且提取率与李军的方法相比没有显著的差异。3.2 小结 本研究对山药中腺苷和DHEA成分的提取和测定条件进行优化,为山药质量标准建立和质量评价提供参考依据。另外,研究对包括野生、种植、驯化品种等不同来源山药中腺苷和DHEA指标含量进行测定,为山药品种的选育和驯化提供一定的研究基础。
急需N''N-二异丙基乙基胺分析方法?谢谢!
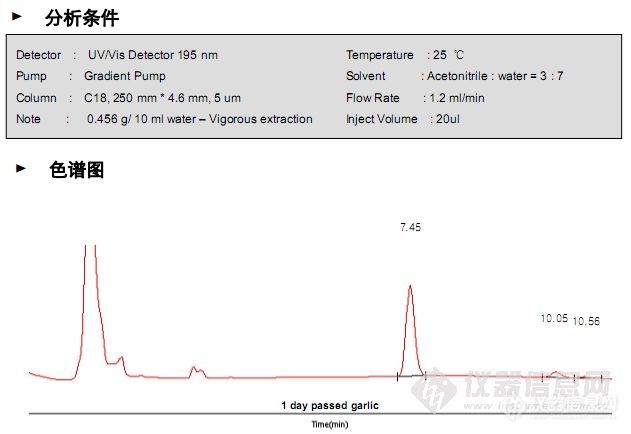
[size=3][font=宋体]大蒜中有两种酶(蒜苷和蒜碱)。蒜苷接触空气时,它会使蒜碱转化[/font][font=宋体]成[/font][font=宋体]二烯丙基二[/font][font=宋体][/font][/size][size=3][font=宋体]硫(蒜素)。就算蒜苷加热至失活,蒜碱仍然会残留在大蒜内,残留在空气中的蒜素会蒸发。[/font][font=宋体]大蒜中的二烯丙基二硫的分析条件如下,需要色谱图,可以下载哦![/font][/size][font=Arial][size=3] Detector : UV/Vis Detector 195 nm[/size][/font][font=Arial][size=3]Pump : Gradient Pump[/size][/font][font=Arial][size=3]Column : C18, 250 mm * 4.6 mm, 5 um[/size][/font][size=3][font=Arial]Note : 0.456 g/ 10 ml water – Vigorous extractionTemperature : 25 [/font][font=宋体]℃[/font][font=Arial][/font][/size][font=Arial][size=3]Solvent : Acetonitrile : water = 3 : 7[/size][/font][font=Arial][size=3]Flow Rate : 1.2 ml/min[/size][/font][font=Arial][size=3]Inject Volume : 20ul[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004151753_212536_1638724_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004151753_212537_1638724_3.jpg[/img][/size][/font]
在操作的过程中,发现产品的腺苷含量不稳定,同一个样品一次进样与隔天进样峰面积相差很大。(图谱附件中)提取的方法 :精密称取蛹虫草子实体1.0g于25ml容量瓶中,加水20ml超声提取90分钟,定容,离心(3000转/ 3分钟)取上清液,过滤,上机。流动相 甲醇:0.01mol/L磷酸二氢钾=10.4:89.6 波长 254
请教,羟丙基取代度测定时硫酸的加入量以及样品在处理过程中如何选择加热的时间?
3-氨丙基三乙氧基硅烷,分析纯就可以了,谢谢。