各位大侠好,有谁能提供苄基三甲基氯化铵分析方法吗?
请问 哪位老师做过草甘膦和氨甲基膦酸[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LCMS[/color][/url]MS检测,求前处理和仪器检测方法?
联苯苄基氯(学名;4,4’-双氯甲基联苯)溶解方法?用ICP-AES测定其中的Ca,Fe,Zn,P,Na等元素(1--5ppm)。请高手指点样品处理方法为盼。谢谢啊http://simg.instrument.com.cn/bbs/images/brow/emyc1010.gif
求助各位版友,如何用HPLC分析吗啉、甲基吗啉和nmmo?根据吗啉结构应该紫外吸收很弱吧,用紫外检测器能做么?谢谢
各位大虾,芳香族胺类化合物(苯胺、N-甲基本胺,N,N-二甲基苯胺,苄基氰)能用HP-innowax做吗?新手求助,万分感谢啊
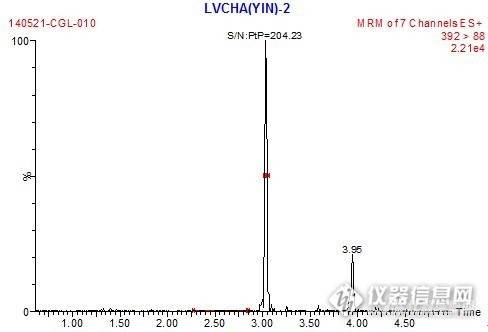
【生活中的仪器分析】样 品:蔬菜、水果、茶叶、茶粉等食品检测项目:草甘膦、草铵膦、氨甲基膦酸参考标准:SN/T 1923-2007检测仪器:a.WATERS液相色谱串联质谱仪:配有电喷雾(ESI)离子源(可用其他品牌作用等效的高效液相色谱质谱仪替代)b.Biotagevacmaster固相萃取仪c.IPRE Qclean PMG草甘膦专用固相萃取柱d.BiotageTurbovap LV 快速浓缩仪e.IKA MS3 涡旋混匀器g.TOMY-MX307离心机g.昆山超声波清洗器实验过程:1.提取及预处理称取2-5g(精确到0.001g)试样于50 mL聚丙烯离心管中,加入100μL内标液,加入20.0 mL水超声提取30min,于10000 r/min离心5min,取1.0 mL上清液于2mL子弹头离心管中,加入100μL酸度调节剂(注A),涡旋混匀,15000r/min离心5 min,待净化。注A:酸度调节剂配制方法:纯水+色谱纯甲醇+盐酸=160+40+13.4(V/V/V)2.固相萃取净化І将PMG-І柱(蓝柱)用2mL甲醇和2 mL 0.5%甲酸淋洗活化并自然滴干,将加入酸度调节剂处理的提取液(2)转移到小柱上,用5mL刻度试管收集流出液(1-2滴/秒),用1.0mL 0.5%甲酸洗柱并真空抽干,合并流出液,用移液枪吸取50%NaOH调pH7-9(用1-14pH试纸,根据样品不同约20-50μL),加水定容到3 mL刻度,混匀,待衍生。3.衍生步骤准确吸取600 μL净化液(3)于2mL子弹头离心管中,加入200 μL 5%硼砂溶液,边涡旋,边加入200 μL 25g/L FMOC-Cl乙腈溶液(注B),放置10min,加入50 μL甲酸,涡旋混匀,15000 r/min离心5min,吸取上清液准备过PMG-ІІ柱。注B:25 g/L FMOC-Cl乙腈溶液配制方法:称取0.25 gFMOC-Cl,溶解于10 mL色谱纯乙腈中。4.固相萃取净化ІІ 将PMG-ІІ柱(红柱)用2 mL甲醇和2 mL 0.5%甲酸淋洗并自然滴干,将上清液过PMG-ІІ柱,用3 mL水淋洗小柱,真空抽干5-10 min,再加入2 mL正己烷淋洗小柱,滴干后真空抽干5 min,最后用5 mL 5%氨水/甲醇洗脱小柱(1-2 mL/min)并用5 mL刻度试管收集流出液,45℃,氮气吹至近干,用20%乙腈定容1.0 mL,涡旋混匀,过0.2 μm PTFE膜后上机测试。5.测定5.1色谱条件a.色谱柱:Waters BEH-C18,1.7 μm,2.1 mm×100 mm;b.流动相:5mmol/L乙酸铵:乙腈梯度洗脱,梯度表见表1; 表1 流动相及梯度 时间(min)流速(mL/min)5mmol/L乙酸铵(%)乙腈(%)00.3901020.362384.40.362384.50.35956.50.35956.60.390109.00.39010c.检测器:串联四极杆质谱仪;d.柱温:35℃;e.进样量:10 μL。5.2质谱分析条件a)电离源:电喷雾正离子模式;b)毛细管电压:3.50KV;c)源温度:120℃;d)脱溶剂气温度:400℃;e)脱溶剂气流量:700L/h;f)碰撞室压力:2.7í10-3mbar;g)特征离子及参数见表2。 表 2 草甘膦和氨甲基膦酸的主要特征离子 化合物保留时间(min)母离子+(m/z)锥孔电压(V)子离子(m/z)碰撞能量(eV)草甘膦1.32392.215*88.02515214.01
GB/T29666-2013化妆品用防腐剂 甲基氯异噻唑啉酮和甲基异噻唑啉酮与氯化镁及硝酸镁的混合物
请问 有人做过N甲基吗啉的残留检测吗
流动相(甲醇:乙腈:磷酸盐)15:15:70谱图如下,如何让甲基氯异噻唑啉酮和甲基噻唑啉酮分得更开呢?[img]https://ng1.17img.cn/bbsfiles/images/2019/02/201902222125434158_9706_3489633_3.png[/img]
有誰可提供DMAC(二甲基乙酰氨)之 dew point, 非常感謝!
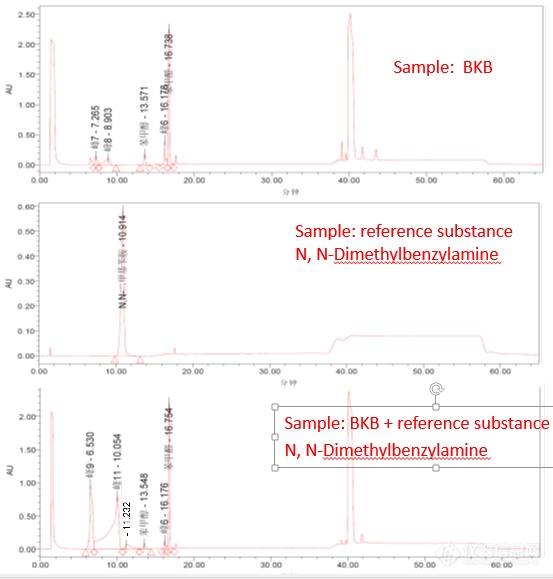
[color=#444444]最近在测苯扎溴胺(BKB)中苄基二甲基胺的残留,在测试条件下标样苄基二甲胺能够正常出峰,而进BKB样品时,苄基二甲基胺却不出峰,在BKB样品中加入苄基二甲基胺标样,却出现了两个奇怪的峰见色谱图,不知这是什么情况?[/color][color=#444444]色 谱 柱:端基封闭的C18(150×4.6mm,5μm)。[/color][color=#444444]柱 温:30℃[/color][color=#444444]流动相A:磷酸盐缓冲液(取己烷磺酸钠1.09g、磷酸二氢钠6.9g,溶于适量水中,用磷酸调节pH至3.5,用水稀释至1000ml,摇匀,即得。[/color][color=#444444]流动相B:甲醇[/color][color=#444444]时间(分) 流动相 A(V/V) 流动相 B(V/V)[/color][color=#444444]0-10 80 20[/color][color=#444444]10-14 80-50 20-50[/color][color=#444444]14-35 50 50[/color][color=#444444]35-36 50-20 50-80[/color][color=#444444]36-55 20 80[/color][color=#444444]流 量:1.0ml/min[/color][color=#444444]检 测 器:二极管阵列检测器(DAD)[/color][color=#444444][img=,553,579]https://ng1.17img.cn/bbsfiles/images/2019/06/201906031402122584_6731_1823055_3.png!w553x579.jpg[/img][/color]
求助给位,我想问一下四丁基溴化铵、十六烷基三甲基溴化铵、苄基三甲基溴化铵怎么做红外,它们都很容易潮解的,吸水性很强,我问一下,做红外的时候样品怎么处理,或者这些物质的标准红外数据在哪可以查到啊
请问DMBC Acetate乙酸二甲基苄基原醇酯的质谱图是怎样的?CAS000151-05-3
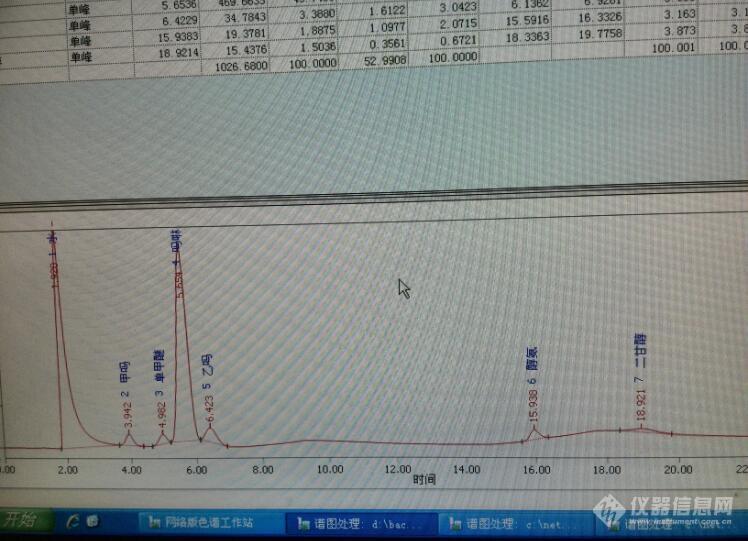
大家好,有人做过化工厂粗吗啉和精吗啉含量检测吗,粗吗啉是用二乙醇胺和二甘醇合成的,故会含这两种高沸点原料,精吗啉是粗吗啉经过精馏得到的,不含原料。现在需测量精吗啉中五个组分,从左至右依次是氨,水,甲基吗啉,单甲醚,吗啉;粗吗啉测水,甲基吗啉,单甲醚,吗啉,乙基吗啉。第一张谱图是粗吗啉,第二张是精吗啉。这是用PEG-20M+KOH+石墨化炭黑的填充柱做的,检测器是TCD,但是由于粗吗啉含有高沸物,约230多度,而且含水量大,还有氨,导致合格的柱子很难做,经常不能用,而且就算能用了,一个月就坏了,粗吗啉缺乙基吗啉峰,精吗啉缺甲基吗啉峰。请大家帮忙分析下,提供更完美的解决方案[img=,690,499]https://ng1.17img.cn/bbsfiles/images/2019/08/201908271108076863_1311_1777483_3.jpg!w690x499.jpg[/img][img=,690,479]https://ng1.17img.cn/bbsfiles/images/2019/08/201908271108129216_3978_1777483_3.jpg!w690x479.jpg[/img]
苯扎氯胺,化学名称十二烷基二甲基苄基氯化铵,是一种表面活性剂,助剂中的苯扎氯胺怎么检测?哪些检测机构可以检测?
求助求助:关于吗啉及甲基吗啉的液相紫外检测方法,各位大侠帮帮忙啊
邻(间、对)甲基苯胺是禁用偶氮中常检出的物质,用液相色谱法可以区分,但是用气相很少,迪马有分邻(间、对)甲基苯胺的的气相方法吗?

“超高效液相色谱-串联质谱法测定大豆中草甘膦及其代谢物氨甲基膦酸的残留”是本人去年开展大豆中草甘膦检测项目整个试验过程的总结,欢迎各位老师和同行批评指正,该文章还未在任何刊物上发表。[align=center][b]超高效液相色谱-串联质谱法测定大豆中草甘膦及其代谢物氨甲基膦酸的残留[/b][/align][align=center][/align][align=center]户江涛[/align][align=center](黑龙江省农垦科学院测试化验中心,黑龙江 佳木斯 154007 )[/align]摘要:采用超高效液相色谱-串联质谱法建立了快速检测大豆中草甘膦和氨甲基膦酸残留量的分析方法。试样经水超声提取,二氯甲烷去除脂肪,C[sub]18[/sub]固相萃取柱净化后,在硼酸钠缓冲溶液中与9-芴甲氧羰酰氯(FMOC-Cl)进行衍生反应,其衍生产物在C[sub]18[/sub]色谱柱上以 2 mmol/L 乙酸铵溶液和乙腈为流动相,进行液相色谱分离:质谱检测采用电喷雾正离子化模式和多反应监测模式(MRM)。结果表明,草甘膦和氨甲基膦酸在0.001~0.5 mg/L范围内线性关系良好,相关系数(R)分别为0.9996和0.9993,定量限(LOQ)均为0.01mg/kg。在空白大豆样品添加浓度为0.02、0.2、2 mg/kg 时,草甘膦和氨甲基膦酸的平均回收率分别为80.2%~91.5%和77.7%~89.3%,相对标准偏差(RSD)分别为3.37%~6.96%和4.11%~8.27%(n=6)。本方法快速、简便、灵敏,适用于大豆中草甘膦和氨甲基膦酸残留的同时检测。关键词:超高效液相色谱-串联质谱;大豆;草甘膦;氨甲基膦酸;衍生反应[align=center]Determination of glyphosate and its metabolite aminomethyl-phosphonic acid residues in soybean by ultra performance liquid chromatography-tandem mass spectrometry[/align][align=center]HU Jiangtao[/align][align=center]([i]Testing and Analysis Center of Heilongjiang Academy of Land Reclamation Sciences, Jiamusi 154007,China[/i])[/align][b]Abstract:[/b]A method[b] [/b]was developed for the determination of glyphosate(PMG) and aminomethyl-phosphonic acid(APMA) residues in soybean by ultra performance liquid chromatography-tandem mass spectrometry(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS). After extracted with water under ultrasonication, the sample was defatted with dichloromethane and purified by C[sub]18 [/sub]solid phase extraction cartridge, and then PMG and APMA were derivatized using 9-fluorenylmethoxycarbonyl(FMOC-Cl) in borate buffer for 2 h.The derivatives of PMG and APMA were separated on a Waters BEH C[sub]18[/sub] column with gradient elution with the mobile phase of 2 mmol/L ammonium acetate and acetonitrile, and finally detected by positive eletrospray ionization-mass spectrometry(ESI[sup]+[/sup]-MS/MS) in multiple reaction monitoring(MRM) mode.The results showed the linearities of PMG and APMA were good in the concentration range of 0.001~0.5 mg/L ,and the correlation coefficients were 0.9996 and 0.9993 respectively. The limit of quantification(LOQ) of PMG and APMA was both 0.01mg/kg. At the spiked levels of 0.02、0.2、2 mg/kg in the blank soybean samples, the mean recoveries of PMG and APMA were 80.2%~91.5% and 77.7%~89.3% respectively, and the relative standard deviation(RSD) of PMG and APMA were 3.37%~6.96% and 4.11%~8.27% res-pectively(n=6).This method is fast,simple,sensitive, and suitable for simultaneous determination of PMG and APMA in soybean.[b]Key words: [/b]ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) soybean glyphosate(PMG) aminomethyl-phosphonic acid(APMA) derivatization草甘膦(Glyphosate,PMG)又名镇草宁、农达,分子式为C[sub]3[/sub]H[sub]8[/sub]NO[sub]5[/sub]P,是1971年美国孟山都公司研发的一种有机磷除草剂,因其兼具内吸、传导性、灭生性及非选择性,同时不易在生物体内累积,故广泛应用于农业生产中一年生和多年生杂草防除,是目前世界上应用最广、生产量最大的除草剂[sup][/sup]。草甘膦及其在植物中的主要代谢物氨甲基膦酸(Aminomethyl-phosphonic acid,APMA,分子式为CH[sub]6[/sub]NO[sub]3[/sub]P)均属于强极性、易溶于水的高沸点化合物,具有不易挥发、无紫外吸收等特性,因此用常规方法分析检测十分困难[sup][/sup]。 目前, PMG和APMA残留检测的方法主要有色谱法(GC[sup][/sup]、LC[sup][/sup]、IC[sup][/sup])、质谱法(GC/MS[sup][/sup]、ICP/MS[sup][/sup]、LC/MS/MS[sup][/sup])、光谱法[sup] [/sup]等。光谱法虽然操作简便,但其灵敏度不高,而[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法[sup][/sup]只能适用于水样等简单基质,用于植物源样品检测时干扰太大;用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]和[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用[/color][/url]技术检测时,需要将PMG和APMA衍生转化为可气化物质,其引入试剂多、过程相对繁琐,效率较低[sup][/sup];用LC/MS/MS法直接检测时[sup][/sup],由于PMG和APMA分子量(分别为169、111)均较小,其主要碎片离子的质荷比多在100以下,检测实际样品时受基质干扰严重,灵敏度较低,因此柱前衍生——[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]法成为近年来国内外检测PMG和APMA残留的主流方法[sup][/sup]。以9-芴甲氧羰酰氯(FMOC-Cl)做为衍生试剂,在硼酸盐缓冲溶液中与PMG和APMA水提取液相容性好,过程简单,其衍生产物在LC/MS/MS中响应信号高,碎片离子干扰小,适合定性定量分析。 目前,采用柱前衍生——LC/MS/MS法检测茶叶、稻米等基质中PMG和APMA残留的报道很多[sup][/sup],专门针对大豆基质的报道很少。行业标准[sup][/sup]的适用范围虽然包括了大豆基质,但该方法在实验过程中试剂用量大、操作繁琐(反复调pH值)、衍生时间长(需过夜),尤其是使用阳离子交换柱(CAX)洗脱时需要加入11 mL 1%的盐酸甲醇水(20/80,v/v),水分含量过高导致旋转蒸发时很难蒸干,容易造成PMG和APMA回收率不稳定。本文专门针对大豆这类高蛋白、高脂肪含量的特殊基质,采用纯水作为提取试剂,二氯甲烷去除脂溶性杂质,C[sub]18[/sub]固相萃取小柱净化后采用FMOC-Cl衍生,最后用UPLC/MS/MS测定。该方法前处理过程简便、快速、灵敏度高,适用于大豆中PMG和APMA的残留检测。[b]1 实验部分[/b]1.1 材料与试剂 草甘膦、氨甲基膦酸(纯度≥99%,德国Dr.Ehrensorfer公司);FMOC-Cl(纯度99%,Sigma公司),使用时配置成10g/L的丙酮溶液;乙腈、二氯甲烷、甲酸、乙酸铵(色谱纯,美国Fisher公司);十水四硼酸钠(优级纯,天津市科密欧化学试剂有限公司),使用时配置成50g/L的水溶液;实验用水为Millipore纯水仪制备;C[sub]18[/sub]固相萃取小柱(200mg/3ml,美国Agilent公司)。1.2 仪器与设备 Acquity UPLC型超高效液相色谱仪(Waters公司);XEVO TQ-S三重四级杆质谱仪(Waters公司);CR21GⅢ型高速离心机(HITACHI公司);KQ5200DB型台式超声波仪(昆山市超声仪器有限公司);涡旋混合器(IKA公司)。1.3 标准溶液的配置 分别称取草甘膦和氨甲基膦酸标准品10mg(精确到0.1mg),用水溶解并定容至10mL,配置成质量浓度为1.0 mg/mL标准储备液,于4℃冰箱保存待用;使用时用水逐级稀释成所需浓度的混合标准工作液。1.4 样品前处理 提取:称取粉碎均匀后的试样1.0g(精确到0.01g)于50mL聚乙烯离心管中,加入10.0mL超纯水,涡旋混合30 s并超声提取20 min后,以10000 r/min离心3 min,将上清液转移至另一离心管中,加入5 mL二氯甲烷涡旋混合30 s,以10000 r/min离心3 min,上清液待净化。 净化:取2.5 mL上清液加入到C[sub]18[/sub]固相萃取柱(使用前依次用3mL甲醇和3mL超纯水活化)中,弃去最初的几滴流出液(约0.5 mL),将剩余部分用5 mL玻璃管收集,待衍生。 衍生:取1.0 mL净化液于5 mL离心管中,依次加入1.0 mL 50g/L的硼酸钠溶液和 1.0 mL 10g/L的FMOC-Cl衍生液,混匀后室温下衍生2 h,以10000 r/min离心3 min,取上清液过0.22 mm有机系微孔滤膜后,供UPLC/MS/MS分析测定。1.5 液相色谱及质谱条件 液相色谱:色谱柱:Waters BEH C[sub]18[/sub](1.7 μm,50mm×2.1mm);柱温:30℃;流速:0.5 mL/min;进样量:2 μL;流动相A:乙腈;流动相B: 2 mmol /L 的乙酸铵水溶液。梯度洗脱程序:0~0.5min,10% A;0.5~3. 0 min,10%~100% A;3. 0 ~4. 0 min,100%A,4 ~4.1min,100% A~10% A,4.1 ~5.0min 10% A。 质谱:离子源:电喷雾离子源( ESI [sup]+[/sup] ) ;扫描方式:正离子扫描;检测方式:多反应监测( MRM);毛细管电压:3.2 kv;离子源温度:150℃;去溶剂气温度:500℃;去溶剂气流量:1000 L /h;定性、定量离子对及碰撞能量见表1。[align=center]表1 PMG-FMOC和 AMPA-FMOC的MRM质谱参数[/align][align=center]Table 1 MRM parameters of PMG-FMOC and AMPA-FMOC[/align][table][tr][td][align=center]Analyte[/align][/td][td][align=center]Cone/V[/align][/td][td][align=center]Parent ion/(m/z)[/align][/td][td][align=center]Daughter ion/(m/z) [/align][/td][td][align=center]Collision energy/V[/align][/td][/tr][tr][td][align=center]PMG-FMOC[/align][align=center] [/align][align=center]AMPA-FMOC[/align][/td][td][align=center]30[/align][align=center] [/align][align=center]30[/align][/td][td][align=center]392[/align][align=center][sup] [/sup][/align][align=center]334[/align][align=center][sup] [/sup][/align][/td][td][align=center]88[/align][align=center]214﹡[/align][align=center]112﹡[/align][align=center]179[/align][/td][td][align=center]14[/align][align=center]8[/align][align=center]11[/align][align=center]20[/align][/td][/tr][/table]﹡quantitative ion[b]2 结果与讨论[/b]2.1 色谱及质谱条件的优化 流动相的选择:对比了酸性体系(0.1%甲酸水溶液)与非酸性体系(乙酸铵水溶液)分别于甲醇、乙腈的流动相体系组合,结果发现两种分析物在酸性体系中分离效果欠佳,峰形拖尾严重,而在非酸性体系中其色谱分离效果得到明显改善,峰形对称;乙腈比甲醇体系洗脱能力更强,可以有效缩短分析时间。故本研究采用乙酸铵水溶液+乙腈流动相体系,并比较了1、2、5 mmol/L三种乙酸铵浓度与乙腈的组合,结果发现随着乙酸铵浓度的增加,目标物响应值虽略有提高但相差不大,而同时仪器背景值却显著升高,综合考虑目标物信号强度、信噪比、色谱分离效果以及分析时间等因素,本实验最终选择了2 mmol /L 乙酸铵水溶液+乙腈分析体系。质谱的选择:PMG、 AMPA对应的衍生物PMG-FMOC、AMPA-FMOC分子量分别为391、333。用超纯水配置10 mg/L 混合标准溶液直接注射到质谱中,在正负离子模式下分别进行母离子全扫描,发现正离子模式下392、334具有很好的响应,然后分别以392、334为母离子进行子离子全扫描,各得到两组丰度高、干扰小的子离子对进行MRM监测,最终确定的质谱条件见表1。2.2 前处理条件的优化 提取溶液的选择:PMG和APMA属于强极性物质,易溶于水,难溶于有机溶剂,故一般采用极性溶剂提取,如纯水及KOH、NaHCO[sub]3[/sub]溶液等[sup][/sup]。实验发现,用碱性溶液提取后,大豆中脂肪、蛋白等物质会与碱性物质发生反应,导致离心后的提取液异常浑浊,不利于后期净化和衍生,因此本实验采用纯水作为提取试剂,再经二氯甲烷液液萃取去除脂溶性杂质。 净化柱的选择:研究发现,对提取后的溶液不经SPE净化直接进行衍生, PMG和APMA的回收率均不足30%,且精密度很差,这可能是由于大豆中富含脂肪、蛋白质等物质干扰衍生过程,故本实验比较了对脂肪、蛋白质有很好去除效果的C[sub]18[/sub]、中性Al[sub]2[/sub]O[sub]3[/sub]、HLB固相萃取SPE柱的净化效果,结果发现提取液经中性Al[sub]2[/sub]O[sub]3[/sub]净化后,PMG和APMA几乎检测不到;而C[sub]18[/sub]净化后目标物回收率为92.7%、90.8%,HLB为83.6%、80.5%。故本实验选取了净化效果更好,成本相对低廉的C[sub]18[/sub]固相萃取小柱。 衍生条件的优化:FMOC-Cl的衍生机制是在碱性环境下(pH=9.0)通过FMOC-Cl基团取代目标化合物氮原子上的氢,从而生成较稳定的化合物FMOC-Cl。参照行业标准[sup][/sup]及文献报道[sup][/sup]所选用的缓冲液浓度,本实验采用50g/L的硼酸钠水溶液缓冲液体系,设置的衍生试剂质量浓度为1、2、5、10、20 g/L FMOC-Cl丙酮溶液,按照本文1.4步骤对PMG和APMA质量浓度为0.5 mg/L的纯水溶液和大豆空白基质溶液分别进行衍生,结果见图1。结果表明,在纯水溶液中,FMOC-Cl浓度为2 g/L时,PMG和APMA的峰面积已达到最大,随着衍生化试剂浓度的升高,其峰面积无明显变化;而在大豆空白基质溶液中,FMOC-Cl低浓度(1、2g/L)时,PMG和APMA几乎检测不到,其峰面积随衍生化试剂浓度增加而加大,浓度到达一定程度(10 g/L)时,峰面积不再变化。产生这种现象的原因,可能是由于尽管大豆提取液经过了二氯甲烷和C[sub]18[/sub]小柱的净化,但还是会有少量水溶性蛋白、脂肪等杂质残留在净化液中,这些杂质可能会与衍生试剂反应,影响目标物的衍生效果。研究还发现,当FMOC-Cl浓度为20 g/L时,得到的PMG和APMA色谱峰产生拖尾现象,可能是由于衍生试剂化学性质较活泼,其用量大时,过量的FMOC-Cl会迅速转化成FMOC-OH,干扰目标物峰形。在50g/L硼酸钠水溶液、10 g/L FMOC-Cl丙酮溶液条件下,考察不同时间(0.5h、1h、2h、4h、8h和16h)对衍生效果的影响,结果发现,2 h后PMG和APMA的测定值无明显增加。因此,本实验最终选定的衍生条件为50g/L硼酸钠水溶液、10 g/L FMOC-Cl丙酮溶液,室温下衍生2 h。[img=,596,378]http://ng1.17img.cn/bbsfiles/images/2017/07/201707020904_01_2984502_3.png[/img][img=,690,530]http://ng1.17img.cn/bbsfiles/images/2017/07/201707020904_02_2984502_3.png[/img]2.3 基质效应的考察 基质效应(主要是抑制)是LC/MS/MS仪器检测时经常遇到的现象。由于本实验采用极性很强的水作为提取剂,大豆中的色素、脂肪酸等极性较强的物质也有少部分进入到最后的上机液中,在离子化带电过程中会与目标物产生竞争,抑制目标物的离子化效率。实验考察了用PMG和APMA的纯水标样去标定经过本文1.4步骤处理后的大豆空白基质溶液配置的同浓度标样,其色谱图见图2。结果发现,PMG在纯水和大豆空白基质中峰面积基本一致,而APMA在大豆空白基质中的峰面积仅为纯水中的55.7%,产生了明显的基质抑制效应。为了消除基质干扰,本实验选用大豆样品空白基质配置不同浓度的标准溶液来绘制标准曲线进行校准。2.4 线性范围和定量限 用大豆空白基质溶液分别配置0.001、0.005、0.01、0.05、0.1、0.2、0.5 mg/L的PMG和APMA混合标准溶液,按本文1.4步骤衍生后测定,以各自定量离子的峰面积为Y对应质量浓度X(mg/L)做标准曲线,得到的线性方程和相关系数见表2。结果表明,这两种物质在0.001~0.5 mg/L浓度范围内线性良好,相关系数R分别为0.9996和0.9993。以10倍信噪比(S/N)计算,该方法PMG和APMA的定量限(LOQ)均为0.01 mg/kg。[align=center]表2 PMG和APMA大豆基质标准溶液的线性方程、相关系数和定量限(LOQ)[/align][align=center]Table 2 Linear equations,correlation and LOQ of PMG and APMA in the soybean matrix standard solutions[/align][table][tr][td][align=center]Analyte[/align][/td][td][align=center]Linear range/(mg/L)[/align][/td][td][align=center]Linear equation[/align][/td][td][align=center]R[/align][/td][td][align=center]LOQ/(mg/ kg )[/align][/td][/tr][tr][td][align=center]PMG[/align][align=center]AMPA[/align][/td][td][align=center][sup]0.001~0.5[/sup][/align][align=center][sup]0.001~0.5[/sup][/align][/td][td][align=center]Y=889809x+1671.3[/align][align=center]Y=476982x+1161.9[/align][/td][td][align=center]0.9996[/align][align=center]0.9993[/align][/td][td][align=center]0.01[/align][align=center]0.01[/align][/td][/tr][/table]2.5 回收率和精密度 称取大豆空白试样1.0 g,分别添加0.02、0.2、2 mg/kg水平的PMG和APMA混合标样,每个水平重复6次,按照本文1.4步骤前处理方法处理后上机检测,实验结果见表3。从表3可以看出,PMG的平均回收率为80.2%~91.5%,相对标准偏差(RSD,n=6)为3.37%~6.96%;APMA的平均回收率和RSD分别为77.7%~89.3%和4.11%~8.27%。[align=center]表3 大豆中PMG和APMA的加标回收率和相对标准偏差(n=6)[/align][align=center]Table 3 Recoveries and relative standard deviations(RSD)of PMG and APMA spiked in the soybean(n=6) [/align][table][tr][td][align=center]Analyte[/align][/td][td][align=center]Spiked level(mg/kg)[/align][/td][td][align=center]Recovery/%[/align][/td][td][align=center]RSD/%[/align][/td][/tr][tr][td]PMGAMPA[/td][td][align=center]0.02[/align][align=center]0.2[/align][align=center]2[/align][align=center]0.02[/align][align=center]0.2[/align][align=center]2[/align][/td][td][align=center]80.2[/align][align=center]91.5[/align][align=center]86.8[/align][align=center]77.7[/align][align=center]89.3[/align][align=center]85.9[/align][/td][td][align=center]6.96[/align][align=center]3.37[/align][align=center]3.95[/align][align=center]8.27[/align][align=center]4.25[/align][align=center]4.11[/align][/td][/tr][/table][b]3 结语[/b] 本文建立了超高效液相色谱-串联质谱法(UPLC/MS/MS)测定大豆中草甘膦及其代谢物氨甲基膦酸残留的分析方法。该方法灵敏度高,PMG和APMA定量限(LOQ)达到0.01 mg/kg,能满足大豆产品相关限量标准要求。同时该方法具有较高的准确度和精密度,前处理步骤简单快速,特别适合大批量大豆样品的检测。
请问各位专家:水胺硫磷和甲基异柳磷能用液质做吗?我在GB/T 20769和安捷伦提供的一本书上的方法里都没有找到这两种农药的方法,自己也做过水胺硫磷,不过没做出来。我的仪器是Agilent 6410A.如果可以的话,请一并告知简单的参数;不行的话请简单讲解原因。谢谢!
GB2763中关于亚砜磷的限值要求,标准中指出残留物为亚砜磷 砜吸磷 甲基内吸磷之和,以亚砜磷表示,不知道亚砜磷 砜吸磷 甲基内吸磷这三者之间有什么关系,是可以相互转化,还是同分异构体?
苯环上3位和5位上各带一个三氟甲基,扫碳谱后非常的杂,如何才能比较准确地找出相对应的峰并计算耦合常数呢?三氟甲基上的碳是否裂分位一个4重峰了,临位的碳也被裂分为双峰了呢?
请教α-甲基苯乙烯,邻甲基苯乙烯,2-甲基苯乙烯,3-甲基苯乙烯,4-甲基苯乙烯,是不同的物质吗?,物质结构
有没有人做过:三甲基氧苄二氨嘧啶?请各位高手指点一下用什么方法进行检测,谢谢!
[size=4][font=宋体]求香菇上氟乐灵,甲基毒死蜱,毒死蜱,氯杀螨,乙硫磷,氯苯嘧啶醇[/font][/size][size=4][font=Times New Roman] [/font][/size][size=4][font=宋体]氟虫腈的前处理方法,能够有效去除杂质的,谢谢大家,这个香菇上的杂质太多了,用弗洛里硅土不管用,杂质很多。[/font][/size]
1701柱,一个是DB,一个是VF1701MS,尺寸是一样的,30*0.25*0.25,可是DB1701上甲基异柳磷与水胺硫磷能分开,相差1.0min,而VF1701上只相差0.1min,两者重合,大家遇见过这种情况吗?
N-乙基-2-氨甲基吡咯烷如何检测水分

做5009,14植物性食品甲基异柳磷的测定,发现标准中的公式就直接除以样品重量。这版标准和上版标准都是这样的。可是作者发的一篇文章上,公式上是有2的。各位老师,能不能帮忙看下,我的这版标准是对的吗?[img=甲基异柳磷公式,690,1226]http://ng1.17img.cn/bbsfiles/images/2017/07/201707292324_01_3240303_3.jpg[/img]
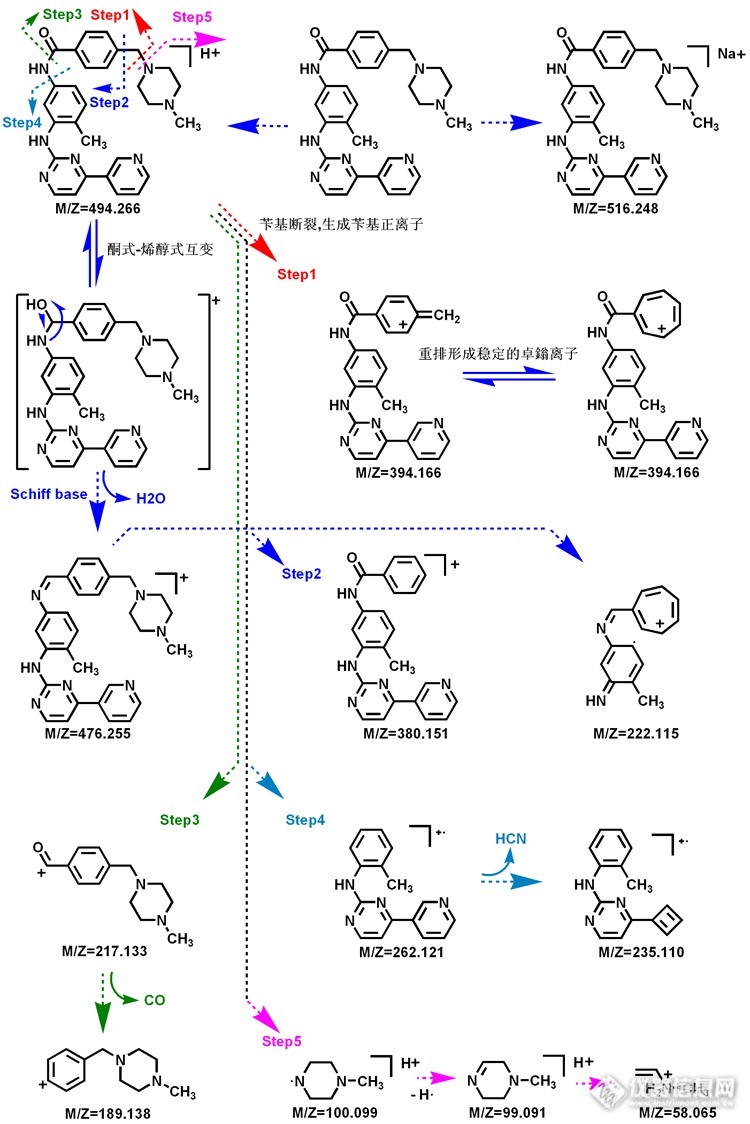
氟马替尼和伊马替尼皆为靶向治疗药物,伊马替尼(原称STI571)是一种治疗普通种类癌症的药物。其甲磺酸盐目前由诺华公司在市面上销售,在中国商品名称“格列卫”。它被用于治疗慢性粒细胞性白血病(CML),胃肠道间质瘤(胃肠道间质瘤)和其他一些疾病。到2011年,该药已被FDA批准用于治疗10个不同的癌症。对于慢性粒细胞白血病,酪氨酸激酶ABL被锁定在其活化形式。它导致慢性粒细胞白血病的异常表型为:过度增殖和白细胞计数高。伊马替尼可与酪氨酸激酶活性位置结合,并阻止其活动。甲磺酸氟马替尼是江苏豪森药业股份有限公司组织多家单位研究开发的氨基嘧啶类化合物甲磺酸氟马替尼是针对Bcr-abl设计的格列卫的结构修饰药物。药理实验显示疗效明显优于imatinib(格列卫),目前的数据支持甲磺酸氟马替尼进入临床进一步试验。本临床研究已得到中国食品药品监督管理局的批准并已被伦理委员会审阅通过。伦理委员会将保证所有参与者的权利得到保护。质谱图是某质谱解析爱好朋友提供的,觉得这个稍微难一点,所以很提人胃口,所以解析起来可能更有点意思!!!氟马替尼质谱图(ESI+):http://ng1.17img.cn/bbsfiles/images/2014/09/201409261650_515869_2359621_3.jpg氟马替尼可能的质谱裂解途径:http://ng1.17img.cn/bbsfiles/images/2014/09/201409261649_515868_2359621_3.png 氟马替尼分子量为562,质子化产物为563,585为其加钠峰,545碎片离子为脱水峰,结构中的酮式会与烯醇式互变,经过氢重排脱水,523与准分子离子相差40为脱去两分子的HF而生成,503为在523的基础上再失去一分子HF生成,基峰为463是与脂肪胺相连的苯环上苄基断裂,同时电荷转移,七元环的卓鎓离子更具有稳定性个人认为脂肪环上的N原子的碱性强一点所以其具有较强的质子亲和力,所以质子化发生位置可能就是在脂肪环的N原子上,除了苄基的断裂还有一种断裂方式就是与苯环相连的C-C键的断裂,从而得到449的碎片离子,423碎片离子是463碎片离子失去两分子的HF而生成的,285为酰胺键断裂电荷转移,由此推断可能质子化位置在酰胺N原子上,277亦为酰胺键断裂只不过正电荷定域在左侧,C-N键断裂会得到263的离子,由于游离基中心的诱导 该离子再失去氢自由基得到262的碎片离子,嘧啶与吡啶相连的氨基经过H重排发生1.3-键断裂,后得到173的碎片离子,58,99,100的离子均来自N脂肪环,C-N键断裂,失去氢自由基,以及开环所生成。依马替尼质谱图(ESI+):http://ng1.17img.cn/bbsfiles/images/2014/09/201409261651_515870_2359621_3.jpg依马替尼可能的质谱裂解途径:http://ng1.17img.cn/bbsfiles/images/2014/09/201409261659_515871_2359621_3.png伊马替尼在结构上与氟马替尼的差异不大,毕竟氟马替尼是伊马替尼的结构修饰药,所以结构上比伊马替尼在苯环上多了三氟甲基取代基,另外则是甲基吡啶环变成甲基苯环,伊马替尼分子量为493,准分子离子加氢峰为494,准分子离子加钠峰为516,离子都具有很高的丰度,476为烯醇互变引起脱水得到的,这个过程与氟马替尼一致,394为苄基断裂,380为与苯环相连的C-C键的断裂得到的 ,262为与苯环相连酰胺键的CN键断裂生成的离子,217为酰胺键断裂电荷转移得到的,后失去CO中性分子得到189碎片离子,222为酰胺键断裂,以及苄基断裂生成卓鎓的离子,235为262失去HCN得到,低质量端为含氮脂肪环产生的离子。注:参加原创不是目的,目的是和各位质谱解析爱好者,更深入、广泛的交流学习,分享自己的心得,同时认识到自己的不足!
急需以下化学试剂标准四氢呋喃、吗啉、DMF-DMA、N-甲基哌嗪、甲磺酸、对甲苯磺酸有知道的同志请将结果发送至我的邮箱weiweidou2008@live.cn谢谢大家啦!
关于竹笋中甲基对硫磷含量的测定,有什么可以检测标准吗?