[color=#DC143C]请问那位大侠知道,用镉铜还原法测定海水中的硝酸盐,用咪唑缓冲合氯化铵缓冲有合不同?我最近总是发现镉柱用过一段时间后,镉粒表面会出现蓝色沉淀物质,我用的缓冲溶液是咪唑溶液。以前美见过这种现象,那位老师知道原因,请赐教,谢谢![/color]
我们做络合滴定时经常要用到缓冲溶液,比如我做锌时用乙酸-乙酸钠缓冲溶液(PH5.6),一般是称取300克无水乙酸钠,溶解后倒入2000ml的容量瓶中,加入100ml36%的乙酸,加水稀释至刻度,摇匀,即得。 那如果我们称取无水乙酸钠100克+33.3ml36%乙酸,pH一样,但缓冲容量与上述的相差多少?这样是否可行?或许更低呢?一般对这个有怎样的要求?
常用PH缓冲溶液 Common pH Buffer Solutions 在化学中,有一类能够减缓因外加强酸或强碱以及稀释等而引起的pH急剧变化的作用的溶液,此种溶液被称为pH缓冲溶液。pH缓冲溶液一般都是由浓度较大的弱酸及其共轭碱所组成,如HAc-Ac-,NH4+-NH3等,此种缓冲溶液具有抗外加强酸强碱的作用,同时还有抗稀释的作用。在高浓度的强酸或强碱溶液中,由于H+或OH-浓度本来就很高,外加少量酸或碱基本不会对溶液的酸度产生太大的影响。在这种情况下,强酸(pH12)也是缓冲溶液,但此类缓冲溶液不具有抗稀释的作用。 在分析化学中用到的缓冲溶液,大多数是用于控制溶液的pH,也有一部分是专门用于测量溶液的pH值时的参照标准,被称为标准缓冲溶液。
缓冲剂及缓冲溶液 能抵抗外加的少量酸、碱或稀释而保持本身的 PH 值基本不变的溶液叫做缓冲溶液,用来配制缓冲溶液的试剂又称缓冲剂。 缓冲溶液一般是具有同离子效应的弱酸和弱酸盐或弱碱和弱碱盐组成的。例如:乙酸 - 乙酸钠、氨 - 氯化铵、碳酸氢钠 - 硫酸钠、硼砂 - 硼酸、磷酸二氢钾 - 磷酸氢二钠等都可以配成缓冲溶液,缓冲溶液根据用途不同分成几种。
pH缓冲溶液的保存时间关于pH缓冲溶液的保存时间大家也有不同的看法,首先我们还是老规矩看下度娘是怎么说的:??网络上也是很多保存时间各不相同,那么我们发现了一个关于pH缓冲溶液的行业标准,JB/T8276-1999PH测量用缓冲溶液制备方法(已废止)。我们参考标准中的时间是:缓冲溶液一般可保存两个月~三个月,若发现有混浊、或沉淀现象时不能继续使用。当然,此标准已经废止,时间我们也只能是参考,现在很多企业在制作标准缓冲溶液,我们查看证书可知?有效期是一年,未开封的缓冲溶液保质期是一年。关于具体保存时间,没有发现现行有效的标准。缓冲溶液的保存大家需要注意的是,碱性的缓冲溶液,应装入低压高密度聚乙烯瓶中保存。
缓冲溶液是生命体的一项重要特征,你眼中的缓冲溶液是什么?谈谈对缓冲容量的看法。
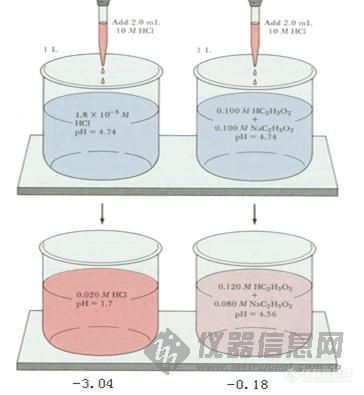
缓冲溶液与缓冲作用原理 (一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4molL-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4 molL-1),若将1滴氢氧化钠溶液(12.4molL-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7 molL-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用 具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。 3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。 (三)缓冲溶液的作用原理 现以HOAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH稳定的原理。醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HOAc分子形式存在,OAc-的浓度很低。醋酸钠是强电解质,在溶液中全部离解成Na+和OAc-,由于同离子效应,加入NaOAc后使HOAc离解平衡向左移动,使 HOAc的离解度减小,[HOAc]增大。所以,在HOAc-NaOAc混合溶液中,存在着大量的HOAc和OAc-。其中HOAc主要来自共轭酸HOAc,OAc-主要来自NaOAc。这个溶液有一定的[H+],即有一定的PH值。在HOAc-NaOAc缓冲溶液中,存在着如下的化学平衡: 在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。假设不发生其他反应,溶液的PH值应该减小。但是由于[H+]增加,抗酸成分即共轭碱OAc-与增加的H+结合成HOAc,破坏了HOAc原有的离解平衡,使平衡左移即向生成共轭碱HOAc分子的方向移动,直至建立新的平衡。因为加入H+较少,溶液中OAc-浓度较大,所以加入的H+绝大部分转变成弱酸HOAc,因此溶液的PH值不发生明显的降低。 在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。假设不发生其他反应,溶液的PH值应该增大。但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HOAc原有的离解平衡,促使HOAc的离解平衡向右移动,即不断向生成H+和OAc-的方向移动 ,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。因为加入的OH-少,溶液中抗碱成分即共轭酸HOAc的浓度较大,因此溶液的PH值不发生明显升高。 在溶液稍加稀释时,其中[H+]虽然降低了,但[OAc-]同时降低了,同离子效应减弱,促使HOAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。所以,溶液具有抗酸、抗碱和抗稀释作用。 多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡: HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。 弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
一、缓冲容量 (一)缓冲容量的概念 为了定量地表示缓冲溶液缓冲能力的大小,采用缓冲容量(也称缓冲指数或缓冲值)β来衡量。 定义:使1L或1ml缓冲溶液的pH值改 变一个单位所需加入一元强酸或一元 强碱的物质的量(mol或mmol), 称为该缓冲溶液的缓冲容量。
有2点疑问:(1)硼酸缓冲溶液是指硼砂-氢氧化钠缓冲溶液还是硼酸-硼砂缓冲液(2)要配置含有0.005mol/L的巯基乙醇的0.05mol/L硼酸盐缓冲溶液(PH 8.8)该如何配置,重点就是这个巯基乙醇。由于未接触过这些,只是查了些常用缓冲溶液的配置方法,未查到含有巯基乙醇的配置方法,还望各位大侠帮帮忙,谢谢了
最近做实验可能用到以缓冲溶液作流动相,以前也没有用过,不明白缓冲溶液的作用是什么?请各位大虾帮忙解释一下吧!!![em0809] [em0808]
1.碱性缓冲溶液有哪些?2.哪些缓冲溶液能更好的稳定PH?3.有哪些缓冲溶液同时能做掩蔽剂的?
用C4-100阳离子柱柱分析锌离子样品,流动相为酒石酸和吡啶二羧酸混合溶液,但是锌在流动相中会发生解离,问:要求用有机酸做缓冲溶液调节pH值到5-7左右,什么酸比较合适呢?急!!!
前段时间校对子在哈希买的pH探头,分享出来,希望能帮到你们。嘿嘿"校正pH探头,用两种缓冲溶液就够了。如果待测样品偏酸性,请中pH为4和7的缓冲溶液校正探头,如果待测样品偏碱性,请用pH为7和10的缓冲液来校正。缓冲溶液有粉末状的冲剂和溶液成品出售。冲剂具有保存时间长、经济的优点,但就是不方便。溶液成品使用方便,但开盖后易变质。您可以把溶液成品用小烧杯分装开来使用,如果您使用的是Singlet Solution Packs,探头可以直接放进溶液袋里。如果您使用粉状冲剂,校正前请用50ml去离子水配成缓冲液。缓冲溶液用于校正后就应该倒掉。因此缓冲液成品应分装开来使用。千万不能把使用过的缓冲液倒回溶液瓶里。"
配制的缓冲溶液一般可用多长时间?缓冲溶液可以回收使用么?
我们用的是C8柱做反相色谱,想问问各位,什么情况下该选择缓冲溶液作为流动相?缓冲溶液的PH值是根据什么来选择的?有资料介绍说缓冲溶液的缓冲范围为PKa的正负1,是指的什么意思?缓冲溶液的配制有什么讲究么?期待各位高手的解答!谢谢!
PH缓冲溶液校正时,一般要求,第一点用中性缓冲溶液校正,第二点用接近待测液值的PH缓冲溶液校正!接近待测液值的PH,怎确定的?
①样品的制备湖水和河水样品中加入浓度为25ng/L的各种喹诺酮抗生素,pH 调至4,在固相萃取前,样品要经过一个0.45μm的微孔滤膜以除去样品中的悬浮杂质。②固相萃取(SPE)C18柱(2×1 ml甲醇,1×1 ml纯水,1×1 ml醋酸钠缓冲溶液Ph4);水样的pH调至4,然后用大体积取样器离心管取250mL水样渗透过C18柱,然后用3×500μL的pH 4的醋酸钠缓冲溶液(含15%乙腈)洗C18柱,再真空干燥5分钟。然后,取3×1 ml的甲醇溶液(含6%氨)洗分析物,最后,样品提取物用氮蒸干然后溶解在250μL的pH2.5的甲酸中用于HPLC分析。③液相色谱法液相色谱分离物用200μL注射剂线性梯度洗脱,如下:从96% A(稀释的甲酸 pH2.5)和4% B(乙腈)到50% A和50% B,在25分钟内,检测波长为275nm。以上是我的实验步骤,具体想问问:1、在河水中取样后,怎样将水的pH 调至4?2、pH 4的醋酸钠缓冲溶液怎么配?3、稀释的甲酸 pH2.5 怎么弄?4、取3×500μL的pH 4的醋酸钠缓冲溶液(含15%乙腈),这个取法是什么意思?15%是质量分数吗?意思是pH 4的醋酸钠缓冲溶液取3×500μL,在此基础上满足含15%乙腈?是这样吗?问题有点多,希望好心人耐心讲解下哦!!先谢谢了!
(一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使增加5000倍左右(由1.0×10-7增至5×10-4 mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,的增加不到百分之一(从1.00×10-7增至1.01×10-7 mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)[font=Arial
======在 2017/6/27 20:53:47 您来信中写道:====== 前辈你好,我想请教一下,我的样品时80乙醇溶解的,50mM硼砂体系做缓冲液,总会出现出完甲醇峰,红遍的样品峰整体上移,以前做其他样品的时候,用过不同浓度的甲醇溶解样品,缓冲体系也是从20实验到了50,也会出现这种情况,或者是出完中性甲醇峰,整个后边的样品峰都下移,有前辈说是样品基质和缓冲体系不匹配,是电导率差异太大么,那么调低PH,理论上是否有效,可是调下PH,会影响分离效果。还望前辈不吝赐教。非常感激 ======================================[b][color=#3333ff][/color][color=#3333ff]建议你用少量有机溶剂溶解后再用缓冲溶液稀释进样。不然就在缓冲溶液中添加少量甲醇(一般不超过8%)[/color][/b]
文献上写的是流动相选用5%的甲醇+95%磷酸缓冲溶液(pH=5),这个pH=5的缓冲溶液怎么配制呢?网上到处找了下都没有。 PS:文章里的试剂写的是磷酸和磷酸氢二钾
[img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908310830_168620_1610969_3.jpg[/img]缓冲溶液 简介 缓冲溶液(英文:buffer solution)是[color=#DC143C]一种能在加入少量酸或碱和水时大大减低pH变动的溶液[/color]。pH缓冲系统对维持生物的正常pH值和正常生理环境起到重要作用。
前一阵子再做一个项目时发现分别用用磷酸、高氯酸、磷酸二氢钾、庚烷磺酸钠配制的缓冲溶液效果不一致。只有用庚烷磺酸钠配制的缓冲溶液在分析该产品时出峰较为正常。现想咨询下各位前辈,在分析哪类产品时适用哪类缓冲盐,有没有诀窍啊,希望各位来谈谈经验!
缓冲溶液使用可以用多长时间.我配的缓冲溶液一~二天后出现菌丝,用0.45um的滤膜不能完全滤去,那个高人有好办法防止菌丝生成[em06] [em55]
配制氨缓冲溶液的时候(ph=10)按这个比例:67.5gNH4CL溶于300mlH20中,加570ml浓氨水稀释至1升问题:倒出分析用纯氨水时候,气味特别刺鼻,有什么方法?问大家都是怎么配制缓冲溶液的,我觉得特别恐怖,请支招?
图解缓冲溶液[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=32683]缓冲溶液[/url]
维权声明:本文为zlhuang0132原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。pH缓冲溶液的组成、作用及计算zlhuang0132 pH缓冲溶液是分析测试中应用最为广泛的试剂溶液。其作用是用来稳定溶液的pH值,以满足测试中对恒定pH的要求。虽然pH缓冲溶液的组成并不复杂,但关于pH缓冲溶液的计算却是酸碱滴定分析中计算最为复杂的内容。下面介绍一下pH缓冲溶液的组成和各种类型的化学计算方法。1 pH缓冲溶液的组成和作用1.1 pH缓冲溶液的类型与作用 pH缓冲溶液包括两大类:标准缓冲溶液和普通缓冲溶液。 标准缓冲溶液主要用在酸度计测量溶液pH值时的仪器校正和定位,要求数值准确、精确。因此对试剂纯度、浓度准确性、温度等都有严格要求,这类缓冲溶液有专门的化学试剂商品,可以购买配制,也可以用优级纯试剂按资料的配比配制。 普通缓冲溶液主要用于化学分析和仪器分析中要控制一定pH值的测定过程中。几乎所有的EDTA络合滴定都必须在一定的pH范围内进行,因此,需要加入pH缓冲溶液,例如,测定铅、锌用到HAc缓冲溶液,测定钙、镁、锌用到氨缓冲溶液。又如,氧化还原滴定中,碘量法测铜要用到NH4HF2,碘量法测砷、锑要加NaHCO3。 普通缓冲溶液的配制并不需要像标准缓冲溶液配制那样严格和苛刻,因为对缓冲溶液的pH值要求并不需要非常精确,因此,可以用分析纯试剂来配制,也可以用已有的酸、碱、盐溶液来“搭配”(后述)。1.2 普通pH缓冲溶液的类型 普通pH缓冲溶液按组成不同可分三大类:弱酸-弱碱型缓冲溶液(即共轭酸碱缓冲溶液)、酸式盐缓冲溶液、强酸或强碱溶液。在一些特殊情况下也使用混合体系的缓冲溶液(两种pKa相近的共轭酸碱缓冲溶液混合而成)。大家比较熟悉的是共轭酸碱缓冲溶液,例如,HAc-NaAc、HF-NH4F、NH3-NH4Cl。其实,酸式盐也可作为缓冲溶液,因为酸式盐的pH值大多是恒定的,随其浓度增减的变化不大,例如,NaHCO3溶液在1.0M至0.01M之间,其pH值几乎都在8左右(理论值为8.3),同样可以抵抗溶液中产生的少量强酸、强碱(或外加),保持溶液的pH值恒定或变化微小。强酸、强碱溶液也能缓冲滴定过程中产生的少量强酸或强碱,保持溶液的pH值变化很小,故强酸强碱也可作为广义的pH缓冲溶液(以前的分析化学教材就是这样分的),例如,EDTA络合滴定铋,需另外加入一定量的0.1mol/L硝酸溶液,就是为了增强溶液对滴定中产生的H+的缓冲作用。下面重点介绍最常用的共轭酸碱缓冲溶液的相关知识。 弱酸-弱碱型缓冲溶液的构成与配制。这类缓冲溶液的组成为:弱酸+弱酸盐(即共轭碱)、弱碱+弱碱盐(即共轭酸)。常见的实例有:HAc-NaAc、[font=Tim
需要配制pH 4.2-4.7的缓冲溶液5升,麻烦设计一个配置方法!多谢!
文章中没有显示公式啥的 http://simg.instrument.com.cn/bbs/images/brow/em09508.gif想下载的可以找到链接 进行下载资料库————缓冲溶液的配制与性能http://www.instrument.com.cn/download/shtml/204329.shtmlhttp://simg.instrument.com.cn/bbs/images/brow/em09505.gif缓冲溶液的配制与性能一 实验目的(1)学习缓冲溶液的配制方法,加深对缓冲溶液性质的理解(2)了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系:(3)练习吸量管的使用方法。二 实验原理 能抵抗外来少量强酸、强碱或适当稀释而保持pH值基本不变的溶液叫缓冲溶液。缓冲溶液一般是由弱酸及其盐、弱碱及其盐、多元弱酸的酸式盐及其次级盐组成。缓冲溶液的pH值可用下式计算: 或 缓冲溶液pH值除主要决定于pKb(pKb)外,还与盐和酸(或碱)的浓度比值有关,若配制缓冲溶液所用的盐和酸(或碱)的原始浓度相同均为C,酸(碱)的体积为Va(Vb),盐的体积为Vs总体积为V,混合后酸(或碱)的浓度为 ,盐的浓度为 ,则 所以缓冲溶液pH值可写为 或 配制缓冲溶液时,只要按计算值量取盐和酸〔或碱)溶液的体积,混合后即可得到一定pH值的缓冲溶液。缓冲容量是衡量缓冲溶液的缓冲能力大小的尺度。为获得最大的缓冲容量,应控制 (或 )=1,酸[font
附录7 缓冲溶液的配制(一)基本溶液(1)0.2mol/L邻苯二甲酸氢钾溶液:称取20.423g邻苯二甲酸氢钾,溶于蒸馏水并释至500mL.(2)0.1mol/L氨基乙酸与0.1mol/L氯化钠混合溶液:称取3.753g氨基乙酸和2.922g氯化钠,溶于蒸馏水并定容至500mL.(3)0.2mol/L硼酸与0.2mol/L氯化钾混和溶液:称取6.183g硼酸和7.455g氯化钾,溶与蒸馏水并释至500mL.(4)0.2mol/L 氯化钾溶液:将7.455g氯化钾溶于蒸馏水并稀释至500mL.(5)0.2mol/L磷酸二氢钾溶液:称取13.609g磷酸二氢钾,溶于蒸馏水并定容至500mL.(二)缓冲溶液(1)盐酸-氯化钾缓冲溶液:将下列各组溶液混合后,用蒸馏水定容至100mLpH值0.1mol/L盐酸溶液(mL)0.2 mol/L氯化钾溶液(mL)pH值0.1mol/L盐酸溶液(mL)0.2 mol/L氯化钾溶液(mL)1.11.21.31.41.51.694.5675.1059.6847.4037.6429.902.7012.4520.1526.3031.2035.001.71.81.92.02.12.223.7618.8614.9811.909.467.5238.1040.6042.5044.0545.3046.25(2)邻苯二甲酸氢钾-盐酸缓冲溶液:将下列各组溶液混合后,用蒸馏水定容至100ml.pH值0.1mol/L盐酸溶液(mL)0.2 mol/L邻苯二甲酸氢钾溶液(mL)pH值0.1mol/L盐酸溶液(mL)0.2 mol/L邻苯二甲酸氢钾溶液(mL)2.22.42.62.83.046.6037.6033.0026.5020.4025.0025.0025.0025.0025.003.23.43.63.818.809.956.002.6525.0025.0025.0025.00(3)邻苯二甲酸氢钾溶液-氢氧化钠缓冲溶液:将下列各组溶液混合后,用蒸馏水定容至100mL.pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L邻苯二甲酸氢钾溶液(mL)pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L邻苯二甲酸氢钾溶液(mL)4.04.24.44.64.85.00.403.657.3512.0017.5023.6525.0025.0025.0025.0025.0025.005.25.45.65.86.06.229.7535.2539.7043.1045.4047.0025.0025.0025.0025.0025.0025.00(4)磷酸二氢钾——氢氧化钠缓冲溶液:将下列各组溶液混合后,用蒸馏水定容至100ml.pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L磷酸二氢钾溶液(mL)pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L磷酸二氢钾溶液(mL)5.86.06.26.46.66.83.665.648.5512.6017.7423.6025.0025.0025.0025.0025.0025.007.07.27.47.67.88.029.5434.9039.3442.7445.1746.8525.0025.0025.0025.0025.0025.00(5)硼酸-氯化钾-氢氧化钠缓冲溶液:将下列各组溶液混合后,用蒸馏水稀释至100mL.pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L硼酸-氯化钾溶液(mL)pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L硼酸-氯化钾溶液(mL)7.88.08.28.48.68.82.654.005.908.5512.0016.4025.0025.0025.0025.0025.0025.009.09.29.49.69.810.021.4026.7032.0036.8540.8043.9025.0025.0025.0025.0025.0025.00(6)氨基乙酸-氯化钠-氢氧化钠缓冲溶液:将下列各组溶液混合后,用蒸馏水定容至100mL.pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L氨基乙酸-氯化钠溶液(mL)pH值0.1mol/L氢氧化钠溶液(mL)0.2 mol/L氨基乙酸-氯化钠溶液(mL)210.010.210.410.610.811.011.211.437.5041.0044.0046.0047.5048.8049.8050.2062.5059.0056.0054.0052.5051.2050.2049.8011.611.812.012.212.412.612.813.051.0052.1054.0056.0060.3067.5077.5092.5049.0047.9046.0044.0039.7032.5022.507.50注:1)所用试剂皆为分析纯和优级纯。 2)氯化钾、氯化钠在120º C烘干后使用;硼酸在80º C烘干后使用;邻苯二甲酸氢钾溶液在110-120º C烘干后使用;氨基乙酸在110º C烘干后使用。
我配的克拉克缓冲溶液为什么稀释之后ph不能保证不变呀,怎样才能缓冲的住?拜托了。