各国争相发展的重点项目 iPS技术,即诱导性多能干细胞技术,是一种将成体成熟、分化的体细胞重编程获得类似胚胎干细胞的新兴技术。2007年11月美国和日本科学家分别独立宣布可将人类皮肤细胞转化为iPS细胞。这一发现被《自然》和《科学》杂志分别评为2007年第一和第二大科学进展。之后,iPS细胞研究迅猛发展,不同的国家和实验室纷纷报道了多种方法建立的iPS细胞系。就连世界第一只体细胞克隆动物多利羊的培育者伊恩·威尔莫特也宣布放弃人类胚胎干细胞克隆研究,转而进行 iPS 细胞研究,因为他认为这种细胞比胚胎干细胞更具潜在优势。 我国连续多年将干细胞研究列入“863”、“973”、国家自然基金重点项目。国务院2006年发布的《国家中长期科学和技术发展规划纲要(2006-2020年)》中,干细胞作为五项生物技术之一成为未来15年我国前沿技术的重点研究领域。 致瘤风险浮出水面 Yamanaka研究组在《自然·生物技术》上发表的文章显示,用iPS细胞诱导的神经干细胞,即使不含c-Myc(曾被认为是导致肿瘤的主要原因),在植入NOD/SCID免疫缺陷小鼠后仍有很强的致瘤性,甚至高于胚胎干细胞。 他们共研究了36个iPS细胞克隆,在诱导方式上,有些诱导剂配方中含有c-Myc基因,有些没有,因此具有较好的代表性。同时他们选择了3株胚胎干细胞作为对照。在45周的观察中,移植胚胎干细胞来源神经干细胞的34只小鼠有4只长出肿瘤。在100只移植胚胎成纤维细胞来源的iPS神经干细胞小鼠中34只发现肿瘤,概率和胚胎干细胞相当。在55只移植成人成纤维细胞来源的iPS神经干细胞小鼠中46只发现肿瘤,概率远高于胚胎干细胞。在36只移植肝细胞来源的iPS神经干细胞小鼠中10只发现肿瘤,概率高于胚胎干细胞。8只移植胃上皮细胞来源的iPS神经干细胞小鼠中未发现肿瘤。病理学检查证实肿瘤均为畸胎瘤,部分为恶性畸胎瘤。 研究还发现,以前认为致瘤性很强的c-Myc在去掉后并没有减少iPS神经干细胞的致瘤性,相反以前认为没有致瘤性的Nanog基因却可以明显增强iPS神经干细胞的致瘤性。 这次试验的另一个意外结果是并未发现在生成的肿瘤细胞中有c-Myc或其他基因的激活。以前的观点认为,转入的癌基因是iPS致瘤性的基础,只要在iPS细胞诱导成功后通过各种方法去除已完成使命的癌基因即可使iPS细胞免于致瘤性。这次试验的结果无疑给这些想法留下了阴影,而且使iPS致瘤的机制更加扑朔迷离。
http://www.bioon.com/biology/UploadFiles/201208/2012080216013081.jpg癌症研究人员可以测定肿瘤细胞基因组的序列,扫描其异常的基因活性,剖析其突变的蛋白质和研究它们在实验室培养皿中的生长,但研究者一直无法跟踪细胞形成肿瘤的过程。现在三个独立研究小组在小鼠体内做到了这一点。他们的研究结果支持这样的观点:一小部分细胞驱动肿瘤的生长,而想要治愈癌症可能需要将这些所谓肿瘤干细胞清除。目前还无法确认,这些从脑瘤,肠癌和皮肤癌研究的结论是否适用于其他类型肿瘤,但是得克萨斯大学西南医学中心的路易斯·帕拉达认为,如果它们适用于其他肿瘤,"将深刻地改变目前的化疗疗效评价和临床疗法的制定标准"。 不仅是看某种疗法是否缩小肿瘤,研究人员将更关注是否杀死了正确的细胞。帕拉达和他的同事们想检测是否特异性标识健康成人神经干细胞的一个遗传标记,也可标识神经母细胞瘤中的癌症干细胞。他们发现,所有神经母细胞瘤样本中至少有几个标记细胞 - 大概是干细胞。未标记细胞可被标准化疗杀死,但肿瘤可迅速恢复。进一步的实验表明,未标记细胞起源于标记的细胞祖先。当研究者把化疗与抑制标记细胞的遗传手段相结合进行治疗时,帕拉达说,肿瘤显著缩小到"残留遗迹"的水平。在另一项研究中,荷兰乌得勒支Hubrecht研究所的干细胞生物学家们把注意力瞄着了肠道。利用药物驱动的荧光素标志物表达系统,他们在小鼠体内证实,多种不同类型的肿瘤细胞,其实是来源于同一干细胞的。而且,这些干细胞是肿瘤发展的驱动力。对皮肤癌的研究,Blanpain和他的小组标记单个肿瘤细胞,而不是特异地标记干细胞。他们发现,细胞表现出两种不同的分工模式:它们要么在慢慢耗尽前分裂出少数细胞,或者产生许多细胞。这再次证实,一类独特的细胞亚群是肿瘤生长的驱动力。研究者说,下一步的研究计划将是,搞清楚这些实验所跟踪的细胞如何与通过多年移植实验所确定的,假定的癌症干细胞相联系的。研究人员已经紧锣密鼓地在寻找杀死这些细胞的方法;现在他们有更多的工具来测试这样的策略是否会奏效。
乳腺癌是世界范围内女性最常见的致死性恶性肿瘤,据统计,2020年女性乳腺癌已超越肺癌成为全球癌症发病率最高的癌种[1-2]。其中三阴性乳腺癌(triple-negative breast cancer,TNBC)是雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)均呈阴性表达的乳腺癌亚型,占所有乳腺癌的15%~20%[3],具有侵袭力强、转移率高、术后复发率高、预后差的特点[4]。由于TNBC内分泌治疗的不确定性及靶向治疗的不应答性,导致临床上的治疗效果不理想[5-6]。因此,寻找有效抑制TNBC增殖转移的药物、降低患者的病死率一直是乳腺癌基础研究的一个重要方向[7-8]。 石蒜碱是石蒜Lycoris radiata (L'Hér.) Herb.、文殊兰Crinum asiaticum L. var. sinicum (Roxb. et Herb.) Baker、朱顶红Hippeastrum rutilum (Ker.-Gawl.) Herb.等石蒜属植物鳞茎中含量较高的异喹啉类生物碱,具有抗肿瘤、抗病毒、抗菌、抗炎镇痛、保肝等药理活性[9-10],近年来石蒜碱的抗肿瘤作用受到众多研究者的关注。有文献报道石蒜碱对人乳腺癌MCF-7细胞[11]、人宫颈癌Hela细胞[12-13]、人肝癌HepG-2细胞[13-16]、人胃癌SGC-7901细胞[17]、人结肠腺癌LoVo细胞[18-19]具有显著的抑制作用,但对其作用机制的研究仍然处于初始阶段。本研究以人乳腺癌MDA-MB-231细胞为研究对象,主要通过体外实验从细胞水平和分子水平探讨石蒜碱对MDA-MB-231细胞的体外抑制活性及其通过线粒体氧化损伤诱导肿瘤细胞自噬及凋亡的机制,为今后石蒜碱抗肿瘤新药的深入研发和临床实践提供理论基础和实验参考。 1 材料 1.1 细胞株 MDA-MB-231细胞由国家教育部抗肿瘤天然药物工程技术研究中心提供。 1.2 药品与试剂 石蒜碱(批号34296,质量分数98%)购自阿拉丁试剂有限公司;胎牛血清(批号0201021)购自浙江杭天生物科技公司;RPMI 1640细胞培养基(批号AD123707271)购自美国HyClone公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号20200901)购自天津中和盛泰化工有限公司;Hoechst 33258染液(批号C1011)、SDS-PAGE蛋白上样缓冲液(批号P0015)、吉姆萨染液(批号C0131)、CCK-8试剂盒(批号C0043)、活性氧(reactive oxygen species,ROS)检测试剂盒(批号S0033S)、PMSF(批号ST505)、HRP标记的山羊抗大鼠IgG二抗(批号A0192)、Western blotting及IP细胞裂解液(批号072318180723)、30% Acr-Bis(批号093018181017)购自碧云天生物技术研究所;碘化丙啶(propidium iodide,PI)染液(批号R20285)、Rhodamine 123(批号R8004)购自美国Sigma公司;台盼蓝(批号72-52-1)购自美国默克公司;Reagent A染液(批号5000113)购自北京诺博莱德科技有限公司;聚山梨酯20(批号20190207)购自美国Biotopped公司;Tris(批号181127)购自美国Amresco公司;兔抗半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号WL02512)、兔抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号WL01506)、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号WL02385)、兔抗细胞色素C(cytochrome-C,Cyt-C)抗体(批号WL04963)、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号WL01114)购自沈阳万类生物科技有限公司;兔抗线粒体内膜转位酶(translocase of inner membrane,TIM)抗体(批号PSI-RF16109)、兔抗线粒体外膜转位酶(translocase of outer membrane,TOM)抗体(批号PSI57577)、兔抗E3泛素连接酶(E3 ubiquitin protein ligase,PARKIN)抗体(批号PSI50248)、兔抗PTEN诱导的激酶1(PTEN induced putative kinase 1,PINK1)抗体(批号PSI7859)、兔抗微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3-B)抗体(批号BS79705)、兔抗p62抗体(批号p196-269)购自艾美捷科技有限公司。 1.3 仪器 ECO-170P-230型细胞培养箱、Model 680型酶标仪(美国NBS公司);Adventurer型万分之一电子天平(美国OHAUS公司);EPICS-XL型流式细胞仪、AllegraTM 64R型低温高速离心机(美国Beckman-Coulter公司);CKX-41-32型倒置显微镜(日本Olympus公司);荧光显微镜、TCS-SP2激光共聚焦扫描显微镜(德国Leica公司);680型全自动酶标仪(美国Bio-Rad公司);P型微量[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url](芬兰百得公司);标准型PB-10 pH计(德国Sartorius公司);GIS-2019型Tannon凝胶成像系统(天能科技有限公司);DYY-7C型电泳仪、M344039型垂直电泳转印槽(北京六一仪器厂)。 2 方法 2.1 细胞培养 MDA-MB-231细胞复苏后接种于含10%胎牛血清的RPMI 1640培养基中,置于5% CO2、37 ℃恒温培养箱中培养,待细胞长势良好时进行传代,取对数生长期的细胞进行实验。 2.2 CCK-8法检测细胞增殖活性 MDA-MB-231细胞以2×103个/孔接种于96孔板中,细胞培养24 h后,给药组每孔加入不同浓度(2、4、8、16、32 μmol/L)的石蒜碱100 μL,对照组加入100 μL细胞培养基,每组均设置6个平行孔,处理48 h后,每孔加入10 μL CCK-8试剂,继续培养4 h。采用酶标仪检测490 nm处的吸光度(A)值,计算各组细胞的增殖抑制率与石蒜碱对MDA-MB-231细胞的半数抑制浓度(half inhibitory concentration,IC50)。 2.3 倒置显微镜、荧光显微镜、激光共聚焦扫描显微镜观察细胞形态变化 MDA-MB-231细胞以3×103个/孔分别接种于2块6孔板中,细胞培养24 h后,根据石蒜碱对MDA-MB-231细胞的IC50设定3个给药剂量,分别以3、6、12 μmol/L的给药浓度每孔加入石蒜碱1 mL,对照组加入1 mL细胞培养基,继续处理48 h。取1块板用倒置显微镜观察并拍照后,每孔加入1 mL多聚甲醛固定1 h,冲洗后加入200 μL Hoechst 33258染液,37 ℃孵育30 min后,用荧光显微镜观察并拍照;取另1块板收集各组细胞,用预冷的PBS重悬细胞并弃去上清液,加入Annexin V-FITC于37 ℃避光孵育15 min,冲洗后加入PI染液于4 ℃避光孵育15 min后,用激光共聚焦扫描显微镜观察并拍照。 2.4 集落实验检测细胞克隆能力 MDA-MB-231细胞以1×103个/孔接种于6孔板中,细胞培养24 h后,按“2.3”项下方法对细胞进行分组和给药,连续培养7 d后弃去培养基。PBS洗涤后用甲醇固定10 min,冲洗后加入吉姆萨染液染色后,用倒置显微镜观察细胞集落形成率并拍照。 2.5 划痕实验检测细胞迁移能力 MDA-MB-231细胞以1×105个/孔接种于6孔板中,细胞培养24 h,细胞融合至70%~80%后,用200 μL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]倚靠直尺,枪头垂直于每孔底部竖直划痕。PBS冲洗后,按“2.3”项下方法对细胞进行分组和给药,培养48 h后,用倒置显微镜观察细胞的迁移情况并拍照记录,比较各组间的划痕宽度,使用Image J软件测量并计算划痕愈合率。 2.6 流式细胞仪检测细胞凋亡率 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入70%冷乙醇2 mL于4 ℃固定24 h后离心。弃去上清液,PBS冲洗后,加入800 μL PI染液,4 ℃避光孵育30 min,经尼龙网滤过后,采用流式细胞仪进行检测,激发波长为488 nm。 2.7 流式细胞仪检测ROS水平 按“2.3”项下方法对细胞进行分组和给药,培养48 h,收集各组细胞,PBS洗涤后加入5 μmol/L DCFH-DA染液0.2 mL,37 ℃避光孵育20 min,经尼龙网滤过后,采用流式细胞仪进行检测。 2.8 流式细胞仪检测线粒体膜电位 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,PBS洗涤后,避光加入Rhodamine 123染料,避光孵育30 min后离心弃去上清液,用PBS洗涤并混匀细胞,经尼龙网滤过后,采用流式细胞仪进行检测。 2.9 激光共聚焦扫描显微镜检测线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)活性 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入37 ℃预热的Reagent A染液500 μL,离心后弃去上清液。37 ℃避光加入染色工作液,混匀后孵育20 min,离心去除上清液,将细胞吹打混匀后,经尼龙网滤过,采用激光扫描共聚焦显微镜检测并进行拍照。 2.10 Western blotting检测线粒体自噬相关蛋白TIM、TOM、PARKIN、PINK1、LC3-B、p62和凋亡相关蛋白Caspase-3、Bax、Bcl-2、Cyt-C表达 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入含PMSF的细胞裂解液,冰上裂解30 min后将细胞加入EP管中,离心15 min。取上清液,煮沸使蛋白变性,采用BCA试剂盒定量蛋白浓度。采用SDS-PAGE凝胶电泳,转至PVDF膜,5%脱脂奶粉封闭2 h后,加入一抗,4 ℃孵育过夜。TBST洗膜后加入二抗,37 ℃孵化2 h,洗膜后加入化学发光试剂,采用凝胶成像系统拍照并进行分析。 2.11 统计学分析 用SPSS 21.0软件进行统计分析,数据以表示,多样本均数比较采用One-way ANOVA分析,通过Graphpad Prism 8软件绘图。 3 结果 3.1 石蒜碱对MDA-MB-231细胞增殖的影响 如图1所示,石蒜碱对MDA-MB-231细胞具有显著的增殖抑制作用(P<0.01),且呈浓度相关性。石蒜碱对MDA-MB-231细胞的IC50为6.21 μmol/L,并参考IC50值设定后续石蒜碱给药浓度分别为3、6、12 μmol/L。 3.2 石蒜碱对MDA-MB-231细胞形态的影响 采用倒置显微镜、荧光显微镜、激光共聚焦显微镜观察石蒜碱对MDA-MB-231细胞形态的影响,如图2所示,与对照组比较,石蒜碱给药后,随着给药浓度增加,细胞生长逐渐变稀疏,细胞膜破裂现象更加明显,细胞间轮廓更加模糊,细胞核固缩形成凋亡小体,发出较强荧光。 3.3石蒜碱对MDA-MB-231细胞克隆、迁移的影响 集落实验结果表明,石蒜碱可以抑制MDA-MB-231细胞的克隆能力(图3-A),且随着浓度的增加细胞集落数量逐渐减少,且呈浓度相关性。划痕实验结果显示,石蒜碱可以显著抑制MDA-MB-231细胞的迁移能力(P<0.01,图3-B、C),呈剂量相关性。 3.4 石蒜碱对MDA-MB-231细胞凋亡率、ROS水平的影响 如图4-A、B所示,经流式细胞仪PI单染法检测出现明显的凋亡峰,表明DNA的合成受到抑制,且随着给药浓度增加,凋亡峰越明显,凋亡率也呈上升趋势,与对照组比较有显著性差异(P<0.01),且呈浓度相关性。如图4-C、D所示,随着给药浓度增加,细胞内ROS水平逐渐升高,具有显著性差异(P<0.01),且呈浓度相关性。 3.5 石蒜碱对MDA-MB-231细胞线粒体膜电位和MPTP的影响 如图5-A、B所示,经流式细胞仪检测,随着石蒜碱给药浓度增加,细胞内线粒体膜阳性表达率逐渐降低,具有显著性差异(P<0.01),且呈浓度相关性。如图5-C、D所示,应用激光扫描共聚焦显微镜结合AM染色技术对不同浓度的石蒜碱作用48 h后的MDA-MB-23细胞进行检测,激光扫描共聚焦显微镜扫描得到的荧光象素强度反映出细胞膜通透性的改变,随着给药浓度增加,细胞内线粒体膜通透性逐渐升高,具有显著性差异(P<0.01),且呈浓度相关性。 3.6 石蒜碱对MDA-MB-231线粒体自噬和凋亡相关蛋白表达的影响 应用凝胶成像系统分析MDA-MB-231细胞中线粒体自噬和凋亡相关蛋白表达的情况。如图6所示,随着石蒜碱浓度增加,细胞自噬相关蛋白TIM、TOM和p62蛋白表达量逐渐降低,PARKIN、PINK1和LC3-B蛋白表达量逐渐升高,均具有显著性差异(P<0.01)。如图7所示,随着石蒜碱浓度增加,细胞凋亡相关蛋白Bcl-2蛋白表达量逐渐降低,Bax、Caspase-3和Cyt-C蛋白表达量逐渐升高,均具有显著性差异(P<0.01)。 4 讨论 乳腺癌已成为全球最常见的恶性肿瘤,与乳腺癌的其他分子亚型相比,TNBC最具侵袭性和高度异质性[20-22],使其在临床上难以得到有效治疗。因此如何有效抑制TNBC侵袭、增殖和转移是目前亟待解决的问题。近年来,有研究表明中药在抗肿瘤方面具有显著的优势[23-25]。石蒜碱是异喹啉类生物碱,广泛分布于石蒜属植物鳞茎中,具有较强的抗肿瘤活性[26-27]。基于石蒜碱的抗肿瘤作用,结合课题组前期研究中TNBC细胞活性筛选,发现石蒜碱对MDA-MB-231细胞较为敏感,故选择MDA-MB-231细胞作为研究对象,本研究结果发现石蒜碱对MDA-MB-231细胞的增殖和迁移具有显著抑制作用,且呈浓度相关性。 ROS水平升高和线粒体功能障碍是诱导肿瘤细胞自噬和凋亡的重要途径[28]。研究发现,过量ROS的产生会诱发肿瘤细胞的损伤、自噬及凋亡并降低细胞的多药耐药性[29]。此外,肿瘤细胞对外源性ROS比正常细胞更敏感且ROS具有一定的细胞毒性。因此,促进ROS水平升高的药物可表现出一定的抗癌活性。有研究表明,线粒体功能障碍与多种恶性肿瘤的发生及ROS的过量产生密切相关[30]。本研究通过激光共聚焦显微镜和流式细胞仪检测结果表明,石蒜碱可以显著提高MDA-MB-231细胞凋亡率和ROS水平,并使线粒体膜电位下降,MPTP开放。这表明石蒜碱诱导细胞自噬和凋亡作用可能与线粒体的氧化损伤有关。 TOM及TIM是线粒体膜蛋白,当线粒体自噬增强时,其细胞内表达水平下降。研究表明线粒体损伤会使线粒体膜电位降低,导致PINK1在线粒体外膜上表达,从而使PINK1-PARKIN依赖性线粒体自噬反应被激活[31]。LC3-B是自噬体形成的特异性标志物,其含量与自噬泡数量成正比,因此被广泛用于监测细胞自噬。p62作为自噬降解的产物,自噬增强,p62水平会下降。p62还可与自噬体膜上的LC3-B蛋白及泛素化的蛋白形成复合物,在自噬溶酶体内完成降解[32]。ROS的过度累积,会触发MPTP开放,导致线粒体膜电位下降,引起Cyt-C从线粒体释放并进入细胞质中,进而激发Caspase的级联反应并启动细胞线粒体凋亡[33]。Bcl-2为抗凋亡蛋白,Bax为促凋亡蛋白,当接收到凋亡刺激信号后可转位至线粒体膜上,Bcl-2和Bax可形成二聚体或多聚体,从而增加细胞线粒体膜的通透性,进一步激活Caspase级联反应,Caspase-3可通过抑制凋亡抑制物,从而破坏细胞结构使蛋白丧失功能[34]。本研究通过Western blotting检测自噬相关蛋白和凋亡相关蛋白的表达,结果显示石蒜碱能够上调PARKIN、PINK1、LC3-B、Caspase-3、Bax和Cyt-C蛋白表达,下调TIM、TOM、p62和Bcl-2蛋白表达,表明石蒜碱可通过线粒体的氧化损伤介导MDA-MB-231细胞的自噬及凋亡。 综上,石蒜碱对MDA-MB-231细胞具有生长抑制作用,并可通过调控线粒体氧化损伤介导MDA-MB-231细胞的自噬及凋亡。本研究为石蒜碱抗肿瘤新药的深入研发和临床实践提供理论基础。
中国科技网讯 最近出版的国际肿瘤学权威期刊《美国国立癌症研究所杂志》发表了题为《转化生长因子β受体Ⅰ抑制剂高效安全抑制乳腺癌转移》的研究论文。该研究由国家“千人计划”入选者、华东师大生命医学研究所、上海市调控生物学重点实验室刘明耀教授领衔的课题组研发,发现了新型抗肿瘤体内生长和转移抑制剂。 随着全球肿瘤发病率的提高,我国已成为世界上肿瘤发病和死亡的大国。预计到2030年,世界上将有1320万人死于癌症,其中1/4在中国。针对这一严峻现状,近年来,学者一直在致力于战胜这个“恶魔”。分子靶向治疗,特别是寻找肿瘤转移的分子靶向治疗是近年来肿瘤治疗研究最为活跃的领域。肿瘤分子靶向治疗药物是一种小分子靶向治疗药物,就像子弹一样,可以直接命中癌细胞,而尽可能不损伤正常细胞,因其高效安全而备受瞩目。 课题组利用计算机模拟技术,构建了以抑制转化生长因子β受体活性为抗肿瘤药物靶点的虚拟筛选模型。利用该模型,从40万个小分子化合物库中筛选确定了100个左右的小分子。这些虚拟筛选出来的小分子在实际中是否真的能抑制癌细胞生长和迁移?这就需要再通过细胞抗癌功能筛选,从中找到1—2个抗癌效果最好的小分子。结合药物化学结构改造,这些小分子就改造成了能强烈抑制乳腺癌细胞迁移的新型转化生长因子β受体Ⅰ抑制剂。 课题组把实验小鼠分为乳腺癌原位转移组、乳腺癌肺转移组和骨转移组3种转移模型,利用治疗和预防两种给药方案,把这种抑制剂用于3种不同的动物模型。实验结果均表明,该抑制剂几乎能完全抑制乳腺癌的体内转移,并且对实验动物没有毒性。 专家认为,该项研究发现了一类新型转化生长因子β受体Ⅰ抑制剂,从多个角度证明其具有良好的抑制肿瘤转移效果,尤其在多种肿瘤转移动物模型中得到了令人印象深刻的结果。(张惠虹 记者王春) 《科技日报》(2013-02-18 一版)
《自然》公布乳腺癌耐药性与FOXA1相关最近一期的生命科学前沿杂志《自然》公布了一项乳腺癌研究结果,结果显示,部分乳腺癌患者对常规乳腺癌标准激素治疗产生极强的耐药性,是因为雌激素受体在受到一种名为FOXAI蛋白质的干扰,在这种蛋白的感受下雌激素受体“工作路线”发生改变,导致雌激素受体与DNA链条上的基因结合紊乱,这一紊乱造成了乳腺癌激素治疗的耐受。 激素与乳腺癌的关系 ER影响基因引发连锁致癌 新桥医院肿瘤生物治疗中心的专家告诉我们雌激素作为一种生理性激素,一旦水平升高,会延长雌激素对乳腺上皮的刺激,改变体内内分泌环境,导致细胞恶变,从而造成乳腺癌发生。因此乳腺癌的发生、发展与雌激素密切相关。 1896年,Bentson就发现乳腺细胞的增生及癌变与激素密切相关,并观察到切除卵巢可使进展期乳腺癌消退。 1967年,Jensen发现人类乳腺癌细胞中含有雌激素受体(ER),这是一种能与基因结合的物质,通过与基因结合,从而改变基因的表达。 大多乳腺癌患者,由于雌激素受体(ER)影响DNA的正常表达,引发了癌症的连锁反应。这种不正常的受体与DNA的结合物随后移位到细胞核与成千上万的基因结合并激活它们,从而产生生物学效应,肿瘤生产的帕多啦从此被打开。 但在这个过程中部分细胞会保留正常的受体系统,肿瘤细胞含有激素受体的功能与正常细胞相似,该肿瘤细胞的生长,仍然依赖原来的激素环境调节,这类肿瘤称为激素依赖性肿瘤,临床上称为ER阳性肿瘤;相反,有些肿瘤在癌变过程中,其受体系统保留很少或完全丧失,不能再作为激素的靶细胞,其生长不再受激素的控制与调节,此乃非激素依赖性肿瘤。 新桥医院肿瘤细胞免疫治疗中心的专家说:临床上我们把这种肿瘤细胞内激素受体含量水平,作为乳腺癌内分泌治疗预后的指标,对于激素依赖性乳腺癌患者,内分泌治疗非常重要,临床中约有60%—70%的乳腺癌是“激素依赖性”,如雌激素受体(ER)阳性和孕激素受体(PR)阳性的乳腺癌被认为是激素依赖性肿瘤,此类复发转移乳腺癌患者内分泌治疗有效率可达30%—50%,早期术后患者接受内分泌治疗可以减少约二分之一的复发危险和三分之一的死亡危险。在内分泌治疗的同时结合自体免疫细胞治疗,可起到巩固内分泌治疗的作用。 FOXA1的研究 揭示乳腺癌耐受的根源 对FOXA1蛋白质的研究,这是一个很重要的研究课题,可能揭示一些激素依赖性乳腺癌患者为何产生耐药。 一般来说,雌激素受体会和基因组上固定的一些位点结合,从而产生生物学效应,一些药物就是抑制这种结合,达到治疗肿瘤的目的。而根据研究报告,在FOXA1蛋白的作用下,雌激素受体改变了“工作线路”,不再结合到常规的基因组位点上,而与其他基因组位点结合,这样就导致了原本针对性的药物作用降低甚至失去效应,导致药物无效。了解了这一原理,对乳腺癌用药具有指导意义。 从FOXA1入手 能够攻克乳腺癌 能否针对FOXA1蛋白,开发出特定的药物,改善乳腺癌治疗效果? 新桥医院肿瘤专家表示有这个可能,但需要一个过程。因为从细胞学研究到临床转化是一个长期的过程。但我们在这段过程中要时刻留意患者的耐受情况,发现耐受应迅速更换方案,寻求一种肿瘤标志物引导的更科学的生物治疗方案。
中医药可整体布局防乳腺癌转移 乳腺癌是最常见的恶性肿瘤之一,其发病率已居女性恶性肿瘤发病率的首位,严重威胁着妇女身体健康。目前,手术切除仍然是乳腺癌的主要治疗方法,但术后的并发症、复发或转移是威胁患者生存的主要原因,中医药扶正固本、祛邪,在术前、术中及术后的运用,在改善术后患者体力、调动机体抗病能力、减轻放化疗毒副反应、提高生活质量、控制肿瘤复发转移、延长生存期方面有着重要作用和独特优势。 在乳腺癌手术前给予患者中医药治疗,可改善机体一般状况,增强体质,调理因疾病引起的脏腑功能障碍,减轻手术对患者机体的损伤,有利于手术进行,对控制肿瘤的发展和潜在的转移及术后患者体质的恢复,有很好的帮助。 在乳腺癌手术中,由于麻醉、创伤出血等易导致机体耗气伤阴、气血两虚,中医常予益气滋阴、清热养血、健脾益气等方法治疗,使手术造成的损伤尽早康复,以利于接受其他治疗。 乳腺癌手术后,通过中药辅助治疗,可防止和减少复发、转移,延长生存时间。临床与实验研究初步证实,长期使用中药治疗可达到这一目的。扶正中药可以改善机体免疫功能,活血化瘀中药可降低血液黏度、血小板聚集,抑制肿瘤灶周围新生血管形成,使癌细胞不能集聚停留,增加了宿主细胞的杀灭机会。其他如对肿瘤基质降解酶、血小板黏附蛋白表达等的研究也显示了中药抗浸润、抗转移作用的可能性。 中医药防治乳腺癌转移是多步骤、多环节与多途径的整体防治,不同于西医仅是单环节的阻断某一个转移步骤或途径,相比之下,有着整体的优势和丰富的治疗途径。中药在抗乳腺癌复发转移方面首先表现在改变癌毒特性,最大限度杀灭癌毒;其次能整体调控,提高机体抗癌能力,又能改善病理瘀滞,阻断转移途径,是从肿瘤病因病理基础上起效。如对肝转移者,在化疗基础上,加用健脾益气、活血化瘀药物,通过扶正与祛邪结合,既有支持强壮作用,又有明显的抗癌效果,对提高乳腺癌患者的生存质量具有明显疗效,对化疗减毒亦有较好的作用。摘自人民网
新华社华盛顿7月6日电(记者任海军)据美国新一期《细胞-干细胞》杂志报道,加拿大研究人员对小鼠进行的研究显示,常用Ⅱ型糖尿病药物二甲双胍能促进脑细胞分裂及新细胞形成。这项研究表明,二甲双胍将来有望用于治疗阿尔茨海默氏症等疾病。 二甲双胍的主要靶点是糖尿病患者肝细胞内的一个特殊通道。加拿大分子遗传学家弗雷达·米勒等研究人员发现,二甲双胍也能激活实验鼠脑细胞中的同样通道,促进新的脑细胞生长。 对在实验室培养皿中培养的人类脑细胞而言,这一结论同样成立。米勒表示,新生的脑细胞能修复阿尔茨海默氏症等神经退行性疾病给大脑带来的不利影响。 2008年曾有研究显示,同时患糖尿病和阿尔茨海默氏症的人如果服用二甲双胍,其阿尔茨海默氏症的症状有所改善。当时科学家认为,其机制可能在于二甲双胍治疗糖尿病时改善了患者的身体状况,这有助于改善阿尔茨海默氏症症状。 米勒认为,他们的新研究表明,二甲双胍本身就有改善脑功能的作用。目前,加拿大研究人员已着手开展二甲双胍治疗神经退行性疾病的临床试验。 二甲双胍是一种具有长期用药安全记录的药品。此前曾有研究显示,二甲双胍可抑制肺部和乳腺肿瘤的生长,降低糖尿病患者患乳腺癌的风险。
肿瘤是指体内细胞的异常增生,可以是良性的或恶性的。良性肿瘤(例如息肉)生长缓慢且通常局限在一个区域,不会侵犯周围组织或扩散到其他部位。恶性肿瘤(即癌症)具有侵袭性,可以快速生长并通过血液或淋巴系统扩散到其他身体部位,形成远处转移。癌症是一种严重威胁人类健康和生命的疾病,2020年全球有1 930万新增癌症病例和1 000万癌症死亡病例,且我国癌症发病率和死亡率均位居全球第一[1]。最常见的癌症类型是乳腺癌、肺癌、结直肠癌和前列腺癌。因此,寻找新的抗肿瘤药物,阐明抗肿瘤药物的分子机制,是解决当前临床肿瘤治疗难点的有效策略。中药具有多种有效成分,因其不良反应低、多靶点、多通路等优点,已成为抗肿瘤药物开发的重要来源和研究热点[2]。目前,常规的肿瘤症治疗方法为手术、放射治疗和化学治疗等,但这些方法往往伴随着较大的不良反应和毒性,而且对某些难治性或复发性肿瘤效果不佳[3]。因此,寻找有效、低毒的抗肿瘤药物是当前临床研究的重要方向。 苍术是一种常用的中药材,分为茅苍术Atractylodes lancea (Thunb.) DC.和北苍术A. chinensis (DC.) Koidz.,分别来源于菊科植物茅苍术或北苍术的干燥根茎。苍术具有燥湿健脾、祛风散寒的功效,在《神农本草经》中列为上品[4]。近年来,苍术在抗微生物、抗炎、抗肿瘤、免疫调节、调节消化系统、心血管系统和神经系统等方面的药理作用受到了广泛关注。苍术中含有挥发油、多糖、倍半萜类、聚乙炔类等[5]多种化学成分。其中一些成分已经被证实具有抑制或杀伤多种肿瘤细胞的能力,其作用机制涉及诱导凋亡、抑制增殖、迁移、侵袭和转移,以及调控免疫功能等方面[6]。然而,苍术中的抗肿瘤活性成分及其作用机制尚未完全明确,需要进一步深入地探索和验证。本文通过整理国内外研究文献,对苍术活性成分、苍术与其他药物联合抗肿瘤及其分子机制进行总结,探讨苍术在抗肿瘤方面的应用规律和思路,为苍术资源的开发利用以及抗肿瘤临床疗法的研究提供理论参考。 1 苍术主要化学成分 茅苍术与北苍术化学成分相似,药理作用也较为相似,目前已从苍术中分离出多种化学成分,主要含有包括萜类、聚乙烯炔类、有机酸类、糖苷类化合物等[7-8]。苍术主要抗肿瘤化学成分,见图1。茅苍术与北苍术中主要化学成分如表1所示。 图片 图片 2 苍术的抗肿瘤机制 苍术中含有苍术内酯Ⅰ、Ⅱ、Ⅲ、苍术酮、β-桉叶醇和苍术素等有效成分,这些成分不仅可以抗炎、抗氧化、抗菌、保肝、降血糖,还可以抗肿瘤[14-15]。近年来,苍术及其有效成分对肿瘤的抑制作用受到了广泛的关注。研究发现,苍术有效成分对多种肿瘤细胞都有抑制作用,可以通过多种途径和机制影响肿瘤细胞的生长、迁移、侵袭和血管生成,诱导肿瘤细胞的凋亡和自噬,调节肿瘤微环境和免疫系统。 2.1 抑制肿瘤细胞增殖 肿瘤是由于细胞增殖失控而形成的一种疾病[16]。细胞周期是细胞增殖的基本过程,由细胞周期蛋白(cyclin,CCN)和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)复合物共同调控[17]。干预细胞周期是抑制肿瘤发展的有效策略之一[18]。Kotawong等[19]发现,苍术中的苍术素、苍术内酯I和β-桉叶醇等有效成分可以通过影响肿瘤细胞周期的不同阶段来抑制肿瘤细胞的增殖。这些成分可以通过抑制磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、磷酸化蛋白激酶B(protein kinase B,AKT)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路来诱导肿瘤细胞在G1期停滞;Yu等[20]发现苍术内酯I通过上调周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,p21)和下调cyclinB1、CDK1和细胞分裂周期25C蛋白(cell division cyclin25,Cdc25c)等关键分子来抑制肿瘤细胞在G2/M期的进入,在动物模型中,苍术内酯I可以显著抑制膀胱癌的生长,且无明显不良反应。Zhang等[21]实验发现苍术内酯Ⅱ可以通过改变结直肠癌细胞内的蛋白表达从而抑制结直肠癌细胞的增殖和活性,并且还显著增强了结直肠癌细胞的化疗敏感性。Pongsakorn等[22]发现,苍术提取物可以通过抑制细胞外信号调节激酶信号级联(ERK-signaling cascade,ERK)信号通路来抑制胆管癌细胞的增殖。ERK信号通路是一种重要的细胞内信号转导机制,参与调节细胞生长、分化和凋亡等过程。苍术提取物可以下调ERK及其下游分子的表达,从而抑制胆管癌细胞的生长和增殖,不同类型的胆管癌细胞对苍术提取物的敏感度不同,其中人胆管HuCCT-1癌细胞最为敏感。 2.2 诱导肿瘤细胞凋亡 细胞凋亡是一种程序性细胞死亡形式,它通过限制细胞的增殖和分化来维持组织稳态或去除潜在的有害细胞[23]。目前已知的细胞凋亡途径主要有3种,即外源性途径(死亡受体介导)、内源性途径(线粒体介导)和内质网途径。其中,线粒体途径是最重要的一种,它涉及线粒体外膜透化(outer mitochondrial membrane,MOMP)、细胞色素C释放和半胱天冬酶(cysteine aspartic acid protease,Caspase)激活[24]。多项研究发现,苍术酮可以通过降低线粒体膜电位、提高活性氧水平、抑制B细胞淋巴瘤-2基因(B-cell lymphoma-2,Bcl-2)表达、促进BCL2-相关X蛋白(BCL2-associated X protein,Bax)裂解和Caspase-3表达[25],以及下调PI3K/AKT/mTOR信号通路来诱导肿瘤细胞凋亡[26]。Narahara等[27]研究表明,β-桉叶醇和苍术内酯Ⅲ[27]可以通过增加Caspase-3、Caspase-8、Caspase-9和Bax等凋亡相关蛋白的表达、下调Bcl-2表达、释放细胞色素C和降低线粒体膜电位来诱导胆管癌细胞凋亡。此外,Li等[28]使用β-桉叶醇处理的白血病HL60细胞,发现β-桉叶醇可以通过激活c-JunN端激酶(c-Jun N-terminal kinase,JNK)丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来诱导白血病HL60细胞凋亡。Li等[29]研究发现,苍术素可以通过降低Bcl-2表达、激活p53肿瘤蛋白(p53 tumor protein,p53)、Bax和Caspase-3、-8、-9等凋亡因子来诱导人乳腺癌MCF-7细胞凋亡,并表现出浓度依赖的毒性效应。Li等[30]研究表明,苍术内酯I和苍术内酯Ⅱ[31]可以通过与对两面针激酶2(Janus kinase 2,JAK2)直接相互作用而负调节信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,从而抑制其活化,进而导致糖酵解的抑制和结肠、直肠癌细胞凋亡的诱导。 2.3 抑制肿瘤细胞转移 肿瘤细胞转移是指肿瘤细胞通过血液循环从原发部位转移到其他部位的过程,这是癌症治疗的难点,也是癌症死亡的主要原因[32]。上皮间质转化(epithelial-mesenchymal transition,EMT)是一种与癌症发生相关的细胞程序,它使癌细胞具有移动性、侵袭性和抗凋亡能力,从而促进转移。苍术的一些活性成分具有抑制肿瘤细胞转移的潜在作用,其机制可能涉及对EMT的调控[33]。Acharya等[34]研究发现,β-桉叶醇可以改变EMT相关标志物的表达,从而抑制结肠癌细胞的增殖、迁移和侵袭。同时它还可以影响PI3K、AKT、p38丝氨酸/苏氨酸蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路,以及肺癌细胞中的活性氧水平,从而降低癌细胞的黏附和迁移能力[35]。麦静愔等[36]发现苍术酮可以通过抑制EMT过程等途径抑制肿瘤细胞的迁移和侵袭能力,此外,苍术酮还可以通过下调基质金属蛋白酶(matrix metalloproteinase,MMP)的表达从而抑制肿瘤细胞的迁移和侵袭能力。MMP是一类能够降解细胞外基质(extracellular matrix,ECM)的锌依赖性内肽酶,在癌症进展中的作用与它们参与ECM降解以及黏附和细胞骨架蛋白、生长因子、趋化因子的调节和加工有关[37]。且有动物实验表明,苍术酮可以明显抑制肝癌生长,没有明显的毒性。Zhong等[38]在观察了苍术多糖在U-2 OS人骨肉瘤细胞中对内皮细胞选择素(endothelial cell selectin,E-Selectin)和路易斯X三糖(Lewis-X Trisaccharide,LacCer Lex)的影响,发现苍术多糖可通过降低U-2 OS细胞上的E-Selectin抑制U-2 OS细胞对人脐静脉内皮细胞HUVECs的黏附、迁移和侵袭。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在促进肿瘤转移中发挥重要作用,Zhang等[39]发现苍术内酯II可以有效抑制肿瘤细胞极化,从而抑制肺癌细胞在体内和体外的转移。铁死亡是一种新的细胞死亡模式,其特征是铁过载导致脂质过氧化而导致膜损伤,过度的铁死亡会影响肿瘤的转移,从而抑制肿瘤的进展[40]。He等[41]发现,苍术素可通过抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)和铁蛋白轻链(ferritin light chain,FTL)的表达,以及上调酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)和转铁蛋白受体(transferrin receptor,TFR1)的表达来诱导肝癌HCCM细胞的铁死亡。 2.4 诱导肿瘤细胞自噬 细胞自噬是一种分解代谢通路,能清除不必要的或功能失调的细胞成分并回收代谢底物[42]。目前已知有3种主要的细胞死亡方式:细胞凋亡(Ⅰ型)、自噬性细胞死亡(Ⅱ型)和坏死(Ⅲ型)。自噬性细胞死亡是指自噬过程中产生的自噬体过多或过大,导致细胞质溶解和细胞死亡。自噬体是由双层膜包裹的囊泡,内含被降解的细胞器和蛋白质。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬体形成的关键标志物,它以微管相关蛋白1A/1B-轻链3(microtubule-associated protein 1 light chain 3,LC3-I)和微管相关蛋白1轻链3的脂化形式(lipidated form of microtubule-associated protein 1 light chain 3,LC3-Ⅱ)2种形式存在,LC3-Ⅰ转化为LC3-Ⅱ是自噬体形成的必要步骤[43-44]。Li等[29]使用苍术素处理乳腺癌MCF-7细胞时发现,苍术素可以增加了LC3Ⅰ向其脂化形式的LC3Ⅱ的转化,并增加了苄氯素1(beclin-1,BECN1)的表达,下调了人乳腺癌MCF-7细胞中的p62蛋白(p62 protein,p62)表达,改变凋亡和自噬相关生物标志物。Acharya等[45]研究发现,苍术素通过调节PI3K、AKT、mTOR、p38MAPK信号通路的活性,可以诱导胆管癌HuCCT-1细胞发生自噬,并抑制其生长、迁移和侵袭,SB202190(p38MAPK诱导剂)和3-MA(p38MAPK抑制剂)分别显著增加和降低苍术素诱导的自噬速率。 2.5 抑制肿瘤血管生成 血管生成本身不会导致恶性肿瘤的形成,但可以为肿瘤的生长和转移提供条件。肿瘤在发展到一定阶段后,需要依赖新生血管来满足其对氧气和营养的增加的需求,以及排除代谢废物,因此,抑制血管生成是一种有效的抗肿瘤策略[46]。血红素加氧酶1(heme oxygenase 1,HO-1)是一种在肿瘤组织中高表达的酶,它可以促进肿瘤的血管生成和抗氧化应激,为肿瘤细胞提供生存优势。因此,抑制HO-1的表达或活性是治疗肿瘤的另一种有效策略之一。Mathema等[47]研究发现,苍术素可以抑制胆管癌CL6肿瘤细胞的集落形成和伤口愈合能力,其机制与抑制HO-1的表达、下调信号转导及转录激活蛋白1/3(signal transducer and activator of transcription 1/3,STAT1/3)和核因子κB(nuclear factor kappa-B,NF-κB)的信号通路有关。β-桉叶醇也具有抑制胆管癌细胞中HO-1的表达的能力,其机制与浓度依赖性地抑制STAT1/3和NF-κB信号通路有关[48]。β-桉叶醇还可以通过抑制生长因子信号通路中的环磷腺苷效应元件结合蛋白(cyclic-AMP response binding protein,CREB)激活来阻断血管生成,从而抑制肿瘤的发展[49]。Tsuneki等[50]有动物实验表明,β-桉叶醇可以通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)来刺激大鼠嗜铬细胞瘤细胞中的神经突生长,且β-桉叶醇还表现出了体外和体内的抗血管生成活性,其阻断了由碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)或血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中CREB蛋白的磷酸化,从而抑制bFGF刺激的HUVEC迁移和HUVEC在基质胶中的管形成。同时,它还能显著降低小鼠皮下植入的Matrigel栓塞和小鼠佐剂诱导的肉芽肿中的血管生成[51]。 2.6 免疫调节作用 随着肿瘤的发生和发展,或在接受化疗、放疗等治疗的过程中,肿瘤患者机体免疫力的显著下降。因此,调节或刺激机体免疫能力,可能是一种有效的主动抗癌策略。免疫治疗作为一种新型的抗癌手段,已经引起了广泛的关注和研究[52]。巨噬细胞是机体内重要的免疫细胞,在机体免疫中发挥着重要的作用[53]。Qin等[54]从苍术中分离得到两种多糖成分:中性多糖和酸性多糖。研究表明,酸性多糖能够显著地刺激小鼠单核巨噬细胞白血病细胞(RAW264.7)细胞的增殖、吞噬能力、NO产生和细胞因子分泌,并且呈现出剂量相关性,而中性多糖则相对较弱。此外,中性多糖和酸性多糖均能够激活淋巴结Peyers patch细胞中的T细胞,并促进集落刺激因子的产生。而酸性多糖也表现出比中性多糖更好的肠道免疫调节活性。吲哚胺-2,3-二氧化酶(indoleamine 2,3-dioxygenase,IDO)是一种通过犬嘌呤途径氧化分解色氨酸的限速酶,是抗肿瘤免疫治疗中小分子药物开发的潜在目标。IDO可在肿瘤微环境中通过与许多肿瘤相关的自发炎症和T细胞激活而被诱导。Liu等[55]研究发现,苍术内酯Ⅰ可以通过下调Toll样受体4/髓样分化蛋白2复合物(toll-like receptor 4/myeloid differentiation 2 complex,TLR4/MD-2)的表达,抑制人卵巢癌细胞(EOCSKOV3)中髓样分化主要反应蛋白88(myeloid differentiation primary response protein 88,MyD88)、NF-κB、Akt和IDO1的信号通路的活化,从而减少白细胞介素-6(interleukin-6,IL-6)、转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、VEGF和白细胞介素-17A(interleukin-17A,IL-17A)等促进肿瘤免疫逃逸的因子的分泌。同时,还可以降低调节性T细胞(Treg细胞)在肿瘤微环境中的比例,改善T淋巴细胞受到EOCSKOV3细胞上清液抑制而导致的增殖反应降低和抗肿瘤细胞毒性减弱。Liu等[56]研究发现,苍术内酯Ⅲ可以通过直接结合JAK3蛋白,从而抑制γ-干扰素(interferon gamma,IFN-γ)触发的JAK3/STAT3通路,从而达到抑制IDO激活的目的。 苍术抗肿瘤成分的潜在分子机制见图2。对苍术抗肿瘤有效成分及其抗肿瘤作用进行归纳总结,见表2。 图片 图片 3 联合用药 西医治疗肿瘤的常用手段有手术切除、药物化疗和高能射线放疗等,这些手段去除肿瘤西医的治疗方式更为直接,适合前期控制病情,化疗药物虽然能够杀死肿瘤细胞,但同时也伴有严重的副作用,影响患者的生活质量和治疗效果。中药具有不良反应小、安全性高的特点,因此中药与化疗药物的联合应用被广泛关注和探索[57]。 阿帕替尼是全球第一个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,明显延长生存期的单药。Zhou等[58] 分析了不同苍术多糖提取方法的影响。比较了热水浸提法、超声浸提法和酶浸提法提取苍术多糖的得率、总糖含量、相对分子质量分布、单糖组成、并测定苍术多糖与阿帕替尼的协同活性。结果发现其中超声浸提法表现出最强的协同作用。这也与超声浸提的苍术多糖相对分子质量小、β-构型高、半乳糖含量高的事实相一致。Srijiwangsa等[59]发现,β-桉叶醇可以通过抑制胆管癌细胞和细胞裂解物中的NAD(P)H醌氧化还原酶1[NAD(P)H quinonedehydrogenase 1,NQO1]的活性和蛋白表达,增强氟尿嘧啶和多柔比星对细胞迁移的细胞毒性活性和抑制活性。Mai等[60]将不同浓度的苍术内酯I、硼替佐米以及硼替佐米+苍术内酯I作用于U266细胞结果研究发现,苍术内酯可以调节JAK2/STAT3通路上的IL-6、JAK2、STAT3等基因表达抑制U266肿瘤细胞的增殖和促进其凋亡并呈剂量依赖性,并能与硼替佐米产生协同作用,当苍术内酯I与硼替佐米联合使用时,可显著增强对U266细胞增殖的抑制作用。 紫杉醇是第一个获得批准的草药衍生化疗药物[61]。并且作为一种已知的Toll受体4配体(toll-like receptor 4 ligand,TLR4),可激活TLR4/MyD88依赖性途径,该通路介导了上皮性卵巢癌的化学耐药性和肿瘤进展。苍术内酯I是一种新型TLR4拮抗剂,通过干扰紫杉醇与人白细胞膜TLR4的结合,来抑制TLR4信号传导。Huang等[62]研究发现苍术内酯-I可以减弱紫杉醇诱导的IL-6、VEGF和存活蛋白的蛋白表达,并增强MyD88(+)EOC人卵巢癌细胞的早期凋亡和生长抑制;苍术内酯I被发现更加亲和人髓样分化蛋白2(myeloid differentiation 2,MD-2)的疏水囊,并通过对接模拟与紫杉醇的结合位点部分重叠,这表明苍术内酯-I可能阻断MyD88(+)EOC细胞中MD-2介导的TLR4/MyD88依赖性紫杉醇信号传导。因此,苍术内酯-I可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高MyD88(+)EOC细胞对紫杉醇的反应。 结缔组织生长因子(connective Tissue Growth Factor,CTGF)是一种多功能信号调节剂,可通过调节细胞增殖、迁移、侵袭、耐药性和EMT来促进癌症的发生、进展和转移。CTGF还参与大多数节点的肿瘤微环境,包括血管生成、炎症和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)激活[63]。Wang等[64]研究发现,苍术内酯-I可以下调三阴性乳腺癌细胞中CTGF的表达和分泌。除了通过CTGF抑制三阴性乳腺癌细胞迁移外,苍术内酯-I还下调了成纤维细胞中CTGF的表达,降低了乳腺癌细胞将成纤维细胞转化为CAFs的能力,从而增加了三阴性乳腺癌细胞对紫杉醇的敏感性。在小鼠肿瘤模型中,发现苍术内酯-I治疗可以增强紫杉醇对肿瘤的化疗作用,减少肿瘤向肺和肝的转移。在用苍术内酯-I与紫杉醇联合治疗的小鼠中,源自接种肿瘤的原代培养的成纤维细胞表达相对较低水平的CAFs标志物。 研究表明了苍术内酯-I可以通过阻断CTGF表达和成纤维细胞活化来使三阴性乳腺癌细胞对紫杉醇敏感,还可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高肿瘤细胞对紫杉醇的反应并。这些机制有助于未来研究以确定苍术内酯I在临床环境中的价值。对苍术化学成分联合治疗归纳总结,见表3。 图片 4 结语与展望 苍术中含有多种抗肿瘤成分,其中多为倍半萜类成分,如苍术酮、苍术素和苍术内酯等,这些成分多是通过调控PI3K/Akt/mTOR通路来发挥抗肿瘤的作用,但作用靶点与方式却各不相同。例如苍术内酯主要通过降低Akt的磷酸化水平、上调Bax和Bad蛋白表达、增加脂质磷酸酶(PTEN)活性来抑制该通路进而诱导肿瘤细胞凋亡[20];β-桉叶醇能通过激活p27抑制cyclinD1和CDK4蛋白表达最终导致细胞周期停滞于G1期[19]。这些成分通过多途径、多靶点影响肿瘤细胞的生存、运动、代谢和迁移进而共同发挥抗肿瘤作用。正因为其作用机制的不同,使其各有效成分对不同肿瘤的作用具有一定特异性。因此苍术抗肿瘤活性成分联合化疗药物减副增效在科学研究及临床用药时可根据其作用机制进行选择。目前关于苍术化合物对肿瘤细胞的研究还存在一些不足之处,如缺乏对不同肿瘤细胞类型和不同剂量的系统比较、缺乏对苍术化合物与其他药物或放化疗的协同作用的评价,以及缺乏对苍术化合物在体内代谢和药效学的深入分析等。 因此,今后还需要加强对苍术化合物抗肿瘤作用的基础和临床研究。后续可以根据苍术有效成分的抗肿瘤作用机制,筛选出具有最强抗肿瘤活性和最低毒性的化合物,作为候选药物进行进一步的优化和改造,提高其药效和安全性;分析苍术中有效成分的药代动力学特征,研究其在体内的吸收、分布、代谢和排泄等过程,确定其最佳的给药途径、剂量和方案,减少其不良反应和药物相互作用;根据苍术中有效成分的药效学特征,研究其对不同类型、分期和分子标志物的肿瘤细胞的作用差异,确定其最适合的治疗对象和指标,提高其个体化和精准化的治疗效果;根据苍术有效成分的协同增效或拮抗作用,探索其与其他抗癌药物或放化疗的联合应用,实现其对肿瘤细胞的多靶点、多途径和多机制的综合干预,增强其抗肿瘤效能和克服肿瘤耐药性,以期为开发新型的抗肿瘤药物提供更多的选择和可能性。 苍术与化疗药物的联合应用被广泛关注和探索。作为苍术的主要成分,现有研究已表明倍半萜类具有显著的抗肿瘤活性,其与化疗药物的联合临床用药有着巨大的潜力。但倍半萜类化合物分子结构中含有多个疏水基团,导致它们的极性较低,难以与水分子形成氢键或静电相互作用,在水中的溶解度小、生物利用度低。随着现代药物研究技术的现代化和多学科的交叉融合,这些问题也可以通过引入基团、采用纳米技术制备纳米载体、采用共晶技术制备倍半萜类化合物的共晶体等方式来提高其水溶性,进而增强其生物利用度。这些技术在药物化学领域已比较成熟,也已逐步应用于临床药物的开发。例如,抗疟活性药物青蒿素同样具有水溶性差应用困难的问题,通过引入羧酸基团,显著提高了其水溶性和生物利用度[65-66]; 此外,共晶体可以改变倍半萜类化合物的晶型和晶格参数,从而降低其结晶度和熔点,增加其自由能和溶解度[67]。苍术内酯也可通过与尼可替尼(一种具有较高水溶性的抗肿瘤药物)制备共晶体,可以显著提高其水溶性。因此,苍术抗肿瘤有效成分和化疗药物的联合用药在临床环境中的开发和应用具有很高的研究价值。 苍术作为中医临床常用的化湿药。其药性辛、苦、温,归脾、胃、肝经,其苦温燥湿,可以去湿浊、辛温健脾以和脾胃,多用于湿
肿瘤是指体内细胞的异常增生,可以是良性的或恶性的。良性肿瘤(例如息肉)生长缓慢且通常局限在一个区域,不会侵犯周围组织或扩散到其他部位。恶性肿瘤(即癌症)具有侵袭性,可以快速生长并通过血液或淋巴系统扩散到其他身体部位,形成远处转移。癌症是一种严重威胁人类健康和生命的疾病,2020年全球有1 930万新增癌症病例和1 000万癌症死亡病例,且我国癌症发病率和死亡率均位居全球第一[1]。最常见的癌症类型是乳腺癌、肺癌、结直肠癌和前列腺癌。因此,寻找新的抗肿瘤药物,阐明抗肿瘤药物的分子机制,是解决当前临床肿瘤治疗难点的有效策略。中药具有多种有效成分,因其不良反应低、多靶点、多通路等优点,已成为抗肿瘤药物开发的重要来源和研究热点[2]。目前,常规的肿瘤症治疗方法为手术、放射治疗和化学治疗等,但这些方法往往伴随着较大的不良反应和毒性,而且对某些难治性或复发性肿瘤效果不佳[3]。因此,寻找有效、低毒的抗肿瘤药物是当前临床研究的重要方向。 苍术是一种常用的中药材,分为茅苍术Atractylodes lancea (Thunb.) DC.和北苍术A. chinensis (DC.) Koidz.,分别来源于菊科植物茅苍术或北苍术的干燥根茎。苍术具有燥湿健脾、祛风散寒的功效,在《神农本草经》中列为上品[4]。近年来,苍术在抗微生物、抗炎、抗肿瘤、免疫调节、调节消化系统、心血管系统和神经系统等方面的药理作用受到了广泛关注。苍术中含有挥发油、多糖、倍半萜类、聚乙炔类等[5]多种化学成分。其中一些成分已经被证实具有抑制或杀伤多种肿瘤细胞的能力,其作用机制涉及诱导凋亡、抑制增殖、迁移、侵袭和转移,以及调控免疫功能等方面[6]。然而,苍术中的抗肿瘤活性成分及其作用机制尚未完全明确,需要进一步深入地探索和验证。本文通过整理国内外研究文献,对苍术活性成分、苍术与其他药物联合抗肿瘤及其分子机制进行总结,探讨苍术在抗肿瘤方面的应用规律和思路,为苍术资源的开发利用以及抗肿瘤临床疗法的研究提供理论参考。 1 苍术主要化学成分 茅苍术与北苍术化学成分相似,药理作用也较为相似,目前已从苍术中分离出多种化学成分,主要含有包括萜类、聚乙烯炔类、有机酸类、糖苷类化合物等[7-8]。苍术主要抗肿瘤化学成分,见图1。茅苍术与北苍术中主要化学成分如表1所示。 图片 图片 2 苍术的抗肿瘤机制 苍术中含有苍术内酯Ⅰ、Ⅱ、Ⅲ、苍术酮、β-桉叶醇和苍术素等有效成分,这些成分不仅可以抗炎、抗氧化、抗菌、保肝、降血糖,还可以抗肿瘤[14-15]。近年来,苍术及其有效成分对肿瘤的抑制作用受到了广泛的关注。研究发现,苍术有效成分对多种肿瘤细胞都有抑制作用,可以通过多种途径和机制影响肿瘤细胞的生长、迁移、侵袭和血管生成,诱导肿瘤细胞的凋亡和自噬,调节肿瘤微环境和免疫系统。 2.1 抑制肿瘤细胞增殖 肿瘤是由于细胞增殖失控而形成的一种疾病[16]。细胞周期是细胞增殖的基本过程,由细胞周期蛋白(cyclin,CCN)和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)复合物共同调控[17]。干预细胞周期是抑制肿瘤发展的有效策略之一[18]。Kotawong等[19]发现,苍术中的苍术素、苍术内酯I和β-桉叶醇等有效成分可以通过影响肿瘤细胞周期的不同阶段来抑制肿瘤细胞的增殖。这些成分可以通过抑制磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、磷酸化蛋白激酶B(protein kinase B,AKT)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路来诱导肿瘤细胞在G1期停滞;Yu等[20]发现苍术内酯I通过上调周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,p21)和下调cyclinB1、CDK1和细胞分裂周期25C蛋白(cell division cyclin25,Cdc25c)等关键分子来抑制肿瘤细胞在G2/M期的进入,在动物模型中,苍术内酯I可以显著抑制膀胱癌的生长,且无明显不良反应。Zhang等[21]实验发现苍术内酯Ⅱ可以通过改变结直肠癌细胞内的蛋白表达从而抑制结直肠癌细胞的增殖和活性,并且还显著增强了结直肠癌细胞的化疗敏感性。Pongsakorn等[22]发现,苍术提取物可以通过抑制细胞外信号调节激酶信号级联(ERK-signaling cascade,ERK)信号通路来抑制胆管癌细胞的增殖。ERK信号通路是一种重要的细胞内信号转导机制,参与调节细胞生长、分化和凋亡等过程。苍术提取物可以下调ERK及其下游分子的表达,从而抑制胆管癌细胞的生长和增殖,不同类型的胆管癌细胞对苍术提取物的敏感度不同,其中人胆管HuCCT-1癌细胞最为敏感。 2.2 诱导肿瘤细胞凋亡 细胞凋亡是一种程序性细胞死亡形式,它通过限制细胞的增殖和分化来维持组织稳态或去除潜在的有害细胞[23]。目前已知的细胞凋亡途径主要有3种,即外源性途径(死亡受体介导)、内源性途径(线粒体介导)和内质网途径。其中,线粒体途径是最重要的一种,它涉及线粒体外膜透化(outer mitochondrial membrane,MOMP)、细胞色素C释放和半胱天冬酶(cysteine aspartic acid protease,Caspase)激活[24]。多项研究发现,苍术酮可以通过降低线粒体膜电位、提高活性氧水平、抑制B细胞淋巴瘤-2基因(B-cell lymphoma-2,Bcl-2)表达、促进BCL2-相关X蛋白(BCL2-associated X protein,Bax)裂解和Caspase-3表达[25],以及下调PI3K/AKT/mTOR信号通路来诱导肿瘤细胞凋亡[26]。Narahara等[27]研究表明,β-桉叶醇和苍术内酯Ⅲ[27]可以通过增加Caspase-3、Caspase-8、Caspase-9和Bax等凋亡相关蛋白的表达、下调Bcl-2表达、释放细胞色素C和降低线粒体膜电位来诱导胆管癌细胞凋亡。此外,Li等[28]使用β-桉叶醇处理的白血病HL60细胞,发现β-桉叶醇可以通过激活c-JunN端激酶(c-Jun N-terminal kinase,JNK)丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来诱导白血病HL60细胞凋亡。Li等[29]研究发现,苍术素可以通过降低Bcl-2表达、激活p53肿瘤蛋白(p53 tumor protein,p53)、Bax和Caspase-3、-8、-9等凋亡因子来诱导人乳腺癌MCF-7细胞凋亡,并表现出浓度依赖的毒性效应。Li等[30]研究表明,苍术内酯I和苍术内酯Ⅱ[31]可以通过与对两面针激酶2(Janus kinase 2,JAK2)直接相互作用而负调节信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,从而抑制其活化,进而导致糖酵解的抑制和结肠、直肠癌细胞凋亡的诱导。 2.3 抑制肿瘤细胞转移 肿瘤细胞转移是指肿瘤细胞通过血液循环从原发部位转移到其他部位的过程,这是癌症治疗的难点,也是癌症死亡的主要原因[32]。上皮间质转化(epithelial-mesenchymal transition,EMT)是一种与癌症发生相关的细胞程序,它使癌细胞具有移动性、侵袭性和抗凋亡能力,从而促进转移。苍术的一些活性成分具有抑制肿瘤细胞转移的潜在作用,其机制可能涉及对EMT的调控[33]。Acharya等[34]研究发现,β-桉叶醇可以改变EMT相关标志物的表达,从而抑制结肠癌细胞的增殖、迁移和侵袭。同时它还可以影响PI3K、AKT、p38丝氨酸/苏氨酸蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路,以及肺癌细胞中的活性氧水平,从而降低癌细胞的黏附和迁移能力[35]。麦静愔等[36]发现苍术酮可以通过抑制EMT过程等途径抑制肿瘤细胞的迁移和侵袭能力,此外,苍术酮还可以通过下调基质金属蛋白酶(matrix metalloproteinase,MMP)的表达从而抑制肿瘤细胞的迁移和侵袭能力。MMP是一类能够降解细胞外基质(extracellular matrix,ECM)的锌依赖性内肽酶,在癌症进展中的作用与它们参与ECM降解以及黏附和细胞骨架蛋白、生长因子、趋化因子的调节和加工有关[37]。且有动物实验表明,苍术酮可以明显抑制肝癌生长,没有明显的毒性。Zhong等[38]在观察了苍术多糖在U-2 OS人骨肉瘤细胞中对内皮细胞选择素(endothelial cell selectin,E-Selectin)和路易斯X三糖(Lewis-X Trisaccharide,LacCer Lex)的影响,发现苍术多糖可通过降低U-2 OS细胞上的E-Selectin抑制U-2 OS细胞对人脐静脉内皮细胞HUVECs的黏附、迁移和侵袭。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在促进肿瘤转移中发挥重要作用,Zhang等[39]发现苍术内酯II可以有效抑制肿瘤细胞极化,从而抑制肺癌细胞在体内和体外的转移。铁死亡是一种新的细胞死亡模式,其特征是铁过载导致脂质过氧化而导致膜损伤,过度的铁死亡会影响肿瘤的转移,从而抑制肿瘤的进展[40]。He等[41]发现,苍术素可通过抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)和铁蛋白轻链(ferritin light chain,FTL)的表达,以及上调酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)和转铁蛋白受体(transferrin receptor,TFR1)的表达来诱导肝癌HCCM细胞的铁死亡。 2.4 诱导肿瘤细胞自噬 细胞自噬是一种分解代谢通路,能清除不必要的或功能失调的细胞成分并回收代谢底物[42]。目前已知有3种主要的细胞死亡方式:细胞凋亡(Ⅰ型)、自噬性细胞死亡(Ⅱ型)和坏死(Ⅲ型)。自噬性细胞死亡是指自噬过程中产生的自噬体过多或过大,导致细胞质溶解和细胞死亡。自噬体是由双层膜包裹的囊泡,内含被降解的细胞器和蛋白质。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬体形成的关键标志物,它以微管相关蛋白1A/1B-轻链3(microtubule-associated protein 1 light chain 3,LC3-I)和微管相关蛋白1轻链3的脂化形式(lipidated form of microtubule-associated protein 1 light chain 3,LC3-Ⅱ)2种形式存在,LC3-Ⅰ转化为LC3-Ⅱ是自噬体形成的必要步骤[43-44]。Li等[29]使用苍术素处理乳腺癌MCF-7细胞时发现,苍术素可以增加了LC3Ⅰ向其脂化形式的LC3Ⅱ的转化,并增加了苄氯素1(beclin-1,BECN1)的表达,下调了人乳腺癌MCF-7细胞中的p62蛋白(p62 protein,p62)表达,改变凋亡和自噬相关生物标志物。Acharya等[45]研究发现,苍术素通过调节PI3K、AKT、mTOR、p38MAPK信号通路的活性,可以诱导胆管癌HuCCT-1细胞发生自噬,并抑制其生长、迁移和侵袭,SB202190(p38MAPK诱导剂)和3-MA(p38MAPK抑制剂)分别显著增加和降低苍术素诱导的自噬速率。 2.5 抑制肿瘤血管生成 血管生成本身不会导致恶性肿瘤的形成,但可以为肿瘤的生长和转移提供条件。肿瘤在发展到一定阶段后,需要依赖新生血管来满足其对氧气和营养的增加的需求,以及排除代谢废物,因此,抑制血管生成是一种有效的抗肿瘤策略[46]。血红素加氧酶1(heme oxygenase 1,HO-1)是一种在肿瘤组织中高表达的酶,它可以促进肿瘤的血管生成和抗氧化应激,为肿瘤细胞提供生存优势。因此,抑制HO-1的表达或活性是治疗肿瘤的另一种有效策略之一。Mathema等[47]研究发现,苍术素可以抑制胆管癌CL6肿瘤细胞的集落形成和伤口愈合能力,其机制与抑制HO-1的表达、下调信号转导及转录激活蛋白1/3(signal transducer and activator of transcription 1/3,STAT1/3)和核因子κB(nuclear factor kappa-B,NF-κB)的信号通路有关。β-桉叶醇也具有抑制胆管癌细胞中HO-1的表达的能力,其机制与浓度依赖性地抑制STAT1/3和NF-κB信号通路有关[48]。β-桉叶醇还可以通过抑制生长因子信号通路中的环磷腺苷效应元件结合蛋白(cyclic-AMP response binding protein,CREB)激活来阻断血管生成,从而抑制肿瘤的发展[49]。Tsuneki等[50]有动物实验表明,β-桉叶醇可以通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)来刺激大鼠嗜铬细胞瘤细胞中的神经突生长,且β-桉叶醇还表现出了体外和体内的抗血管生成活性,其阻断了由碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)或血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中CREB蛋白的磷酸化,从而抑制bFGF刺激的HUVEC迁移和HUVEC在基质胶中的管形成。同时,它还能显著降低小鼠皮下植入的Matrigel栓塞和小鼠佐剂诱导的肉芽肿中的血管生成[51]。 2.6 免疫调节作用 随着肿瘤的发生和发展,或在接受化疗、放疗等治疗的过程中,肿瘤患者机体免疫力的显著下降。因此,调节或刺激机体免疫能力,可能是一种有效的主动抗癌策略。免疫治疗作为一种新型的抗癌手段,已经引起了广泛的关注和研究[52]。巨噬细胞是机体内重要的免疫细胞,在机体免疫中发挥着重要的作用[53]。Qin等[54]从苍术中分离得到两种多糖成分:中性多糖和酸性多糖。研究表明,酸性多糖能够显著地刺激小鼠单核巨噬细胞白血病细胞(RAW264.7)细胞的增殖、吞噬能力、NO产生和细胞因子分泌,并且呈现出剂量相关性,而中性多糖则相对较弱。此外,中性多糖和酸性多糖均能够激活淋巴结Peyers patch细胞中的T细胞,并促进集落刺激因子的产生。而酸性多糖也表现出比中性多糖更好的肠道免疫调节活性。吲哚胺-2,3-二氧化酶(indoleamine 2,3-dioxygenase,IDO)是一种通过犬嘌呤途径氧化分解色氨酸的限速酶,是抗肿瘤免疫治疗中小分子药物开发的潜在目标。IDO可在肿瘤微环境中通过与许多肿瘤相关的自发炎症和T细胞激活而被诱导。Liu等[55]研究发现,苍术内酯Ⅰ可以通过下调Toll样受体4/髓样分化蛋白2复合物(toll-like receptor 4/myeloid differentiation 2 complex,TLR4/MD-2)的表达,抑制人卵巢癌细胞(EOCSKOV3)中髓样分化主要反应蛋白88(myeloid differentiation primary response protein 88,MyD88)、NF-κB、Akt和IDO1的信号通路的活化,从而减少白细胞介素-6(interleukin-6,IL-6)、转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、VEGF和白细胞介素-17A(interleukin-17A,IL-17A)等促进肿瘤免疫逃逸的因子的分泌。同时,还可以降低调节性T细胞(Treg细胞)在肿瘤微环境中的比例,改善T淋巴细胞受到EOCSKOV3细胞上清液抑制而导致的增殖反应降低和抗肿瘤细胞毒性减弱。Liu等[56]研究发现,苍术内酯Ⅲ可以通过直接结合JAK3蛋白,从而抑制γ-干扰素(interferon gamma,IFN-γ)触发的JAK3/STAT3通路,从而达到抑制IDO激活的目的。 苍术抗肿瘤成分的潜在分子机制见图2。对苍术抗肿瘤有效成分及其抗肿瘤作用进行归纳总结,见表2。 图片 图片 3 联合用药 西医治疗肿瘤的常用手段有手术切除、药物化疗和高能射线放疗等,这些手段去除肿瘤西医的治疗方式更为直接,适合前期控制病情,化疗药物虽然能够杀死肿瘤细胞,但同时也伴有严重的副作用,影响患者的生活质量和治疗效果。中药具有不良反应小、安全性高的特点,因此中药与化疗药物的联合应用被广泛关注和探索[57]。 阿帕替尼是全球第一个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,明显延长生存期的单药。Zhou等[58] 分析了不同苍术多糖提取方法的影响。比较了热水浸提法、超声浸提法和酶浸提法提取苍术多糖的得率、总糖含量、相对分子质量分布、单糖组成、并测定苍术多糖与阿帕替尼的协同活性。结果发现其中超声浸提法表现出最强的协同作用。这也与超声浸提的苍术多糖相对分子质量小、β-构型高、半乳糖含量高的事实相一致。Srijiwangsa等[59]发现,β-桉叶醇可以通过抑制胆管癌细胞和细胞裂解物中的NAD(P)H醌氧化还原酶1[NAD(P)H quinonedehydrogenase 1,NQO1]的活性和蛋白表达,增强氟尿嘧啶和多柔比星对细胞迁移的细胞毒性活性和抑制活性。Mai等[60]将不同浓度的苍术内酯I、硼替佐米以及硼替佐米+苍术内酯I作用于U266细胞结果研究发现,苍术内酯可以调节JAK2/STAT3通路上的IL-6、JAK2、STAT3等基因表达抑制U266肿瘤细胞的增殖和促进其凋亡并呈剂量依赖性,并能与硼替佐米产生协同作用,当苍术内酯I与硼替佐米联合使用时,可显著增强对U266细胞增殖的抑制作用。 紫杉醇是第一个获得批准的草药衍生化疗药物[61]。并且作为一种已知的Toll受体4配体(toll-like receptor 4 ligand,TLR4),可激活TLR4/MyD88依赖性途径,该通路介导了上皮性卵巢癌的化学耐药性和肿瘤进展。苍术内酯I是一种新型TLR4拮抗剂,通过干扰紫杉醇与人白细胞膜TLR4的结合,来抑制TLR4信号传导。Huang等[62]研究发现苍术内酯-I可以减弱紫杉醇诱导的IL-6、VEGF和存活蛋白的蛋白表达,并增强MyD88(+)EOC人卵巢癌细胞的早期凋亡和生长抑制;苍术内酯I被发现更加亲和人髓样分化蛋白2(myeloid differentiation 2,MD-2)的疏水囊,并通过对接模拟与紫杉醇的结合位点部分重叠,这表明苍术内酯-I可能阻断MyD88(+)EOC细胞中MD-2介导的TLR4/MyD88依赖性紫杉醇信号传导。因此,苍术内酯-I可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高MyD88(+)EOC细胞对紫杉醇的反应。 结缔组织生长因子(connective Tissue Growth Factor,CTGF)是一种多功能信号调节剂,可通过调节细胞增殖、迁移、侵袭、耐药性和EMT来促进癌症的发生、进展和转移。CTGF还参与大多数节点的肿瘤微环境,包括血管生成、炎症和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)激活[63]。Wang等[64]研究发现,苍术内酯-I可以下调三阴性乳腺癌细胞中CTGF的表达和分泌。除了通过CTGF抑制三阴性乳腺癌细胞迁移外,苍术内酯-I还下调了成纤维细胞中CTGF的表达,降低了乳腺癌细胞将成纤维细胞转化为CAFs的能力,从而增加了三阴性乳腺癌细胞对紫杉醇的敏感性。在小鼠肿瘤模型中,发现苍术内酯-I治疗可以增强紫杉醇对肿瘤的化疗作用,减少肿瘤向肺和肝的转移。在用苍术内酯-I与紫杉醇联合治疗的小鼠中,源自接种肿瘤的原代培养的成纤维细胞表达相对较低水平的CAFs标志物。 研究表明了苍术内酯-I可以通过阻断CTGF表达和成纤维细胞活化来使三阴性乳腺癌细胞对紫杉醇敏感,还可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高肿瘤细胞对紫杉醇的反应并。这些机制有助于未来研究以确定苍术内酯I在临床环境中的价值。对苍术化学成分联合治疗归纳总结,见表3。 图片 4 结语与展望 苍术中含有多种抗肿瘤成分,其中多为倍半萜类成分,如苍术酮、苍术素和苍术内酯等,这些成分多是通过调控PI3K/Akt/mTOR通路来发挥抗肿瘤的作用,但作用靶点与方式却各不相同。例如苍术内酯主要通过降低Akt的磷酸化水平、上调Bax和Bad蛋白表达、增加脂质磷酸酶(PTEN)活性来抑制该通路进而诱导肿瘤细胞凋亡[20];β-桉叶醇能通过激活p27抑制cyclinD1和CDK4蛋白表达最终导致细胞周期停滞于G1期[19]。这些成分通过多途径、多靶点影响肿瘤细胞的生存、运动、代谢和迁移进而共同发挥抗肿瘤作用。正因为其作用机制的不同,使其各有效成分对不同肿瘤的作用具有一定特异性。因此苍术抗肿瘤活性成分联合化疗药物减副增效在科学研究及临床用药时可根据其作用机制进行选择。目前关于苍术化合物对肿瘤细胞的研究还存在一些不足之处,如缺乏对不同肿瘤细胞类型和不同剂量的系统比较、缺乏对苍术化合物与其他药物或放化疗的协同作用的评价,以及缺乏对苍术化合物在体内代谢和药效学的深入分析等。 因此,今后还需要加强对苍术化合物抗肿瘤作用的基础和临床研究。后续可以根据苍术有效成分的抗肿瘤作用机制,筛选出具有最强抗肿瘤活性和最低毒性的化合物,作为候选药物进行进一步的优化和改造,提高其药效和安全性;分析苍术中有效成分的药代动力学特征,研究其在体内的吸收、分布、代谢和排泄等过程,确定其最佳的给药途径、剂量和方案,减少其不良反应和药物相互作用;根据苍术中有效成分的药效学特征,研究其对不同类型、分期和分子标志物的肿瘤细胞的作用差异,确定其最适合的治疗对象和指标,提高其个体化和精准化的治疗效果;根据苍术有效成分的协同增效或拮抗作用,探索其与其他抗癌药物或放化疗的联合应用,实现其对肿瘤细胞的多靶点、多途径和多机制的综合干预,增强其抗肿瘤效能和克服肿瘤耐药性,以期为开发新型的抗肿瘤药物提供更多的选择和可能性。 苍术与化疗药物的联合应用被广泛关注和探索。作为苍术的主要成分,现有研究已表明倍半萜类具有显著的抗肿瘤活性,其与化疗药物的联合临床用药有着巨大的潜力。但倍半萜类化合物分子结构中含有多个疏水基团,导致它们的极性较低,难以与水分子形成氢键或静电相互作用,在水中的溶解度小、生物利用度低。随着现代药物研究技术的现代化和多学科的交叉融合,这些问题也可以通过引入基团、采用纳米技术制备纳米载体、采用共晶技术制备倍半萜类化合物的共晶体等方式来提高其水溶性,进而增强其生物利用度。这些技术在药物化学领域已比较成熟,也已逐步应用于临床药物的开发。例如,抗疟活性药物青蒿素同样具有水溶性差应用困难的问题,通过引入羧酸基团,显著提高了其水溶性和生物利用度[65-66]; 此外,共晶体可以改变倍半萜类化合物的晶型和晶格参数,从而降低其结晶度和熔点,增加其自由能和溶解度[67]。苍术内酯也可通过与尼可替尼(一种具有较高水溶性的抗肿瘤药物)制备共晶体,可以显著提高其水溶性。因此,苍术抗肿瘤有效成分和化疗药物的联合用药在临床环境中的开发和应用具有很高的研究价值。 苍术作为中医临床常用的化湿药。其药性辛、苦、温,归脾、胃、肝经,其苦温燥湿,可以去湿浊、辛温健脾以和脾胃,多用
哺乳动物雷帕霉素靶蛋白(mTOR)是一种丝/苏氨酸蛋白激酶,于1991年被Heitman等研究啤酒酵母细胞突变体抵抗雷帕霉素毒性作用中发现并提出[1]。雷帕霉素是一种由大量蛋白质组成的大环内酯类药物,属于磷酸肌醇3-激酶相关蛋白激酶(PIKK)家族。mTOR与癌症有密切关系[2-3],mTOR信号转导通常参与调节细胞的存活、生长、代谢、蛋白质合成和自噬、稳态[4]。mTOR有两种不同的多蛋白复合物mTORC1、mTORC2。mTORC1对雷帕霉素敏感,激活参与mRNA翻译的p70S6激酶(p70S6K)和真核起始因子4E结合蛋白(4E-BP1)。mTORC2被认为对雷帕霉素有耐药性,通常对营养和能量信号不敏感[5]。mTORC1受磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)通路、Ras/Raf/MEK/ERK通路和其他细胞内因子等多种信号通路调节[4, 6]。目前对mTORC2的研究较少,有研究表明mTORC2通过磷酸化AGC激酶,包括Akt、蛋白激酶C(PKC)和血清/糖皮质激素调节激酶1(SGK-1)来发挥作用[7]。mTOR上游信号传导通路主要由PI3K/Akt等介导。mTOR下游信号通路为p70S6K、4E-BP1等,通过促进其翻译和蛋白质合成的磷酸化来介导[8]。目前许多mTOR抑制剂被开发用于癌症的治疗[9]。一些中药活性成分可以通过mTOR信号通路促进细胞凋亡和自噬性死亡、抑制细胞增殖,发挥抗肿瘤作用[10-11]。目前关于中药活性成分抑制mTOR信号通路的研究较多,根据结构不同可分为蒽醌类、生物碱类、萜类、多糖类、黄酮类、多酚类成分。本文总结了中药活性成分抑制mTOR通路抗肿瘤作用的研究进展,明确其作用机制,为临床应用提供参考。 1 蒽醌类成分 蒽醌类化合物是一类具有良好抗癌作用的三环类天然有机化合物,其中2个酮基位于中心环,这种三环双酮核心结构具有特定靶向作用。如通过不同的上游途径靶向自噬,包括Akt/mTOR轴等从而达到抑癌结果[12]。Zhang等[13]研究发现大黄酸诱导口腔癌细胞中的活性氧(ROS)积聚以抑制Akt/ mTOR信号传导通路,通过Akt/mTOR信号通路诱导口腔癌细胞凋亡和ROS在体内外发挥抗癌作用。另有研究发现大黄酸联合mTOR抑制剂依维莫司作用胃癌细胞MGC-803,可抑制p-磷脂酰肌醇3激酶(PI3K)、p-Akt和p-mTOR的表达发挥协同抗肿瘤作用[14]。此外,大黄酚与mTOR抑制剂雷帕霉素组合时,通过表皮生长因子受体(EGFR)/mTOR介导的信号转导途径显著阻断细胞增殖[15]。研究发现紫九牛总蒽醌通过下调p-Akt、p-mTOR蛋白的表达而抑制PI3K/Akt/mTOR信号通路活化抑制胃癌细胞SGC7901细胞的增殖、诱导凋亡、抑制迁移和侵袭的能力[16]。 2 生物碱类成分 生物碱含有环状结构,其中至少1个碱性氮原子被并入其中,广泛分布于豆科、防己科、毛茛科等植物中[17]。生物碱及其衍生物种类众多,具有相似环结构,经不同代谢途径合成的生物碱可能具有不同的药理活性。郝艳梅等[18]观察到苦参碱培养的人非小细胞肺癌A549细胞造成细胞萎缩、碎裂显著增加,可以观察到自噬液泡,在加入PI3K特异性抑制剂后发现可以减少p-Akt和p-mTOR的表达,诱导A549细胞自噬和凋亡增加,说明苦参碱通过抑制PI3K/Akt/mTOR通路实现。Zhang等[19]发现小檗碱可以通过PI3K/Akt通路逆转小鼠黑色素瘤B16细胞的上皮间质转化,起到参与治疗黑色素瘤的作用。另有研究发现,小檗碱通过PI3K/Akt/ mTOR途径调节人甲状腺未分化癌细胞的自噬和凋亡[20]。Li等[21]发现小檗碱抑制Notch 1通路导致PTEN表达增加,进而下调PI3K/Akt/mTOR通路,导致直肠癌细胞SW480细胞周期停滞和自噬发生,产生抑制肿瘤细胞增殖的作用。另外的研究中发现小檗碱可通过诱导结直肠癌细胞Ht-29、Sw-480和Hct-116凋亡和坏死来抑制细胞的增殖、迁移和侵袭,通过上调PTEN、下调PI3K、Akt和p-Akt的表达和抑制其下游靶点mTOR、p-mTOR来调节PI3K/Akt通路的活性[22]。苦参碱和小檗碱已经发挥出了抑制肺癌、甲状腺癌等的抑制作用,更多的生物碱类成分在mTOR信号通路的作用亟待被发现。 3 萜类成分 萜类化合物由异戊二烯或异戊烷单元以各种方式连接在一起,并具有不同类型的闭环、不饱和度和官能团,可分为单萜、倍半萜、二萜、三萜等,多样的结构为抗肿瘤药物的开发提供了较多的选择性[23]。Jang等[24]研究发现从泽泻分离的三萜类成分表现出抗肿瘤活性,如泽泻醇A、泽泻醇B、泽泻醇B 23-乙酸酯等。在1项研究中,乳腺癌MDA-MB-231细胞p-Akt、p-mTOR和p70 S6K的表达水平在泽泻醇A处理后显著下调,表明泽泻醇A可以抑制PI3K/Akt/mTOR信号传导[25]。同样在乳腺癌细胞MCF-7、雌激素受体阳性乳腺癌MCF-7细胞中,穿心莲内酯通过下调雌激素受体α(ERα)、PI3K和mTOR的表达水平抑制细胞增殖[26]。除以上萜类成分外,其他如白桦脂醇对转移性结直肠癌细胞的抗增殖作用[27]、柴胡皂苷A联合化疗药物促进前列腺癌细胞的死亡和缓解耐药[28]、银杏内酯抑制肝细胞癌[29]、土贝母皂苷甲诱导乳腺癌细胞自噬激活Akt活性化合物[30]、土贝母总皂苷抑制三阴性乳腺癌细胞MDA-MB-231细胞的增殖[31]均与各种mTOR相关信号通路的调控机制有关。以上研究表明中药活性成分单独应用或联合应用时可以作为治疗癌症的潜在Akt/mTOR抑制剂。 4 多糖类成分 中药多糖具有抗肿瘤、抗病毒、抗氧化等活性,可有效抑制肿瘤细胞增殖分化[32]。多糖的抗肿瘤活性与其一级结构、高级结构有关,其中每种因素对多糖的抗肿瘤活性都有不同程度的影响。Yao等[33]从枸杞多糖进一步提取和分离具有短肽骨架和复杂的分支聚糖部分的肽聚糖(LbGP),研究发现其能抑制癌细胞生长,还可以通过蛋白激酶A-cAMP反应元件结合蛋白(PKA-CREB)通路促进PER2的表达,而PER2抑制PI3K/Akt/mTOR通路负性调节固醇调节元件结合蛋白-1c(SREBP1c)的表达抑制胶质母细胞瘤中的脂质合成,从而抑制胶质母细胞瘤细胞增殖。研究者发现黄芪多糖抑制结直肠癌细胞HCT-116细胞和小鼠肿瘤组织中PI3K/Akt/ mTOR信号通路相关蛋白p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR的表达诱导自噬,从而减少肿瘤细胞的生长[34]。通过对宫颈癌U14荷瘤小鼠的实验研究提示半枝莲多糖可能通过抑制mTOR/p70S6K信号通路使凋亡基因Bcl-2表达减少,促进细胞凋亡,发挥抑瘤作用[35]。另有研究发现山慈菇多糖抑制肝癌腹水荷瘤小鼠肿瘤生长[36],黄芪多糖导致肿瘤细胞细胞程序性死亡-配体1(PD-L1)表达降低以增强化疗效果[37],这些也是通过mTOR信号通路调控自噬、免疫等达到的治疗目的。可见枸杞多糖、黄芪多糖、山慈菇多糖等中药多糖均可通过调控mTOR通路对肝癌、结直肠癌等肿瘤细胞有着体内、体外的抑制作用。 5 黄酮类成分 黄酮类化合物的基本母体是由2个具有酚羟基的苯环通过3个碳原子相互连接而成的C6-C3-C6单元[38]。抗肿瘤活性程度与各类黄酮母核结构差异、C-2,3位是否存在双键等的化学结构有密切关系[39]。异槲皮苷是存在于杨梅等植物中的黄酮类化合物,Shui等[40]发现使用异槲皮苷处理的人肝癌细胞HepG 2、Huh 7通过激活AMPK/mTOR/p70S6K途径触发自噬诱导细胞死亡,而异槲皮苷触发失调的自噬促进caspase依赖的凋亡性细胞死亡。小豆蔻素是从草豆蔻中分离得到的查耳酮,Jin等[41]研究发现小豆蔻素可以抑制三阴性乳腺癌细胞株MDA-MB-231的生长,是通过抑制mTOR/p70S6K通路从而在mRNA和蛋白水平抑制低氧诱导因子-1α(HIF-1α)的表达,进而增强线粒体氧化磷酸化,诱导ROS的积累达到抑癌作用的。更多研究如荔枝核总黄酮通过抑制Akt/mTOR等信号通路诱导前列腺癌细胞(PCa)凋亡,抑制PCa细胞的体内生长和体外增殖、转移[42]。异甘草素在体内和体外通过诱导自噬有效地抑制肝癌细胞的增殖,并诱导凋亡,可能通过PI3K/Akt/mTOR通路[43]。桑根醇L在前列腺癌细胞中抑制PI3K/Akt/mTOR信号传导诱导其凋亡[44]。羟基红花黄色素A通过抑制肝癌细胞PI3K/Akt/mTOR通路触发自噬反应抑制肿瘤细胞生长[45]。研究中发现异鼠李素可降低MAPK14的表达,抑制胃癌细胞HGC-27细胞的增殖和迁移,促进其细胞凋亡,进一步研究显示异鼠李素通过调节MAPK/mTOR信号通路抑制胃癌细胞增殖[46]。另有研究提示黄酮类化合物对肺癌、乳腺癌、结直肠癌等的抗癌作用中有着积极的表现[47]。以上结果说明黄酮类化合物可对抗恶性肿瘤的发生、发展,对应用于临床、解决实际问题有一定的潜力。 6 多酚类成分 多酚类是一类由1个或多个直接连接到芳族烃基的有机化合物。外界因素的诱导使多酚在原有的结构上经羟基化、甲氧基化、脱糖基化、单体聚合等结构修饰,从而发挥各种药效作用。经结构修饰后的多酚类成分往往具有更高生物活性、更好临床疗效[48-49]。在1项实验中发现芦荟素的使用抑制了肝细胞癌HepG2、Bel-7402细胞的增殖和侵袭,进一步研究发现其通过激活PI3K/Akt/mTOR途径诱导肝细胞癌的凋亡和自噬[50]。在另一项研究中发现芦荟素可抑制胃癌细胞HGC-27、BGC-823 GC细胞增殖和迁移,可能是通过抑制烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NOX2)的激活来抑制ROS的产生,从而抑制Akt/mTOR等信号通路的磷酸化[51]。Zhang等[52]发现毛兰素可能通过抑制PI3K/ Akt/mTOR通路实现诱导肺癌细胞凋亡、G2/M期阻滞,抑制其迁移和侵袭,在体内实验中减少肿瘤组织的血管比率、增加凋亡肿瘤细胞的数量、上调白细胞介素(IL)-2和肿瘤坏死因子-α(TNF-α)水平等对肿瘤细胞的积极抑制作用。此外,红景天苷通过PI3K/Akt/mTOR通路抑制胃癌生长,并诱导细胞凋亡和保护性自噬[53]。姜黄素通过抑制Akt/mTOR通路抑制肾癌细胞ACHN细胞活力,诱导凋亡和自噬[54],通过修饰关键基因和蛋白的表达下调PI3K/ Akt/mTOR信号通路抑制头颈肿瘤细胞的增殖[55],以及对雄激素依赖性和非依赖性前列腺癌的抑制作用[56]。白藜芦醇调节NGFR/AMPK/mTOR信号通路诱导肺癌细胞A549细胞自噬和凋亡[57]。仙鹤草素显著破坏线粒体功能,降低mTOR/HIF-1α通路蛋白表达,影响细胞内能量代谢,诱导胰腺癌细胞凋亡[58]。其他酚类如石斛酚[59]、6-姜烯酚[60]均可调节mTOR信号通路抑制癌细胞的增长。学者对于酚类化合物的研究较多,这为其尽早应用于临床提供了实验依据。 7 结语 mTOR是重要的信号传导通路,在癌细胞中被过度激活,使肿瘤细胞增殖,抑制该通路可以起到一定抗肿瘤作用。蒽醌类、生物碱类、萜类等中药活性成分可以通过抑制mTOR通路诱导肿瘤细胞凋亡、促进自噬、阻断细胞周期,逆转上皮间质转化等一系列抑癌作用对肺癌、胃癌、结直肠癌等肿瘤细胞起到治疗作用。中药活性成分抑制mTOR信号通路的国内外研究展现了其在改善患者生存质量,降低耐药、减少患者复发率等方面良好的前景。中药活性成分具有不良反应较小、抗肿瘤作用明显的优点,但也有不足之处,如中药靶向性差、生物利用度不足、消除速度快等。目前靶向mTOR信号通路作为先导化合物研发出高效、安全的中药抗肿瘤新药的研究还很欠缺,对此应该进行更深入的研究。不过随着相关领域的基础理论、实验和技术手段的不断更新,相信不久会将精准靶向mTOR信号通路的中药活性成分选出,并明确其作用机制,将基础实验结果推向临床应用。
生鲜乳中体细胞数(SomaticCellCount,简称SCC)反应生鲜乳卫生状况和奶牛乳房健康的状态。体细胞通常由巨噬细胞、淋巴细胞、脱落上皮细胞和中性白细胞等组成。当乳腺被感染或受机械损伤后,体细胞会上升,受感染乳区的乳汁中大约99%的细胞是白细胞。 1、高体细胞数对乳制品的影响主要有:(1)牛奶味道变异;(2)牛奶贮存期缩短;(3)乳清量增加、酪蛋白收缩性降低,导致奶酪的产量下降。 2、引发高体细胞数原因有:(1)可能有隐性乳腺炎发生 发生隐性乳腺炎时,感染牛很少有临床症状,肉眼观察乳汁正常,故常常误将感染乳区的乳作正常牛奶处理,造成生鲜牛奶中体细胞的升高。(2)牛群结构偏老 一般而言,胎次越小的牛只体细胞越低。因为老龄牛只长期接触乳腺炎病原菌,免疫功能下降,有更多的被感染机会。 3、降低生鲜乳中SCC,重点应从以下方面着手:(1)减少乳房机械性损伤。牛床、运动场、挤奶厅、饲槽、水槽等奶牛活动区域无尖锐物品,机械挤奶时不可过挤,以避免引起乳房损伤。(2)减少病原菌等生物侵袭。加强环境消毒,及时杀灭环境中的有害微生物。(3)日粮营养充足、均衡,提高机体抗感染能力。(4)定期(至少每月1次)进行牛群隐性乳房炎检测,及时进行乳房炎预防。(5)隔离患有传染性乳房炎的奶牛,淘汰患有慢性乳房炎的母牛等。
作者:丁香园网友Docofsoul《每日科学》2011年9月1日报道——由瑞士联邦理工学院(ETH)Yaakov Benenson教授与麻省理工Ron Weiss教授率领的研究小组成功地将生物“计算机”诊断网络导入人类细胞。该网络有识别某些肿瘤细胞的能力,利用五种肿瘤特异性分子因子的逻辑组合,进而触发肿瘤细胞毁灭过程。http://img1.jiansuo.net/cms/upload/userfiles/image/2011/09/04/1315042501_small.jpg细胞微机布线图:所有五种因子必须处于相应的正确状态,由此触发细胞死亡(图片来源:y Benenson Y. 教授 R. Weis教授)开发活体细胞内运作的生物电脑,是ETH苏黎世分院合成生物学教授Yaakov (Kobi) Benenson孜孜以求的目标,其职业生涯的大部分时间都倾注于此。他想建立既能侦测细胞生存状况、又能在细胞异常时对相应信息进行处理以提供合适的治疗响应的生物微机。目前,通过与麻省理工教授Ron Weiss以及团队成员(包括博士后学者Zhen Xie 与 Liliana Wroblewska、博士生Laura Prochazka)合作,他向这一目标迈出了重大一步。这一研究成果已发表于《Science》(见本文所附参考文献),论文介绍了一种多基因合成“电路”;此电路负责鉴别正常细胞与肿瘤细胞、继而进一步摧毁肿瘤细胞。其工作方式是:对细胞内五种肿瘤特异性分子因子及其出现频率进行抽样与综合;只有当所有这些因子在细胞内同时出现时,该电路才会作出正识别响应。这种方式使得侦测肿瘤的准确率非常高。研究者希望这一成果能够为高特异性抗癌治疗奠定基础。对肿瘤细胞的选择性破坏本研究对实验室培养的两种类型人类细胞进行了基因网络测试:海拉细胞(子宫颈癌细胞)与正常细胞。当基因生物微机被导入这两种不同的细胞类型时,只有海拉细胞被摧毁,而正常细胞则安然无恙。当然,取得这一结果需要做大量的基础工作。首先必须找出海拉细胞特有的分子组合。Benenson及其他小组成员在属于小RNA分子(MicroRNA或miRNA)这一类化合物的分子中找,终于确认其中一个miRNA组合(或者说“可识别属性”)只有海拉细胞才有,其它健康细胞类型内则不存在。发现这种可识别属性是一项颇具挑战性的任务。人体内既存在250种不同的健康细胞类型,此外也存在为数众多的肿瘤细胞的变异型(其中数百种可作实验室培养)。但miRNA多样性则更是不让须眉花样繁多,人类细胞中已得以描述的即达500到1000不同种类。Benenson指出:“每种健康或病损细胞类型都有其不同的miRNA分子处于开放或关闭状态。”可识别肿瘤属性中的五种因子确立一种miRNA“可识别属性”与发现一组症状以可靠诊断一种疾病有所不同。教授说:“一种症状,比如说发热吧,不可能由此概括出一种疾病。医生获得的信息越多,其诊断才越可靠。” 一年半前他从哈佛大学到ETH后,研究小组找到了几种因子,可由此可靠地将海拉细胞从所有其它健康细胞中鉴别出;结果表明,仅仅五种特定miRNA的组合(其中某些以高水平出现,某些则以极低水平出现)就足以将海拉细胞从其混迹的健康细胞中揪出来。与微机运作相似的网络Benenson介绍说:“这些miRNA因子在细胞内进行逻辑代数运算;该生物微机运用诸如‘与’与‘非’等逻辑操作将这些因子进行组合,并且,当全部因子的整体运算结果为逻辑‘真’值时,只产生所需要的结果——那就是细胞死亡。” 确实,研究者已经能够显示该网络在活体细胞内可以非常稳定地运作,可正确组合所有细胞内因子并给出正确的诊断。Benenson认为,这一成果代表该领域的一项重大成就。动物模型与基因疗法该研究小组想在下一步在合适的动物模型上测试该细胞计算方法,以期在未来创建诊断与治疗工具。这听起来可能象科幻小说,但Benenson相信其可行性;不过,仍有不少棘手的问题需要解决。比如,如何有效、安全地将外源基因导入细胞?这种DNA递送在目前情况下颇具挑战性。尤其是,该方法需要将外源基因暂时而不是永久导入细胞。现有的病毒导入法或化学导入法均未充分开发,需要进一步完善。Benenson说:“为人类提供一种功能完善的治疗方法还非常遥远。不过这一工作是重要的第一步,显示了单一细胞水平上这样一种选择性诊断方法具有可行性。”参考文献:1. Z. Xie, L. Wroblewska, L. Prochazka, R. Weiss, Y. Benenson. Multi-Input RNAi-Based Logic Circuit for Identification of Specific Cancer Cells. Science, 2011; 333 (6047): 1307 DOI: 10.1126/science.1205527
[size=24px][b]课程详情[/b][/size]肿瘤的发生及发展机制是当前生命科学和基础医学的重要研究领域,对应的抗肿瘤药物和细胞治疗方法的研发也是行业研究热点。本次讲座将围绕肿瘤细胞和细胞治疗研究方法,介绍赛多利斯提供的活细胞水平检测方法及整体解决方案。[size=18px][b]讲师简介:[/b][/size]黄雯琪:黄雯琪,女,就职于赛多利斯公司生物分析部门,负责细胞检测产品线的应用支持、产品培训等业务,在细胞生物学检测技术及实验方法方面具有丰富的经验。[size=18px][b]相关领域:[/b][/size](生物产业)-(综合)[size=18px][b]相关仪器:[/b][/size](生命科学仪器及设备)-(细胞生物学仪器)-(高内涵细胞成像分析系统)点击链接立即报名:[url]https://www.instrument.com.cn/webinar/meeting_13888.html[/url]
我想做一下肿瘤细胞的P谱,但以前没有做过,制备样品是把肿瘤细胞制成细胞悬液就行了吗?内标和普通样品的内标一样吗?是不是应该先做一下细胞培养液的P谱?求大神帮助!!
最新发现与创新 中国科技网讯 对于恶性肿瘤患者而言,最可怕的莫过于肿瘤出现转移扩散,因为这意味着肿瘤病变已经发展到晚期,也是肿瘤治疗失败的重要原因之一。今天(7日)在第七届中国肿瘤学术大会上披露,国际权威学术杂志《抗癌研究》(Anticancer Research)刊发了英国卡迪夫大学关于中药抑制肿瘤转移的研究报告,在国际上引起广泛关注。 英国卡迪夫大学医学院研究证实,我国抗肿瘤创新中药养正消积胶囊可有效抑制肿瘤细胞侵袭转移。研究人员指出,在肿瘤细胞的侵袭转移过程中,磷酸肌醇 3-激酶/蛋白激酶 B(PI3K/AKT) 信号通路的过度激活起到了关键作用,养正消积胶囊可以显著干预 PI3K/AKT 通路,从而对乳腺癌、肠癌、前列腺癌、肺癌、胃癌和骨肉瘤等肿瘤细胞的黏附和迁移起到明显抑制作用,有效控制肿瘤的病变发展。 有关专家介绍,恶性肿瘤细胞非常容易从原发病灶上脱落,每克肿瘤组织每天可向血液中释放300—400万个肿瘤细胞,脱落的肿瘤细胞随血液或淋巴流布全身,一旦条件成熟就会迅速生长,形成转移性病灶。控制肿瘤细胞的侵袭扩散是避免肿瘤恶化、提高肿瘤治疗效果、改善患者生存质量及延长患者寿命的有效措施。 专家认为,这一研究结果对恶性肿瘤的临床治疗具有极高的指导意义,对于尚未出现转移病灶的早中期肿瘤患者,使用养正消积胶囊可以控制肿瘤转移扩散,从而增加手术、介入等治疗手段的成功几率。此外,对于已经发展为全身性病变的晚期肿瘤患者,养正消积胶囊还具有增效减毒作用,可增加化疗疗效,减轻化疗中出现的消化道反应及免疫、造血系统损害,改善患者临床症状,明显提高患者的生存质量,延长患者的生存时间,是辅助治疗恶性肿瘤的一种安全、可靠、疗效满意的治疗方法。(通讯员 杨叁平 李瑞) 《科技日报》(2012-9-8 一版)
1. MSI1 在实体肿瘤中的研究进展1.1 胶质母细胞瘤脑癌一直是威胁人类生命的恶性肿瘤,而胶质母细胞瘤是最具破坏性的脑癌之一, 其中位生存期仅有 16 个月[7]。MSI1 在神经发育中起重要作用,MSI1 的高表达与胶质母细胞瘤的恶性进展呈正相关且预示着不良预后。研究发现,MSI1 通过增强血管细胞粘附因子-1(VCAM1)在修复同源重组、逃避凋亡和上调 DNA 损伤反应中的作用来调节辐射抗性,进而促进肿瘤细胞的迁移[8,9]。Aliaksandr[10]等人发现在胶质母细胞瘤中MSI1 直接调控 YTH-N6 甲基腺苷 RNA 结合蛋白-1(YTHDF1),而 YTHDF1 能调节肿瘤细胞的增殖、化疗耐药以及癌细胞样特性,MSI1 与 YTHDF1 呈正相关,且MSI1 与 YTHDF1 表达上调预示了患者的不良预后。另有研究发现在胶质母细胞瘤细胞中 MSI1 过度表达时,会增加巨噬细胞抑制因子 1(MIF1)的表达和分泌,由此导致巨噬细胞分化为 M2 表型,从而促进肿瘤的进展[11]。因此胶质母细胞瘤中对 MSI1 功能的进一步探索,可能为临床诊断和治疗提供新的思路。1.2 乳腺癌乳腺癌是女性癌症死亡的主要原因之一[12]。有研究通过免疫组化等方法分析 20 个乳腺癌细胞系和 140 个原发性乳腺肿瘤中 MSI1 的表达中发现,MSI1 正常人乳腺组织中表达极低,但在 68% 的原发肿瘤和 100% 的淋巴结转移中表达,MSI1 成为了乳腺癌患者生存率的负预后指标[13]。Yun[14]等人发现 MSI1 在侵袭性乳腺肿瘤中表达增高,证实了 MSI1 是乳腺癌转移的关键调节因子,MSI1 表达上调直接抑制了基质金属蛋白酶-9(MMP9)抑制剂 Timp3 的表达,导致 MMP9 的表达和活力增强,从而增强了乳腺癌细胞的侵袭能力,同时促进了乳腺肿瘤细胞的肺转移。Wang[15]等人还发现 MSI1 通过触发 Notch 和 Wnt 信号通路促进乳腺干细胞的增殖。研究者发现调节多种类型乳腺癌进展的潜在因子 miR-125b 能与 MSI1 的 3'UTR 结合,上调 miR-125b 表达能抑制肿瘤细胞中 MSI1 的表达。但 MSI1 作为 miR-125b 的潜在靶点,其分子机制仍需进一步研究[16]。如今 MSI1 在乳腺癌进展中的致癌作用已被证实,我们可以通过对乳腺癌中 MSI1 的表达及相关机制研究,为乳腺癌转移的治疗策略提供新的见解。1.3 宫颈癌宫颈癌是一种高发病率的恶性肿瘤,严重威胁女性的身体健康[17],尽管对于宫颈癌的预防已经突飞猛进,但是宫颈癌的治疗仍然是一大难题。癌细胞的永生化是宫颈癌进展的关键因素,早期有研究发现 MSI1 在宫颈癌组织中高表达,MSI1 可以与周期调节因子 P21、P27 和 P53 的 mRNA 3’UTR 结合并抑制其翻译过程,加速宫颈癌细胞的G0/G1-S 细胞周期转化,促进肿瘤细胞的增殖[18]。最新研究发现,宫颈癌细胞中 MSI1 过表达导致 AKT 信号的负调节因子 PTEN 以及 AKT 信号下游的凋亡因子 BAK 的表达均下调,从而使宫颈癌细胞凋亡受到抑制[19]。MSI1 参与肿瘤的进展,MSI1 通过激活宫颈癌中的 Wnt 信号通路促进上皮细胞间充质转化的进展,且 MSI1 高表达与患者的不良预后密切相关[20,21]。越来越多的研究表明,MSI1 可以作为宫颈癌的候选治疗靶点。1.4 结肠癌随着时代发展,人类生活方式、饮食习惯的改变,结肠癌的发病率呈上升趋势[22], 因此迫切需要一种生物标志物用于结肠癌的高精度早期筛查和治疗。有研究表明,MSI1 通过靶向细胞周期蛋白依赖性激酶(CDK)抑制剂 p21cip1 的负调节而改变细胞周期, 并抑制结肠癌细胞的细胞增殖、集落形成以及体内的肿瘤形成[23]。有报道称,癌基因Circ_KIAA1199 通过竞争性靶向 miR-34c-5p 激活 MSI1,驱动了结肠癌的恶性发展[24,25]。另有研究发现,在结直肠癌中 miR-137 作为肿瘤抑制性 miRNA 发挥作用,并对致癌基因 MSI1 产生负性调节,MSI1 表达下调抑制了结肠癌细胞生长和化疗耐药性[26]。Li[27]等人进一步研究发现,外泌体 circ_IFT80 能通过调节 miR-296-5p/MSI1 轴促进结肠癌细胞发生并降低肿瘤细胞的放射敏感性,这为结肠癌的治疗提供了新思路。化疗耐药仍然是癌症治疗中不可忽略的问题,研究指出 Circ0032833/miR-125-5p/MSI1 在FOLFOX 治疗中能调节 5-氟尿嘧啶和奥沙利铂敏感性[40],对结肠癌治疗难的问题提供了强有力的理论支持。1.5 肺癌肺癌是癌症死亡的主要原因之一,非小细胞肺癌(NSCLC)占肺癌的 85% 左右[28]。研究发现 NSCLC 中 MSI1 呈高表达状态,MSI1 参与了 NSCLC 细胞的发生发展[29]。Guo[30]等人研究了 MSI1 在 NSCLC 恶性肿瘤和化疗耐药中的作用,发现 miR-181a-5p能够抑制 MSI1 基因的 3'-UTR 活性,从而在 NSCLC 中发挥肿瘤抑制作用,同时MSI1 的表达水平与 Akt 信号通路的活性呈正相关,MSI1 通过激活 Akt 信号通路促进 NSCLC 的恶性增殖和耐药。晚期癌症患者 MSI1 表达水平较高的结果表明,MSI1 不仅在 NSCLC 的发病过程中发挥重要作用,而且在癌症的进展过程中也发挥了重要作用。因此 MSI1 除了作为癌症的生物标志物,还可能成为潜在的治疗靶点。
铂类药物是一类重要的肿瘤化疗药物,在临床中得到广泛的应用,成为治疗包括肺癌、胃癌、结肠癌、卵巢癌、睾丸癌等常见恶性肿瘤的一线药物。然而,目前临床使用的铂类抗癌药物对肿瘤细胞缺乏选择性,在杀死肿瘤细胞的同时,对正常细胞也有较大伤害,导致明显的临床毒副作用。同时,肿瘤病人容易对铂类药物产生耐药性,导致化疗失败。 针对铂类药物存在的以上两大问题,中国科学院昆明植物研究所李艳研究组与昆明贵金属研究所刘伟平研究组合作,发现mixed-NH3/cyclopentamine和不对称的3-X-1,1-cyclobutanedicarboxylato与Pt(II)配合物对肿瘤细胞显示出明显的选择性,能选择性诱导肿瘤细胞的凋亡,而对正常细胞影响很小,同时对顺铂耐受的非小细胞肺癌和卵巢癌细胞株有较高的杀伤活性,显示出重要的研究开发前景。 近日,这类化合物的结构和用途已经获得国家发明专利授权(ZL20101027465.2)。
多数抗肿瘤药物因其本身的难溶性而无法实现有效的靶向递送,进而严重影响其在临床方面的应用。紫杉醇(Paclitaxel, PTX)是目前临床上应用较为广泛的难溶性抗肿瘤药物之一,其对肺癌、卵巢癌、乳腺癌等均具有很好的治疗作用。为了解决其难溶问题,现用临床注射制剂(Taxol®)是将其溶解于聚氧乙烯蓖麻油和无水乙醇的混合溶媒后再行给药。然而,该制剂因缺乏靶向性,对其他正常组织产生明显的毒副作用;而且添加的聚氧乙烯蓖麻油在体内降解时会释放组胺,引起严重的过敏反应。因此,开发方便安全的靶向给药系统对PTX的临床应用有重要的研究意义。 近日,中科院过程工程研究所马光辉研究员领导的团队开发出了一种新型的难溶性抗肿瘤药物的纳米靶向给药系统(如图所示)。首先,利用O/W/O复乳液法并结合程序升温法,成功地将PTX以纳米晶形式原位装载于亲水性材料羧化壳聚糖纳米球中,并结合快速膜乳化技术实现了纳米球粒径的均一性。在此基础上,研究人员利用纳米球表面的羧基,引入具有隐形效果的聚乙二醇(PEG)链和靶向肿瘤细胞的RGD肽,最终制得兼具隐形和靶向能力的纳米给药系统。 后续的体外细胞及体内荷瘤小鼠模型实验表明,该制剂能够有效延长药物在体内的循环周期,改善纳米球对肿瘤细胞的亲和能力,提高药物生物利用度。另外,与传统的注射制剂相比,该制剂还具有很低的毒副作用。 上述研究工作已发表在Molecular Pharmceutics(2012, 9, 1736-1747)上,审稿人认为这是一项有趣的工作,方法新颖。该研究工作受到973项目(2009CB930300)和国家自然科学基金(20820102036, 21161160555)的资助。http://www.cas.cn/ky/kyjz/201207/W020120720343496926834.jpg PTX靶向纳米给药系统示意图
大神们,帮忙推荐台主要针对小鼠骨髓细胞数检测的仪器,再一个就是能对小鼠血细胞的种类分类,计数。要求不高。。但是这种针对性的仪器还这难找。。
大神们,帮忙推荐台主要针对小鼠骨髓细胞数检测的仪器,再一个就是能对小鼠血细胞的种类分类,计数。要求不高。。但是这种针对性的仪器还这难找。。
国际学术期刊Cell Research于4月24日在线发表了中科院上海生命科学研究院生化与细胞所刘默芳组关于Onconase抑制恶性间皮瘤细胞microRNA(miRNA)表达的最新研究成果。该工作与上海南方模式生物研究中心王庆诚教授合作完成。 Onconase是从北方豹蛙卵或胚胎中提取的一种核糖核酸酶,是RNase A超家族中最小的成员,目前已被欧盟、澳大利亚和美国FDA批准作为罕见病药物(Orphan drug)用于恶性间皮瘤临床治疗使用。因接触石棉是其主要诱因,恶性间皮瘤也俗称为石棉癌,该恶性肿瘤预后极差,至今尚无有效的治疗措施。Onconase特异性地诱导癌细胞凋亡,而对正常细胞的毒性较低,对非小细胞肺癌、乳腺癌等的临床试验目前也正在进行中。然而,作为一种很有前景的抗肿瘤药物,Onconase的细胞毒性机理尚不完全清楚。 miRNA在肿瘤发生发展中有重要作用。刘默芳研究组研究生乔萌和祖立东等发现,Onconase对恶性间皮瘤细胞的miRNA表达具有普遍下调作用,而对细胞中一些oncomiR(如miR-155和miR-21)的下游靶基因,如socs1、pten、pdcd4等肿瘤抑制基因有明显上调作用。有趣的是,该工作发现Onconase降解miRNA前体,而对miRNA成熟链无明显作用;与之一致的是,Onconase抑制Dicer对miRNA前体的加工、降低Dicer生产成熟miRNA。进一步的研究发现,Onconase对miRNA前体的切割位点偏好于U-G和U-U。 该工作揭示了Onconase抗癌活性的一种新机制,完善了Onconase的抗癌作用机理,为与Onconase有关的更加合理、有效、安全的用药提供了科学依据。 该项研究工作得到了科技部、国家自然科学基金委、中国科学院及上海市科委的资助。
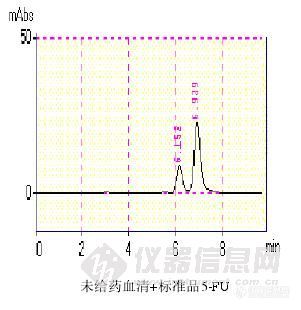
【作者】 但操;【导师】 张继民; 【作者单位】 广州医学院, 外科学,【摘要】 研究背景:5’-脱氧氟尿苷(5’-deoxy-5-fluorouridine, 5’-DFUR)是临床治疗消化道恶性肿瘤的口服抗癌药物,为5-氟尿嘧啶(5-FU)的前体药物。其本身没有细胞毒作用,需要在细胞内经过胸苷磷酸化酶(thymidine phosphorylase,TP)转化为5-FU才能发挥抗肿瘤作用。已有文献报道乳腺癌和胃癌细胞可以表达TP活性,而大肠癌细胞是否表达TP则持论不同。我们在前期研究中发现大肠癌组织中TP活性主要由间质细胞中的巨噬细胞表达,而测定6株结肠癌细胞系也几乎没有TP蛋白表达。在癌细胞不表达TP的情况下5’-DFUR在结直肠癌组织中如何转化尚属疑问。我们前期体内实验对结肠癌小鼠动物模型应用化疗药物5’-DFUR进行治疗,结果发现与5-FU相比平均荷瘤生存期更长,平均瘤重轻,同期平均体重下降缓慢,提示5’-DFUR在小鼠结肠癌组织比正常组织中转化率高,抗癌选择性高。其原因可能是TP酶在癌组织中分布较正常组织多。前期体外实验把5’-DFUR加入培养基中同人血单核细胞一起培养24h,5’-DFUR对4种癌细胞的IC50明显下降,提示血液中单核细胞也可表达TP。由于尚未发现实验比较在癌组织和血液中TP含量,故两者TP的含量高低尚需要实验进一步证实。本实验应用高效液相色谱法(high performance liquid chromatography,HPLC)测定应用5’-DFUR后癌组织和血液中5-FU的转化情况,间接推断TP酶在癌组织和血液中分布差异,为进一步研究5’-DFUR在结直肠癌组织中转化及TP酶调控机制提供资料。实验材料:1、实验动物SPF级近交系BALB/c小鼠28只,6-8周龄,雄性,体重20.00±2.34g,购自广东省医学实验动物中心。2、肿瘤细胞株BALB/c小鼠结肠腺癌细胞株(CT26),购自美国菌种保藏中心(American Type Culture Collection, ATCC)。3、实验药物5’-DFUR由Roche公司日本研究中心提供; 5-FU注射液,江苏南通精华制药有限公司生产(批号: 080607);5-FU标准品购自Sigma有限公司提供(批号: 097K1352)。4、实验仪器岛津高效液相系统;色谱柱:Diamonsil C18柱(250mm×4.6mm,5μm)实验方法:1、小鼠结肠癌CT-26细胞株的培养10%胎牛血清1640培养基,含青霉素100×103 U/L和链霉素100 mg/L,37℃,5%CO2水浴恒温培养箱中培养,隔日换液,2-3天酶消化法传代。2、细胞悬液制备制备模型当天取指数生长期的细胞,用0.25%胰蛋白酶消化,机械吹打成细胞悬液,2 000r/min离心5 min,弃上清液,加适量生理盐水调整细胞浓度至1×107个/ml,以台盼蓝测定细胞活力在95%以上。3、结肠癌模型制作方法将体外培养的CT26细胞悬液0.2ml注入小鼠(BALB/c)背部皮下,约2周后基本可以形成肉眼可见的肿瘤隆起。4、动物分组及给药荷瘤小鼠28只随机分为4组:①5’-DFUR给药15分钟组;②5’-DFUR给药30分钟组;③5-FU给药15分钟组;④5-FU给药30分钟组。根据动物体重,5-FU用量0.020mg/g ,配制浓度为1.0 mg/ml。5’-DFUR用量0.038mg/g;配置浓度为2.0mg/ml。各组分别腹腔注射给药15分钟、30分钟后处死小鼠立即取血和瘤组织。5、标本处理小鼠眼眶动静脉取血0.5 ml后放置入37℃水浴30分钟,3200rpm离心5min,取上清液4℃保存。肿瘤组织用滤纸吸干血迹后称重,然后按0.5g组织与4 ml生理盐水(1:8)加入匀浆器匀浆5min, 3200rpm离心5min,取上清液4℃保存。6、制作血液和肿瘤组织的5-FU药物标准曲线取未给药小鼠血清7份,每份90μL,分别加入由5-FU对照品和蒸馏水配制的系列标准液适量并混匀配成100μL,使血清中药物浓度分别为6.25,12.5,25.0,50.0,100.0,200.0,400.0μg·mL-1,制作血清标准曲线;取未给药小鼠肿瘤组织匀浆液7份,每份90μL,分别加入由5-FU对照品和蒸馏水配制的系列标准液适量并混匀配成100μL,使肿瘤匀浆液中药物浓度分别为1.0,2.0,4.0,8.0,16.0,32.0,64.0μg·mL-1,制作肿瘤标准曲线。7、测量各标本浓度取血清100μL,置于5mL玻璃试管中,加入乙酸乙酯2mL,漩涡振荡2min后,3200rpm离心5min,取上层析液置于另一玻璃试管中。再次加入乙酸乙酯2mL进行第二次提取,漩涡振荡2min后,3200rpm离心5min,取上层析液,然后合并两次提取的上层析液,离心浓缩挥干。加入100μL流动相定容,混匀取出,置于EP管中,10000rpm离心7min,取上层析液20μL进样。记录药物峰面积,代入相应标准曲线计算药物浓度;取肿瘤匀浆液100μL,以同样方法处理标本测量浓度。8、观测指标给药15分钟、30分钟处死组5’-DFUR组和5-FU组小鼠血液与癌组织5-FU浓度。9、统计学方法应用统计软件SPSS13.0数据包对5’-DFUR组和5-FU组小鼠血液与癌组织5-FU浓度采用配对样本t检验进行比较。当P0.05时,认为差异有统计学意义。结果:1、注射药物5’-DFUR 15、30分钟后,癌组织转化的5-FU浓度分别54.64μg/g±12.80μg/g和45.58μg/g±18.82μg/g,血清中中5-FU浓度分别为8.83μg/ml±1.68μg/ml和9.82μg/ml±2.93μg/ml,15分钟、30分钟组癌组织5-FU浓度分别为血清的6.36、4.47倍(P0.05);2、注射药物5-FU 15、30分钟后,癌组织转化的5-FU浓度分别86.13μg/g±15.42μg/g和94.68μg/g±39.89μg/g,血清中5-FU浓度分别为133.35μg/ml±20.69μg/ml和112.70μg/ml±26.27μg/ml,15分钟、30分钟组血清5-FU浓度分别为癌组织的1.59、1.62倍(P0.05)。结论:小鼠结肠癌模型体内,癌组织内5’-DFUR转化率高于血液,考虑分布在癌组织中的PyNPase酶比血液高。 【谱图】http://ng1.17img.cn/bbsfiles/images/2012/08/201208142214_383901_1609970_3.jpg
[align=center][font='黑体'][size=21px]外泌体对肿瘤疾病靶向治疗的研究进展[/size][/font][/align][size=18px]1[/size][size=18px]外泌体在乳腺癌靶向治疗[/size][size=18px]中[/size][size=18px]的研究进展[/size][size=16px]乳腺癌是女性最常见的恶性肿瘤之一,居我国女性恶性肿瘤发病率的首位。中国女性乳腺癌的发病率呈逐年上升趋势,而且趋于年轻化。外泌体在乳腺癌治疗上也发挥着日益重要的作用,包括调控外泌体的表达、将外泌体作为药物运输载体、将外泌体进行工程化修饰用于靶向治疗等。[/size][size=16px]Limoni[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][12][/size][/sup][/font][size=16px]通过特异性改造,将[/size][size=16px]siRNA[/size][size=16px]装载于[/size][size=16px]HEK293[/size][size=16px]细胞来源的外泌体中,改造后的外泌体显示出显著的[/size][size=16px]HER-2[/size][size=16px]靶向性,并成功敲[/size][size=16px]除[/size][size=16px]低乳腺癌细胞[/size][size=16px]TPD52[/size][size=16px]基因的表达。[/size][size=16px]Liang[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][13][/size][/sup][/font][size=16px]将抗肿瘤药物[/size][size=16px]5-[/size][size=16px]氟尿嘧啶和[/size][size=16px]miRNA-21[/size][size=16px]寡核苷酸拮抗片段一同包裹在外泌体中,成功实现了[/size][size=16px]HER-2[/size][size=16px]阳性肿瘤细胞的靶向治疗。外泌体表面定向性修饰是增强外泌体靶向性的一种有效方式。[/size][size=16px]Yu[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][14][/size][/sup][/font][size=16px]通过修饰改造,将化疗药物[/size][size=16px]Erastin[/size][size=16px]成功装载于叶酸标记的外泌体中,实现了乳腺癌的靶向治疗。[/size][size=16px]Li[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][15][/size][/sup][/font][size=16px]通过对巨噬细胞来源的外泌体做[/size][size=16px]c-Met[/size][size=16px]修饰,成功实现了外泌体携带多西他滨对乳腺癌的靶向治疗。[/size][size=18px]2[/size][size=18px]外泌体在肝癌靶向治疗[/size][size=18px]中[/size][size=18px]的研究进展[/size][size=16px]肝癌是病死率较高的恶性肿瘤,中国是全球肝癌发病率最高的国家。[/size][size=16px]miR-122[/size][size=16px]是目前研究较多的与肝癌相关的外泌体[/size][size=16px]miRNA[/size][size=16px],它在正常肝组织中丰度最高,约占肝组织[/size][size=16px]miRNA[/size][size=16px]的[/size][size=16px]50%[/size][size=16px]。[/size][size=16px]miR-122[/size][size=16px]在肝癌组织中表达量明显降低,且在肝癌患者血清外泌体中的表达量也显著下降。[/size][size=16px]L[/size][size=16px]o[/size][size=16px]u[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][16][/size][/sup][/font][size=16px]研究证实,将[/size][size=16px]miR-122[/size][size=16px]转染到脂肪组织来源的间充质干细胞中,待其产生大量富含[/size][size=16px]miR-122[/size][size=16px]的外泌体后,将外泌体运载到肝癌细胞中,能提高肝癌细胞对化疗的敏感性。鉴于[/size][size=16px]GPC3[/size][size=16px]在肝癌细胞外泌体分泌的特异性,也表明了[/size][size=16px]GPC3[/size][size=16px]有望成为肝癌的治疗靶点。[/size][size=16px]Zhang[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][17][/size][/sup][/font][size=16px]将阿霉素或索拉菲尼装载至红细胞来源的外泌体中,该载药外泌体可明显抑制小鼠原位肝癌细胞的生长,并且其对肝癌的抑制作用强于传统化疗药物给药方式及剂量所诱导的肝癌抑制作用。[/size][size=18px]3[/size][size=18px]外泌体在胃癌靶向治疗中的研究进展[/size][size=16px]胃癌是起源于胃黏膜上皮的恶性肿瘤,可发生于胃的任何部位,我国是胃癌发病大国,好发于[/size][size=16px]50[/size][size=16px]岁[/size][size=16px]以上[/size][size=16px]的中老年人,其早期发现困难,极易误诊,患者预后差,生存期短。因此对于胃癌的早期诊断以及靶向性治疗研究成为亟待解决的[/size][size=16px]热点问题。在研究[/size][size=16px]miRNA[/size][size=16px]靶点或制定[/size][size=16px]miRNA[/size][size=16px]靶向治疗策略时,发现外泌体可研发成新型[/size][size=16px]miRNA[/size][size=16px]的纳米载体,能够调控某些[/size][size=16px]miRNA[/size][size=16px]的表达,最终抑制肿瘤的进展。[/size][size=16px]Z[/size][size=16px]hang[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][18][/size][/sup][/font][size=16px]研究发现外泌体可以包裹肝细胞生长因子小干扰[/size][size=16px]RNA[/size][size=16px]([/size][size=16px]HGF siRNA[/size][size=16px]),并将其转运到胃癌细胞中,负向调控[/size][size=16px]HGF[/size][size=16px]表达,从而抑制胃癌细胞的增殖和迁移,[/size][size=16px]HGF siRNA[/size][size=16px]在胃癌的靶向治疗中具有潜在的应用前景。外泌体在胃癌中[/size][size=16px]也[/size][size=16px]可作为治疗靶点。服用[/size][size=16px]PPI[/size][size=16px]抑制剂已被证明是可以减少胃酸产生和促进抗癌作用的药物。[/size][size=16px]Guan[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][19][/size][/sup][/font][size=16px]人最近证明了[/size][size=16px]PPI[/size][size=16px]抑制剂可能抑制外泌体释放作为胃癌治疗的一种潜在的治疗工具。[/size][size=18px]4[/size][size=18px]外泌体在卵巢癌靶向治疗中的研究进展[/size][size=16px]卵巢癌是影响全世界众多女性的最致命的妇科恶性肿瘤,其早期症状隐匿,临床诊断时往往已为中晚期。靶向杀灭恶性肿瘤细胞是一个高效的方式,外泌体和外泌体模拟物在靶向药物的治疗剂递送中的新兴作用已得到广泛认可[/size][size=16px]。[/size][size=16px]卵泡刺激素受体[/size][size=16px]β[/size][size=16px]([/size][size=16px]FSHβ[/size][size=16px])链特定的氨基酸片段能够特异性的识别[/size][size=16px]FSHβ[/size][size=16px]阳性的卵巢癌细胞,锚定[/size][size=16px]FSHβ[/size][size=16px]的外泌体通过其表面的特异表达分子诱导外周血[/size][size=16px]T[/size][size=16px]淋巴细胞的增值效应从而激发其抗肿瘤效应,负载外泌体[/size][size=16px]/FSHβ[/size][size=16px]的树突状细胞能显著激活[/size][size=16px]T[/size][size=16px]细胞的卵巢癌细胞杀伤力,展示了外泌体装载靶向肽的潜力[/size][font='times new roman'][sup][size=16px][20][/size][/sup][/font][size=16px]。外泌体[/size][size=16px]miR-21-5p[/size][size=16px]在肿瘤患者中高表达,研究表明其可促进腹膜间皮细胞间皮[/size][size=16px]-[/size][size=16px]间质转化,促进肿瘤细胞腹腔转移,外泌体[/size][size=16px]miR-21-5p[/size][size=16px]可能成为腹腔转移的新型治疗靶点[/size][font='times new roman'][sup][size=16px][21][/size][/sup][/font][size=16px]。此外[/size][size=16px]miR-1246[/size][size=16px]在卵巢癌外泌体中高表达,[/size][size=16px]Kanlikilicer[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][22][/size][/sup][/font][size=16px]发现其表达水平是来源细胞的几百倍,抑制[/size][size=16px]miR-1246[/size][size=16px]的表达,可显著降低肿瘤负荷。[/size][size=18px]5[/size][size=18px]外泌体在肺癌靶向治疗中的研究进展[/size][size=16px]近年来外泌体在肺癌治疗方面的研究越来越多,认为外泌体在肺癌的治疗领域中有望为新的治疗靶点。可通过减少外泌体含量、调控特异性[/size][size=16px]miRNA[/size][size=16px]的表达,增强肿瘤细胞对药物敏感性、提高抗肿瘤免疫等途径促进肿瘤细胞凋亡,抑制肿瘤细胞增殖、侵袭及转移。[/size][size=16px]L[/size][size=16px]i[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][23][/size][/sup][/font][size=16px]证实耐紫杉醇肺腺癌细胞([/size][size=16px]A549/PTX[/size][size=16px])、顺铂耐药肺癌细胞([/size][size=16px]A549/PTX[/size][size=16px])中[/size][size=16px]miR[/size][size=16px]-181a[/size][size=16px]过度表达,促进肺腺癌细胞([/size][size=16px]A549[/size][size=16px])细胞上皮间充质转化([/size][size=16px]EMT[/size][size=16px]),而抑制[/size][size=16px]miR[/size][size=16px]-181a[/size][size=16px]表达,可逆转[/size][size=16px]A549/PTX[/size][size=16px]和[/size][size=16px]A549/PTX[/size][size=16px]细胞[/size][size=16px]EMT[/size][size=16px]表型,并增强肺腺癌细胞对紫杉醇和铂类化疗敏感性。上调外泌体[/size][size=16px] mi[/size][size=16px]R[/size][size=16px]-630[/size][size=16px]在[/size][size=16px]NSCLC[/size][size=16px]细胞中的表达,通过靶向[/size][size=16px]LM03[/size][size=16px]蛋白,可抑制肿瘤[/size][size=16px]细胞的生长增殖及转移。[/size][size=16px]Kim[/size][size=16px]等[/size][font='times new roman'][sup][size=16px][24][/size][/sup][/font][size=16px]将紫杉醇载入外泌体中制成外泌体紫杉醇制剂,发现气道给予的外泌体能够将药物足量有效的运送至肺癌细胞,并且对耐药肺肿瘤有显著治疗效果。[/size]
[align=center]肿瘤干细胞学说[/align][font='times new roman'][size=16px][color=#000000]关于肿瘤起源,目前讨论较多的是肿瘤干细胞学说。肿瘤干细胞学说认为,肿瘤细胞中存在[/color][/size][/font][font='times new roman'][size=16px][color=#000000]一[/color][/size][/font][font='times new roman'][size=16px][color=#000000]小部分[/color][/size][/font][font='times new roman'][size=16px][color=#000000]具有自我更新和分化能力[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的细胞,是[/color][/size][/font][font='times new roman'][size=16px][color=#000000]真正驱动肿瘤发生和发展的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]“[/color][/size][/font][font='times new roman'][size=16px][color=#000000]动力[/color][/size][/font][font='times new roman'][size=16px][color=#000000]”[/color][/size][/font][font='times new roman'][size=16px][color=#000000],在维持肿瘤的恶性增殖、侵袭、耐药、转移、复发等方面起着决定性的作用[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][6, 7][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]且在多种恶性肿瘤中已成功分离出了肿瘤干细胞。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]虽然其在肿瘤组织中数量极少[/color][/size][/font][font='times new roman'][size=16px][color=#000000]([/color][/size][/font][font='times new roman'][size=16px][color=#000000][/color][/size][/font][font='times new roman'][size=16px][color=#000000]1%), [/color][/size][/font][font='times new roman'][size=16px][color=#000000]但是对于肿瘤的预后及治疗意义重大,可能成为肿瘤诊断标志物及治疗靶点。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][8-10][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][10][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ABCG2[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][11][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]LGR5[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][12, 13][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]SOX2[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][14][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]是目前研究相对较多的潜在的肿瘤干细胞标志物。研究显示,与非小细胞肺癌相比,小细胞肺癌的肿瘤干细胞数量明显增加[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][15][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]肿瘤干细胞显示胚胎干细胞的许多特征,具有高度的致瘤性,并经常表现出参与发育和组织稳态的一个或多个高度保守的信号通路的持续激活,包括[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Notch[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Hedgehog[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]W[/color][/size][/font][font='times new roman'][size=16px][color=#000000]nt[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路,所有这些[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路[/color][/size][/font][font='times new roman'][size=16px][color=#000000]在[/color][/size][/font][font='times new roman'][size=16px][color=#000000]SCLC[/color][/size][/font][font='times new roman'][size=16px][color=#000000]中都可能[/color][/size][/font][font='times new roman'][size=16px][color=#000000]表现活跃[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][4][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]为目前已知的肿瘤干细胞标志物,其在小细胞肺癌细胞中也是呈[/color][/size][/font][font='times new roman'][size=16px][color=#000000]高表达[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的。通过[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Western blot[/color][/size][/font][font='times new roman'][size=16px][color=#000000]技术[/color][/size][/font][font='times new roman'][size=16px][color=#000000]可[/color][/size][/font][font='times new roman'][size=16px][color=#000000]检测其在蛋白质水平的表达。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]已有研究表明,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][size=16px][color=#000000]与[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的表达成正相关,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000]+[/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]的细胞[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI[/color][/size][/font][font='times new roman'][size=16px][color=#000000]1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]表达量明显升高,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][size=16px][color=#000000]与[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI[/color][/size][/font][font='times new roman'][size=16px][color=#000000]1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]双阳性表达在结直肠癌的转移及浸润有着重要的协同作用[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][69][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000],[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Wang[/color][/size][/font][font='times new roman'][size=16px][color=#000000]等人发现[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]在[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000]+[/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]细胞及干细胞样球形肿瘤细胞中表达,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]敲低表达[/color][/size][/font][font='times new roman'][size=16px][color=#000000]抑制球形菌落形成,并且降低了[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的表达[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][26][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。小细胞肺癌细胞的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]表达量降低后,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][size=16px][color=#000000]表达量也下降,表明[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]与[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD133[/color][/size][/font][font='times new roman'][size=16px][color=#000000]存在共表达,但两者之间相互调控机制尚不清楚,需进一步研究。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]是一种跨膜受体蛋白,属于黏附分子家族,是第一个发现并证实是实体瘤干细胞表面标志分子[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][70][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000],研究显示,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]也可能是肺癌肿瘤干细胞的标志物,并可能成为治疗新的靶点[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][71][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]可以作为透明质酸的受体将信号传导入胞内激活下游信号通路如[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Wnt/β-catenin[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][72][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。研究显示,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]在肝细胞癌中,肝癌干细胞的干细胞性质与[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI[/color][/size][/font][font='times new roman'][size=16px][color=#000000]1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]和[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的表达有关[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][73][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI[/color][/size][/font][font='times new roman'][size=16px][color=#000000]1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]调节[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000]+[/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]肿瘤干细胞诱导结直肠癌的发生的过程,并且增强肿瘤干细胞的耐药[/color][/size][/font][font='times new roman'][size=16px][color=#000000]。在神经胶质瘤中,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]促进肿瘤干细胞标志物[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的表达[/color][/size][/font][font='times new roman'][sup][size=16px][color=#000000][74][/color][/size][/sup][/font][font='times new roman'][size=16px][color=#000000]。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]同样影响[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的表达,而[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]与[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Wnt[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路相互作用,那么,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]MSI1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]与[/color][/size][/font][font='times new roman'][size=16px][color=#000000]CD44[/color][/size][/font][font='times new roman'][size=16px][color=#000000]可能是通过调控[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Wnt[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路相互影响。[/color][/size][/font]
原文是Purton, L.E., and Scadden, D.T. (2007). Limiting Factors in Murine Hematopoietic Stem Cell Assays. Cell Stem Cell 1, 263-270.发表在2007年cell stem cell 杂志上,最近由于要进行相应的课题研究,拿来精读了一番,做了一个笔记,发上来和大家分享,由于初涉小鼠造血干细胞这个领域,肯定有很多地方理解不全和错误,请大家指正。下面是我的精读笔记:小鼠造血干细胞研究方法综述一.关于HSC 免疫表型1. Thy1.1lo,Lin-Sca-1+Cells:其缺点是Thy1.1只表达于C57BL/Ka-Thy1.1小鼠,不表达于常用的C57BL/6小鼠;2. Lin- c-Kit+ Sca-1+ Cells(LSK):异质性,含有祖细胞,HSC含量不超过10%;结合CD34和Flt3可以分为long-term repopulating HSCs (LKS+ CD34- Flt3-) ,short-term repopulating HSCs (LKS+ CD34+ Flt3-) ,以及multipotent progenitors(LKS+ CD34+ Flt3+);3.荧光染料标记HSC: Rhodamine 123, Hoescht 33342, 以及Side Population,Rhodamine 123为线粒体染料,Hoescht 33342为DNA染料,HSC能够更多地将这两种染料泵出细胞外,所以染色较浅;4. SLAM Family Members:SLAM antigens (CD150+ CD244-CD48- cells),其优点是不像Thy1.1和Sca-1其表达受到品系和发育阶段等的影响,在更多的种系的小鼠中适用二.克隆形成实验:主要反映的是祖细胞的造血能力,不反映HSC,检测T系和B系需要另外特定的培养条件;三.Cobblestone Area-Forming Cells/Long-Term Culture-Initiating Cells,鹅卵石样区域形成细胞实验/长期培养-启动细胞实验:体外检测更早期造血干/祖细胞的方法,但由于feeder layers和培养条件不同,实验结果在不同实验室间稳定性较差,对于其是否真正能检测造血干细胞也比较有争议,不过在一些情况下,比如归巢(homing)或植入(engraftment)有缺陷导致体内造血重建实验无法进行时,这两个方法是较好的替代方法;四.Colony-forming unit-spleen (CFU-S)脾集落单位形成实验:属于短期(1-3周)体内重建实验,检测的干祖细胞比体外CFC早,但比HSC晚;五.long-term repopulating assays,长期重建实验,包括:1. competitive repopulation assay:竞争重建实验:属于定性或者半定量研究HSC重建能力的方法,不能区别是HSC的数量还是质量造成的结果差异,得到的结果为RU即重建单位;2. limiting dilution assay:统计的指标是造血重建失败的小鼠数目,采用泊松分布来计算HSC的频率,得到的结果为CRU即竞争重建单位;Stem Cell公司的免费软件L-Calc,可用于分析实验结果。limiting dilution assay有两种方法:1CRU assay,采用最小数的HSC作为竞争细胞,可以在单细胞水平检测HSC;2也称为CRU assay,采用标准的,足量的HSC作为竞争细胞,不能在单细胞水平检测HSC;3serial transplant assay,多代移植,最为严格的检测造血干细胞的方法;六:Limiting Dilution Assays需要考虑的几个重要因素:1.竞争细胞:1compromised bone marrow,即连续两代重建成功的骨髓细胞,比较耗时2W41/W41受体小鼠:c-kit基因发生突变,具有更加敏感的宿主微环境,能够检测更少的植入的HSC,不需要另外的HSC作为支持细胞(竞争细胞);3全骨髓细胞(whole bone marrow cells):经验表明2 X105 competing bone marrow cells比较适合2.受测细胞(Test Cells, Unknown HSC Potential):有人用LKS+ CD34- cells,但作者认为全骨髓细胞最好,原因是这种方法是在功能上评价HSC,避免了HSC在基因修饰的小鼠中免疫表型发生变化导致的结果的不可靠,在作者实验室通常采用的受测全骨髓细胞数为8 X 103到2 X106;3.重建失败的标准:现在一般认为受测细胞的重建比例小于1%为重建失败;在重建比例中,红细胞是不计算在内的,因为其不表达CD45,但一般认为只要其他系重建成功,红系应该也会重建成功;4.分析重建的时间点:看长期造血重建,最少要16周,最佳是六个月;5.其他考虑因素:归巢,HSC各系分化阻滞或减弱,祖细胞增殖动力学特性的改变,造血微环境对HSC的影响等等七.区分供体,受体的遗传学标志:最常用的是CD45.1,CD45.2系统,还有可以通过性别(Y染色体)来区分。
1. 利用诱导性多功能干细胞构建出小鼠精子祖细胞日本京都大学研究人员通过体外诱导胚胎干细胞(ESCs)和诱导性多功能干细胞(iPSCs),形成原始生殖细胞样细胞(primordial germ cell-like cells, PGCLCs),最后进一步分化,通过体内植入不能生育的小鼠睾丸中,产生了外观正常的精子。将这些精子注射到雌性小鼠的卵细胞中,不久雌性小鼠生出了健康的小鼠后代。2. 鉴定出阿尔茨海默病Alzheimer's disease的生物标记美国研究人员利用一种一般性和无偏差的方法---组合文库筛选(Combinatorial Library Screening)来鉴定出诊断上有用的抗体,而避免进行抗原鉴定。该方法涉及利用非自然的合成分子组合文库对病人血清样品和对照样品进行比较性筛选,这样就可鉴定出病人血清样品中要比和对照样品中保留极其多IgG抗体的分子,随后利用这些分子作为捕获试剂来捕获诊断上有用的抗体。研究人员利用多发性硬化症(multiple sclerosis)小鼠模式动物和证实这种方法的实用性,并利用该方法在阿尔茨海默病小鼠模式动物中鉴定出两种候选的IgG抗体生物标记。3. 发现干细胞多能性的选择性剪接开关加拿大多伦多大学研究人员发现了进化上保守的特异的FOXP1选择性剪接开关,可调控干细胞的多能性。研究人员发现这种剪接开关产生的FOXP1胚胎干细胞特异性异构体,与典型的FOXP1异构体相比,着不同的DNA结合性质。选择性剪接事件改变了FOXP1胚胎干细胞特异性异构体的DNA结合性质,促进维持多能性所需的转录因子基因的表达,包括OCT4、NANOG、NR5A2和GDF3,同时抑制胚胎干细胞分化所需的基因。同时,研究小组还发现FOXP1胚胎干细胞特异性异构体促进体细胞高效重编程为诱导性多功能干细胞(iPSC)。4. 追踪神经胶质瘤的起源美国研究人员利用双标记嵌合分析(Mosaic Analysis with Double Markers,MADM)---该技术的精髓在于用绿色荧光蛋白明确标示突变细胞,还有一个关键特色就是无论一个突变的绿色细胞何时产生,总是同时产生一个正常的红色细胞---来分析神经胶质瘤(glioma)的起源。他们将胶质瘤病人体内发现的两种流行突变p53与NF1导入神经干细胞(neural stem cells, NSCs)中,对源自神经干细胞的所有细胞系所作的进一步分析清楚地显示了少突胶质前体细胞(Oligodendrocyte precursor cells,OPCs)是该肿瘤的来源细胞,因为任何可见的肿瘤标志可被检出之前,变异的绿色少突胶质前体细胞的数量大大超过了其正常的红色对应物数量,足足超了130倍。为了进一步证实这点,研究人员也将p53与NF1突变直接导入小鼠少突胶质前体细胞,结果发现这些小鼠产生神经胶质瘤,从而再次证实少突胶质前体细胞是神经胶质瘤的来源。5. 发现新的组蛋白修饰方式美国芝加哥大学Ben Mary癌症研究所研究人员在细胞中筛查出了67个新组蛋白修饰标记,并从中发现了一种新型组蛋白翻译后修饰方式---赖氨酸巴豆酰化(lysine crotonylation)修饰。通过进一步的结构及基因组定位分析,研究人员证实氨酸巴豆酰化修饰是一种进化高度保守,且在生物学功能上完全不同于组蛋白赖氨酸乙酰化的蛋白质修饰方式。研究人员还发现在人类体细胞和小鼠精子细胞基因组中,组蛋白赖氨酸巴豆酰化分布于基因活性转录启动区域或增强子上。在减数分裂后的精子细胞中,赖氨酸巴豆酰化高丰度集中在性染色体上,被用来标记睾丸特异性基因。
[em0808]我要做的是小鼠的卵细胞的电镜,但是我所能获得的卵细胞的数量有限的,不知道有什么技巧可以保证细胞能包埋进去,听说有人做了好几次就没有作出来呀 急哦 谢谢大家了
[align=center][font='times new roman'][size=21px]肿瘤细胞分泌的外[/size][/font][font='times new roman'][size=21px]泌[/size][/font][font='times new roman'][size=21px]体在机体内的作用[/size][/font][/align][font='times new roman'][size=16px]摘要[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]肿瘤细胞通过产生,释放和利用外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体来促进肿瘤发生发展。肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体在肿瘤中的作用机制以成为目前的研究热点。外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体作为信息载体,可将遗传信息从肿瘤细胞传递到位于近处或远处的正常或其他异常细胞。所有体液中[/size][/font][font='times new roman'][size=16px]均[/size][/font][font='times new roman'][size=16px]发现了肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体,与靶细胞接触后,[/size][/font][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]会改变受体[/size][/font][font='times new roman'][size=16px]细胞[/size][/font][font='times new roman'][size=16px]的表型和功能属性,[/size][/font][font='times new roman'][size=16px]起到促进[/size][/font][font='times new roman'][size=16px]血管生成,血栓形成,免疫抑制,肿瘤转移和耐药的作用。[/size][/font][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]在抑制宿主抗肿瘤反应和[/size][/font][font='times new roman'][size=16px]介导[/size][/font][font='times new roman'][size=16px]耐药中发挥重要作用。肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体可能会干扰癌症患者的免疫治疗。它们在癌症进展以及癌症治疗中的生物学作用表明肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体是致癌转化的关键组成部分。[/size][/font][font='times new roman'][size=16px]关键词[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体;肿瘤转移;耐药;免疫抑制;血栓形成[/size][/font][font='times new roman'][size=16px]多细胞生物[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]中相邻细胞之间的通讯通常包括细胞内物质的交换和共享,这些[/size][/font][font='times new roman'][size=16px]过程[/size][/font][font='times new roman'][size=16px]是通过细胞间连接、突触或通过吞噬作用形成的,都需要细胞接触并且在短距离内进行。相反,外[/size][/font][font='times new roman'][size=16px]泌体代表[/size][/font][font='times new roman'][size=16px]了信息传递的独特形式,既可以在短距离传递,也可以在长距离下进行信息交流。肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体可以将信号从肿瘤细胞转移到远端组织和器官。[/size][/font][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]存在于机体循环中,并可以随时进入身体的各个部位。它们带有能够与内皮细胞接触并促进外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体进入血管和组织的表面成分[/size][/font][font='times new roman'][size=16px][[/size][/font][font='times new roman'][size=16px]1,2[/size][/font][font='times new roman'][size=16px]][/size][/font][font='times new roman'][size=16px]。但是肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体仅占患者血浆中总外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的[/size][/font][font='times new roman'][size=16px]一[/size][/font][font='times new roman'][size=16px]小部分,且该部分的含量可根据肿瘤进展而改变。[/size][/font]1. [font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体在肿瘤转移中的作用[/size][/font][font='times new roman'][size=16px]肿瘤[/size][/font][font='times new roman'][size=16px]细胞[/size][/font][font='times new roman'][size=16px]的转移过程[/size][/font][font='times new roman'][size=16px]开始[/size][/font][font='times new roman'][size=16px]于肿瘤细胞经历[/size][/font][font='times new roman'][size=16px]了[/size][/font][font='times new roman'][size=16px]上皮间质转化([/size][/font][font='times new roman'][size=16px]Epithelial-to-mesenchymal transition[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]EMT[/size][/font][font='times new roman'][size=16px])。肿瘤细胞[/size][/font][font='times new roman'][size=16px]获得[/size][/font][font='times new roman'][size=16px]迁移[/size][/font][font='times new roman'][size=16px]能力,并[/size][/font][font='times new roman'][size=16px]进入血液[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]淋巴系统[/size][/font][font='times new roman'][size=16px],逐渐[/size][/font][font='times new roman'][size=16px]转移[/size][/font][font='times new roman'][size=16px]到其他组织[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]这些[/size][/font][font='times new roman'][size=16px]肿瘤细胞产生具有独特分子特征的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体,[/size][/font][font='times new roman'][size=16px]主要包含[/size][/font][font='times new roman'][size=16px]EMT[/size][/font][font='times new roman'][size=16px]相关的蛋白质与迁移和侵袭所需的分子,[/size][/font][font='times new roman'][size=16px]如[/size][/font][font='times new roman'][size=16px]前列腺癌释放的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中的α[/size][/font][font='times new roman'][size=16px]v[/size][/font][font='times new roman'][size=16px]β[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]整联蛋白[/size][/font][font='times new roman'][size=16px][3][/size][/font][font='times new roman'][size=16px],白血病[/size][/font][font='times new roman'][size=16px]或[/size][/font][font='times new roman'][size=16px]乳腺癌衍生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的[/size][/font][font='times new roman'][size=16px]Wnt[/size][/font][font='times new roman'][size=16px]通路[/size][/font][font='times new roman'][size=16px]成分[/size][/font][font='times new roman'][size=16px][4,5][/size][/font][font='times new roman'][size=16px],以及胃肠道间质瘤([/size][/font][font='times new roman'][size=16px]GIST[/size][/font][font='times new roman'][size=16px])产生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中的[/size][/font][font='times new roman'][size=16px]KIT [/size][/font][font='times new roman'][size=16px][6][/size][/font][font='times new roman'][size=16px]。这些外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中缺氧诱导因子[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]HIF[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]的含量增加,[/size][/font][font='times new roman'][size=16px]促炎因子[/size][/font][font='times new roman'][size=16px]的含量也增加[/size][/font][font='times new roman'][size=16px][7][/size][/font][font='times new roman'][size=16px]。准备迁移的肿瘤细胞产生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体可与机体的血管、基质成分和免疫细胞相互作用,完成转移前的准备[/size][/font][font='times new roman'][size=16px][8][/size][/font][font='times new roman'][size=16px]。黑色素瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体显示在前哨淋巴结中积累,刺激血管生成,重塑细胞外基质并诱导黑色素瘤细胞富集到淋巴结中[/size][/font][font='times new roman'][size=16px][9][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]Peinado[/size][/font][font='times new roman'][size=16px]研究团队证明了,从高度转移的鼠类黑[/size][/font][font='times new roman'][size=16px]色素瘤细胞衍生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体能够将骨髓重编程为转移前的生理状态。现在已有研究支持肿瘤细胞分泌的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体与高度侵袭性的黑色素瘤细胞的发展有关,与空白对照组相比,实验组小鼠先前外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体进行过注射处理,其体内黑色素瘤细胞的增殖和转移速率明显提高[/size][/font][font='times new roman'][size=16px][10][/size][/font][font='times new roman'][size=16px]。在许多有关鼠类和人体肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的近期研究中,已证明这些外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体还携带微小[/size][/font][font='times new roman'][size=16px]RNA[/size][/font][font='times new roman'][size=16px]分子,将其转移至正常细胞并诱导其遗传和蛋白质谱发生变化,从而有利于转移形成[/size][/font][font='times new roman'][size=16px][11,12][/size][/font][font='times new roman'][size=16px]。肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体已被证明带有[/size][/font][font='times new roman'][size=16px]CD39[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]CD73[/size][/font][font='times new roman'][size=16px],它们是催化腺苷产生的外核苷酸酶[/size][/font][font='times new roman'][size=16px][13][/size][/font][font='times new roman'][size=16px]。腺苷在机体内可[/size][/font][font='times new roman'][size=16px]介[/size][/font][font='times new roman'][size=16px]导免疫抑制,发挥促进血管生成并驱动细胞基质重塑的重要作用,所有这些功能都促进肿瘤细胞迁移及其进入淋巴结。肿瘤外[/size][/font][font='times new roman'][size=16px]泌体支持[/size][/font][font='times new roman'][size=16px]转移的能力可以通过腺苷参与不同类别的分子途径[/size][/font][font='times new roman'][size=16px][14][/size][/font][font='times new roman'][size=16px]。[/size][/font]2. [font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体在肿瘤耐药性中的作用[/size][/font][font='times new roman'][size=16px]肿瘤对放射和化学药物的抵抗作用是肿瘤患者临床治疗中面对的严重问题,至今尚未得到解决。值得注意的是有研究指出肿瘤分泌的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体在肿瘤的耐药性中起重要作用;肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体通过多种机制促进耐药性的发展,例如肿瘤细胞可以将化学治疗性药物(例如顺铂)浓缩并通过外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体从细胞质中去除[/size][/font][font='times new roman'][size=16px][15][/size][/font][font='times new roman'][size=16px];此外肿瘤细胞还可以简单地将化疗药物包装到外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中以保护自己免受细胞毒性作用。耐药性肿瘤细胞可以通过外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体将抗性传递给敏感细胞,从而产生新的耐药性肿瘤细胞株。例如,已显示某些[/size][/font][font='times new roman'][size=16px]RNA[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]miR-100[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]miR-222[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]miR-30a[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]miR-17[/size][/font][font='times new roman'][size=16px])在外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中从抗阿霉素和多[/size][/font][font='times new roman'][size=16px]西他赛[/size][/font][font='times new roman'][size=16px]的乳腺癌耐药细胞系转移至敏感细胞[/size][/font][font='times new roman'][size=16px]系[/size][/font][font='times new roman'][size=16px]赋予抗药性[/size][/font][font='times new roman'][size=16px][16][/size][/font][font='times new roman'][size=16px]。有研究报道,在乳腺癌中,由[/size][/font][font='times new roman'][size=16px]HER2[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px]细胞系或[/size][/font][font='times new roman'][size=16px]HER2[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px]的肿瘤患者[/size][/font][font='times new roman'][size=16px]产生的[/size][/font][font='times new roman'][size=16px]携带[/size][/font][font='times new roman'][size=16px]HER2[/size][/font][font='times new roman'][size=16px]的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]可以[/size][/font][font='times new roman'][size=16px]清除特异性抗肿瘤药[/size][/font][font='times new roman'][size=16px]物曲妥珠单[/size][/font][font='times new roman'][size=16px]抗[/size][/font][font='times new roman'][size=16px][17,18][/size][/font][font='times new roman'][size=16px]。多[/size][/font][font='times new roman'][size=16px]西他赛[/size][/font][font='times new roman'][size=16px]耐药性已在前列腺癌中进行了研究,发现其抗药性是通过多药耐药蛋白[/size][/font][font='times new roman'][size=16px]-1[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]MDR-1 / P-[/size][/font][font='times new roman'][size=16px]gp[/size][/font][font='times new roman'][size=16px])的外[/size][/font][font='times new roman'][size=16px]泌体转移[/size][/font][font='times new roman'][size=16px]而赋予的,多药耐药蛋白[/size][/font][font='times new roman'][size=16px]-1[/size][/font][font='times new roman'][size=16px]是一种[/size][/font][font='times new roman'][size=16px]P-[/size][/font][font='times new roman'][size=16px]糖蛋白转运蛋白,通常在耐药肿瘤中过表达[/size][/font][font='times new roman'][size=16px][19][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]顺铂耐药[/size][/font][font='times new roman'][size=16px]的卵巢癌产生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中富含其他转运蛋白,例如[/size][/font][font='times new roman'][size=16px]MDR-2[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]ATP-7A[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]ATP-7B [/size][/font][font='times new roman'][size=16px][15][/size][/font][font='times new roman'][size=16px]。最近的研究表明,耐药性部分归因于外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中的[/size][/font][font='times new roman'][size=16px]miRNA[/size][/font][font='times new roman'][size=16px]从耐药性癌细胞向敏感性癌细胞的细胞间转移[/size][/font][font='times new roman'][size=16px][16][/size][/font][font='times new roman'][size=16px]。黑色素瘤动物模型的体内研究表明,质子泵抑制剂([/size][/font][font='times new roman'][size=16px]PPI[/size][/font][font='times new roman'][size=16px])和低[/size][/font][font='times new roman'][size=16px]pH[/size][/font][font='times new roman'][size=16px]剂的联合使用可有效降低外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]对顺铂的[/size][/font][font='times new roman'][size=16px]耐药性[/size][/font][font='times new roman'][size=16px][20][/size][/font][font='times new roman'][size=16px]。尽管现有的研究表明外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体与肿瘤的耐药[/size][/font][font='times new roman'][size=16px]性转移有关,但更详细的分子和遗传学分析对于确认上述研究并确定该过程中的潜在机制是十分重要的。[/size][/font]3. [font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体对宿主免疫功能的影响[/size][/font][font='times new roman'][size=16px]肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]不仅仅在[/size][/font][font='times new roman'][size=16px]肿瘤微环境[/size][/font][font='times new roman'][size=16px]起[/size][/font][font='times new roman'][size=16px]免疫抑制或免疫刺激作用,与循环[/size][/font][font='times new roman'][size=16px]系统[/size][/font][font='times new roman'][size=16px]以及各种淋巴器官中的免疫细胞也[/size][/font][font='times new roman'][size=16px]可以[/size][/font][font='times new roman'][size=16px]相互[/size][/font][font='times new roman'][size=16px]作用[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]例如,[/size][/font][font='times new roman'][size=16px]白血病胚泡衍生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体在血浆中[/size][/font][font='times new roman'][size=16px]聚集[/size][/font][font='times new roman'][size=16px]并直接与免疫细胞作用[/size][/font][font='times new roman'][size=16px][21][/size][/font][font='times new roman'][size=16px]。在肿瘤存在的情况下,外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体与周围免疫细胞的相互作用会导致免疫抑制[/size][/font][font='times new roman'][size=16px][22][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]实验性小鼠模型的体内研究表明,注射肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体后,外周免疫细胞的功能发生改变,这些改变[/size][/font][font='times new roman'][size=16px]导致[/size][/font][font='times new roman'][size=16px]肿瘤生长和更短的生长周期[/size][/font][font='times new roman'][size=16px][23][/size][/font][font='times new roman'][size=16px]。将离体分离的人[/size][/font][font='times new roman'][size=16px]T[/size][/font][font='times new roman'][size=16px]细胞、[/size][/font][font='times new roman'][size=16px]B[/size][/font][font='times new roman'][size=16px]细胞或[/size][/font][font='times new roman'][size=16px]NK[/size][/font][font='times new roman'][size=16px]细胞与肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体共同孵育,导致[/size][/font][font='times new roman'][size=16px]其[/size][/font][font='times new roman'][size=16px]介[/size][/font][font='times new roman'][size=16px]导的抗肿瘤功能部分或完全丧失,其机制与上述中外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的机制相同。癌症患者血液和淋巴器官中常见免疫抑制因子,并且似乎与血浆中外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的水平相关。循环肿瘤源性外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的分子和遗传特征部分反映了在肿瘤细胞中发现的分子和遗传特征,这些特征正在作为鉴定癌症进展的非侵入性生物标志物的潜在方法被广泛研究[/size][/font][font='times new roman'][size=16px][24][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]肿瘤源性外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的免疫抑制机制之一是癌症患者循环中活化的[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]效应细胞的凋亡。癌症患者循环中几乎所有的[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]淋巴细胞都表达表面[/size][/font][font='times new roman'][size=16px]CD95[/size][/font][font='times new roman'][size=16px],同时有许多表达[/size][/font][font='times new roman'][size=16px]PD-1 [/size][/font][font='times new roman'][size=16px][25][/size][/font][font='times new roman'][size=16px]。因此,它们分别受到携带[/size][/font][font='times new roman'][size=16px]FasL[/size][/font][font='times new roman'][size=16px]膜形式[/size][/font][font='times new roman'][size=16px]的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体或携带[/size][/font][font='times new roman'][size=16px]PD-L1[/size][/font][font='times new roman'][size=16px]的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的凋亡影响。这些凋亡诱导分子在外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体中的表达水平与癌症患者循环中对细胞凋亡敏感的活化[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]细胞的频率相关。此外,循环中的[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]细胞的“自发凋亡”与疾病分期和预后之间存在显着相关性[/size][/font][font='times new roman'][size=16px][26][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]TEX[/size][/font][font='times new roman'][size=16px]介[/size][/font][font='times new roman'][size=16px]导的导致活化[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]细胞凋亡的信号与靶细胞中的早期膜变化([/size][/font][font='times new roman'][size=16px]即膜联蛋白[/size][/font][font='times new roman'][size=16px]V[/size][/font][font='times new roman'][size=16px]结合)、半[/size][/font][font='times new roman'][size=16px]胱天冬酶[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]裂解、线粒体细胞色素[/size][/font][font='times new roman'][size=16px]C[/size][/font][font='times new roman'][size=16px]释放、线粒体膜电位([/size][/font][font='times new roman'][size=16px]MMP[/size][/font][font='times new roman'][size=16px])的损失以及最后的[/size][/font][font='times new roman'][size=16px]DNA[/size][/font][font='times new roman'][size=16px]片段[/size][/font][font='times new roman'][size=16px]化有关[/size][/font][font='times new roman'][size=16px][27][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px] PI3K / AKT[/size][/font][font='times new roman'][size=16px]途径成为活化的[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]细胞中肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的主要靶标。有研究发现调节[/size][/font][font='times new roman'][size=16px]PI3K-AKT[/size][/font][font='times new roman'][size=16px]信号的[/size][/font][font='times new roman'][size=16px]PTEN[/size][/font][font='times new roman'][size=16px]是外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的组成成分,并[/size][/font][font='times new roman'][size=16px]介[/size][/font][font='times new roman'][size=16px]导受体细胞中的磷酸酶活性。将活化的[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]细胞与肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体共同孵育会导致严重的时间依赖性[/size][/font][font='times new roman'][size=16px]AKT[/size][/font][font='times new roman'][size=16px]去磷酸化,并同时下调抗凋亡蛋白[/size][/font][font='times new roman'][size=16px]Bcl-2[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]Bcl-xL[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]MCl-1[/size][/font][font='times new roman'][size=16px]的表达水平,同时,肿瘤细胞分泌的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体会上调促凋亡蛋白[/size][/font][font='times new roman'][size=16px]Bax[/size][/font][font='times new roman'][size=16px][28][/size][/font][font='times new roman'][size=16px]。这些研究表明,肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体通过参与外在和[/size][/font][font='times new roman'][size=16px]内在的凋亡途径来诱导活化的[/size][/font][font='times new roman'][size=16px]CD8[/size][/font][font='times new roman'][size=16px]+[/size][/font][font='times new roman'][size=16px] T[/size][/font][font='times new roman'][size=16px]细胞凋亡[/size][/font][font='times new roman'][size=16px][22][/size][/font][font='times new roman'][size=16px]。体外数据与癌症患者循环[/size][/font][font='times new roman'][size=16px]T[/size][/font][font='times new roman'][size=16px]细胞中促凋亡或抗凋亡家族成员表达的类似变化的报道一致[/size][/font][font='times new roman'][size=16px][7][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体可能会激活宿主的免疫系统。由于发现了肿瘤相关抗原([/size][/font][font='times new roman'][size=16px]TAA[/size][/font][font='times new roman'][size=16px])、[/size][/font][font='times new roman'][size=16px]MHC[/size][/font][font='times new roman'][size=16px]分子、伴侣蛋白(例如热休克蛋白[/size][/font][font='times new roman'][size=16px]HSP-70[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]HSP-90[/size][/font][font='times new roman'][size=16px])等,因此,研究人员对肿瘤衍生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的免疫刺激作用进行了详细的研究。实际上,肿瘤细胞释放并被免疫系统内化的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体是开发抗肿瘤疫苗中[/size][/font][font='times new roman'][size=16px]TAA[/size][/font][font='times new roman'][size=16px]的良好来源[/size][/font][font='times new roman'][size=16px][29,30][/size][/font][font='times new roman'][size=16px]。有研究报道在鼠类肿瘤模型中进行的疫苗接种研究证实,使用肿瘤衍生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体进行有效的疫苗接种可诱导小鼠产生强大的抗肿瘤免疫力和肿瘤排斥反应[/size][/font][font='times new roman'][size=16px][31][/size][/font][font='times new roman'][size=16px]。基于这些报告,在人类临床试验中,肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体分别被认为是疫苗佐剂和治疗性疫苗的设计的免疫激活剂和免疫原性抗原的贡献者。[/size][/font]4. [font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体在血栓形成过程中的作用[/size][/font][font='times new roman'][size=16px]晚期恶性肿瘤患者可能会产生足以危及生命的血栓。有研究指出,携带转移因子([/size][/font][font='times new roman'][size=16px]Tf[/size][/font][font='times new roman'][size=16px])的肿瘤来源外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体可以诱导癌症相关的血栓形成[/size][/font][font='times new roman'][size=16px][32][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]Tf[/size][/font][font='times new roman'][size=16px]也被称为凝血因子,其在患者体内的过表达与肿瘤的进展和转移密切相关[/size][/font][font='times new roman'][size=16px][33][/size][/font][font='times new roman'][size=16px]。当癌细胞发生[/size][/font][font='times new roman'][size=16px]EMT[/size][/font][font='times new roman'][size=16px]过程时,它们开始释放含有高水平[/size][/font][font='times new roman'][size=16px]Tf[/size][/font][font='times new roman'][size=16px]的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体。这些富含[/size][/font][font='times new roman'][size=16px]Tf[/size][/font][font='times new roman'][size=16px]的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体可以被内皮细胞内化,并诱导其快速转化为促凝血表型。癌症患者血浆中存在大量促凝囊泡是一种不良预后因素[/size][/font][font='times new roman'][size=16px][32][/size][/font][font='times new roman'][size=16px]。但是,目前尚不清楚外[/size][/font][font='times new roman'][size=16px]泌体转移[/size][/font][font='times new roman'][size=16px]Tf[/size][/font][font='times new roman'][size=16px]及其促血栓作用如何促进癌症进展和转移形成。[/size][/font][font='times new roman'][size=16px]总结[/size][/font][font='times new roman'][size=16px]在过去的[/size][/font][font='times new roman'][size=16px]10[/size][/font][font='times new roman'][size=16px]年里,外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体作为细胞间传递信息的载体而被熟知。虽然信息传递可能是外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的主要生物学作用,但这种囊泡通讯机制似乎超越了几乎所有的细胞功能,并调节所有正常和异常细胞的分子和遗传特征。肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体引起了人们的兴趣,因为人们认为它们不仅能将肿瘤的信息传递给附近或远处的正常细胞,而且还能改变这些靶细胞的表型和功能,从而促进肿瘤的进展。在[/size][/font][font='times new roman'][size=16px]TME[/size][/font][font='times new roman'][size=16px]中,这些外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体直接或间接有助于肿瘤的发生发展。在癌症中,循环外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的负荷和功能与健康供体不同。肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体是血浆内容物的重要组成部分,它们的分子和基因图谱在疾病或治疗过程中发生变化,并且部分反映了母体肿瘤细胞的特征。此外,通过自分泌或旁分泌信号,肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体调节肿瘤生长,驱动新生血管形成、细胞分化、迁移和生存,并协调转移性肿瘤扩散。肿[/size][/font][font='times new roman'][size=16px]瘤来源的外[/size][/font][font='times new roman'][size=16px]泌体似乎[/size][/font][font='times new roman'][size=16px]在整个癌变过程中发挥作用,并被肿瘤细胞设定为促进癌变的过程。它们还能抑制抗肿瘤免疫反应。此外,它们还可以将癌基因和致癌蛋白或其转录本从肿瘤细胞中转移到正常细胞。有趣的是,正常造血或组织细胞产生的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体可以[/size][/font][font='times new roman'][size=16px]介[/size][/font][font='times new roman'][size=16px]导抗肿瘤反应并维持体内平衡。区分好的和坏的外[/size][/font][font='times new roman'][size=16px]泌体成为[/size][/font][font='times new roman'][size=16px]未来沉默肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体疗法的主要挑战。肿瘤来源的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体作为治疗靶点或癌症生物标志物进入这个领域之前,还需要进行更多的基础和临床工作。[/size][/font][align=center][font='times new roman'][size=21px][color=#000000]参考文献[/color][/size][/font][/align][1] [font='times new roman']Skog J, W[/font][font='times new roman']ü[/font][font='times new roman']rdinger[/font][font='times new roman'] T, Van Rijn S, et al. Glioblastoma [/font][font='times new roman']microvesicles[/font][font='times new roman'] transport RNA and proteins that promote [/font][font='times new roman']tumour[/font][font='times new roman'] growth and provide diagnostic biomarkers[/font][font='times new roman'][J].[/font][font='times new roman'] Nature Cell Biology, 2008, 10(12):1470-1476.[/font][2] [font='times new roman']Al-[/font][font='times new roman']Nedawi[/font][font='times new roman'] K, Meehan B, [/font][font='times new roman']Kerbel[/font][font='times new roman'] R S, et al. Endothelial expression of autocrine VEGF upon the uptake of tumor-derived [/font][font='times new roman']microvesicles[/font][font='times new roman'] containing oncogenic EGFR[J].[/font][font='times new roman'] [/font][font='times new roman']Proceedings of the National Academy of Sciences,[/font][font='times new roman'] [/font][font='times new roman']2009, 106(10):3794-3799.[/font][3] [font='times new roman']Bretz[/font][font='times new roman'] N P, [/font][font='times new roman']Ridinger[/font][font='times new roman'] J, Rupp A K, et al. Body fluid exosomes promote secretion of inflammatory cytokines in monocytic cells via Toll-like receptor signaling[J]. The Journal of biological chemistry, 2013, 288(51):36691.[/font][4] [font='times new roman']Chalmin[/font][font='times new roman'] F, [/font][font='times new roman']Ladoire[/font][font='times new roman'] S, Grégoire M, et al. Membrane-associated Hsp72 from tumor-derived exosomes mediates STAT3-dependent immunosuppressive function of mouse and human myeloid-derived suppressor cells[J]. Journal of Clinical Investigation, 2010, 120(2):457-471.[/font][5] [font='times new roman']Gross J C, Chaudhary V, [/font][font='times new roman']Bartscherer[/font][font='times new roman'] K, et al. Active [/font][font='times new roman']Wnt[/font][font='times new roman'] proteins are secreted on exosomes[J]. Nature Cell Biology, 2012, 14(10):1036-[/font][font='times new roman']10[/font][font='times new roman']45.[/font][6] [font='times new roman']Yang C, Kim S H, Bianco N R, et al. Tumor-Derived Exosomes Confer Antigen-Specific Immunosuppression in a Murine Delayed-Type Hypersensitivity Model[J]. [/font][font='times new roman']PLoS[/font][font='times new roman'] ONE, 2011, 6(8):1-11.[/font][7] [font='times new roman']Hoffmann T K, [/font][font='times new roman']Dworacki[/font][font='times new roman'] G, [/font][font='times new roman']Tsukihiro[/font][font='times new roman'] T, et al.[/font][font='times new roman'] Spontaneous Apoptosis of Circulating T Lymphocytes in Patients with Head and Neck Cancer and Its Clinical Importance[J]. Clinical Cancer Research, 2002, 8(8):2553-2562.[/font][8] [font='times new roman']Zhang H G, Grizzle W E. Exosomes: a novel pathway of local and distant intercellular communication that facilitates the growth and metastasis of neoplastic lesions[J]. The American Journal of Pathology, 2014, [/font][font='times new roman']184( 1[/font][font='times new roman']):28-41.[/font][9] [font='times new roman']Hood J L, San R S, Wickline S A. Exosomes Released by Melanoma Cells Prepare Sentinel Lymph Nodes for Tumor Metastasis[J]. Cancer Research, 2011, 71(11):3792-3801.[/font][10] [font='times new roman']Peinado[/font][font='times new roman'] H, [/font][font='times new roman']Aleckovic[/font][font='times new roman'] M, [/font][font='times new roman']Lavotshkin[/font][font='times new roman'] S, et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET[J]. Nature Medicine, 2012, 18(6):883.[/font][11] [font='times new roman']Yu S, Liu C, [/font][font='times new roman']Su[/font][font='times new roman'] K, et al. Tumor Exosomes Inhibit Differentiation of Bone Marrow Dendritic Cells[J]. Journal of Immunology, 2007, 178(11):6867-6875.[/font][12] [font='times new roman']Altevogt[/font][font='times new roman'] P, [/font][font='times new roman']Bretz[/font][font='times new roman'] N P, [/font][font='times new roman']Ridinger[/font][font='times new roman'] J, et al. Novel insights into exosome-induced, tumor-associated inflammation and immunomodulation[J]. Seminars in Cancer Biology, 2014, 28:51-57.[/font][13] [font='times new roman']Schuler P[/font][font='times new roman'] [/font][font='times new roman']J, [/font][font='times new roman']Saze[/font][font='times new roman'] Z, Hong C[/font][font='times new roman'] [/font][font='times new roman']S, et al. [/font][font='times new roman']Human CD4+CD39+ regulatory T cells produce adenosine upon co-expression of surface CD73 or contact with CD73+ exosomes or CD73+ cells[J]. Clinical & Experimental Immunology, 2014, [/font][font='times new roman']177[/font][font='times new roman'](2)[/font][font='times new roman']:531[/font][font='times new roman']-5[/font][font='times new roman']43.[/font][14] [font='times new roman']Muller-[/font][font='times new roman']Haegele[/font][font='times new roman'] S, Muller L, Whiteside T L. Immunoregulatory activity of adenosine and its role in human cancer progression[J]. Expert Review of Clinical Immunology, 2014, 10(7):897.[/font][15] [font='times new roman']Safaei[/font][font='times new roman'] R, Larson B[/font][font='times new roman'] [/font][font='times new roman']J, Cheng T[/font][font='times new roman'] [/font][font='times new roman']C, et al. Abnormal lysosomal trafficking and enhanced [/font][font='times new roman']exosomal[/font][font='times new roman'] export of cisplatin in drug-resistant human ovarian carcinoma cells[J].[/font][font='times new roman'] Molecular Cancer Therapeutics, 2005, 4(10):1595-1604.[/font][16] [font='times new roman']Mrizak[/font][font='times new roman'] D, Martin N, [/font][font='times new roman']Barjon[/font][font='times new roman'] C,[/font][font='times new roman'] [/font][font='times new roman']et al. Effect of nasopharyngeal carcinoma-derived exosomes on human regulatory T cells[J]. [/font][font='times new roman']Journal of the National Cancer Institute,[/font][font='times new roman'] 2015[/font][font='times new roman'], [/font][font='times new roman']107(12):363.[/font][17] [font='times new roman']Ciravolo[/font][font='times new roman'] V, Huber V, [/font][font='times new roman']Ghedini[/font][font='times new roman'] G[/font][font='times new roman'] [/font][font='times new roman']C, et al.[/font][font='times new roman'] Potential role of HER2-overexpressing exosomes in countering trastuzumab-based therapy[J]. Journal of Cellular Physiology, 2012, 227(2):658-667.[/font][18] [font='times new roman']Amorim M, Fernandes G, Oliveira P, et al. The overexpression of a single oncogene (ERBB2/HER2) alters the proteomic landscape of extracellular [/font][font='times new roman']vesicles[/font][font='times new roman'].[/font][font='times new roman'][[/font][font='times new roman']J]. Proteomics, 2014, 14(12)[/font][font='times new roman']:1472-1479[/font][font='times new roman'].[/font][19] [font='times new roman']Claire C, Sweta R, O’Brien Keith, et al. Docetaxel-Resistance in Prostate Cancer: Evaluating Associated Phenotypic Changes and Potential for Resistance Transfer via Exosomes[J]. [/font][font='times new roman']Plos[/font][font='times new roman'] One, 2012, 7(12[/font][font='times new roman']):e[/font][font='times new roman']50999-.[/font][20] [font='times new roman']Federici C, Petrucci F, [/font][font='times new roman']Caimi[/font][font='times new roman'] S, et al. Exosome Release and Low pH Belong to a Framework of Resistance of Human Melanoma Cells to Cisplatin[J]. [/font][font='times new roman']Plos[/font][font='times new roman'] One, 2014, [/font][font='times new roman']9(2[/font][font='times new roman']):e[/font][font='times new roman']88193[/font][font='times new roman'].[/font][21] [font='times new roman']Szczepanski[/font][font='times new roman'] M[/font][font='times new roman'] [/font][font='times new roman']J, [/font][font='times new roman']Szajnik[/font][font='times new roman'] M, Welsh A,[/font][font='times new roman'] et al[/font][font='times new roman']. Blast-derived [/font][font='times new roman']microvesicles[/font][font='times new roman'] in sera from patients [/font][font='times new roman']with acute myeloid leukemia suppress natural killer cell function via [/font][font='times new roman']membraneassociated[/font][font='times new roman'] transforming growth factor-beta1[J]. [/font][font='times new roman']Haematologica[/font][font='times new roman'], [/font][font='times new roman']2011[/font][font='times new roman'], [/font][font='times new roman']96[/font][font='times new roman'](9)[/font][font='times new roman']:1302[/font][font='times new roman']-130[/font][font='times new roman']9.[/font][22] [font='times new roman']Whiteside T[/font][font='times new roman'] [/font][font='times new roman']L. Immune modulation of T-cell and NK (natural killer) cell activities by TEXs ([/font][font='times new roman']tumour[/font][font='times new roman']-derived [/font][font='times new roman']exosomes)[[/font][font='times new roman']J]. Biochemical Society Transactions, 2013, 41(1):245-251.[/font][23] [font='times new roman']Curtale[/font][font='times new roman'] G, [/font][font='times new roman']Citarella[/font][font='times new roman'] F, [/font][font='times new roman']Carissimi[/font][font='times new roman'] C, et al. An emerging player in the adaptive immune response: microRNA-146a is a modulator of IL-2 expression and [/font][font='times new roman']activationinduced[/font][font='times new roman'] cell death in T lymphocytes[J]. Blood[/font][font='times new roman'], [/font][font='times new roman']2010[/font][font='times new roman'],[/font][font='times new roman'] 115[/font][font='times new roman'](2)[/font][font='times new roman']:265[/font][font='times new roman']-2[/font][font='times new roman']73.[/font][24] [font='times new roman']Dinarello[/font][font='times new roman'] C A. Interleukin-1 and interleukin-1 [/font][font='times new roman']antagonism[/font][font='times new roman'].[/font][font='times new roman'][[/font][font='times new roman']J].[/font][font='times new roman'] Blood, 1991, 77(8):1627.[/font][25] [font='times new roman']Schuler P[/font][font='times new roman'] [/font][font='times new roman']J, Schilling B, [/font][font='times new roman']Harasymczuk[/font][font='times new roman'] M, et al. Phenotypic and functional characteristics of CD4+ CD39+ FOXP3+ and CD4+ CD39+ FOXP3neg T-cell subsets in cancer patients[J]. [/font][font='times new roman']European Journal of Immunology,[/font][font='times new roman'] 2012[/font][font='times new roman'],[/font][font='times new roman'] 42[/font][font='times new roman'](7)[/font][font='times new roman']:187[/font][font='times new roman']6-18[/font][font='times new roman']85.[/font][26] [font='times new roman']Kim J[/font][font='times new roman'] [/font][font='times new roman']W, [/font][font='times new roman']Wieckowski[/font][font='times new roman'] E, Taylor D[/font][font='times new roman'] [/font][font='times new roman']D[/font][font='times new roman'], [/font][font='times new roman']et al[/font][font='times new roman']. [/font][font='times new roman']Fas[/font][font='times new roman'] ligand-positive membranous vesicles isolated from sera of patients with oral cancer induce apoptosis of activated T lymphocytes[J]. [/font][font='times new roman']Clinical Cancer Research,[/font][font='times new roman'] 2005[/font][font='times new roman'],[/font][font='times new roman'] 11[/font][font='times new roman'](3)[/font][font='times new roman']:1010[/font][font='times new roman']-10[/font][font='times new roman']20[/font][font='times new roman'].[/font][27] [font='times new roman']Czystowska[/font][font='times new roman'] [/font][font='times new roman']M, Han J, [/font][font='times new roman']Szczepanski[/font][font='times new roman'] M J, et al. IRX-2, a novel immunotherapeutic, protects human T cells from tumor-induced cell death[J]. Cell Death & Differentiation, 2009, 16(5):708-718.[/font][28] [font='times new roman']Czystowska[/font][font='times new roman'] M, [/font][font='times new roman']Szczepanski[/font][font='times new roman'] M J, [/font][font='times new roman']Szajnik[/font][font='times new roman'] M, et al. Mechanisms of T-cell protection from death by IRX-2: a new immunotherapeutic[J]. Cancer Immunology Immunotherapy, 2011, 60(4):495-506.[/font][29] [font='times new roman']Li W, Kong L[/font][font='times new roman'] [/font][font='times new roman']B, Li J[/font][font='times new roman'] [/font][font='times new roman']T, et al. MiR-568 inhibits the activation and function of CD4(+) T cells and Treg cells by targeting NFAT5[J]. International Immunology[/font][font='times new roman'],[/font][font='times new roman'] 2014[/font][font='times new roman'],[/font][font='times new roman'] 26(5):269–[/font][font='times new roman']2[/font][font='times new roman']81.[/font][30] [font='times new roman']Gracias D T, [/font][font='times new roman']Katsikis[/font][font='times new roman'] P D. MicroRNAs: key components of immune regulation[J]. [/font][font='times new roman']Advances in experimental medicine and biology,[/font][font='times new roman'] 2011[/font][font='times new roman'],[/font][font='times new roman'] 780:15[/font][font='times new roman']-[/font][font='times new roman']26[/font][font='times new roman'].[/font][31] [font='times new roman']Baxevanis[/font][font='times new roman'] C[/font][font='times new roman'] [/font][font='times new roman']N, [/font][font='times new roman']Anastasopoulou[/font][font='times new roman'] E[/font][font='times new roman'] [/font][font='times new roman']A, [/font][font='times new roman']Voutsas[/font][font='times new roman'] I[/font][font='times new roman'] [/font][font='times new roman']F, [/font][font='times new roman']et al[/font][font='times new roman']. Immune biomarkers: how well do they serve prognosis in human [/font][font='times new roman']cancers?[[/font][font='times new roman']J]. Expert review of molecular diagnostics[/font][font='times new roman'],[/font][font='times new roman'] 2015[/font][font='times new roman'],[/font][font='times new roman'] 15[/font][font='times new roman'](1)[/font][font='times new roman']:49–59.[/font][32] [font='times new roman']Chowdhury F, Williams A, Johnson P. Validation and comparison of two multiplex technologies, Luminex and Mesoscale Discovery, for human cytokine profiling[J]. Journal of Immunological Methods, 2009, 340(1):55-64.[/font][33] [font='times new roman']Dai R, Ahmed S A. MicroRNA, a new paradigm for understanding immunoregulation, inflammation, and autoimmune diseases[J]. Translational Research, 2011, 157(4):163-179.[/font]
[size=15px][color=#595959]在全球范围内,[/color][/size][b][size=15px][color=#595959]乳腺癌[/color][/size][/b][size=15px][color=#595959]是女性中最常见的[/color][/size][b][size=15px][color=#595959]恶性肿瘤[/color][/size][/b][size=15px][color=#595959],也是中国女性中最常见的癌症,是第五大癌症死亡原因。此外,乳腺癌已成为威胁全世界妇女健康的严重疾病。目前,乳腺癌的主要治疗方法是手术、放疗和化疗。化疗是不能接受手术的乳腺癌患者最重要的治疗方法之一。然而,[/color][/size][b][size=15px][color=#595959]放化疗[/color][/size][/b][size=15px][color=#595959]的严重副作用往往会阻碍治疗计划的实施,导致治疗效果不理想。[/color][/size] [size=15px][color=#595959]许多研究表明,中药在治疗癌症方面具有独特的优势,可以改善乳腺癌患者的[/color][/size][b][size=15px][color=#595959]生活质量[/color][/size][/b][size=15px][color=#595959]。因此,研究中药的抗乳腺癌作用及其分子机制对乳腺癌的治疗具有重要意义。[b]小柴胡汤(XCH)[/b]是中药经典方剂,最早载于《伤寒论》,并已载入《中华人民共和国药典》。在中国,XCH在临床上用于治疗多种肿瘤,如[/color][/size][b][size=15px][color=#595959]肺癌[/color][/size][size=15px][color=#595959]、[/color][/size][size=15px][color=#595959]结直肠癌[/color][/size][size=15px][color=#595959]、[/color][/size][size=15px][color=#595959]肝癌[/color][/size][/b][size=15px][color=#595959]等,也包括乳腺癌。然而,其潜在的作用机制尚不明确。[/color][/size] [size=15px][color=#595959][/color][/size][size=15px][color=#595959]采用[b]Q - Exactive Orbitrap[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-质谱联用技术([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)[/b]对XCH煎剂中的化学成分进行鉴定。然后,从中药系统药理学数据库与分析平台(TCMSP)中筛选XCH汤的有效成分和靶点。接下来,利用Cytoscape和metscape构建了一个活性成分-靶标-疾病网络,其中包括蛋白质-蛋白质相互作用(PPI)网络、GO富集分析和京都基因与基因组百科全书(KEGG)途径分析。最后通过分子对接和体外实验对[b]网络药理学[/b]分析结果进行验证。[/color][/size][size=15px][color=#595959][/color][/size] [align=center] [/align] [size=15px][color=#595959][/color][/size][size=15px][color=#595959]通过Q Exactive Orbitrap [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析,鉴定出70多种主要化合物。共鉴定出XCH煎剂与乳腺癌相关的162种有效成分和153个靶点,构建复方靶点-疾病网络。GO和KEGG分析显示,XCH煎剂调节[b]药物反应、细胞凋亡过程、肿瘤通路和PI3K/Akt信号通路[/b]。分子对接和实验验证表明,XCH汤通过调节凋亡相关蛋白的表达,[b]抑制PI3K/Akt通路,抑制乳腺癌细胞增殖,诱导细胞凋亡[/b]。[/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size] [b][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][/b][size=15px][color=#595959]该研究提示XCH煎剂可通过抑制细胞增殖、诱导细胞凋亡、下调PI3K/Akt信号通路来治疗乳腺癌,为XCH汤在乳腺癌治疗中的临床应用提供了理论依据。[/color][/size]
文章出处:Natural killer cell education and tolerance. Cell. 2010. 142:847-856综述背景与主要内容:NK细胞作为继T细胞、B细胞之后的第三大类淋巴细胞,对它的研究已经超过了30年,对其的认识也在一步一步的加深。NK细胞最主要的功能是杀伤病毒感染细胞和转化了的肿瘤细胞,从而起到免疫防御和免疫自稳的作用。从一开始,大家就提出了关于NK细胞如何识别“自我”与“非我”的问题,也就是为什么NK细胞不会杀伤正常的细胞,而专杀病毒感染细胞和肿瘤细胞呢?随着NK细胞众多活化性受体和抑制性受体的发现似乎解释了这一问题,尤其是识别自身MHC I类分子的抑制性受体的发现,认为机体有核细胞都表达MHC I类分子,NK细胞接受自身MHC I类分子的抑制性信号所以不会杀伤自身正常细胞,而病毒感染细胞和肿瘤细胞MHC I类分子下调,NK细胞抑制性信号下降,活化性信号占主导,NK细胞活化从而杀伤这些细胞。但是,随着研究的深入,发现事实并不是如此简单,有些NK细胞并不表达识别MHC I类分子的抑制性受体,或者表达的抑制性受体不识别自身的MHC I类分子。但是这些NK细胞却并不杀伤正常细胞,也不杀伤MHC I类分子缺陷的细胞。另外,无核的红细胞并不表达MHC I类分子,NK细胞也并不杀伤正常的红细胞。虽然自身免疫性疾病有很多,但是没有证据表明NK细胞是导致自身免疫性疾病的主要细胞,自身免疫性疾病一般都是由T细胞或B细胞自身耐受被打破导致的,说明NK细胞自身耐受机制比T细胞和B细胞要完善。逐着研究的深入,对NK细胞耐受的机制的研究也取得了重要突破,本文全面介绍了NK细胞耐受机制研究的重要进展。NK细胞耐受机制(本人总结):1、经典方式:NK细胞表达识别自身MHC I类分子的抑制性受体,机体正常细胞通过表达MHC I类分子抑制NK细胞对机体正常细胞的杀伤。2、NK细胞表达的识别自身配体的活化性受体长期接触机体正常细胞表达的自身配体能够诱导NK细胞耐受。证据1:NKG2D是NK细胞重要的活化性受体,其配体是Rae-1家族,该配体在机体出生前高表达,出生后不表达。所以,NK细胞可以直接杀伤表达Rae-1配体的细胞。但是转基因持续表达该配体的小鼠的NK细胞则表现为对这些配体的耐受,无法杀伤表达该配体的细胞。证据2:Ly49D识别H-2Dd,来源于H-2Dd缺陷小鼠的Ly49D阳性NK可以杀伤表达H-2Dd的细胞。证据3:Ly49H识别MCMV编码的m157,野生型Ly49H阳性NK细胞可以杀伤表达m157的细胞;但是转基因表达m157小鼠来源的Ly49H阳性NK细胞则无法杀伤表达m157的细胞。而且,将野生型Ly49H阳性NK细胞过继转移到转基因表达m157小鼠内,该NK细胞也将耐受,无法杀伤表达m157的细胞。3、正常机体内存在不表达识别自身MHC I类分子的抑制性受体的NK细胞,这些NK细胞在正常机体内表现为耐受状态。在感染或者炎症条件下,这些NK细胞将打破耐受状态,具有较强的杀伤功能,但是,此时这些NK细胞也不会杀伤自身正常的细胞,因为这些NK细胞表达识别其它自身抗原分子的抑制性受体,如识别CD48的CD244抑制性受体,识别LLT1的CD161抑制性受体等。