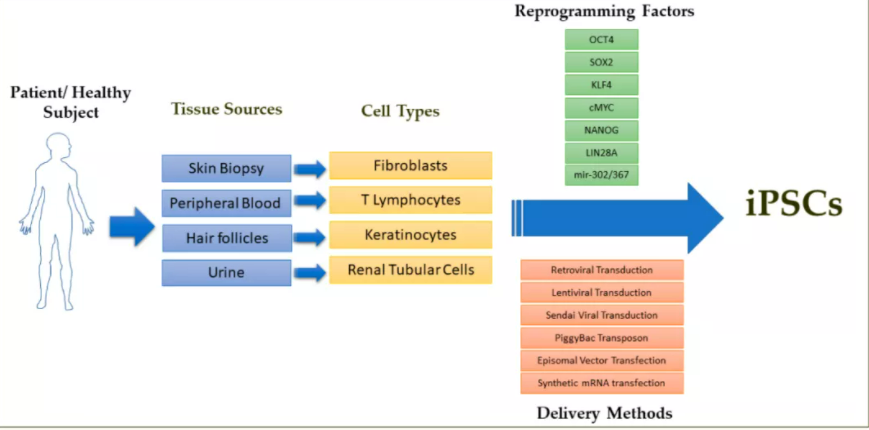
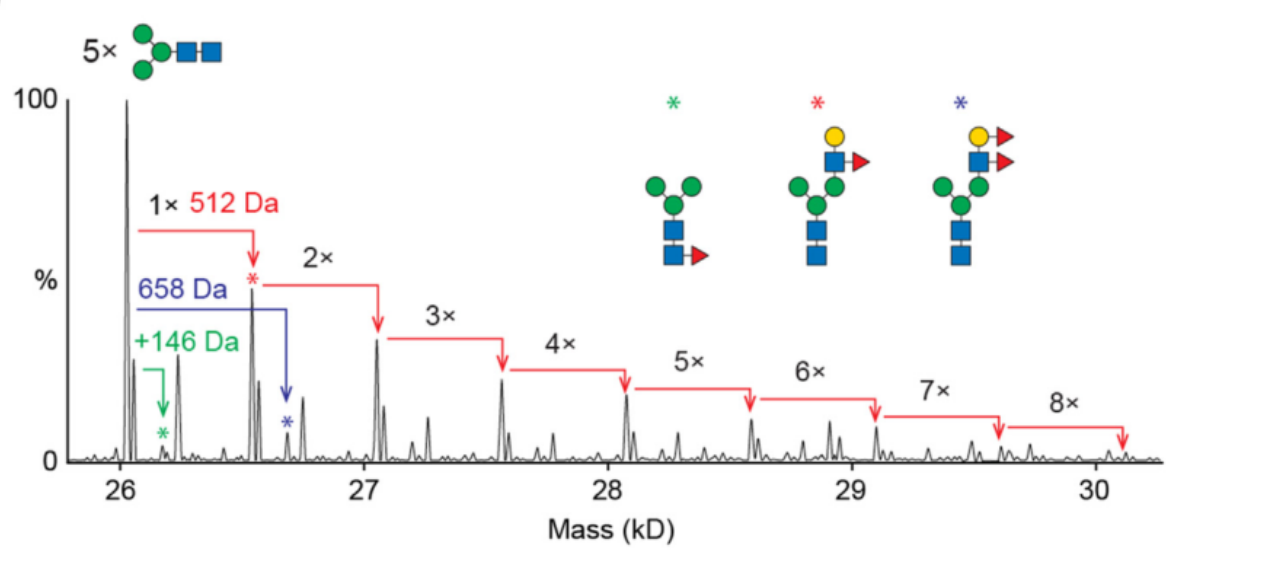
胶原蛋白企业亮出检测报告自证清白 各自执行企业标准
10月8日,有媒体声称其自行送检的7款口服胶原蛋白产品中3款并未检出胶原蛋白的特征氨基酸&mdash &mdash 羟脯氨酸。对于这一结果,相关企业均强烈否认并亮出检测报告自证清白。据了解行业内一直未形成对于胶原蛋白产品的统一标准,各大公司执行自己的企业标准。 胶原蛋白产品不含胶原蛋白? 涉事企业强烈否认 胶原蛋白可谓命运多舛,日前又被爆成分争议&ldquo 不含胶原蛋白&rdquo 。昨日,有媒体声称其自行送检的7款口服胶原蛋白产品中,汤臣倍健胶原蛋白粉、颜如玉胶原蛋白口服液、无限极美姿力胶原蛋白果味饮料等3款产品中,并未检出胶原蛋白的特征氨基酸&mdash &mdash 羟脯氨酸。另外Fancl、Lumi、丸美、安婕妤4款产品胶原蛋白含量则远低于宣称的含量。不过,报道未披露具体数据,也未交代其送检机构。对于这一结果,相关企业均强烈否认并亮出检测报告&ldquo 自证清白&rdquo 。 记者了解到,目前胶原蛋白产品始终未有统一标准,特异性指标也未能明确,造成行业频频陷入舆论危机。 从成本看似无造假必要 汤臣倍健昨日在给本报的声明说,其胶原蛋白采购自法国罗赛洛公司,检测显示羟脯氨酸含量为9.33%,并能提供检测报告。该公司指,一直严守法律法规以及食品安全标准。 无限极声明表示,报道提及的产品其生产标准在广东省卫生厅备案,原料经第三方权威机构检测完全符合国家相关法律法规和标准,昨日已再次送检,结果会及时公布。 而广州颜如玉医药科技有限公司的声明则称,上述口服液取得国家保健食品批准证书,标志性成分为低聚肽而非羟脯氨酸。此外,有关产品是海洋鱼皮胶原低聚肽口服液,而不是胶原蛋白口服液,用评价胶原蛋白的方法来评价低聚肽是不专业的,&ldquo 被检产品未经我们公司确认,是否属实,不得而知。&rdquo 羟脯氨酸是胶原蛋白18种氨基酸中的一种,为胶原蛋白特有,但从成本角度看,企业似乎并无造假必要。南海水产研究所一位研究员昨日对本报说,只要采用一般鱼类的&ldquo 边角料&rdquo 进行水解就能提取,&ldquo 甚至不法之徒用皮革的下脚料,也能得到羟脯氨酸。&rdquo 记者翻查资料发现,乳业之前曾热炒&ldquo 皮革奶&rdquo ,即添加皮革下脚料来&ldquo 增加&rdquo 蛋白质,科研人员就是通过检测奶中是否含有羟脯氨酸来辨别的。&ldquo 普通猪皮中就能弄出羟脯氨酸。&rdquo 上述研究员说。 各公司执行自己的标准 不过,胶原蛋白近期先后被质疑功效、涉嫌违法宣传,还是让这种在近年被不断应用于食品、保健品、化妆品中的成分受到了高度关注。记者了解到,事实上目前胶原蛋白仍未有国标,消费者对其作用也是&ldquo 蒙查查&rdquo 。 目前,我国已认可胶原蛋白、胶原肽的保健功效只有保护皮肤水分、增加骨密度、增强免疫力三项。但市民麦小姐说,她选购胶原蛋白的理由是冲着它&ldquo 可以修复肌肤、保持弹性,人变得更年轻。&rdquo 据记者昨日获得的一份由中国食品科学技术学会在2011年撰写的胶原蛋白标准研讨会摘要显示,在2010年国内胶原蛋白年产值保守估计已经达到100亿元,产能在600多吨或日本的十分之一。 该学会指出,在胶原蛋白生产过程中都存在水解或酶解过程,最终很多产品已经以多肽的形式存在,因此行业内一直未形成对于胶原蛋白产品的统一标准。此外,行业也需要明确胶原蛋白的特异性指标,例如羟脯氨酸的含量比例,或者是甘氨酸、脯氨酸和羟脯氨酸的总含量占到蛋白质的50%左右。 记者还了解到,《水解胶原蛋白》国标曾在2007年对外征求意见,但该稿一度被业内指出&ldquo 操作性不够好&rdquo ,而且最终版本始终未能落地。目前各大公司执行自己的企业标准。 胶原蛋白或将 禁止以口服液形式销售 国庆长假期间,国家食品药品监督管理总局在官方网站征求对保健食品监管新规的意见,提出拟于2014年1月1日起,禁止食品以片剂、胶囊、口服液、丸剂等形状生产销售,&ldquo 如仅取得食品生产许可(QS标志),国家食药总局拟于2014年1月1日起,禁止其以片剂、胶囊、口服液、丸剂等形状生产销售 禁止营养补充剂宣称有保健功能。&rdquo 而据记者走访药店、超市、便利店以及从业界了解得知,目前市面上充斥的大量胶原蛋白产品刚好就处于此政策&ldquo 打击&rdquo 范围内:基本上既属于普通食品,又主要以口服液形式存在。&ldquo 不少消费者将胶原蛋白口服液当美颜饮料喝,而且相信了其铺天盖地宣传的保健功效,但实际上它作为普通食品,功效推广属于违法,而且口服液形式也会暗示和催眠消费者,其具有不错的保健功效甚至药效。&rdquo 一位行业观察人士表示,胶囊和口服液暗示产品的药用性太强,的确应进行规范整顿。