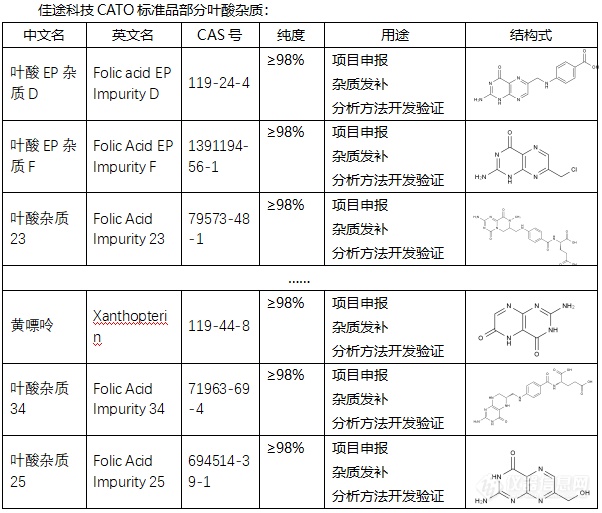
[font=宋体]◇叶酸杂质[/font][font='Segoe UI'][color=#05073b][font=Segoe UI] 叶酸杂质通常是指在叶酸的生产或保存过程中产生的非目标化合物。这些杂质可能会影响叶酸的纯度和效果,因此在叶酸的生产和质量控制过程中需要严格控制其含量。叶酸杂质有多种类型,每一种都具有不同的化学特性,如[/font]CAS号、分子式、分子量等。例如,有一种叶酸杂质CAS号为82778-08-3,分子式为C7H7ClN6HCl,分子量为247.08。另一种叶酸杂质G的CAS号为6810-75-9,英文名称为Folinic Acid Impurity G。此外,叶酸杂质5的CAS号为873397-19-4,纯度为98% HPLC。[/color][/font][font=宋体][font=Calibri] CATO[/font][font=宋体]标准品提供的叶酸全套的杂质[/font][/font][font=宋体],[/font][font=宋体]这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分[/font][font=宋体]。[img=,602,513]https://ng1.17img.cn/bbsfiles/images/2024/02/202402182015587706_5356_6381607_3.png!w602x513.jpg[/img][/font][font=宋体][color=#05073b][back=#fdfdfe] 广州[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]佳途科技[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]股份有限公司[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]深知药物研发与质量控制的重要性[/back][/color][/font][font=宋体][font=宋体],[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供叶酸全套[/font][/font][font=宋体]的[/font][font=宋体]杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展[/font][font=宋体],[/font][font=宋体]以满足客户在药物研发和质量控制方面的需求。[/font]
在标准物质证书或标签上都有纯度,大家配制标液时会将这个纯度带入计算吗,为什么?
大家使用标准物质计算,如使用标准物质稀释配置工作曲线,标准物质的纯度问题不可忽略,大家在计算的时候是如何考虑的?
标准品在称量时是否考虑物质的纯度,我的标准品一个浓度标的是大于等于95%,另一个标准品的是97%,我称量时是否要考虑浓度的问题?是否要折算成%?最后用上面的标准品配成2500ppm或150ppm溶液去做标准曲线。
有机标准物质配置标准曲线,一般习惯性称重法,有些标准如EPA8270D提到标准品纯度达到96以上,其实际计算时候纯度可忽略不计,大家觉得了?
以前买各种有机标准物质,总会有张证书,上面有一大串洋文,最主要的有标准浓度在上面,一般是98%,99%居多、、最近又买了一大批化妆品的标准物质,一张张证书在看时,突然发现一个问题,很多98%,99%之前会有个小括号(GC)或(LC),想了一会才明白,原来那个所谓的纯度结果是通过在GC或LC上做归一化得到的我灌水!!天!!这算什么标准纯度!如果我在标准物质里掺点食盐,上去液相或测量,一样不会有干扰峰,得出的结果是纯度很高,所以有GC,LC符号有纯度也就只能糊弄人、、找了不少人讨论这个问题,大多数人没有意识到,意识到了人也不知道怎么办好,也有人提出了只能元素分析比例,但是成本和技术难度太高,没法可行。难道就这么凑合用下去 ??欢迎大家讨论!

接触国外标准物质多了,发现对于纯度的表示真是五花八门,有的纯度标识≥98%,有的纯度标识>99%,如下图(见图中正文第五行)[img=,690,586]http://ng1.17img.cn/bbsfiles/images/2017/05/201705161522_01_1645752_3.jpg[/img] 那我配制标准溶液,需要一个确定的值啊!神啊,你们说我该取哪个值??! 纯度标识为≥98%,我当做98%的纯度来使用?那纯度标识>99%的,我?我??
是不是所有的标准物质纯度都很高呀?
刚买来的标准品由于状态是粉末状,所以需要先进行称量,但标准品是96.5%的纯度,如果我想配制1mg/ml的标准溶液,那么我在称标准品时是否要考虑纯度问题呢,就是换算一下,比如要称50mg标准物质(万分之一天平),最后真正称的量是50/96.5%=51.81mg,然后再用这个量定容到50ml,请问这种做法对不对,还是直接称取50mg的标准品,不考虑纯度问题,哪位有经验的朋友指点下,谢谢!
我们购买的标准物质都不是100%的纯物质,都是有一定杂质含量的,如果我想验证一下厂家给出的标准物质的纯度是否正确,那么怎样来测定农药标准物质的纯度呢?哪些地方可以检测?需要用到什么仪器和方法?大概需要的标准物质的量是多少呢?请大家指教,非常感谢!
张老师好,请问可以通过购买一级/二级纯度标准物质配制一级或二级溶液标准物质吗?
GB 5009.211-2014微生物法测定叶酸标准3.5.1叶酸标准储备液20.5ug/mL的配制:精确称取20.mg叶酸标准品,用氢氧化钠乙醇溶液定容至1000mL,然后在256nm处进行了标定,得到浓度为c1。然后3.5.2配制叶酸标准中间液(0.200ug/mL)时,是吸取1mL上述储备液定容至100mL,但没有用到标定浓度c1啊,这不符合试剂配制原理吧,还是说有什么特殊情况?6.7测定 部分,测定时采用的是540nm,但是标定时采用的254nm,为什么不一样呢?问题1:标准储备液标定的作用是什么?问题2:标定和检测时的波长为什么不一致?
我们需要50克/瓶的二苯胺纯度标准物质,含量在99.9%以上的,有标准物质证书的。查了很多网站都没有这个规格的了请问哪位朋友知道哪里有卖的。分享一下网站或介绍一下。万分感谢
1.原理叶酸是酪乳酸杆菌(Lactobacillus casei, L. C, ATCC 7469)生长所必需的营养素。在一定条件下,L.C的生长繁殖与培养基中叶酸含量呈正比关系,细菌增殖的量以光密度值计,通过与标准曲线相比较,计算出样品中叶酸的含量。2.适用范围参考《Methods of Vitamin Assay》,第4版。本方法适用于各类食物中叶酸的测定。检测限为0.1ng。3.仪器与设备(1) 恒温培养箱(2) 离心机(3) 高压消毒锅(4) 震荡器(5) 接种针和接种环(6) 分光光度计4.试剂除特殊说明外,本实验中所有试剂均为分析纯,水为蒸馏水。(1) 菌种:酪乳酸杆菌(Lactobacillus casei, L.C, ATCC 7469)(2) 磷酸缓冲液(0.05mol/L, pH6.8):称取4.35g Na3PO412H2O,10.39g Na2HPO47H2O溶解于800ml水中。临用前用约5g抗坏血酸调节pH至6.8。(注:叶酸对光、热敏感,易被氧化破坏,抗坏血酸有助于保护叶酸被氧化。)(3) 鸡胰酶溶液: 称取100mg干燥的鸡胰酶(Difco公司)(注:含有叶酸轭合酶,用于水解叶酸多谷氨酸盐), 加入20ml磷酸缓冲液制成匀浆,3000rpm离心10min,取上清液备用。临用前现配。(4) 蛋白酶-淀粉酶溶液:分别称取200mg蛋白酶(Sigma公司)和淀粉酶(Sigma公司),加入20ml磷酸缓冲液制成匀浆,离心3000rpm 10min,取上清液备用。临用前配制。(5) 2+8乙醇溶液:量取20ml无水乙醇溶液,加入80ml水混匀。(6) 01mol/L NaOH: 称取0.4g氢氧化钠,加2+8乙醇溶液溶解并稀释至1L。(7) 10mol/L NaOH。称取400g氢氧化钠,加水溶解并稀释至1L。(8) 叶酸标准储备液(200mg/ml):准确称取200mg叶酸标准品(Sigma公司,纯度大于98%),用0.01mol/L NaOH溶解并定容至1L。储存于棕色瓶中。(9) 叶酸标准中间液(200ng/ml):准确吸取1.0ml叶酸标准储备液,用0.01mol/L NaOH 溶解并定容至1L。储存于棕色瓶中。待标定。标定:准确吸取1ml叶酸标准中间液,用0.1mol/L NaOH定容至10ml。以0.1mol/L NaOH调零点,比色杯厚度1cm,波长256nm,测定3次紫外吸光度值,取平均值,按下式计算标准中间液浓度。X1 =A/E×M ×10×10E6 …………………(1) ` 式中:X1 -- 叶酸标准中间液浓度,ng/ml;A -- 标准中间液平均紫外吸光度值;E -- 摩尔消光系数24,500;M -- 叶酸分子量441.42;10-- 测定紫外吸光度值时的稀释倍数;106 -- 由g/L换算成ng/ml的换算系数。(10) 叶酸标准工作液(0.2ng/ml):准确吸取1.0ml叶酸标准中间液,用磷酸缓冲液稀释定容至1L。(11) 2.4mol/L HCl:量取20ml浓盐酸,加水稀释至100ml。(12) 酶解酪蛋白溶液:将8g碳酸氢钠溶解于1L水中,加入60g去维生素酪蛋白(Sigma 公司),用10mol/L NaOH调节pH至 8.0(调pH时应小心,不要过碱后再加酸反复调节,避免酪蛋白结块)。加入300mg胰酶,搅拌20min,使胰酶混匀充分。再加入2.5ml甲苯,置37℃恒温箱酶解48~72h(此步骤是将酪蛋白酶解为L.C可以利用的小分子肽。酶解时间不易超过72h,如时间过长,配成的培养基不利于细菌生长)。将酪蛋白液从恒温箱中取出,121℃高压30min以终止反应并去除甲苯。冷却,加10g硅藻土搅拌,用垫有滤纸的布氏漏斗过滤。向滤液中加入约60ml冰乙酸调节pH至3.7。称取活性炭12g,加入滤液中搅拌10min,用布氏漏斗过滤,重复三次。每次过滤时,布氏漏斗内加有10g硅藻土协助过滤。最后滤液用水稀释至1200ml,4℃冰箱保存1年(活性碳可吸附酪蛋白中的叶酸以减少试剂空白,同时也可吸附肽及氨基酸,应注意控制搅拌时间)。取10ml酶解后的酪蛋白溶液加入已称重的蒸发皿中,沸水浴蒸发至干。将蒸发皿置于100℃恒温烤箱内干燥至恒重,在干燥器中冷却至室温。称量蒸发皿的重量,蒸发皿内固体重量,如固体重量小于400mg,即每毫升酪蛋白溶液中固体含量40mg,则弃除酪蛋白液,重新制备。(13) 黄嘌呤溶液:取0.4g黄嘌呤,加入10ml氨水,加热溶解,用水稀释至100ml。冰箱保存。
各位亲们,今天看到了一份萘D8(八氘萘)的标准物质证书(如图),上面显示了两个纯度信息,想跟大家讨论下,如果是你使用这份标准物质证书对应的物质配制标准溶液,你会采用哪个纯度呢?为什么?http://ng1.17img.cn/bbsfiles/images/2013/08/201308271837_460332_1760328_3.bmp
你们好,我想请教一下,用液相做氨基酸检测所需要用的标准品的纯度应该在多少以上啊?是不是用国家级标准物质会浪费?今天联系了很多供应商,想请购苏氨酸单独标准品,国家标准物质网上的苏氨酸对照品的价格在70元(100mg/瓶),标准物质750元/瓶(200mg/瓶),和别的供应商联系说中检所的标准品要600多元/瓶,纯度在99%,现在我就不确定了,到底标准品和标准物质是不是一样的,是不是检测的范围有所局限?请高人明示!谢谢
国标试剂:该类试剂为我国国家标准所规定,适用于检验、鉴定、检测 基准试剂(JZ,绿标签):作为基准物质,标定标准溶液。 优级纯(GR,绿标签)(一级品):主成分含量很高、纯度很高,适用于精确分析和研究工作,有的可作为基准物质。 分析纯(AR,红标签)(二级品):主成分含量很高、纯度较高,干扰杂质很低,适用于工业分析及化学实验。 化学纯(CP,蓝标签)(三级品):主成分含量高、纯度较高,存在干扰杂质,适用于化学实验和合成制备。 实验纯(LR,黄标签):主成分含量高,纯度较差,杂质含量不做选择,只适用于一般化学实验和合成制备。 教学试剂():可以满足学生教学目的,不至于造成化学反应现象偏差的一类试剂。 指定级(ZD),该类试剂是按照用户要求的质量控制指标,为特定用户订做的化学试剂。
给位好,最近用气相做一些物质的纯度 如碳酸二甲酯 甲基吡咯烷酮等纯度都在99.0%以上 ,这些样品也都没有相关的国家或行业标准,我都用的都是面积百分比来定量的的,不知道大家都有什么看法?
一般来说质量不大于0.1克纯度标准品配制母液需要全部溶解转移到容量瓶中。具体操作如下:1)检查包装是否完好,储存条件是否满足要求。2)把包装的标签去除,使用合适的溶剂擦干净表面,干燥后精密称重(毛重)。3)使用合适的溶剂少量多次把标准品完全转移到容量瓶中,定容到刻度。4)使用缓慢的氮气吹干包装内部,干燥后精密称重(皮重)5)质量之差就是标准品的准确质量,折算纯度后计算出母液浓度。
德国Dr.E 邻苯二甲酸酯标准物质中纯度不确定度给的值有正负号,和误差列在一起,按照JJF 1059-1999 检测和校准不确定度评定与表示不确定度是没有正负号的, 大家在标准物质验收的时候有注意到吗? 是如何理解的?
前段时间买了瓶分析纯碳酸钙,拿回来试了试,用ELTRA的碳酸钙校准了一下,发现纯度比标的低啊大家分享一下哪卖的纯物质好一些?
液相色谱,外标法定量,对标准样品的纯度有要求吗?是不是一定要大于98%?现在只能买到FLUKA质保书上纯度为95%的标准品(GC),可以用于外标法定量吗。大家平时有没有碰到过标准品纯度不高的问题,是不是说明这种物质很难提纯?
中文英文缩写或简称优级纯试剂Guaranteed reagentGR分析纯试剂Analytial reagentAR化学纯试剂Chemical pureCP实验试剂Laboratory reagentLR纯PurePurum Pur高纯物质(特纯)Extra pureEP特纯PurissimumPuriss超纯Ultra pureUP精制PurifedPurif分光纯Ultra violet PureUV光谱纯Spectrum pureSP闪烁纯Scintillation Pure 研究级Research grade 生化试剂BiochemicalBC生物试剂Biological reagentBR生物染色剂Biological stainBS生物学用For biological purposeFBP组织培养用For tissue medium purpose 微生物用For microbiologicalFMB显微镜用For microscopic purposeFMP电子显微镜用For electron microscopy 涂镜用For lens bloomingFLB工业用Technical gradeTech实习用Pratical usePract分析用Pro analysisPA精密分析用Super special gradeSSG合成用For synthesisFS闪烁用For scintillationScint电泳用For electrophoresis use 测折光率用For refractive indexRI显色剂Developer 指示剂IndicatorInd配位指示剂Complexon indicatorComplex ind荧光指示剂Fluorescene indicatorFluor ind氧化还原指示剂Redox indicatorRedox ind吸附指示剂Adsorption indicatorAdsorb ind基准试剂Primary reagentPT光谱标准物质Spectrographic standard substanceSSS原子吸收光谱Atomic adsorption spectormAAS红外吸收光谱Infrared adsorption spectrumIR核磁共振光谱Nuclear magnetic resonance spectrumNMR有机分析试剂Organic analytical reagentOAS微量分析试剂Micro analytical standardMAS微量分析标准Micro analytical standardMAS点滴试剂Spot-test reagentSTR气相色谱Gas chromatographyGC液相色谱Liquid chromatographyLC高效液相色谱High performance liquid chromatographyHPLC气液色谱Gas liquid chromatographyGLC气固色谱Gas solid chromatographyGSC薄层色谱Thin layer chromatographyTLC凝胶渗透色谱Gel permeation chromatographyGPC层析用For chromatography purposeFCP 为了使各种规格和化学试剂实行标准化和控制试剂产品的质量,并使买卖双方在发生争议时有据可依,人们便制定了《试剂标准》。为了保证试剂质量,试剂还需要进行多种检验。本节着重讨论试剂规格和试剂标准主,主要介绍试剂检验中的一些注意事项。• 试剂规格 试剂规格又称试剂级别或类别。一般按实际的用途或纯度、杂质含量来划分规格标准。目前,国外试剂厂生产的化学试剂的规格趋向于按用途划分。 例如德国伊默克公司生产的硝酸有13种规格:最低浓度为65%(密度约1.40)的特纯试剂硝酸双硫腙试验通过的最低浓度为65%(密度约1.40,Hg的最高浓度0.0000005%)的保证试剂(GR)硝酸、双硫腙试验通过的最低浓度为65%(密度约1.40)的保证试剂(GR)硝酸、最低浓度为65%(密度约1.40)的光学与电子学专用特纯(Selectipur)硝酸、100%(密度约1.52)的保证试剂(GR)硝酸、100%(密度约,1.42)的光学与电子学专用特纯(Seletipur)发烟硝酸、重氢度小于99%的重氢试剂硝酸-di(在D2O中,不小于65%DNO3)、滴定用0.1mo1/L硝酸溶液和滴定用1mo1/L硝酸溶液。 伊默克公司还按用户的需要生产各种规格的试剂,如生化试剂、默克诊断试剂、医学研究、农业和环境监测试剂等等。 试剂规格按用途划分的优点简单明了,从规格即可知此试剂的用途,用户不必在使用哪一种纯度级和试剂上反复考虑。 我国的试剂规格基本上按纯度划分,共有高纯、光谱纯、基准、分光纯、优级纯、分析和化学纯等7种。国家和主管部门颁布质量指标的主要优级纯、分级纯和化学纯3种。 ⑴优级纯又称一级品,这种试剂纯度最高,杂质含量最低,适合于重要精密的分析工作和科学研究工作用绿色瓶签。 ⑵分析纯又称二级品,纯度很高,略次于优级纯,适合于重要分析及一般研究工作,使用红色瓶签。 ⑶化学纯又称三级品,纯度与分析纯相差较大,适用于工矿、学校一般分析工作。使用蓝色瓶签。 纯度远高于优级纯的试剂叫做高纯试剂。高纯试剂是在通用试剂基础上发展起来的,它是为了专门的使用目的而用特殊方法生产的纯度最高的试剂。它的杂质含量要比优级试剂低2个、3个、4个或更多个数量级。因此,高纯试剂特别适用于一些痕量分析,而通常的优级纯试剂就达不到这种精密分析的要求。 目前,除对少数产品制定国家标准外(如高纯硼酸、高纯冰乙酸、高纯氢氟酸等),大部分高纯试剂的质量标准还很不统一,在名称上有高纯、特纯、超纯、光谱纯等不同叫法。根据高纯试剂工业专用范围的不同,可将其分为以下几种:⑴光学与电子学专用高纯化学品,即电子级试剂(EIectronicgrade)试剂。⑵金属-氧化物-半导体(Metal-Oxide-Semiconductor)电子工业专用高纯化学品,即MOS试剂(读作:摩斯试剂)。一般用于半导体,电子管等方面,其杂质最高含量为0.01-10ppm,有的可降低到ppb数量级。尘埃等级达到0-2ppb.⑶单晶生产用高纯化学品。⑷光导纤维用高纯化学品。此外,还有仪分试剂、特纯试剂(杂质含量低于1/1000000~1/1000000000级)、特殊高纯度的有机材料等。下面将化学试剂纯度和规格中,英文及其缩写符号汇集成表(见上)• 试剂标准各国生产化学试剂的大公司,均有自己的试剂标准,我国也有我国的化学试剂标准。近年来,我国化学剂标准委员会正在逐步修正我国的试剂标准,尽可能与国际接轨,统一标准。⑴我国的化学试剂标准我国的化学试剂标准分国家标准、部颁标准和企业标准三种。• 国家标准国家标准由化学工业部提出,国家标准局审批和发布,其代号是“GB”,系取自“国标”两字的汉语拼音的第一个字母。其编号采用顺序号加年代号,中间用一横线分开,都用阿拉伯数字。如GB2299-80高纯硼酸,表示国家标准2299号,1980年颁布。《中华人民共和国国家标准·化学试剂》制订、出版于1965年、1971年编成《国家标准·化学试剂汇编》出版,1978年净增订分册陆续出版。1990年又以《化学工业标准汇编·化学试剂》(第13册)问世。它将化学试剂的纯度分为5级,即高纯、基准、优级纯、分析纯和化学纯,其中优级纯相当于默克标准的保证试剂(BR)。《中华人民共和国国际标准·化学试剂》是我国最权威的一部试剂标准。它的内容除试剂名称、形状、分子式、分子量外,有:技术条件(试剂最低含量和杂质最高含量等)、检验规则(试剂的采样和验收规则)、试验方法、包装及标志等4项内容。②部颁标准部颁标准由化学工业部组织制定、审批和发布,报送国家标准局备案,其代号是“HG”,系取自“化工”两字的汉语拼音的第一个字母,编号形式与国家标准相同。除部颁标准外,还有部颁暂行标准,是化工部发布暂行的标准,代号是“HGB”,取自“化工部”三个汉字拼音的第一个字母,编号形式与国家标准相同。③企业
测定一个项目,获得准确结果的前提就是必须要首先有一个可信度高的标准物质GBW(E)100066甜蜜素纯度标准物质中甜蜜素的标准值是99.4%,相对扩展不确定度是0.6%。储存和使用:常温、避光、干燥条件下保存。使用前,在P2O5干燥器中干燥48小时以上,以除去水分。我的问题是:1、为什么一定要在P2O5干燥器中干燥呢?是否可以选择其他方式??2、称量之后,计算浓度是否需要算入这个标准值??
泛解酸内酯分析方法,还有标准物纯度98%或者99%可以做外标曲线么?
今天做纯镁分析时,用高纯镁(99.99%)的配制标准溶液,上设备一测,发现高纯镁的纯度不如样品的纯度好,特别是纯镁中Zn含量,强度达到14000了下图为高纯镁的Zn含量强度首先说明不是标准样品弄反了,而是买的试剂有问题,[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004021138_209609_1619487_3.jpg[/img]

检验工作离不开标准化,但标准化工作却不一定靠谱。我们直奔主题吧,随着大量的国外精密仪器的涌入,原有的化学试剂纯度称谓和品质已不能满足精密检测的需求,于是大量的更高级别的称谓应运而生。当前常见的与纯度相关的称谓有高纯、光谱纯、基准、分光纯、优级纯、分析和化学纯等,但国家标准仅仅止步于优级纯、分级纯、化学纯和实验试剂。实际上,优级纯以上纯度的试剂的称谓远不止这几种,譬如商家习用的超级纯、超高纯、电子纯、电子级……所以,我们有必要对下面几个问题展开讨论:1.优级纯以上的纯度称谓到底都有哪些?其间又有哪些对应关系?譬如[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]金属分析的消解用硝酸,有人说是电子级,有人说是PPT级,又有人说是超级纯……标准化之外的称谓好乱!2.高纯度试剂有没有相应的品质标准?哪怕是约定俗成的、行业共识的,或者是分试剂别的。3.在试剂纯度标准化上,国家标准体系什么态度?大乱之后必有大治,我们期待着试剂世界的整齐划一、各安其位。以下是之家同仁们提供的图片(小有优化)。[img=,690,678]http://ng1.17img.cn/bbsfiles/images/2018/03/201803091728162653_7205_1838957_3.jpg!w690x678.jpg[/img][img=,690,969]http://ng1.17img.cn/bbsfiles/images/2018/03/201803091728171833_3318_1838957_3.jpg!w690x969.jpg[/img]称谓一乱,很容易让人六神无主。譬如说化工标准中就有高纯盐酸,它与化学试剂中的高纯是一回事吗?
GBT 20382-2006 纺织品 致癌染料的测定GBT 20383-2006 纺织品 致敏性分散染料的测定这两个标准里的标准品纯度都不高,有90多的,还有30多的用这些标准品配溶液做标准曲线最后对样品定量的时候是不是需要再除以它们的纯度啊???
[align=center][b]HPLC法测定果冻类样品中叶酸含量的方法学建立[/b][/align][align=center]顾琛 [/align][align=left][b]摘要:目的:[/b]本文采用反相高效液相色谱法建立测定果冻类食品叶酸(folic acid)含量的分析的方法。[b]方法:[/b]使用C[sub]18[/sub]柱作为分析柱,磷酸缓冲液和甲醇作为流动相,紫外检测器作为检测器,叶酸(Pteroylmonoglutamic acid)作为对照品,果冻食品作为样品。[b]结论:[/b]该法在50ng/mL-1000ng/mL之间呈良好的线性,重现性好RSD<2%,回收率在107±2%,稳定性良好,最小检测限20ng/mL。样品测试结果与微生物检测结果相符。本法可以作为测定食品中叶酸含量的一个方法。[/align][b]关键词:[/b]叶酸,HPLC, 果冻样品[b]Abstracts :Aim:[/b] A simple method for the determination offolic acid in gel sample by high-performance liquid chromatography withUV-detection is reported. [b]Methods: [/b]The method was simple by using RP-column (C[sub]18[/sub])with phosphorate -methanol as mobile phase and UV as a detector. [b]Conclusion: [/b]The calibration graph was linear from 50 to1000ng/mL for folic acid with a correlation coefficient of 0.999(n=5). Thedetection limit is 20ng/mL. The method was successfully applied fordetermination of folic acid in the gel sample. The recovery was 107±1.5% and the reletive standard deviation was no morethan 2%. Compared with microbiology method, the results of the samples are same.This method can be used for content determination of the folic acid in gelsample.[b]Key Words:[/b] folic acid, HPLC, gel sample [b]1.前言与文献综述1.1叶酸的理化性质,生物学功能[/b] 叶酸(folic acid)是一组含有碟酰谷氨酸结构的一类化合物统称。食物中的叶酸绝大多数是以喋酰多谷氨酸(或称多谷氨酸叶酸)的形式存在的。叶酸为淡黄色结晶粉末,微溶于水,不溶于乙醇、乙醚及其它有机溶剂;叶酸的钠盐易溶于水,但在水溶液中易被光解破坏,分解成碟啶和氨基苯甲酰谷氨酸盐。在酸性溶液中对热不稳定,而在中性和碱性溶液中却十分稳定。食品中叶酸经受热易损失。 食物叶酸经小肠粘膜细胞内特异叶酰多谷氨酸水解酶的作用,水解为喋酰单谷氨酸(或称单谷氨酸叶酸,PteGlu①)后吸收。吸收后的单谷氨酸叶酸一部分又转变为多谷氨酸叶酸,在肝脏、红细胞及其他组织细胞内贮存,其余部分则以单谷氨酸叶酸的形式分布于血浆、组织液、胆汁及尿液中。肝脏的叶酸浓度是血浆的几百倍,但其单谷氨酸叶酸浓度与血浆相近。叶酸以8种辅酶形式存在于生物体内,为一碳单位的载体参与嘌呤、嘧啶等重要物质的合成。[sup] [/sup]因此叶酸在DNA、RNA、核酸和蛋白质的生物合成中起着重要作用,是细胞增殖和机体发育的物质基础。叶酸在体内的含量直接影响到多种物质如核苷酸的代谢,进而影响血细胞的形成。[b]1.2目前测定叶酸的一些主要方法以及对各个方法的评价1.2.1微生物法[/b] 微生物法是检测生物体内叶酸的经典方法。[color=black]它最根本的原理在于利用了微生物对于某些营养物质的特异性。大量的研究发现,某种微生物会对某种维生素具有极强的特异性,是其正常生长所必需的维生素,并且在一定条件下,其生长与繁殖速度与溶液中该维生素的含量成一定的对应关系,含量高则生长快,反之则慢,微生物法便利用了这种对应关系间接地测定出样品中该维生素的含量。[/color]通常所用的微生物有干酪样乳酸杆菌(L.casei)、粪链球菌和啤酒小球菌属。此3种微生物对不同形式叶酸的敏感度不同。粪链球菌只对非甲基化叶酸敏感,如PteGlu、二氢叶酸(DHF)和四氢叶酸(THF)。 微生物分析叶酸[color=black]具有极高的灵敏度准确度高、先期投入少,见效快、测定结果反映了样品中具有生物活性的被测物含量等优点。许多国际标准方法机构仍旧将微生物法作为叶酸分析的标准方法或第一方法。[/color] 但是微生物法也有许多局限性,如整个实验周期长,批间检测结果重复性差,检测结果受样品中所含抗叶酸药物或抗生素成分的影响,[color=black]只能反映维生素的总含量,不能测定维生素各种异构体的组成和含量[/color]等。[b]1.2.2同位素放射免疫法[/b] 同位素放射免疫法检测血清叶酸始于70年代初。该方法具有快速、简便的特点,同时由于叶酸放射免疫试剂盒的出现,很快得到普及,尤其广泛应用于临床实验室。放射免疫法与微生物法检测叶酸,除原理不同外,检测结果的意义也有所不同。对大量标本总体而言,两种方法结果相关性较好,但对个体标本,两种方法结果的差异较大。微生物法对多谷氨酸叶酸响应值低,不能直接用于检测叶酸含量。但微生物法对所有单谷氨酸叶酸及其衍生物的反应灵敏度相同,故在用叶酸水解酶处理样品使所有叶酸形式转变为单谷氨酸叶酸后进行检测,可得到准确的叶酸值。同位素放射免疫法对多谷氨酸叶酸反应的相对灵敏度有较大的差别,随着叶酸浓度增加,反应的相对灵敏度增加,但多谷氨酸叶酸的反应曲线不可能与单谷氨酸叶酸的反应曲线重合;另一方面,多谷氨酸叶酸与结合蛋白的亲合性与单谷氨酸叶酸相比较高,不同的单谷氨酸叶酸衍生物反应灵敏度不同,放射免疫法也不适用于检测单谷氨酸叶酸衍生混合物。由于上述原因,尽管放射免疫法可用于检测和评价叶酸的营养状况,但从定量检测的角度来讲,难以得到准确的叶酸含量值。[b]1.2.3离子捕获法[/b] Wilson等提出离子 捕获法检测叶酸,该技术可谓叶酸检测技术中的最新方法,即在实验中,样品加入变性剂后叶酸与内源性结合蛋白分离,释放后的叶酸再与带有大量阴离子的亲合试剂结合,合成产物经过离子捕获池而与阳离子纤维结合,最后通过碱性磷酸酶与喋酸(叶酸的类似物)结合物对叶酸结合蛋白上游离结合位点的探查,定量分析样品的叶酸含量。该研究证实,离子捕获法测定血清或红细胞叶酸,其结果与同位素放射免疫法的结果具有良好的相关性,相关系数分别为0.96 和0.93。[b]1.3色谱法和HPLC法在测定食品中叶酸含量的现状[/b][align=left] 色谱法也称层析法,是一种分配平衡为基础的分离分析技术。色谱分离体系包含两相:固定相和流动相。由流动相带领的[color=black]物质分子在固定相间分配达到“平衡”的过程。通过不同物质分配平衡性质的差异达到彼此分离。[/color][/align][align=left][color=black] 20[/color][color=black]世纪[/color][color=black]70[/color][color=black]年代初发展起来的高效液相色谱([/color][color=black]High performance liquidchromatography, HPLC[/color][color=black])吸收了普通液相层析和[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]的优点,经过适当改进发展起来的。它既有普通液相层析的功能(可在常温下分离制备水溶性物质),又有[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]诸多优点(高速、高分辨率和高灵敏度)。适用于很多不易挥发、受热易分解的物质定性定量分析。[/color][sup][/sup][color=black][/color][/align][align=left] 运用高效液相色谱(HPLC)方法来定量食品中叶酸含量在近年来得到了普及。借助于色谱柱的高分离效果和灵敏的检测器,有能力来分离检测不同形式叶酸。中国药典方法使用高效液相色谱-紫外检测器检测叶酸。由于有些叶酸具有荧光特性,D.MP.Johan等[sup][/sup]使用高效液相色谱-荧光-紫外检测器的串连(HPLC-FD-UV)分析面包酵母中叶酸含量。R.Stefania[sup][/sup]等同样使用HPLC-FD-UV分析意大利食品中叶酸含量。由于食品中的干扰物质多,且叶酸含量较少,E.J.M.Konings[sup][/sup] 使用固相萃取法(SPE)对样品进行纯化和富集,然后使用HPLC-FD-UV检测牛奶,肝脏,蔬菜,面粉中的叶酸。L.H Douglas[sup][/sup] 等用HPLC-柱前衍生和HPLC-电化学检测器分别检测牛奶和其它食品中叶酸含量。随着技术的进步,高效液相色谱和质谱联用(HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url])提供了专一性好,灵敏的方法。A.Freisleben[sup][/sup]使用LC-FD-MS联用检测食品中叶酸含量。[/align][align=center][b]表一:几种液相色谱联用的检测器方法的比较:[/b][/align][align=center][b]Table 1. Comparison of some detectors of HPLC [/b][/align] [table=649][tr][td=1,1,61] [align=center]检测器[/align] [/td][td=1,1,192] [align=center]原理[/align] [/td][td=1,1,72] [align=center]灵敏度[/align] [/td][td=1,1,84] [align=center]专一性[/align] [/td][td=1,1,108] [align=center]检测限②[/align] [/td][td=1,1,132] [align=center]评注[/align] [/td][td=1,1,0] [/td][/tr][tr][td=1,2,61] [align=center]紫外[/align] [align=center](UV)[/align] [/td][td=1,2,192] 物质在紫外光谱有吸收[/td][td=1,2,72] [align=center]较高[/align] [/td][td=1,2,84] [align=center]稍强[/align] [/td][td=1,2,108] [align=center]2μg/100mL[/align] [/td][td=1,2,132] 受到食品中其它物质干扰较大。[/td][td=1,1,0] [/td][/tr][tr][td=1,1,0] [/td][/tr][tr][td=1,2,61] [align=center]荧光[/align] [align=center](FD)[/align] [/td][td=1,2,192] 共轭结构在激发光下电子激发到高能态,退激回基态时能量以荧光形式释放,根据荧光强度得待测物浓度。[/td][td=1,2,72] [align=center]高[/align] [/td][td=1,2,84] [align=center]强[/align] [/td][td=1,2,108] [align=center]不能检测[/align] [/td][td=1,2,132] 能检测四氢叶酸和5-甲基四氢叶酸。而叶酸(Pt-Glu)③无荧光性质。[/td][td=1,1,0] [/td][/tr][tr][td=1,1,0] [/td][/tr][tr][td=1,2,61] [align=center]电化学(ECD)[/align] [/td][td=1,2,192] 外加电压使特征物质失去电子,根据失去电子形成电流大小得出待测物质的浓度。[/td][td=1,2,72] [align=center]高[/align] [/td][td=1,2,84] [align=center]强[/align] [/td][td=1,2,108] [align=center]0.32pmol[/align] [/td][td=1,2,132] 灵敏度高,专一性强。但是装备复杂。[/td][td=1,1,0] [/td][/tr][tr][td=1,1,0] [/td][/tr][tr][td=1,2,61] [align=center]质谱[/align] [align=center](MS)[/align] [/td][td=1,2,192] 特征碎片离子检测[/td][td=1,2,72] [align=center]较高[/align] [/td][td=1,2,84] [align=center]强[/align] [/td][td=1,2,108] [align=center]0.1μg/100mL[/align] [/td][td=1,2,132] 不普及,价格高。但是发展方向。[/td][td=1,1,0] [/td][/tr][tr][td=1,1,0] [/td][/tr][/table][b]1.4方法学建立的目的和意义以及技术路线1.4.1方法学建立的目的和意义[/b] 由于人体内的叶酸几乎完全依赖于食物的摄入,因此当摄入量不足或利用率低时,体内便会出现叶酸缺乏的状况。近年来的研究表明,叶酸缺乏会导致贫血、慢性下痢、食欲不振、发育迟缓等疾病,孕妇补充叶酸可防止因神经系统发育不全而形成的畸胎,儿童服用叶酸可提高智商,促进智力发展。所以,叶酸强化食品的摄取对人类健康具有重要意义。而叶酸强化食品的含量的科学性显得十分重要。 确实食品添加剂的质和量决定着加工类食品的营养和安全性。国外对于食品营养和安全十分关注,通过在加工食品的包装上注明的添加成分、营养物质的含量、适宜人群在产品包装,以利于不同需求的消费者选择。随着国内外交流的加强和HACCP认证的推进以及质量意识的增强,食品安全,食品营养受到了消费者和食品生产企业的关注。随着分析测试仪器的先进化和自动化给食品中各个成分的测定提供了强有力的“武器”,尤其是高效液相色谱的普及,它的高效性、准确性、方便、微量等优点是食品分析的一场“革命”。国内外HPLC法测定食品营养成份和食品添加剂方法发展得很快,相关报道较多。但是由于叶酸在食品中添加量甚微,食品中干扰物质较多,所以相应的文章报道相对较少。基于以上考虑设立本项目,具体目的有以下四点:[list=1][*]建立高效液相色谱方法分离分析果冻类样品中叶酸含量的方法学;[*]通过色谱条件的摸索和优化,获得叶酸分离的最佳条件;[*]对样品前处理条件的摸索和调整,得到简便、快速、有效的样品前处理方法;[*]通过对本套方法学的验证包括线性、精密度、回收率、稳定性等实验,建立可靠、完善、准确的测定果冻类样品中叶酸含量的方法学。本方法的建立,可为检测果冻类样品中叶酸含量提供可靠和准确的手段,也为检测其他食品中叶酸含量提供参考资料,所以本研究具有社会效益和经济价值。[/list][b]1.4.2技术路线[/b] 色谱条件的建立(流动相配比、色谱柱选取、检测波长、流速、柱温) [img=,51,13]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710139504_8563_1626663_3.png[/img] 积分条件的建立 [img=,51,14]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710137869_6909_1626663_3.png[/img] 确立标准品、样品配制方法 [img=,51,13]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710142106_9538_1626663_3.png[/img] 方法学验证(线性回归、精密度、回收率、稳定性、样品含量测定)[img=,40,14]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710143330_4024_1626663_3.png[/img] 方法学的改进 [b]2.实验部分2.1实验样品的描述2.1.1样品性质[/b] 无色或淡黄色果胶类样品。常温下为胶态和液态混合物。样品名称(AminoVital Supersports;AminoVital-1;AminoVital-2)。[b]2.1.2样品中添加的主要物质[/b] 添加氨基酸,维生素类,甜味剂,食用香精,食用色素,有机酸。[b]2.1.3可能的干扰因素[/b] 根据配料表信息,氨基酸、甜味剂、色素等物质在样品中较维生素几十倍量添加,而维生素中又以维生素C添加量最大,叶酸添加量相当少。所以上述物质对叶酸分析造成较大的干扰。[b] 2.1.4标准品和样品保存条件[/b] 标准品避光保存于冰箱冷冻柜中。样品置于-18℃冷藏库中保存。[b]2.2实验条件2.2.1仪器和试剂及标准品[/b]仪器配置:岛津LC-10A系列 泵:LC-10ADVP真空脱气机:DGU-12A控制器:SCL-10AVP紫外检测器:SPD-10AVP自动进样器:SIL-10ADVP柱温箱:CTO-10ASVP积分仪:CR-8A和LC-Solution积分工作站试剂:磷酸二氢钾(GR),氢氧化钾(GR),甲醇(HPLC),氨水(GR),纯水(HPLC)标准品:叶酸标准品(Pteroylglutamic Acid),纯度:98.0~102.0% 和光特级[b]2.2.2HPLC方法条件建立[/b]2.2.2.1流动相配制 0.05mol/L磷酸二氢钾(pH=6.33):甲醇=92:8(体积比),作为流动相。 称取7.0g KH[sub]2[/sub]PO[sub]4[/sub]置于1000mL烧杯,加入800mL纯水,溶解。通过滴加0.1mol/L KOH溶液,调节缓冲液pH值为6.33,转移至1000mL容量瓶中,加入80mL甲醇,再用纯水定容至刻度,摇匀。用0.45μm微孔滤膜过滤。装瓶。2.2.2.2检测器和检测波长 使用紫外检测器。使用λ=285nm作为检测波长。2.2.2.3色谱柱 ODS柱作为本次实验的分离分析柱。2.2.2.4流速和柱温选 流速设0.6mL/min;柱温选定为35.0℃2.2.2.5色谱条件: 色谱柱:Shim-pack VP-ODS 4.6mm×150mm 粒度:5μm (P/N 228-34937-91) 流速:0.6mL/min 检测器:紫外检测器 波长:λ=285nm 进样量:100μL 分析时间:100分钟(对于标准品测试仅需40分钟) 柱温:35.0 ℃ [b]2.3标准品配制(线性浓度配制)[/b] 标准品在使用前先放置于五氧化二磷干燥器至室温,并且避光保存。称取5.1mg叶酸(Pteroylglutamic Acid, 纯度:98.0~102.0% 和光特级)标准品,置于50mL棕色容量瓶中,用0.5%氨水溶液稀释,定容,摇匀。作为贮备液。用移液管吸取叶酸贮备液1mL,移入100mL棕色容量瓶中,用0.5%氨水溶液稀释,定容,摇匀。浓度为1020ng/mL.(STD 5)。分别吸取STD 5溶液1mL, 1mL, 5mL, 5mL, 置于20mL, 10mL, 25mL, 10mL容量瓶中,用0.5%氨水溶液稀释,定容,摇匀。浓度分别为 51ng/mL.(STD 1);102ng/mL.(STD 2);204ng/mL.(STD 3);510ng/mL.(STD 4)。[align=center][b]表二:标准品及对应的浓度[/b][/align][align=center][b]Table 2.Standard and their concentrations[/b][/align][align=center] [table=307][tr][td=1,1,72] [align=center]标准品[/align] [/td][td=1,1,72] [align=center] [/align] [/td][td=1,1,72] [/td][td=1,1,91] 浓度(ng/mL)[/td][/tr][tr][td] [align=center]STD1[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]51[/align] [/td][/tr][tr][td] [align=center]STD2[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]102[/align] [/td][/tr][tr][td] [align=center]STD3[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]204[/align] [/td][/tr][tr][td] [align=center]STD4[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]510[/align] [/td][/tr][tr][td] [align=center]STD5[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]1020[/align] [/td][/tr][/table][/align][b]2.4精密度重复性[/b] 5个标准均连续进样6次,测试标准品相对标准偏差。[b]2.5标准品稳定性[/b] 5℃保存的半个月的叶酸标准品贮备液,放至室温。用移液管吸取1mL移入100mL棕色容量瓶中,用0.5%氨水定容,摇匀。再用移液管吸取上述溶液,移入10mL棕色容量瓶中。用0.5%氨水定容,摇匀。连同新试验配制的同浓度标准品一起测试。观察叶酸标准品在0.5%氨水溶液中的稳定性。 [b]2.6样品前处理步骤[/b] 精密称取样品5.00g置于25mL棕色容量瓶中,用0.5%氨水溶解,定容,摇匀。超声波超声10分钟。10000rpm离心10分钟。取上清液,用0.45μm微孔滤膜过滤。作为检液。[b]2.7样品配制[/b] 每个样品测试3次,样品分析后,在各样品中添加1mL STD5标准品,来确定样品溶液中叶酸的保留时间。样品分析时间100分钟。[b]2.8样品回收率[/b] 样品名称:Amino Vital ATP 19582 精密称取样品5.00g,置于25mL棕色容量瓶中,用0.5%氨水溶解,定容,摇匀。10000rpm离心10分钟。吸取上清液,用0.45μm微孔滤膜过滤。作为空白检液。 精密称取10.00g样品,置于50mL棕色容量瓶中,用移液管吸取5mLSTD 5 溶液,移入同一容量瓶中, 用0.5%氨水溶解,定容,摇匀。10000rpm离心10分钟。吸取上清液,用0.45μm微孔滤膜过滤。作为回收率试验检液。[b]2.9确定最小检测浓度[/b] 用移液管吸取STD3标准品1mL置于10mL棕色容量瓶中,用0.5%氨水溶解,定容,摇匀。浓度为20ng/mL.[b]3.结论3.1标准曲线[/b][align=center][b]表三:标准品浓度和峰面积[/b][/align][align=center][b]Table 3.Standard concentration with their peak area[/b][/align][align=center] [table=288][tr][td=1,1,72] [align=center]C(ng/mL)[/align] [/td][td=1,1,72] [align=center] [/align] [/td][td=1,1,72] [align=center] [/align] [/td][td=1,1,72] [align=center]平均面积[/align] [/td][/tr][tr][td] [align=center]51[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]16661[/align] [/td][/tr][tr][td] [align=center]102[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]33061[/align] [/td][/tr][tr][td] [align=center]204[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]66948[/align] [/td][/tr][tr][td] [align=center]510[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]168852[/align] [/td][/tr][tr][td] [align=center]1020[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]331618[/align] [/td][/tr][/table][/align][align=center][img=,547,246]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710144650_39_1626663_3.png[/img][/align][align=center][b]图一:叶酸标准品浓度和面积线性关系图[/b][/align][align=center][b]Fig1.Linearity of HPLC method[/b][/align]叶酸标准品线性回归方程: Y=325.58x+555.10 R=0.9999 式中Y是面积;x是浓度;R是相关系数。[img=,553,174]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710143198_4423_1626663_3.png[/img][align=center][b]图二:204ng/mL叶酸标准品色谱图[/b][/align][align=center][b]Fig 2.Chromatogram of folic acid standard (204g/mL)[/b][/align][b]3.2精密度[/b]每个标准品重复测试6次,各相对标准偏差见表四:[align=center][b] [/b][/align][align=center][b]表四:叶酸标准品精密度测试数据[/b][/align][align=center][b]Table4.Percise of standards[/b][/align][align=center] [table=288][tr][td=1,1,72] [align=center]C(ng/mL)[/align] [/td][td=1,1,72] [align=center] [/align] [/td][td=1,1,72] [align=center] [/align] [/td][td=1,1,72] [align=center]RSD%[/align] [/td][/tr][tr][td] [align=center]51[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]1.13%[/align] [/td][/tr][tr][td] [align=center]102[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]1.20%[/align] [/td][/tr][tr][td] [align=center]204[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]1.53%[/align] [/td][/tr][tr][td] [align=center]510[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]0.22%[/align] [/td][/tr][tr][td] [align=center]1020[/align] [/td][td] [align=center] [/align] [/td][td] [align=center] [/align] [/td][td] [align=center]0.34%[/align] [/td][/tr][/table][/align][b]3.3样品测试结果表五:HPLC方法测定的果冻类样品中叶酸含量Table 5. Folic acid content in gel samples(μg/100g) by HPLC[/b] [table][tr][td=1,1,516] 样品名 HPLC测定量(μg/100g)[/td][/tr][/table]1.Amino Vital 31.7Supersports 2. Amino Vital-1 17.63.Amino Vital-2 17.9 [table][tr][td=1,1,516] [/td][/tr][/table][b]3.4 回收率[/b]样品名:Amino Vital ATP 19582[b] 表六:添加回收率测定Table 6. Recoveries of folic acid to sample[/b] [table][tr][td=1,1,504] Amino Vital 回收率[/td][/tr][/table]1. 106%2 107%3. 109% [table][tr][td=1,1,504] 平均回收率为107±1.5%[/td][/tr][/table][b] [/b][img=,528,162]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710147516_2748_1626663_3.png[/img][align=center][b]图三:回收率测试空白图谱(Amino Vital ATP 19582)[/b][/align][align=center][b]Fig 3.Recovery test chromatogram Blank(Amino Vital )[/b][/align][img=,528,164]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710146335_2905_1626663_3.png[/img][align=center][b]图四:回收率测试添加叶酸标准溶液图谱(Amino Vital )[/b][/align][align=center][b]Fig 4.Recovery test chromatogram by adding folic acid standardsolution(Amino Vital )[/b][/align][b] 3.5 HPLC法与微生物法测试结果比较[/b]日本的国家标准是使用微生物方法测定叶酸的含量。微生物方法测定的是食品中总的叶酸含量,应该比HPLC方法测的的值要大些。为了比较HPLC方法的准确性,通过对应样品比较得知。[b]表七:微生物测定值与HPLC测定值比较Table 7. Comparison of the result of mircobiology method and HPLC method[/b] [table][tr][td=1,1,516] 样品名 微生物测定值(μg/100g) HPLC测定值(μg/100g)[/td][/tr][/table]1.Amino Vital 44 31.7Super sports 2. Amino Vital 18 17.6 3.Amino Vital 20 17.9 [table][tr][td=1,1,516] [/td][/tr][/table][b]3.6总体评价及方法适应性[/b] 通过以上实验以及对实验数据的分析和比较,得出本方法线性拟合良好, 精密度高,最小检测限低。样品添加回收率在107±2%内,并且样品测试结果与微生物方法测试结果作比较,两者数据相近。本方法简便,前处理相对简便,可以为检测果冻类样品中叶酸含量提供可靠和准确的分析手段,同时也为其它食品中叶酸含量的检测提供参考。[b]4.讨论4.1分析条件选取 4.1.1流动相 [/b]流动相在HPLC分离分析中起着至关重要的作用。 过实验确定了本次实验的流动相。原因如下:[list=1][*]叶酸在碱性水溶液中溶解且稳定性较好,而大多数ODS柱在pH=2.0~7.0范围内使用,所以本文使用的流动相pH值在6.3比较适合[*]通过实验发现水相和甲醇的配比为92:8(v/v)分离效果最好。样品中叶酸和前面的杂质完全分离。[*]使用磷酸二氢钾和氢氧化钾来调节离子浓度和pH值。这时色谱峰形呈正态曲线,柱效最高。[/list][b]4.1.2检测器和检测波长[/b] 叶酸中有苯环和碟酰结构,图五。所以可以用紫外检测器来检测。虽然叶酸中有共轭结构,但是通过实验发现Pteroylglutamic Acid 无荧光吸收。所以不能使用荧光检测器。 由于条件限制,无全波长扫描的紫外光度计和二极管阵列检测器。所以通过文献和实验来找最佳波长。根据报道[sup][/sup],叶酸在265nm,285nm至290nm以及365nm处有极大吸收。在265nm,285nm,290nm,365nm分析同一叶酸标准品,发现λ=285nm处峰形最高。[b] [/b][align=center][img=,363,124]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181710151110_6182_1626663_3.png[/img][/align][align=center][b]图五:叶酸的分子结构[/b][/align][align=center][b]Fig 5. Molecular structure of folicacid (Pteroylglutamic Acid)[/b][/align][b]4.1.3 进样量[/b] 所以根据本实验室条件,100μL的进样量适合并且满足实验要求。[b] 4.1.4分析时间[/b] 由于标准品在30分钟内就已出来,所以标准品采集时间仅需30分钟。但是样品中成分复杂,一定把样品中组分全部出尽才能进下一个样品。通过实验样品的采集时间为100分钟。[b]4.2试样标准的配制讨论 4.2.1样品试液选取[/b] 原则:确保叶酸在溶液中溶解且不被破坏。 实验证明:叶酸不溶解于纯水中,在酸性溶液中不稳定。而使用0.5%氨水溶液较好地溶解叶酸,而且通过稳定性实验,叶酸在该试液中稳定,峰面积无显著变化。[b] 4.2.2标准品浓度选取[/b] 本实验样品的浓度恰好在线性范围内,而且标准品浓度与响应值呈一元线性关系。[b] 4.2.3样品前处理[/b] 样品使用0.5%氨水溶液溶解。由于样品呈液胶状,超声波超声可以击碎胶状物质,使其分散。通过实验发现10分钟超声可以使之形成均一、稳定的溶液。[b]5.后续工作及前景[/b] 由于条件的限制和目的要求的局限,本文只对一种叶酸化合物进行分析测试,而食品中的叶酸形式有五种之多。通过流动相摸索和梯度洗脱完全能够使不同形式的叶酸得到分离,以此扩大分析的范围。同时叶酸分析也可以通过色谱条件的摸索与其它物质(尤其是水溶性维生素)一起分析,达到提高效率的目的。为了使灵敏度提高,高效能的检测器的选择有着可观的前景。现在困扰我们分析叶酸含量的主要问题是样品中叶酸含量甚微,仅仅是ng级。紫外检测器最小检测限也就是这个级别。本文也指出:一味地扩大样品称样量或增加样品进样量会导致噪音增大,同样不能提高灵敏度。所以象一些专属性较强的检测器如荧光检测器,电化学检测器是考虑的一个方向。荧光检测器的灵敏度可以达到pg级。对于荧光检测器不能检测Pteroylglutamic Acid,是由于该物质没有荧光发色基团。我们可以通过柱前或柱后衍生的方法让其接上荧光发色基团,或者是柱前分离柱后通过反应液改变它的结构,提高检测的灵敏度。而使用电化学检测器需要摸索诸如电离电压,流动相等等条件。由于电化学检测器它的专属性很高,不容易受到干扰物质的影响。它应该是一个发展方向。从样品前处理的角度考虑,前处理步骤越少,分析时间更短,目标物在处理时损失越少,相对实验成本越低是改进原有实验方法的目标。一般对于含有复杂成分且目标分析物含量甚微的样品要去除干扰物质然后富集待测组分。固相萃取技术(solidphase extraction, SPE)应当是一个比较好的样品前处理方法。但是固相萃取技术的一个弱点是样品容易损失,回收率不高引起准确性不高。荷兰的Knoing教授使用亲和层析(affinity chromatography)的方法来提高待测物富集和纯化的效率。可见食品中叶酸分析应该还是一个难点,同时又是一个热点。快速高效准确的方法会随着仪器性能的进步和方法的进一步完善成熟而成熟。[b]6.参考文献[/b][list=1][*]中国药典编委会.中国药典(2000)二部,北京:化学工业出版社,2000.[*]Johan D.M. P. Jelena A. J. Sofia B.H., Development of aSimplified Method for the Determination of Folates in Baker’s Yeast by HPLCwith Ultraviolet and Fluorescence Detection. J.Agric. Food Chem. 2005,53:2406-2411.[*]Douglas L.H. RandyL.W. Michael G.Z., Determination ofnative folates in milk and other dairy products by high-performance liquidchromatography. J.Chrom. 1988, 449 : 271-279.[*]Stefania R. Liisa T.V. AlteroA., Determination of folate vitamersin food and in Italian reference diet by high-performance liquidchromatography.J.Chrom A . 1999, 855: 237-245.[*]Konings EJM,A validated LC method for the determinationof folates in vegetables, milk powder, liver and flour.J AOAC Int. 1999, 82: 119-127.[*]Eduward Chu. James C.Drake. Donna Boarman, Mechanism of Thymidylate Synthase Inhibition by Methotrexate inHuman Neoplastic Cell Lines and Normal Human Myeloid Progenitor, J. Biochem.1990,265: 8470-8473.[*]Pamela J.Bagley Jacob selhub,Analysis of Folate Form Distribution by Affinity Followed by Reversed-PhaseChromatography with Electrochemical Detection, Clin. Chem. 2000, 46: 404.[*] FreislebenA. Schieberle P. Rychlik M., Comparison of folate quantification in foods byhight-performance liquid chromatography-fluorescence detection to that bystable isotope dilution assays using high-performance liquid chromatography-tandemmass spectrometry. Anal. Biochem. 2003, 315: 247-255.[*] 赵永芳.生物化学技术原理及应用(第三版).北京:科学出版社,2003.10[*] 吴坤等.营养与食品卫生学(第五版).北京:人民卫生出版社,2005.[/list][hr/] ①PteroylglutamicAcid②检测限是以叶酸(Pt-Glu)来计算。③微生物测定值是日本食品研究所用微生物法测定。
液相用的标准品纯度要求80%是否可以