求草酸钴产品标准
请问草酸亚铁的国家标准或行业标准那里有?
请问磷酸二氢铵、草酸亚铁的国家标准在那里可以找到?
高锰酸钾标准溶液用草酸标定的问题?为何滴定时一滴颜色就出现红色,而且几分钟都不褪色,加热才能退去,但是按照国标601上做的。国标上说到终点时才能加热的?说明一下每一步都是按照国标进行的。
GB/T601-2002草酸标准滴定溶液的不确定度评定,实验中用到高锰酸钾标准溶液----------关于高锰酸钾标准溶液不确定度的是怎样来进行分析的,因为高锰酸钾标准溶液也是配制的(非购买的标准物质),难道由此前配制高锰酸钾标准溶液得出的不确定度直接代入吗?
草酸钠标准溶液中加入硫酸得目的是什么
目前乙醛酸是公司一种主要的原料,需要测定里面的乙醛酸,乙二醛和草酸的含。乙醛酸是采用乙二醛氧化法制得的,在测定草酸的过程中是采用先加氯化钙沉淀然后洗涤到不含氯离子产生,然后加硫酸和高锰酸钾标准溶液进行氧化还原进行滴定的。具体步骤如下:称取约2g样品m(准至O.0002g)于100ml烧杯中,加水30ml,滴加氨水,调PH值至5~6。然后滴加氯化钙至沉淀完全,再多加2~3滴,并不断搅拌,于室温下静置50min,过滤,洗涤至不含氯离子(用0.1mol/L硝酸银试验,无白色浑浊产生),将沉淀连同滤纸一并放入250ml三角瓶中,加入25ml水及25ml硫酸溶液,用高锰酸钾标准溶液滴定,近终点时加热至65℃,继续滴定至溶液呈微粉红色保持30秒不褪为终点。记录消耗高锰酸钾标准滴定液的体积 V′。问题是:在洗脱氯离子的过程中,耗时太长,需要一天的时间,用纯水淋洗,非常麻烦,但是呢,由于氯离子如果不洗脱的话严重干扰反应,但是洗脱过程实在是太耗时了,想问下各种虫虫们,有什么好的办法木有。可以快速洗脱氯离子,或者又什么更好的办法能不能不引入氯离子呢
草酸钠标准溶液中加入硫酸得目的是什么?

在一次失效分析的过程中,发现别的实验室在分析我们自己的日常样品中,有比较明显的草酸的结果显示,但是自己内部的测试结果没有很好地显示出来。因为之前没有需要报告草酸这个项目,所以也没有买过草酸的标准溶液。为了研究内部是否可以测试草酸,需要另外购买草酸的标准液(Fig-1)。[align=center] [img=,435,422]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011031011657_3849_2942222_3.jpg!w435x422.jpg[/img][/align] 等草酸标液到了之后,开始配置不同浓度的标液,从低到高开始尝试进样,但是都没有在谱图上发现明显的出峰。到了150ppm仍然没有检测到很明显的峰,这是比较不正常的。在观察谱图时,发现在22分钟左右有一个翘起来的部分,有点像峰(Fig-2)。但是因为之前的程序设定了运行时间都是22分钟,是不是因为运行时间太短,导致草酸的峰还没有出来呢。[align=center] [img=,690,357]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011031471109_959_2942222_3.jpg!w690x357.jpg[/img][/align] 经过更改程序文件,把出峰时间改到26分钟,在22-23分钟左右看到一个非常明显的草酸出峰(Fig-3),果然是之前的运行时间太短了,导致草酸不能够显示出来。[align=center][img=,690,213]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032034570_2099_2942222_3.jpg!w690x213.jpg[/img][/align] 为了进一步,进行了草酸的标准曲线验证。在新程序条件运行下,草酸在不同浓度都可以显示出来,可以得到一个非常好标准曲线,R2的值达到0.99以上(Fig-4)。[align=center][img=,690,468]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032193998_3826_2942222_3.jpg!w690x468.jpg[/img][/align][align=center]另外,有继续进行了草酸的回收率实验。把草酸标准溶液加入到正常的7个阴离子溶液中,草酸能够明显检测出来(Fig-5),回收率大概是107%。[/align][align=center][img=,690,328]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032369340_1786_2942222_3.jpg!w690x328.jpg[/img][/align] [font=等线]在新程序下运行,发现在日常的产品中也可以明显检测出草酸(Fig-6)。这证明了的确是之前的运行时间太短,导致草酸检测不出来.[/font][align=center][img=,690,502]https://ng1.17img.cn/bbsfiles/images/2023/09/202309011032564960_9557_2942222_3.jpg!w690x502.jpg[/img][/align] 经过这次的草酸寻峰计,还得出了一个教训。在以后研究新的物质时,要提前好好查下相关的文献,因为不同的柱子和淋洗方法都会影响到物质的出峰。如果没有资料可查,需要尝试在尽可能的运行时间去检测,以免有峰遗漏。
最近做小儿七星茶颗粒甘草酸的测定时遇到了很奇怪的问题:对照品有峰,样品却只出杂质峰,开始怀疑是样品没有含量,可是拿以前做过的有含量的样品再做,却没峰了;后来吸一半对照品一半样品进样就出峰了,可是加对照品到样品中一起按标准处理后就又没有峰出来,怎么想都不明白问题出在哪里。所用的试剂换了好几次,也换人配了,结果还是一样没有,会不会是超声引起的呢,因为我们的超声机的功率只有80瓦,不过以前也做得出啊,大家帮帮忙,下面是标准【含量测定】 照高效液相色谱法(中国药典2005年版一部附录VI D)测定。 色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.2mol/L醋酸铵溶液—冰醋酸(65:35:1)为流动相;检测波长为250nm。理论板数按甘草酸峰计算应不低于2000。 对照品溶液的制备 取甘草酸铵对照品适量,精密称定,加流动相制成每1ml含16μg的溶液,即得(折合甘草酸为15.672μg)。 供试品溶液的制备 取装量差异项下的本品内容物,混匀,研细,取约7g,精密称定,置50ml量瓶中,加流动相约45ml,超声处理(功率300W,频率40kHz)30分钟,放冷,加流动相至刻度,摇匀,滤过,取续滤液,即得。 测定法 精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,即得。

[align=center][b][font=宋体]虫草浓缩液中虫草酸和虫草素测定方法[/font][/b][/align][size=18px][font=宋体]虫草浓缩液由虫草水提物制得,用于化妆品原料。客户想测虫草浓缩液中虫草酸和虫草素,虫草酸又名甘露醇。[/font][font='Times New Roman','serif']1 [/font][font=宋体]试剂:乙腈(色谱级),超纯水,甲醇(分析纯),虫草酸和虫草素均购置北京索莱宝公司。[/font][font='Times New Roman','serif']2 [/font][font=宋体]标准品配制:称取一定量的虫草酸,用纯水溶解,定容,得到浓度为[/font][font='Times New Roman','serif']150 μg/mL[/font][font=宋体],待测;[/font][font=宋体]虫草素,用甲醇溶解,定容,得到浓度为[/font][font='Times New Roman','serif']220 μg/mL[/font][font=宋体],待测;[/font][font='Times New Roman','serif']3 [/font][font=宋体]样品制备:[/font][font='Times New Roman','serif']3.1 [/font][font=宋体]精密量取[/font][font='Times New Roman','serif']0.5 mL[/font][font=宋体]虫草浓缩液,分别用水定容至[/font][font='Times New Roman','serif']10 mL[/font][font=宋体]测定虫草酸,用甲醇定容至[/font][font='Times New Roman','serif']10 mL[/font][font=宋体]测定虫草素,过[/font][font='Times New Roman','serif']0.45 μm[/font][font=宋体]滤膜,待测。[/font][font='Times New Roman','serif']4 [/font][font=宋体]虫草素[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]条件:[/font][font='Times New Roman','serif']LC-20AT[/font][font=宋体]配制紫外检测器,[/font][font=宋体]波长:[/font][font='Times New Roman','serif']260 nm [/font][font=宋体];进样量:[/font][font='Times New Roman','serif']5μL[/font][font=宋体];色谱柱型号:[/font][font='Times New Roman','serif']Agilent Zorbax SB-C18(4.6 mm×250mm, 5 μm)[/font][font=宋体];柱温:[/font][font='Times New Roman','serif']30.0 [/font][font=宋体]℃;流速:[/font][font='Times New Roman','serif']0.8 mL/min[/font][font=宋体];流动相条件如表[/font][font='Times New Roman','serif']1[/font][font=宋体]:[/font][/size][align=center][img=,551,185]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311641477076_4077_1858223_3.jpg!w551x185.jpg[/img][/align][font='Times New Roman','serif'] [/font][size=18px][font=宋体]虫草酸[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]条件:[/font][font='Times New Roman','serif']Angilent infinit1260[/font][font=宋体]配制示差检测器,进样量:[/font][font='Times New Roman','serif']5[/font][font=宋体]μ[/font][font='Times New Roman','serif']L[/font][font=宋体];色谱柱型号:[/font][font='Times New Roman','serif']Agilent Zorbax SB-C18(4.6 mm[/font][font=宋体]×[/font][font='Times New Roman','serif']250 mm, 5 μm)[/font][font=宋体];[/font][font=宋体]柱温:[/font][font='Times New Roman','serif']30.0 [/font][font=宋体]℃,;流动相条件乙腈:纯水[/font][font='Times New Roman','serif']=80:20[/font][font=宋体];流速:[/font][font='Times New Roman','serif']0.5mL/min[/font][font=宋体]。[/font][/size][align=center][img=,690,265]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311642440362_8441_1858223_3.jpg!w690x265.jpg[/img][/align][align=center][b][font=宋体]虫草素标准品色谱图[/font][/b][/align][align=center][img=,683,269]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311642555977_2623_1858223_3.jpg!w683x269.jpg[/img][/align][align=center][b][font=宋体]虫草浓缩液中虫草素色谱图[/font][/b][/align][b][font=宋体]结果:虫草浓缩液中虫草酸含量([/font]7.65 mg/mL [font=宋体]),虫草素含量([/font]2.65[/b][font='Times New Roman','serif']μg/mL[/font][b][font=宋体])。[/font][font=宋体]小结:测定虫草素的过程中发现流动相梯度洗脱,回到起始梯度是需要平衡时间久一些,虫草素含量较低,虫草酸含量比较高。示差检测器也是进样前需要稳定[/font]2[font=宋体]小时左右,才能保证实验数据稳定性。[/font] [/b]
有哪位老师有用HPLC成功检测样品中草酸残留的案例么?我目前在草酸检测过程中,采用通用的纯水柱时空白死体积处的未知峰对草酸有干扰,采用RP18时草酸的保留得到了改善,但是草酸峰拖尾,且调节方法无改善。谢谢
草酸学名乙二酸,化学式HOOC-COOH。当我们从课本上了解了羧酸的化学性质,是不是也能推断出草酸的一般性质了?在我们身边,草酸一般用作除锈剂或者可以除去白衣衫上的墨水污迹,而它其实也是一种可以能致人死命的危险的化学物质。可是大家知道平时爱吃的巧克力中也含有草酸吗?不要慌张,这种危险情况极少出现。我们每天都通过许多不同渠道摄入草酸,草酸在很多食品中都有少量存在,而在少数食品中含量很高。可可就属于含量最高的食品之一,,每100克可可中含有500毫克草酸;绿色蔬菜中的草酸含量一般很高,每100克菠菜含600毫克,大黄含500毫克,甜菜、花生、茶中也有较多的草酸。平均一个人一天大约摄入150毫克草酸,而草酸的致死剂量是1500毫克左右。我们在普通的一天中会摄入这么多草酸吗?那么摄入草酸对我们人体有什么影响? 大黄在美国曾被称为“食用大黄”,在过去,人们常把它和糖放在一起炖了吃。大黄最出名的特性是治疗便秘,因为它能刺激肠道排出自然毒素——草酸。一碗炖烂的大黄里含有的草酸已经接近于使人中毒的剂量。第一次世界大战期间,由于有人把大黄叶当作蔬菜吃,以至于草酸中毒身亡。而吃巧克力则无须担心,无论你对巧克力多么喜爱,但巧克力中的草酸含量太低,就是你吃的无法下咽的时候,体内的草酸含量达不到让你腹泻的程度。 在大黄流行的时候,烹制大黄食品方法层出不穷,曾经使用铝锅来炖大黄,发现意想不到的好处:它能把铝锅“炖”的很干净。之所以有这样的效果,是因为草酸能把铝锅氧化膜和表面金属溶解掉。当然,这种方法还会使食者摄取铝元素造成潜在的危害。
我们是用草酸酸化提取出土霉素。怎样测定药品中草酸残余量呢?我用的是高效液相色谱。用的是反向离子柱。
1、九水硝酸铝配制成饱和硝酸铝溶液怎么配制?比如配制成250ml饱和溶液需要加多少g九水硝酸铝及多少氨水?2、二水合草酸配制成10%草酸溶液怎么配制?
建立食品中草酸含量测定的新方法—间接[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]。样品经处理后,加入过量且定量的氯化钙,使其与草酸根离子生成草酸钙沉淀,经离心分离后再利用[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url](AAS)法定量测定上清液中剩余Ca2+ 的含量,间接计算出食品中草酸的含量。在最佳条件下,该法的线性范围为0~8.0mg/L,回收率为98.1%~98.4%。本方法精密度高、灵敏度高、检出限低,适用于食品中草酸含量的测定。
本人最近在做职业卫生草酸的方法验证,参考的标准是GBZ/T 300.114-2017,这个标准采用的色谱柱是阳[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱和邻苯二甲酸流动相,我们平时做环境中的草酸都是阴[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱,碳酸钠和碳酸氢钠流动相。大家做职业卫生的草酸的时候具体是怎么操作的?严格按照标准用阳[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱做?还是用阴离子做,再写一份方法偏离?先谢谢大家了!
[align=center]CNS食品添加剂—甘草酸盐性质概述[/align] 杨勉疾[align=center]2021年 7 月[/align]1.甘草酸盐系列物质理化性质概述1.1 甘草酸理化性质 甘草入药史自古以来,是最为广泛的药用植物之一。其中甘草酸(CA)被认为是其提取物中最主要活性成分。甘草酸呈白色结晶性粉末,甜度约为蔗糖的200倍。显甜迟后,但留甜时间长;相对密度(d204):1.43;熔点在212-217℃左右;常压沸点972℃;闪点288℃;溶解性:难溶于冷水,易溶于热水,不溶于油脂,其热水溶液冷却后呈黏稠冻胶状。溶于丙二醇。 GA是一种单桥皂甙,其由三萜类疏水性苷元(18β甘草次酸)与亲水性二葡萄糖醛酸结合而成,GA的两亲性结构决定了其性能溶液中的物理性质。使得GA分子聚集水溶液中的表面活性化合物会导致聚集体、胶束的形成,并且在较高浓度下尤甚。其皂苷结构决定了GA许多特殊药理功能,调节其疏水分子形成水溶性复合物能力,可以用于调节其他物质化学稳定性,水溶性,生物利用度;以及在临床上应用于能性药物释放系统(DDS)。其有急性毒性:人体口经TDLo:280mg/kg/4W;小鼠口经LCLo:3gm/kg;小鼠腹经LCLo:2gm/kg;小鼠静脉LC:300mg/kg。在环境方面,甘草酸对水稍有危害,不可使未稀释或大量的产品接触地下水、水道或者污水系统。若无政府许可,不得排入周围环境。[1] 下图1.2分别为二维糖平台与三萜组成的基本结构单元透视图从两边伸出的部分;球和棍子(b)和空间填充(c)表示,显示由相互渗透的基本元素形成的通道单位(以浅灰色和深灰色显示的分子属于相邻单位)。通道约占晶体体积的42%。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081544564157_4482_1608728_3.png[/img][/align][align=center]图 1甘草酸二维结构[size=16px][2][/size][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081544567370_8_1608728_3.png[/img][/align][align=center]图 2 甘草酸三维立体结构[2][/align] 甘草酸作为一种多元酸,在碱性或离子液体内会不同程度脱质子成盐,在自然条件下,会和钾、钠离子结合存在。甘草酸盐是由甘草酸衍生的一系列盐类总称,包括甘草酸铵、甘草酸一钾及三钾、甘草甜素二钠等。1.2 甘草酸铵 甘草酸铵为白色粉末或淡黄色结晶型粉末,有强甜味,甜度约为蔗糖的200倍,溶于氨水,不溶于冰乙酸。应用于甜味剂,依照我国《食品添加剂使用卫生标准》,可按生产需要适量用于肉类罐头、调味品、糖果、饼干、蜜饯凉果、饮料等等。还可以用于进一步制备其他甘草酸盐类的中间物。 甘草酸单铵盐具激素样活性,但无激素的副作用,不仅对气管炎、支气管炎、咳嗽、哮喘等呼吸系统疾病有显著疗效。而且对消化道感染、乙肝、口腔溃疡、胃溃疡等也有奇效。对于多种毒素如白喉毒素、河月豕毒素、破伤风毒素和蛇毒等有着较强的解毒功效。同时还具有类似肾上腺皮质激素的作用。其毒理学半数致死量为10g/kg;经骨髓微核实验证实无致突变作用[3]。1.3 甘草酸一钾及三钾 甘草酸一钾及三钾类似白色或淡黄色粉末,无臭。有特殊甜味(甘草酸一钾为蔗糖的500倍;甘草酸三钾为蔗糖的150倍),甜味残留时间长,易溶于水,溶于稀乙醇、甘油、丙二醇,微溶于无水乙醇和乙醚。其同样应用于甜味剂,和甘草酸铵类似;毒理依据其半致死量为小鼠口服>10g/kg[4]。 在化妆品行业,可配制成护肤霜,祛斑霜高级珍珠膏等,既有美容护肤,又能消炎、抗变态反应,治疗皮肤病等作用;在医药行业,可用于眼药水、口腔炎的药膏;在日化行业,可用于牙膏。1.4 甘草酸二钠 甘草酸二钠又名甘草甜素二钠。为白色至淡黄色粉末,味极甜,稀释4000倍仍有甜味,甜度约为蔗糖的150-200倍,且甜味残留时间长。易溶于水,溶于稀乙醇、甘油、丙二醇,不溶于无水乙醇、乙醚、氯仿和油脂。用作甜味剂。日本限用于酱油(0.015g/L)和豆酱(0.03-0.07g/L)。毒性为半致死量5g/kg[5]。 由于其在水中非常易溶解,溶液澄清透明,无杂质和怪味,口感好,在食品添加剂方面具有低热能、安全无毒和较强的医疗保健功效,是高血压、肥胖症、糖尿病、心脏病患者使用的最理想甜味剂,有浓郁的甘草特殊香味,具有保健、解毒、护肝、消炎、增香等功效,是非常理想的纯天然甜味剂原料。2.甘草酸盐的制备及检测标准2.1 甘草酸生产方法及指标[6] 甘草酸以甘草为直接制备原料。将甘草的根茎干燥后粉碎至0.833mm的粉末(保留纤维部分)取粉末及纤维200kg,加水1200kg,在85-100℃下浸提2h。过滤后滤渣再用1000kg水提取2h,过滤后滤渣再重复浸提1次。合并3次滤液,在搪瓷蒸发器中浓缩至1/5体积。冷却后加入95%乙醇,使乙醇浓度达到65%,静置24h,过滤除去植物蛋白、多糖等杂质。滤液中加入硫酸,调节PH至甘草酸沉淀析出。过滤。洗涤后,加入3倍的丙酮,加热可回流3h,倾出提取液,残渣再反复回流提取2次。合并3次提取液,过滤后回收丙酮,浸湿甘草酸,与45℃干燥1h,缓缓升温至85-95℃,快烘干时,升至100-105℃烘干5min,经粉碎后即得成品。 此外,也可直接用氨水萃取,经浓缩后用硫酸沉淀,再用95%乙醇重结晶而得。 其质量指标需要符合中国企标:水分≤13%;灰分15%;熔点为220℃。2.2甘草酸二钠制备及质量标准[7] 甘草酸二钠一般由甘草酸为直接原料。其一由甘草甜素与钠碱进行部分中和而后精制而成。其二,由甘草粉加五倍水煮沸抽提,滤去固形物,加稀硫酸至呈弱酸性。室温下放置至析出物沉降,除去上澄清液,沉淀经水析出后用氨水中和、过滤、滤液加醋酸使甘草甜素铵析出,用70%-80%乙醇重结晶,按理论值加入碳酸钠水溶液,减压浓缩而得。 其质量指标参照日本标准,1999。包括含量95%-100%,溶液性状:10%水溶液应透明;5%溶液PH值5.5-6.5,氯化物(Cl-计)≤0.014%;水分≤13%;砷含量<4mg/kg;重金属<40mg/kg等等。相应的质量指标分析手段一般均通过标准试剂化学滴定得到。2.3甘草酸一钾及三钾制备方法及质量标准[8] 以甘草酸粗品(含量75%)为原料,在乙醇中用氢氧化钾中和而得。将100g甘草酸盐粗品加入400ml工业乙醇中国,在40-50℃下搅拌提取1h。抽滤后滤渣用200ml乙醇在同样的条件下提取1h,合并提取液,在搅拌下加入20%的KOH乙醇溶液至PH至7-8为止。静置片刻后分离得甘草酸三钾黄色结晶200g,将其放入80-90ml冰醋酸中,加热至75℃,保温几分钟使其转化为单钾盐,抽滤得近白色甘草酸单钾盐粗品,用少量工业乙醇洗涤一次,以出去黄酮类色素和甘草次酸等杂质。粗品用400ml乙醇冰醋酸混合液溶解,加入10g活性炭,在80℃下脱色0.5h。过滤后滤液放置结晶,得产品25-30g,收率约为70%。 其质量指标包括含量(UV法≥98%;HPLC≥85%);重金属≤0.001;砷盐≤0.0002;灰分≤9.63%;水中不溶物≤0.5%。2.4 间接甘草酸盐生产制备方法 为使甘草酸发挥更好的疗效和提高生产效率,非常需要实用性较强的制备甘草酸盐精品方法。 根据甘草酸易溶于热水,可溶于热稀醇,几乎不溶于无水乙醇和乙醚, 又可于水溶液中加稀酸游离液,又可于水溶液中加稀酸游离出来的性质,以及甘草酸锌盐、铁盐、铝盐及秘盐在热水中仅微溶或者不溶的性质,可以使甘草酸在水或稀醇溶液中与相应的无机盐水溶液反应制取需要的甘草酸盐。如果选用粗甘草酸溶液作原料,则得到甘草酸盐粗品,要制成精品往往需要反复多次精制,[font=times new roman][size=13px] [/size][/font]操作十分繁琐.如果选用甘草酸单按盐精品为原料,[font=times new roman][size=13px] [/size][/font]可以比较方便地制取草酸盐精品。在实际生产中,可以利用甘草或者甘草浸膏为原料,先制取甘草酸单按盐精品,然后再以甘草酸单按盐为原料制备甘草酸盐别的品种。在质量指标检测方面,甘草酸根含量测定可采用层析法,锌、秘、铝和铁的测定可采用容量分析或重量分析的方法。2.4.1甘草锌制备 取甘草酸单铁盐209溶于80%乙醇90ml中,加热回流,慢慢滴加予热至50℃的5%硫酸锌溶液80g,生成白色沉淀,加完硫酸锌溶液后,保温反应30min,之后降温至20℃,过滤,滤饼用6oml蒸馏水分三次清洗,滤尽母液,取出滤饼真空50℃干燥,得棕黄色甘草锌粉末19.69。测定甘草酸根含量87.6%,锌含为10.5%。2.4.2甘草酸秘制备 取甘草酸单铵盐溶于200ml热水中,于8℃在搅拌下慢慢滴加予热至60℃的10%的硝酸秘酸性溶509,需维持反应液为酸性(PH~3),生成白色沉淀,加完硝酸秘溶液后,保温反应30min,然后降温至30℃,过滤,滤饼用60rnl蒸馏水分三次清洗,滤尽母液,再以95%乙醇45ml分三次清洗,滤尽母液,在40~50℃真空干操,得白色甘草酸秘粉末21.39,测定甘草酸根含量82.2%,秘含量14%。3.甘草酸盐应用 邓淑华等人研究显示,甘草酸二钠、甘草酸二钾、甘草酸二铵在体外实验条件下,对金黄色葡萄球菌、白色葡萄球菌、大肠埃希氏菌、福氏志贺氏菌、乙型副伤寒沙门氏菌等细菌均表现了不同程度的抑菌作用。实验额外证实,甘草酸盐对乙型副伤寒沙门氏菌、金黄色葡萄球菌(附院)、福氏志贺氏菌等细菌具有一定的杀菌作用[9]。 甘草酸盐及甘草煎剂对杀虫双染毒的小鼠急性中毒不仅有顶防作用,而且甘草酸盐对急性中毒还有治疗作用,能明显降低杀虫双不同途径染毒之小鼠 、兔子的死亡率、其解毒机尚待进一步研究[10]。Francesco Maione[font=宋体]等人对单铵甘草酸盐抗炎抗伤害以小鼠实验进行以及生化和对接研究。在小鼠单次给药后的,一次腹腔注射AG对酵母多糖引起的足跖水肿和足跖肿胀均有抗炎作用腹膜炎。此外,在几种疼痛动物模型中,如扭体试验、福尔马林试验,酵母多糖诱发的痛觉过敏,试验前24小时给予AG可诱发痛觉过敏强烈的抗伤害作用。综上所述,所有这些发现都突出了AG在疼痛和或炎症相关疾病临床治疗中的潜在应用。AG与mPGES-2和COX-2的关键氨基酸相互作用。经过实验结果分析,甘草酸单铵的抗炎抗伤效应来自其与mPGES-2和COX-2的特异受体相互作用 。AG在结合处的定位较好COX-2与Trp387、Ser530(氢键)和Arg120等关键氨基酸相互作用时的囊袋。此外,通过结合刚性和柔性分子对接研究,两种可能的方法提出了AG与5-LO相互作用的机制:非氧化还原竞争结合和非氧化还原竞争结合Fe[/font][font=宋体]2+[/font][font=宋体]络合。而理论计算结果显示,前者结合能相对更低。[/font][font=宋体][11][/font]Carlotta Marianecci等人[font=宋体]研究表明甘草提取物可用于治疗皮炎、湿疹和银屑病,其疗效与皮质类固醇相当。在这项工作中,通过研究不同浓度的表面活性剂(吐温85和司班20)和胆固醇组成的囊泡在甘草酸铵(AG)释放中用于治疗各种炎症性疾病的效果。对囊泡进行了包括尺寸、ζ电位、各向异性、药物包封率、稳定性、细胞毒性评价和皮肤耐受性等方面的表征,证实纤维素膜在甘草酸铵囊泡的体外释药特性中作用[/font][font=宋体][12][/font][font=宋体]。[/font]甘草酸在大多数肝脏疾病的临床实践中用作肝脏保护剂。万荣等研究证实,甘草酸二铵减缓肝损伤并可阻止自然杀伤T细胞。其通过两种不同剂量甘草酸多铵给药对照试验,通过检测相应指标。得出预处理能显著降低血清ALT并改善cona诱导的自身免疫性肝组织损伤的结论。实验结果证实,DG预处理可下调攻击后的炎性细胞因子与Con A,并可以抑制胸腺T淋巴细胞凋亡。此外,甘草酸二铵还可有效地抑制CD4的增殖+CD25、CD69+、CD8+及CD69型+等外周血和脾脏的亚群,并显著下调NKT细胞的频率,同时上调树突状细胞的频率肝脏[13]。隋秀文等研究证明了甘草酸多铵盐和氯化锂共同作用抑制伪狂犬病病毒PrV感染,并可诱导PrV细胞凋亡。(PrV)是一种猪嗜神经性疱疹病毒与单纯疱疹病毒1型(HSV-1)有共同的基因组排列。其感染严重威胁畜牧业和人类健康。以甘草酸多铵盐为基底开发有效的抗病毒药物是减少PrV感染的重要策略之一[14]。李云等研究证实,甘草酸二铵(DG)具有抗炎和保肝药理作用。非酒精性脂肪肝(NAFLD),作为常见的慢性肝病,在世界范围内普遍存在。李云团队通过高脂饮食诱导的NAFLD模型小鼠实验,我们观察到DG可以减轻体重、肝脏脂肪变性以及肝脏炎症Illumina对16S rRNA的测序显示DG干预改变NAFLD小鼠肠道微生物群的组成,使得肠道菌群的丰富度显著增加。特别是DG降低了厚壁菌与拟杆菌的比率和产生内毒素的细菌(如脱硫弧菌)提高了益生菌如变形杆菌和乳酸杆菌的丰度。DG能增强短链蛋白的表达水平,如产脂肪酸(SCFA)的细菌、瘤胃科和漆树科,促进SCFA的产生。此外DG补充显著减轻了肠道低度炎症。促进细胞表达紧密连接蛋白、杯状细胞数量和粘蛋白分泌,从而增强肠屏障功能。因此,目前可以认为,DG对NAFLD的预防可能是通过调节肠道菌群和恢复肠道功能来实现的[15]。异甘草酸镁(MgIG)被广泛应用于慢性肝病的治疗。主要认为是通过作用于肝毒性诱导物质——甲氨蝶呤(MTX)诱导的肝毒性实现其效果。曹雨竹等人研究结果显示,预防性的给予小鼠MgIG(9和18mg/kg/天)可显著降低小鼠血液中血清天冬氨酸转氨酶和丙氨酸转氨酶的减少;MgIG还能减轻MTX诱导的肝纤维化。对MTX诱导的肝细胞损伤有较好的保护作用。此外,MTX还可诱导环氧合酶-2(COX-2)表达,给予MgIG后,肠道通透性和炎症减轻。总之,MgIG对甲氨蝶呤引起的肝毒性和肠道损伤有积极作用一种,是有可能缓解MTX肝脏和肠道副作用的药物[16]。4.总结甘草是一种豆科草本植物,其作史古已有之,必然意味着甘草所独具的 性质千百年来一直为人们所使用。而其主要活性成分甘草酸及其衍生盐类由于其甜度极高,且甜度留存时间长,主要用作甜味剂用于食品添加剂中。但都具有一定毒性,需要严格按照国家标准使用。此外,甘草酸盐还具有药理性质,在生物医药研究方面受到了学者的广泛关注,具有抗炎、保肝两方面的功能,因此也频繁应用与新型药物的开发,其价值也得到了更多的延伸。参考文献[1]甘草酸的制备及其在食品工业中的应用.食品工业,1994,(6);49~51[2]Tykarska E , Gdaniec M . Toward Better Understanding of Isomorphism of Glycyrrhizic Acid and Its Mono- and Dibasic Salts[J]. Crystal Growth & Design, 2013, 13(3):1301-1308.[3]郑国斌.从甘草酸粗品制取甘草酸单钾盐.中国医药工业杂志,1995,26(2);54[4-5,7-8]食品添加剂应用手册/孙平,张津凤主编.一北京:化学工业出版社,2010.10 ISBN978-7-122-09417-9[6]苌云玉.甘草酸盐制备方法研究[J].基层中药杂志,1995(04):33-34. [9]邓淑华,王晓斌,王鸿梅,刘艳华.甘草酸盐抗菌作用的实验研究[J].承德医 学院学报,2011,28(03):325-326.[10]黄能慧,曾样锬,刘季昆,夏炳南.甘草酸盐对农药(杀虫双)的解救作用[J].贵阳医学院学报,1982(03):21-22.[size=13px] [/size][11] Maione F , Minosi P , Giannuario A D , et al. Long-Lasting Anti-Inflammatory and Antinociceptive Effects of Acute Ammonium Glycyrrhizinate Administration: Pharmacological, Biochemical, and Docking Studies[J]. Molecules, 2019, 24(13)[12] [size=13px][color=#222222]Koide M , Takahashi M , Tamagaki S , et al. Catalytic effect of dipotassium glycyrrhizinate on the hydrolysis of nonionic ester surfactants[J]. Journal of the American Oil Chemists' Society, 1996, 73.[/color][/size][13]万荣, 刘莎, 范稚坚,等. Clinical Observation of Diammonium Glycyrrhizinate Enteric-coated Capsule in Preventing Liver Injury Induced by Anti-tuberculosis Drugs[J]. 大理学院学报, 2019, 004(004):45-47.[color=#222222][14] Sui X , Yin J , Ren X . Antiviral effect of diammonium glycyrrhizinate and lithium chloride on cell infection by pseudorabies herpesvirus.[J]. Antiviral Research, 2010, 85(2):346-353. [15][/color] [color=#222222]Li, Yun, Liu, et al. Diammonium Glycyrrhizinate Protects against Nonalcoholic Fatty Liver Disease in Mice through Modulation of Gut Microbiota and Restoration of Intestinal Barrier[J]. Molecular pharmaceutics, 2018.[/color][16] Marianecci C , Rinaldi F , Mastriota M , et al. Anti-inflammatory activity of novel ammonium glycyrrhizinate/niosomes delivery system: Human and murine models[J]. Journal of Controlled Release, 2012, 164(1):17-25.
我最近按中国药典2010版方法测定复方甘草口服溶液中甘草酸突然含量测定不上来,原来测定结果能与原料甘草流浸膏中甘草酸基本对应一致,现在会差很大,从柱效、拖尾因子看现在与原先无太大差异,且符合中国药典2010版要求,请教各位同仁,在测定复方甘草口服溶液中甘草酸有什么特别注意点吗?
请问专家:哪里可以买到沙蚕毒素(沙参毒素草酸盐)标准品?谢谢。
原子荧光测铅有可能空白荧光强度达到580(负高雅270V灯电流60mA),正常情况是空白荧光强度280。北京的专家说一般铁氰化钾含铅。回来试验,发现不是铁氰化钾的质量问题,也不是盐酸含铅(我买过一瓶高纯的进口盐酸,和我蒸馏提纯前后的盐酸含铅空白一样好。)。我改用酒石酸代替草酸实验(可以采用酒石酸、柠檬酸、邻苯二甲酸、乙酸等代替草酸实验,效果和草酸一样,参阅《中国金属学会第13届分析测试学术年会论文集》2006年P37),证实了是草酸的问题。估计草酸含铅约10mg/kg,符合试剂标准20mg/kg要求。我的铁氰化钾、盐酸、草酸都是进口的,所以不要盲目迷信进口的试剂一定好。我以前用的铁氰化钾、盐酸、草酸都是国产的质量也很好。昨天用了一瓶广州化学试剂厂的铁氰化钾,和美国进口的铁氰化钾比较,铅的空白是一样的好。所以不是盐酸含铅过高的问题。我发帖是提醒朋友们注意到草酸这种络合剂很可能含铅,这是没有人提到过的情况。
请求帮助,急!昨天做实验,用EDTA滴定草酸合铜酸钾溶液中的铜离子,具体的做法是准确称取0.17~0.19g的产物,用15mL氨-氯化铵缓冲溶液(pH=10)溶解,再稀释至100mL.以紫脲酸胺为指示剂,用EDTA标准液滴定至溶液由亮黄至紫色.但我做的却没有亮黄色.不知道是什么原因哪儿出错了.请专家们能给我指导,谢谢!
各位用DSC或者TG做的氮气气氛下草酸钙的曲线是什么样的?我想跟我们仪器做出的曲线比较下,在网上搜了很多资料,三个峰的温度范围都不一样,不知道哪位老师知道标准数值。
本人刚做了TA SDT Q600校准,使用标准品草酸钙做检正实验,第一次图线比较正常,做重复实验时第二个峰由吸热变为放热峰,不知是何原因,请高人指点.

问题:四君子颗粒中甘草苷、甘草酸铵的检测对照品分析中甘草苷与甘草酸铵的分离度是?答案:62.445【活动奖励】因zgx3025(注册ID:v2844608)的答案不正确,所以取消本次获得的钻石币幸运奖(2钻石币):抽奖软件,当天随机抽取3个回答正确的版友ID号(最后一个ID号,截止至下午3:00),每人奖励2个钻石币mengzhaocheng(注册ID:mengzhaocheng)莫名其妙(注册ID:moyueqiu)http://ng1.17img.cn/bbsfiles/images/2016/03/201603031621_585902_1610895_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/03/201603031621_585903_1610895_3.png积分奖励:所有回答正确的版友奖励10个积分(幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================四君子颗粒中甘草苷、甘草酸铵的检测样品制备制备方法1. 对照品:取甘草苷对照品、甘草酸铵对照品适量,精密称定,加甲醇制成每1 mL分别含甘草苷20 μg、甘草酸铵0.2 mg溶液,即得(甘草酸重量=甘草酸铵重量/1.0207)。2. 供试品:取本品装量差异项下的内容物3 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定重量,超声处理(功率250 W,频率40 KHz)30分钟,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液15 mL,蒸干,残渣加甲醇使溶解,移至5 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。分析条件色谱柱Platisil ODS 250 x 4.6 mm,5 μm (Cat#:99503)流动相A:乙腈 B:0.05%磷酸溶液 梯度流速1.0 mL/min柱温30 ℃检测器UV 237 nm 进样量10 μL 色谱图对照品http://ng1.17img.cn/bbsfiles/images/2016/03/201603031020_585805_1610895_3.jpg 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数* N USP拖尾因子 分离度 1 15.739 771814 49202 22131.352 0.998 -- 2 36.170 766340 93054 391608.534 1.043 62.445 *药典要求理论板数按甘草苷峰计算应不低于5000供试品http://ng1.17img.cn/bbsfiles/images/2016/03/201603031021_585807_1610895_3.jpg 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数* N USP拖尾因子 分离度 1 15.784 475765 27766 18773.718 0.973 -- 2 36.033 152478 18510 403100.536 0.997 58.879 *药典要求理论板数按甘草苷峰计算应不低于5000本品种同时使用了Diamonsil C18、DiamonsilC18(2)两款色谱柱,在药典规定条件下进行甘草苷、甘草酸铵的检测,均满足药典要求。
请问下大家,买的孔雀石绿标准品是孔雀石绿草酸盐2(C23H25N2)*2(C2HO4)*C2H2O4,配制标样的时候,怎么换算成孔雀石绿的含量,称10mg孔雀石绿草酸盐定容至10mL,孔雀石绿的浓度是多少?可以详细一点么,谢谢小仙女,大神帅哥。
我这平时有石墨炉测铅,所以原子荧光测铅没做过,前段时间第一次做。主要参考国标5009.12第二法 和 海光用户手册,两者基本差不多,有略微差异,我主要参照海光用户手册。一开始做标准曲线,线性是很好0.9997,但是后面的点荧光值一直往上翘,数值关系,基本上是每次都是前面点荧光值的2倍再多点,导致截距在负90个荧光值左右。于是,我洗了几针,然后重测标准曲线,线性仍很好3个9,但是截距变正的170了,(原因是我忘了重新进一针标准空白,而真正的空白估计往上飘了好多,虽然是洗过好几针的),于是,我再重测标曲废了九牛二虎之力,总算把标曲勉强搞到了我的心理价位(线性0.9992,截距-30荧光值)测样,基本还可以,反正也不知道结果准不准,问题是,空白还是会有一定幅度的飘,测几个样我就校准以下空白。加标回收,因为不知道样品铅含量,所以先加了很高量的标,回收在85-90左右(因为加标量相对样品本身含量太高了,所以这个加标回收参考性估计不强吧)第一次做,只是试探下条件,载流2%盐酸,还原剂2%硼氢化钾0.5%氢氧化钠。有个疑问,国标上,铁氰化钾和草酸是分开配的,海光用户手册上是配在一起的,我试了配在一起。第一次,称了草酸、铁氰化钾,混在一块,加水,最后有些无色晶体怎么也溶不掉。第二次,我先称了草酸,配成溶液,配的浓度跟上次一样,草酸全部溶解了,再往里边加铁氰化钾,结果起白色沉淀了。是不是两者会反应?还有,加草酸是什么作用?
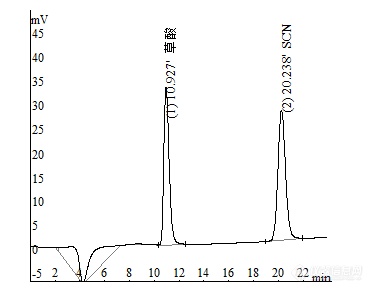
[font=宋体][size=13px]中[/size][/font][font=宋体][size=13px][color=#444444][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐[/color][/size][/font][align=center]黄选忠[/align][align=center](湖北兴山县疾病预防控制中心,湖北兴山,443711)[/align]摘要:【目的】建立以SH-AC-3型阴离子交换柱为分离柱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url][font=times new roman][size=18px]-[/size][/font]抑制电导检测法同时测定尿样中草酸和硫氰酸盐的新方法。【方法】研究用[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐的可能性,通过试验优化确定了各项色谱条件。【结果】以SH-AC-3型阴离子交换柱为分离柱,以10.0mmol/LNa2CO3为淋洗液,流量为1.0mL/min,等度洗脱可将草酸和硫氰酸盐与尿液中大量共存的氯化物、磷酸盐和硫酸盐等常见阴离子完全分离,通过抑制电导检测,草酸和硫氰酸盐的峰面积、峰高均与其浓度在0.20~30.0mg/L范围内呈良好的线性关系,相关系数[size=13px][i]r[/i][/size]在0.9991~0.9999,方法应用于尿液中草酸和硫氰酸盐的同时测定,加标回收率在93.2%~105.2%[size=13px]和95.3%~99.8%,[/size], 5次平行测定的相对标准偏差(RSD)小于5%(n=5)。【结论】本方法可用于尿液中草酸和硫氰酸盐的同时测定。关键词:[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法;[font=times new roman][color=#444444]尿液[/color][/font];硫氰酸盐;草酸;中图分类号:O652.63 文献标识码: 文章编号:尿中硫氰酸盐(SCN-)含量是人体接触氰化物的一项生物接触指标[1],而SCN-又是致甲状腺肿物质,可阻滞甲状腺激素合成,尤其对胎儿和婴儿的智力和神经系统发育存在较大的风险[2],因此监测人血、尿等生物标本中的SCN-含量具有重要意义。目前,测定尿中微量SCN-的方法主要有分光光度法[3-5]、衍生-顶空[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法[6-7]等,其中分光光度法和[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法都存在氰化物的干扰问题。尿结石约70%为草酸钙结石,草酸代谢异常所引起的高含量草酸尿是泌尿系结石形成的主要原因[8]。因此准确测定尿中草酸含量对研究结石形成机理、结石的鉴别等均具有重要意义。目前测定尿中草酸的方法主要有光度法包括络合物褪色比色法[9]和催化光度法[10-11]、催化荧光法[12-13]、高效液相色谱法[14-15]和毛细管电泳法[16]等,而比色法、光度法、荧光法等光谱分析方法因特异性差样品要进行前处理,操作繁杂,高效液相色谱法和毛细管电泳法均需要专用仪器使其应用受限。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法以其操作简便、试剂消耗少、可自动化和多组分同时测定的优势现已成为阴离子分析的首选方法[17],并成功应用于尿液中草酸[17-18]和SCN- [19-20]的分别测定,用[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和SCN-似未见报道。本工作拟定的以SH-AC-3型阴离子交换柱为分离柱,10.0mmol/LNa2CO3溶液为淋洗液, 1.0mL/min的流量等度洗脱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]-抑制电导检测法同时测定尿液中草酸和硫氰酸盐的新方法,草酸和SCN-的含量均在0.20~30.0mg/L范围内与其峰高和峰面积呈良好的线性关系(相关系数r在0.9991~0.9999),方法应用于尿液中草酸和SCN-的同时测定,加标回收率分别为:95.0%~101.1%和95.5~100.5%,5次平行测定的相对标准偏差(RSD)小于3%,以3倍信噪比(3N/b)计算草酸和SCN-最低检出限分别为0.04mg/L和0.03mg/L。1、试验部分1.1主要仪器CIC-100型[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url](青岛盛瀚色谱公司,编号15601),抑制器:自再生抑制器,检测器:电导检测器,定量环体积为25μL;SHA—15自动进样器(青岛盛瀚色谱公司,编号AS1518050);SH-AC-3型阴离子交换柱(250×4.0mm i.d,青岛盛瀚色谱公司,批号:1602037);SH-AC-3型保护柱(50×4.0mm i.d,青岛盛瀚色谱公司,批号:1602037)。1.2 仪器工作条件及参数设置色谱仪:柱箱温度35℃,电流:75mA,量程:1档。自动进样器:全定量环取样,取样后清洗(每针之间),置换量70μL,取样量25μL,扎针深度4mm。1.3主要试剂草酸标准溶液:1000 mg/L,称取优级纯草酸(H2C2O42H2O)0.1401g用超纯水溶解定容至100mL;SCN-标准溶液:1000 mg/L,称取烘干的优级纯硫氰酸钾0.1673g用超纯水溶解定容至100mL。Cl-标准溶液:GBW(E)080268,1000 mg/L;SO4-2标准溶液:GBW(E)080266,1000 mg/L;H2PO4-标准溶液:1000 mg/L,称取分析纯磷酸二氢钾0.1402g用超纯水溶解定容至100mL。用前将各种标准溶液用纯水分别稀释成含草酸和SCN-10.0mg/L(A液)、100.0mg/L(B液)混合标准应用液备用。无水碳酸钠(分析纯,国药集团化学试剂有限公司),草酸(优级纯,国药集团化学试剂有限公司),硫氰酸钾(优级纯,国药集团化学试剂有限公司)。试验所用其他试剂均为AR级,试验用水为超纯水(18.2ΜΩcm)。1.4 试验方法1.4.1 标准曲线的绘制 取混合标准应用液(A液)0.20、0.50和1.00mL及B液0.50、1.0、1.50、2.00和3.00 mL于10mL容量瓶中加纯水至刻度,混匀,配制成含草酸和SCN-均为0.20~30.0 mg/L的标准系列,各管取1.5mL于样品瓶中,启动自动进样器进样分别测定各组分的峰面积(S)和峰高(H),以S及H对各组分浓度(C)绘制工作曲线。1.4.2尿样的采集 用清洗干净并干燥的聚乙烯瓶采集尿样50mL储存于4℃冰箱待测定。1.4.3 尿样测定 取新鲜尿样经8000转/min离心10min,取上清液用高纯水稀释10倍后分别用C18柱净化、用0.22μm滤膜过滤后取1.5mL于样品瓶中,启动自动进样器进样测定各组分的S和H,以标准曲线法定量,同时进行加标回收试验。2、结果与讨论2.1 色谱条件的选择2.1.1 淋洗液的选择 试验结果表明,当以SH-AC-3型阴离子交换柱为分离柱,以Na2CO3+NaHCO3溶液为淋洗液,其浓度配比在6 mmol/L+1 mmol/L~6 mmol/L+3 mmol/L时,均可将草酸和硫氰酸盐与尿液中的氯化物、磷酸盐和硫酸盐等常见阴离子完全分离,各组分的分离度R(相对于后续组分,如磷酸盐的R是相对于硫酸盐的,下同)可达1.5及以上,但硫氰酸盐的保留时间(T)长达24min以上,分析效率低下。为缩短硫氰酸盐的T提高分析工作效率,以洗脱能力较强的Na2CO3溶液进行了淋洗试验,结果显示当Na2CO3溶液浓度分别为8.0、10.0和12.0 mmol/L时,硫氰酸盐的T分别缩短至21、20和19分多钟,且草酸和硫氰酸盐与尿液中的磷酸盐和硫酸盐等阴离子完全分离,试验结果见表1。考虑到Na2CO3溶液浓度大,相应的抑制电流也高,不利于抑制器的使用[17],在保证适宜的R和较短的T的情况下,试验选择10.0mmol/LNa2CO3溶液为淋洗液。[align=center]表1 Na2CO3溶液浓度选择试验结果(流量1.0 ml/min)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]8.0mmol/L[/align][/td][td=2,1][align=center]10.mmol/L[/align][/td][td=2,1][align=center]12.0mmol/L[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO4-2[/align][/td][td][align=center]10.245[/align][/td][td][align=center]3.07[/align][/td][td][align=center]8.606[/align][/td][td][align=center]2.60 [/align][/td][td][align=center]7.868 [/align][/td][td][align=center]2.34[/align][/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]13.121[/align][/td][td][align=center]8.15[/align][/td][td][align=center]10.891[/align][/td][td][align=center]9.45[/align][/td][td][align=center]9.828[/align][/td][td][align=center]10.18 [/align][/td][/tr][tr][td][align=center]SCN- [/align][/td][td][align=center]21.665[/align][/td][td][align=center]/[/align][/td][td][align=center]20.151[/align][/td][td][align=center]/[/align][/td][td][align=center]19.177 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.1.2 色谱柱的选择 以10.0mmol/LNa2CO3溶液为淋洗液、流量1.0mL/min等度洗脱,考察了青岛盛翰色谱公司生产的SH-AC-1型和SH-AC-3型阴离子交换柱对草酸和硫氰酸盐与氯化物、磷酸盐和硫酸盐等常见阴离子的分离情况,结果表明,在此条件下SH-AC-1型柱虽能将草酸与常见阴离子完全分离,但硫氰酸盐至少在90min内未出峰,而SH-AC-3型柱不但可将草酸和硫氰酸盐与氯化物、磷酸盐和硫酸盐等常见阴离子完全分离,且硫氰酸盐的T在21min以内,故本试验选择SH-AC-3型阴离子交换柱为分离柱。2.1.3淋洗液流量的选择 对于相同浓度的淋洗液,不同的流量组分的T和R的将发生改变。试验结果表明,当淋洗液流量从0.8mL/min增加至1.2mL/min时,硫酸盐、草酸和硫氰酸盐的T逐渐变短,R逐渐变小,但硫酸盐和草酸的R远大于1.5达到完全分离的标准,见表2。在保证待测组分与干扰离子完全分离的前提下尽量使用较低的流量,以使系统有较低的压力,淋洗液流量选定为1.0mL/min。[align=center]表2 不同淋洗液流量试验结果(10.0mmol/LNa2CO3)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]0.8ml/min[/align][/td][td=2,1][align=center]1.0ml/min[/align][/td][td=2,1][align=center]1.2ml/min[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]SO4-2[/align][/td][td][align=center]10.471[/align][/td][td][align=center]2.65[/align][/td][td][align=center]8.726[/align][/td][td][align=center]2.54 [/align][/td][td][align=center]7.331 [/align][/td][td][align=center]2.46 [/align][/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]13.856[/align][/td][td][align=center]9.34[/align][/td][td][align=center]11.097[/align][/td][td][align=center]9.24 [/align][/td][td][align=center]9.540 [/align][/td][td][align=center]8.95 [/align][/td][/tr][tr][td][align=center]SCN- [/align][/td][td][align=center]24.793[/align][/td][td][align=center]/[/align][/td][td][align=center]20.383[/align][/td][td][align=center]/[/align][/td][td][align=center]17.350 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.1.4 柱箱温度的确定 考察了柱温在30℃、35℃和40℃时各组分的分离效果,结果显示,在30℃~40℃范围内,草酸和硫氰酸盐均能与氯化物、磷酸盐和硫酸盐等常见阴离子完全的分离,且随着柱温的升高组分的T稍微缩短,R逐渐下降,草酸的S和H均随着柱温的升高而增长,从30℃上升35℃,增长10%左右,35℃上升40℃,增长6%左右;硫氰酸盐的S随着柱温的升高基本保持不变,而其H随着柱温的升高而增长,从30℃上升35℃,增长7%左右,35℃上升40℃,增长9%左右;在保证适宜的T和较高的R的情况下,尽量采用较低的柱温,本试验确定柱箱温度为35℃,这也是产品说明书推荐的柱箱温度。2.2标准曲线按照1.4.1配制标准系列,测定各管的峰面积(S)和峰高(H),以S、H对浓度(C)绘制标准曲线,其标准曲线的线性范围、回归方程、相关系数r(回归曲线的截距、斜率和r由仪器软件给出)列于表3。从表3可见,以峰面积计算的草酸标准曲线的线性优于峰高,硫氰酸盐则反之,同时分段计算的标准曲线的线性较好,故在计算结果时草酸和硫氰酸盐可分别用峰面积和峰高计,并根据样品浓度范围采用分段计算的回归方程来计算,以减少测量误差,尤其对低含量的样品。其中,含10.0mg/L的草酸和硫氰酸盐标准溶液色谱图见图1。[align=center]表3 标准曲线试验结果[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=3,1][align=center]以峰面积计[/align][/td][td=2,1][align=center]以峰高计[/align][/td][/tr][tr][td][align=center]线性范围/mg/L[/align][/td][td][align=center]回归方程[/align][/td][td][align=center]相关系数/r[/align][/td][td][align=center]回归方程[/align][/td][td][align=center]相关系数/r[/align][/td][/tr][tr][td=1,3][align=center]草酸[/align][/td][td][align=center]0.20~10.0[/align][/td][td][align=center]S=96700C-17000[/align][/td][td][align=center]0.99957[/align][/td][td][align=center]H=3320C-770[/align][/td][td][align=center]0.99930 [/align][/td][/tr][tr][td][align=center]10.0~30.0[/align][/td][td][align=center]S=112800C-177600[/align][/td][td][align=center]0.99996[/align][/td][td][align=center]H=3862C-6116[/align][/td][td][align=center]0.99993[/align][/td][/tr][tr][td][align=center]0.20~30.0[/align][/td][td][align=center]S=107100C-53210[/align][/td][td][align=center]0.99929[/align][/td][td][align=center]H=3671C-1995[/align][/td][td][align=center]0.99928[/align][/td][/tr][tr][td=1,3][align=center]SCN- [/align][/td][td][align=center]0.20~10.0[/align][/td][td][align=center]S=114600C+621.7[/align][/td][td][align=center]0.99913[/align][/td][td][align=center]H=2718C-108.6[/align][/td][td][align=center]0.99999[/align][/td][/tr][tr][td][align=center]10.0~30.0[/align][/td][td][align=center]S=124700C-141500[/align][/td][td][align=center]0.99971[/align][/td][td][align=center]H=2934C-2787[/align][/td][td][align=center]0.99984[/align][/td][/tr][tr][td][align=center]0.20~30.0[/align][/td][td][align=center]S=119200C-22340[/align][/td][td][align=center]0.99949[/align][/td][td][align=center]H=2835C-609.3[/align][/td][td][align=center]0.99972[/align][/td][/tr][/table]2.3 方法的精密度和检出限对2种浓度的标准溶液各平行测定5次,计算各成分峰面积的RSD,同时测定仪器30min的基线噪声,以3倍基线噪声除以标准曲线(峰面积计)的斜率(3N/b)计算草酸和硫氰酸[align=center][img=,374,293]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021441333779_9714_3389662_3.png!w374x293.jpg[/img][/align][align=center]图1 标准溶液色谱法图[/align]盐的检出限,5次平行测定的RSD在0.86%~2.26%,方法的重复性良好,方法的检出限分别为0.04 mg/L和0.03 mg/L,见表4。[align=center]表4 方法的精密度和检出限[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=3,1][align=center]标液1[/align][/td][td=3,1][align=center]标液2[/align][/td][td][align=center]检出限/mg/L[/align][/td][/tr][tr][td]浓度/mg/L[/td][td]平均峰面积[/td][td][align=center]RSD/%[/align][/td][td][align=center]浓度/mg/L[/align][/td][td]平均峰面积[/td][td][align=center]RSD/%[/align][/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]1.00 [/align][/td][td][align=center]78077.3[/align][/td][td][align=center]2.10[/align][/td][td][align=center]10.00 [/align][/td][td][align=center]955086.6[/align][/td][td][align=center]0.86 [/align][/td][td][align=center]0.04[/align][/td][/tr][tr][td][align=center]SCN- [/align][/td][td][align=center]1.00 [/align][/td][td][align=center]116110.4[/align][/td][td][align=center]2.26[/align][/td][td][align=center]10.00 [/align][/td][td][align=center]1146968.6[/align][/td][td][align=center]1.16 [/align][/td][td][align=center]0.03 [/align][/td][/tr][/table]2.4 [size=12px] [/size]共存阴离子及抗坏血酸的影响由于尿液中含有大量的有机物和氯化物、磷酸盐和硫酸盐等阴离子,尿样通过C18柱的净化可以消除有机物的影响,尿液经10倍稀释以降低氯化物、磷酸盐和硫酸盐的影响。考察了氯化物等3种阴离子对草酸和硫氰酸盐测定结果的影响,结果表明,氯化物、磷酸盐和硫酸盐的保留时间远小于草酸和硫氰酸盐,且500mg/L Cl-、300mg/L H2PO4-、SO4-2(H2PO4-、SO4-2完全分不开合并为一个峰)不影响50mg/L的草酸、3mg/L的测定,分离色谱图见图2。[align=center][img=,379,281]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021441474631_778_3389662_3.png!w379x281.jpg[/img][/align][align=center]图2 常见阴离子与草酸和硫氰酸盐分离色谱图[/align]尿液中可能含有抗坏血酸,在碱性条件下,抗坏血酸易发生降解反应,而草酸是抗坏血酸的降解产物之一,影响草酸的准确测定,有研究显示在15.0mmol/LNaHCO3溶液(pH=8.3)中40mg/L的抗坏血酸在80min内未降解为草酸[17],本试验使用10.0mmol/LNa2CO3溶液(pH≈11.1)为淋洗液,pH值远大于8.3,样品从进样到草酸出峰需要11min多钟,这段时间尿液中的抗坏血酸可能降解生成草酸而影响其测定。试验用纯水配制30mg/L的抗坏血酸观察其降解情况,结果表明,本试验条件下30mg/L的抗坏血酸降解产生约0.3mg/L的草酸,试验采用亚硫酸盐(SO3-2)抑制抗坏血酸的降解,这与在易氧化药物制剂中加入亚硫酸盐以提高药物稳定性的方法有相似原理。[align=center][img=,517,262]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021442032319_2305_3389662_3.png!w517x262.jpg[/img][/align][align=center]图3 抗坏血酸降解抑制试验结果[/align][align=center]曲线1、30mg/L抗坏血酸(黑色)2、1+50 mg/L的SO3-2(粉红色)[/align][align=center] 3、[size=12px]30mg/L抗坏血酸+10mg/L草酸(蓝色)4、3+50 mg/L的SO[/size][size=12px]3[/size][size=12px]-2[/size][size=12px](桔红色)[/size][/align]试验结果显示,50mg/L的SO3-2可抑制30mg/L抗坏血酸的降解,见图3,且至少在120min内30mg/L抗坏血酸对10.0mg/L的草酸的峰面积与峰高无明显影响(增加值5%)。同时50mg/L的SO3-2对草酸和硫氰酸盐的测定结果无明显影响(误差5%),见图4。[align=center][img=,565,254]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021442164802_4125_3389662_3.png!w565x254.jpg[/img][/align][align=center]图4 50mg/L的SO3-2对草酸和硫氰酸盐测定结果的影响[/align][align=center]曲线1、10mg/L草酸和硫氰酸盐(蓝色)[/align][align=center] 2、1+50 mg/L的SO3-2(粉红色)[/align]2.5尿液测定及回收率试验结果按试验方法1.4.3的步骤操作取1.5mL样液于样品瓶中,启动自动进样器进样测定各组分的峰面积(S)和峰高(H),以标准曲线法定量,同时进行加标回收试验。3份尿液草酸和[align=center]表5 尿液测定及回收率试验结果(以峰面积计)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=3,1][align=center]尿液1[/align][/td][td=3,1][align=center]尿液2[/align][/td][td=3,1][align=center]尿液3[/align][/td][/tr][tr][td][align=center]本底/mg/L[/align][/td][td][align=center]加入量[/align][align=center]/mg/L[/align][/td][td][align=center]回收率/%[/align][/td][td][align=center]本底/mg/L[/align][/td][td][align=center]加入量/mg/L[/align][/td][td][align=center]回收率[/align][align=center]/%[/align][/td][td][align=center]本底[/align][align=center]/mg/L[/align][/td][td]加入量/mg/L[/td][td]回收率/%[/td][/tr][tr][td][align=center]草酸[/align][/td][td][align=center]4.71[/align][/td][td][align=center]10.0[/align][/td][td][align=center]101.1[/align][/td][td][align=center]6.21[/align][/td][td][align=center]5.0[/align][/td][td][align=center]97.0[/align][/td][td][align=center]14.83[/align][/td][td][align=center]2.0[/align][/td][td][align=center]95.0[/align][/td][/tr][tr][td][align=center]SCN-[/align][/td][td][align=center]0.21[/align][/td][td][align=center]10.0[/align][/td][td][align=center]100.5[/align][/td][td][align=center]0.45[/align][/td][td][align=center]5.0[/align][/td][td][align=center]97.2[/align][/td][td][align=center]0.72[/align][/td][td][align=center]2.0[/align][/td][td][align=center]95.5[/align][/td][/tr][/table]硫氰酸盐的测定结果分别在4.71mg/L~14.83mg/L和0.21mg/L~0.72mg/L,加标回收率分别为:95.0%~101.1%和95.5~100.5%,结果见表5。其中尿液2的加标色谱图见图5.[align=center][img=,574,253]https://ng1.17img.cn/bbsfiles/images/2020/09/202009021442298329_66_3389662_3.png!w574x253.jpg[/img][/align][align=center]图5 尿液2及其加标色谱图[/align]曲线1、尿液[align=center] 2、尿液加5mg/L草酸和硫氰酸盐[/align]3 小结本工作采用国产[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]设备,建立了以青岛盛翰色谱公司生产的SH-AC-3型阴离子交换柱为分离柱,10.0mmol/LNa2CO3为淋洗液、流量1.0mL/min等度洗脱,抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐的分析方法。方法具有良好的重现性和准确性,操作简便快速,尿样通过C18柱的净化可以消除有机物的影响,尿液稀释10倍后可降低氯化物、磷酸盐和硫酸盐的影响。方法以自动进样器进样,降低检验人员的工作强度,提高了工作效率,适用尿液中草酸和硫氰酸盐的同时测定。参考文献1)中华人民共和国卫生部.GBZ209-2008职业性急性氰化物中毒诊断标准.北京:人民卫生出版社,20082)顾 欣,黄士新,李丹妮,等.乳中硫氰酸盐对人类健康的风险评估[J],中国兽药杂志,2010,44(9):45-523)WS/T39-1996.尿中硫氰酸盐的吡啶-巴比妥酸分光光度测定方法.北京:中国标准出版社,19974)冯翠霞,林丽玲,黄辉涛.分光光度法测定尿中硫氰酸盐的异烟酸-吡唑酮[J],中国职业医学,2009,36(6):501,5045)黄选忠,汪 波,舒开继等.异烟酸-巴比妥酸分光光度法测定尿硫氰酸盐[J],山东化工,2019,48(20):106-107,1126)钟良康,方波. 超短柱顶空[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法测定尿中硫氰酸盐[J],中国卫生检验杂志,2005,15(5):568,6287)武和平,武景福.尿中硫氰酸盐的[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]测定法[J],职业与健康,2005,21(1):40-418)马腾骧,孙 光. 现代泌尿外科学[M].天津:天津科学技术出版社,2000:587-5889)李桂兰.锆-偶氮胂Ⅲ络合物比色法测定尿草酸[J].临床检验杂志,1997,15(2):86-8710)张爱梅,贾丽萍,牛学丽.表面活性剂增敏阻抑动力学光度法测定痕量草酸[J].分析化学,2003,31(9):1115-111811)麻全生,杨文初.铬酸钾氧化甲基红催化光度法测定微量草酸[J].理化检验化学分册,1998,37(7):309-31012)冯素玲,陈小兰,樊 静,等.抑制动力学荧光法测定草酸[J].分析化学,2000,28(5):621-62313)陈兰化,赵丹华.催化荧光法测定痕量草酸[J].光谱学与光谱分析,2003,23(1):203-20414)廖贤平,宋光庆.HPLC法同时测定尿液中草酸和枸橼酸含量的方法学评价及临床应用[J].武警医学院学报,2010,19(1):47-5015)彭 婕,郭卫红,谈恒山,等.高效液相色谱法测定人尿液中草酸的含量[J].中国医院药学杂志,2006,26(3):299-30116)谈绮文,郭 玮,顾梅秀,等.高效毛细管电泳法测定尿液中微量草酸和柠檬酸[J].中华检验医学杂志,2014,37(4):281-28417)杭义萍,卢祝靓子,杨春英.抗坏血酸存在下[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法直接测定尿液中草酸含量的研究[J].分析科学学报,2014,33(11):1307-131118)颜金良,高 杰,颜勇卿,等.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法快速测定人尿液中草酸含量研究[J],中国卫生检验杂志,2009,19(3):554-55519)郭爱华,袁 佗,王 玮.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法快速测定人尿中的硫氰酸盐[J],环境与职业医学,2015,32(6):593-59620)何 漪,王 钟,刘月月,等.抑制电导检测-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定人尿中硫氰酸盐[J].现代预防医学,2017,44(22):4165-4167
请求帮助,急!昨天做实验,用EDTA滴定草酸合铜酸钾溶液中的铜离子,具体的做法是准确称取0.17~0.19g的产物,用15mL氨-氯化铵缓冲溶液(pH=10)溶解,再稀释至100mL.以紫脲酸胺为指示剂,用EDTA标准液滴定至溶液由亮黄至紫色.但我做的却没有亮黄色.不知道是什么原因哪儿出错了.请专家们能给我指导,谢谢!
草酸,即乙二酸,最简单的二元酸。结构简式HOOCCOOH。它一般是无色透明结晶,对人体有害,会使人体内的酸碱度失去平衡,影响儿童的发育,草酸在工业中有重要作用,草酸可以除锈。草酸遍布于自然界,常以草酸盐形式存在于植物如伏牛花、羊蹄草、酢浆草和酸模草的细胞膜,几乎所有的植物都含有草酸钙。 [img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004221543_214006_1604460_3.jpg[/img]