完全按照药典标准做的三七总皂苷,可是对照品和样品的Re均不出峰,其他几个峰都出得很好

问题:颈痛颗粒中三七皂苷、人参皂苷的检测使用了哪几款液相色谱柱?答案:Platisil ODS、Leapsil C18、Spursil C18-EP【活动奖励】幸运奖(2钻石币):抽奖软件,当天随机抽取3个回答正确的版友ID号(最后一个ID号,截止至下午3:00),每人奖励2个钻石币mengzhaocheng(ID:mengzhaocheng)999youran(注册ID:999youran)WUYUWUQIU(注册ID:wulin321)http://ng1.17img.cn/bbsfiles/images/2016/01/201601291556_583923_1610895_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/01/201601291556_583924_1610895_3.png积分奖励:所有回答正确的版友奖励10个积分(幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================颈痛颗粒中三七皂苷、人参皂苷的检测样品制备制备方法1. 对照品:取人参皂苷Rg1对照品、人参皂苷Rb1对照品和三七皂苷R1对照品适量,精密称定,加甲醇制成每 1 mL含人参皂苷Rg1 0.5 mg、人参皂苷Rb1 0.5 mg、三七皂苷R1 0.1 mg的混合溶液,即得。2. 供试品:取装量差异项下的本品适量,研细,取约1.3 g,精密称定,加乙醚40 mL,加热回流30分钟,滤过,弃去乙醚液,药渣及滤纸挥尽乙醚,再精密加入甲醇40 mL,称定重量,加热回流1小时,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液20 mL,回收溶剂至干,残渣加水10 mL使溶解,用水饱和的正丁醇振摇提取5次,每次10 mL,合并正丁醇提取液,用2%碳酸钠溶液洗涤2次,每次20 mL,再用正丁醇饱和的水洗涤2次,每次20 mL,取正丁醇液回收溶剂至干,残渣用甲醇溶解,转移至10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得。分析条件色谱柱Platisil ODS 250 x 4.6 mm,5 μm (Cat#:99503)流动相A:水 B:乙腈 梯度流速1.0 mL/min柱温30 ℃检测器UV 203 nm进样量10 μL色谱图对照品 http://ng1.17img.cn/bbsfiles/images/2016/01/201601290942_583886_1610895_3.jpg 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数* N USP拖尾因子 分离度 1 36.408 264983 25847 265850.102 1.018 -- 2 38.915 1775914 178004 318998.439 0.998 8.983 3 54.506 1316933 127848 597818.242 0.870 55.926 *药典要求理论板数按三七皂苷 R1峰计算应不低于3000供试品http://ng1.17img.cn/bbsfiles/images/2016/01/201601290943_583887_1610895_3.jpg 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数* N USP拖尾因子 分离度 1 36.344 250230 25147 274216.739 0.996 --
目的:建立麝香接骨胶囊的含量测定方法。方法:采用高效液相色谱法。色谱柱:Agilent Technologies ZORBAX Extend-C18 4.6×250mm, 5μm,流动相:乙腈-水(21:79 V/V),流速:1.0mlmin-1,检测波长:203nm,柱温:30℃。结果:三七皂苷R1在0.005~0.25mgml-1范围内线性关系良好(r=0.9998);平均加样回收率为97.6%, RSD=1.0%(n=6)。结论:该方法简便易行,结果准确可靠,可适用于麝香接骨胶囊的质量控制。 【关键词】高效液相色谱法 麝香接骨胶囊 三七皂苷R1 含量测定 Determination of Forsythin content in Shexiang Jiegu Jiaonang by HPLC 【Abstract】 OBJECTIVE:To set up a method for quality control of Shexiang Jiegu Jiaonang METHOD HPLC method was developed to quantitative determination. COLUMN Agilent Technologies ZORBAX Extend-C18 4.6×250mm, 5μm.The mobilic phase was acetonifrile-water (21:79V/V).The column temperature was 30℃,the wavelength for detection was 203nm,flow rate was 1.0mlmin-1. RESULTS The paeonol average of recovery rate was 97.6%, and RSD was 1.0%(n=6). CONCLUSION The method is simple, accurate and suitable for its assaying. 【Key word】 HPLC Shexiang Jiegu Jiaonang Notoginsenoside R1 determination 麝香接骨胶囊为《卫生部药品标准》第五册(中药成方制剂)收载的品种,由赤芍、三七、当归、续断、苏木、麝香等22味中药组成,具有散瘀止痛,续筋接骨之功效。临床用于跌打损伤,筋伤骨折,瘀血凝结,闪腰岔气[1]。处方中三七为主药之一,三七皂苷R1为其主要有效成分,原标准中无含量测定方法。为了更好地控制制剂的内在质量,本文采用高效液相色谱法测定麝香接骨胶囊中三七皂苷R1的含量,以期为该制剂的质量提供快速、准确的测定方法,现报告如下。 1 仪器与试药 LC-2010A 高效液相色谱仪,CLASS-VP 色谱工作站,紫外检测器;三七皂苷R1对照品(批号:110745-200312),由中国药品生物制品检定所提供,供含量测定用;麝香接骨胶囊为市售样品(辽源市亚东中药有限责任公司,规格0.3g粒-1,批号:060801,061102,060912)。乙腈为色谱纯;水为超纯水;其他试剂均为分析纯。 2 方法与结果 2.1 色谱条件与系统适用性试验 色谱柱:Agilent Technologies ZORBAX Extend-C18 4.6×250mm, 5μm;流动相:乙腈-水(21:79, V/V);检测波长:203nm;流速:1.0mlmin-1;柱温:30℃。理论板数按三七皂苷R1峰计应不低于4000。 2.2 溶液制备 2.2.1 对照品溶液的制备 精密称取经五氧化二磷减压干燥12小时以上的三七皂苷R1对照品适量,加甲醇制成0.25 mgml-1的对照品贮备液;再精密量取对照品贮备液适量,加甲醇制成0.05mgml-1的对照品溶液,即得。 2.2.2 供试品溶液的制备 取装量差异项下的麝香接骨胶囊内容物,研细,取约1g,精密称定,置具塞锥形瓶中,精密加入甲醇50ml,密塞,称定重量,超声处理(功率250W,频率50 kHz)1小时,取出,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液25ml,置蒸发皿中,蒸干,残渣加水饱和的正丁醇30ml使溶解,加氨试液振摇提取3次,每次15ml,合并氨试液提取液,再用水饱和的正丁醇振摇提取2次,每次15ml,与上述正丁醇液合并,蒸干,残渣加甲醇适量使溶解,转移置10ml量瓶中,加甲醇稀释置刻度,摇匀,用微孔滤膜(0.22μm)滤过,取续滤液,即得[2]。 2.2.3 阴性对照溶液的制备 取除三七皂苷R1以外的处方中其余药材的十分之一量,按法制成胶囊,再按供试品溶液制备方法,制成阴性对照溶液。 2.3 专属性试验 分别精密吸取供试品溶液、阴性对照溶液和对照品溶液各10μl注入液相色谱仪,记录色谱图(图1)。由图1可见,供试品色谱中,在与对照品色谱相应的位置上,有相同保留时间(三七皂苷R110.971min)的色谱峰,阴性试验无干扰,证明本法可行。2.4 线性关系考察 精密吸取三七皂苷R1对照品贮备液(浓度:0.25mg.ml-1)适量,加甲醇配成浓度分别为0.005、0.01、0.05、0.10、0.15、0.25mgml-1的溶液6份,摇匀,用0.22μm微孔滤膜过滤。精密吸取续滤液各10μl,注入液相色谱仪,测得峰面积。以峰面积(A)为纵坐标,其浓度(C)为横坐标,得三七皂苷R1的回归方程为:A=392250.2 C +8620.1,r =0.9998(n=6)。结果表明,三七皂苷R1在0.005~0.25mgml-1范围内峰面积与其浓度呈良好线性关系。 2.5 精密度试验 精密吸取三七皂苷R1对照品溶液(0.05mgml-1)10μl,在上述色谱条件下重复进样6次,求得三七皂苷R1溶液峰面积的相对标准偏差(RSD)为0.3%(n=6),表明精密度较好。 2.6 稳定性试验 精密吸取三七皂苷R1对照品溶液(0.05mgml-1)10μl,在0、4、8、12、24、48h分别进行测定,结果表明三七皂苷R1对照品溶液在48h内稳定, RSD为0.4%(n=6)。 2.7 重复性试验 取供试品(批号061101),共6份,分别按“2.2.2供试品溶液的制备”方法制备供试品溶液,进行测定,求得三七皂苷R1含量的RSD为1.6%(n=6),表明重现性较好。 2.8 加样回收率试验 精密称取已知含量的样品(批号061101,三七皂苷R1含量0.93mgg-1,平均装量0.2996g粒-1)适量,共6份,分别置具塞锥形瓶中,分别精密加入三七皂苷R1对照品贮备液(0.25mgml-1)各3ml,按“2.2.2供试品溶液的制备”方法操作,得回收率试验溶液,依法测定,结果见表1。表1 三七皂苷R1加样回收率试验(略) 2.9 样品含量测定 分别精密吸取供试品溶液与对照品溶液各10μl,注入液相色谱仪,测定三批样品中三七皂苷R1峰面积,按外标法计算其含量(n=5),结果见表2。表2 3批样品含量测定结果(略) 3 讨论 3.1 通过对3批样品中三七皂苷R1的测定,结果表明最高含量为0.31mg粒-1,最低为0.27mg粒-1,综合考虑确定限量每粒含三七皂苷R1不得低于0.20mg。 3.2 流动相的选择 试验中采用不同的流动相甲醇-水(25︰75),乙腈-水-冰醋酸(25︰75︰0.5),结果表明采用流动相乙腈-水(21︰79)的色谱图基线较稳。 3.3 本方法结果准确,方法简便,重现性及回收率均理想,可以作为该制剂的质量控制方法。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=70141][url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]法快速测定三七总皂苷的方法研究[/url]
[b]问题:[b][/b]三七总皂苷 -Platisil C18 -2015药典的检测的化合物是?答案:三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1=======================================================================【活动内容】1、每个工作日上午10:00左右发布一个关于应用数据库的应用问答题,版友根据题目给出自己理解的答案。2、每个工作日下午15:10公布参考答案。【活动奖励】幸运奖:抽奖软件,当天随机抽取3个或5个回答正确的版友ID号(最后一个ID号,截止至下午15:00),每人奖励[color=#ff0000]2钻石币[/color](抽奖人数≤10,抽取3个版友;抽奖人数>10,抽取5个版友);中奖名单:yy_0324(注册ID:yy_0324)荷花仙子(注册ID:v2975525)zgx3025(注册ID:v2844608)莫名其妙(注册ID:moyueqiu)dahua1981(注册ID:dahua1981)[img=,690,388]http://ng1.17img.cn/bbsfiles/images/2018/07/201807231533458327_9617_708_3.png!w690x388.jpg[/img][img=,690,388]http://ng1.17img.cn/bbsfiles/images/2018/07/201807231533576197_1958_708_3.png!w690x388.jpg[/img]积分奖励:所有回答正确的版友奖励[color=#ff0000]10个积分[/color](幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次[/b][align=left][color=#ff0000][b]PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。[/b][/color][/align][align=left][color=#ff0000][b] 下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。[/b][/color][/align][align=center]=======================================================================[/align]方法:2015药典基质:标准品溶液应用编号:102413化合物:三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1色谱柱:[url=http://www.dikma.com.cn/product/details-854.html]Platisil ODS 5μm 150 x 4.6mm[/url]样品前处理:混标:精密称取人参皂苷Rg1、人参皂苷Rb1、三七皂苷R1、人参皂苷Re标准品适量,加70%甲醇配制成浓度均为0.5mg/ml的混标溶液,待上机。色谱条件:色谱柱:Platisil C18 5μm 150*4.6mm (Cat#: 99501)流动相: A:乙腈 B:水流速: 1.5mL/min柱温: 25℃检测器: 203 nm进样量: 10 uL梯度条件:[img]http://www.dikma.com.cn/UploadImage/edit/images/1(53).png[/img]文章出处:天津应用实验室关键字:三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、HPLC、Platisil C18 、2015药典摘要:Platisil C18 检测三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1。图谱:[img]http://www.dikma.com.cn/UploadImage/edit/images/5(10).png[/img]
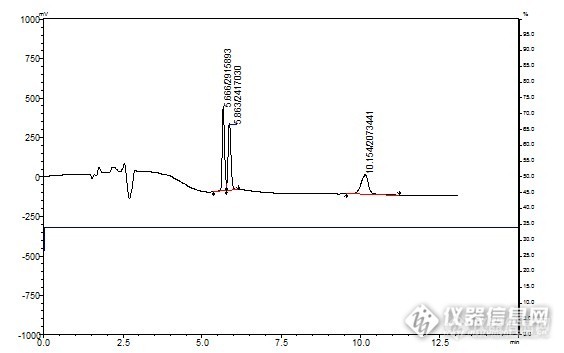
各位大侠你们好,小弟正在学习用液相,我们用的岛津LC-15, 我今天测了一下三七皂苷(三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1)。发现了一些问题想跟各位请教一下。http://ng1.17img.cn/bbsfiles/images/2013/04/201304100014_434700_2652395_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/04/201304100016_434701_2652395_3.jpg我是按照这个药典里面的方法测的,出峰顺序分别为(三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1)。发现几个问题,第一个就是我的出峰时间和别人文献上的有较大差别,另外就是基线不是太稳。其他的问题我暂时也不清楚,还劳烦各位给我指出。另外我还试了下用34乙腈等度洗脱,发现三七皂苷R1、人参皂苷Rg1,也就是前面两个峰分不开~但是这个时间就很快~不知道各位有没有好的建议,再次谢谢各位!http://ng1.17img.cn/bbsfiles/images/2013/04/201304100020_434702_2652395_3.jpg

三七中三七皂苷R1、人参皂苷Rg1、Rb1的测定和复方芩兰口服液中黄芩苷的测定http://ng1.17img.cn/bbsfiles/images/2009/10/200910311047_179308_1896702_3.jpg
[font='Times New Roman'][font=宋体]五加科人参属中重要的[/font]3[font=宋体]种植物人参、西洋参、三七均为名贵中药材,红参为人参的栽培品经蒸制后的干燥根和根茎。现代药物化学研究表明,四者中主要的有效成分均为皂苷类化合物,迄今为止,从人参中分离得到近百种皂苷单体化合物,从西洋参和三七中也分离得到了数十种人参皂苷。[/font][font=Times New Roman]4[/font][font=宋体]种中药有效成分中含有多个相同的单体皂苷类化合物,但也有其特征的皂苷成分,例如拟人参皂苷[/font][font=Times New Roman]F11[/font][font=宋体]为西洋参特征性成分,三七皂苷[/font][font=Times New Roman]R1[/font][font=宋体]为三七特征成分。现代药理作用研究表明,人参皂苷类化合物具有广泛的药理活性,如延缓衰老、提高免疫力、抗肿瘤、益智、抗氧化。[/font][/font][font='Times New Roman'][font=宋体]而人参、红参、西洋参、三七,是《中国药典》[/font][/font][font='Times New Roman'][color=#333333]2020 [font=宋体]年版中[/font][/color][/font][font='Times New Roman'][font=宋体]以人参皂苷为指标成分进行定性鉴定和含量测定的中药。在含量分析中,需要色谱柱具有特殊的选择性,峰形对称性好、柱效高。[/font][/font][font='Times New Roman'] [font=宋体]人参皂苷[/font]Rg1[font=宋体]、[/font][font=Times New Roman]Re[/font][font=宋体]是人参、红参和西洋参中的活性成份,这两个化合物具有非常相似的色谱性能,常规[/font][font=Times New Roman]C18[/font][font=宋体]柱上通常很难实现[/font][font=Times New Roman]1.5[/font][font=宋体]的分离度(即基线分离),例如在[/font][/font][font='Times New Roman'][color=#333333][font=宋体]《中国药典》[/font]2020[font=宋体]年版中,西洋参的含量测定需要柱温[/font][font=Times New Roman]40[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]℃[font=宋体],在此条件下,常规[/font][font=Times New Roman]C18[/font][font=宋体]色谱柱基本不可能分离。[/font][/color][/font][font='Times New Roman'][font=宋体]为了更好的满足质量控制要求,我司使用了纳谱分析[/font][/font][font='Times New Roman'][color=#333333]ChromCore[/color][/font][sup][font='Times New Roman'][color=#333333] [/color][/font][/sup][font='Times New Roman'][color=#333333]300 C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]应用于人参、红参、西洋参、三七的检测中,得到了良好的使用效果。[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][b][font='Times New Roman'][color=#333333]1[font=宋体].[/font][/color][/font][font='Times New Roman'][font=宋体]人参和红参的含量测定[/font][/font][/b][font='Times New Roman'][color=#333333][font=宋体]本次试验以赛默飞[/font][/color][/font][font='Times New Roman']UltiMate3000[font=宋体]高效液相色谱仪为[/font][/font][font='Times New Roman'][color=#333333][font=宋体]采集[/font][/color][/font][font='Times New Roman'][font=宋体]设备,[/font][/font][font='Times New Roman'][color=#333333][font=宋体]采用纳谱分析[/font]ChromCore[/color][/font][sup][font='Times New Roman'][color=#333333] [/color][/font][/sup][font='Times New Roman'][color=#333333]300 C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱,以[/font][font=Times New Roman]2020[/font][font=宋体]版《中国药典》中规定的条件,以乙腈为流动相[/font][font=Times New Roman]A[/font][font=宋体],以水为流动相[/font][font=Times New Roman]B[/font][font=宋体],按下表中的规定进行梯度洗脱;检测波长为[/font][font=Times New Roman]203[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]nm[font=宋体]。理论板数按人参皂苷[/font][font=Times New Roman]Rg1[/font][font=宋体]峰计算应不低于[/font][font=Times New Roman]6000[/font][font=宋体]。结果如图[/font][font=Times New Roman]1[/font][font=宋体]、[/font][font=Times New Roman]2[/font][font=宋体]、[/font][font=Times New Roman]3[/font][font=宋体]、[/font][font=Times New Roman]4[/font][font=宋体]: [/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'] [img=,417,127]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141515595525_1260_3527267_3.jpg!w417x127.jpg[/img][/font][img=,558,216]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141516167743_8653_3527267_3.png!w558x216.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]1[font=宋体]人参对照品图谱[/font][/color][/font][/align][img=,558,215]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141516308721_7973_3527267_3.png!w558x215.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]2[font=宋体]人参供试品图谱[/font][/color][/font][/align][align=center][font='Times New Roman'][color=#333333] [/color][/font][/align][img=,558,215]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141516457742_3429_3527267_3.png!w558x215.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]3[font=宋体]红参对照品图谱[/font][/color][/font][/align][img=,558,213]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141517022737_6042_3527267_3.png!w558x213.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]4[font=宋体]红参供试品图谱[/font][/color][/font][/align][font='Times New Roman'][color=#333333][font=宋体]从上述图谱可以看出来,采用纳谱分析[/font]ChromCore 300 C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱后,样品的峰型良好,人参皂苷[/font][font=Times New Roman]Rg1[/font][font=宋体]、[/font][font=Times New Roman]Re[/font][font=宋体]分离良好,理论塔板数达到要求。[/font][/color][/font][b][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]2[font=宋体].[/font][/color][/font][font='Times New Roman'][font=宋体]西洋参的含量测定[/font][/font][/b][font='Times New Roman'][color=#333333][font=宋体]采用纳谱分析[/font]ChromCore 300 C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱,以[/font][font=Times New Roman]2020[/font][font=宋体]版《中国药典》中规定的条件,以乙腈为流动相[/font][font=Times New Roman]A[/font][font=宋体],以[/font][font=Times New Roman]0.1%[/font][font=宋体]磷酸溶液为流动相[/font][font=Times New Roman]B[/font][font=宋体],按下表中的规定进行梯度洗脱;检测波长为[/font][font=Times New Roman]203[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]nm[font=宋体];柱温[/font][font=Times New Roman]40℃[/font][font=宋体]。理论板数按人参皂苷[/font][font=Times New Roman]Rb1[/font][font=宋体]峰计算应不低于[/font][font=Times New Roman]5000[/font][font=宋体]。如图[/font][font=Times New Roman]5[/font][font=宋体]、[/font][font=Times New Roman]6[/font][font=宋体]:[/font][/color][/font][img=,266,189]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141517157651_8022_3527267_3.jpg!w266x189.jpg[/img][font='Times New Roman'] [/font][img=,642,230]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141517282623_478_3527267_3.png!w642x230.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]5[font=宋体]西洋参对照品图谱([/font][font=Times New Roman]40℃[/font][font=宋体])[/font][/color][/font][/align][img=,641,223]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141520525477_496_3527267_3.png!w641x223.jpg[/img][font=&][color=#333333] [/color][/font][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]6[font=宋体]西洋参供试品图谱([/font][font=Times New Roman]40℃[/font][font=宋体])[/font][/color][/font][/align][font='Times New Roman'] [/font][font='Times New Roman'][color=#333333] [font=宋体]在没有[/font]ChromCore[/color][/font][sup][font='Times New Roman'][color=#333333] [/color][/font][/sup][font='Times New Roman'][color=#333333]300 C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱的时候,我摸索了[/font][font=Times New Roman]ChromCore[/font][/color][/font][sup][font='Times New Roman'][color=#333333] [/color][/font][/sup][font='Times New Roman'][color=#333333]C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱的条件,在柱温降至[/font][font=Times New Roman]25[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]℃[font=宋体]时,也能达到良好的分离效果,如图[/font][font=Times New Roman]7[/font][font=宋体]、[/font][font=Times New Roman]8[/font][font=宋体]:[/font][/color][/font][img=,643,199]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141521257610_3828_3527267_3.png!w643x199.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]7[font=宋体]西洋参对照品图谱([/font][font=Times New Roman]25℃[/font][font=宋体])[/font][/color][/font][/align][align=center][font='Times New Roman'][color=#333333] [/color][/font][/align][img=,643,205]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141521414095_578_3527267_3.png!w643x205.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]8[font=宋体]西洋参供试品图谱([/font][font=Times New Roman]25℃[/font][font=宋体])[/font][/color][/font][/align][font='Times New Roman'][color=#333333][font=宋体]综上[/font]ChromCore 300 C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱在药典要求的柱温[/font][font=Times New Roman]40[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]℃[font=宋体]时,可以达到分离和柱效的要求,[/font][font=Times New Roman]ChromCore C18 4.6mm×250mm[/font][font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱在柱温降至[/font][font=Times New Roman]25[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]℃[font=宋体]时,也可以达到分离和柱效的分析要求。[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][b][font='Times New Roman'][color=#333333]3[font=宋体].[/font][/color][/font][font='Times New Roman'][font=宋体]三七的含量测定[/font][/font][/b][font='Times New Roman'][color=#333333][font=宋体]采用纳谱分析[/font]ChromCore 300 C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱,以[/font][font=Times New Roman]2020[/font][font=宋体]版《中国药典》中规定的条件,以乙腈为流动相[/font][font=Times New Roman]A[/font][font=宋体],以水为流动相[/font][font=Times New Roman]B[/font][font=宋体],按下表中的规定进行梯度洗脱;检测波长为[/font][font=Times New Roman]203[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333]nm[font=宋体]。理论板数按三七皂苷[/font][font=Times New Roman]R1[/font][font=宋体]峰计算应不低于[/font][font=Times New Roman]4000[/font][font=宋体]。如图[/font][font=Times New Roman]9[/font][font=宋体]、[/font][font=Times New Roman]10[/font][font=宋体]:[/font][/color][/font][img=,583,182]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141522058277_8404_3527267_3.png!w583x182.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]9[font=宋体]三七对照品图谱[/font][/color][/font][/align][img=,581,183]https://ng1.17img.cn/bbsfiles/images/2021/10/202110141522487354_6419_3527267_3.png!w581x183.jpg[/img][align=center][font='Times New Roman'][color=#333333][font=宋体]图[/font]10[font=宋体]三七供试品图谱[/font][/color][/font][/align][align=center][font='Times New Roman'][color=#333333][/color][/font][font='Times New Roman'][color=#333333] [font=宋体]上述图谱也是采用纳谱分析[/font]ChromCore C18 4.6mm×250mm[font=宋体],[/font][font=Times New Roman]5μm[/font][font=宋体]色谱柱,样品的峰型和分离度明显改善,塔板数也达到要求,结果准确可靠。[/font][/color][/font][/align][font='Times New Roman'][color=#333333] [/color][/font][b][font='Times New Roman'][color=#333333]4. [font=宋体]我所了解的纳谱分析色谱柱性能[/font][/color][/font][/b][font='Times New Roman']4.1[font=宋体]. [/font][/font][font='Times New Roman'][color=#333333]ChromCore 300 C18[font=宋体](人参皂苷[/font][font=Times New Roman]C18[/font][font=宋体]柱)性能特点:[/font][/color][/font][font='Times New Roman'][color=#333333]4.11[font=宋体].载碳量[/font][font=Times New Roman]8.5%[/font][font=宋体],对皂苷类化合物特别是对人参皂苷[/font][font=Times New Roman]Rg1[/font][font=宋体]和[/font][font=Times New Roman]Re[/font][font=宋体]具有特殊的选择性;[/font][/color][/font][font='Times New Roman'][color=#333333]4.13[font=宋体].[/font][font=Times New Roman]300A[/font][font=宋体]的大孔径更耐皂苷类样品污染;[/font][/color][/font][font='Times New Roman'][color=#333333]4.14[font=宋体].使用[/font][font=Times New Roman]Unisil[/font][font=宋体]单分散球形硅胶,其粒径大小和颗粒均一性的精确控制达到前所未有的水平。具有:优异的分离效果,传质速度快提升做样效率,极佳的峰对称性,优良的批次间重复性,优秀的碱耐受性。[/font][/color][/font][font='Times New Roman'][color=#333333]4.2[font=宋体]. [/font][font=Times New Roman]ChromCore C18[/font][font=宋体](通用柱)性能特点:[/font][/color][/font][font='Times New Roman'][color=#333333]4.21[font=宋体].载碳量[/font][font=Times New Roman]14%[/font][font=宋体],[/font][font=Times New Roman]180A[/font][font=宋体]的孔径更适合中药的分离,具有出峰时间快,柱效高,寿命长的特点;[/font][/color][/font][font='Times New Roman'][color=#333333]4.22[font=宋体].同样使用单分散球形硅胶,有更多成功的中药应用案例。[/font][/color][/font][font='Times New Roman'][color=#333333] [/color][/font][font='Times New Roman'][color=#333333][font=宋体]综上所述,[/font]ChromCore 300 C18[font=宋体](人参皂苷[/font][font=Times New Roman]C18[/font][font=宋体]柱)经过特殊设计,针对人参、红参、西洋参中人参皂苷[/font][font=Times New Roman]Rg1[/font][font=宋体]、[/font][font=Times New Roman]Re[/font][font=宋体]和三七中的三七皂苷[/font][font=Times New Roman]R1[/font][font=宋体]对乙腈敏感、难于分离的特点,采用了独特的技术,实现了[/font][/color][/font][font='Times New Roman'][color=#333333][font=宋体]人参皂苷[/font][/color][/font][font='Times New Roman'][color=#333333]Rg1[/color][/font][font='Times New Roman'][color=#333333][font=宋体]和[/font][/color][/font][font='Times New Roman'][color=#333333]Re[font=宋体]的高效分离,三七皂苷[/font][font=Times New Roman]R1[/font][font=宋体]和人参皂苷[/font][font=Times New Roman]Rg1[/font][font=宋体]的高效分离。是我推荐分析人参、红参、西洋参和三七的最佳选择。[/font][/color][/font][font='Times New Roman'] [/font][font='Times New Roman'][color=#333333][font=宋体]公司名称:[/font][/color][/font][font='Times New Roman'][color=#333333][font=宋体]安徽益生源药业有限公司[/font][/color][/font][font='Times New Roman'][color=#333333][font=宋体]个人信息:胡[/font]××[/color][/font][font='Times New Roman'][color=#333333][font=宋体]老师[/font] [/color][/font][font='Times New Roman'][color=#333333][font=宋体]地址:安徽省亳州市经济开发区亳菊路附近[/font][/color][/font][font='Times New Roman'][color=#333333][font=宋体]色谱柱信息:[/font][/color][/font][font='Times New Roman'][color=#333333][font=宋体]纳谱分析[/font]ChromCore 300 C18 5μm, 4.6×250mm[font=宋体],序列号:[/font][font=Times New Roman]13538-001103[/font][/color][/font][font='Times New Roman'][color=#333333][font=宋体]纳谱分析[/font]ChromCore C18 5μm, 4.6×250mm[font=宋体],序列号:[/font][font=Times New Roman]21538-002485[/font][/color][/font]
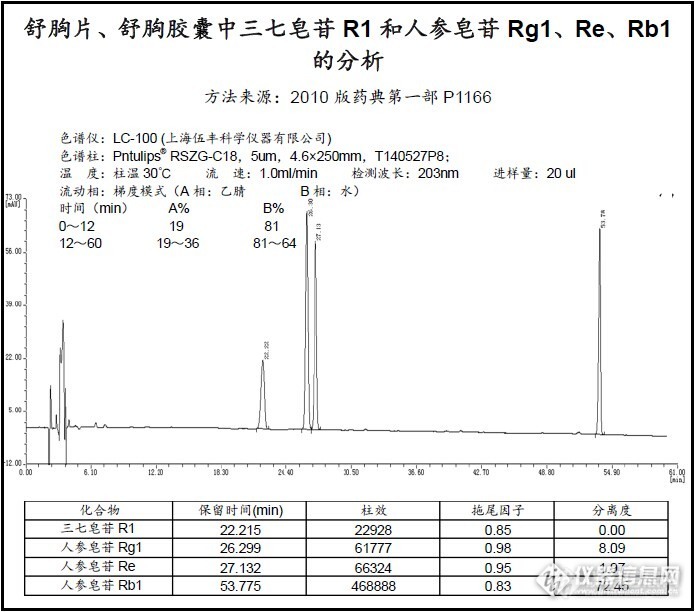
独圣活血片中三七皂苷R1和人参皂苷Rg1、Re的分析2010版药典解决方法独圣活血片中三七皂苷R1、人参皂苷Rg1、Re的分析本方法来源于2010版药典P940中“独圣活血片”的分析l 前言虽然药典中只要求分析三七皂苷R1和人参皂苷Rg1,但实际上是需要有效分离人参皂苷Rg1和人参皂苷Re的,因为作为独圣活血片原料的三七中或多或少总会含有Re,如果不将Rg1和Re分开,将会对Rg1的定量产生极大的干扰; l 样品分子结构中文名英文名结构式三七皂苷R1Notoginsenoside R1见附页人参皂苷Rg1Ginsenoside Rg1见附页人参皂苷ReGinsenoside Re见附页 l 样品来源记录
用Akasil-L C18色谱柱做的,效果不错![img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=47514]三七皂苷的分离图谱[/url]

作者:http://d.g.wanfangdata.com.cn/Images/head_pic.gif雷灼雨 http://d.g.wanfangdata.com.cn/Images/head_pic.gif邹丽 作者单位:重庆市药品检验所,重庆,401121 四川省食品药品检验所,四川成都,摘要:建立测定血塞通片中三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1含量的反相高效液相色谱(RP-HPLC)法.方法 色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5μm),柱温30℃,采用乙腈-水线性梯度洗脱,检测波长203 nm,流速1.0 mL/min....http://ng1.17img.cn/bbsfiles/images/2012/08/201208201721_384768_2379123_3.jpg
[color=#444444]HPLC测定人参皂苷Ra1对照品含量以色谱纯乙腈-水为流动相,为什么所得结果只有前五分钟的溶剂峰,却没有想要的保留时间为16分钟左右的峰呢?[/color]
各位老师、朋友 我使用waters的仪器检测三七,在换了新批号(110704-200324)的人参皂苷Rg1对照品之后,发现峰面积降了20~30%,进样量和柱子都没换,原来使用的对照品批号是(110704-200323),而检测其他物质都没有发现此种问题。是仪器的问题还是对照品的问题呢? 色谱条件:流动相是乙腈-0.05%磷酸(20:80),波长203nm。 请各位老师、朋友指教,不胜感谢!
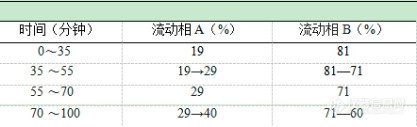
【含量测定】照高效液相色谱法(附录ⅥD)测定。色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B,按下表中的规定进行梯度洗脱;检测波长为203nm。理论板数按三七皂苷R1峰计算应不低于4000。时间(分钟) 流动相A(%) 流动相B(%)0~12 19 8112~60 19→36 81→64对照品溶液的制备 精密称取人参皂苷Rg1对照品、人参皂苷Rb1对照品和三七皂苷R1对照品适量,加甲醇制成每1m1含人参皂苷Rg10.4mg、人参皂苷Rb10.4mg、三七皂苷R10.1mg的混合溶液,即得。供试晶溶液的制备 取本品粉末(过四号筛)0.6g,精密称定,精密加入甲醇50ml,称定重量,放置过夜,置80℃水浴上保持微沸2小时,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。测定法 分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。本品按干燥品计算,含人参皂苷Rg1 (C42H72014)、人参皂苷Rb1 (C54H92023)和三七皂苷R1 (C47H80018)三者的总量不得少于5.0% 做出来的图飘的厉害,请问各位对色谱仪有什么具体的要求吗?单泵能做吗?请教具体的做法!
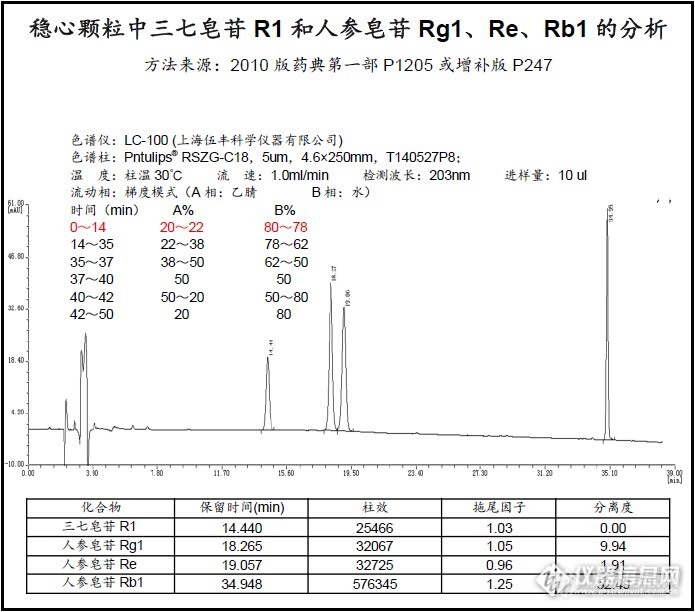
稳心颗粒中三七皂苷R1和人参皂苷Rg1、Re、Rb1的分析(液相)http://ng1.17img.cn/bbsfiles/images/2014/07/201407221419_507523_2568233_3.jpg
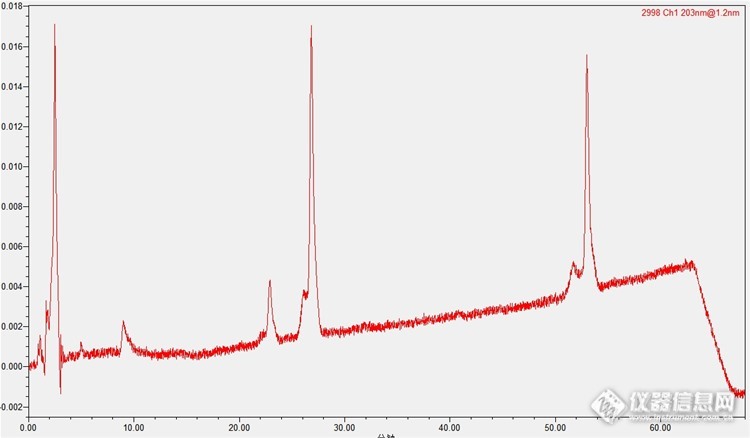
温度35℃.同样的机器,同样的条件,一个月之前是30℃,能做出来。http://ng1.17img.cn/bbsfiles/images/2014/05/201405091559_499065_2856959_3.jpg【含量测定】照高效液相色谱法(附录Ⅵ D)测定。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B,按下表中的规定进行梯度洗脱;检测波长为203nm。理论板数按三七皂苷R1峰计算应不低于4000。时间(分钟)流动相A(%)流动相B(%)1~12198112~6019→3681→64 加了十分钟回到初始流动相状态对照品溶液的制备精密称取人参皂苷Rg1对照品、人参皂苷Rb1,对照品及三七皂苷R1对照品适量,加甲醇制成每1ml含人参皂苷Rg10.4mg、人参皂苷Rb1 0.4mg、三七皂苷R1 0.1mg的混合溶液,即得。
方法:HPLC基质:药品应用编号:103736化合物:三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1固定相:Diamonsil C18(2)色谱柱/前处理小柱:Diamonsil 5μm C18(2), 250 x 4.6mm样品前处理:对照品溶液:精密称取人参皂苷Rg1对照品、人参皂苷Rb1对照品、三七皂苷R1对照品及人参皂苷Re对照品适量,加70%甲醇制成每1ml含人参皂苷Rg1及人参皂苷Rb1各0.2mg,三七皂苷R1及人参皂苷Re各0.05mg的混合溶液,即得。 供试品溶液:取本品10片,除去包衣,精密称定,研细,取约1g,精密称定,精密加入70%甲醇50ml,称定重量,超声处理(功率250W,频率33kHz)30分钟,放冷,再次称定重量,用70%甲醇补足减失的重量,摇匀,过滤,取续滤液,即得。色谱条件:色谱柱: Diamonsil C18(2) 250*4.6 mm,5 μm(Cat#:99603) 流动相:A:水 B:乙腈 流速:1.0 mL/min 柱温: 30 ℃ 检测器:203 nm 进样量:20.0 uL文章出处:天津应用实验室关键字:三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、复方丹参片、三七、Diamonsil C18(2)、HPLC摘要:Diamonsil C18(2)检测复方丹参片中三七谱图:http://www.dikma.com.cn/u/image/2016/01/18/1453101115105427.pnghttp://www.dikma.com.cn/u/image/2016/01/18/1453101118102428.pnghttp://www.dikma.com.cn/u/image/2016/01/18/1453101122610750.png
方法:HPLC基质:药品应用编号:103735化合物:三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1色谱柱/前处理小柱:Diamonsil Plus 5 μm C18, 250 x 4.6 mm样品前处理:对照品溶液:精密称取人参皂苷Rg1对照品、人参皂苷Rb1对照品、三七皂苷R1对照品及人参皂苷Re对照品适量,加70%甲醇制成每1ml含人参皂苷Rg1及人参皂苷Rb1各0.2mg,三七皂苷R1及人参皂苷Re各0.05mg的混合溶液,即得。供试品溶液:取本品10片,除去包衣,精密称定,研细,取约1g,精密称定,精密加入70%甲醇50ml,称定重量,超声处理(功率250W,频率33kHz)30分钟,放冷,再次称定重量,用70%甲醇补足减失的重量,摇匀,过滤,取续滤液,即得。色谱条件:色谱柱: Diamonsil PLUS C18 250*4.6 mm,5 μm (Cat#:99403) 流动相: A:水 B:乙腈 流速: 1.0 mL/min 柱温: 30 ℃ 检测器: 203 nm 进样量: 20.0 uL文章出处:天津应用实验室关键字:三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、复方丹参片、三七、Diamonsil PLUS C18、HPLC摘要:Diamonsil PLUS C18检测复方丹参片中三七。谱图:http://www.dikma.com.cn/u/image/2016/01/18/1453100166195192.pnghttp://www.dikma.com.cn/u/image/2016/01/18/1453100170120747.pnghttp://www.dikma.com.cn/u/image/2016/01/18/1453100173191577.png

全自动固相萃取-比色法测定保健食品中总皂苷 作者:赵晓冬http://ng1.17img.cn/bbsfiles/images/2015/11/201511261708_575182_2904170_3.jpg目的:建立保健食品中总皂苷的含量测定方法。方法:采用Sepline全自动固相萃取装置对保健食品中的总皂苷富集,通过70%乙醇回收,以香草醛-高氯酸为显色剂,采用比色法测定。结果:比色法测定的线性范围为0.038~0.268mg,相关系数 r=0.9997; 在不同保健食品中的平均加样回收率均在98.3%~102.4%,RSD〈2.2% (n=6)。结论:本法简便、准确、灵敏度高、重复性好,可用于不同类型保健食品中总皂苷的含量测定。 目前保健食品中的总皂甙测定方法尚无国家标准,大多都是按照《保健食品检验与评价技术规范 (2003年版) 》“保健食品中总皂甙的测定”方法检测,该方法采用人参皂苷 Re为对照,用香草醛比色法测定总皂苷。其显色体系为:香草醛-冰醋酸-高氯酸,但在实际操作中和据相关文献报道中,但采用该方法检测结果误差较大,尤其是不同实验室间测定结果差异更大,不利于产品的质量控制。有文献报道,卫生部食品卫生监督所2000年组织全国22个省、市、自治区省级疾病预防控制中心对这一方法进行比对试验,结果显示:离散度较大,有的浓度水平还出现离群值,各实验室间的RSD达80%,因此需要对测定方法加以改进。本文采用莱伯泰科公司Sepline全自动固相萃取提取装置 具有洗脱液流速恒定可控、大批量产品自动化处理,保证试验系统的密闭性等优点可保证结果的平行性和准确性。在对大孔树脂进行品牌筛选的基础上,定制统一规格固相萃取柱、对总皂苷测定前处理过程进行了优化,整套方法简单,数据结果离散性小,平行性得到提高。1材料与方法1.1 仪器 UV-2450 紫外可见分光光度计(日本,岛津公司),CP2250分析天平,AS10200ADT超声波清洗仪,TLL-DCⅡ型氮吹仪,Sepline全自动固相萃取系统(北京莱伯泰科有限公司),固相萃取柱(底层有砂芯隔板,内装XAD-2大孔树脂2.7g,Alumina-N中性氧化铝,6ml,北京莱伯泰科有限公司)。1.2 试药 人参皂苷Re对照品(中国食品药品检定研究院,含量92.7%),冰醋酸、香草醛、高氯酸、乙醇均为分析纯,水为纯化水。1.3 供试品 上普牌西洋参含片 (厦门上普药业有限公司,批号14040201);天信减肥茶( 福建安溪馨隆保健品有限公司,批号: 20140504 ) ;辅助降血脂片(哈尔滨久盛医药科技开发有限公司,批号:20140714)珍迪牌黄芪阿胶口服液(南昌健民营养补品厂,批号: 20130701)2方法与结果2.1 标准溶液制备精密称取20mg人参皂苷Re对照品置于100mL量瓶中,用甲醇溶解并稀释至刻度,摇匀。吸取10mL人参皂苷Re标准溶液(0.2mg/ml)放蒸发皿中,放在水浴挥干(低于60℃),准确加入10ml水溶解,作为标准溶液2.2 样品溶液制备 精密称取适量样品,置于50mL容量瓶中,加水适量溶解,超声30min,放置至室温,用水稀释至刻度,摇匀, 3000r·min-1离心5min,0.45um微孔滤膜过滤。若为非乙醇类液体试样,先经0.45um微孔滤膜过滤,取精密过滤后样品1mL (根据试样含总皂苷量定) 进行固相萃取。2.3 样品溶液吸附及洗脱 取样品溶液上清液置于收集管中(大于2ml), 放置于Sepline全自动固相萃取系统中,按以下步骤进行吸附及洗脱(详见图1)。2.3.1 活化:在固相萃取柱中,以2.5 ml·min-1 流速冲洗70%乙醇25ml、然后以2.5 ml·min-1 流速冲洗水25ml。2.3.2 上样:以1ml·min-1 流速加1ml样品溶液于固相萃取柱中。2.3.3 洗脱:以0.8ml·min-1 流速, 依次用25ml水,25ml70%乙醇进行洗脱,收集70%乙醇洗脱液,在收集结束时氮气吹扫管理残留洗脱液50s。2.3.4 挥干:将收集的洗脱液转入50ml的离心管中,在60℃下氮气吹干。https://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXHUdyj5UNWFsWqjnVFOfw77OyyjdE8AtsH0V1ibNylQgZibv2FialaXicibA/0?wx_fmt=jpeg2.4 显色与测定 在上述已挥干的洗脱液中准确加入0.2ml5%香草醛冰乙酸溶液,使残渣都溶解,再加0.8ml 高氯酸,混匀后60℃水浴上加热 10min,冰浴冷却后,准确加入冰乙酸 5.0ml,摇匀后,以 1cm 比色池于 560nm 波长处与标准管一起进行比色测定。2.5 线性关系考察 精密吸取“2.1”项标准溶液0、0.2、0.5、0.8、1.0、1.2、、1.4人参皂苷Re标准溶液(0.2mg/ml),按 “2. 3”“2.4”项下方法进行前处理并测定。以吸光度值为横坐标, 以人参皂苷Re含量 (mg) 为纵坐标进行回归计算,回归方程为y =0.3521x+0.0018,r=0.9997,结果表明,总皂苷( 以人参皂苷Re计) 在0.038~0.268mg 范围内线性关系良好。2.6 加样回收率试验 采用加样回收率法,精密称取4类保健品适量,分别按样品量的100%的比例各6份加入对照品 ,按“2.3”项下和“2.4”项下进行测定,并分别计算回收率(见表1-表5),结果各品种平均加样回收率均在98.3%~102. 4% ,RSD<2.2% ,并与传统方法(手填层析柱、人工进行柱洗脱)进行比较,表明该方法准确度良好,且离散度低于传统方法。https://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXpKdklF1UoeMzvU6eQJEseF6P0shyEyUViacyO2M0iaBmcQmLVtq4YUIQ/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXcxdobibU0cPzwap5qsdShaQtxlrmMbDxOG6AKyWSTxYHbwu085loQog/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXudGTrHbh0Eu8R6zY3PNo4iaHwJMh58wAxhK00QPk76bje6KXTQ6LWAA/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXO3ae9XyfEiaaUU6Qkibib1WgWDiaAVh9AQEFhV6tJ8oJxfsibuHW7tMWHUw/0?wx_fmt=jpeghttps://mmbiz.qlogo.cn/mmbiz/1M6WGftQWKcMCtAjjEeTO31icqxEfIgZXfVUKQfmpzF7ootVP2rp4VREoKIGLKDM54tMwEK2GyZ8DazgJL6tfug/0?wx_fmt=jpeg2.7 稳定性试验 将显色后样品分别放置 0、0.5、1、1.5、2、2.5、3h, 测定吸光值。结果表明该显色体系在1 h内吸光度基本不变,1h后吸光度有所降低,故在显色后1 h内测定。2.8 样品含量测定 取4类保健食品 ,按“2.3”项下和“2.4”项下进行测定,于 560nm 波长处测定吸光度值, 根据所得到的标准曲线计算样品中总皂苷的含量(见表6) 。[align
舒胸片、舒胸胶囊中三七皂苷R1和人参皂苷Rg1、Re、Rb1的分析(液相)http://ng1.17img.cn/bbsfiles/images/2014/07/201407151806_506759_2568233_3.jpg
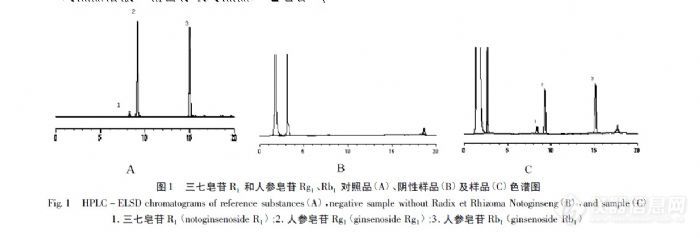
【作者】 满莹; 宋铁兵; 王玉华; 肖威; 【Author】 MAN Ying1,SONG Tie -bing2,WANG Yu -hua2,XIAO Wei2 (1. The Second Affiliated Hospital of Heilongjiang University of Chinese Medicine,Harbin 150001,China; 2. Daqing Oilfield General Hospital,Daqing 163001,China)【机构】 黑龙江中医药大学附属第二医院; 大庆油田总医院; 【摘要】 目的:采用HPLC-ELSD法测定通迪胶囊中三七皂苷R1和人参皂苷Rg1、Rb1的含量。方法:色谱柱DiamonsilC18(150mm×4.6mm,5μm),流动相:乙腈-水,梯度洗脱0~5min,乙腈20%~25%;5~20min,乙腈25%~45%;流速:1.0mL.min-1;柱温:25℃;漂移管温度:70℃;载气流速2.0L.min-1。结果:三七皂苷R1和人参皂苷Rg1、Rb1进样量分别在0.3~1.5μg(r=0.9997),1.5~7.5μg(r=0.9998)和1.5~7.5μg(r=0.9999)范围内呈良好的线性关系;平均回收率(n=6)分别为101.8%、102.1%、103.6%;RSD分别为1.6%、2.1%、1.8%。结论:HPLC-ELSO法结果准确,便于操作,可用于通迪胶囊的质量控制。 更多还原【Abstract】 Objective:To develop the quantitative method of notoginsenoside R1,ginsenoside Rg1,and Rb1 in Tongdi capsules by HPLC -ELSD. Methods:The column was packed with a DiamonsilC18(150mm × 4. 6mm,5μm) stationary phase. The mobile phase consisted of acetonitrile -water,eluted in gradient mode(0 ~ 5min,acetonitrile 20% ~ 25% ;5 ~ 20min,acetonitrile 25% ~ 45% ) with flow rate of 1. 0ml.min -1. Column tem-perature was set at 25℃. The temperature of driftube was 70℃. Results:The linear ranges of notoginsen... 更多还原【关键词】 HPLC-ELSD; 三七皂苷R1; 人参皂苷Rg1; 人参皂苷Rb1; 通迪胶囊; 【Key words】 HPLC -ELSD; notoginsenoside R1; ginsenoside Rg1; ginsenoside Rb1; Tongdi capsules;http://ng1.17img.cn/bbsfiles/images/2012/08/201208071023_382119_2352694_3.jpg
人参皂苷有好多种,如果用比色法测定总皂苷的话,是不是用任何一种人参皂苷都可以呀?有些文献中要求用Re,其他的可不可以呢?
[b][font=宋体]藤三七[/font][font=宋体]总[/font][font=宋体]多糖的制备、鉴别与纯度检查[/font][font=宋体]及提取[/font][font=宋体]条件优化[/font][/b][font=宋体]1.[/font][font=宋体]样品预处理[/font][font=宋体]干燥样品经粉碎机粉碎,过[/font]40[font=宋体]目筛,置密封袋中,干燥、避光条件下密封保存[/font][b][font=宋体]2.[/font][font=宋体]可见分光光度法测定条件[/font][/b][font=宋体]精密吸取葡萄糖对照品溶液和供试品溶液适量,置[/font][font=宋体]10 mL[/font][font=宋体]具塞磨口试管中,[/font][font=宋体]加入[/font]5[font=宋体] [/font]%[font=宋体]苯酚溶液[/font]1 mL[font=宋体],充分混匀后,加入浓硫酸[/font]6 mL[font=宋体],[/font]40[font=宋体] [/font][font=宋体]℃反应[/font]20 min[font=宋体],放置室温,在[/font]490 nm[font=宋体]处测得吸光度。[/font][b][font=宋体]藤三七[/font][font=宋体]总[/font][font=宋体]多糖的制备、鉴别与纯度检查[/font][font=宋体]与提取[/font][font=宋体]3.[/font][font=宋体]藤三七[/font][font=宋体]纯化[/font][font=宋体]多糖的制备[/font][/b][font=宋体]取藤三七药材干粉约[/font]10 g[font=宋体],精密称定,[/font][font=宋体]加入石油醚[/font](60[font=宋体]~[/font]90 [font=宋体]℃[/font])100 mL[font=宋体]回流提取两次,每次[/font]2 h[font=宋体],弃去[/font][font=宋体]提取液[/font][font=宋体]([/font][font=宋体]除去[/font][font=宋体]脂溶性成分[/font][font=宋体])[/font][font=宋体],药渣烘干,用[/font]80[font=宋体] [/font]%[font=宋体]乙醇[/font]100 mL[font=宋体]浸泡过夜,回流提取[/font]2[font=宋体]次,每次[/font]2 h[font=宋体]。弃去提取液[/font]([font=宋体]除去单糖、低聚糖[/font][font=宋体]和苷类等小分子物质[/font])[font=宋体],药渣烘干,[/font][font=宋体]加蒸馏水[/font]100 mL[font=宋体]回流,提取三次,每次[/font]2 h[font=宋体]。合并提取液,减压浓缩至[/font]40 mL[font=宋体],[/font][font=宋体]即得粗多糖的水溶液。[/font][font=宋体]在粗多糖水溶液中加入[/font]Sevage[font=宋体]试剂[/font][font=宋体]([/font][font=宋体]氯仿:正丁醇[/font][font=宋体]=[/font]4[font=宋体]:[/font]l[font=宋体])[/font]10 mL[font=宋体],剧烈震荡[/font]20 min[font=宋体],使其充分混合,在[/font]4000 rmin[sup] -1[/sup][font=宋体]转速下离心[/font]5 min[font=宋体],弃去中间变性蛋白层和下层有机层,水相继续重复上述操作[/font]8[font=宋体]次,直至水相与有机相中间无变性蛋白出现为止,[/font][font=宋体]即得脱蛋白多糖水溶液。[/font][font=宋体]向脱蛋白多糖水溶液中加入[/font][font=宋体]无水乙醇[/font]80 mL[font=宋体],使溶液含醇量达[/font]80[font=宋体] [/font]%[font=宋体]以上,充分[/font][font=宋体]搅拌,[/font][font=宋体]静置过夜。在[/font]4000 r min[sup] -1[/sup][font=宋体]转速下离心[/font]5 min[font=宋体],弃去上清液,所得沉淀依次用无水乙醇、丙酮、无水乙醚各洗涤[/font]3[font=宋体]次,弃去有机溶剂[/font][sup][2[/sup][sup][font=宋体]2[/font][/sup][sup]-2[/sup][sup][font=宋体]5[/font][/sup][sup]][/sup][font=宋体]后挥干沉淀,并用真空干燥机抽真空,[/font]60[font=宋体] [/font][font=宋体]℃干燥[/font]30 min[font=宋体],得到灰白色颗粒状多糖样品。[/font][b][font=宋体]4.[/font][font=宋体]藤三七[/font][font=宋体]总[/font][font=宋体]多糖的鉴别与纯度检查[/font][font=宋体]([/font]1[font=宋体])[/font]Molish[font=宋体]试验[/font][/b](1)[font=宋体]供试品溶液:取藤三七多糖[/font]10 mg[font=宋体],加[/font]10 mL[font=宋体]蒸馏水,加热溶解,[/font][font=宋体]量取[/font]1 mL[font=宋体]至试管中,[/font][font=宋体]再加入[/font]α-[font=宋体]萘酚[/font][font=宋体]乙醇溶液[/font][font=宋体];[/font](2)[font=宋体]阳性对照品溶液:取淀粉[/font]10 mg[font=宋体],加[/font]10 mL[font=宋体]蒸馏水,加热溶解,[/font][font=宋体]量取[/font]1 mL[font=宋体]至试管中,[/font][font=宋体]再加入[/font]α-[font=宋体]萘酚[/font][font=宋体]乙醇溶液[/font][font=宋体];[/font](3)[font=宋体]阴性对照品溶液:[/font][font=宋体]量取[/font]1 mL[font=宋体]蒸馏水于试管中[/font][font=宋体],加入[/font]α-[font=宋体]萘酚[/font][font=宋体]乙醇溶液[/font][font=宋体]。[/font][font=宋体]分别摇匀上述溶液,将试管倾斜,沿试管壁慢慢加入浓硫酸,竖直试管观察。结果,供试品溶液与阳性对照品溶液试管中界面呈[/font][font=宋体]紫堇[/font][font=宋体]色环,阴性对照品溶液试管界面无变化,表明供试品为糖类。[/font][b][font=宋体]([/font]2[font=宋体])[/font]Feling[font=宋体]试验[/font][/b]Feling[font=宋体]试剂的配[/font][font=宋体]制[/font][font=宋体]:[/font][font=宋体]甲液[/font][font=宋体]:[/font][font=宋体]取[/font]34.6 g[font=宋体]酒石酸钾钠[/font]KNaC[sub]4[/sub]H[sub]4[/sub]O[sub]6[/sub]4H[sub]2[/sub]O[font=宋体],[/font]14.2 g NaOH[font=宋体]固体溶于[/font]80 mL[font=宋体]水中,加水稀释到[/font]100[font=宋体] [/font]mL[font=宋体];[/font][font=宋体]乙液[/font][font=宋体]:称取[/font]7.28 g CuSO[sub]4[/sub]5H[sub]2[/sub]O[font=宋体]溶于[/font]40 mL[font=宋体]水中,加水稀释到[/font]100 mL[font=宋体]待用。使用时取等体积两溶液混合即可。[/font](1)[font=宋体]供试品溶液:[/font] [font=宋体]取上述[/font][font=宋体]多糖溶液[/font]1 mL[font=宋体]于试管中;[/font](2)[font=宋体]阳性对照品溶液:取葡萄糖[/font]10 mg[font=宋体],加[/font]10 mL[font=宋体]蒸馏水,溶解,摇匀,[/font][font=宋体]量取[/font]1 mL[font=宋体]于试管中;[/font](3)[font=宋体]阴性对照品溶液:[/font] [font=宋体]量取蒸馏水[/font]1 mL[font=宋体]于试管中。[/font][font=宋体]分别加入[/font]Feling[font=宋体]试剂[/font]2 mL[font=宋体],在沸水中加热[/font]10 min[font=宋体]。结果,供试品溶液与阴性对照品溶液为蓝色,阳性对照品溶液变为砖红色。单糖多为还原性糖,可与[/font]Feling [font=宋体]试剂反应产生砖红色,而多糖为非还原性糖,不与[/font]Feling[font=宋体]试剂反应,结果表明供试品中不含有单糖。[/font][b][font=宋体]([/font]3[font=宋体])[/font][font=宋体]紫外可见光谱分析[/font] [/b][font=宋体]将上述供试品溶液在[/font]190 ~ 500 nm[font=宋体]区间进行光谱扫描,结果在[/font]260 ~ 280 nm[font=宋体]处无明显吸收峰,而未经脱蛋白处理的藤三七粗多糖水溶液,在[/font]260 ~ 280 nm[font=宋体]处有明显吸收峰,表明多糖样品中不含有蛋白质、多肽和核酸类物质。[/font][font=宋体]通过以上三种试验证明所制藤三七多糖为不含单糖、蛋白质、多[/font][font=宋体]肽[/font][font=宋体]、核酸等物质的纯化多糖。[/font][b][font=宋体]5.[/font] [font=宋体]苯酚[/font][font=宋体]-[/font][font=宋体]硫酸法测定总[/font][font=宋体]多[/font][font=宋体]糖含量的条件优化[/font][font=宋体]检测波长的选择[/font][/b][font=宋体]吸取一定浓度的葡萄糖对照品溶液[/font] 0. 2 mL[font=宋体],用蒸馏水补充至[/font]1 mL[font=宋体],加入[/font]5[font=宋体] [/font]%[font=宋体]苯酚溶液[/font]1 mL[font=宋体],充分混匀后,加入浓硫酸[/font]6 mL[font=宋体],振摇[/font]5 min[font=宋体],至[/font]40[font=宋体] [/font][font=宋体]℃水中反应[/font] 20 min[font=宋体],放置室温,同法制得空白溶液,紫外可见分光光度计在[/font]200~800 nm[font=宋体]范围内扫描,结果表明最大吸收波长为[/font]490 nm[font=宋体]。[/font][b][font=宋体]提取方法的优化[/font][/b][font=宋体]采用正交设计,选用提取溶剂用量[/font](A)[font=宋体]、提取时间[/font](B)[font=宋体]及提取温度[/font](C)3[font=宋体]个因素,每个因素选[/font]3[font=宋体]个水平,用[/font]L[sub]9[/sub](3[sup]4[/sup])[font=宋体]正交表进行实验设计的优选,见表[/font]1[font=宋体]。[/font][font=宋体]以藤三七总多糖的含量为检测指标,[/font] [font=宋体]处理组合见表[/font]2[font=宋体] ~[/font]3[font=宋体]。[/font][align=center][font=宋体]表[/font].1 The factor-level table[/align][table][tr][td]levels[/td][td][align=center]A[/align][align=center]Quant. of solvent [/align][align=center](mL)[/align][/td][td][align=center]B[/align][align=center]Time[/align][align=center](h)[/align][/td][td][align=center]C[/align][align=center]Temp[/align][align=center]([font=宋体]℃[/font])[/align][/td][/tr][tr][td]1[/td][td][align=center]10[/align][/td][td]2[/td][td]70[/td][/tr][tr][td]2[/td][td][align=center]20[/align][/td][td]3[/td][td]80[/td][/tr][tr][td]3[/td][td][align=center]30[/align][/td][td]4[/td][td]90[/td][/tr][/table][font=宋体] [/font][font=宋体]取烘干并粉碎的藤三七药材[/font]9[font=宋体]份,每份[/font]1 g[font=宋体],精密称定,用[/font]80[font=宋体] [/font]%[font=宋体]乙醇浸泡过夜,再用[/font]80[font=宋体] [/font]%[font=宋体]乙醇回流[/font]2 h[font=宋体],残渣挥去溶剂,根据正交实验设计,分别加入不同体积水、按不同提取时间、不同提取温度提取。提取液过滤,待冷却后转移于[/font]250 m[font=宋体]L[/font][font=宋体]容量瓶,用蒸馏水稀释至刻度。精密吸取[/font]l mL[font=宋体]于试管中,再分别加入[/font]5[font=宋体] [/font]%[font=宋体]苯酚溶液[/font]1 mL[font=宋体],充分混匀后,加入浓硫酸[/font] 6 mL[font=宋体],[/font]40[font=宋体] [/font][font=宋体]℃[/font][font=宋体]反应[/font]20 min[font=宋体],放至室温,[/font]490 nm[font=宋体]处测得吸光度。[/font][align=center][font=宋体]表[/font]2 Results of L[sub]9[/sub](3[sup]4[/sup]) orthogonal design[/align][table][tr][td][align=center] [/align][align=center]Test NO.[/align][/td][td][align=center]A[/align][align=center]Volume[/align][/td][td][align=center]B[/align][align=center]Time[/align][/td][td][align=center]C[/align][align=center]Temp[/align][/td][td][align=center] [/align][align=center]Content (%)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td]10[/td][td][align=center]2[/align][/td][td][align=center]70[/align][/td][td][align=center]1.66[font=宋体]2[/font][/align][/td][/tr][tr][td]2[/td][td][align=center]10[/align][/td][td][align=center]3[/align][/td][td][align=center]80[/align][/td][td][align=center]2.53[font=宋体]1[/font][/align][/td][/tr][tr][td]3[/td][td][align=center]10[/align][/td][td][align=center]4[/align][/td][td][align=center]90[/align][/td][td][align=center]3.4[font=宋体]18[/font][/align][/td][/tr][tr][td]4[/td][td][align=center]20[/align][/td][td][align=center]2[/align][/td][td][align=center][font=宋体]8[/font]0[/align][/td][td][align=center]2.31[font=宋体]4[/font][/align][/td][/tr][tr][td]5[/td][td][align=center]20[/align][/td][td][align=center]3[/align][/td][td][align=center][font=宋体]9[/font]0[/align][/td][td][align=center]3.19[font=宋体]4[/font][/align][/td][/tr][tr][td]6[/td][td][align=center]20[/align][/td][td][align=center]4[/align][/td][td][align=center][font=宋体]7[/font]0[/align][/td][td][align=center]1.80[font=宋体]3[/font][/align][/td][/tr][tr][td]7[/td][td][align=center]30[/align][/td][td][align=center]2[/align][/td][td][align=center][font=宋体]9[/font]0[/align][/td][td][align=center]4.02[font=宋体]2[/font][/align][/td][/tr][tr][td]8[/td][td][align=center]30[/align][/td][td][align=center]3[/align][/td][td][align=center][font=宋体]7[/font]0[/align][/td][td][align=center]1.90[font=宋体]4[/font][/align][/td][/tr][tr][td]9[/td][td][align=center]30[/align][/td][td][align=center]4[/align][/td][td][align=center][font=宋体]8[/font]0[/align][/td][td][align=center]2.76[font=宋体]0[/font][/align][/td][/tr][tr][td]K[sub]1[/sub][/td][td][align=center]2.537[/align][/td][td][align=center]2.663[/align][/td][td][align=center]1.787[/align][/td][td][/td][/tr][tr][td]K[sub]2[/sub][/td][td][align=center]2.433[/align][/td][td][align=center]2.54[/align][/td][td][align=center]2.533[/align][/td][td][/td][/tr][tr][td]K[sub]3[/sub][/td][td][align=center]2.893[/align][/td][td][align=center]2.66[/align][/td][td][align=center]3.543[/align][/td][td][/td][/tr][tr][td][align=center] R[/align][/td][td][align=center]0.64[/align][/td][td][align=center]0.123[/align][/td][td][align=center]1.756[/align][/td][td][/td][/tr][/table][font=宋体]表[/font]3 Results of analysis of varianee[table][tr][td][align=center]Source of[/align][align=center]variation[/align][/td][td][align=center]Sum of[/align][align=center]squares[/align][/td][td]Degrees of freedom[/td][td][align=center]F[/align][/td][td][align=center]P[/align][/td][/tr][tr][td][align=center]A[/align][/td][td][align=center]0.379[/align][/td][td][align=center]2[/align][/td][td][align=center]2.958[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]B[/align][/td][td][align=center]0.03[/align][/td][td][align=center]2[/align][/td][td][align=center]0.254[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]C[/align][/td][td][align=center]4.663[/align][/td][td][align=center]2[/align][/td][td][align=center]39.517[/align][/td][td][align=center]AB[font=宋体],最佳水平组合为[/font]A[sub]3[/sub]B[sub]1[/sub] C[sub]3[/sub][font=宋体],即加入[/font]30[font=宋体]倍体积水于[/font]90[font=宋体] [/font][font=宋体]℃水浴中提取[/font]2 h[font=宋体]。[/font][font=宋体]方差分析[/font] [font=宋体]由表[/font]2-3[font=宋体]方差分析结果可见:水浴温度对测定结果有显著性影响。[/font][font=宋体]综合分析[/font] [font=宋体]综合考虑各因素对[/font]3[font=宋体]个考察指标的影响,确定藤三七总多糖的最佳提取工艺条件为[/font]A[sub]3[/sub]B[sub]1[/sub]C[sub]3[/sub][font=宋体],即加入[/font]30[font=宋体]倍量体积水于[/font]90[font=宋体] [/font][font=宋体]℃水浴中提取[/font]2 h[font=宋体]。[/font][font=宋体]多糖提取次数的考察[/font] [font=宋体]称取藤三七药材粉末约[/font]1 g[font=宋体],精密称定,按正交试验优选的最佳工艺条件分别提取[/font]3[font=宋体]次,实验结果见表[/font]4[font=宋体]。[/font][align=center][font=宋体]表[/font]-4 Results with the different times[/align][table][tr][td][align=center]time[/align][/td][td][align=center][font=宋体]extraction rate [/font](%)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center][font=宋体]77.63[/font][/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center][font=宋体]22.37[/font][/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center][font=宋体]1.225[/font][/align][/td][/tr][/table][font=宋体]由表可以看出,第[/font]1[font=宋体]次和第[/font]2[font=宋体]次[/font][font=宋体]的[/font][font=宋体]多糖[/font][font=宋体]提取[/font][font=宋体]率较多,而第[/font]3[font=宋体]次多糖[/font][font=宋体]的提取[/font][font=宋体]率较少,多糖[/font][font=宋体]提取率[/font][font=宋体]不足[/font][font=宋体]1.3 [/font]%[font=宋体],所以提取次数可选为[/font]2[font=宋体]次。[/font][font=宋体]综上所述,本实验得到藤三七多糖最佳提取工艺条件为[/font]30[font=宋体]倍量体积的水,于[/font]90[font=宋体] [/font][font=宋体]℃水浴中提取[/font]2[font=宋体]次,每次[/font]2 h[font=宋体]。[/font]
最近遇到一个头痛的问题,中药复方里面三萜酸、三七总皂苷在200~220nm有吸收,分别采用同种显色方法(根据规定用香草醛-冰醋酸-高氯酸显色法),两者都于540~550nm附近有吸收,我想分开测复方中这两个成分,已经尝试双波长法,但是两者吸收波长非常接近,也不想摸索两者的预分离,有没有同行做过不同的显色方法?或是添加其他试剂?各位有何良策?谢谢!!
请问一下各位:车前醚苷对照品哪里有卖呢?
理化分析法是借助现代仪器设备,如薄层色谱仪、高效液相色谱仪等,对三七中主要化学成分进行鉴别、含量测定或有毒有害物质的测定。特别对于含三七的中成药,如复方丹参片、血塞通滴丸、注射用血塞通、血栓通注射液等,理化分析更为重要。 皂苷类化合物是三七的主要有效化学成分之一,其总含量的高低是衡量三七内在质量优劣的重要标准,三七中皂苷类成分的苷元化学结构绝大多数属于达玛烷型四环三萜皂。根据其结构可分为两个基本类型,即20(S)-原人参 二醇型和20(S)-原人参三醇型。该类结构规律性强,主要区别在于R1、R2、R3的种类不同,如含氧糖基的数量、种类等。含氧糖基主要包括α-L-鼠李吡喃糖基(rha)、α-L-阿拉伯吡喃糖基ara(pyr)]、β-D-葡萄吡喃糖基(glc)、α-D-葡萄吡喃糖基(glc*),β-D-木吡喃糖基(xyl)、α-L-阿拉伯呋喃糖基[ara(fur)]等。迄今为止,从三七的根、根茎、侧根、茎叶、花芽、种子和果梗中分离得到的皂苷类成分达130余种。其中,三七药材中所含化学成分从皂苷角度分类,大致可分为人参皂苷、三七皂苷、绞股蓝皂苷和七叶胆皂苷等。 三七与同属的人参、西洋参在化学成分上既有相似性,又有差异性,三七特有的成分为三七皂苷R1,其他含量较高的成分主要为人参皂苷Rg1、Re、Rb1、Rd等,三七茎叶中人参皂苷Rb3的含量较高,而三七根和根茎中基本不含此成分。
前面发了很多关于2010版方法分析三七、人参、红参、西洋参制剂的谱图,为方便大家查看和对照现已整理成谱图集,这是第一次出现专门针对人参皂苷分析的谱图集,希望对大家有用,请大家在附件中下载。
测人参、红参、西洋参中人参皂苷的含量、三七中人参皂苷、三七皂苷的含量大家公司一般用哪个品牌的高效液相来测呢?检测效果怎么样?

高效液相色谱法对土三七的质量研究 土三七别名见肿消、乳香草、奶草、泽兰、叶下红、散血草、和血丹、天青地红、破血丹、血牡丹、三七草、九头狮子草、白田七草、血当归、红背三七、散血丹、血三七、菊叶三七、水三七、紫背三七、狗头三七。 药材基源:为菊科植物菊叶三七的根或全草。 【性味】味甘;微苦;性温 【功能主治】止血;散瘀;消肿止痛;清热解毒。主吐血;衄血;咯血;便血;崩漏;外伤出血;痛经;产后瘀滞腹痛;跌打损伤;风湿痛;疮痈疽疔;虫蛇咬伤对于土三七的文晓报道较少,本试验旨在建立土三七的质量分析方法,为土三七的进一步药学研究建立可控性指标。 材料及方法 仪器:安捷伦1200高效液相色谱仪,diamonsil色谱柱5um,150×4.6(mm);十万分之一分析天平(梅特勒托利多);电热恒温干燥箱(上海)。材料:土三七购自于药店。经去离子水漂洗去浮尘与污物,于干燥箱中65℃干燥,粉碎机粉碎,置干燥器中备用。试剂:山奈酚对照品(中国药品生物制品检定所)。冰醋酸、乙腈(色谱纯)。试验方法色谱条件:色谱柱:diamonsil色谱柱5um,150×4.6(mm),流动相:乙腈-水-冰醋酸提速洗脱;柱温37℃,检测波长360nm,流速1.0mL·min-1,进样量20μL。梯度洗脱条件: 时间(min)溶剂(%)A(乙腈)B(1%醋酸水)03070104060156040204060对照品溶液的制备:精密称取一定量的山奈酚对照品,用甲醇溶解制成标准储备液,山奈酚对照品溶液浓度分别为1.50mg·mL-1。供试品溶液的制备:取药材粉末,用分析天平准确称取[/siz
http://ng1.17img.cn/bbsfiles/images/2012/09/201209272130_393425_2255248_3.gifHPLC测定木犀草苷对照品为什么峰前面有个小峰????