样品为复方维生素,其中一项是核黄素磷酸钠,没找到核黄素磷酸钠的对照品,故用的核黄素对照品样品制备:先用水溶,然后用流动相稀释,流动相弱酸性做出的结果比标示量低了很多啊用核黄素对照品代替核黄素磷酸钠对照品,请问结果可信吗?
食品安全国家标准 食品添加剂 姜黄素
急用!一直没找到,实验室又没有大黄素的标准品。请问谁有大黄素的标准光谱图,给我发一张吧!我的邮箱:HCM2100amy@hsbiotech.com谢谢了![em0808]
GB 26405-2011 食品安全国家标准 食品添加剂 叶黄素
《土壤分析技术规范》第二版中18.2有效硼姜黄素比色法。我们实验室扩项中有该项目,是该做方法验证还是方法确认?是不是方法确认挺复杂,要参考27417?
最近,要开展食品中叶黄素的检测,存在叶黄素的标准品很贵,也很难购买在这里,也很想请高人们指点一下,检测过程中应注意哪些注意事项?
各位大叔大婶,谁有茶黄素的标准曲线图,万分火级!感谢!!
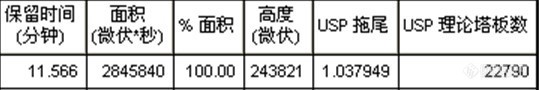
大黄素是从大黄的干燥根及根茎提取而得,味苦,具有泻热通肠,凉血解毒,逐瘀通经等功效。2010年药典中大黄中的大黄素就是用HPLC法检测,而大黄素在减肥、降脂、排毒、抗衰老等方面有很大的作用,保健食品也开始加入大黄素,下面我就简单说说说。1 仪器与试剂仪器:Waters2695型高效液相色谱仪,配2996型二极管检测器,,大黄素对照品(由中国药品生物制品检定所提供),乙腈(色谱纯),乙醚、甲醇、磷酸、硫酸、无水硫酸钠均为分析纯,二次蒸馏水。2 色谱条件 色谱柱:Topsil C18柱; 流动相:A泵乙腈,B泵0.1%磷酸水溶液(A:B=60:40); 流速:1.0mL/min; 柱温:室温; 检测波长:288nm; 进样量:20μL。3 标准 称取10mg对照品于50mL容量瓶中,用甲醇稀释溶解定容,再分取一定体积于50mL容量瓶中,用甲醇稀释溶解定容,分别配制成含大黄素4、20、40、80、100μg/mL的标准使用液,上机测定。4 样品预处理4.1 液体样品 量取一定体积样品,加入2.5mol·L-1硫酸20mL,置沸水浴上加热回流30分钟,放冷,用乙醚提取5次,每次5mL,合并乙醚液,用水洗至中性,过无水硫酸钠后旋转蒸发挥至近干,再用氮气吹干,残渣加甲醇适量溶解,移至50mL容量瓶中,加甲醇稀释于刻度。经0.45μm滤膜过滤,作为上机待测液。4.2 固体样品称取1g置索氏提取器中,加甲醇50mL,置于80℃水浴上加热回流至无色,提取液置水浴上蒸干,蒸干的残渣用2.5mol·L-1硫酸20ml溶解,按2.4.1处理。测试结果见下图,为了方便大家看拖尾因子和理论塔板数,特意把数字放大,供参考:图1 标准色谱图http://ng1.17img.cn/bbsfiles/images/2011/05/201105171335_294598_1608710_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/05/201105171335_294599_1608710_3.jpg图2 样品色谱图http://ng1.17img.cn/bbsfiles/images/2011/05/201105171336_294600_1608710_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/05/201105171336_294601_1608710_3.jpg
1实验部分1.1仪器与试剂Acctuity超高效液相色谱仪,配二极管阵列检测器(PDA,美国Waters公司);Acquity超高效液相色谱一Quattro Premier串联四极杆质谱联用仪,配电喷雾离子源(美国Waters公司)。角黄素标准品:纯度95.8%(德国Dr.Ehren—stoffer公司);标准储备溶液(1.0 mg/mL):称取标准品0.100 g,用乙腈溶解定容于100mL容量瓶,-18℃冷冻保存,保质期30天;乙腈,正己烷,色谱纯;甲酸,优级纯;无水硫酸钠,焦性没食子酸为分析纯,水为超纯水;
紫外分光光度法测定盐酸麻黄素注射液含量关键词: 麻黄素;可见和紫外分光光度法[摘要] 目的:探讨盐酸麻黄素注射液含量测定的新方法,以求更快速、准确地适应临床用药需要。方法:用不同厂家不同批号的盐酸麻黄素注射液做供试品,用标准麻黄素做对照品,用紫外分光光度计测出标准品的最大吸收度,求出浓度与吸收度关系,得其回归方程,测其回收率。求出含量与药典法进行比较。结果:在256±1 nm处有最大吸收,以256 nm为测定波长,盐酸麻黄素浓度与吸收度呈标准曲线线性范围0.2~1.2 mg/ml(r=0.999 9),平均回收率为(100.31±1.02)%,两种方法测定结果差异无显著性(P>0.05)。结论:紫外分光光度法,可以做为盐酸麻黄素注射液含量测定的新方法。[中国图书资料分类法分类号] R 974.3;O 657.32 [文献标识码] A[文章编号] 1000-2200(2000)05-0380-02 盐酸麻黄素是拟肾上腺素药,目前对该病及其制剂的含量测定方法有非水滴定法[1]、银量法[1]及中和法[2]。本文采用紫外分光光度法[1],测定盐酸麻黄素注射液的含量[3],并与1995年版药典的非水滴定法进行比较,兹作报道。1 材料与方法1.1 仪器 Du-640型紫外分光光度计(美国贝克曼公司)。1.2 试药 盐酸麻黄素对照品,盐酸麻黄素注射液(上海信谊制药厂,批号951201-1,951201-2;无锡市第七制药厂,批号960117-1,960117-2,960610;规格均为1 ml∶50 mg)。1.3 测定方法 (1)盐酸麻黄素紫外吸收光谱:取盐酸麻黄素对照品适量,用蒸馏水溶解并配制成0.6 mg/ml的溶液,以蒸馏水为空白,在230~300 nm波长之间扫描,在256±1 nm波长处有最大吸收,故采用256 nm为测定波长。(2)标准曲线的绘制:精密称取经105℃干燥至恒重的盐酸麻黄素对照品50 mg,置25 ml量瓶中,加水溶解并稀释至刻度,摇匀。精密量取该药液1.0、2.0、3.0、4.0、5.0、6.0 ml分别置10 ml量瓶中,加水稀释至刻度,摇匀,以水为空白,在256 nm处分别测定吸收度。结果表明,在0.2~1.2 mg/ml浓度范围内,浓度与吸收度呈良好的线性关系。得其回归方程为:A=0.8256 C+0.012 0(r=0.999 9,n=6)。(3)稳定性实验:取(2)项下的各溶液于配制后0、1、2、3、4、8、16、24 h分别测吸收度,结果几无变化。(4)回收率试验:精密称取经105℃干燥至恒重的盐酸麻黄素对照品约25 mg,置50 ml量瓶中,加水溶解并稀释至刻度,以水为空白,在256 nm波长处依法测定吸收度,求出回收率。(5)样品测定:取不同批号的盐酸麻黄素注射液,精密量取1 ml,分别置于100 ml量瓶中,加水稀释至刻度,摇匀,以水为空白,在256 nm处测吸收度,计算其含量,并将本法测定的结果与中国药典1995年版收载的非水滴定法测定的结果进行比较。1.4 统计学方法 采用配对t检验。2 结果 紫外分光光度法回收率试验结果见表1;与药典法测定样品中盐酸麻黄素注射液的含量结果比较见表2。表1 回收率试验结果(n=5) 编号 加入量(mg) 测得量(mg) 回收率(%) ±s(%) 1 26.40 26.42 100.08 2 24.80 25.20 101.61 3 25.20 25.08 99.52 100.31±1.02 4 24.30 24.57 101.11 5 25.00 24.81 99.24 表2 两种方法测定结果比较(ni=15;±s) 测定方法 标示量(%) ±sd td P 紫外分光光度法药典法 100.17±1.07100.18±0.48 0.01±0.80 0.02 >0.05 3 讨论 盐酸麻黄素注射液是卫生部规定的控制药品。为保证患者用药的准确有效,防止在生产这类药品过程中盐酸麻黄素原料的流失,对其含有盐酸麻黄素的药品进行快速、简便、准确的含量测定显得尤为重要。传统的本品测定方法,不但操作过程繁琐,消耗试药量大,且非水滴定法中的醋酸汞试剂对人体有害,污染环境。 麻黄素属β肾上腺素受体激动剂,可直接或间接激动肾上腺素受体。对心血管系统、支气管平滑肌、中枢神经系统都有较强的作用。在临床上应用较为广泛且剂量要求十分准确,所以对其含量的准确、快速测定更为重要。特别是临床上经常使用“盐酸麻黄素滴鼻剂”是医院自配药品,效期短,配制频繁,在其准确的基础上,快速测定及时保证药品的临床供应,并指导临床用药有一定的意义。 两种方法测定结果差异无显著性(P>0.05),表明紫外分光光度法可以做为盐酸麻黄素注射液的含量测定新方法。且本法操作简便、快速、准确,重复性好。作者简介:郗 颖(1967-),女,安徽灵璧县人,药剂师.[参考文献][1]中华人民共和国卫生部药典委员会.中国药典二部[M].广州:广东科学技术出版社,1995.18,693~694.[2]中华人民共和国卫生部药政局.中国医药制剂规范*西药制剂[M].北京:中国医药科学技术出版社,1996.166~167.[3]熊凤英,简 洁,周淑群.紫外分光光度法测定米非司酮血药浓度[J].中国医院药学杂志,1998,18(6)∶262.
众位亲,求助一篇文献,叶黄素Lutein,FCC10中的质量标准。谢谢

叶黄素是人类日常食用生果及蔬菜时可吸收到的营养素,但吸收利用率一般较低。如果缺乏叶黄素,可服用补充剂。如果是消化系统较差的老年人,可以使用舌下的喷剂来补充叶黄素。早在 1996 年叶黄素已被加入到膳食补充剂。另外,过量吸取叶黄素会对肝脏造成多余的负担,建议用量每日大约为 12 毫克。一般在绿叶的蔬菜中可以找得到。叶黄素本身是一种抗氧化物,并可以吸收蓝光等有害光线。[align=center][img=,324,276]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101153518939_6860_932_3.jpg!w324x276.jpg[/img][/align][color=#646464]本实验主要针对果汁中叶黄素的测定[/color][align=center][color=#646464][img=,600,405]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101153577234_9508_932_3.jpg!w640x433.jpg[/img][/color][/align][color=#646464][color=#646464]参考标准:《GB 5009.248-2016食品安全国家标准 果汁中叶黄素的测定》[/color][/color][b][color=#646464] [/color]萃取溶剂称取 1g BHT(二丁基羟基甲苯),以 200mL 环己烷溶解,加入 400mL 乙醚和 400mL 正己烷,混匀。1、样品提取称取 10g 果汁试样于 50mL 离心管中,加入 10mL 萃取剂,避光旋涡震荡提取 3min,4000r/min 离心 3min,重复提取两次,合并三次萃取液,室温减压浓缩至近干,用 3mL 萃取溶剂溶解待净化。2、样品净化Welchrom Alumina-N, 500mg/3mL活化: 5mL 萃取溶剂淋洗,保持柱体湿润,弃去。上样:将上述萃取液,以 1滴/s 的速度通过Welchrom Alumina-N 柱至鸡心瓶中。洗脱:用 3mL 萃取液洗脱至鸡心瓶中,室温减压浓缩近干,用甲醇定容至 10mL,过 0.45μm 滤膜待 HPLC 分析。3、仪器条件HPLC条件色谱柱:Ultimate AQ-C18 4.6×150mm,5μm仪器型号:Waters2695+PDA2996流动相:甲醇-乙腈=20:80柱温:35℃流速:1.0mL/min检测波长:445nm进样体积:10μL4、实验图谱及结果[/b][align=center][img=,600,488]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101326381133_6340_932_3.jpg!w640x521.jpg[/img][/align][align=center]图1 叶黄素样品加标 5mg/kg 液相色谱图[/align]由图1可看出经 Alumina-N 柱净化,采用月旭 Ultimate C18 色谱柱检测峰形良好,保留时间稳定。[color=#646464][/color][align=center][color=#646464][img=,600,486]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101154109028_1819_932_3.png!w640x519.jpg[/img][/color][/align]图2 叶黄素样品加标 10mg/kg 液相色谱色谱图[align=center][b][img=,600,111]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101154198884_9526_932_3.jpg!w640x119.jpg[/img][/b][/align][align=center]表1 叶黄素加标回收实验结果(n=10)[/align][b]由表1可知,采用月旭 Welchrom Alumina-N 小柱结合液相色谱法检测叶黄素,加标量为 5mg/kg 和 10mg/kg 的样品进行了检测,回收率在86.29%~97.27%,能够满足检测要求。5、实际样品检测为了保证果汁样品的代表性,从多家超市以及菜场选择具有代表性的 10 个果汁样品进行检测,结果均为未检出。6、结论本实验建立了叶黄素检测的 HPLC 检测方法,对于加标量为 5 和 10mg/kg 的样品进行了检测,回收率在 86.29%~97.27%,固相萃取柱方法稳定并且色谱柱重现性良好,说明本方法能够用于检测食品中的叶黄素的含量。7、订购指南[/b][align=center][img=,600,524]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101154281505_9762_932_3.jpg!w581x508.jpg[/img][/align]
姜黄素是从姜科、天南星科中的一些植物的根茎中提取的一种化学成分,其中,姜黄约含3%~6%,是植物界很稀少的具有二酮的色素,为二酮类化合物。姜黄素为橙黄色结晶粉末,味稍苦。不溶于水。在食品生产中主要用于肠类制品、罐头、酱卤制品等产品的着色。医学研究表明,姜黄素具有降血脂、抗肿瘤、抗炎、利胆、抗氧化等作用。 姜黄素 Curcumin Turmeric yellow, Diferuloylmethane 1,6-Heptadiene-3,5-dione,1,7-bis(4-hydroxy-3-methoxyphenyl)- C21H20O6; 368.37 橙黄色结晶性粉末, 熔点183°。不溶于水及乙醚, 溶于乙醇及冰醋酸。 有机酸及酚类。
《SN/T 3866-2014 出口保健食品中酚酞和大黄素的测定 液相色谱-质谱/质谱法》这个标准中要求过0.22微米孔径的有机相滤膜,可是过完滤膜后损失很大,换成0.45微米滤膜后还是损失很大,100ppb的标准溶液过完滤膜后就剩4ppb了。这个问题要怎么解决?
求助芦荟大黄素的药典标准,请各位老师帮帮忙!
因为刚接触药品检验,在做核黄素磷酸钠的游离磷酸的测定的时候,做了几次都不合格。 按照标准要求进行对照及样品配制,对照品为蓝色的澄清液体,但是样品很浑浊,土黄色。在730nm处进行测定,结果不符合规定。 因为样品很浑浊,所以吸收值很大(2.0),大过了对照品; 我们把样品用0.45的滤膜过滤,吸收值(0.35)低于对照,但是我们怀疑过滤的影响太大,我们就再次过滤样品,吸收值又降低了一半(0.13). 请各位大侠帮帮忙啊!!!

实验目的(实验背景及目的):国家标准GB2760-2011版GB2760-2014《食品安全国家标准 食品添加剂使用标准》中规定姜黄(INS100ii,turmeric)和姜黄素(INS100i,curcumin)可作为食用色素在人造黄油、碳酸饮料、胶基糖果、巧克力制品、冷冻饮品等食品中使用,分别规定了使用量。国内目前尚未制定食品中姜黄素的HPLC和LCMSMS检测方法标准,因此建立一种快速、简便、可供确认用的检测方法十分必要。实验方法: 固相萃取柱的选择是关系到固相萃取净化步骤回收率的重要因素,它直接决定着分析组分能否定量地吸附、保留在固相萃取柱上和被一定量的洗脱溶剂洗脱。固定相的选择主要依据目标化合物的性质和样品基体(即样品的溶剂)性质。本实验对比了WatersSep-Pak C18、Agilent-ODS-C18和Anpelclean PA 聚酰胺小柱对姜黄素的净化效果,最终选择国产AnpelcleanPA 聚酰胺固相萃取柱小柱(60 mg,3 mL)。聚酰胺固定相广泛适用于各类含色素样品的净化。利用新的聚酰胺化学技术,制成与水和大多数有机溶剂,及pH0-pH14的酸性和碱性溶剂都兼容的小柱。由于聚酰胺既有亲水性又有亲脂性,对极性和非极性化合物都可以保留。与硅胶类填料不同的是,聚酰胺小柱如果在处理时不慎干涸,也能得到同样的结果。SPE小柱信息1: 货号SBAA- 1400603描述Anpelclean PA 规格60mg, 3ml聚酰胺固相萃取柱使用前,依次用3 mL 甲醇、3 mL 水活化。将上清提取液2.5 mL全部过柱,过滤速度不宜过快。上样完毕后,以2 mL 5 %甲醇水(5.9)淋洗固相萃取柱,淋洗后抽干固相萃取柱。用1.0 mL的 2 %氨化甲醇(5.5)洗脱并收集,洗脱液需尽快转移到氮吹仪,在40℃用氮气吹干后,用1.00 mL甲醇(5.1)溶解定容,过0.45 mm亲水聚四氟乙烯(PTFE)针式滤膜,供仪器测定。本标准HPLC法流动相体系采用“0.1%甲酸水-0.1%甲酸乙腈”体系,等度洗脱。姜黄素用甲醇配制成混合标准储备溶液,校正后母液浓度大致为200μg/mL,在室温或低温避光条件下,有效期至少可达6个月。以420 nm作为UV-vis或DAD检测器的检测波长;采用常规C18柱(250×4.6mm,5μm);流速:1.00 mL/min;进样量:15μL;柱温:25℃。 http://ng1.17img.cn/bbsfiles/images/2015/08/201508041901_559116_1608728_3.png 1.果冻定量限添加10 mg/kg的HPLC色谱图
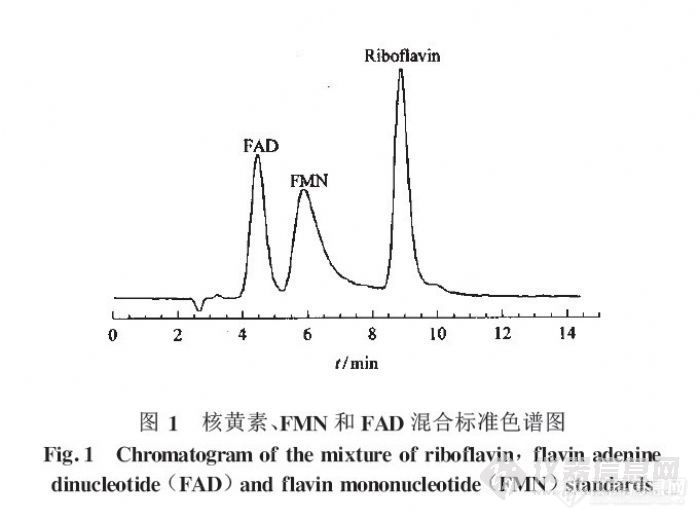
高效液相色谱法测定大鼠血浆和全血中核黄素的含量韦京豫, 郭长江, 杨继军, 蒋与刚, 李云峰, 徐琪寿(军事医学科学院卫生学环境医学研究所,天津)摘要:为了直接反映核黄素营养状况对血中核黄素水平的影响,建立了高效液相色谱测定大鼠血浆及全血中核黄素含量的方法。采用Diamonsil C18色谱柱250mmx4.6mm i.d.5um)分离,以甲醇5mol/l乙酸铵(体积比为1.2ml/min)为流动相,流速1.2ml/min,荧光检测器检测(激发波长450nm,发射波长:520nm)。样品经乙腈、三氯甲烷处理后进样分析。核黄素测定的线性范围5-200nmol/l,最低检测限为2.5nmol/l(s/n=2),日内测定的峰面积的相对标准偏差(RSD)为1.2%,日间测定的RSD=4.3%。核黄素在血浆样品中的加标回收率为97.0%-104%,在全血样品中的加标回收率为97.4%-104.4%.关键词:高效液相色谱法;核黄素;血浆;全血;大鼠http://ng1.17img.cn/bbsfiles/images/2012/07/201207241234_379356_2355529_3.jpg
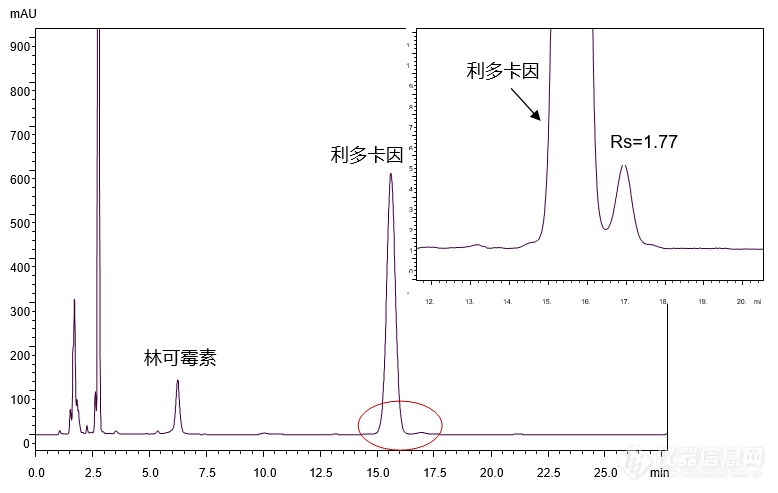
[align=center][b]【国家药品标准】林可霉素利多卡因凝胶的分析[/b][/align][align=center][b][/b][/align][align=right][b]——依据国家药品标准WS-10001-(HD-0140)-2002方法[/b][/align][b]林可霉素利多卡因凝胶[/b]为复方制剂,每克含林可霉素5毫克,利多卡因4毫克。适应症为用于轻度烧伤、创伤及蚊虫叮咬引起的各种皮肤感染。 [img=,193,127]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260834522166_2994_2222981_3.gif!w193x127.jpg[/img] [img=,140,64]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260834520028_3541_2222981_3.gif!w140x64.jpg[/img] 林可霉素 利多卡因 Lincomycin Lidocaine M.W.: 406.54 M.W.: 234.34客户提供林可霉素利多卡因凝胶样品,希望本实验室帮忙通过筛选色谱柱及调节分析条件,依据[color=#ff0000][b]国家药品标准WS-10001-(HD-0140)-2002[/b][/color]方法,实现林可霉素利多卡因凝胶样品的良好分析。首先,使用能在纯水条件下稳定使用的高极性色谱柱[color=#ff0000][b]CAPCELL PAK C[sub]18[/sub] AQ S5 4.6 mm i.d. × 150 mm[/b][/color],对林可霉素利多卡因凝胶样品进行分析,结果如图1所示,[color=#330099]利多卡因与其峰后杂质之间分离度为1.77[/color]。[align=center][img=,690,437]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260858200006_8607_2222981_3.png!w690x437.jpg[/img][/align][align=center]图1 CAPCELL PAK C[sub]18 [/sub]AQ分析所得色谱图[/align]注:峰上标数字为分离度。[img=,528,205]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260858202566_2695_2222981_3.png!w528x205.jpg[/img]为进一步提高利多卡因与其峰后杂质之间的分离度,在原条件基础上将柱温由30℃降低至25℃,并分别使用 CAPCELL PAK C[sub]18[/sub] AQ、CAPCELL PAK C[sub]18[/sub] MG及高含碳量ODS色谱柱SUPERIOREX ODS进行分析,结果如图2所示。[align=center][img=,690,490]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260859201516_7229_2222981_3.png!w690x490.jpg[/img][/align][align=center]图2 25℃条件下不同色谱柱分析结果对比[/align]注:峰上标数字为分离度。[img=,637,223]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260859204236_7198_2222981_3.png!w637x223.jpg[/img]如图2所示,在柱温25℃条件下使用三款色谱柱进行分析,其中,[color=#ff0000][b]CAPCELL PAK C[sub]18[/sub] AQ色谱柱分析结果最好,利多卡因与其峰后杂质分离得到最佳分离,分离度为4.23[/b][/color];[color=#330099][b]使用CAPCELL PAK C[sub]18[/sub] MG色谱柱进行分析时,利多卡因与其峰后杂质分离度为3.27[/b][/color];而使用SUPERIOREX ODS色谱柱分析时,利多卡因与其峰后杂质未得到有效分离。综上,在国家药品标准WS-10001-(HD-0140)-2002方法基础上,将色谱柱柱温由30℃降低至25℃,使用高极性色谱柱CAPCELL PAK C[sub]18[/sub] AQ及中等极性色谱柱CAPCELL PAK C[sub]18[/sub] MG进行分析,均可在25 min内完成林可霉素利多卡因凝胶样品的分析,并得到利多卡因与其峰后杂质之间的良好分离结果。[align=right][/align][align=right][/align][align=right] [/align][align=right]三耀精细化工品销售(中国)有限公司[/align][align=right]技术开发部[/align][align=right]地址:北京经济技术开发区宏达南路5号[/align][align=right]宏达利德工业园1栋418室[/align][align=right]邮编:100176[/align]
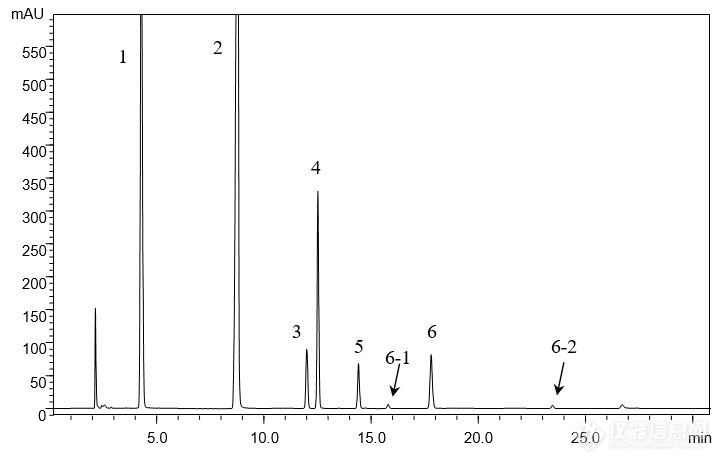
[align=center][b]注射用水溶性维生素的分析(1)[/b][/align][align=center][b]——维生素C钠、烟酰胺、泛酸钠、盐酸吡哆辛、硝酸硫胺、核黄素磷酸钠[/b][/align][align=center][b][/b][/align][align=left]客户提供了注射用水溶性维生素粉针剂及对照品(维生素C钠、烟酰胺、泛酸钠、盐酸吡哆辛、硝酸硫胺、核黄素磷酸钠),要求本实验室依据客户所提供方法筛选合适色谱柱,实现粉针剂中各组分物质的良好分离,同时满足方法中对分离度及理论塔板数的要求。[/align][align=left][/align][align=left]首先,依据客户提供的色谱条件,对对照品溶液进行分析。尝试使用不同填料类型的色谱柱,包括CAPCELL PAK C[sub]18[/sub] MGII,AQ S5,AQ S3,SUPERIOREX ODS,CAPCELL PAK ADME及PFP色谱柱。[/align][align=left][/align][align=left]由于不同色谱柱的分离选择性不同,最终发现CAPCELL PAK C[sub]18 [/sub]MGII色谱柱在完全按照客户提供方法的前提下能够得到最佳分离结果,对照品溶液中各组分均能够得到良好分离(如图1),分离度均在3.0以上,满足客户1.5要求;理论塔板数按核黄素计为103983,满足客户大于15000的要求(见表1)。[/align][align=left][/align][align=center][img=,690,443]http://ng1.17img.cn/bbsfiles/images/2018/01/201801041022_5661_2222981_3.jpg!w690x443.jpg[/img][/align][align=center]图1 CAPCELL PAK C[sub]18[/sub] MGII分析对照品溶液结果[/align][align=center] 1. 维生素C钠 2. 烟酰胺 3. 泛酸钠 4. 盐酸吡哆辛 5. 硝酸硫胺 6, 6-1, 6-2 核黄素磷酸钠[/align][align=left][img=,690,270]http://ng1.17img.cn/bbsfiles/images/2018/01/201801041022_1444_2222981_3.jpg!w690x270.jpg[/img][/align][align=left][/align][align=left][/align][align=center]表1 CAPCELL PAK C[sub]18 [/sub]MGII分析对照品溶液结果详表[/align][align=center][img=,458,316]http://ng1.17img.cn/bbsfiles/images/2018/01/201801041022_2894_2222981_3.jpg!w458x316.jpg[/img][/align][align=center][/align][align=center]在上述色谱条件下,继续使用CAPCELL PAK C[sub]18[/sub] MGII色谱柱对粉针剂供试品溶液进行分析,各待测组分及相邻杂质均能够得到良好分离,结果见图2、图3及表2。[/align][align=center][/align][align=center][img=,682,427]http://ng1.17img.cn/bbsfiles/images/2018/01/201801041023_7282_2222981_3.jpg!w682x427.jpg[/img][/align][align=center]图2 CAPCELL PAK C[sub]18[/sub] MGII分析供试品及空白溶液结果[/align][align=center]1. 维生素C钠 2. 烟酰胺 3. 泛酸钠 4. 盐酸吡哆辛 5. 硝酸硫胺 6, 6-1, 6-2 核黄素磷酸钠[/align][align=center][/align][align=left][img=,690,200]http://ng1.17img.cn/bbsfiles/images/2018/01/201801041023_5300_2222981_3.jpg!w690x200.jpg[/img][/align][align=left][/align][align=center][img=,690,455]http://ng1.17img.cn/bbsfiles/images/2018/01/201801041024_9636_2222981_3.jpg!w690x455.jpg[/img][/align][align=center]图3 CAPCELL PAK C[sub]18[/sub] MGII分析供试品溶液结果放大图[/align][align=center] [/align][align=center]表2 MGII分析供试品溶液结果详表[/align][align=center][img=,487,538]http://ng1.17img.cn/bbsfiles/images/2018/01/201801041024_7687_2222981_3.jpg!w487x538.jpg[/img][/align][align=center][/align]
水质 硼的测定 姜黄素的方法中曲线绘制好像没有空白,但是标准里面有空白试验的方法,那做曲线和样品的时候要做空白吗
参照标准 水质 硼的测定 姜黄素分光光光度法(HJ/T 49-1999)有用过这个标准的老师吗?在做硼的时候,水浴不显色。试剂都是按照标准上面配的,姜黄素溶解不完全,过滤了用。
我查过所有的食品分析用基体标准物质(国家标物中心)里面都没有元素锡,但现在又要做这个元素,应该怎么办才好。
姜黄素分光光度法测硼酸,用的是RO水。按标准做标准曲线,蒸干后呈棕黄色,其A均为0.000附近,请问:什么原因?
精密称取姜黄素样品约0.0015 g置50 ml容量瓶中,加流动相超声溶解,冷却至室温,用流动相稀释至刻度,摇匀,精密移取1 ml置50 ml容量瓶中。加流动相稀释至刻度,摇匀,滤过,作为供试品溶液。流动相:乙腈:5%冰醋酸=45:55流速:0.9 mL/min柱温:40 ℃检测器:UV 340 nm进样量:20 μLSpursil C18,250×4.6 mm,5 μm http://dikma.com.cn/Public/Uploads/images/898(9).JPGDiamonsil C18,250×4.6 mm,5 μmhttp://dikma.com.cn/Public/Uploads/images/898(8).JPGDiamonsil C18(2),250×4.6 mm,5 μmhttp://dikma.com.cn/Public/Uploads/images/898(10).JPG图例:1,2-杂质3-姜黄素
[font=宋体][size=17px][color=rgba(0, 0, 0, 0.901961)]姜黄素为姜黄中的有效成分,具有抗炎[/color][/size][/font][font=宋体][size=17px][color=rgba(0, 0, 0, 0.901961)]、抗氧化[/color][/size][/font][font=宋体][size=17px][color=rgba(0, 0, 0, 0.901961)]、调节脂质代谢[/color][/size][/font][font=宋体][size=17px][color=rgba(0, 0, 0, 0.901961)]、抗肿瘤[/color][/size][/font][font=宋体][size=17px][color=rgba(0, 0, 0, 0.901961)]、抗纤维化[/color][/size][/font][sup][color=black]][/color][/sup][font=宋体][size=17px][color=rgba(0, 0, 0, 0.901961)]、器官保护[/color][/size][/font][font=宋体][size=17px][color=rgba(0, 0, 0, 0.901961)]等功效。虽然姜黄素的药效得到了国内外的普遍认可,但是其溶解性低、稳定性低和生物利用率低等缺点,限制了姜黄素的临床应用。[/color][/size][/font] [font=宋体]一般而言,姜黄素类化合物是姜黄素、[color=var(--weui-LINK)]去甲氧基姜黄素[i][/i][/color]和双去甲氧基姜黄素的混合物,这些物质具有相同的庚烷长链和双苯环结构,区别在于苯环上的甲氧基[/font][b][color=#ffffff][back=#7b0c00][/back][/color][/b][font=宋体]数目不同。在姜黄提取物中,姜黄素占[/font]61.69%[font=宋体],去甲氧基姜黄素占[/font]16.06%[font=宋体],双去甲氧基姜黄素占[/font]12.32%[font=宋体]。姜黄素分子中含有[/font]α,β-[font=宋体]不饱和二酮基,且在[/font]2[font=宋体]个苯环上分别含有酚羟基和甲氧基[/font][font=宋体],酮[/font]-[font=宋体]烯醇部分可与金属螯合,能够清除由金属离子产生的活性自由基,使姜黄素可以成为氢离子的供体或受体,这是姜黄素抗氧化、抗炎症、抗凋亡能力的来源[/font][font=宋体]。[/font] [font=宋体]姜黄素在水中的溶解度小于[/font]50 μmol/L[font=宋体],但极易溶于有机溶剂[/font][font=宋体],其溶解度和稳定性与溶剂的种类和[/font]pH[font=宋体]值相关。在高相对[color=var(--weui-LINK)]介电常数[i][/i][/color]或极性的溶液中以[/font]β-[font=宋体]二羰基形式存在,在低相对介电常数的溶液如环己烷和四氯化碳中以烯醇形式存在。在姜黄素的[/font]β-[font=宋体]二酮链上存在分子内氢原子转移,导致其在溶剂中存在酮和烯醇互变异构的构象:在酸性和中性溶液中稳定存在,呈亮黄色;而在碱性条件下姜黄素无法保持稳定,分解反应的产物中四氢二阿魏酰甲烷会迅速形成缩合产物,呈现棕红色或棕褐色[/font][font=宋体]。姜黄素还是一种光敏性物质,将姜黄素溶于乙醇,在[/font]24 h[font=宋体]强光照射后会被完全降解,溶液由黄色转变为无色[/font][font=宋体]。[/font] [font=黑体][/font][font=宋体]生物制药分类系统按照水溶性和肠道渗透性将药品归为[/font]4[font=宋体]类,而姜黄素因其水溶性差、通过胃肠上皮的渗透性可忽略不计的特点被归于第[/font]4[font=宋体]类药物。虽然各种动物模型和临床试验都证实了姜黄素的安全性[/font][font=宋体],但过去[/font]30[font=宋体]年来,与姜黄素吸收、分布、代谢和排泄相关的研究表明,血药浓度低、组织分布局限、转化速度快和代谢周期短等因素限制了其应用[/font][font=宋体]。姜黄素的最高口服耐受剂量可达[/font]12 g/d[font=宋体],有报道指出,即使摄入姜黄素[/font]10[font=宋体][color=black]~[/color][/font]12 g[font=宋体],人体内姜黄素最高血浆浓度仍然低于[/font]160 nmol/L[font=宋体]。[/font][font=宋体]目前临床姜黄素剂型主要为注射液及原料药,给药途径主要为[/font][i]po[/i][font=宋体]、[/font]iv[font=宋体]及[/font]ip[font=宋体]。姜黄素在体内的吸收代谢及分布情况一直以来被广泛研究,研究对象包括小鼠、大鼠及人体[/font][font=宋体]。绝大部分姜黄素未经小肠消化直接进入结肠部位,只有少量姜黄素可以被上皮细胞吸收,并在肝脏和血浆中分布。汪小珍[/font][font=宋体]对比了姜黄素不同给药方式在大鼠体内生物利用度的变化,结果显示[/font]ip[font=宋体]姜黄素的生物利用度([/font]35.07%[font=宋体])比[/font]ig[font=宋体]([/font]4.13%[font=宋体])更高,表明姜黄素在肠道内的吸收效率较低。[/font] [font=宋体] [/font]
GB 26405-2011 食品添加剂 叶黄素
[align=center][b]GB 22255-2014 食品安全国家标准 食品中三氯蔗糖(蔗糖素)的测定——三氯蔗糖标准品分析-NQAD检测器[/b][/align]三氯蔗糖(TGS),是唯一以蔗糖为原料的功能性甜味剂,甜度可达蔗糖600倍。这种甜味剂具有无能量,甜度高,甜味纯正,高度安全等特点,是最优秀的功能性甜味剂之一。[align=center][img=,170,99]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011004470313_2453_2222981_3.png!w170x99.jpg[/img][/align][align=center]三氯蔗糖结构式[/align]本实验按照[b]《GB 22255-2014 食品安全国家标准 食品中三氯蔗糖(蔗糖素)的测定》[/b]方法,使用[b][color=#ff0000]高灵敏度气溶胶型检测器——纳克级水凝粒子计数检测器(NQAD)[/color][/b]对三氯蔗糖标准品进行了分析。色谱柱选择中等极性普适型[color=#3333ff][b]CAPCELL PAK C18 MGII S5 4.6 mm i.d. × 150 mm[/b][/color],得到结果如图1所示。三氯蔗糖保留时间为12.709min,[b]与标准谱图保留时间基本一致,理论塔板数为9992,不对称因子为1.06,峰形良好。[/b][align=center][b][img=,690,497]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011006155125_1559_2222981_3.png!w690x497.jpg[/img][/b][/align][align=center]图1 三氯蔗糖标准品分析色谱图[/align]*注:峰上标数字由下至上依次为保留时间、理论塔板数及不对称因子。[b][img=,633,176]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011006367633_3986_2222981_3.png!w633x176.jpg[/img]附图:GB方法中标准色谱图[/b][align=center][b][img=,690,448]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011007162573_9264_2222981_3.png!w690x448.jpg[/img][/b][/align][b][/b]接下来,按照国标要求配制三氯蔗糖工作液,浓度分别为0.02 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.4 mg/mL,进行线性考察实验。[b][color=#3333ff]由于NQAD检测器原理与常规蒸发光散射检测器ELSD不同,能够直接得到线性回归结果,不需要做对数方程,更加简单快捷。[/color][/b]线性结果如图2所示,R[sup]2[/sup]=0.996,得到良好线性结果。同时,我们根据标准曲线最低浓度的信噪比计算出定量限(以S/N=10计)约为3 μg/mL,[b][color=#ff0000]能够实现三氯蔗糖的高灵敏度检出[/color][/b]。[align=center][img=,658,399]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011008425185_5014_2222981_3.png!w658x399.jpg[/img][/align][align=center]图2 三氯蔗糖标准曲线图[/align]
般而言,人们都希望饮料澄清透明。比如茶,清亮的总比浑浊的更有吸引力一些。所以,人们发现有的红茶茶汤在放凉之后出现浅褐色或橙色乳状的浑浊之后,在相当长的时间里并不待见它。直到后来有农艺师指出这其实是优质红茶的标志,这种被称为“冷后浑”的现象才受到人们的欢迎。冷后浑是如何产生的?为什么它又被认为是好茶的标志呢?茶叶中有许多种成分,其中有一类在化学结构上有共同之处,统称为茶多酚,现在已经识别出了有几十种。在未经加工的茶叶中,茶多酚大多数以儿茶素的形态存在。红茶制作中要进行充分的氧化,许多儿茶素会转化成茶黄素,还有的会进一步转化成茶红素。茶黄素和茶红素,就是为红茶带来红亮颜色的功臣。茶黄素的溶解度受温度影响比较大。在高温下,它还能好好地呆在茶汤中。当温度降低,它们就开始扎堆。温度越低,扎的堆就越大。大到一定程度——大致相当于牛奶中的乳滴大小,看起来就是茶汤变浑浊了。再进一步扎堆,就会形成乳酪那样的东西,与茶汤分层。茶中还有一种成分是咖啡因。其实它跟茶黄素一样,随着温度的降低也会喜欢扎堆,溶解度也会降低。不过在茶汤中的咖啡因含量低于它的溶解度,所以它们自己并不足以导致茶汤浑浊。但咖啡因非常喜欢茶黄素——相对于自己扎堆,它们更喜欢跟茶黄素混在一起。一个茶黄素分子上有两个位置能够结合咖啡因,当第一个咖啡因分子傍上茶黄素之后,就会使茶黄素露出第二个结合位点,再容纳另一个咖啡因分子。咖啡因到了人的嘴里,会与舌头上的苦味受体结合,让我们尝到苦味。而多酚类物质到了嘴里,则可能与舌头上的蛋白质结合,生成不溶于唾液的沉淀物,然后我们就感觉到了涩。相对来说,绿茶中的儿茶素和咖啡因比较多,所以绿茶比较容易出现苦涩。在红茶里,儿茶素经过氧化和聚合变成茶黄素,能与蛋白质结合的位点变少了,涩味也就降低了。茶黄素与咖啡因的结合在茶黄素自己扎堆之前就会进行。这种结合不仅进一步消耗了茶黄素的结合位点,同时也限制了咖啡因与舌头上苦味受体的结合。于是,与同样固体含量的绿茶茶汤相比,红茶茶汤的苦涩味就往往要低。茶黄素与咖啡因的络合产物溶解度更低,更容易扎堆变大,从而导致冷后浑的出现。因此,许多人认为冷后浑是茶黄素和咖啡因发生反应的结果。在实际的红茶中,咖啡因和茶黄素都存在,所以这样的解释也说得过去。“无事生非”的科学家,会把红茶中的咖啡因去掉,非要看看茶黄素自己能否出现冷后浑——结果是能,只是需要的茶黄素浓度会高一些。冷后浑还有一个名字叫做“茶乳酪”。跟牛奶形成奶酪一样,茶中的茶黄素等成分含量越高,就越容易出现冷后浑。茶黄素是红茶最关键的标志成分——冷后浑意味着它的含量高,“冷后浑是好茶的标志”之说,也就主要是这个原因。在红茶饮料生产中,冷后浑的出现导致产品不均一、外观不合格,风味口感也受到影响。在生产过程中,有一些阶段是以红茶提取物浓缩液的状态存在。因为固体含量高,“茶乳酪”就更容易出现——这会导致有效成分的损失,也为下一步的生产流程带来困难。因此,这个产业需要避免冷后浑的出现——这种需要,也就导致了许多关于冷后浑的研究。科学家们发现,除了咖啡因,茶汤中的钙离子对冷后浑的出现也有显著的作用。他们把茶乳酪拿去分析,发现其中的钙占固体总量的比例,大大高于茶汤中的钙占其固体含量的比例。这是因为,茶汤中的茶黄素带着负电,而钙离子带着正电——类似于卤水点豆腐,钙离子会把本来不想扎堆的茶黄素们拉到一起,让它们沉淀析出。茶中本来就具有不少钙,要避免它导致冷后浑,就需要压制住它的活动。在食品饮料工业中,这可以通过加入“螯合剂”来实现——螯合剂是一些结构特殊的分子,对于钙离子有超级强大的吸引力。只要螯合剂一出现,钙离子们就纷纷投奔而去,茶黄素也就“无钙问津”,不会被它们拉到一起扎堆了。科学家们还发现,如果把糖分子通过“糖苷化”加到茶黄素上,可以增加茶黄素的溶解度、避免冷后浑的出现。红茶制作中的氧化那一步加入一些糖,它们就会在后续的加工过程中结合到茶黄素上去。最后得到的红茶,就不容易出现冷后浑。“冷后浑是优质红茶的标志”是对的,但只是针对正常的红茶。当科学研究让我们对冷后浑有了更深入的认识,就会发现:如果我们不喜欢它,可以通过技术手段避免它的出现;如果我们喜欢它,也可以“捣鬼”促使它的出现。转自:科学松鼠会
叶黄素属于类胡萝卜素的一种,是视网膜黄斑的主要色素,但叶黄素在人体内不能自行合成,主要是通过进食蔬菜或水果维持体内叶黄素的需求,叶黄素含量较高的食物主要有菠菜、西兰花、芥菜、芹菜叶、胡萝卜、香菜、西红柿等蔬菜,以及柑桔、猕猴桃、鲜枣、芒果等水果。含叶黄素高的食物:1、蔬菜类。蔬菜类中含有叶黄素的食物较多,如南瓜、胡萝卜、西红柿、菠菜、甘蓝菜、绿花椰菜、韭菜、小白菜、芹菜叶、香菜等,这些绿叶蔬菜及黄橙色蔬菜中都含有较多的叶黄素,通常是人们补充叶黄素的重要蔬菜来源。2、水果类。水果类含有叶黄素较多的食物,有芒果、猕猴桃、葡萄、黄桃、橙子、橘子等。3、谷物类。谷物类中含叶黄素多的食物有玉米、小米等,同样这些谷物制品中也含有叶黄素,如玉米面、小米糕等。4、其他食物。除了上述这些食物之外,还有鸡蛋的蛋黄、红薯等中也含有大量的叶黄素,同时一些花卉中也含有较多叶黄素,如万寿菊、金盏花,这些花卉本身不可以食用,但可作为提取叶黄素的原材料,将提取的叶黄素应用到乳制品、脂肪制品、糖果、烘烤类食品等的制作中。叶黄素的作用:1、保护视力。太阳光中含有强烈的紫外线和蓝光,可以伤害视网膜和黄斑,其中蓝光对人眼的伤害甚至比紫外线还大,叶黄素能够吸收蓝光和紫外线,并协助黄斑过滤蓝光,协助视网膜抵挡紫外线,从而避免蓝光和紫外线损害视力,此外太阳光具有强氧化性,很容易损伤黄斑,眼睛若长期受到强光直射会生成大量的氧自由基,使黄斑区和视网膜退化,视力严重减退,甚至失明,叶黄素是还原剂,有强抗氧化的作用,可以抑制氧自由基生成,所以补充叶黄素,有助于保护眼睛,尤其是保护视网膜和黄斑。可以保护视力,延缓视力进展,减少视力损害。2、抗氧化作用。氧自由基可加速人体各种器官的老化,对眼睛和皮肤损害尤其严重,再加上太阳光中紫外线的照射,更会加速皮肤的老化,叶黄素具强抗氧化能力,能够抑制氧自由基生成,不仅能保护眼睛,还能保护皮肤,在一定程度上能够延缓皮肤的老化。3、其他。叶黄素对于减缓早期动脉硬化的发展也有一定作用,还可以辅助加强胰岛素降血糖的功能,减少患糖尿病的风险。