自制杂质对照品,新药申报时杂质含量方面需要做哪些工作?按照CTD格式要求,对于自制对照品应该“简述含量和纯度标定的方法及结果”,具体做应该怎么做?请各位专家指导,谢谢!
相关物质检测的时候通常会用到杂质对照品,关于这个杂质对照品你是如何管理的?对它的含量与纯度有木有做过分析检测?有效期是怎么规定的?
如题,请知道的朋友告诉我,先谢谢了! 我即将参与做的一个3.1类新药项目,其杂质定量研究正需要考虑这个响应因子的问题,以前做的都是补充申请,还没有考虑响应因子不一致的情况,现在考虑了一个方案,那就是液相色谱检测,液相色谱和紫外同步进行,如果我们这个新药项目杂质可得,并且有对照品,那么就可以绘制杂质和对照品的标准曲线,杂质标准曲线的斜率除以对照品标准曲线的斜率的比值就是响应因子吧?我想参照指导原则确定到底什么范围时可以用主成分的自身对照法计算含量,什么范围时,宜用杂质对照品法计算含量,也可用加校正因子的主成分自身对照法?您有好的建议吗?期待您的帮助。
一直很纠结,杂质对照品的稳定性需要做吗?我曾请教过别人说是不用作,可是如果不做,当作为对照品时,无论结构还是浓度一旦发生变化,岂不是杂质的检测就受影响吗?
液相分析时,对照浓度一般是多少,根据什么来定?杂质对照呢?
丙谷二肽杂质对照品名称 环-(L-丙氨酰-L-谷氨酰胺) 规格:0.25gL-焦谷氨酰-L-丙氨酸 规格1g"N-(2)-D-丙氨酰-L-谷氨酰胺" 规格:0.25gL-丙氨酰-L-谷氨酸 规格:1gL-焦谷氨酸 规格:125mg
[font=宋体]1.用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]做对照品的分子量的确认(scan模式),[/font][font='Times New Roman',serif] [img=,159,138]file:///C:/Users/ADMINI~1/AppData/Local/Temp/msohtmlclip1/01/clip_image002.png[/img][/font][font=宋体]杂质[/font][font='Times New Roman',serif]-B [/font][font=宋体]测得[/font][font='Times New Roman',serif]m/z[/font][font=宋体]是[/font][font='Times New Roman',serif]314.0[/font][font=宋体](最高响应峰)[/font][font=宋体],与实际相差[/font]17[font=宋体],而本该有的[/font][font='Times New Roman',serif]m/z331[/font][font=宋体]的峰很小[/font]2.[font=宋体]用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]做对照品的分子量的确认(scan模式),[/font][font='Times New Roman',serif][img=,136,110]file:///C:/Users/ADMINI~1/AppData/Local/Temp/msohtmlclip1/01/clip_image002.png[/img][/font][font=宋体]杂质[/font][font='Times New Roman',serif]-L [/font][font=宋体]测得[/font][font='Times New Roman',serif]316.1、347.1(两个响应高的峰),[font=&]347.1是对的上,[font=&]316.1不知道怎么产生的?[/font][/font][/font]
请教专家:如何用HPLC准确定量样品中的一个杂质,目前有样品、杂质对照品,样品中的杂质已用百分比法测出。如用外标法,溶剂及波长是否要一致。谢谢!
[color=#DC143C]请问大家在用TLC测定有关物质的时候,有没有遇到过把供试品溶液稀释N倍后作为对照溶液的情况?我很疑惑:供试品溶液的浓度比对照溶液深,为什么杂质斑点不得比对照溶液深呢?这样的对照能说明什么问题呢?谢谢![/color]我是在中国药典上见到的这种方法:乙胺嘧啶的有关物质(05版CP第3页):取本品,加三氯甲烷-甲醇(9:1)制成每1ml中含20mg的溶液,作为供试品溶液;精密量取适量,加同一溶剂稀释成每1ml中含50ug的溶液,作为对照溶液。照薄层色谱法检验,……供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深。
我公司求购下列对照品:USP Gabapentin Related Compound D RS [(1-(3-oxo-2-aza-spiro[4.5]dec-2-ylmethyl)-cyclohexyl)-acetic acid] (C18H29NO3 307.43) . 1S (USP29)联系方式: wdzhang@du-hope.com
请教下各位,一般做溶出曲线时,一个介质配一份该介质下的对照;但是遇到多个介质一起做的时候,是否可以共用一份对照?假如,同时配制的多介质对照品f值只相差2%以内,是否可以认为这几个介质的对照可以共用呢?就不再需要每个介质单独配对照?
[B][center]药物中杂质的来源及杂质限量检查[/center] [/B]药物只有合格品与不合格品;一般化学试剂分为4个等级(基准试剂、优级纯、分析纯、化学纯) [B]药物中一般杂质检查 [/B][B]氯化物为一指示性杂质。[/B] 通过对氯化物的控制,可同时控制与氯化物结合的一些阳离子以及某些同时生成的副产物。可从氯化物检查结果显示药物的纯度,间接考核生产、贮藏过程是否正常。 1. 原理 药物中微量的氯化物在硝酸酸性条件下与硝酸银反应,生成氯化银的胶体微粒而显白色浑浊,与一定量的标准氯化钠溶液在相同条件下产生的氯化银浑浊程度比较,判定供试品中氯化物是否符合限量规定。 Ag+ + Cl- → AgCl ↓ [B]硫酸盐检查法 [/B] 1. 原理 药物中微量的硫酸盐在稀盐酸酸性条件下与氯化钡反应,生成硫酸钡的微粒而显白色浑浊,与一定量的标准硫酸钾溶液在相同条件下产生的硫酸钡浑浊程度比较,判定供试品中硫酸盐是否符合限量规定。 [B]铁盐检查法 [/B]硫氰酸盐法 巯基醋酸法 砷盐检查法 1. 古蔡氏法 1. 原理 金属锌与酸作用产生新生态的氢,与药物中微量砷盐反应生成具挥发性的砷化氢,遇溴化汞试纸产生黄色至棕色的砷斑,与同条件下一定量标准砷溶液所生成的砷比较斑,判断砷盐的含量。 [B]硒、氟及硫化物检查法 [/B]1. 氧瓶燃烧法 适用于以共价键结合的卤素、硫、硒的有机药物。 本法系将有机药物防入充满氧气的密闭燃烧瓶中进行燃烧,将燃烧所产生的欲测组分吸收于适当的吸收液中,然后根据欲测组分的性质,选用合适的分析方法进行鉴别、检查或含量测定。 [B]注意事项及讨论 [/B]1. 根据被燃烧分解的样品量选用适宜大小的燃烧瓶。 2. 测定氟化物时应改用石英燃烧瓶。 1. 硒检查法 (1). 操作方法 样品与对照品液,调节Ph2.0±0.2,加盐酸羟胺,二氨基萘,比色。 [B]硫化物检查法 [/B] 方法同砷盐检查第一法,不装醋酸铅棉花,以醋酸铅试纸代替溴化汞试纸。 标准液取1ml 5/ml [B]澄清度检查法 [/B]将一定浓度的供试品溶液与浊度标准液分别置于配对的比浊用玻璃管,同置黑色背景上,在漫射光下观察。浊度标准液 硫酸肼与乌洛托品溶液混合分五个等级,未超过0.5等级即为澄清。BP98规定未超过1等级即为澄清。 [B]溶液颜色检查法 [/B]CHP2000 [B]1. 比色法[/B] 色调标准贮备液 黄色液 重铬酸钾液(BP98用氯化铁) 红色液 氯化钴液 蓝色液 硫酸铜液 配成各种色调色号标准比色液共50种。 [B]2. 分光光度法 [/B] [B]易碳化物检查法 [/B]检查药物中含有的遇硫酸易碳化或易氧化而呈色的有机杂质。 对照品液 样品液 加硫酸5后,加供试品。 [B]炽灼残渣检查法[/B] 取供试品1.0~2.0g或个药品项下规定的重量,置已炽灼至恒重的坩埚中,精密称定,缓缓炽灼至完全碳化,放冷至室温;除另有规定外,加硫酸使湿润,低温加热至硫酸蒸气除尽后,在700~800炽灼使完全灰化,移至干燥器内,放冷至室温,精密称定,再在700~800炽灼至恒重,即得。残渣限量一般为0.1~0.2% 一般应使炽灼残渣量为1~2mg 若需将炽灼残渣留作重金属检查时,炽灼温度必须控制在500~600。 [B]干燥失重测定 [/B]1. 常压恒温干燥法 2. 干燥剂干燥法 3. 减压干燥法 [B]水分测定法 [/B][B]费休氏法 [/B] 本法是根据碘和二氧化硫在吡啶和甲醇溶液中能与水起定量反应的原理以测定水分。 [B]甲苯法[/B] 在加热状态下,甲苯夹带着水分蒸出,收集蒸出的水分测定。 [B]药物中特殊杂质检查 [/B] [B]一、物理法 [/B] [B]二、化学反应法 [/B](一)容量分析法 (二)重量分析法 (三)比色法和比浊法 [B]三、色谱法 [/B]1.纸色谱法 薄层色谱法 TLC是药典中最常用的特殊杂质限量检查方法。 1.在一定供试品及检查条件下,不允许有杂质斑点存在 2.以待测杂质对照品检测 3.将供试品稀释到适当浓度作为杂质对照品溶液 4.选用质量符合规定的与供试品相同的药物作为杂质对照品 [B]高效液相色谱法 [/B] [B][url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法 [/B] 1.面积归一化法 2.主成分自身对照法 3.内标法测定 4.内标法加校正因子法 5.外标法 有机溶剂残留量测定法 [B]分光光度法 紫外分光光度法 比色法 [url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法[/B]
[B]杂质对钛白粉有何影响及提高其白度的方法[/B] 对于颜料钛白粉,除了生产上采取一些措施来提高白度以外,关键还在于杂质的去除,杂质对白度的不良影响是很大的,杂质去除得越彻底,产品白度就越高,这对用在涂料中的意义就更大。 在钛白粉生产过程中,如果杂质去除不彻底,当用高温煅烧时,很多杂质元素如铁、锰、钒、铅、铬、钴、铈铜、镉、镍、钼等以氧化物状态存在,这些带色的氧化物就表现出各种色相,使整个钛白粉的色相受到影响而不纯白,以致大大影响了产品的质量。因此,必须采用多种方法除去杂质。 1选矿除杂质 要除去杂质,首先就要选矿。因为任何钛铁矿一般都混杂有不少脉石和共生、伴生、复合的其它矿物。选矿就是利用矿物不同的物理化学性质,采用各种有效方法,将钛铁矿与它们分离。例如摇床的重力选矿,可以除去铸铁矿中的大部分脉石,再用磁选机进行磁选,让矿物通过磁场,由于钛铁矿是导磁率高、能被磁铁吸引而本身不能吸铁、可磁化又可去磁的顺磁性矿物,而能磁盘吸引,其它导磁率低的非钛铁矿,不能被磁盘吸引而得到分离。 2除不溶性杂质 硫酸法生产钛白粉,由酸解浸取得到的是浑浊不清的钛液,其不溶性杂质主要是颗粒较大的机械杂质和颗粒较小的胶体杂质。机械杂质是未起反应的钛铁矿物,属于粗分散状态,很容易沉析下来;胶体杂质主要是硅酸铝酸盐等,由于颗粒小,吸附H而带有相同的正电荷,由于同种电荷相斥,胶粒很难接近成比较大的颗粒而沉淀下来,因而具有较高的稳定性。解决的办法是用带负电荷的改性的聚丙烯酰胺胶体进行电性中和,使胶体粒子凝聚沉降而除去。但是由于胶体沉降不完全,经过硫酸亚铁的过滤后,仍有一些穿滤而存在于钛液中,必须用带有木炭粉为助滤层的板框压滤机进行压滤,直到检测滤液的澄清度合格为止. 3除铁杂质 在钛铁矿中,非钛杂质最多的是铁,并以二价和三价两种状态存在。将钛铁矿与硫酸作用,即生成FeSO和(SO)。由于FeSO只有在pH值大于6.5时才开始水解,因此在钛液水解过程中,因钛液的酸性较大,FeSO就始终保持溶解状态,在偏钛酸洗涤时得以除去。而Fe(SO)在pH值为1.7的酸性溶液中即开始水解生成Fe(OH)沉淀,其混杂在偏钛酸中,煅烧时即生成红棕色的FeO而使成品不够纯白。所以应用铁屑把Fe(SO)还原为FeSO。为了保证钛液中的三价铁全部还原为二价铁,还原反应还应略为过度,此时钛液中就有小部分四价钛还原为三价钛。三价钛的存在就可保证三价铁还原完全,可避免三价铁水解生成Fe(OH)进而影响产品白度。经过还原,钛液中全部是FeSO,此时冷冻钛液,Fe即达到过饱和状态而大量结晶析出,过滤即可除去大部分铁钛液中剩下的未结晶的FeSO,待水解生成偏钛酸进行水洗时,用水洗除去。由于滤饼的FeO质量分数超过90×10时,产品白度将受到影响。所以可采取漂白措施使FeO质量分数降低到30×10,并进一步除去痕量的钒、铬、铜等杂质。
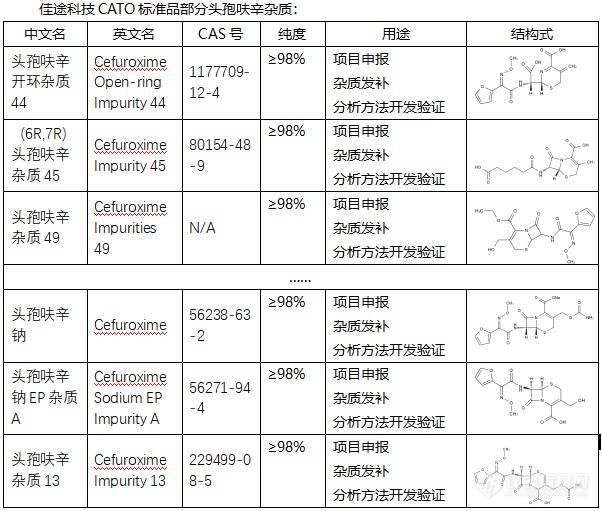
头孢呋辛是一种广泛使用的抗生素,主要用于治疗由敏感细菌引起的各种感染。在生产、储存和使用头孢呋辛的过程中,可能会产生一些杂质。这些杂质的存在可能会影响头孢呋辛的纯度和疗效,因此了解和控制这些杂质对于确保药物的安全性和有效性至关重要。头孢呋辛的杂质有多种,其中一些具有特定的CAS号、化学式和分子量。例如,头孢呋辛杂质33(Cefuroxime Impurity 33)的CAS号为929531-94-2,分子式为C16H16N4O9S,分子量为440.38。此外,还有其他一些头孢呋辛杂质,如头孢呋辛杂质A、B、C、D、E、F、G、H等。 CATO标准品提供的头孢呋辛全套的杂质,这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分。[img=,602,511]https://ng1.17img.cn/bbsfiles/images/2024/02/202402192104451830_7644_6381607_3.png!w602x511.jpg[/img] 广州佳途科技股份有限公司深知药物研发与质量控制的重要性,CATO标准品厂家,提供头孢呋辛全套的杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展,以满足客户在药物研发和质量控制方面的需求。[list][*]原创检测区[/list]◇头孢呋辛杂质头孢呋辛是一种广泛使用的抗生素,主要用于治疗由敏感细菌引起的各种感染。在生产、储存和使用头孢呋辛的过程中,可能会产生一些杂质。这些杂质的存在可能会影响头孢呋辛的纯度和疗效,因此了解和控制这些杂质对于确保药物的安全性和有效性至关重要。头孢呋辛的杂质有多种,其中一些具有特定的CAS号、化学式和分子量。例如,头孢呋辛杂质33(Cefuroxime Impurity 33)的CAS号为929531-94-2,分子式为C16H16N4O9S,分子量为440.38。此外,还有其他一些头孢呋辛杂质,如头孢呋辛杂质A、B、C、D、E、F、G、H等。CATO标准品提供的头孢呋辛全套的杂质,这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分。广州佳途科技股份有限公司深知药物研发与质量控制的重要性,CATO标准品厂家,提供头孢呋辛全套的杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展,以满足客户在药物研发和质量控制方面的需求。
现有一原料药,已知其杂质为abcde,并有相应的杂质对照品,请教大家怎么测定杂质的校正因子?
借贵版人气问一个问题:测定样品中的杂质时,什么情况下不用杂质标准品做对照,而采取把样品稀释后做自身对照?能给出自己工作中具体例子的,给悬赏分。谢谢!我说的是药品中的有关物质(生产过程中带来的有机杂质),无机杂质和残留溶剂不算。有关物质包括已知杂质和未知杂质,二者加起来是总杂质。我在中国药典上见到过这样的方法:乙胺嘧啶的有关物质(05版CP第3页):取本品,加三氯甲烷-甲醇(9:1)制成每1ml中含20mg的溶液,作为供试品溶液;精密量取适量,加同一溶剂稀释成每1ml中含50ug的溶液,作为对照溶液。照薄层色谱法检验,……供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深。详见下面的帖子:http://www.instrument.com.cn/bbs/shtml/20070831/964769/[color=#DC143C]我在5楼举了几种情况,都是我翻译资料时遇到的。[/color]药品审评中心的老师也发过相关的讨论,见下:[color=#00008B]关于HPLC主成分自身对照法检查有关物质时检测波长确定的讨论[/color]http://www.cde.org.cn/page/framelimit.cbs?ResName=dzkw据说这种稀释后自身对照的方法应用得挺多,但[color=#DC143C]我不知道为什么要这样用。[/color]
溶剂残留测定,对照品杂质峰是否应该删除好友回复:不应该大家说说看http://ng1.17img.cn/bbsfiles/images/2017/01/201701191701_670748_3111590_3.jpg
对于99.995%的高纯吸附载气和吸附质气体,其中的主要杂质气体为水份。假设气源气体中水份的含量为0.004%,则样品处在-195.8℃、30ml/min的流速中120min内停留在粉末表面的水的量为 0.14ml(标况下的体积),而对于500mg比表面积为1m2/g的材料,在其表面形成水的单分子层吸附所需要的水蒸汽的量为:0.12 ml(标况),与实际停留在粉末表面的水量相当,材料表面已经被水分饱和;如果不吹扫处理继续测试,那测试结果将不可能正确。对于色谱法孔径测试需要测试三四十个分压点,影响更是显著,若分压点之间不做吹扫处理,最后得到的结果将不是固体材料本身对氮分子的吸附了,而是包覆了水分子的颗粒对氮分子的吸附了,孔隙也早已被高沸点易吸附气体杂质H2O、CO2饱和。 要消除吸附质气源中的气体杂质H2O、CO2等的影响, 可采用冷阱气体净化装置,冷阱是消除高沸点气体杂质的有效方式;比表面仪配备的冷阱,使本会被样 品吸附的水份等高沸点杂质提前被冷阱捕获,使得经过净化后的高纯氮和高纯氦气体中的水分含量低于10-17Pa,达到超高纯气体状态; 3H-2000系列比表面仪是国内唯一配备冷阱的比表面仪器,这也是该系列仪器能够取得高精度和高分辨率的因素之一。
[B][center]药品研发如何确定杂质限度[/center][/B][B]国家食品药品监督管理局药品审评中心 黄晓龙[/B] 在药品研发中,如何证实药品安全有效应该是研发人员始终关注的问题;而药品质量的稳定可控又是保证其安全有效的前提与基础。如果一个药品的质量不能达到稳定与可控,在使用时这一药品就不可能始终安全、有效,也就不能被批准上市。保证药品质量稳定可控,药品的纯度是一个重点。如何确定杂质的限度是药学研究人员与审评人员不能回避的关键问题,该限度的制订是否科学、合理,直接关系到药品的安全性与质量。药品在临床使用中产生的不良反应除与该药品本身的药理活性有关外,也有一部分与药品中所混入的其它杂质有关。例如,通过我国药学科技工作者数十年的努力,基本上确定青霉素等抗生素中的多聚物等高分子杂质是引起过敏的主要原因。所以在研发过程中一定要对药品中的杂质进行全面研究,并将杂质完全准确地控制在一个合理的范围之内。 尽管杂质限度的确定对于药品研发非常重要,但国内药品研发的现实情况并不令人乐观。从近几年的新药申报情况分析,在杂质的研究与限度确定方面存在着较多的问题,主要表现为:部分药品研究单位对杂质研究的重要性了解不深;标准中对杂质的控制不够全面与准确;制订杂质限度时考虑问题不够全面,很少考虑杂质对药品安全性的不良影响;即使在杂质的含量明显超出正常工艺所允许的范围时,也不注意对现有的处方与工艺进行必要的优化,以降低杂质的限度。◆杂质的分类 药品中的杂质一般分为三类:有机杂质、无机杂质及残留溶剂。 有机杂质是指在药品的生产与储存过程中产生的杂质,这些杂质可以是已知的、未知的、挥发性的或不挥发性的杂质,主要包括:降解产物、聚合物、原料药与辅料或内包材的反应产物、以及原料药制备过程中引入的起始原料、副产物、中间体、反应试剂、配位体与催化剂。由于这些杂质的化学结构与产品分子类似或具渊源关系,所以通常称之为有关物质。 无机杂质是指在药品的生产过程中产生的杂质,这些杂质通常是已知的,主要包括:反应试剂、配位体与催化剂、重金属或其它残留的金属、无机盐、过滤助剂、活性炭等其它物质。 残留溶剂是指在原料药及制剂的生产过程中使用的有机溶剂。 对于生产过程中引入的外来污染物,可通过“良好的生产规范”(GMP)来控制,故不属于本文所说的杂质范畴。原料药的不同晶型也不属于本文的讨论范畴。本文只谈有机杂质与无机杂质的限度确定。
普拉克索杂质A,B,C,D,E欧洲药典标准。进口注册标准中代码【BI-II751XX】 【BI-II786BS】 【BI-II820BS】BI-II 546 CL】常用杂质对照品
实验室研发的新产品即将生产,其中有一个[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]监控的步骤,需要用简单的方式来定量控制该物质的含量。杂质是异丙醚,此步是中间控制,需要将该杂质含量控制在1%以内,领导要求开发一个简便的方式来定量从而控制其含量。我想了一下,能否将产品与杂质1:1配制,溶解至100ml,那么此时杂质与产品的含量比即为杂质与产品的峰面积比。问过研发人员,中间产物中,产品大致的量他们是知道的,也就是产品的量已知。那么能否通过直接进样中间产物,观察产品与杂质的比值来判断杂质的大致含量呢?这个方式我在液相的杂质含量中其实有大致了解,但是无奈理解能力有限,其实没有太懂[b][color=#000000]加校正因子主成分自身对照法[/color][/b]与[color=#000000][b]不加校正因子的主成分自身对照法[/b]的[/color]计算方式。[b][color=#ff0000]举个例子:[/color][/b]第一种[font=&][color=#000000][size=14px][b]加校正因子主成分自身对照法[/b][/size][/color][/font]:假设我现在有杂质对照品,和产品对照品,我将两种配制成浓度已知的混合液,进样,已知校正因子(f)=(S杂质*C杂质)/(S产品*C产品)计算出校正因子,假设(f)=杂质:产品=1.2那么我现在有个中控液进样了,杂质:产品峰面积为1:10,产品在混合液中的含量差不多为50%,那么杂质含量占多少呢?杂质含量此时是6%吗?第二种[b]不[/b][font=&][size=14px][color=#000000][b]加校正因子主成分自身对照法[/b][/color][/size][/font]:这种我是完全没懂了,,,懵圈了。如果我第一种方法的理解没错的话,那么此次[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]中控方式能否用这种方式来计算杂质的大致含量呢。求教。
如题,俺第一次测盐酸左氧氟沙星,做有关物质时杂质A与左氧保留时间完全重叠,排除了乙酸铵、高氯酸钠等试剂滴原因,实在没辙咧,请教大虾帮忙。盐酸左氧氟沙星有关物质测定方法(来源:中国药典2010年版第一增补本): 有关物质 取本品,精密称定,加0.lmol/L盐酸溶液溶解并定量稀释制成每1ml中约含1.2mg的溶液,作为供试品溶液,精密量取适量,用0.1mol/L盐酸溶液定量稀释制成每1ml中含2.4ug的溶液,作为对照溶液。另精密称取杂质A对照品约18mg,置100ml量瓶中,加6mol/L氨溶液1ml与水适量使溶解,用水稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用水稀释至刻度,摇匀,作为杂质A对照品溶液。照高效液相色谱法(附录V D)测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85 :15)为流动相A,乙腈为流动相B;按下表进行线性梯度洗脱。柱温为40°C;流速为每分钟1ml。称取左氧氟沙星对照品、环丙沙星对照品和杂质E对照品各适量,加0.1mol/L盐酸溶液溶解并稀释制成每1ml中约含左氧氟沙星1.2mg、环丙沙星和杂质E各6ug的混合溶液,取10ul注人液相色谱仪,以294nm为检测波长,记录色谱图,左氧氟沙星峰的保留时间约为15分钟。左氧氟沙星峰与杂质E峰和左氧氟沙星峰与环丙沙星峰的分离度应分别大于2.0与2.5。量取对照溶液10ul注人液相色谱仪,以294mn为检测波长,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。精密量取供试品溶液、对照溶液和杂质A对照品溶液各10ul,分别注人液相色谱仪,以294nm和238nm为检测波长,记录色谱图。供试品溶液色谱图中如有杂质峰,杂质A(238nm检测)按外标法以峰面积计算,不得过0.3%。其他单个杂质(294nm检测)峰面积不得大于对照溶液主峰面积(0.2%),其他各杂质(294nm检测)峰面积的和不得大于对照溶液主峰面积的2.5倍(0.5%)。供试品溶液色谱图中任何小于对照溶液主峰面积0.1倍的峰可忽略不计。时间(分钟) 流动相A(%) 流动相B(%) 0 100 0 18 100 0 25 70 30 39 70 30 40 100 0 50 100 0
采用面积归一化法测定高分子杂质,但系统适用性的对照品溶液峰面积rsd达到9%以上,这样会影响杂质定量么,有人说峰面积归一化法不用对照品峰面积,不用管,有做过的么?(对照品溶液和杂质不是一个物质)
硅胶中含有的少量金属杂质对色谱峰有影响吗?如有,应该如何处理?
主成分的响应因子比已知杂质的响应因子小,2者相差较大,如何定量呢?已知杂质 Response Factoru/mL 5 11.5 10 12.3 30 23.9 50 31.8 80 36.5 100 36.4 主成分 5000 mcg/mLmcg/mL Peak Area 28679 Resp Factor 5.7 现有的方法,是用已知杂质对照品,来定量样品中的杂质含量。。响应因子相差较大,是否造成计算出的结果偏小??
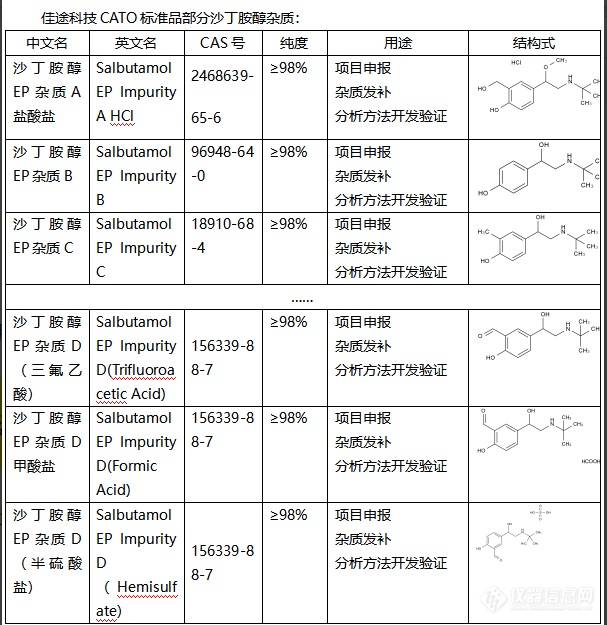
沙丁胺醇是一种药物,主要用于治疗哮喘和慢性阻塞性肺病等呼吸系统疾病。在药品制备过程中,可能会产生一些不同结构的化合物,这些化合物就被称为杂质。杂质可能会对药品的品质、安全性、效力和稳定性等产生影响。根据产生的差异,杂质的作用可以具体表现如下:1. 影响药品的稳定性:杂质可能导致药品在贮存过程中发生化学变化,从而影响药品的稳定性。2. 影响药品的安全性:如果杂质对人体有毒性,那么杂质的存在可能降低药品的安全性。3. 影响药品的效力:杂质可能与药品的有效成分发生竞争,导致药品的效力降低。4. 影响药品的品质:杂质可能改变药品的外观、颜色、溶解性等物理性质,影响药品的品质。CATO标准品制药行业对药品的杂质进行严格控制,保障药品的质量和患者的用药安全。[img=,607,625]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021631332927_8650_6381668_3.png!w607x625.jpg[/img]
有没有做过维生素A杂质的液相色谱分析?维生素A及其杂质维生素A环氧化物、维生素A醛、维生素A酸没有杂质对照品,以上物质在甲醇-水(90:10)流动相,C18*250mm柱能不能分的开?
[size=4]1.所用对照品(标准品)中检所已经发放提供(可参阅中国药典2005年版二部附录ⅩⅤG),且使用方法相同时,应使用中检所提供的现行批号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源者;如使用方法与说明书使用方法不同(如定性对照品用作定量用、效价测定用标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等),应采用适当方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。 2.申报临床研究时,如中检所尚无供应,为不影响注册进度,可先期与中检所接洽制备和标定,申报时提供标定报告、标签(应标明效价或含量、批号、使用效期)和使用说明书;也可与省所合作标定,申报时提供标准品或对照品研究资料,“说明其来源、理化常数、纯度、含量及其测定方法和数据”;标定有困难时,可使用国外药品管理当局或药典委员会发放的对照品(标准品)或国外制药企业的工作对照品(标准品),进行标准制订和其他基础性研究,但应提供其标签(应标明其含量)和使用说明书,能保证其量值溯源性;也可使用国外试剂公司(如sigma公司等)提供的对照品(标准品),但应提供试剂公司该批对照品(标准品)的检测报告(用作含量测定时,应有确定的含量数据),如为高纯度试剂,提供了国外试剂公司检测报告(用作含量测定时,应有确定的含量数据)时,也可使用,并应能保证其量值溯源性,但申请人应及时与中检所接洽对照品(标准品)的标定事宜,临床研究期间完成此工作。 3.直接申报生产品种,如中检所尚无供应,可参照2中要求进行,并提供相应研究资料,但申请人在标准试行期间应与中检所接洽并完成的标定事宜。 4.对照品(标准品)标定的技术要求: 4.1.创新药物 应说明对照品(标准品)原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱),提供标定方法的研究和验证资料(如与原料药质量研究项下相同,可不再提供)、含量测定数据及经统计分析得到的对照品(标准品)含量结果,并说明进行临床前药学研究、药理毒理学研究所用样品的含量是否用该批对照品(标准品)确定或可用该批对照品(标准品)进行量值溯源。 ●纯度测定方法应选用色谱法,并采用两种以上不同分离机理或不同色谱条件并经验证的色谱方法相互验证比较,同时采用二极管阵列检测器或其它适宜方法检测HPLC法的色谱峰纯度,而后根据测定结果经统计分析确定对照品(标准品)原料的纯度。 ●对于组份单一、纯度较高的药物,对照品(标准品)标定方法宜首选可进行等当量换算、精密度高、操作简便快速的容量法。可根据药物分子中所具有的官能团及其化学性质,选用不同的容量分析方法,但应符合如下条件:(1)反应按一个方向进行完全;(2)反应迅速,必要时可通过加热或加入催化剂等方法提高反应速度;(3)共存物不得干扰主药反应,或能用适当方法消除;(4)确定等当点的方法要简单、灵敏;(5)标化滴定液所用基准物质易得,并符合纯度高、组成恒定且与化学式符合、性质稳定(标定时不发生副反应)等要求。 标定方法的选择要关注如下事项:(1)供试品的取用量应满足滴定精度的要求(消耗滴定液约20ml);(2)滴定终点的判断要明确,提供滴定曲线。如选用指示剂法,应考虑其变色敏锐,并用电位法校准其终点颜色。(3)为排除因加入其它试剂而混入杂质对测定结果的影响,或便于剩余滴定法的计算,可采用“将滴定的结果用空白试验校正”的办法;(4)要给出滴定度(采用四位有效数字)的推导过程。 标定结果要根据3个以上实验室各不少于15组测定结果经统计分析,去除离群值和可疑值后的结果,并报告可信限。 ●如该药物没有可进行等当量换算并符合要求的容量法时,可采用反复纯化的原料,色谱法确定纯度后扣除有关物质、炽灼残渣、水分和挥发溶剂等后的理论含量确定为标准品含量,以此为基准进行对照品(标准品)的换代和量值传递。 ●用于抗生素微生物检定法的第一代基准标准品可参照上述方法标定,如为多组份抗生素,其组份比例应与拟上市产品组份比例一致或接近,或以其中某一组份纯品为基准标准品,但要注意标准品换代时量值传递的恒定。 ●仅用于鉴别定性的化学对照品,注重其结构确证的研究资料,纯度和含量的要求一般可适当降低。 ●杂质对照品,用作限度要求时,应提供其来源(合成路线)、结构确证的研究资料,应具备较高的纯度和含量,并提供纯度和含量的的测定结果,提供质量控制标准。 4.2其他类别药物,可参照4.1要求进行。 ●用于抗生素微生物检定法的标准品须用上市国的国家标准品或原发厂的工作标准品为基准标准品进行标定。标定时采用的原料药应符合相应要求,并提供原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱)。标定须用现行版中国药典附录收载的“抗生素微生物检定法”-三剂量法,并提供详细的方法学研究,包括检定菌和培养基的选择、剂量和剂距选择、缓冲液选择(如与质量研究项下相同,可不再提供)。每次标定结果均应照“生物检定统计法-量反应平行线测定法(3.3)”法进行可靠性测验及效价计算。按照《药品注册管理办法》,上市药品质量标准所用标准物质均须由中检所负责标定和管理,药品研发过程中,研制单位应注意及时与中检所联系标定事宜,以保证研发工作的连续性。[/size]
问题描述:超纯水中的杂质对[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]实验有什么影响?解答:[font=宋体][color=black]超纯水中不同的杂质对于[/color][/font][font='Times New Roman','serif'][color=black][url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url][/color][/font][font=宋体][color=black]实验有不同的影响:[/color][/font][font=宋体][color=black]金属离子:水中的任何痕量金属杂质都可能影响等离子体的电离或与待测质量重叠,干扰分析结果。[/color][/font][font=宋体][color=black]颗粒物:粘附待测金属离子,干扰分析;还会附着在雾化器上,影响雾化效果。[/color][/font][font=宋体][color=black]有机物:不但会粘附在雾化器壁上,导致漂移和变化,增加清洁频率;还会和一些金属形成络合物(如铂、汞、锡或钯),影响等离子体的电离效率。[/color][/font][font=宋体][color=black]细菌:菌体可以看成颗粒物,菌膜会附着在雾化器等元器件上,损坏元器件,影响实验;由于细菌是有生命的,其代谢会持续释放离子及有机物,造成影响。[/color][/font]以上内容来自仪器信息网《[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]实战宝典》
http://www.greenherbs.com.cn/bbs/dispbbs.asp?boardid=2&Id=7651724918 唑吡坦杂质A CIV Zolpidem Related Compound A CIV 对照品/标准品1724907 酒石酸唑吡坦 CIV Zolpidem Tartrate CIV 对照品/标准品1724893 唑吡坦 CIV Zolpidem CIV 对照品/标准品1724805 盐酸唑拉西泮 Zolazepam Hydrochloride 对照品/标准品1724769 硫酸锌 Zinc Sulfate 对照品/标准品1724747 氧化锌 Zinc Oxide 对照品/标准品1724689 齐留通杂质C Zileuton Related Compound C 对照品/标准品1724678 齐留通杂质B Zileuton Related Compound B 对照品/标准品1724667 齐留通杂质 A Zileuton Related Compound A 对照品/标准品1724656 齐留通 Zileuton 对照品/标准品1724532 齐多夫定杂质C(胸腺嘧啶) Zidovudine Related Compound C (thymine) 对照品/标准品1724521 齐多夫定杂质B Zidovudine Related Compound B 对照品/标准品1724500 齐多夫定 Zidovudine 对照品/标准品1724317 扎西他滨杂质A Zalcitabine Related Compound A 对照品/标准品1724306 扎西他滨 Zalcitabine 对照品/标准品1724000 盐酸育亨宾 Yohimbine Hydrochloride 对照品/标准品1722005 木糖 Xylose 对照品/标准品1721002 盐酸赛洛唑啉 Xylometazoline Hydrochloride 对照品/标准品1720600 木糖醇 Xylitol 对照品/标准品1720429 盐酸赛拉嗪 Xylazine Hydrochloride 对照品/标准品1720407 赛拉嗪 Xylazine 对照品/标准品1720203 呫吨酮 Xanthone 对照品/标准品1720000 呫吨酸 Xanthanoic Acid 对照品/标准品1719102 华法林杂质 A Warfarin Related Compound A 对照品/标准品1719000 华法林 Warfarin 对照品/标准品1717708 牡荆素(牡荆甙) Vitexin 对照品/标准品1717504 含量测定系统适用性用维生素D Vitamin D Assay System Suitability 对照品/标准品1716002 维生素A Vitamin A 对照品/标准品1715000 硫酸紫霉素 Viomycin Sulfate 对照品/标准品1714528 长春瑞滨杂质A Vinorelbine Related Compound A 对照品/标准品1714506 酒石酸长春瑞滨 Vinorelbine Tartrate 对照品/标准品1714007 硫酸长春新碱 Vincristine Sulfate 对照品/标准品1713004 硫酸长春碱 Vinblastine Sulfate 对照品/标准品1711508 阿糖腺苷 Vidarabine 对照品/标准品1711472 维替泊芬杂质A Verteporfin Related Compound A 对照品/标准品1711461 维替泊芬 Verteporfin 对照品/标准品1711440 维拉帕米杂质F Verapamil Related Compound F 对照品/标准品1711439 维拉帕米杂质E Verapamil Related Compound E 对照品/标准品1711428 维拉帕米杂质D Verapamil Related Compound D 对照品/标准品1711406 维拉帕米杂质B Verapamil Related Compound B 对照品/标准品1711304 维拉帕米杂质A Verapamil Related Compound A 对照品/标准品1711224 维库溴铵杂质F Vecuronium Bromide Related Compound F 对照品/标准品1711202 盐酸维拉帕米 Verapamil Hydrochloride 对照品/标准品1711188 维库溴铵杂质C Vecuronium Bromide Related Compound C 对照品/标准品1711177 维库溴铵杂质B Vecuronium Bromide Related Compound B 对照品/标准品1711166 维库溴铵杂质A Vecuronium Bromide Related Compound A 对照品/标准品1711155 维库溴铵 Vecuronium Bromide 对照品/标准品1711133 赖氨加压素 Lypressin 对照品/标准品1711100 加压素 Vasopressin 对照品/标准品1711009 香草醛熔点标准品 Vanillin Melting Point Standard 对照品/标准品1710006 香草醛 Vanillin 对照品/标准品1709018 Vancomycin B with Monodechlorovancomycin 对照品/标准品1709007 盐酸万古霉素 Vancomycin Hydrochloride 对照品/标准品1708795 缬沙坦杂质 C Valsartan Related Compound C 对照品/标准品1708784 缬沙坦杂质 B Valsartan Related Compound B 对照品/标准品1708773 缬沙坦杂质 A Valsartan Related Compound A 对照品/标准品1708762 缬沙坦 Valsartan 对照品/标准品1708751 戊柔比星分离度用混合物 Valrubicin Resolution Mixture 对照品/标准品1708730 戊柔比星 Valrubicin 对照品/标准品1708729 丙戊酸杂质A Valproic Acid Related Compound A 对照品/标准品1708718 丙戊酸杂质 B Valproic Acid Related Compound B 对照品/标准品1708707 丙戊酸 Valproic Acid 对照品/标准品1708503 L- 缬氨酸 L-Valine 对照品/标准品1708015 D-缬更昔洛韦 D-Valganciclovir 对照品/标准品1708004 缬更昔洛韦盐酸盐 Valganciclovir Hydrochloride 对照品/标准品1707908 缬草烯酸 Valerenic Acid 对照品/标准品1707894 万乃洛韦杂质G Valacyclovir Related Compound G 对照品/标准品1707883 万乃洛韦杂质F Valacyclovir Related Compound F 对照品/标准品1707872 万乃洛韦杂质E Valacyclovir Related Compound E 对照品/标准品1707861 万乃洛韦杂质D Valacyclovir Related Compound D 对照品/标准品1707855 万乃洛韦杂质C Valacyclovir Related Compound C 对照品/标准品1707839 盐酸万乃洛韦 Valacyclovir Hydrochloride 对照品/标准品1707806 熊去氧胆酸 Ursodiol 对照品/标准品1706701 C13尿素 Urea C 13 对照品/标准品1706698 尿素 Urea 对照品/标准品1706009 乌拉莫司汀 Uracil Mustard 对照品/标准品1705800 阿糖尿苷 Uracil Arabinoside 对照品/标准品1705505 十一烯酸 Undecylenic Acid 对照品/标准品1705323 泛癸利酮杂质A Ubidecarenone Related Compound A 对照品/标准品1705312 系统适用性试验用泛癸利酮 Ubidecarenone for System Suitability 对照品/标准品1705301 泛癸利酮 Ubidecarenone 对照品/标准品1705006 L- 酪氨酸 L-Tyrosine 对照品/标准品1704003 泰洛沙泊 Tyloxapol 对照品/标准品1703850 酒石酸泰洛星 Tylosin Tartrate 对照品/标准品1703805 泰洛星 Tylosin 对照品/标准品1702008 氯筒箭毒碱 Tuboc