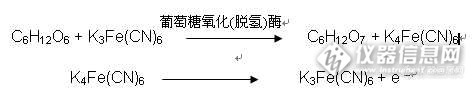
关于JJF1383-2012《便携式血糖分析仪校准规范》可行性的分析 便携式血糖分析仪简称血糖仪,主要用于糖尿病患者对自身血糖值的监测,目前部分医疗机构也将血糖仪用于临床诊断。按照卫生局的要求用于临床诊断的血糖仪需每半年校准一次,但对于血糖仪国家却一直缺少相应的检定规程或校准规范。直到2012年才颁布了《便携式血糖分析仪校准规范》,并于2013年3月开始实施。但该规范的可行性却值得思考。 一、概念问题 血糖仪按检测技术可以分为电化学法和光反射技术两大类,根据《规范》第4项概述所描述内容,我们可以认为该《规范》适用于这两类血糖仪。但概述的最后一句话却存在问题,《规范》将血糖仪定性为:主要用于新鲜毛细血管全血的葡萄糖含量的快速测量,也可用于静脉全血、血清(浆)的葡萄糖含量的快速测量。首先该句话中最明显的错误在于也可用于静脉全血、血清(浆)的葡萄糖含量的快速测量。血糖仪应该是用于测量毛细血管全血的葡萄糖含量的,虽然也可用于测量静脉全血的葡萄糖含量,但会存在着较大误差。因为血糖仪主要用于患者自我监控,采血时采集的是指端的血,属于毛细血管全血。毛细血管全血的血糖值相对于静脉全血的血糖值要偏高10%-20%,为了真实的体现人体的血糖含量生产厂家多会对该数值进行修正。所以血糖仪在测量静脉全血血糖值时会存在较大的误差,必须进行修正才能进行测量。而对血清(浆)的葡萄糖含量的快速测量,应该仅仅是适用于光反射法的血糖仪,而不适用于电化学法的血糖仪,这从血糖仪的原理上看也是显而易见的。 最早的光反射法血糖仪也称为水洗式血糖仪,该种仪器使用时先将血液涂抹在试纸条上,待反应完成后,再将试纸条上的血液清洗干净后进行测量,此时的试纸条多数变色为蓝色。现在这种血糖仪的试纸条上多有一层网膜用于过滤血液的颜色,免去了清洗步骤,使用更加方便。可见这种血糖仪是利用试纸与葡萄糖反应后颜色发生更改变进行测量的,由于要将血液的颜色清除,所以基本不受血液中其他物质的干扰,所以可以用于血清(浆)的葡萄糖含量的测量。而电化学法血糖仪的工作原理是建立在电化学葡萄糖传感器的基础上的,是电化学酶法测定葡萄糖,其反应过程如下:http://ng1.17img.cn/bbsfiles/images/2013/07/201307010733_448531_1638093_3.jpg在检测血液时,血液中的葡萄糖在葡萄糖氧化(脱氢)酶的催化下发生反应释放出电子, 改变试纸条电阻值,达到改变检测电路中电流强弱的效果,最终实现对人体血液中葡萄糖含量的检测。血糖仪主要用于人体全血血糖值的测量,全血中包含血浆,红细胞,白细胞,血小板,血浆是水,糖,脂肪,蛋白质,钾盐和钙盐的混合物。由于血糖仪使用时不会对血液进行任何前处理,所以血液中的所有成分均会对试纸条电阻值产生一定的影响。所以血糖仪在设计制造时,一般都是使用全血来绘制仪器的测量曲线的。所以很明显,使用全血绘制出的曲线是不适用于血清(浆)葡萄糖含量的测量的,如果使用会产生极大误差。该情况通过使用GB/T19634-2005《体外诊断检验系统自测用血糖监测系统通用技术条件》所推荐的回收试验法可以轻松验证。 二、测量标准 《规范》第6.2.1条规定需要使用血糖标准物质,但是截至目前由于电化学法血糖仪仅适用于全血血糖值的测量,所以尚无专用于血糖仪的标准物质,而通过查阅《规范》附录C发现,这里所说的血糖标准物质实际上是冻干粉血清标准物质,该标准物质实际是用于校准用于血糖测量的生化分析仪的标准物质,由于是血清标准物质所以不适用于电化学法血糖仪的检测。 三、建议使用的校准方法 在对血糖仪进行校准时,我建议还是应该将仪器部分和试纸部分分开检测,因为根据GB/T19634-2005《体外诊断检验系统自测用血糖监测系统通用技术条件》的要求,我们可以推断试纸还可能存在着15%的批间差,而血糖仪的试纸误差最大仅为20%,如果仅仅整体判定,血糖仪容易受试纸误差的影响而出现误判。这里我仅简单介绍一下血糖仪整体性能的校准。 在校准中我建议还是应该参照GB/T19634-2005《体外诊断检验系统自测用血糖监测系统通用技术条件》规定的方法,使用人体全血,或模式生物(如:兔子、小白鼠等)的全血,采用比对法和回收试验法进行校准。开始校准前采集全血,加入制造厂商建议的抗凝剂(如:肝素锂、肝素钠),静置12小时,此时该血样的血糖值将下降到2mmol/L附近。此时分别用血糖仪和生化分析仪测量该血样,记录数据。之后向该血样加入葡萄糖溶液,调整血样的血糖值到预期浓度后,再用血糖仪和生化分析仪对血样进行测量。上述步骤重复数次,直到测得值涵盖低值、中值、高值,中值应适当增加测量点。然后将使用血糖仪测量的一组数根据制造商提供的换算公式计算得到的静脉血果与生化分析仪测量的结果进行比较,以生化分析仪测得的结果作为参考值,计算误差。 四、结束语 计量检测应该是一项十分科学、严谨的工作,而我们的校准规范却出现了如此明显的问题不能不让我们深思。只能说在规范的起草过程中,我们的技术人员过于浮躁,缺少了试验的严谨性,如果在起草的过程中多做了几组试验,多征求了几个知名生产
新买了一根月旭的钙型糖分析柱,说明书上要求保存10%乙醇中,且在5度保存。我想知道的是新柱的保存溶剂是什么?使用之前用不用5度保存?请各位大侠不吝赐教!谢谢!
做糖分析,用聚乙烯二乙烯苯阴离子柱,有哪家做啊?请高手指点!日本的不要!
由于本人是从事食品检验的,没检验过药品,最近一朋友拿来一种用于糖尿病病人吃的药品让我检验其中是否含有糖分,我想先问下做过药品分析的同行,你们是用什么方法测定的?是滴定法还是液相的示差检测器做的?跟食品中糖分测定是不是差不多呢?
绵白糖中还原糖分标准糖液需要每次都标定吗?望老师不吝赐教
安捷伦糖分析柱如何冲洗保存?测试完后可以先用高浓度水冲洗吗?

QB/T2343.2-2013标准赤砂糖中还原糖分的测定方法解读经常会接到很多的同事问:按 QB/T2343.2-2013标准检测赤砂糖中还原糖分,我怎么做不出来啊,颜色判定不出来,结果计算出来为什么这么多都是不合格啊,标准的计算公式为什么是这样的。。。。。等各种问题。针对这些问题,本人在此详细对 QB/T2343.2-2013标准赤砂糖中还原糖分的测定方法进行解读,欢迎跟贴进行讨论。溶液的配制:这么略,与标准一致。从测定步骤开始:[img=,690,334]https://ng1.17img.cn/bbsfiles/images/2018/09/201809161714176758_2764_2166779_3.png!w690x334.jpg[/img]注意滴定时:一定要在有白色底面的滴定台中滴定:因为赤砂糖样液会呈红色,利用它的白色来反衬亚甲基蓝的蓝色,认真观察,还是可以观察到样液颜色的变化的。标准中的计算公式其实是有误的:[img=,690,219]https://ng1.17img.cn/bbsfiles/images/2018/09/201809161720042647_5859_2166779_3.png!w690x219.jpg[/img]这里计算出耗用配制糖液中所含有的蔗糖量G是为了查下表得出校正系数f的:[img=,690,226]https://ng1.17img.cn/bbsfiles/images/2018/09/201809161722215594_1734_2166779_3.png!w690x226.jpg[/img]真正计算出赤砂糖样品中还原糖分的百分含量是下面的计算公式:[img=,690,270]https://ng1.17img.cn/bbsfiles/images/2018/09/201809161724082221_328_2166779_3.png!w690x270.jpg[/img]结论:我们检测人员不能生搬硬套标准,一定要理解标准的检测原理,计算公式最好能根据自己的测定步骤导推出其计算公式,有时真的是尽信书还不如无书啊,因为标准有时也会有出差的地方,尤其是计算公式这一类直接导致计算结果错误的地方。希望通过这个标准的解读让大家更好地理解这个检测方法。
最近在做糖蛋白的单糖分析,检测前要用盐酸和三氟乙酸水解,然后离心浓缩仪除去溶剂。现有的离心浓缩仪不耐强酸,所以除溶剂步骤采用的是加热挥发法。做了两次发现,样品中都检测不到单糖峰,怀疑是不是加热时间长单糖焦化了呢?不知道有没有人做相关的实验,是不是有别的办法水解单糖呢?或者水解完毕后有别的办法来处理样品,像加碱中和之类的。
月旭公司的钙型糖柱能做木糖分析吗?如果不能的话,哪一款能做,请介绍一下,谢谢!
请问一下:在采用二次折光法测定蔗糖分时,为什么要调节盐酸溶液为24.85° Bx和氯化钠的浓度为什么为231.5g/L? (标准为:QB/T5012-2016绵白糖试验方法)
用的安捷伦公司的糖分析柱,在液相中分离大豆低聚糖,流动相为乙腈:水=80:20,但是基线很难走稳,进样了以后每次都是负峰,而且还特别高的负峰。求大神解释?
转让戴安PA10及PA20糖分析柱全新,价格面谈。
哪位前辈能告诉俺新鲜南瓜的糖分该按哪个检验标准测定呀?急盼回复呀!!
我提取出来的多糖,经DEAE-52离子交换柱分离得到三个不同组分,但是经HPLC---TSK G-4000PWxl洗脱却得到一个很均一的峰...想了解下为什么会这样?看峰形很对称、狭窄(比我用的标准糖的峰宽要窄),说明多糖分子量很均一么?洗脱条件:0.3ml/min,超纯水超纯水洗脱,TSK G-4000PWxl柱子,ELSD(蒸发光散射检测器)[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004121638_211589_1169172_3.gif[/img]补充:楼下有板油提到说是GPC的峰形是这种图形有问题,馒头形的会好一些....但是..我走的标准品差不多也是这个形状的,我把标准品的图形也给放上,大家给参考下..标准品用的是Sigma的Dextran标准品,分子量是1000Da...[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004131525_211844_1169172_3.gif[/img]
总糖分,还原糖分,蔗糖分,色值,不溶水杂质等食糖项目需要哪些必备仪器?标准对于我来说太过复杂,望老师不吝赐教
[align=center][size=11.0pt]用于生物治疗药物的N-糖分析和唾液酸定量方案[/size][/align][align=center][size=11.0pt]会议时间:2020年3月5日10:00[/size][/align][b]内容介绍:[/b]糖基化作为N-糖表征中公认的关键质量属性,是生物治疗糖蛋白开发过程中必不可少的一部分。在N-糖分析过程中,传统方法步骤繁琐、耗时长、结果重现性差等问题始终困扰着分析工作者。本次讲座将提供一种快速的N-糖分析工作流程以解决以上问题。糖蛋白分子中唾液酸化也很重要,我们也将同时介绍唾液酸定量的工作流程。[b]讲师介绍:[/b] 陆予菲:毕业于中国药科大学。在安捷伦公司工作期间,专注于液相色谱、[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]中的色谱柱选择及方法开发等应用领域。在安捷伦期间,作为主要成员参与了2010年版和2015年版中国药典应用图谱集的工作,以及多个色谱应用方法开发项目。报名地址:[url=https://www.instrument.com.cn/webinar/meeting_10434.htmlhttp://]https://www.instrument.com.cn/webinar/meeting_10434.html[/url]
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网[em0805]
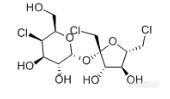
[align=center][b]GB 22255-2014 食品安全国家标准 食品中三氯蔗糖(蔗糖素)的测定——三氯蔗糖标准品分析-RI[/b][/align]三氯蔗糖(TGS),是唯一以蔗糖为原料的功能性甜味剂,甜度可达蔗糖600倍。这种[url=http://baike.sogou.com/v130009.htm][color=windowtext]甜味剂[/color][/url]具有无能量,甜度高,甜味纯正,高度安全等特点,是最优秀的功能性甜味剂之一。[align=center][img=,170,99]http://ng1.17img.cn/bbsfiles/images/2018/03/201803080920210187_4197_2222981_3.png!w170x99.jpg[/img][/align][align=center]三氯蔗糖结构式[/align]实验室前期按照《GB 22255-2014 食品安全国家标准食品中三氯蔗糖(蔗糖素)的测定》方法,使用高灵敏度气溶胶型检测器——纳克级水凝粒子计数检测器(NQAD),得到了三氯蔗糖标准品的良好分析结果。本实验按照相同条件,使用示差折光检测器(RI)对三氯蔗糖标准品进行分析。色谱柱同样选择中等极性的普适型色谱柱CAPCELL PAK C[sub]18 [/sub]MGII S5 4.6 mm i.d. × 150 mm,得到结果如图1所示。三氯蔗糖保留时间为12.400min,与标准谱图保留时间基本一致,理论塔板数为12350,不对称因子为0.95,峰形良好。[align=center][img=,690,489]http://ng1.17img.cn/bbsfiles/images/2018/03/201803080945469257_8172_2222981_3.png!w690x489.jpg[/img][/align][align=center]图1 三氯蔗糖标准品分析色谱图(0.4 mg/mL)[/align]*注:峰上标数字由下至上依次为保留时间、理论塔板数及不对称因子。[img=,472,187]http://ng1.17img.cn/bbsfiles/images/2018/03/201803080945471937_6640_2222981_3.png!w472x187.jpg[/img][align=center][img=,690,435]http://ng1.17img.cn/bbsfiles/images/2018/03/201803080946205953_7240_2222981_3.png!w690x435.jpg[/img][/align][align=center]附图:GB方法中标准色谱图[/align]接下来,按照国标要求配制三氯蔗糖工作液,0.02 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.4 mg/mL,进行线性考察实验。线性实验结果如图2所示,R[sup]2[/sup]=0.9939,得到良好线性结果。同时,由于低浓度0.02 mg/mL、0.05 mg/ mL标准品溶液均未检出色谱峰,因此根据标准曲线最高浓度的信噪比计算出检出限(以S/N=3计)约为0.17 mg/ mL。[align=center][img=,650,398]http://ng1.17img.cn/bbsfiles/images/2018/03/201803080947051037_4812_2222981_3.png!w650x398.jpg[/img][/align][align=center]图2 三氯蔗糖标准曲线图[/align]综上,按照《GB 22255-2014 食品安全国家标准食品中三氯蔗糖(蔗糖素)的测定》方法,使用示差检测器(RI)进行检测,以及CAPCELL PAK C[sub]18[/sub] MGII S5 4.6 mm i.d. ×150 mm色谱柱进行分析,可得到三氯蔗糖标准品的良好线性分析结果;但RI检测器的检测灵敏度较低。
绵白糖还原糖分测定中,10g/L的标准转化糖溶液可以加入用热水溶解的苯甲酸,做为稳定的储备液,可是苯甲酸不溶于水啊,我都是不加苯甲酸现用现配,亲们都是咋配的?苯甲酸加不加呢
成分分析中微量其他纤维的标准表示方法? 例: 1. 聚酯纤维:88% 2. 聚酯纤维:88% 3.聚酯纤维:88% 桑蚕丝:12% 桑蚕丝:12% 桑蚕丝:12% 含微量其他纤维 以上3种那个更标准一些?
解析我国与美国纤维含量测试标准的差异马志强摘要:综合概述了我国与美国在纤维含量分析标准上存在的主要差异,提供给生产、贸易和检测企业作为参考。关键词:纤维成分;美国;差异美国是我国服装类纺织品最主要的出口国,也是世界最大的纺织品消费市场,出口美国的产品必须要遵循美国本地的法令法规,特别针对纤维成分标签,美国有严格的标签法令,指导生产商和零售商进行正确的纤维标注。为了确保标签的正确性,首先要使用正确的测试方法。本文针对我国和美国在纤维含量测试方法上存在的差异进行了比较和分析,给国内的生产、贸易企业提供了相关的信息,使其能根据产品的出口地区,正确的进行产品纤维含量的分析和标签标注,满足市场的要求。1美国纤维含量测试标准的特点美国纺织染色家和化学家协会(AATCC)在纺织测试标准领域非常具有权威性,由其编制的针对纺织品的AATCC测试方法涵盖了纺织品纤维成份分析,色牢度实验及织物水洗的物理性能等测试标准。AATCC标准是纺织产品进入美国市场采用最为广泛的测试标准。AATCC测试标准在纤维含量测试方面有两个方法,AATCC20标准为纤维定性分析法;AATCC20A标准为纤维定量分析法。纤维定性分析中包括纤维纵向和横向截面显微镜观察法,燃烧法,密度法,溶解法,干捻法,粘色法,熔点法,红外光谱法。AATCC20A是纤维定量分析,包括显微镜分析法,化学溶解法和拆分法等。2我国标准与美国标准之间的差异我国对纺织产品的纤维含量测试是基于FZ/T 01057—2007《纺织纤维鉴别实验方法》和GB/T 2910《纺织品 定量化学分析》。在此之外还有行业协会和相关机构针对特殊产品编制的方法标准,如FZ/T 01095—2002《纺织品 氨纶产品纤维含量实验方法》、GB/T 16988—1997《特种动物纤维与绵羊毛混合物含量的测定》、FZ/T 30003—2009《麻棉混纺产品定量分析法》和FZ/T 01026—2009《定量化学分析 四组分纤维混合物》等。2.1纤维定性分析方法在所有检测机构中对纤维鉴别使用最为广泛的方法应该为显微镜观察法和溶解法,针对特殊的纤维还会辅助采用燃烧法、红外光谱法等,其他方法在实际检测过程中由于精准性和可操作性等原因,使用较少。现简单介绍几个定性分析方法的过程,以及差异。2.1.1显微镜观察法显微镜观察法依靠生物显微镜作为工具,通过技术人员直接观察纤维的纵向和横向截面,从而初步判断纤维的种类。一个经验丰富的技术人员,可以通过显微镜判断棉、麻、丝、毛等天然纤维,以及粘胶、氨纶等部分化学纤维。AATCC 20《纤维定性分析》标准和FZ/T 01057—2007《纺织纤维鉴别实验方法》,除了对每一种类纤维的纵向和横向外观形态进行语言描述之外,还提供了大量的纤维图片,给以更为直观的认知。2.1.2溶解法我国的行业标准FZ/T 01057.4—2007《纺织纤维鉴别实验方法 溶解法》要求一律采用常温(20℃~30℃)振荡5min,或煮沸3min之后观察样品的溶解情况。而AATCC20中溶解试验针对不同纤维溶解的难易程度提供了3种溶解时间,分别为5min,10min,20min。溶解温度除常温20℃之外还有50℃,90℃和煮沸。例如,二甲基甲酰胺法溶解确认试验,要求在90℃时处理10分钟之后再观察溶解现象。由于采用的溶解条件不同,某些特殊纤维的溶解现象会有所不同,检测人员应细心观察,注意区分。2.1.3干捻法AATCC20中用干捻法来初步判断麻类纤维。取平行纤维束,浸入水中,握住一端,使另一自由端对着观察者,在电炉上使用热空气加热,在纤维干燥的过程中,亚麻和苎麻纤维为顺时针旋转,大麻和黄麻纤维为逆时针旋转。2.2纤维定量分析方法GB/T2910—2009中除个别方法外均等同采用ISO1833最新版的方法,与美国标准体系有较多差异。美国AATCC20A标准中包含有含水率、非纤维物质去除、纤维含量拆分法、纤维含量化学分析法以及纤维含量显微镜分析法。而我国的纤维定量分析法根据方法的不同,有专门的标准与之对应。在进行国内纤维含量分析时要特别注意方法的选择,GB/T2910 为纤维定量化学分析法(附录中提供有手工拆分法),GB/T16988是针对动物纤维的显微镜分析法等等。2.2.1纤维定量化学分析法AATCC20A中提供了8种化学分析法:100%丙酮法、20%盐酸法、59.5%硫酸法、70%硫酸法、碱性次氯酸钠法、90%甲酸法、二甲基甲酰胺和二甲基乙酰胺法。而GB/T2910提供了23种化学分析法,覆盖了AATCC20A所有测试方法。现从样品准备、试剂选择、测试过程、数据处理等方面,分析两个方法体系之间的差异。1)样品准备(见表1)表1 备样方法比较步骤AATCC 20AGB/T 2910取样0.5~1.5g至少1g制样切成不大于3mm切成10mm左右烘干温度105~110℃(105±3)℃烘干时间至少1.5 h不少于4h,不超过16h冷却冷却至室温不少于2h称重精确至0.1mg精确至0.0002g恒重要求两次测量值在±0.001g无虽然在取样重量表述上有所不同,但是根据实际经验,两个标准的取样要求均能满足测试的代表性和准确性。在样品称重环节,AATCC明确要求样品烘干至恒重,并对恒重有明确的要求。而GB/T2910采用足够长的烘干时间,也能达到实际恒重的要求,但AATCC20A的可操作性更强些。2)试剂选择在进行相同的纤维含量分析过程中,AATCC与我国标准在溶解过程中试剂的选择有异同(见表 2)。表 2 部分方法的溶解试剂比较混纺类型AATCC 20AGB/T 2910醋酯纤维与其他纤维100%丙酮丙酮法聚酰胺纤维与其他纤维20%盐酸/90%甲酸甲酸法粘胶纤维与棉59.5%硫酸甲酸/氯化锌纤维素纤维与聚酯纤维70%硫酸硫酸蛋白质纤维与其他纤维次氯酸钠次氯酸钠腈纶、改性腈纶、氨纶和其他纤维二甲基甲酰胺/二甲基乙酰胺二甲基甲酰胺聚氨酯弹性纤维与其他纤维二甲基甲酰胺/二甲基乙酰胺二甲基乙酰胺[/td
食糖的糖分检测有什么简便检测方法可以用?现实标准太复杂了
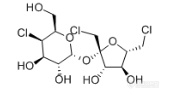
[align=center][b]GB 22255-2014 食品安全国家标准 食品中三氯蔗糖(蔗糖素)的测定——三氯蔗糖标准品分析-NQAD检测器[/b][/align]三氯蔗糖(TGS),是唯一以蔗糖为原料的功能性甜味剂,甜度可达蔗糖600倍。这种甜味剂具有无能量,甜度高,甜味纯正,高度安全等特点,是最优秀的功能性甜味剂之一。[align=center][img=,170,99]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011004470313_2453_2222981_3.png!w170x99.jpg[/img][/align][align=center]三氯蔗糖结构式[/align]本实验按照[b]《GB 22255-2014 食品安全国家标准 食品中三氯蔗糖(蔗糖素)的测定》[/b]方法,使用[b][color=#ff0000]高灵敏度气溶胶型检测器——纳克级水凝粒子计数检测器(NQAD)[/color][/b]对三氯蔗糖标准品进行了分析。色谱柱选择中等极性普适型[color=#3333ff][b]CAPCELL PAK C18 MGII S5 4.6 mm i.d. × 150 mm[/b][/color],得到结果如图1所示。三氯蔗糖保留时间为12.709min,[b]与标准谱图保留时间基本一致,理论塔板数为9992,不对称因子为1.06,峰形良好。[/b][align=center][b][img=,690,497]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011006155125_1559_2222981_3.png!w690x497.jpg[/img][/b][/align][align=center]图1 三氯蔗糖标准品分析色谱图[/align]*注:峰上标数字由下至上依次为保留时间、理论塔板数及不对称因子。[b][img=,633,176]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011006367633_3986_2222981_3.png!w633x176.jpg[/img]附图:GB方法中标准色谱图[/b][align=center][b][img=,690,448]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011007162573_9264_2222981_3.png!w690x448.jpg[/img][/b][/align][b][/b]接下来,按照国标要求配制三氯蔗糖工作液,浓度分别为0.02 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.4 mg/mL,进行线性考察实验。[b][color=#3333ff]由于NQAD检测器原理与常规蒸发光散射检测器ELSD不同,能够直接得到线性回归结果,不需要做对数方程,更加简单快捷。[/color][/b]线性结果如图2所示,R[sup]2[/sup]=0.996,得到良好线性结果。同时,我们根据标准曲线最低浓度的信噪比计算出定量限(以S/N=10计)约为3 μg/mL,[b][color=#ff0000]能够实现三氯蔗糖的高灵敏度检出[/color][/b]。[align=center][img=,658,399]http://ng1.17img.cn/bbsfiles/images/2018/03/201803011008425185_5014_2222981_3.png!w658x399.jpg[/img][/align][align=center]图2 三氯蔗糖标准曲线图[/align]
我最能进在做白砂糖的实验,结果不成功第一,我不知道加多少碘标准溶液,照上限22mL加的,结果可能过量的碘太多,用0.1mol/L的硫代硫酸钠滴了50mL,还是没有出现颜色变化。请问大家一般加多少碘就能保证其过量第二,我根据公式想推一下实验需要多少碘液,结果发现一个问题。公式R(%)=(A-B-I)*(0.001/10)*100A是加入碘液的量,B是滴定消耗的硫代硫酸钠的量 I是根据碘液体积查得的换算系数,结果在1.11-1.95之间假设我做的白砂糖的还原糖分是97%,带到R里,计算一下,结果A-B-I=9970,可是按标准规定,加入碘液的体积顶多22mL,所以根本算不出结果啊!!!!!!
急寻白砂糖蔗糖分的测定标准,或者国标。有相关注意事项最好。谢谢各位。
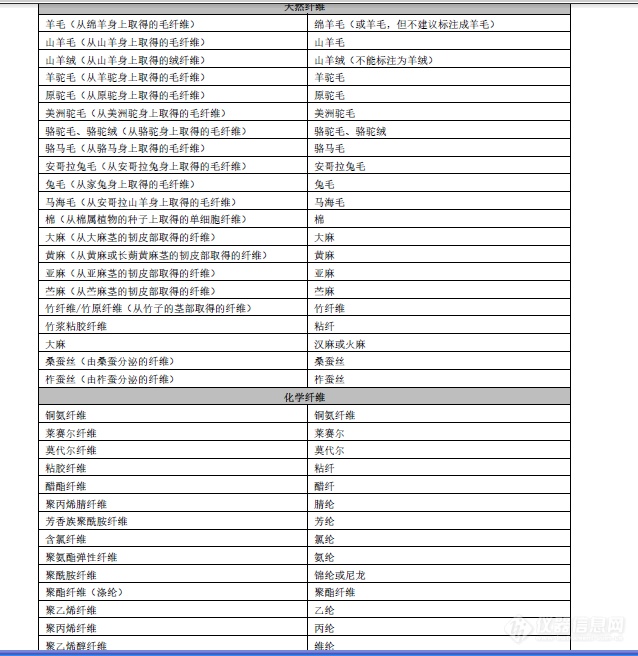
成分分析中常见纤维标准名称分享[img=,638,656]https://ng1.17img.cn/bbsfiles/images/2019/12/201912091357214265_8701_2154459_3.png!w638x656.jpg[/img]
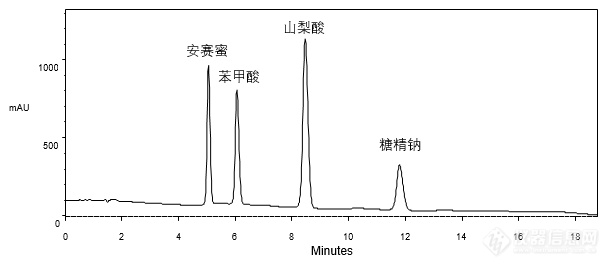
[align=center][b]GB 5009.28-2016食品安全国家标准 食品中苯甲酸、山梨酸和糖精钠的测定[/b][/align][align=center][b] ——标准品与乳品实际样品的分析[/b][/align][align=center][/align][align=left]本实验按照《GB5009.28-2016 食品安全国家标准食品中苯甲酸、山梨酸和糖精钠的测定》方法,分别对安赛蜜、苯甲酸、山梨酸、糖精钠的标准品混合溶液及加标乳品样品进行了分析。首先,使用CAPCELL PAK C[sub]18[/sub] MG S5 4.6 mm i.d. × 150mm色谱柱,对标准品混合溶液进行分析,如图1,安赛蜜、苯甲酸、山梨酸、糖精钠标准品均得到了良好的分析结果。[/align][align=left][/align][align=center][img=,611,268]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221532276656_9890_2222981_3.png!w611x268.jpg[/img][/align][align=center]图1 标准品混合溶液分析色谱图[/align][img=,400,200]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221532280132_6863_2222981_3.png!w400x200.jpg[/img][align=left][/align][align=left]其次,对乳品加标样品进行分析,如图2,糖精钠(Rt 12 min)与其后杂质峰之间未能取得基线分离,分离度仅为1.02。[/align][align=left][/align][align=center][img=,668,335]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221533054905_2223_2222981_3.png!w668x335.jpg[/img][/align][align=center]图2 加标乳品样品分析色谱图[/align][align=left][img=,406,203]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221533317202_2333_2222981_3.png!w406x203.jpg[/img][/align][align=left][/align][align=left]为改善糖精钠与杂质间的分离,在国标方法基础上,将流动相由[b]乙酸铵 / 甲醇 = 95 / 5[/b]调整为[b][b]乙酸铵 / 甲醇[/b][color=red]([/color][color=red]2 mmol/L [/color][color=red]甲酸)[/color]= 92 / 8[/b],再次对混合标准溶液和加标样品进行分析,结果如图3所示。[/align][align=left][/align][align=center][img=,690,545]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221534141056_4073_2222981_3.png!w690x545.jpg[/img][/align][align=center]图3 混标与加标乳品样品分析色谱图[/align][align=left][img=,464,171]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221535548985_7176_2222981_3.png!w464x171.jpg[/img][/align][align=left][/align][align=left]如图3,在酸性条件下,出峰顺序发生了变化,安赛蜜保留时间略有缩短,糖精钠保留时间明显缩短,由12 min缩短至8 min,苯甲酸和山梨酸保留时间分别延长至2 min和6 min;在分离度方面,糖精钠与苯甲酸之间分离度为2.79,苯甲酸与峰后杂质间分离度为2.04,所有色谱峰之间都达到了基线分离。[/align][align=left][/align][align=left]为使客户有更多选择,实验室又在国标原方法条件下继续筛选色谱柱,最终使用SUPERIOREX ODS S5 4.6 mm i.d. × 250 mm色谱柱时,仅微调有机相比例即可实现加标乳品样品的良好分析结果。如图4,杂质峰与糖精钠之间分离度达到2.48,达到基线分离要求。[/align][align=left][/align][align=center][img=,580,332]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221537130173_1058_2222981_3.png!w580x332.jpg[/img][/align][align=center]图4 加标乳品样品分析色谱图[/align][align=left]*注:峰上标所示数字由下至上依次为分离度与不对称因子。[/align][align=left][img=,326,177]http://ng1.17img.cn/bbsfiles/images/2018/03/201803221537540634_9437_2222981_3.png!w326x177.jpg[/img][/align][align=left][/align][align=left]综上所述,按照国标《GB 5009.28-2016 食品安全国家标准食品中苯甲酸、山梨酸和糖精钠的测定》方法进行分析,使用CAPCELL PAK C[sub]18 [/sub]MG色谱柱对标准品混合溶液能得到良好分析结果,但在对加标乳品样品进行分析时,糖精钠与样品中的杂质未能实现基线分离,通过在流动相中添加甲酸可实现安赛蜜、糖精钠、苯甲酸、山梨酸及杂质的基线分离;另一方面,使用SUPERIOREX ODS色谱柱,在原条件基础上微调即可实现乳品中安赛蜜、苯甲酸、山梨酸、糖精钠及杂质间的良好分离。[/align]
我想做液相,需要葡萄糖酸标准品,各位有做过的吗,给个建议。谢谢。另外,测酒中的糖份用液相的话,一般用什么柱子。我听说NH2柱,行吗?
GB/T 1549-2008 纤维玻璃化学分析方法国家标准