原料药中杂质分离和特征描述战略性方法
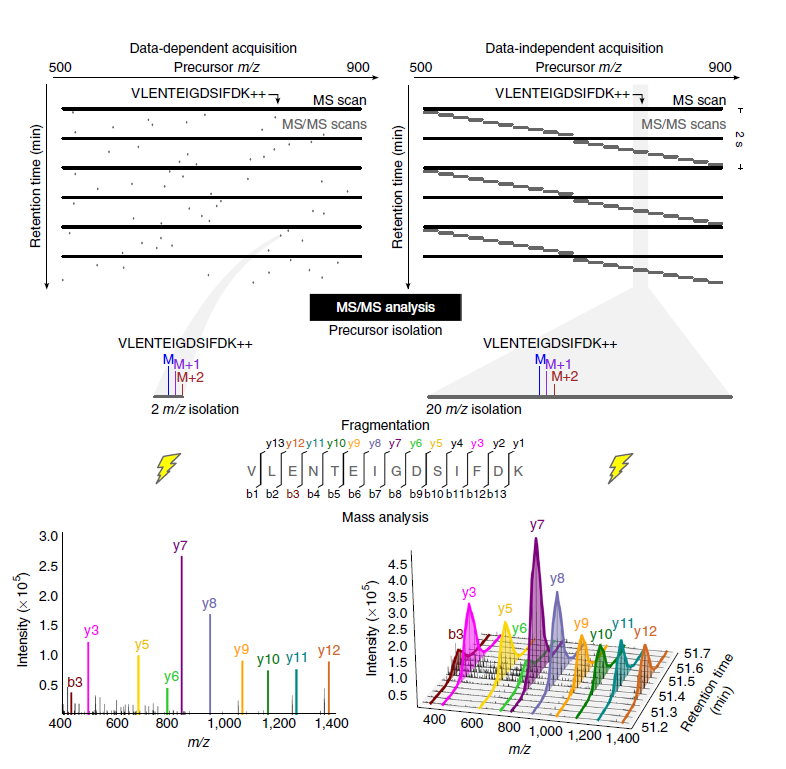
原料药中杂质的分离和特征描述的战略性方法 迈克尔 道. 琼斯, 玛丽安 特渥辛, 罗布 Plumb,宋相晋, 约翰 Shockcor, 乔斯 卡斯特罗 佩雷斯 和 安德鲁 奥宾 沃特世公司, 米尔福德市, 马萨诸塞州, 美国, 01757 简介 监测化合物中的杂质对于生产制剂和原料药的公司来说是有既得利益的,除了法规要求外,还有其它很多原因。杂质的鉴定可以帮助发现潜在未知的降解途径,虚假的过程/专利保护侵害,和/或遗传毒性影响。杂质的分析是劳动密集型的工作,包括方法开发,杂质分离技术和各种各样的分析方法,以得出所感兴趣杂质的真实结构。 这篇文章介绍了一种战略性的方法,该方法应用了高分离液相色谱理论和强制降解研究,以最大化生产原料药喹硫平中的杂质。高分离液质联用和核磁被用来解释结构。 方法学 分析 仪器: ACQUITY 超高效液相 色谱柱: ACQUITY UPLC™ BEH C18 规格: 100 x 2.1mm, 1.7µ m 流动相: A: 20mM Ammonium 碳酸氢铵, pH10 B: 乙腈 梯度: 见图 1 和 2 柱温: 650C 进样量: 3 µ L 检测器: ACQUITY PDA @ 250 nm ACQUITY SQD 扫描范围 100-1000amu 质谱条件 仪器: Waters® SYNAPT™ 软件: Masslynx™ 4.1 离子源: ES+ 毛细管电压 (kV): 3.2 提取电压 (V): 4.0 脱溶剂气温度 (0C): 350.0 源温度 (0C): 120.0 脱溶剂气流速 (L/Hr): 650.0 锁定质量: 300pg/µ L白氨酸/脑啡肽@ 50µ L/min 质谱/质谱参数设置 飞行时间 椎孔电压 (V): 15 碰撞能 (V): 变化从15到30 采集范围: 质谱 100 - 1000Da 质谱/质谱 50—600 Da 制备 沃特世质谱引导的纯化系统 泵 2454二元溶剂管理器 进样/收集器 2767 检测器 2998 光电二极管阵列 质谱 3100 色谱柱 100X19mm XBridge, 5 um 溶剂 A = 10 mm 碳酸氢铵 pH 10 溶剂 B = 乙腈 流速 25/mL/min 梯度 B 经过10分钟 从5% 到60% 95% 有机相保持5分钟 核磁 仪器参数见图9 观察,制备和分离 喹硫平的酸解 该杂质鉴定方法(以前建立的)被用来鉴定喹硫平原料药在0.1mol/L盐酸中降解的主要杂质。 图1: pH 9 的碳酸氢铵, ACQUITY BEH C18 2.1x100 mm 1.7um, 乙腈, 0.8mL/min. 650C, 20 分钟, 15-39%B到10.5分钟, 39-43%B到14.4分钟, 43-95%B到18分钟, 保持95%B到20分钟. 制备分离的准备 此方法为了更快的速度、更低的温度和更短的色谱柱,而进行了再优化,同时又能保持主要杂质和喹硫平间足够的分辨率 . 为什么呢? 在从超高效液相方法转换到制备型高效液相时,有些因素必须要考虑: 保持分离效率: L/dP (柱长度/颗粒度) 例如: 50 mm、1.7 um色谱柱的L/Dp为29,411,和具有30,000 L/Dp 值的150mm、5um制备柱等效 能使用更短的制备柱吗?在杂质402的分离中,100 mm的制备柱仍能提供足够的柱效以完全分离杂质。 在放大制备梯度中,对于制备流速,柱体积数必须保持合适的数值。如果这些因素都被考虑到,从超高效液相方法转换到制备型高效液相是能保证相似的选择性的。 从超高效液相放大到制备色谱 传统上, 从分析型高效液相放大到制备型高效液相使用同样的色谱柱长度和颗粒度,并运用下面的公式: Fp= Fa [(Dp)2]/[Da2] 注: Fp=制备柱的流速 Fa=分析柱的流速 Dp=制备柱的内径 Da=分析柱的内径 其它工具: Waters 制备放大计算器可以计算每个梯度段的时间,柱长度的变化和进样量。 聚焦梯度 *克利里等. 纯化过程中聚焦梯度的影响, Waters 应用文献 720002284EN 质谱引导的自动纯化 主要杂质m/z =402的分离在分析和化学上都很容易。 最大化产出: 8g/mL 喹硫平的储备液在 600C、0.1mol/L的盐酸中加热回流8小时, 以增加m/z=402 杂质的 产量 制备上样研究允许色谱柱进样20uL。 图3: 强制降解样品的制备色谱 仪器优势: 分离是通过Masslynx™ Fractionlynx™ 软件中的自动质量触发进行的。 ACQUITY BEH C18的方法可以无缝转换到XBridge C18 制备柱 通过超高效液相对感兴趣杂质的再优化可提供快速方法,以通过UPLC-SQD, UPLC-oaTof, 和/或UPLC MS/MS进一步确认分析 鉴定,确认和特征描述 分离的确认 通过质谱引导的纯化系统收集的m/z = 402的馏分被收集并挥干。该分离步骤得到了28.6mg m/z = 402的杂质。用甲醇稀释得到浓度为286µ g/mL和2.86µ g/mL的溶液,并用3分钟的UPLC-SQD方法进样以确认分离的质量 . 图4: 被分离杂质m/z=402的UPLC UV/SQD 确认 质量精度的重要性 杂质的质荷比为402,等于喹硫平(m/z = 384)加合了18 amu。样品进样到Waters SYNAPT™ MS可得到精确质量数以确认元素组成 . 图5: m/z = 402杂质的元素组成. 双键等价值(DBE) 、低的同位素匹配度(low i-Fit)、毫道(mDa)和结果都支持第一个分子式 加合可以在喹硫平结构中氧化一个点,同时减少一个双键 . 图6: 建议的结构. A.) 硫代氧化物 或 B.氮代氧化物 )? 氮代氧化物为基础的结构的确认 通常, 在低PH流动相的反相液相中,含有氮代氧化物杂质的化合物在原料药后被洗脱出来。超高效液相是在pH=9.0下进行的,所以使用pH=3.0的甲酸铵和乙腈的梯度检测速度变快 。 图7: 酸性流动相条件下进样时,酸降解喹硫平的洗脱顺序。因为感兴趣的峰在喹硫平原料药前被洗脱出来,所以氮代氧化物的可能性不大 . 质谱/质谱分析 精确质量数质谱/质谱分析是为了确认任何碎片数据的存在已进一步支持喹硫平的硫代氧化物降解形式。指示性的碎片最有可能是分子量很低的碎片,在那里所发生的裂解可以区分硫代氧化物和氮代氧化物。 图 8: 裂解分析显示了硫代氧化物/裂解为基础的结构。 通过分析m/z = 137.0063的碎片可得出: -元素组成是 C7 H5 O S -质量精度为 0.2毫道尔顿 -双键等价值(DBE) = 5.5, 对于环结构转换为4.5,而对于硫代氧化物为1.0。 如果N=C是完整的,由于四价碳缺少质子,所以不可能得到228.0480和175.1428的碎片 NMR 支持的数据 核磁数据和建议的结构是一致的 图 9: 被分离的喹硫平中m/z = 402杂质的C13-NMR and H-NMR 结论 从超高效液相转换到制备色谱 -保持L/Dp不变被证明是放大可能性的关键因素 -相容的化学性质可最小化分离度差异 -利用强制降解研究可增加最大化产出的潜能 -质谱引导的馏分收集可保证正确的杂质收集 杂质确认和说明 -ACQUITY UV/SQD 为很多的馏分组成提供快速确认 -高分辨率 SYNAPT MS为母离子和产物离子的元素组成确认提供很好的质量精度 -对于有显著不同色谱行为的结构,高/低PH值流动相测试可以帮助确定建议的结构 -尽管采集了核磁数据(不是决定性的),但它的精确质量质谱/质谱数据证明了杂质是硫代氧 化物而不是遗传毒性结构。