蛋白测序和质谱的区别
听说蛋白酶解肽段二级质谱图可以通过de novo方法测序,请问,除了手工解析,用哪些软件可以快速鉴定辅助解析
各位大侠,给支个招,哪里可以既做高效液相又蛋白测序啊?我的样品现在是两个成分混在一起,分子量又都很小,我想测序,可最好是先用HPLC分开再来测,哪家公司或者研究所提供这方面的服务啊?
大家好,氨基酸分析仪与蛋白质测序仪有主要区别在什么地方呢?目前实验室需要进行氨基酸的测序分析,究竟买一台蛋白质测序仪好呢,还是氨基酸分析仪好呢?价格大概有多少呢?这些仪器有没有国产的呢 QQ:2392795357
Edman降解法是测定蛋白质序列的经典方法,该方法由瑞士生物化学家佩尔维克托于1950年创立。Edman降解法通常是以周期的形式来表征。对于一个完整的周期,异硫氰酸苯酯标记上指定肽段的N末端,环化,之后被标记的氨基酸在酸性条件下从肽链中游离出来,进一步酸化后形成一个更加稳定的乙内酰苯硫脲-氨基酸(PTH-AA)衍生物。PTH-AA衍生物可以通过高效液相色谱鉴定。埃德曼降解周期就是通过反复地将多肽的氨基酸依次降解下来,从而鉴定氨基酸序列。 1982年,美国应用生物系统(ABI)公司了将第一台商用自动多肽测序仪推向市场,并被实践证明是可靠和耐用的。实际上,在过去几十年中,自动多肽测序仪只有屈指可数的一些改进,但此类自动肽测序仪仍是测定肽序列的黄金标准。然而,串联质谱的使用已经成为日益重要的肽序列测定工具。质谱,特别是串联飞行时间(TOF-TOF 和QTOF)质谱仪可以对少量样本进行更快速的分析。 与质谱相比,自动Edman降解测序的明显优势在于:已被化学验证的精确性、系统初始投资较小 然而,它的缺点是:分析时间较长、测得序列数有限,典型的测量长度范围是20~50个氨基酸序列。而对于低丰度的肽、无法获得N末端的肽,或者需要更短的分析时间,质谱则是理想的工具。但是,质谱价格高且无法区分同分异构的氨基酸。 虽然美国应用生物系统(ABI)公司主导了自动多肽测序仪的市场,但由于市场疲软,ABI于2008年6月停止生产自动多肽测序仪。然而岛津公司看准了机会,在2009年匹兹堡会议上将其PPSQ自动多肽测序仪推向北美市场,PPSQ已在日本广泛应用超过20年。另一方面,对用质谱测定蛋白质序列的方法改进的需求保持旺盛,布鲁克道尔顿公司最近推出了Edmass Micro MALDI-TOF和 Edmass Ultra TOF-TOF 系统,这是专门为没有质谱使用经验的多肽化学家们设计的。 自动多肽测序仪的市场主要来自于科研机构,但过去几年中自动多肽测序仪的市场需求增长处于某种停滞状态,尤其是质谱变得容易获得。但是,随着肽自动测序仪在连续使用过程中的老化,Edamn化学家们正在准备购买新设备。售后服务、附件、耗材及试剂有望在短期内对自动多肽测序仪市场产生推动作用。
传统的蛋白鉴定方法,如免疫印迹法、内肽的化学测序、已知或未知蛋白的comigration分析,或者在一个有机体中有意义的基因的过表达通常耗时、耗力,不适合高流通量的筛选。 目前,所选用的技术包括对于蛋白鉴定的图象分析、微量测序、进一步对肽片段进行鉴定的氨基酸组分分析和与质谱相关的技术。1 图象分析技术(Image analysis)“满天星”式的2-DE图谱分析不能依靠本能的直觉,每一个图象上斑点的上调、下调及出现、消失,都可能在生理和病理状态下产生,必须依靠计算机为基础的数据处理,进行定量分析。 在一系列高质量的2-DE凝胶产生(低背景染色,高度的重复性)的前提下,图象分析包括斑点检测、背景消减、斑点配比和数据库构建。 首先,采集图象通常所用的系统是电荷耦合CCD(charge coupled device)照相机;激光密度仪(laser densitometers)和Phospho或Fluoroimagers,对图象进行数字化。 并成为以象素(pixels)为基础的空间和网格。 其次,在图象灰度水平上过滤和变形,进行图象加工,以进行斑点检测。 利用Laplacian,Gaussian,DOG(difference of Gaussians) opreator使有意义的区域与背景分离,精确限定斑点的强度、面积、周长和方向。图象分析检测的斑点须与肉眼观测的斑点一致。 在这一原则下,多数系统以控制斑点的重心或最高峰来分析,边缘检测的软件可精确描述斑点外观,并进行边缘检测和邻近分析,以增加精确度。 通过阈值分析、边缘检测、销蚀和扩大斑点检测的基本工具还可恢复共迁移的斑点边界。 以PC机为基础的软件Phoretix-2D正挑战古老的Unix为基础的2-D分析软件包。 第三,一旦2-DE图象上的斑点被检测,许多图象需要分析比较、增加、消减或均值化。 由于在2-DE中出现100%的重复性是很困难的,由此凝胶间的蛋白质的配比对于图象分析系统是一个挑战。 IPG技术的出现已使斑点配比变得容易。 因此,较大程度的相似性可通过斑点配比向量算法在长度和平行度观测。 用来配比的著名软件系统包括Quest,Lips,Hermes,Gemini等,计算机方法如相似性、聚类分析、等级分类和主要因素分析已被采用,而神经网络、子波变换和实用分析在未来可被采用。 配比通常由一个人操作,其手工设定大约50个突出的斑点作为“路标”,进行交叉配比。 之后,扩展至整个胶。例如:精确的PI和MW(分子量)的估计通过参考图上20个或更多的已知蛋白所组成的标准曲线来计算未知蛋白的PI和MW。 在凝胶图象分析系统依据已知蛋白质的pI值产生PI网络,使得凝胶上其它蛋白的PI按此分配。 所估计的精确度大大依赖于所建网格的结构及标本的类型。 已知的未被修饰的大蛋白应该作为标志,变性的修饰的蛋白的PI估计约在±0。25个单位。 同理,已知蛋白的理论分子量可以从数据库中计算,利用产生的表观分子量的网格来估计蛋白的分子量。 未被修饰的小蛋白的错误率大约30%,而翻译后蛋白的出入更大。 故需联合其他的技术完成鉴定。2 微量测序(microsequencing)蛋白质的微量测序已成为蛋白质分析和鉴定的基石,可以提供足够的信息。 尽管氨基酸组分分析和肽质指纹谱(PMF)可鉴定由2-DE分离的蛋白,但最普通的N-末端Edman降解仍然是进行鉴定的主要技术。 目前已实现蛋白质微量测序的自动化。 首先使经凝胶分离的蛋白质直接印迹在PVDF膜或玻璃纤维膜上,染色、切割,然后直接置于测序仪中,可用于subpicomole水平的蛋白质的鉴定。 但有几点需注意:Edman降解很缓慢,序列以每40 min 1个氨基酸的速率产生;与质谱相比,Edman降解消耗大;试剂昂贵,每个氨基酸花费
大家好,我们这里现有一个分子量为11kd的蛋白质想要对其进行二级结构的核磁测序,但由于分子量相对比较大,我联系了国内的很多大学和科研机构都不能完成,因为我赶着毕业所以急需可以做这种检测的单位. 我希望大家可以向我提供对外可以做这么大分子量蛋白质核磁测序的单位,我们愿意付费对该蛋白质进行核磁测序. 对您的帮助表示万分感谢!! 谢谢谢谢谢谢!!!! 我的邮箱:lzjqq001@yahoo.com.cn
几种常用的蛋白鉴定方法传统的蛋白鉴定方法,如免疫印迹法、内肽的化学测序、已知或未知蛋白的comigration分析,或者在一个有机体中有意义的基因的过表达通常耗时、耗力,不适合高流通量的筛选。 目前,所选用的技术包括对于蛋白鉴定的图象分析、微量测序、进一步对肽片段进行鉴定的氨基酸组分分析和与质谱相关的技术。1 图象分析技术(Image analysis)“满天星”式的2-DE图谱分析不能依靠本能的直觉,每一个图象上斑点的上调、下调及出现、消失,都可能在生理和病理状态下产生,必须依靠计算机为基础的数据处理,进行定量分析。 在一系列高质量的2-DE凝胶产生(低背景染色,高度的重复性)的前提下,图象分析包括斑点检测、背景消减、斑点配比和数据库构建。 首先,采集图象通常所用的系统是电荷耦合CCD(charge coupled device)照相机;激光密度仪(laser densitometers)和Phospho或Fluoroimagers,对图象进行数字化。 并成为以象素(pixels)为基础的空间和网格。 其次,在图象灰度水平上过滤和变形,进行图象加工,以进行斑点检测。 利用Laplacian,Gaussian,DOG(difference of Gaussians) opreator使有意义的区域与背景分离,精确限定斑点的强度、面积、周长和方向。图象分析检测的斑点须与肉眼观测的斑点一致。 在这一原则下,多数系统以控制斑点的重心或最高峰来分析,边缘检测的软件可精确描述斑点外观,并进行边缘检测和邻近分析,以增加精确度。 通过阈值分析、边缘检测、销蚀和扩大斑点检测的基本工具还可恢复共迁移的斑点边界。 以PC机为基础的软件Phoretix-2D正挑战古老的Unix为基础的2-D分析软件包。 第三,一旦2-DE图象上的斑点被检测,许多图象需要分析比较、增加、消减或均值化。 由于在2-DE中出现100%的重复性是很困难的,由此凝胶间的蛋白质的配比对于图象分析系统是一个挑战。 IPG技术的出现已使斑点配比变得容易。 因此,较大程度的相似性可通过斑点配比向量算法在长度和平行度观测。 用来配比的著名软件系统包括Quest,Lips,Hermes,Gemini等,计算机方法如相似性、聚类分析、等级分类和主要因素分析已被采用,而神经网络、子波变换和实用分析在未来可被采用。 配比通常由一个人操作,其手工设定大约50个突出的斑点作为“路标”,进行交叉配比。 之后,扩展至整个胶。例如:精确的PI和MW(分子量)的估计通过参考图上20个或更多的已知蛋白所组成的标准曲线来计算未知蛋白的PI和MW。 在凝胶图象分析系统依据已知蛋白质的pI值产生PI网络,使得凝胶上其它蛋白的PI按此分配。 所估计的精确度大大依赖于所建网格的结构及标本的类型。 已知的未被修饰的大蛋白应该作为标志,变性的修饰的蛋白的PI估计约在±0。25个单位。 同理,已知蛋白的理论分子量可以从数据库中计算,利用产生的表观分子量的网格来估计蛋白的分子量。 未被修饰的小蛋白的错误率大约30%,而翻译后蛋白的出入更大。 故需联合其他的技术完成鉴定。2 微量测序(microsequencing)蛋白质的微量测序已成为蛋白质分析和鉴定的基石,可以提供足够的信息。 尽管氨基酸组分分析和肽质指纹谱(PMF)可鉴定由2-DE分离的蛋白,但最普通的N-末端Edman降解仍然是进行鉴定的主要技术。 目前已实现蛋白质微量测序的自动化。 首先使经凝胶分离的蛋白质直接印迹在PVDF膜或玻璃纤维膜上,染色、切割,然后直接置于测序仪中,可用于subpicomole水平的蛋白质的鉴定。 但有几点需注意:Edman降解很缓慢,序列以每40 min 1个氨基酸的速率产生;与质谱相比,Edman降解消耗大;试剂昂贵,每个氨基酸花费3~4$。 这都说明泛化的Edman降解蛋白质不适合分析成百上千的蛋白质。 然而,如果在一个凝胶上仅有几个有意义的蛋白质,或者如果其他技术无法测定而克隆其基因是必需的,则需要进行泛化的Edman降解测序。近来,应用自动化的Edman降解可产生短的N-末端序列标签,这是将质谱的序列标签概念用于Edman降解,业已成为一种强有力的蛋白质鉴定。 当对Edman的硬件进行简单改进,以迅速产生N-末端序列标签达10~20个/d,序列检签将适于在较小的蛋白质组中进行鉴定。若联合其他的蛋白质属性,如氨基酸组分分析、肽质质量、表现蛋白质分子量、等电点,可以更加可信地鉴定蛋白质。 选择BLAST程序,可与数据库相配比。 目前,采用一种Tagldent的检索程序,还可以进行种间比较鉴定,又提高了其在蛋白质组研究中的作用。3 与质谱(mass spectrometry)相关的技术质谱已成为连接蛋白质与基因的重要技术,开启了大规模自动化的蛋白质鉴定之门。 用来分析蛋白质或多肽的质谱有两个主要的部分,1)样品入机的离子源,2)测量被介入离子的分子量的装置。 首先是基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF)为一脉冲式的离子化技术。 它从固相标本中产生离子,并在飞行管中测其分子量。 其次是电喷雾质谱(ESI-MS),是一连续离子化的方法,从液相中产生离子,联合四极质谱或在飞行时间检测器中测其分子量。 近年来,质谱的装置和技术有了长足的进展。在MALDI-TOF中,最重要的进步是离子反射器(ion reflectron)和延迟提取(delayed ion extraction),可达相当精确的分子量。 在ESI-MS中,纳米级电雾源(nano-electrospray source)的出现使得微升级的样品在30~40 min内分析成为可能。将反相液相色谱和串联质谱(tandem MS)联用,可在数十个picomole的水平检测;若利用毛细管色谱与串联质谱联用,则可在低picomole到高femtomole水平检测;当利用毛细管电泳与串联质谱连用时,可在小于femtomole的水平检测。 甚至可在attomole水平进行。 目前多为酶解、液相色谱分离、串联质谱及计算机算法的联合应用鉴定蛋白质。 下面以肽质指纹术和肽片段的测序来说明怎样通过质谱来鉴定蛋白质。(1)肽质指纹术(peptide mass fingerprint, PMF)由Henzel等人于1993年提出。 用酶(最常用的是胰酶)对由2-DE分离的蛋白在胶上或在膜上于精氨酸或赖氨酸的C-末端处进行断裂,断裂所产生的精确的分子量通过质谱来测量(MALDI-TOF-MS,或为ESI-MS),这一技术能够完成的肽质量可精确到0。1个分子量单位。 所有的肽质量最后与数据库中理论肽质量相配比(理论肽是由实验所用的酶来“断裂”蛋白所产生的)。 配比的结果是按照数据库中肽片段与未知蛋白共有的肽片段数目作一排行榜,“冠军”肽片段可能代表一个未知蛋白。若冠亚军之间的肽片段存在较大差异,且这个蛋白可与实验所示的肽片段覆盖良好,则说明正确鉴定的可能性较大。(2)肽片段(peptide fragment)的部分测序肽质指纹术对其自身而言,不能揭示所衍生的肽片段或蛋白质。 为进一步鉴定蛋白质,出现了一系列的质谱方法用来描述肽片段。 用酶或化学方法从N-或C-末端按顺序除去氨基酸,形成梯形肽片段(ladder peptide)。 首先以一种可控制的化学模式从N-末端降解,可产生大小不同的一系列的梯形肽片段,所得一定数目的肽质量由MALDI-TOF-MS测量。 另一种方法涉及羧基肽酶的应用,从C-末端除去不同数目的氨基酸形成肽片段。 化学法和酶法可产生相对较长的序列,其分子量精确至以区别赖氨酸(128。09)和谷氨酰胺(128。06)。 或者,在质谱仪内应用源后衰变(post-source decay, PSD)和碰撞诱导解离(collision-induced dissociation, CID),目的是产生包含有仅异于一个氨基酸残基质量的一系列肽峰的质谱。 因此,允许推断肽片段序列。 肽片段PSD的分析在MALDI反应器上能产生部分序列信息。 首先进行肽质指纹鉴定。 之后,一个有意义的肽片段在质谱仪被选作“母离子”,在飞行至离子反应器的过程中降解为“子离子”。 在反应器中,用逐渐降低的电压可测量至检测器的不同大小的片段。 但经常产生不完全的片段。 现在用肽片段来测序的方法始于70年代末的CID,可以一个三联四极质谱ESI-MS或MALDI-TOF-MS联合碰撞器内来完成。 在ESI-MS中,由电雾源产生的肽离子在质谱仪的第一个四极质谱中测量,有意义的肽片段被送至第二个四极质谱中,惰性气体轰击使其成为碎片,所得产物在第三个四极质谱中测量。 与MALDI-PSD相比,CID稳定、强健、普遍,肽离子片段基本沿着酰胺键的主架被轰击产生梯形序列。 连续的片段间差异决定此序列在那一点的氨基酸的质量。 由此,序列可被推测。 由CID图谱还可获得的几个序列的残基,叫做“肽序列标签”。 这样,联合肽片段母离子的分子量和肽片段距N- C端的距离将足以鉴定一个蛋白质。4 氨基酸组分分析1977年首次作为鉴定蛋白质的一种工具,是一种独特的“脚印”技术。 利用蛋白质异质性的氨基酸组分特征,成为一种独立于序列的属性,不同于肽质量或序列标签。 Latter首次表明氨基酸组分的数据能用于从2-DE凝胶上鉴定蛋白质。 通过放射标记的氨基酸来测定蛋白质的组分,或者将蛋白质印迹到PVDF膜上,在15
传统的蛋白鉴定方法,如免疫印迹法、内肽的化学测序、已知或未知蛋白的comigration分析,或者在一个有机体中有意义的基因的过表达通常耗时、耗力,不适合高流通量的筛选。 目前,所选用的技术包括对于蛋白鉴定的图象分析、微量测序、进一步对肽片段进行鉴定的氨基酸组分分析和与质谱相关的技术。1 图象分析技术(Image analysis)“满天星”式的2-DE图谱分析不能依靠本能的直觉,每一个图象上斑点的上调、下调及出现、消失,都可能在生理和病理状态下产生,必须依靠计算机为基础的数据处理,进行定量分析。 在一系列高质量的2-DE凝胶产生(低背景染色,高度的重复性)的前提下,图象分析包括斑点检测、背景消减、斑点配比和数据库构建。 首先,采集图象通常所用的系统是电荷耦合CCD(charge coupled device)照相机;激光密度仪(laser densitometers)和Phospho或Fluoroimagers,对图象进行数字化。 并成为以象素(pixels)为基础的空间和网格。 其次,在图象灰度水平上过滤和变形,进行图象加工,以进行斑点检测。 利用Laplacian,Gaussian,DOG(difference of Gaussians) opreator使有意义的区域与背景分离,精确限定斑点的强度、面积、周长和方向。图象分析检测的斑点须与肉眼观测的斑点一致。 在这一原则下,多数系统以控制斑点的重心或最高峰来分析,边缘检测的软件可精确描述斑点外观,并进行边缘检测和邻近分析,以增加精确度。 通过阈值分析、边缘检测、销蚀和扩大斑点检测的基本工具还可恢复共迁移的斑点边界。 以PC机为基础的软件Phoretix-2D正挑战古老的Unix为基础的2-D分析软件包。 第三,一旦2-DE图象上的斑点被检测,许多图象需要分析比较、增加、消减或均值化。 由于在2-DE中出现100%的重复性是很困难的,由此凝胶间的蛋白质的配比对于图象分析系统是一个挑战。 IPG技术的出现已使斑点配比变得容易。 因此,较大程度的相似性可通过斑点配比向量算法在长度和平行度观测。 用来配比的著名软件系统包括Quest,Lips,Hermes,Gemini等,计算机方法如相似性、聚类分析、等级分类和主要因素分析已被采用,而神经网络、子波变换和实用分析在未来可被采用。 配比通常由一个人操作,其手工设定大约50个突出的斑点作为“路标”,进行交叉配比。 之后,扩展至整个胶。例如:精确的PI和MW(分子量)的估计通过参考图上20个或更多的已知蛋白所组成的标准曲线来计算未知蛋白的PI和MW。 在凝胶图象分析系统依据已知蛋白质的pI值产生PI网络,使得凝胶上其它蛋白的PI按此分配。 所估计的精确度大大依赖于所建网格的结构及标本的类型。 已知的未被修饰的大蛋白应该作为标志,变性的修饰的蛋白的PI估计约在±0。25个单位。 同理,已知蛋白的理论分子量可以从数据库中计算,利用产生的表观分子量的网格来估计蛋白的分子量。 未被修饰的小蛋白的错误率大约30%,而翻译后蛋白的出入更大。 故需联合其他的技术完成鉴定。
请问生物育种、基因测序、蛋白质 这些方面有哪些仪器啊?这些有关生物学方面的知识我一点都不明白。就连这个问题问的对不对,我都不知道!
蛋白质结构分析:制备、鉴定与微量测序
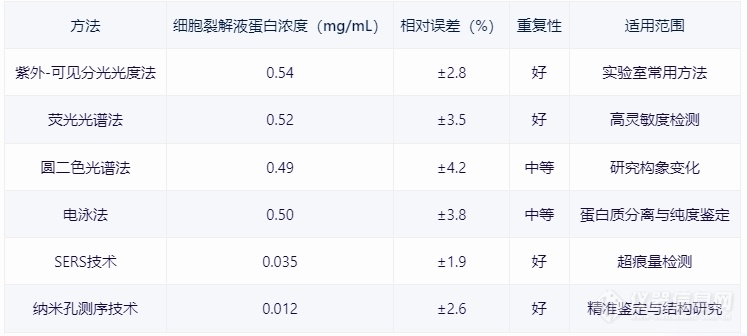
[b][font=宋体]一、引言[/font][/b][font=宋体] [/font][font=宋体]蛋白质浓度测定是生物化学实验中的一项基本操作,对于了解蛋白质的性质、评估实验效果以及开展生物学研究具有重要意义。本文将详细介绍蛋白浓度测定的方法、技术原理、最新进展及其在生物医学研究中的应用。[/font][font=宋体] [/font][b][font=宋体]二、蛋白浓度测定方法概述[/font][/b][font=宋体] [/font][font=宋体][font=宋体]①紫外[/font][font=Calibri]-[/font][font=宋体]可见分光光度法[/font][/font][font=宋体]原理:利用蛋白质中特定氨基酸(如酪氨酸、色氨酸)在紫外光区的吸收特性,通过测量吸光度值来计算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:适用于大多数蛋白质的测定,尤其在实验室中广泛使用。[/font][font=宋体] [/font][font=宋体]②荧光光谱法[/font][font=宋体]原理:利用荧光染料与蛋白质结合后产生的荧光光谱,通过测量荧光强度来计算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:适用于具有荧光特性的蛋白质,具有高灵敏度。[/font][font=宋体] [/font][font=宋体]③圆二色光谱法[/font][font=宋体]原理:利用圆二色光谱分析蛋白质的构象变化,从而推算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:常用于研究蛋白质的构象变化和稳定性。[/font][font=宋体] [/font][font=宋体]④电泳法[/font][font=宋体]原理:利用电泳技术将蛋白质分离,通过测量电泳带亮度或面积来计算蛋白质浓度。[/font][font=宋体] [/font][font=宋体]应用:常用于蛋白质分离和纯度鉴定。[/font][font=宋体] [/font][b][font=宋体]三、进展与技术优化[/font][/b][font=宋体] [/font][font=宋体][font=宋体]①表面增强拉曼散射([/font][font=Calibri]SERS[/font][font=宋体])技术[/font][/font][font=宋体]原理:利用金属表面增强拉曼散射效应,提高信号强度,从而提高检测灵敏度。[/font][font=宋体] [/font][font=宋体]应用:适用于痕量蛋白质的检测,具有高灵敏度和高分辨率。[/font][font=宋体] [/font][font=宋体]②纳米孔测序技术[/font][font=宋体]原理:利用纳米孔测序技术对蛋白质进行测序,通过电导变化检测蛋白质序列信息。[/font][font=宋体] [/font][font=宋体]应用:有助于蛋白质的精准鉴定和分子结构研究。[/font][font=宋体] [/font][font=宋体][b]四、[/b][/font][b][font=宋体]实际应用案例分析[/font][/b][font=宋体] [/font][align=center][img=蛋白浓度测定案例,690,310]https://ng1.17img.cn/bbsfiles/images/2024/01/202401231537106869_2656_5907840_3.png!w690x310.jpg[/img][font=宋体] [/font][/align][font=宋体][font=宋体]详情可以关注义翘神州更多[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url]详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[摘要] 质谱对于现代蛋白质化学研究是一项重要的技术。也可用于蛋白组分析,在同一时间监控上千种蛋白的表达情况。首先蛋白质混合物可以用双向凝胶电泳分开,再用质谱及随后的蛋白质数据库检索对单个蛋白进行鉴定和分析。最近几年,质谱领域取得了令人鼓舞的进展,使得全自动、高通量的蛋白检测成为可能。质谱也可以用来分析蛋白的转录后调节以及研究蛋白质复合体。本文将介绍目前蛋白组研究中质谱方法的应用并对其优缺点进行讨论。关键词: 质谱;二维电泳(2-DE);蛋白组分析MALDI-TOF1 前 言蛋白组学是研究生物特定组织或细胞内表达的所有蛋白质成分,蛋白质组的一门学科。蛋白组分析一般是用双向凝胶电泳(2-DE),质谱(MS)以及数据检索来完成。2-DE要回顾到20世纪70年代初[1],但是用质谱技术对蛋白质进行鉴定和分析是在近十年内才成为可能。其中最重要的一个原因是新的软离子技术即基质辅助激光解析电离(MALDI)[2]和电喷雾电离(ESI)[3,4]技术的发展和应用,以及样本制备技术和质谱仪的发展等。从数据库中获得成指数上升的序列信息也促进了质谱技术的发展。跟转录组学中的全自动DNA微阵列技术相比,蛋白组分析需要更多的手工操作,尤其在2-DE上会出现很多问题[5,6]。尽管存在很多困难,蛋白组学的重要性还是公认的。DNA微阵列技术是建立在对mRNA稳定水平的检测上,然而蛋白组学研究的对象是细胞中最活跃的因子——蛋白质。最近有研究证明,mRNA的表达和蛋白的水平并非具有相关性[7,8]。蛋白质有转录后修饰过程,并会以不同的形式出现。而这些修饰过程是相应的DNA测序技术所不能预测的。质谱技术在蛋白质修饰分析过程中具有重要的作用。2 质谱对蛋白质的检测质谱仪是由离子源,质量分析,离子检测器,以及数据检索等单元组成。首先,被分析的分子在离子源中被离子化,然后在质量分析器里根据不同的质荷比分开,再对分开的离子进行检测。随着MALDI和EIS的出现,质谱技术已经广泛用来分析蛋白质。质量分析器有很多种,最常用的方法是将飞行时间检测器(TOF)与MALDI或三级四级串联质谱仪联用,或者将四级杆-TOF,离子阱等连接到ESI上。蛋白组分析中,可以用两种不同的方法检测电泳分离后的单个蛋白质。最简单的方法叫做肽指纹谱测定(PMF)[9~13]。这个方法是用特殊的酶对2-DE分离后的蛋白质点进行降解,产生的肽从凝胶中分离出来后再用质谱分析和检测肽的分子量。数据库检测能够产生所有蛋白质理论上的PMF,把它们和质谱分析所获得的肽片进行比较就可以得出结果。第二种方法是在质谱仪中把凝胶分离后的肽分解成片段,产生局部的氨基酸序列(序列标签)。那么就可以用分子量或者序列信息进行数据库检索[14,15]。PMF一般用MALDI-TOF来实现,序列标签可以用串联质谱技术MS-MS进行检测[16~18]。用质谱检测蛋白的灵敏性可以精确到飞摩的水平,甚至已有报道其精确度可以达到阿摩水平[19]。3 用MALDI-TOF进行肽指纹谱分析凝胶分离后的蛋白质鉴定以及肽指纹谱分析是目前质谱实验室常规使用的方法。在进行MALDI分析之前需要最优化的凝胶上消化[20~22]和脱盐过程。胰岛素是最常用的凝胶消化酶,因为它在赖氨酸和精氨酸位点能够特异性切割蛋白质,产生分子量在600~2500Da之间的小分子肽,并能够从凝胶上有效的分离出来。MALDI-TOF是质谱技术中相对简单并很容易使用的一种方式,对样本中的盐和其他污染物有很高的耐受性,这点优于ESI。提取的肽片混合物中较小的片段可以直接沉积在靶板上做PMF分析,剩下的样本可以储存起来作为以后的ESI-MS分析。如果经凝胶分离后所有的肽全用来做MALDI分析,那么样本经脱盐以后将会取得更好的结果。脱盐的过程可以用商品化的试剂盒ZipTip(Millipore),或者在凝胶电泳仪的末端放置一个小的逆向塑料柱来实现[23,24]。PMF中非常重要的一个因素就是质谱测量分子量的准确度[25]。现代的MALDI-TOF仪都具有延迟取样反射器装置,用它们检测的肽段分子量可以精确到10~30ppm。这样的精确度使得4~5个肽段足以清楚的鉴定蛋白质的分子量。MALDI产生的大多数都是单电荷离子,所以它的图谱很容易解释。4 肽质指纹谱分析的自动化为了实现高通量蛋白检测,样本准备,质谱检测,资料分析和数据检索必须实现自动化操作。目前有些实验室用机器人对蛋白质进行自动化取点,凝胶上消化,样本脱盐以及对MALDI平板进行定点测定等。而且,现代化的MALDI-TOF仪完全能够让MALDI检测自动化。资料分析和数据检索过程同样可以自动化。在进行蛋白组分析时,如果在凝胶上不用单个分离就可以对所有蛋白质进行鉴定将是非常具有诱惑力的。为此,研究人员做了很多努力,由Hochestrasser及其同事建立了一套称作分子探测术的方法(molecular scanner)[26,27]。它是将整个2-DE胶上蛋白质样本同时酶解,并将酶解片段一起原位转移至另一张膜上,再直接用MALDI- TOF 质谱对膜上样本进行整体扫描,为实现蛋白质组学研究的自动化、规模化以及临床应用提供了一个崭新的思路和方法。这种思路的优点是显而易见的,不过按照目前的方法,要普及此种技术主要的难点是,质谱扫描一张图谱所需的时间过长,如用0.4mm的精度扫描一张4cm×4cm的膜需55个小时,这就意味着一张16cm×16cm的常用膜的扫描,至少需要36天不间断的工作和大约40G的磁盘空间存储如此庞大的原始数据。5 用ESI-MS/MS的方法创建序列标签只有当被消化的蛋白存在于已有的蛋白或基因组数据库中,并且能从MALDI分析器中得到四五个肽片的数据才能成功进行。如果在EST数据库中只有目的蛋白的部分序列,那么就需要知道肽片的序列信息。创建序列标签的优势在于,用肽的分子量和序列作为数据库检索对象比只用分子量作为检索对象具有更高的特异性。有了序列标签信息后,也可以用EST数据库进行检索[28]。通常来自于一个肽上的序列标签就足以鉴定蛋白质。同MALDI相比,纳升-ESI-MS/MS费时费力,而且在做ESI分析之前必须对样本进行脱盐处理。这些问题可以通过ESI-MS与HPLC联用得到解决。做ESI分析对样本浓度很敏感,用现代化的纳升-HPLC方法可以提供很高的局部肽片凝聚物,分离后的样本可以直接用于质谱分析,而不需要再分解。当分析混合物的时候,在质谱之前做LC分离尤其重要,因为它使得数据依赖的实验(DDE)成为可能,在DDE中,所有的离子都进入检测器进行测量,如果从HPLC到质谱之间出现一个峰的话,软件将自动从质谱转换到MS/MS模式并对产生的离子进行扫描。跟纳升-ESI相比,用这个方法可以从一份标本产生更多的MS/MS数据。Yates等已经详细叙述了如何进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS全自动蛋白检测的策略[29]。
http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378379551.jpg 氨基酸是蛋白质的基础组成单位,通过研究蛋白质中氨基酸的性质和组成来预测蛋白质的结构和功能,蛋白质氨基酸残基组成分析主要是通过氨基酸分析仪来完成的,本文推荐了2个基于氨基酸组成进行蛋白质预测软件。基于氨基酸组成的蛋白质预测软件根据组成蛋白质的20种氨基酸的物理和化学性质可以辨析电泳等实验中的未知蛋白质,也可以分析已知蛋白质的物化性质。ExPASy工具包包涵的程序:AACompIdent:与把氨基酸序列在SWISS-PROT库中搜索不同,AACompIdent工具利用未知蛋白的氨基酸组成去确认具有相同组成的已知蛋白。该程序分析时需提交的相关信息包括:蛋白质的氨基酸组成、等电点pI和分子量(如果知道)、正确的物种分类及特别的关键词。此外,用户还需在六种氨基酸“组合”中作出选择,这影响到分析如何进行。例如,某种“组合”会把残基Asp/Asn(D/N)和Gln/Glu(Q/E)组合成 Asx(B)和Glx(Z);或者某种残基会在分析中被完全除去。对数据库中的每一个蛋白序列,算法会对其氨基酸组成与所查询的氨基酸组成的差异打分。由电子邮件返回的结果被组织成三级列表:第一张列表中的蛋白都基于特定的物种分类而不考虑pI和分子量;第二张列表包含了不考虑物种分类、pI和分子量的全体蛋白;第三张列表中的蛋白不但基于特定物种分类,并且将 pI和分子量也考虑在内。虽然计算所得结果各不相同,但零分表明了该序列与提出的组成完全相符。AACompSim:AACompIdent的一个变种,AACompSim提供类似的分析,但与前者以实验所得的氨基酸组成为依据进行搜索不同,后者使用SWISS-PROT中的序列为依据。有报道称,氨基酸组成在物种之间是十分保守的(Cordwell等,1995),并且通过分析氨基酸的组成,研究者能从低于25%序列相似性的蛋白之间发现弱相似性(Hobohm和Sander,1995)。因此,在“传统的”数据库搜索基础上辅以组成分析,能为蛋白质之间关系提供更多见解。PROSEARCH:PROPSEARCH也提供基于氨基酸组成的蛋白质辨识功能。用144种不同的物化性质来分析蛋白质,包括分子量、巨大残基的含量、平均疏水性、平均电荷等,把查询序列的这些属性构成的“查询向量”与SWISS-PROT和PIR中预先计算好的各个已知蛋白质的属性向量进行比较。这个工具能有效的发现同一蛋白质家族的成员。可以通过Web使用这个工具,用户只需输入查询序列本身。分子量搜索(MOWSE)分子量搜索(MolecularWeightSearch,MOWSE)算法利用了通过质谱(MS)技术获得的信息。利用完整蛋白质的分子量及其被特定蛋白酶消化后产物的分子量,一种未知蛋白质能被准确无误地确认,给出由若干实验才能决定的结果。由于未知蛋白无需再全部或部分测序,这一方法显著地减少了实验时间。MOWSE的输入是一个纯文本文件,包含一张实验测定的肽段列表,分子量范围在0.7到4.0Kda之间。计算过程基于在OWL非冗余蛋白质序列库中包含的信息。打分基于在一定分子量范围内蛋白中一个片段分子量出现的次数。输出的结果是得分最佳的30个蛋白的列表,包括它们在OWL中的条目名称、相符肽段序列、和其它统计信息。模拟研究得出在使用5个或更少输入肽段分子量时,准确率为99%。该搜索服务可通过向mowse@daresburg.ac.uk发送电子邮件实现。为获得更多关于查询格式的细节信息,可以相该地址发送电子邮件,并在消息正文中写上“help”这个词。蛋白质氨基酸组成分析用盐酸在110 ℃将蛋白或多肽水解成游离的氨基酸,用氨基酸分析仪测定各氨基酸的含量。采用经典的阳离子交换色谱分离、茚三酮柱后衍生法,对蛋白质水解液及各种游离氨基酸的组分含量进行分析。仪器基本结构同普通HPLC相似,但针对氨基酸分析进行了细节优化(例如氮气保护、惰性管路、在线脱气、洗脱梯度及柱温梯度控制等等)通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸锂进行梯度洗脱。其中钠盐系统一次最多分析约25种氨基酸,速度较快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,基线一般不如钠盐系统好。分析效果:从目前已知的氨基酸分析方法比较来看,除灵敏度(即最低检测限)比HPLC柱前衍生方法稍低以外(HPLC:0.5 pmol;氨基酸分析仪:10 pmol),其他如分离度、重现性、操作简便性、运行成本等方面,都优于其他分析方法。蛋白质氨基酸残基组成分析的主要步骤包括:首先是蛋白被水解为氨基酸,其次是采用离子色谱等方法进行游离的氨基酸含量和组成的分析。总之利用蛋白可以分析氨基酸,利用氨基酸也可以研究蛋白质。
我正在做细胞色素C 胰蛋白酶酶解后[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]测序,我想请教一下酶解的条件。酶的用量,时间,温度,pH,还有缓冲溶剂的配置
RIP技术(RNA Binding Protein Immunoprecipitation,RNA结合蛋白免疫沉淀),是研究细胞内RNA与蛋白结合情况的技术,是了解转录后调控网络动态过程的有力工具,能帮助我们发现miRNA的调节靶点。RIP这种新兴的技术运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析。RIP可以看成是普遍使用的染色质免疫沉淀ChIP技术的类似应用,但由于研究对象是RNA-蛋白复合物而不是DNA-蛋白复合物,RIP实验的优化条件与ChIP实验不太相同(如复合物不需要固定,RIP反应体系中的试剂和抗体绝对不能含有RNA酶,抗体需经RIP实验验证等等)。RIP技术下游结合microarray技术被称为RIP-Chip,帮助我们更高通量地了解癌症以及其它疾病整体水平的RNA变化。Millipore基于磁珠的RIP实验流程RIP 实验基本原理:1. 用抗体或表位标记物捕获细胞核内或细胞质中内源性的RNA结合蛋白。2. 防止非特异性的RNA的结合。3. 免疫沉淀把RNA结合蛋白及其结合的RNA一起分离出来。4.结合的RNA序列通过microarray(RIP-Chip),定量RT-PCR或高通量测序(RIP-Seq)方法来鉴定。延伸阅读:95%的人类基因组并不编码基因,而是产生大量的非编码RNA,真正编码蛋白质的基因只占人类总基因组的约2%。这些非编码RNA在生命的生长发育的各个阶段都发挥着重要的调节作用,与艾滋病、白血病、糖尿病、畸形等多种病变密切相关,并且参与着干细胞和表观遗传学调控。而RNA-蛋白复合物驱动了几乎所有细胞过程的基因表达的转录后调控,包括剪接(splicing)、出核转运(nuclear export)、mRNA 稳定性以及蛋白转译过程,因此,对基因调控的了解就有赖于确定这些过程中RNA的结合的变化。因此,RNA研究也被越来越多的科学家重视起来,目前已经成为生命科学研究中一个炙手可热的领域,而RIP技术也逐渐成为RNA研究领域的一项常规方法,帮助我们了解越来越受关注的转录后调控网络。
铁蛋白,C反应蛋白,心肌三项检测试剂北京易斯威特生物医学科技有限公司产品介绍 铁蛋白(FER)检测试剂盒 (胶体金法)1.国内第一家免疫层析法检测FER的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的铁蛋白,适用于急性贫血,肝脏损伤等相关疾病的辅助诊断3.最快速准确的辅助诊断方法。4.血清铁蛋白是血液去铁蛋白和铁核心Fe3+形成的复合物。是检查体内铁缺乏的最灵敏的指标。血清铁蛋白测定在临床上常用于缺铁性贫血的诊断。简单 便捷 快速 灵敏 环保 肌红蛋白/肌酸激酶/心肌肌钙蛋白I,心梗三项检测试剂盒(胶体金法)1.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的肌红蛋白,肌酸激酶,心肌肌钙蛋白I检测,用于临床快速诊断急性心肌梗塞(AMI).2.最快速准确的辅助诊断方法。3.肌红蛋白:是心肌梗死的标志物,增高表示冠状动脉堵塞引起心肌严重缺血造成心肌梗死;4.肌钙蛋白:是一种心肌蛋白,升高见于心肌损伤,多见于心肌梗死,也见于心肌炎和心肺复苏后患者,特异性较高,阳性的话一般可确诊心肌损伤,阴性的话不能排除,因为肌钙蛋白的升高出现在心肌梗塞3-6小时之后,之前可能出现阴性。肌酸激酶敏感性较高,特异性较低,升高也出现在心梗3-8小时之后。5.肌酸激酶:主要存在于骨骼肌和心肌,在脑组织中也存在,是参与体内的能量代谢的一种酶。在临床上主要用于诊断心肌梗塞。心肌梗塞患者发病后2-4小时,血液中此酶活动即开始升高。比血清中谷草转酸酶和乳酸脱氢酶的活力变化都出现得早。 简单 便捷 快速 灵敏 环保 C反应蛋白(CRP)检测试剂盒(胶体金法)1.国内第一家免疫层析法检测CRP的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的C反应蛋白,适用于感染,炎性疾病,组织损伤,手术创伤及组织坏死等病变情况的辅助诊断3.最快速准确的辅助诊断方法。4.是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白。可用于细菌和病毒感染的鉴别诊断简单 便捷 快速 灵敏 环保
如果说一个人一次献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献的血——转基因水稻胚乳可提取血清白蛋白——转基因水稻胚乳可提取血清白蛋白2012年09月01日 来源: 中国科技网 关注转基因 白蛋白供应紧张一直困扰着人类。我国每年需求150—160吨,全球每年需求量则高达500吨,由于血浆来源紧张,我国目前从血浆中提取量仅可供应1/3,其中2/3依赖进口。 2011年10月31日,武汉大学生命科学学院教授杨代常撰写的论文《利用转基因水稻规模化生产重组人血清白蛋白》在《美国科学院院报》发表,吸引了世界的目光。 文章用翔实的科学数据证明,植物来源的重组人血清白蛋白与临床使用的血浆来源血清白蛋白,无论是在生理生化性质,还是功能用途等方面,都具有高度的等同性。 为何这项研究引发种种关注?稻米血清白蛋白是否会危及生态及人身安全?其何时能用于临床治疗?……带着这些问题,记者采访了杨代常和他的团队。 “借腹生子”:从水稻胚乳中提取血清白蛋白 植物种子生物反应器,是将植物种子作为一个蛋白质“生产车间”,利用植物作为合成蛋白质的“机器”来合成人类所需的蛋白质。“通俗地解释,便是‘借腹生子’。”杨代常说。 国外从1989年已开始利用DNA重组技术生产血清白蛋白,但由于血清白蛋白产量低、纯化工艺复杂、生产成本远高于市场成本,始终无法进入市场。 杨代常带领研究团队,从水稻基因组数据入手,根据水稻种子储藏蛋白与血清白蛋白的生化性质差异,设计出从提取到纯化的一整套工艺方案,最大限度地提取血清白蛋白,最低限度去除种子的内源蛋白,成为一项原始创新的科研成果。 “具体来说,是由表达元件组成的载体,通过遗传工程整合到水稻基因组内,在种子特异性调控元件的指导下,水稻种子在成熟过程中也不断地合成和积累人血清白蛋白,然后通过规模化种植获得原料,再经过提取、纯化等步骤获得高纯度的血清白蛋白。”杨代常介绍,目前大约每亩水稻可以产生1.5—2公斤血清白蛋白,如果说一个人一次能献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献血。 “天然屏蔽”:可杜绝肝炎、艾滋病毒等风险 植物源重组血清白蛋白优势明显,它来源于非动物,避免了各种病毒和病原菌的污染,并由于不受血浆供应限制,可无限量供应。但是转基因农业作物安全性向来争议不断,植物源血清白蛋白有望未来直接应用于人体中,有人担心会危及生态及人身安全。 对此,杨代常解释,首先,就人血清白蛋白本身安全性而言,血清白蛋白本就是人体的蛋白质,占血浆中蛋白的30%,是一种安全的蛋白质。目前,根据获取的数据,植物来源的人血清白蛋白从生物活性、分子结构和理化性质与血浆来源的人血清白蛋白完全一致,从水稻胚乳中提取的血清白蛋白可杜绝携带如肝炎病毒、艾滋病毒等风险。研究发现,人体对植物蛋白的耐受能力大于对细菌和酵母的耐受能力。从安全性考虑,已建立高纯度符合医药级别纯度的血清白蛋白。其次,就转基因生物安全而言,由于采取地理和时间双重隔离方法,要求比美国更为严格。第三,为杜绝进入食物链,在研究中采取了专用收割机、烘干机、稻米加工设备以及专用仓库等措施,建立了严格的监管规范,能做到可管可控和可追溯。 未来预期:进入临床需4至5年 从2005年始,杨代常自主研发的水稻胚乳细胞蛋白质高效表达技术平台,填补了国际上此项技术规模化生产的空白,已获美、日、欧盟以及我国的多项专利。 杨代常说,目前,植物源重组血清白蛋白的质量已达到非临床应用标准,可替代血源人血白蛋白用于细胞培养基添加剂,成为细胞培养中血浆来源的血清白蛋白的替代品;可减少培养基中胎牛血清的使用量;还可用于高纯试剂、细胞冷冻保护剂、医疗器械包埋剂、药物载体、化妆品组分、体外诊断等。 国外已在疫苗及生物医药产品的细胞培养的稳定剂上使用。我国按照国家药监局的要求,要通过临床研究后才能进入临床应用。 通过治疗大鼠肝硬化腹水对比,进行植物源重组血清白蛋白的药效研究,发现大鼠肝硬化腹水的治疗效果在降低腹围、增加尿量和尿蛋白量等指标优于血浆来源的血清白蛋白。 “植物源重组血清白蛋白正在进行临床前研究,已完成大部分的药学研究,预计在2013年上半年可望完成临床前研究;预计进入临床研究至少需要2年时间,进入临床应用至少需要4—5年或更长的时间,这取决于临床研究的结果与进度以及国家的法规。”杨代常说。 从实验室走向产业化 去年年初,杨代常带着多年的研发成果,入驻武汉东湖国家自主创新示范区光谷生物城,一年内实现了项目产业化。 “这一过程我们走得很艰难。”杨代常说,为了让投资者更有信心,他在商业模式上从长中短期产品计划入手,将技术做好做精。在科技部转基因重大专项、国家863计划和武汉东湖国家自主创新示范区光谷生物城的支持下,加速了项目产业化进程。 “我国生物产业要走在世界前列,在心理上要打破‘奴性’思维,在政策上要突破传统观念,要敢做别人不能做或不敢做的事情。”杨代常说,“现在一谈到转基因,很多人就‘谈虎色变’。实际上,理解上存在很多误区。转基因技术是通过遗传工程的手段,将人类需要的基因(一段DNA片段)导入到植物或任何一种生物的一项高科技技术,是人类由必然王国走向自由王国的必由之路。” 近日,杨代常的科研团队又传出喜讯,在水稻中“种”出了“人抗胰蛋白酶”。目前,重组抗胰蛋白酶与重组血清白蛋白一样,有效地避免人血液中病毒病原菌感染的风险,但需要进行一系列的免疫原性、急性、毒性等相关实验和临床研究后,方能应用于临床。 杨代常透露,未来,其团队研发重心将着重原创性技术研究,建立单克隆抗体的表达平台,使我国的单克隆抗体药物的价格降到5万元左右,重组血清白蛋白进入临床应用。(记者 马爱平) 《科技日报》(2012-09-01 三版)
现有基因重组表达的糖蛋白想进行以下几项委托检测, C端氨基酸测序、氨基酸组分分析、肽图、质谱分子量、糖基化分析如果有意者请联系,将样品要求、检测费用以及合作流程发到邮箱,如有疑问可以加qq联系。 qq:278569901 邮箱:wbz5102@gmail.com
现在,在实验研究基础上,借助多方面的生物信息学方法,可以快速高通量的预测和进行蛋白质鉴定蛋白翻译后修饰。分泌蛋白和膜相关蛋白附着于细胞膜上的或将被排泄出去的蛋白质是由细胞内质网膜上附着的核糖体合成。附着有核糖体的内质网被称为糙面型内质网。这类蛋白质都含有一个N-末端(或氨基端),我们称之为信号序列或信号肽。这个信号肽通常情况下含有13-36个主要疏水性残基,同时它含有多蛋白复合物,我们称之为信号识别粒子(SRP)。这种信号肽在通过内质网膜之后会被去除。信号肽的去除过程是在信号肽酶催化作用下完成的。含有一个信号肽的蛋白质被称为前蛋白,有别于原蛋白。然而,某些用于分泌的蛋白在分泌之后会进一步被蛋白水解,因此包含有原蛋白的序列。这类蛋白质被称为前原蛋白。蛋白水解性裂解许多蛋白质在翻译之后会经历水解性裂解过程。其中最为简单的形式是去除起始蛋氨酸。许多蛋白质合成了不活跃的前体细胞,这些细胞只能在合适的生理条件下通过限制性蛋白水解过程产生活性。在凝血过程中使用到的胰腺酶和酶类就是后者的例证。多肽去除时产生活性的不活跃的前体蛋白,我们称之为原蛋白。前原蛋白的翻译后加工过程的一个复杂的例子就是脑垂体分泌合成的前阿黑皮素原的裂解过程(有关前阿黑皮素原的讨论,见肽类激素页)。这类前原蛋白经过复杂的裂解,根据合成的前阿黑皮素原的细胞定位而不同,其路径也有所不同。另一个前原蛋白的例子就是胰岛素。由于胰岛素是由胰腺分泌的,因此它有一个前肽。随着含24个氨基酸的信号肽的裂解,这类蛋白也折叠成了胰岛素原。胰岛素原进一步分裂,产生活跃的胰岛素,它包含两个肽链,由二硫键进行连接。但仍有其他的蛋白(酶类)被合成为非活跃的前体细胞,被称为酶原。酶原在蛋白水解性裂解时会产生活性,在凝血串联蛋白质链的若干蛋白质中都会发生这种现象。甲基化作用蛋白翻译后的甲基化过程主要发生在氮原子和氧原子上。活性甲基供体是活性腺苷甲硫胺酸(SAM)。最常见的甲基化作用发生在赖氨酸残基的ε-amine上。脱氧核糖核酸组蛋白中赖氨酸残基的甲基化作用可调节核染色质结构,因此可调节其转录活性。赖氨酸原本被认为是一种常设共价标记,可提供长期信号,甚至包括转录记忆时的组蛋白依赖机制。然而,最近的临床研究表明赖氨酸甲基化作用与其他共价修饰体相似,作用时间短,并能通过反脱甲基化活动进行动态调节。最近的组学研究发现表明,赖氨酸残基的甲基化作用不仅发生在核染色质层面,而且还通过修订转录因子影响基因表达。组氨酸的咪唑环,精氨酸的胍基部分以及谷氨酸盐和天冬氨酸盐的R组酰胺(R-group amides )上,都发现了额外的氮甲基化作用。谷氨酸盐和天冬氨酸盐的R组羧化物也会发生氧甲基化作用并形成甲基酯。蛋白可能在半胱氨酸的R[
本文引用自cheney《蛋白胨和胰蛋白胨简介》蛋白胨是将肉、酪素或明胶用酸或蛋白酶水解后干燥而成的外观呈淡黄色的粉剂,具有肉香的特殊气息。蛋白质经酸、碱或蛋白酶分解后也可形成蛋白胨。蛋白胨富含有机氮化合物,也含有一些维生素和糖类。它可以作为微生物培养基的主要原料,在抗生素、医药工业、发酵工业、生化制品及微生物学科研等领域中的用量均很大。不同的生物体需要特定的氨基酸和多肽,因此存在着各种蛋白胨,一般来说,用于蛋白胨生产的蛋白包括动物蛋白(酪蛋白、肉类)和植物蛋白(豆类)等两种。能为微生物提供C源、N源、生长因子等营养物质。因此,蛋白胨从来源上可分为动物性蛋白胨和植物性蛋白胨。胰胨、肉胨、骨胨等都是动物性蛋白胨,而大豆蛋白胨等则是植物性蛋白胨。动物性来源的蛋白胨还有:蚕蛹蛋白胨、血液蛋白胨等。 不同来源的蛋白质和不同的水解条件,其水解物中组成可千差万别。所以胨往往是一个复杂的多肽混合物。可溶于水,过热不凝固,在饱和硫酸铵中不发生沉淀但可为蛋白质沉淀剂所沉淀。可用作微生物和动物细胞培养基、特种功能性食品和化妆品的配料,也有用作啤酒等产品的稳定剂。胰蛋白胨,又称胰酪蛋白胨(Casein Tryptone)、胰酶消化酪蛋白胨(Pancreatic digest of casein),是一种优质蛋白胨,是以新鲜牛肉和牛骨经胰酶消化,浓缩干燥而成的浅黄色粉末。具有色浅、易溶、透明、无沉淀等良好的物理性状。含有丰富的氮源、氨基酸等,可配制各种微生物培养基,用于细菌的培养、分离、增殖、鉴定,以及无菌试验培养基、厌氧菌培养基等细菌生化特性试验用培养基的配置。胰蛋白胨还广泛应用于高品质的抗生素、维生素、医药工业,氨基酸、有机酸、酶制剂、黄原胶等发酵工业,生化制品及微生物学科研等领域中的用量均很大,临床用于抗炎消肿,工业上用于皮革制造,生丝处理,食品加工。在国际市场上,胰蛋白胨也属于货紧价昂的短线品种之一。 胰酪蛋白胨质量标准及其检验标准: 常规各项理化指标: 1. 澄清度(磷酸盐、碱性沉淀):无沉淀、澄清 2. 2%水溶液:透明 3. 酸碱度:6-7 4. 氨基氮:≥3% 5. 色氨酸:≥0.8% 6. 胨含量:≥80% 7. 总氮:≥13% 8. 水份:≤5% 9. 灰份:≤6% 10. 氯化钠:≤0.2%胰蛋白胨特指用胰蛋白酶酶解酪蛋白生成的蛋白胨产物,与一般蛋白胨的区别在于酶解工艺处理上,属于水解度更高、胨分子量更小更均衡的蛋白胨。
北京易斯威特生物医学科技有限公司产品介绍 铁蛋白(FER)检测试剂盒 (胶体金法)1.国内第一家免疫层析法检测FER的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的铁蛋白,适用于急性贫血,肝脏损伤等相关疾病的辅助诊断3.最快速准确的辅助诊断方法。4.血清铁蛋白是血液去铁蛋白和铁核心Fe3+形成的复合物。是检查体内铁缺乏的最灵敏的指标。血清铁蛋白测定在临床上常用于缺铁性贫血的诊断。简单 便捷 快速 灵敏 环保 肌红蛋白/肌酸激酶/心肌肌钙蛋白I,心梗三项检测试剂盒(胶体金法)1.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的肌红蛋白,肌酸激酶,心肌肌钙蛋白I检测,用于临床快速诊断急性心肌梗塞(AMI).2.最快速准确的辅助诊断方法。3.肌红蛋白:是心肌梗死的标志物,增高表示冠状动脉堵塞引起心肌严重缺血造成心肌梗死;4.肌钙蛋白:是一种心肌蛋白,升高见于心肌损伤,多见于心肌梗死,也见于心肌炎和心肺复苏后患者,特异性较高,阳性的话一般可确诊心肌损伤,阴性的话不能排除,因为肌钙蛋白的升高出现在心肌梗塞3-6小时之后,之前可能出现阴性。肌酸激酶敏感性较高,特异性较低,升高也出现在心梗3-8小时之后。5.肌酸激酶:主要存在于骨骼肌和心肌,在脑组织中也存在,是参与体内的能量代谢的一种酶。在临床上主要用于诊断心肌梗塞。心肌梗塞患者发病后2-4小时,血液中此酶活动即开始升高。比血清中谷草转酸酶和乳酸脱氢酶的活力变化都出现得早。 简单 便捷 快速 灵敏 环保 C反应蛋白(CRP)检测试剂盒(胶体金法)1.国内第一家免疫层析法检测CRP的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的C反应蛋白,适用于感染,炎性疾病,组织损伤,手术创伤及组织坏死等病变情况的辅助诊断3.最快速准确的辅助诊断方法。4.是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白。可用于细菌和病毒感染的鉴别诊断简单 便捷 快速 灵敏 环保
朊蛋白与免疫系统相互作用的新发现http://www.bioon.com/biology/UploadFiles/201112/2011123113381385.jpg 12月29日,据《每日科学》报道,痒病是一种神经退行性疾病,它可以作为其他由蛋白积累致组织畸形(蛋白质病)疾病的模型,如阿尔兹海默氏病和帕金森氏病。有关这些基因的许多问题仍然悬而未决。在一个新的博士论文研究中,发现了数个与阮蛋白(PrPSc,与疾病的发展有关)摄取相关的因子以及朊蛋白是如何与肠道内的免疫细胞相互作用。 羊瘙痒病属于一组被称为"传染性海绵状脑病(TSE)"的疾病,因为它们可以在动物个体之间传播,并导致大脑产生海绵状、退行性改变。这些疾病不仅折磨羊,还折磨牛(牛海绵状脑病,又称疯牛病,BSE)、鹿(鹿慢性消耗性疾病,又称疯鹿病,CWD)以及人类(克雅氏病CJD)。它们在一定程度上也可以在物种见传播,在20世纪90年代,超过200人经由食物感染而患上了克雅氏病。 传染性海绵状脑病(TSE),或者称阮病毒疾病,被认为是感染了一种能致病的蛋白质变体--朊蛋白,它是机体细胞的正常组成部分,在脑中含量最为丰富。一般而言,阮病毒疾病可能是传染的、遗传的或偶发/自发的。当正常的朊蛋白突变成致病的变种,疾病便发生了,变种朊蛋白在空间结构上与健康的朊蛋白不同。由于变种的朊蛋白具有不同的空间结构,机体细胞很难降解它,因此它就一直在积累。 因为朊蛋白(PrPSc)是在疾病早期在肠道系统的淋巴组织中被发现,推测它是经由肠胃道传染。在兽医学家Caroline Piercey Akesson博士研究杂交仪期间,研究了朊蛋白在肠道内的吸收,从而对疾病发展的早期阶段所发生的过程有了新的了解。与早先的推测相反,她通过免疫电镜证明阮蛋白不是直接从肠道转运到肠道相关的的淋巴组织。相反,她发现朊蛋白自由地穿过或穿进肠道淋巴组织之外的淋巴细胞。 树突状细胞据推测发挥着"看门人"的作用,它决定机体能容忍什么以及当面对外来物时该策划哪一种免疫防御反应。Akeeson的目标之一就是树突细胞与朊蛋白摄取之间的相互作用。首先,需要了解正常的羊肠道内树突状细胞的特点;其次,去调查哪一类型的细胞与阮病毒的摄取有关。 她的研究结果表明,不是树突状细胞,而是巨噬细胞负责朊蛋白的摄取。Akesson的研究揭示,朊蛋白利用了肠道中大分子物质摄取的正常生理通道,这可能对机体的免疫监视系统有显著影响。一个可能的后果就是免疫耐受被激活,从而阻碍了肠道对所吸收的朊蛋白的正常免疫反应。 今后的研究能够揭示免疫细胞是如何运输朊蛋白及机体是如何处理朊蛋白,这将具有非常重要的意义,不仅是为了提供更多的关于痒病的知识,还为研究人类和其他动物中神经退行性蛋白质病提供重要见解。 Caroline Piercey Akesson于12月20日在挪威兽医科学系进行了博士论文答辩,论文的题目是:研究阮病毒的摄取及其与羊肠道中免疫细胞的早期相互作用。
[font=宋体]在分子生物学和生物工程领域,蛋白表达载体构建是至关重要的技术之一,它涉及到将目的基因插入到适当的表达载体中,以便在宿主细胞内进行蛋白表达。这一过程不仅有助于研究基因的功能和蛋白质的结构,还为药物开发、基因治疗等领域提供了有力支持。本文将详细介绍蛋白表达载体构建的整个流程,包括目的基因的选择、载体的选择与改造、基因插入、转化、筛选与鉴定等关键步骤。[/font][font=宋体] [/font][b][font=宋体]蛋白表达载体构建流程:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]①[/font][font=Calibri]NCBI[/font][font=宋体]查找目的基因的[/font][font=Calibri]CDS[/font][font=宋体]序列[/font][/font][font=宋体][font=宋体]进入[/font][font=Calibri]NCBI[/font][font=宋体](美国国家生物技术信息中心)的网站。[/font][/font][font=宋体]在搜索框中输入目的基因的名称或关键词。[/font][font=宋体][font=宋体]在搜索结果中找到[/font][font=Calibri]CDS[/font][font=宋体]([/font][font=Calibri]Coding Sequence[/font][font=宋体])序列,通常会显示基因的[/font][font=Calibri]DNA[/font][font=宋体]序列。[/font][/font][font=宋体][font=宋体]记录或复制所需的[/font][font=Calibri]CDS[/font][font=宋体]序列信息。[/font][/font][font=宋体] [/font][font=宋体]②选择合适的表达载体[/font][font=宋体]根据目的基因的性质和所需的表达水平,选择适合的表达载体。[/font][font=宋体]考虑载体的克隆容量、复制子类型、筛选标记等。[/font][font=宋体] [/font][font=宋体]③确定双酶切位点[/font][font=宋体]根据目的基因和载体,选择合适的双酶切位点。[/font][font=宋体][font=宋体]确保酶切位点在[/font][font=Calibri]CDS[/font][font=宋体]序列和载体上都是独特的,避免切割其他部位。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]④[/font][font=Calibri]Primer 5[/font][font=宋体]预测目的序列酶切位点[/font][/font][font=宋体][font=宋体]使用[/font][font=Calibri]Primer 5[/font][font=宋体]或其他相关软件,根据已知的[/font][font=Calibri]CDS[/font][font=宋体]序列设计酶切位点的引物。[/font][/font][font=宋体]通过软件预测引物的特异性,确保它们仅与目的基因结合。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]⑤双酶切[/font][font=Calibri]buffer[/font][/font][font=宋体][font=宋体]根据选择的酶,准备相应的酶切[/font][font=Calibri]buffer[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]注意[/font][font=Calibri]buffer[/font][font=宋体]的[/font][font=Calibri]pH[/font][font=宋体]值和离子浓度,确保酶的活性。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]⑥目的基因[/font][font=Calibri]CDS[/font][font=宋体]序列引物设计[/font][/font][font=宋体][font=宋体]根据[/font][font=Calibri]CDS[/font][font=宋体]序列,设计一对引物用于[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增目的基因。[/font][/font][font=宋体]确保引物的特异性,避免与其他基因序列发生非特异性结合。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑦转化[/font][font=宋体][font=宋体]制备感受态细胞,使其处于易于接受外源[/font][font=Calibri]DNA[/font][font=宋体]的状态。[/font][/font][font=宋体][font=宋体]将[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增得到的目的基因与载体混合,进行转化反应。[/font][/font][font=宋体]将转化后的细菌在选择培养基上培养,筛选含有重组载体的阳性克隆。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑧双酶切及鉴定[/font][font=宋体][font=宋体]提取阳性克隆的质粒[/font][font=Calibri]DNA[/font][font=宋体]。[/font][/font][font=宋体]使用设计的引物进行双酶切反应。[/font][font=宋体]对酶切产物进行电泳分析,观察是否获得预期的片段,并进行凝胶回收。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑨测序[/font][font=宋体]将回收的酶切产物进行序列测定。[/font][font=宋体][font=宋体]对比测序结果与目的基因的[/font][font=Calibri]CDS[/font][font=宋体]序列,确保没有突变或错误。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑩阳性菌落扩大培养,用于后期蛋白纯化研究[/font][font=宋体] [/font][font=宋体]选择测序正确的阳性菌落进行扩大培养。[/font][font=宋体]在摇瓶或发酵罐中进行高密度培养,为后续的蛋白表达提供充足的原料。[/font][font=宋体]在确定目的基因在载体上正确表达后,可以进行蛋白纯化研究。[/font][font=宋体]通过适当的纯化技术,如亲和层析、离子交换等,分离和纯化目的蛋白。[/font][font=宋体]对纯化的蛋白进行质量分析和功能研究。[/font][font=宋体] [/font][font=宋体][font=宋体]综上所述,蛋白表达载体构建是一个系统性的过程,涉及到多个关键步骤和复杂的技术操作。通过遵循这一流程,研究人员能够成功地在宿主细胞内表达所需蛋白,并进一步对其进行分析和功能研究。随着生物技术的不断发展,蛋白表达载体构建的应用领域将越来越广泛,为人类对生命现象的深入理解和疾病的防治提供更多可能性。因此,不断优化和完善这一技术对于生命科学领域的发展至关重要。更多[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]蛋白表达生产[/b][/url]详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font]
性能介绍: 377型全自动遗传分析仪采用经典的聚丙烯酰胺凝胶的电泳方式,结合PE公司专利的四色荧光标记,激光检测的方法,具有测序精确度高,每个样品判读序列长(800-1200bp),一次电泳可测定样品数多(96个),快速方便,不需要同位素,测序方法灵活多样等特点,已成为全球应用最多最广的全自动DNA测序仪,尤其在人类基因组测序cDNA文库测序及比较基因组测序研究中应用极其广泛,此外377型全自动DNA测序仪在各种应用软件的辅助下,还可以进行DNA片段大小分析和定量分析,应用于基因突变分析SSCP,DNA指纹图谱分析(AFLP、RAPD、VNTR、STR),基因连锁图谱分析以及基因表达水平的研究,在临床遗传病、传染性病和癌症基因诊断、农业畜牧业的动植物育种、法医鉴定等领域有极其广泛的应用前景。 377型全自动遗传分析仪特点: 专利设计: 采用PE公司专利四色荧光标记,一个泳道测序的方法,避免单一标记(如:同位素标记)四个泳道测序因泳道间迁移率不同对精确度的影响,同时一个样品只占用一个泳道,使一次测定样品数目大大增加(至96个),因而具有精确度高,一次测定样品数多的特点。 测序能力强: 377型全自动遗传分析仪的荧光检测器采用激光激发、CCD摄像机同步成像技术,代表不同碱基信息的不同颜色荧光先经光栅分光,再经CCD摄像机成像,具有一次扫描可检测多种荧光的特点,测序速度高达200bp/小时,此外一个样品一次可测定800-1200个碱基,而同位素测序一次只能测定200-300个碱基。 电脑单点控制整个DNA测序仪的功能: 包括电泳参数设置,数据收集和分析以及结果输出。此外电脑可在电泳过程中对仪器运行状态进行同步监测,电泳结果也可以凝胶电泳图谱、荧光吸收峰图或碱基排列顺序等多种形式输出。新增加的用户界面卡功能强且简便易学,无论进行DNA序列分析还是DNA片段大小和定量分析,都可在各种软件辅助下方便地进行。 电泳的精确控温: 采用上下缓冲液环泵和温度检测器,使电泳温度恒定在51℃,这样可提高测序精度,调节温度,还可进行特殊应用研究,如:SSCP。此外采用恒定电压,而非恒定功率,可减少迁移率的变化,进一步提高电泳结果的重复性。 新改变的电泳胶板设计和电泳胶配方: 简化了灌胶操作,使灌胶更方便快捷,此外电泳胶的聚合可在最短的时间内完成。 测序方法灵活多样: 采用两种荧光染料标记方法(标记终止物ddNTP法和标记引物5'端法),两种DNA聚合酶(Sequenase和AmpliTaq),提供20钟测序试剂盒,可满足各种DNA模板(单链DNA,双链DNA,PCR产物)和测序策略(鸟枪法、缺失法、基因行走法)的要求。 丰富的应用软件: 有GeneScanTM、GenotyperTM、AutoAssemblerTM、Sequence NavigatorTM等软件,可进行DNA片段大小和定量分析,遗传基因的组型分析,DNA亚克隆序列拼接,DNA和蛋白序列比较。 多功能: 提供三种不同长度的凝胶电泳板,可根据对电泳时间和样品分辨率的不同要求选择,进行DNA序列分析,DNA片段大小分析(碱基分辨率可达1bp)和DNA片段定量分析(可检测从单一分子扩增的产物)。
如果目前分离蛋白质组的最好技术是2-DE,那么随之而来的挑战是数百数千个蛋白如何被鉴定。在这里,我们不考虑传统的蛋白鉴定方法,如免疫印迹法、内肽的化学测序、已知或未知蛋白的comigration分析,或者在一个有机体中有意义的基因的过表达。并不是因为这些方法无效,而是因为它们通常耗时、耗力,不适合高流通量的筛选。目前,所选用的技术包括对于蛋白鉴定的图象分析、微量测序;进一步对肽片段进行鉴定的氨基酸组分分析和与质谱相关的技术。(1) 图象分析技术(Image analysis)。“满天星”式的2-DE图谱分析不能依靠本能的直觉,每一个图象上斑点的上调、下调及出现、消失,都可能在生理和病理状态下产生,必须依靠计算机为基础的数据处理,进行定量分析。在一系列高质量的2-DE凝胶产生(低背景染色,高度的重复性)的前提下,图象分析包括斑点检测、背景消减、斑点配比和数据库构建。首先,采集图象通常所用的系统是电荷耦合CCD(charge coupled device)照相机;激光密度仪(laser densitometers)和Phospho或Fluoro?imagers,对图象进行数字化。并成为以象素(pixels)为基础的空间和网格。其次,在图象灰度水平上过滤和变形,进行图象加工,以进行斑点检测。利用Laplacian,Gaussian,DOG(difference of Gaussians) opreator使有意义的区域与背景分离,精确限定斑点的强度、面积、周长和方向。图象分析检测的斑点须与肉眼观测的斑点一致。在这一原则下,多数系统以控制斑点的重心或最高峰来分析,边缘检测的软件可精确描述斑点外观,并进行边缘检测和邻近分析,以增加精确度。通过阈值分析、边缘检测、销蚀和扩大斑点检测的基本工具还可恢复共迁移的斑点边界。以PC机为基础的软件Phoretix-2D正挑战古老的Unix为基础的2-D分析软件包。第三,一旦2-DE图象上的斑点被检测,许多图象需要分析比较、增加、消减或均值化。由于在2-DE中出现100%的重复性是很困难的,由此凝胶间的蛋白质的配比对于图象分析系统是一个挑战。IPG技术的出现已使斑点配比变得容易。因此,较大程度的相似性可通过斑点配比向量算法在长度和平行度观测。用来配比的著名软件系统包括Quest,Lips,Hermes,Gemini等,计算机方法如相似性、聚类分析、等级分类和主要因素分析已被采用,而神经网络、子波变换和实用分析在未来可被采用。配比通常由一个人操作,其手工设定大约50个突出的斑点作为“路标”,进行交叉配比。之后,扩展至整个胶。例如:精确的PI和MW(分子量)的估计通过参考图上20个或更多的已知蛋白所组成的标准曲线来计算未知蛋白的PI和MW。在凝胶图象分析系统依据已知蛋白质的pI值产生PI网络,使得凝胶上其它蛋白的PI按此分配。所估计的精确度大大依赖于所建网格的结构及标本的类型。已知的未被修饰的大蛋白应该作为标志,变性的修饰的蛋白的PI估计约在±0.25个单位。同理,已知蛋白的理论分子量可以从数据库中计算,利用产生的表观分子量的网格来估计蛋白的分子量。未被修饰的小蛋白的错误率大约30%,而翻译后蛋白的出入更大。故需联合其他的技术完成鉴定?(2) 微量测序(microsequencing)。蛋白质的微量测序已成为蛋白质分析和鉴定的基石,可以提供足够的信息。尽管氨基酸组分分析和肽质指纹谱(PMF)可鉴定由2-DE分离的蛋白,但最普通的N-末端Edman降解仍然是进行鉴定的主要技术。目前已实现蛋白质微量测序的自动化。首先使经凝胶分离的蛋白质直接印迹在PVDF膜或玻璃纤维膜上,染色、切割,然后直接置于测序仪中,可用于subpicomole水平的蛋白质的鉴定。但有几点需注意:Edman降解很缓慢,序列以每40 min 1个氨基酸的速率产生;与质谱相比,Edman降解消耗大;试剂昂贵,每个氨基酸花费3~4$。这都说明泛化的Edman降解蛋白质不适合分析成百上千的蛋白质。然而,如果在一个凝胶上仅有几个有意义的蛋白质,或者如果其他技术无法测定而克隆其基因是必需的,则需要进行泛化的Edman降解测序。近来,应用自动化的Edman降解可产生短的N-末端序列标签,这是将质谱的序列标签概念用于Edman降解,业已成为一种强有力的蛋白质鉴定。当对Edman的硬件进行简单改进,以迅速产生N-末端序列标签达10~20个/d,序列检签将适于在较小的蛋白质组中进行鉴定.若联合其他的蛋白质属性,如氨基酸组分分析、肽质质量、表现蛋白质分子量、等电点,可以更加可信地鉴定蛋白质。选择BLAST程序,可与数据库相配比。目前,采用一种Tagldent的检索程序,还可以进行种间比较鉴定,又提高了其在蛋白质组研究中的作用。(3) 与质谱(mass spectrometry)相关的技术。质谱已成为连接蛋白质与基因的重要技术,开启了大规模自动化的蛋白质鉴定之门。用来分析蛋白质或多肽的质谱有两个主要的部分,1)样品入机的离子源,2)测量被介入离子的分子量的装置。首先是基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF)为一脉冲式的离子化技术。它从固相标本中产生离子,并在飞行管中测其分子量。其次是电喷雾质谱(ESI-MS),是一连续离子化的方法,从液相中产生离子,联合四极质谱或在飞行时间检测器中测其分子量。近年来,质谱的装置和技术有了长足的进展。在MALDI-TOF中,最重要的进步是离子反射器(ion reflectron)和延迟提取(delayed ion extraction),可达相当精确的分子量。在ESI-MS中,纳米级电雾源(nano-electrospray source)的出现使得微升级的样品在30~40 min内分析成为可能。将反相液相色谱和串联质谱(tandem MS)联用,可在数十个picomole的水平检测;若利用毛细管色谱与串联质谱联用,则可在低picomole到高femtomole水平检测;当利用毛细管电泳与串联质谱连用时,可在小于femtomole的水平检测。甚至可在attomole水平进行。目前多为酶解、液相色谱分离、串联质谱及计算机算法的联合应用鉴定蛋白质。下面以肽质指纹术和肽片段的测序来说明怎样通过质谱来鉴定蛋白质。1)肽质指纹术(peptide mass fingerprint, PMF)是由Henzel等人于1993年提出。用酶(最常用的是胰酶)对由2-DE分离的蛋白在胶上或在膜上于精氨酸或赖氨酸的C-末端处进行断裂,断裂所产生的精确的分子量通过质谱来测量(MALDI-TOF-MS,或为ESI-MS),这一技术能够完成的肽质量可精确到0.1个分子量单位。所有的肽质量最后与数据库中理论肽质量相配比(理论肽是由实验所用的酶来“断裂”蛋白所产生的)。配比的结果是按照数据库中肽片段与未知蛋白共有的肽片段数目作一排行榜,“冠军”肽片段可能代表一个未知蛋白.若冠亚军之间的肽片段存在较大差异,且这个蛋白可与实验所示的肽片段覆盖良好,则说明正确鉴定的可能性较大。2)肽片段(peptide fragment)的部分测序。肽质指纹术对其自身而言,不能揭示所衍生的肽片段或蛋白质。为进一步鉴定蛋白质,出现了一系列的质谱方法用来描述肽片段。用酶或化学方法从N-或C-末端按顺序除去氨基酸,形成梯形肽片段(ladder peptide)。首先以一种可控制的化学模式从N-末端降解,可产生大小不同的一系列的梯形肽片段,所得一定数目的肽质量由MALDI-TOF-MS测量。另一种方法涉及羧基肽酶的应用,从C-末端除去不同数目的氨基酸形成肽片段。化学法和酶法可产生相对较长的序列,其分子量精确至以区别赖氨酸(128.09)和谷氨酰胺(128.06)。或者,在质谱仪内应用源后衰变(post-source decay, PSD)和碰撞诱导解离(collision-induced dissociation, CID),目的是产生包含有仅异于一个氨基酸残基质量的一系列肽峰的质谱。因此,允许推断肽片段序列。肽片段PSD的分析在MALDI反应器上能产生部分序列信息。首先进行肽质指纹鉴定。之后,一个有意义的肽片段在质谱仪被选作“母离子”,在飞行至离子反应器的过程中降解为“子离子”。在反应器中,用逐渐降低的电压可测量至检测器的不同大小的片段。但经常产生不完全的片段。现在用肽片段来测序的方法始于70年代末的CID,可以一个三联四极质谱ESI-MS或MALDI-TOF-MS联合碰撞器内来完成。在ESI-MS中,由电雾源产生的肽离子在质谱仪的第一个四极质谱中测量,有意义的肽片段被送至第二个四极质谱中,惰性气体轰击使其成为碎片,所得产物在第三个四极质谱中测量。与MALDI-PSD相比,CID稳定、强健、普遍,肽离子片段基本沿着酰胺键的主架被轰击产生梯形序列。连续的片段间差异决定此序列在那一点的氨基酸的质量。由此,序列可被推测。由CID图谱还可获得的几个序列的残基,叫做“肽序列标签”。这样,联合肽片段母离子的分子量和肽片段距N-、C?端的距离将足以鉴定一个蛋白质。(4) 氨基酸组分分析。1977年首次作为鉴定蛋白质的一种工具,是一种独特的“脚印”技术。利用蛋白质异质性的氨基酸组分特征,成为一种独立于序列的属性,不同于肽质量或序列标签。Latter首次表明氨基酸组分的数据能用于从2-DE凝胶上鉴定蛋白质。通过放射标记的氨基酸来测定蛋白质的组分,或者将蛋白质印迹到PVDF膜上,在155℃进行酸性水解1 h,通过这
[font=宋体][font=宋体]真核蛋白表达系统是一种广泛应用的蛋白表达方式,通常利用酵母、昆虫或哺乳动物细胞作为宿主。这种表达系统所生成的蛋白与目标[/font][font=Calibri]DNA[/font][font=宋体]具有极高的相似性,能诱导高效蛋白表达。那么,在实施真核蛋白表达时,有哪些关键的纯化步骤呢?接下来,我们将详细解析这一过程。[/font][/font][font=宋体] [/font][font=宋体]首先,我们要明确真核蛋白表达的纯化步骤是至关重要的环节。这些步骤不仅关系到最终产品的纯度和产量,还直接影响其生物活性和应用价值。因此,选择合适的纯化方法对于整个实验的成功至关重要。[/font][font=宋体] [/font][b][font=宋体]真核蛋白表达及纯化步骤主要有以下几个方面:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、重组质粒构建:将目的基因克隆进表达载体,常见的方法包括限制性切酶切割,基因合成等,根据连接酶说明,进行线性载体和目的基因片段的酶联,最后对质粒测序做好验证;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、蛋白诱导表达:普适条件下查看蛋白是否表达,若不表达,更换载体,表达菌株等方法查看是否表达,如果表达,继续实验;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、蛋白表达部位分析:分析蛋白是可溶性还是不溶性的表达,即在超声后上清表达还是沉淀表达;是否与你的目标蛋白表达部位相同,相同进行后续蛋白表达条件优化;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、蛋白表达优化:优化诱导[/font][font=Calibri]IPTG[/font][font=宋体]浓度、诱导温度,进行放大培养;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、蛋白纯化:根据目标蛋白的性质进行样本处理,然后进行亲和纯化,获取目的蛋白。[/font][/font][font=宋体] [/font][font=宋体][b]真核表达系统的选择与应用[/b][/font][font=宋体]酵母蛋白表达系统[/font][font=宋体]酵母真核蛋白表达系统有甲醇酵母表达系统,酿酒酵母表达系统,裂殖酵母表达系统以及克鲁维酸酵母表达系统等,其中最早应用于基因工程的酵母是酿酒酵母,但现在运用最广泛的酵母表达系统还是甲醇酵母表达系统中的毕赤酵母真核蛋白表达系统。[/font][font=宋体] [/font][font=宋体]哺乳动物细胞表达系统[/font][font=宋体][font=宋体]哺乳动物细胞表达系统是真核表达系统中唯一可以表达复杂蛋白的系统,它能够指导真核表达蛋白进行正确折叠,提供复杂的[/font][font=Calibri]N[/font][font=宋体]型糖基化和准确的[/font][font=Calibri]O[/font][font=宋体]型糖基化等多种翻译后加工功能,所以它和昆虫酵母系统比较更具有发展潜力,哺乳动物细胞真核表达的蛋白与天然真核表达蛋白的结构、糖基化类型和方式几乎相同且能正确组装成多亚基蛋白[/font][font=Calibri],[/font][font=宋体]但成本较高也一定程度上减缓了它的发展速度。哺乳动物细胞表达系统主要是通过改造宿主细胞来提高外源蛋白的表达效率,常用的宿主细胞有[/font][font=Calibri]CHO[/font][font=宋体]、[/font][font=Calibri]COS[/font][font=宋体]、[/font][font=Calibri]BHK[/font][font=宋体]、[/font][font=Calibri]SP2 /0N[/font][font=宋体]等,哺乳动物转染方法[/font][font=Calibri]*[/font][font=宋体]有脂质体转染法,电穿孔法以及病毒转染等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques][b]蛋白纯化技术[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques[/font][/font][font=Calibri] [/font]
据8月28日的《科学》杂志报道说,蚕虫驯养已经有1万多年历史了。蚕为人类提供了宝贵的丝绸和蛋白。但是,现在对蚕基因进行序列测试还为人们提供了一张有关这些随时会为我们提供如此多宝贵物质的昆虫的基因变异图。由西南大学、深圳华大基因带领的国际研究团队为29种家蚕和11种野蚕世系的基因组成功地进行了测序并找到了这些世系之间的差别。共获得了40个家蚕突变品系和中国野桑蚕的全基因组序列,共测632.5亿对碱基序列,覆盖了99.8%的基因组区域,是多细胞真核生物大规模重测序研究的首次报道;绘制完成了世界上第一张基因组水平上的蚕类单碱基遗传变异图谱,这是世界上首次报道的昆虫基因组变异图。科学家还发现了驯化对家蚕生物学影响的基因组印记,从全基因组水平上揭示了家蚕的起源进化。 研究发现,家蚕很明显地在基因上与其野生对应物不同,但即使在各家蚕世系之间,它们仍然维持着大量的变异性。这提示,家蚕只经历了一次牵涉有大量个体的单一且短暂的驯养过程,并在此后在家蚕与野蚕种群之间很少有基因流动。研究人员还能够识别出特别的能够增进丝的生产、蚕虫的繁殖和生长的基因(这些基因很可能是被人类挑选出的)。他们甚至还寻找到了在驯养过程中由蚕虫所获取的行为特征,例如极端的拥挤和容忍人的靠近和操作,以及它们在驯养过程中所丧失的如逃逸及躲避掠食者和疾病等的特征。(
测序都是从5'端进行的,正向和反向测序是指对DNA的两条互补链分别测序,通常两个方向测序结果经校读后完全一致才能认为得到可靠结果。生工测序结果一般都提供两个文档,一个是TEXT的序列文档,一个是用Chromas软件打开的ABI文档。1.寻找引物http://blast.ncbi.nlm.nih.gov/Blast.cgi 比对,去除引物序列,找到目的片段。在DNAMan上进行比对,看引物能不能比对上(一个不变,一个反向互补),如果比不上,那可能就不是你要的序列,如果能比上,上游以引物第一个为分界线,去除前面的;下有一最后一个为分界线,去除后面的,剩下的就是目的序列。然后在NCBI上Blast.就OK了。批注:PCR产物进行测序的结果可能不包含引物序列2.将找到的对应目的片段转成*.txt格式3.下载BioEdit软件第一:打开Bioedit软件,导入拼接好的样品序列与标准亚型参考序列File—New Alignment—Sequence—New Sequence—导入拼接好的样品序列和标准参考序列(从TEXT文档利用复制粘贴工具)—Apply and close —保存结果—关闭窗口第二:点击菜单栏上按钮“Accessory Application”,选择“Clustalw Multiple Alignment”File—Open—Accessory Application—Clustalw Multiple Alignment第三:比对结束后,删除比对序列两端的多余序列,使所有序列等长选择需要编辑的序列—Sequence—Edit Sequence—进行序列的编辑—保存修改后结果第四:选择“Sequence”菜单下的“Gaps”,点击“Lock Gaps”第五:将比对后的序列保存为Fasta 格式文档4.下载MAGE4.0软件1) 打开MEGA软件,选择“File”菜单栏中的“Convert To MEGA Format”,把序列文件的格式转换为meg文档保存;2) 双击序列的meg文档,选择“Nucleotide Sequences”,点击“OK”;3) 程序运行中询问是否为蛋白编码序列,选择“NO”;4) 在MEGA操作界面选择“Phylogeny”菜单栏下“Bootstrap Test of Phylogeny”中的“Neibour-Joining”;5) 选择“Test of Phylogeny”栏中的“Bootsrap”,“Replications”设定为1 000;在“Options Summary”栏中的“Model”项中,设定参数为“Kimura 2-Paramete”r,最后选择“Compute”;6) 将分析结果采用Los Alamos HIV序列库提供的HIV-BLAST和Subtyping工具进行验证。
我是做啤酒微生物检测的新手,做了2次菌落总数都没有成功,遇到几个问题请教一下;1.培养基中是用的蛋白胨代替的胰蛋白胨,可以吗?2.空白培养基上有菌落长出。(生理盐水和培养基是用的灭菌锅灭菌,移液管和培养皿是用的牛皮纸包好后160度干燥2小时灭菌。操作在无菌室内的超净工作台上。)个人觉得是不是移液管灭菌不好,培养皿一直都是这样灭菌的,做酵母的时候没有问题。3.有几个细菌长在培养基表面的,大部分长在培养基内部的,一点一点的,不知道是不是这样子的?