美国食品药品监督管理局(FDA)近日批准了Gazyva(obinutuzumab)与苯丁酸氮芥联用治疗初治型慢性淋巴细胞白血病(CLL)患者。CLL是一种缓慢加重的渐进性血液与骨髓系统疾病。根据美国国家癌症研究所估计,今年将有15680名美国人被确诊患有该疾病,4580人因CLL死亡。Gazyva有助于免疫系统的某些细胞攻击癌细胞,并且需要与另一种CLL治疗药物——苯丁酸氮芥合用。在对重症CLL患者的治疗过程中,Gazyva在安全性和有效性方面表现出显著改善,此外,FDA还授予此药优先审查和孤儿药地位。FDA药物评价研究中心血液/肿瘤部门主管,Richard Pazdur博士说:“FDA对Gazyva的批准意味着对CLL患者疗法的重要补充,同时也反映了突破性疗法认定的优势,此项认定使我们与企业共同合作,加快重要新药物的开发、评估和上市。”此次批准是基于一项涉及356名受试者的随机、开放性、多中心临床研究,评估了Gazyva-苯丁酸氮芥联用组和苯丁酸氮芥单用组的药效。结果表明,联用组患者的无进展生存期得到显著提高(23个月vs11.1个月)。联用组患者的最常见不良反应包括输液反应、白细胞减少(中性粒细胞减少症)、血小板水平降低(血小板减少症)、红细胞数目降低(贫血)、肌肉和骨骼疼痛、发热等。Gazyva的说明书中含有黑框警告,提示Gazyva与乙肝病毒的再活化及一种罕见病有关,该罕见病(进行性多灶性白质脑病)能损伤大脑白质中覆盖和保护神经的物质,这是此类药物(包括其它单克隆抗体)共有的已知风险。Gazyva由罗氏子公司基因泰克上市销售。转自:http://www.hfoom.com/industry/20131106/376.html
十三.流式细胞术在血液学中的应用 淋巴瘤免疫分型 目前淋巴瘤的分类方法已从LSG的形态学分类逐渐转变为REAL分类法, REAL分类法是以肿瘤发生源为基础的分类方法,在原来的形态学基础上加上免疫学分型后再加以分类,这种分类方法不仅能够推断肿瘤的发生源,对治疗也有指导意义。因此淋巴瘤的免疫分型越来越重要。如同白血病免疫分型一样,淋巴瘤的免疫分型也是利用单克隆抗体检测淋巴瘤细胞的细胞膜和细胞浆抗原,分析其表现型,以了解被测淋巴瘤细胞所属细胞系列及其分化程度。流式细胞仪能对多数的淋巴瘤细胞的细胞膜和细胞浆抗原迅速客观地做出检测,在淋巴瘤的免疫分型中起着不可替代的作用。临床淋巴瘤的免疫分型的检测标本一般是淋巴结、脾脏、胸水、腹水等。在临床淋巴瘤的免疫分型工作中常可遇到以下四种情况:①B细胞系淋巴瘤②T/NK细胞系淋巴瘤③淋巴细胞系以外的造血细胞肿瘤④造血细胞以外的肿瘤。REAL分类淋巴瘤的免疫表型见表12.8。*:弱表达或阴性。BLBL :前B原始淋巴细胞淋巴瘤/白血病; BSLL: B-小淋巴细胞淋巴瘤; LPL:淋巴浆细胞样淋巴瘤; MCL: 斗篷细胞淋巴瘤; FCL:滤泡中心淋巴瘤; MZL: 边缘带B细胞淋巴瘤; SMZL :脾MZL ;HCL:毛细胞白血病; PC:浆细胞瘤;DLBL: B-弥漫性大细胞淋巴瘤; BL: Burkitts淋巴瘤; HBLB:高度B细胞淋巴瘤, Burkitts样; TLB L: 前T原始淋巴细胞淋巴瘤/白血病; TPLL: T幼淋细胞白血病; LGLT:大颗粒淋巴细胞白血病, T细胞型[col
流式细胞仪在白血病诊断的应用 。正文在附件里。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=2421]相关附件[/url]
概念:细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。基本步骤:1、取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在10%胎牛血清的DMEM培养液中备用。2、将细胞悬液作梯度倍数稀释,每组细胞分别以每皿50、100、200个细胞的梯度密度分别接种含10mL 37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。置37℃ 5% CO2及饱和湿度的细胞培养箱中培养2~3周。3、经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加4%多聚甲醛固定细胞5mL固定15分钟。然后去固定液,加适量GIMSA应用染色液染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。4、将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数。最后计算克隆形成率。克隆形成率 =(克隆数/接种细胞数)×100%平板克隆形成试验方法简单,适用于贴壁生长的细胞。适宜底物为玻璃的、塑料瓶皿。试验成功的关键是细胞悬液的制备和接种密度。细胞一定要分散得好,不能有细胞团,接种密度不能过大。
鉴于本人还是零蛋一个,特发此贴,虽然得分不是最主要目的,但零分确实很让人难受啊!单克隆抗体的研制一、单克隆抗体的概念抗体是机体在抗原刺激下产生的能与该抗原特异性结合的免疫球蛋白。常规的抗体制备是通过动物免疫并采集抗血清的方法产生的,因而抗血清通常含有针对其他无关抗原的抗体和血清中其他蛋白质成分。一般的抗原分子大多含有多个不同的抗原决定簇,所以常规抗体也是针对多个不同抗原决定簇抗体的混合物。即使是针对同一抗原决定簇的常规血清抗体,仍是由不同B细胞克隆产生的异质的抗体组成。因而,常规血清抗体又称多克隆抗体(polyclonal antibody),简称多抗。由于常规抗体的多克隆性质,加之不同批次的抗体制剂质量差异很大,使它在免疫化学试验等使用中带来许多麻烦。因此,制备针对预定抗原的特异性均质的且能保证无限量供应的抗体是免疫化学家长期梦寐以求的目标。随着杂交瘤技术的诞生,这一目标得以实现。1975年,Kohler和Milstein建立了淋巴细胞杂交瘤技术,他们把用预定抗原免疫的小鼠脾细胞与能在体外培养中无限制生长的骨髓瘤细胞融合,形成B细胞杂交瘤。这种杂交瘤细胞具有双亲细胞的特征,既像骨髓瘤细胞一样在体外培养中能无限地快速增殖且永生不死,又能像脾淋巴细胞那样合成和分泌特异性抗体。通过克隆化可得到来自单个杂交瘤细胞的单克隆系,即杂交瘤细胞系,它所产生的抗体是针对同一抗原决定簇的高度同质的抗体,即所谓单克隆抗体(monoclonal antibody),简称单抗。与多抗相比,单抗纯度高,专一性强、重复性好、且能持续地无限量供应。单抗技术的问世,不仅带来了免疫学领域里的一次革命,而且它在生物医学科学的各个领域获得极广泛的应用,促进了众多学科的发展。Kohler和Milstein两人由此杰出贡献而荣获1984年度诺贝尔生理学和医学奖。二、杂交瘤技术(一) 杂交瘤技术的诞生淋巴细胞杂交瘤技术的诞生是几十年来免疫学在理论和技术两方面发展的必然结果,抗体生成的克隆选择学说、抗体基因的研究、抗体结构与生物合成以及其多样性产生机制的揭示等,为杂交瘤技术提供了必要理论基础,同时,骨髓瘤细胞的体外培养、细胞融合与杂交细胞的筛选等提供了技术贮备。1975年8月7日,Kohler和Milstein在英国《自然》杂志上发表了题为“分泌具有预定特异性抗体的融合细胞的持续培养”(Continuous cultures of fused cells secreting antibody of predefined specificity)的著名论文。他们大胆地把以前不同骨髓瘤细胞之间的融合延伸为将丧失合成次黄嘌呤-鸟嘌呤磷酸核糖转移酶(hypoxanthine guanosine phosphoribosyl transferase,HGPRT)的骨髓瘤细胞与经绵羊红细胞免疫的小鼠脾细胞进行融合。融合由仙台病毒介导,杂交细胞通过在含有次黄嘌呤(hypoxanthine,H)、氨基喋呤(aminopterin,A)和胸腺嘧啶核苷(thymidine,T)的培养基(HAT)中生长进行选择。在融合后的细胞群体里,尽管未融合的正常脾细胞和相互融合的脾细胞是HGPRT+,但不能连续培养,只能在培养基中存活几天,而未融合的HGPRT-骨髓瘤细胞和相互融合的HGPRT-骨髓瘤细胞不能在HAT培养基中存活,只有骨髓瘤细胞与脾细胞形成的杂交瘤细胞因得到分别来自亲本脾细胞的HGPRT和亲本骨髓瘤细胞的连续继代特性,而在HAT培养基中存活下来。实验的结果完全像起始设计的那样,最终得到了很多分泌抗绵羊红细胞抗体的克隆化杂交瘤细胞系。用这些细胞系注射小鼠后能形成肿瘤,即所谓杂交瘤。生长杂交瘤的小鼠血清和腹水中含有大量同质的抗体,即单克隆抗体。这一技术建立后不久,在融合剂和所用的骨髓瘤细胞系等方面即得到改进。最早仙台病毒被用做融合剂,后来发现聚乙二醇(PEG)的融合效果更好,且避免了病毒的污染问题,从而得到广泛的应用。随后建立的骨髓瘤细胞系如SP2/0-Ag14,X63-Ag8.653和NSO/1都是既不合成轻链又不合成重链的变种,所以由它们产生的杂交瘤细胞系,只分泌一种针对预定的抗原的抗体分子,克服了骨髓瘤细胞MOPC-21等的不足。再后来又建立了大鼠、人和鸡等用于细胞融合的骨髓瘤细胞系,但其基本原理和方法是一样的。(二) 基本程序和方法杂交瘤技术在具体操作上,各实验室使用的程序不尽一致。本节中介绍的方法是作者所在实验室采用的、实践证明成熟的程序,该程序适合国内大多数实验室。在开展杂交瘤技术制备单抗之前,培养骨髓瘤和杂交瘤细胞必须具备下列主要仪器设备:超净工作台、CO2恒温培养箱、超低温冰箱(-70℃)、倒置显微镜、精密天平或电子天平、液氮罐、离心机(水平转子,4000r/min)、37℃水浴箱、纯水装置、滤器、真空泵等。其需要的主要器械包括:100ml、50ml、25ml细胞培养瓶,10ml、1ml刻度吸管,试管,滴管(弯头、直头),平皿,烧杯,500ml、250ml、100ml盐水瓶,青霉素小瓶,10ml、5ml、1ml注射器等,96孔、24孔细胞培养板,融合管(50ml圆底带盖玻璃或塑料离心管),眼科剪刀,眼科镊,血细胞计数板,可调微量加样器(~50ul,~200ul,~1000ul),弯头针头,200目筛网,小鼠固定装置等。此外,杂交瘤细胞的筛选与检测的仪器设备,依据检测单抗的方法不同而各异,请参阅本节有关部分。淋巴细胞杂交瘤技术的主要步骤包括:动物免疫、细胞融合、杂交瘤细胞的筛选与单抗检测、杂交瘤细胞的克隆化、冻存、单抗的鉴定等,图6-1概括了淋巴细胞杂交瘤技术研制单抗的主要过程。1、动物免疫(1) 抗原制备 制备单克隆抗体的免疫抗原,从纯度上说虽不要求很高,但高纯度的抗原使得到所需单抗的机会增加,同时可以减轻筛选的工作量。因此,免疫抗原是越纯越好,应根据所研究的抗原和实验室的条件来决定。一般来说,抗原的来源有限,或性质不稳定,提纯时易变性,或其免疫原性很强,或所需单抗是用于抗原不同组分的纯化或分析等,免疫用的抗原只需初步提纯甚至不提纯,但抗原中混杂物很多,特别是如果这些混杂物的免疫原性较强时,则必须对抗原进行纯化。检测用抗原可以是与免疫抗原纯度相同,也可是不同的纯度,这主要决定于所用筛检方法的种类及其特异性和敏感性。(2) 免疫动物的选择 根据所用的骨髓瘤细胞可选用小鼠和大鼠作为免疫动物。因为,所有的供杂交瘤技术用的小鼠骨髓瘤细胞系均来源于BALB/c小鼠,所有的大鼠骨髓瘤细胞都来源于LOU/c大鼠,所以一般的杂交瘤生产都是用这两种纯系动物作为免疫动物。但是,有时为了特殊目的而需进行种间杂交,则可免疫其他动物。种间杂交瘤一般分泌抗体的能力不稳定,因为染色体容易丢失。就小鼠而言,初次免疫时以8-12周龄为宜,雌性鼠较便于操作。(3) 免疫程序的确定 免疫是单抗制备过程中的重要环节之一,其目的在于使B淋巴细胞在特异抗原刺激下分化、增殖,以利于细胞融合形成杂交细胞,并增加获得分泌特异性抗体的杂交瘤的机会。因此在设计免疫程序时,应考虑到抗原的性质和纯度、抗原量、免疫途径、免疫次数与间隔时间、佐剂的应用及动物对该抗原的应答能力等。没有一个免疫程序能适用于各种抗原。现用的免疫程序中多数是参照制备常规多克隆抗体的方法。表6-1列举了目前常用的免疫程序。免疫途径常用体内免疫法包括皮下注射、腹腔或静脉注射,也采用足垫、皮内、滴鼻或点眼。最后一次加强免疫多采用腹腔或静脉注射,目前尤其推崇后者,因为可使抗原对脾细胞作用更迅速而充分。在最后一次加强免疫后第3天取脾融合为好,许多实验室的结果表明,初次免疫和再次免疫应答反应中,取脾细胞与骨髓瘤细胞融合,特异性杂交瘤的形成高峰分别为第4天和第22天,在初次免疫应答时获得的杂交瘤主要分泌IgM抗体,再次免疫应答时获得的杂交瘤主要分泌IgG抗体。笔者体会阳性杂交瘤出现的高峰与小鼠血清抗体的滴度并无明显的平行关系,且多在血清抗体高峰之前。因此,为达到最高的杂交瘤形成率需要有尽可能多的浆母细胞,这在最后一次加强免疫后第3天取脾进行融合较适宜。已有人报道采用脾内免疫,可提高小鼠对抗原的免疫反应性,且节省时间,一般免疫3天后即可融合。
[size=16px]克隆形成实验[/size][size=16px]及划痕实验[/size][size=16px]、[/size][size=16px]流式细胞术[/size][size=16px]操作步骤[/size]软琼脂克隆形成实验检测单细胞克隆形成能力软琼脂克隆形成实验适用于悬浮生长的细胞。1. 配胶液:用蒸馏水和琼脂糖粉配制浓度为 0.3% 的琼脂糖液,高压灭菌,置于42℃ 水浴锅中,目的是为了使其保持融化状态。2. 配制含 20% FBS 的 2×1640 培养基,用 0.22 ?m 的滤器过滤除菌。3. 铺下层胶:将 0.6% 的琼脂糖胶液与 2×1640 培养基等体积混合,以每孔 1.5mL 加至 6 孔板中,室温等其凝固。4. 细胞计数:将细胞用 PBS 洗一遍,离心,加入新的培养基混匀稀释,计数。H69-NC、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2 均以 1×104/孔铺入 6 孔板。5. 铺上层胶:将 0.3% 的琼脂糖胶液与 2× 培养基 1:1 混合,加入 100 μL 细胞悬液,混匀后,每孔加入 1.5 mL 混合液。6. 放入 37℃,5%CO2 培养箱培养,约 2-3 周后终止培养。7. 比较细胞克隆形成能力的差异,利用 Graphpad prism5 作图计算两种细胞克隆形成能力的差异。平板克隆形成实验检测单细胞克隆形成能力平板克隆形成实验适用于贴壁生长的细胞。1. 细胞处理:将 SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞,用 PBS洗一遍,用胰酶消化并计数。2. 接种细胞: 将细胞接种于 6 孔板中, SW1271-NC 、SW1271-shMSI1-1 、SW1271-shMSI1-2 接种密度为 3×103/孔,注意一定让细胞均匀分布。于 37℃,隔离CO2 静置培养 2-3 周(终止培养时间以不小于 2 周且克隆之间不发生融合为标准)。3. 出现肉眼可见的克隆时,终止培养。弃去旧培养基, 用 PBS 清洗 2 次,用 4% 多聚甲醛固定液固定 20 min,吸除固定液,用蒸馏水清洗 2 次后加适量结晶紫染色15-20 min,用蒸馏水洗去结晶紫,自然风干,用扫描仪扫描成图片。4. 在低倍镜下计数大于 50 个细胞的克隆数。5. 计算克隆形成率。细胞划痕实验1. 用记号笔在 12 孔板底部划两条平行线做为标记。2. 将 SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞接种至 6 孔板。3. 待细胞汇合度为 90% 左右时,用 10μL 枪头垂直于两条平行标记线进行划痕。4. 吸除培养基,1xPBS 漂洗 2 次,并换用无血清培养基培养。5. 分别在划痕后培养 0h,12h,24h,48h,72h 观察细胞迁移情况并拍照。流式细胞术1. 收集 H69、H82、H526、SW1271 的对照组和实验组细胞(包括培养上清中的细胞),收集 1 - 10 ×105 个细胞,用预冷 PBS 离心洗涤。用双蒸水稀释 5 ×Binding Buffer为 1 × 工作液,取 500 μl 1 × Binding Buffer 重悬细胞。2. 每管加入 5 μl Annexin V-APC 和 10 μl 7-AAD。3. 轻柔涡旋混匀后,室温避光孵育 5 分钟。4. 上机进行分析。
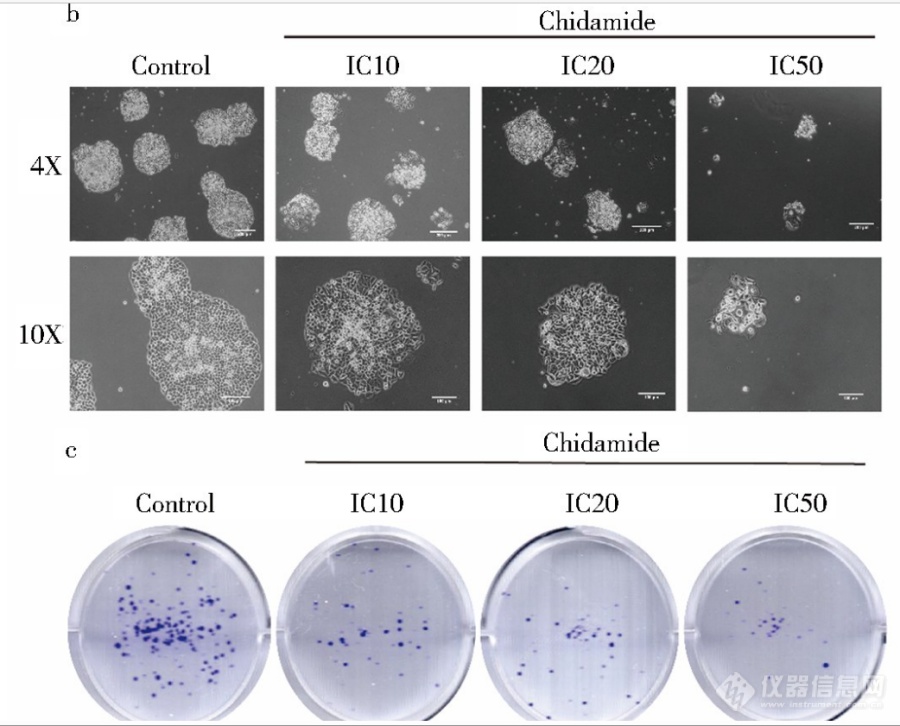
显微镜下西达本胺影响细胞克隆平板克隆的结果显示,随着加药浓度的增加克隆集落数减少,且单个集落体积逐渐减小(图 b).平板克隆结晶紫染色结果同样印证了上述结果,集落数明显减少(图c).由此可见,西达本胺显著影响 了结肠癌细胞的生物学形态和克隆形成能力. [img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306302201105759_3735_5389809_3.png[/img]
[font=宋体]慢病毒构建稳转细胞系的原理主要是利用慢病毒载体将外源基因导入宿主细胞,并实现外源基因的稳定表达。具体来说,构建稳转细胞系的核心是将慢病毒矢量载体导入宿主细胞中,慢病毒载体通常包含病毒的复制和包装组件,以及外源基因的表达调控序列。当慢病毒载体被导入宿主细胞后,它可以利用细胞的复制和转录机制将外源基因插入宿主细胞的染色体中,从而实现外源基因的稳定表达。[/font][font=宋体] [/font][font=宋体][b]构建稳定的慢病毒转染细胞系是在细胞中稳定表达外源基因的一种有效方法。下面是一般慢病毒构建稳定转染细胞系的步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、选择慢病毒载体: 选择适当的慢病毒载体,通常是一个包含[/font][font=Calibri]LTR[/font][font=宋体]、包装信号、引导[/font][font=Calibri]RNA[/font][font=宋体]序列和多功能质粒载体的质粒。这个载体应该包含要表达的外源基因。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、转染慢病毒包装细胞: 使用慢病毒包装细胞系,例如[/font][font=Calibri]293T[/font][font=宋体]或其他适合的细胞系。这些细胞通常被选择因为它们能够支持慢病毒复制和包装。将慢病毒载体与包装蛋白的表达质粒一同转染进这些细胞中。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、病毒产生和收集: 慢病毒包装细胞会开始产生慢病毒颗粒,这些颗粒包含了慢病毒载体和外源基因。培养一定时间后,收集细胞培养上清液,这是富含病毒的液体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、测定病毒滴度: 对采集的上清液进行病毒滴度的测定,通常可以通过转染一定数量的目标细胞,然后测定这些细胞的感染率来确定病毒的滴度。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、转染目标细胞: 将上一步获得的病毒用于转染目标细胞。这些目标细胞可以是要建立稳定转染细胞系的细胞。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、筛选稳定细胞系: 添加适当的筛选物质,例如抗生素,以选择表达了外源基因的细胞。这可以通过在培养基中添加抗生素,使得只有表达了外源基因的细胞能够存活下来。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、单克隆分离: 对稳定表达细胞群进行单克隆分离,以确保每个克隆都来自单一细胞。这有助于保持表达的一致性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、验证表达: 对所得的单克隆细胞系进行验证,确认外源基因的表达水平和稳定性。这可以通过[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]、[/font][font=Calibri]Western blotting[/font][font=宋体]等分子生物学技术来实现。[/font][/font][font=宋体] [/font][font=宋体]通过这些步骤,可以建立一个稳定表达外源基因的慢病毒转染细胞系,为后续的实验和研究提供了有力的工具。这种方法常用于基因功能研究、药物筛选和基因治疗等领域。[/font][font=宋体] [/font][font=宋体][b]慢病毒构建稳转细胞系的优点:[/b][/font][font=宋体] [/font][font=宋体]与常用的转染方法相比,慢病毒构建稳转细胞系有以下几个优点:[/font][font=宋体] [/font][font=宋体]①高效性:慢病毒能够将外源基因整合到宿主细胞基因组中,实现稳定的外源基因表达。[/font][font=宋体] [/font][font=宋体]②特异性:由于慢病毒的感染和复制比较特异,只会影响一定类型的细胞,因此可以实现对具体细胞的选择性转染。[/font][font=宋体] [/font][font=宋体]③安全性:慢病毒的基因转移速度较缓慢,对宿主细胞和人体的损伤较小,因此具有较高的安全性。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/stable-cell-line-development-service][b]稳转细胞株构建服务[/b][/url],包含过表达细胞系构建服务和[/font][font=Calibri]CHO[/font][font=宋体]稳定细胞株开发服务,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/stable-cell-line-development-service[/font][/font]
新华社悉尼12月11日电(记者赵小娜)澳大利亚研究者日前表示,他们对一种白血病新药的试验显示出较好的初步效果,有20%的患者血液中已检测不到癌细胞,这种新药有可能为白血病患者带来治愈希望。 据当地媒体报道,慢性淋巴细胞性白血病是澳大利亚最常见的白血病类型,对这种病一直缺乏有效的治疗方法。澳大利亚“沃尔特与伊丽莎?霍尔医学研究所”经数年研究开发出了这种代号为ABT-199的新药,目前正在墨尔本两家医院对数十名患者进行临床试验。 研究人员康宁·塔姆博士说,经过一年半的试验,有20%的患者血液中已检测不到癌细胞。他说,之前很多患者对化疗和其他治疗方法没有任何积极反应,只能任病情恶化,而“新药完全改变了这一现状”,患者有望恢复健康重回正常生活。 塔姆博士表示,这种药物上市销售还需几年时间,但对愿意参与试验的患者,研究者现在即可提供这种药物。(完)
我在做免疫分析的时候想通过聚电解质静电吸附方法来固定单克隆抗体,想请教一下小鼠抗人单克隆IgG等电点一般多少?邮箱: lgs005@126.com谢谢,望不吝指教!
[font=宋体][font=宋体]单克隆抗体是由单个[/font][font=Calibri]B[/font][font=宋体]细胞克隆产生的高度均一、特异性针对某一抗原表位的抗体。通过使用杂交瘤技术,科学家们将具有分泌特异性抗体能力的致敏[/font][font=Calibri]B[/font][font=宋体]细胞与具有无限繁殖能力的骨髓瘤细胞融合,形成了独特的[/font][font=Calibri]B[/font][font=宋体]细胞杂交瘤。[/font][/font][font=宋体][font=Calibri]1975[/font][font=宋体]年分子生物学家[/font][font=Calibri]G.J.F.[/font][font=宋体]克勒和[/font][font=Calibri]C.[/font][font=宋体]米尔斯坦在自然杂交技术的基础上,创建立杂交瘤技术,他们把可在体外培养和大量增殖的小鼠骨髓瘤细胞与经抗原免疫后的纯系小鼠[/font][font=Calibri]B[/font][font=宋体]细胞融合,成为杂交细胞系,既具有瘤细胞易于在体外无限增殖的特性,又具有抗体形成细胞的合成和分泌特异性抗体的特点。将这种杂交瘤作单个细胞培养,可形成单细胞系,即单克隆。利用培养或小鼠腹腔接种的方法,便能得到大量的、高浓度的、非常均一的抗体,其结构、氨基酸顺序、特异性等都是一致的,而且在培养过程中,只要没有变异,不同时间所分泌的抗体都能保持同样的结构与机能。这种单克隆抗体是用其他方法所不能得到的。[/font][/font][font=宋体] [/font][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-production][b]单克隆抗体[/b][/url][b]的优势和局限性[/b][/font][font=宋体][font=Calibri]1[/font][font=宋体].单克隆抗体的优点[/font][/font][font=宋体][font=Calibri](1)[/font][font=宋体]杂交瘤可以在体外“永久”地存活并传代,只要不发生细胞株的基因突变,就可以不断地生产高特异性、高均一性的抗体。[/font][/font][font=宋体][font=Calibri](2)[/font][font=宋体]可以用相对不纯的抗原,获得大量高度特异的、均一的抗体。[/font][/font][font=宋体][font=Calibri](3)[/font][font=宋体]由于可能得到“无限量”的均一性抗体,所以适用于以标记抗体为特点的免疫学分析方法,如[/font][font=Calibri]IRMA[/font][font=宋体]和[/font][font=Calibri]ELISA[/font][font=宋体]等。[/font][/font][font=宋体][font=Calibri](4)[/font][font=宋体]由于单克隆抗体的高特异性和单一生物学功能,可用于体内的放射免疫显像和免疫导向治疗。[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体].单克隆抗体的局限性[/font][/font][font=宋体][font=Calibri](1)[/font][font=宋体]单克隆抗体固有的亲和性和局限的生物活性限制了它的应用范围。由于单克隆抗体不能进行沉淀和凝集反应,所以很多检测方法不能用单克隆抗体完成。[/font][/font][font=宋体][font=Calibri](2)[/font][font=宋体]单克隆抗体的反应强度不如多克隆抗体。[/font][/font][font=宋体][font=Calibri](3)[/font][font=宋体]制备技术复杂,而且费时费工,所以单克隆抗体的价格也较高 。[/font][/font][font=宋体] [/font][font=宋体][b]单克隆抗体的应用[/b][/font][font=宋体] [/font][font=宋体]如今,单克隆抗体广泛应用于癌症治疗、医疗诊断和基础研究等方面。[/font][font=宋体] [/font][font=宋体]①癌症治疗应用[/font][font=宋体][font=宋体]用于癌症治疗的单克隆抗体旨在结合癌症细胞表面的抗原,相比于健康细胞,这种抗原通常在癌细胞过表达。通过[/font][font=宋体]“瞄准”这些抗原,抗体可以锁定癌细胞,并在免疫系统中充当其他免疫战士的“战斗号令”。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]美国食品和药物管理局([/font][font=Calibri]FDA[/font][font=宋体])已经批准了[/font][font=Calibri]100[/font][font=宋体]多种单克隆抗体用于治疗不同类型的癌症,包括乳腺癌、头颈癌、肺癌、肝癌、膀胱癌、黑色素瘤以及霍奇金淋巴瘤等。有报道称,单克隆抗体首次用于晚期黑色素瘤,将部分患者的生存延长了[/font][font=Calibri]10[/font][font=宋体]年之久。[/font][/font][font=宋体] [/font][font=宋体]②医疗诊断应用[/font][font=宋体][font=宋体]单克隆抗体的出现,已经变革了多种疾病的实验室诊断。它们可作为生物化学分析的诊断试剂,也可作为疾病诊断影像的工具。基于单抗试剂的诊断检测一般可用于实验室中的放射免疫测定([/font][font=Calibri]RIA[/font][font=宋体])和酶联免疫吸附测定([/font][font=Calibri]ELISA[/font][font=宋体])。[/font][/font][font=宋体]单克隆抗体已用于例如妊娠、激素紊乱、传染病和癌症等疾病的早期诊断。[/font][font=宋体] [/font][font=宋体]③基础研究应用[/font][font=宋体][font=宋体]在基础研究中,研究人员可以使用单克隆抗体通过蛋白质印迹、流式细胞术、免疫组化([/font][font=Calibri]IHC[/font][font=宋体])、酶联免疫吸附测定([/font][font=Calibri]ELISA[/font][font=宋体])等多种方法来识别目标分子。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/resource/antibody-technical/mab-development][b]单克隆抗体开发[/b][/url]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/mab-development[/font][/font][font=Calibri] [/font]
[size=4]人类体细胞克隆胚胎是福还是祸?!进行人类治疗性克隆研究,造福人类呢?还是制造克隆人的时代到来?福兮?祸兮?[/size]
[font=宋体][font=宋体]单克隆抗体是由单一[/font][font=Calibri]B[/font][font=宋体]细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。通常采用杂交瘤技术来制备,杂交瘤([/font][font=Calibri]hybridoma[/font][font=宋体])抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的致敏[/font][font=Calibri]B[/font][font=宋体]细胞和具有无限繁殖能力的骨髓瘤细胞融合为[/font][font=Calibri]B[/font][font=宋体]细胞杂交瘤。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1975[/font][font=宋体]年分子生物学家[/font][font=Calibri]G.J.F.[/font][font=宋体]克勒和[/font][font=Calibri]C.[/font][font=宋体]米尔斯坦在自然杂交技术的基础上,创建立杂交瘤技术,他们把可在体外培养和大量增殖的小鼠骨髓瘤细胞与经抗原免疫后的纯系小鼠[/font][font=Calibri]B[/font][font=宋体]细胞融合,成为杂交细胞系,既具有瘤细胞易于在体外无限增殖的特性,又具有抗体形成细胞的合成和分泌特异性抗体的特点。将这种杂交瘤作单个细胞培养,可形成单细胞系,即单克隆。利用培养或小鼠腹腔接种的方法,便能得到大量的、高浓度的、非常均一的抗体,其结构、氨基酸顺序、特异性等都是一致的,而且在培养过程中,只要没有变异,不同时间所分泌的抗体都能保持同样的结构与机能。这种单克隆抗体是用其他方法所不能得到的。[/font][/font][font=宋体] [/font][font=宋体][b]单克隆抗体的优势和局限性[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体].单克隆抗体的优点[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](1)[/font][font=宋体]杂交瘤可以在体外“永久”地存活并传代,只要不发生细胞株的基因突变,就可以不断地生产高特异性、高均一性的抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](2)[/font][font=宋体]可以用相对不纯的抗原,获得大量高度特异的、均一的抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](3)[/font][font=宋体]由于可能得到“无限量”的均一性抗体,所以适用于以标记抗体为特点的免疫学分析方法,如[/font][font=Calibri]IRMA[/font][font=宋体]和[/font][font=Calibri]ELISA[/font][font=宋体]等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](4)[/font][font=宋体]由于单克隆抗体的高特异性和单一生物学功能,可用于体内的放射免疫显像和免疫导向治疗。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体].单克隆抗体的局限性[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](1)[/font][font=宋体]单克隆抗体固有的亲和性和局限的生物活性限制了它的应用范围。由于单克隆抗体不能进行沉淀和凝集反应,所以很多检测方法不能用单克隆抗体完成。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](2)[/font][font=宋体]单克隆抗体的反应强度不如多克隆抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri](3)[/font][font=宋体]制备技术复杂,而且费时费工,所以单克隆抗体的价格也较高 。[/font][/font][font=宋体] [/font][font=宋体][b]单克隆抗体的应用[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体].检验医学诊断试剂[/font][/font][font=宋体] [/font][font=宋体]作为检验医学实验室的诊断试剂,单克隆抗体以其特异性强、纯度高、均一性好等优点,广泛应用于酶联免疫吸附试验、放射免疫分析、免疫组化和流式细胞仪等技术。并且单克隆抗体的应用,很大程度上促进了商品化试剂盒的发展。[/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体].蛋白质的提纯[/font][/font][font=宋体] [/font][font=宋体][font=宋体]单克隆抗体是亲和层析中重要的配体。将单克隆抗体吸附在一个惰性的固相基质(如[/font][font=Calibri]Speharose 2B[/font][font=宋体]、[/font][font=Calibri]4B[/font][font=宋体]、[/font][font=Calibri]6B[/font][font=宋体]等)上,并制备成层析柱。当样品流经层析柱时,待分离的抗原可与固相的单克隆抗体发生特异性结合,其余成分不能与之结合。将层析柱充分洗脱后,改变洗脱液的离子强度或[/font][font=Calibri]pH[/font][font=宋体],欲分离的抗原与抗体解离,收集洗脱液便可得到欲纯化的抗原。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]. 肿瘤的导向治疗和放射免疫显像技术[/font][/font][font=宋体] [/font][font=宋体][font=宋体]将针对某一肿瘤抗原的单克隆抗体与化疗药物或放疗物质连接,利用单克隆抗体的导向作用,将药物或放疗物质携带至靶器官,直接杀伤靶细胞,称为肿瘤导向治疗。另外,将放射性标记物与单克隆抗体连接,注入患者体内可进行放射免疫显像,协助肿瘤的诊断。单克隆抗体主要为鼠源性抗体,异种动物血清可引起人体过敏反应。因此,制备人[/font][font=Calibri]-[/font][font=宋体]人单克隆抗体或人源化抗体更为重要,但此方面仍未取得明显进展。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]目前义翘神州提供[url=https://cn.sinobiological.com/services/monoclonal-antibody-production-services][b]单克隆抗体定制服务[/b][/url],有需求可查看详情[/font][font=Calibri]https://cn.sinobiological.com/services/monoclonal-antibody-production-services[/font][/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-technology][b]单克隆抗体技术[/b][/url]详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-technology[/font][/font]
[font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-technology][b]单克隆抗体[/b][/url]是由单一[/font][font=Calibri]B[/font][font=宋体]细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。通常采用杂交瘤技术来制备,杂交瘤([/font][font=Calibri]hybridoma[/font][font=宋体])抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的致敏[/font][font=Calibri]B[/font][font=宋体]细胞和具有无限繁殖能力的骨髓瘤细胞融合为[/font][font=Calibri]B[/font][font=宋体]细胞杂交瘤。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1975[/font][font=宋体]年分子生物学家[/font][font=Calibri]G.J.F.[/font][font=宋体]克勒和[/font][font=Calibri]C.[/font][font=宋体]米尔斯坦在自然杂交技术的基础上,创建立杂交瘤技术,他们把可在体外培养和大量增殖的小鼠骨髓瘤细胞与经抗原免疫后的纯系小鼠[/font][font=Calibri]B[/font][font=宋体]细胞融合,成为杂交细胞系,既具有瘤细胞易于在体外无限增殖的特性,又具有抗体形成细胞的合成和分泌特异性抗体的特点。将这种杂交瘤作单个细胞培养,可形成单细胞系,即单克隆。利用培养或小鼠腹腔接种的方法,便能得到大量的、高浓度的、非常均一的抗体,其结构、氨基酸顺序、特异性等都是一致的,而且在培养过程中,只要没有变异,不同时间所分泌的抗体都能保持同样的结构与机能。这种单克隆抗体是用其他方法所不能得到的。[/font][/font][font=宋体] [/font][font=宋体][b]单克隆抗体的优势和局限性[/b][/font][font=宋体][font=Calibri]1[/font][font=宋体].单克隆抗体的优点[/font][/font][font=宋体][font=Calibri](1)[/font][font=宋体]杂交瘤可以在体外“永久”地存活并传代,只要不发生细胞株的基因突变,就可以不断地生产高特异性、高均一性的抗体。[/font][/font][font=宋体][font=Calibri](2)[/font][font=宋体]可以用相对不纯的抗原,获得大量高度特异的、均一的抗体。[/font][/font][font=宋体][font=Calibri](3)[/font][font=宋体]由于可能得到“无限量”的均一性抗体,所以适用于以标记抗体为特点的免疫学分析方法,如[/font][font=Calibri]IRMA[/font][font=宋体]和[/font][font=Calibri]ELISA[/font][font=宋体]等。[/font][/font][font=宋体][font=Calibri](4)[/font][font=宋体]由于单克隆抗体的高特异性和单一生物学功能,可用于体内的放射免疫显像和免疫导向治疗。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体].单克隆抗体的局限性[/font][/font][font=宋体][font=Calibri](1)[/font][font=宋体]单克隆抗体固有的亲和性和局限的生物活性限制了它的应用范围。由于单克隆抗体不能进行沉淀和凝集反应,所以很多检测方法不能用单克隆抗体完成。[/font][/font][font=宋体][font=Calibri](2)[/font][font=宋体]单克隆抗体的反应强度不如多克隆抗体。[/font][/font][font=宋体][font=Calibri](3)[/font][font=宋体]制备技术复杂,而且费时费工,所以单克隆抗体的价格也较高。[/font][/font][font=宋体] [/font][font=宋体][b]单克隆抗体的应用[/b][/font][font=宋体][font=Calibri]1[/font][font=宋体].检验医学诊断试剂[/font][/font][font=宋体]作为检验医学实验室的诊断试剂,单克隆抗体以其特异性强、纯度高、均一性好等优点,广泛应用于酶联免疫吸附试验、放射免疫分析、免疫组化和流式细胞仪等技术。并且单克隆抗体的应用,很大程度上促进了商品化试剂盒的发展。[/font][font=宋体][font=Calibri]2[/font][font=宋体].蛋白质的提纯[/font][/font][font=宋体][font=宋体]单克隆抗体是亲和层析中重要的配体。将单克隆抗体吸附在一个惰性的固相基质(如[/font][font=Calibri]Speharose 2B[/font][font=宋体]、[/font][font=Calibri]4B[/font][font=宋体]、[/font][font=Calibri]6B[/font][font=宋体]等)上,并制备成层析柱。当样品流经层析柱时,待分离的抗原可与固相的单克隆抗体发生特异性结合,其余成分不能与之结合。将层析柱充分洗脱后,改变洗脱液的离子强度或[/font][font=Calibri]pH[/font][font=宋体],欲分离的抗原与抗体解离,收集洗脱液便可得到欲纯化的抗原。[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体].肿瘤的导向治疗和放射免疫显像技术[/font][/font][font=宋体][font=宋体]将针对某一肿瘤抗原的单克隆抗体与化疗药物或放疗物质连接,利用单克隆抗体的导向作用,将药物或放疗物质携带至靶器官,直接杀伤靶细胞,称为肿瘤导向治疗。另外,将放射性标记物与单克隆抗体连接,注入患者体内可进行放射免疫显像,协助肿瘤的诊断。单克隆抗体主要为鼠源性抗体,异种动物血清可引起人体过敏反应。因此,制备人[/font][font=Calibri]-[/font][font=宋体]人单克隆抗体或人源化抗体更为重要,但此方面仍未取得明显进展。[/font][/font][font=宋体][font=宋体]义翘神州提供多种单克隆抗体、多克隆抗体、一抗、二抗、抗体蛋白等生物试剂、抗体试剂应用于细胞学、免疫蛋白质组化、[url=https://cn.sinobiological.com/services/molecular-biology-service][b]分子生物学技术服务[/b][/url][/font][font=宋体]……。详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-technology[/font][/font][font=Calibri] [/font]
根据流行病学的统计,中国白血病的自然发病率为3/10万~4/10万,并成增长趋势。卫生纸是每个家庭必备的生活用品,但是你可能不知道,它居然也会引发白血病。白血病又叫血癌,是一种难以治疗的疾病。劣质卫生纸易引发白血病 有些女孩子平时在穿着打扮上非常注意,舍得花几百几千买新衣服和化妆品,但在选择卫生纸这样的细节化商品时,却不太在意,往往拣廉价便宜的买。殊不知,有些劣质卫生纸虽然颜色亮白,是因为其中添加了荧光增白剂或滑石粉,长期与皮肤接触容易引发白血病。还有的用废纸经过漂白后加工而成,很可能含大肠杆菌、肝炎病毒等。所以对小小的卫生用品千万不能掉以轻心,一定要选购正规品牌的产品,不要因追求一时的廉价而伤害了自己的一生健康。从生活点滴中学会预防白血病 近年来,有关白血病的报道频现报端,引起了广大读者的关注。由于白血病病情发展变化快、治疗难度大、死亡率高,以至于让人感到“谈白色变”。专家级介绍,人类白血病的确切病因至今未明,许多因素被认为和白血病的发病有关。病毒被认为是主要的因素。此外尚有遗传因素,放射性因素,化学毒物或药物等要素。 全国目前有400万名白血病患者,每年新增约4万名白血病患者,其中2万多名是儿童,而且以2~9岁的儿童居多,其中城市白血病患儿比例占1/3,导致城市白血病患儿增多的罪魁祸首不排除家庭装修造成的污染。因为装修中常用的黏合剂、涂料、地板砖、夹板等材料会释放出甲醛、铅、苯等有毒物质,对人体的血液系统造成损害,抵抗力较弱的人就容易引发白血病。 因此建议,第一,装修住宅最好选用符合环保要求对人体无害的材料,入住前最好开窗通风一周以上,请室内环境监测部门进行监测,合格后再入住,一旦出现不明原因的出血、低烧、关节痛、头晕等症状就要到医院进行检查。 第二,不要滥用药物。使用氯霉素、细胞毒类抗癌药、免疫抑制剂等药物时要小心谨慎,必须有医生指导,切勿长期使用或滥用。此外,尽量少用或不用染发剂。美国研究人员发现使用染发剂(尤其是大量使用)的女性,患白血病的危险是普通人的3.8倍。经常接触染发剂的理发师、美容师、整容师也有潜在危害。 第三,避免辐射。一项最新研究发现,开灯睡觉的儿童或者自然睡眠模式受人造光线干扰的人,患癌症的可能性比平常人要大。最近,研究人员在伦敦举行的儿童白血病大会上提出,儿童白血病发病率增多与夜晚暴露在灯光下有关系。因此,一上床睡觉,人们就应该把灯关掉,直到第二天早晨醒来。还应注意远离高压线、变电站及正在使用的微波炉等。 第四,注意饮食卫生。因为含有化肥、农药的蔬菜水果等食物,食用后经消化吸收进入血液,容易破坏骨髓的正常造血功能,从而发病。所以,蔬菜、水果食用前要清洗干净,把化肥农药的残留量降至最低限度。 第五,预防疾病就是要多运动,中医讲“正气存内,邪不可干”,意思是说人体正气(即免疫力)充足了,病邪就不容易侵犯人体。而增强正气的最有效的方法就是多运动。
95%。目前细胞分选主要用于研究,临床应用较少。血液学应用最多的是造血干细胞的研究,最近随着造血理论的深入研究关于造血干细胞究竟是否都是CD34+细胞出现一些争论,实验研究证明, CD34-造血干细胞较CD34+造血干细胞更具造血潜能,这些实验研究所用的CD34- 和CD34+细胞就是通过细胞分选获得的。小鼠造血干细胞分选一般按lin-c-Kit+CD34+/ lin-c-Kit+CD34-分选,人造血干细胞分选一般按lin-CD34+/ lin-CD34-分选。 为避免某些遗传性血液病如海洋性贫血、异常血红蛋白病的纯合子出生,产前诊断非常重要,这些疾病的主要靶细胞是红细胞,而孕妇血循环中存在着胎儿有核红细胞,只是数量非常少,利用流式细胞仪可从孕妇血液中分选出胎儿有核红细胞(分选条件:CD45-GPA+)进行基因分析,作出产前诊断。利用流式细胞仪分选免疫担当细胞进行细胞免疫学研究也是目前的热门课题。总之,流式细胞仪能够分选出你想得到的任何一亚群细胞,只要你想得到的某一亚群细胞有合适的单克隆抗体标记,流式细胞仪的分选功能将得到越来越多的科学研究和临床应用。二十二. 流式细胞术在血液学中的应用 其他流式细胞仪可能在两方面对骨髓增生异常综合症(MDS)有用,一是测定CD34阳性细胞数,以监测病情,二是测定核蛋白增殖因子(PCNA),有报告PCNA再在生障碍性贫血、骨髓增生异常综合症、白血病三种疾病中表达有明显差异,可辅助鉴别诊断。 此外流式细胞仪也可检耐药蛋白,如肺耐药相关蛋白(LRP)、多药耐药蛋白(MRP)、 P170等。 流式细胞仪也可检测细胞因子,细胞内细胞因子如白介素系列(IL-1—IL-14),肿瘤坏死因子(TNF),干扰素(IFN)等,[/color
经过抗体测定的阳性孔,可以扩大培养,进行克隆,以得到单个细胞的后代分泌单克隆抗体。克隆的时间一般说来越早越好。因为在这个时期各种杂交瘤细胞同时旺盛生长,互相争夺营养和空间,而产生指定抗体的细胞有被淹没和淘汰的可能。但克隆时间也不宜太早,太早细胞性状不稳定,数量少也易丢失。克隆化的阳性杂交瘤细胞,经过一段时期培养之后,也还会因为细胞突变或特定染色体的丢失,使部分细胞丧失产生抗体的能力,所以需要再次或多次克隆化培养。克隆化次数的多少由分泌能力强弱和抗原的免疫性强弱而决定。一般说,免疫性强的抗原克隆次数可少一些,但至少要3~5次克隆才能稳定。克隆化的方法很多,包括有限稀释法、显微操作法、软琼脂平板法及荧光激活分离法等。一、有限稀释法1.材料① 微量培养盘,盘内各孔于克隆化前一天培养小鼠腹腔细胞(即饲养细胞)每孔2万~4万。② HT培养基2.操作方法① 取出抗体阳性孔细胞,用HT培养液制成细胞悬液。并取样进行台盼兰染色,计数。② 用HT培养液将细胞稀释成200个/ml、40个/ml、20个/ml和的悬液。③ 用吸管将细胞悬液分别种入微量培养盘,每孔0.05ml,细胞含量分别为10个/孔、2个/孔、1个/孔和0.5个/孔。④ 5%CO2饱和湿度,37℃培养。⑤ 每天用倒置显微镜观察克隆生长情况,选择只有一个集落生长的孔,弃掉两个以上和没有细胞生长的孔。⑥ 克隆大量繁殖后,布满孔底的1/3~1/2时,测培养液抗体。⑦ 抗体阳性孔细胞,移到有饲养层的组织培养瓶中,并传2~4代就可以脱离饲养细胞,建成克隆株。二、软琼脂克隆化借助撒在软琼脂上单个细胞定位生长,而达到克隆化,具体操作如下:1.配2.5%的琼脂糖30ml,水浴溶化后,移入45℃水浴中。2.将117ml完全DMEM液和3ml 10倍浓度的DMEM液混合,置45℃水浴预热。3.将琼脂糖与DMEM液混合,即为含0.5%琼脂糖的完全DMEM液,并加75×108 脾细胞。4.每块平皿加10ml,于室温中凝固。5.DMEM中的细胞与DMEM―琼脂1:1混合,将细胞琼脂混合物2ml铺于凝固的平板上,使其全部覆盖。6.放入CO2箱饱和湿度,37℃培养10天。7.用PBS配制0.6%琼脂糖,于沸水浴溶解后,置45℃,在保温情况下取一试管,迅速加入0.1ml 25%羊红血球,0.2ml豚鼠补体,2.7ml 0.6%琼脂糖。8.用3ml琼脂糖―羊红血球混合液覆盖克隆。于37℃CO2箱孵育1h~2h。从克隆上部溶解羊红血球的溶血范围,可筛选抗羊红血球Ig。三、显微镜操作法在直径6cm培养皿中,加入1ml 1.0×108 细胞悬液放置5%CO2饱和湿度,37℃温箱中放置30min以上,倒置显微镜下,寻找那些与周围相距甚远的单个细胞,将毛细管口(一头有直角弯头毛细管,一头连接一尺长乳胶管,用口控制液体进入)水平置放于液面上,左右微动,直到看见管口,对准细胞,吸入毛细管,将管中细胞移到预先加有2.0×104~5.0×104 饲养细胞96孔板内,培养后,即可获得单个细胞形成的克隆。四、荧光激活分离法用一种荧光激活细胞分类器(Fluorescein Activafed Cell Sorter,FACS)。其基本原理是:将细胞经荧光抗体染色后,经喷嘴形成单个细胞的线形液滴,在莱塞光激发下,荧光素发射荧光,此信号由光电倍增管接收,再结合细胞形态大小产生光散射信号,经电脑处理,产生信号并与预定的信号对比,根据细胞荧光强度及细胞大小不同,将细胞分成不同级别,在电场中发生偏离,而分别收集于不同容器中。
[align=center]抗肿瘤单克隆抗体药物的研究进展[/align][align=center] [/align][align=center]摘 要[/align][align=center] [/align] 通过淋巴细胞杂交瘤技术或基因工程技术制备单克隆抗体药物,已经成为生物制药领域的一个重要方面,特别是对抗肿瘤单克隆抗体药物的研究已获得了重要进展。多年来,许多研究证实了抗肿瘤单克隆抗体药物的作用,为其应用于肿瘤治疗提供了重要依据。这类药物的特异性强,疗效显著。本文主要就近年来抗肿瘤单克隆抗体药物的研究进展进行了综述,并对抗肿瘤单克隆抗体药物的发展前景进行了展望。[align=left] [/align][align=left]关键词:抗肿瘤;单克隆抗体;研究进展[/align][align=center] [/align][align=center] [/align][b]一 引言[/b]抗肿瘤单抗药物因与烷化剂、抗代谢药、抗肿瘤抗生素、铂类配合物、植物药等抗肿瘤药物相比,具有高效价、高特异性、血清交叉反应少等特点与优点,在肿瘤治疗中起着不可替代的作用。单抗药物是当前生物技术药物领域甚为活跃的部分。针对特定的分子靶点(抗原),单抗有高度特异性。针对各种不同的抗原,可以制备为数众多的、各不相同的单抗;因此,作为药物来源,单抗又具有高度多样性。由于其特异性和多样性,研制单抗药物有巨大的潜力。单克隆抗体药物治疗恶性瘤主要机制有两种[sup][/sup]:一是利用单克隆抗体本身来阻断癌细胞生长的信号,单克隆抗体在癌细胞膜外与生长因子竞争结合受体,阻断信号传递过程,从而阻止癌细胞的生长和扩散,诱导细胞凋亡或者间接激活宿主的抗肿瘤免疫反应;二是利用单克隆抗体作为药物载体的靶向治疗,如将有细胞毒性的药物或有放射性的药物靶向性的运送到肿瘤细胞,从而杀伤肿瘤细胞。目前,国际上与肿瘤治疗相关的抗体研究主要集中在将抗体与耦联物作用后直接杀伤肿瘤细胞,利用抗体促进肿瘤细胞凋亡和抑制肿瘤血管生成等方面。此外,研究表明静脉内注射抗肿瘤单抗,在肿瘤部位的浓度较高,显示特异性定位;单抗与药物的偶联物通常仍保留原来单抗的分布特征,在靶肿瘤的浓度较高[sup][/sup]。[align=center]二 单克隆抗体药物作用靶点[/align]特定受体或特定的基因表达蛋白可能作为单抗药物的靶点。Rituxan是以B细胞的CD20分子作为靶点的人鼠嵌合抗体,对非霍奇金氏B细胞淋巴瘤有疗效,是第一个获美国FDA批准用于治疗恶性肿瘤的单抗。Herceptin是抗HER-2/neu癌基因编码蛋白的单抗,临床研究对乳腺癌有效,与化疗药物联合有更显著的疗效。Mylotarg是由抗CD33单抗与calicheamicin构成的偶联物,已获批准用于治疗急性复发性髓性白血病[sup][/sup]。表皮细胞生长因子受体(EGFr)在人的鳞癌、乳腺癌和脑胶质瘤等均有较高的表达。有报道,抗EGFr单抗与长春碱衍生物的偶联物在裸鼠体内试验,显示良好的抗癌效果。抗EGFr的人鼠嵌合抗体已进入临床研究。血管内皮生长因子(VEGF)在血管生成中有重要作用。据报道,抗VEGF的中和性单抗具有广谱的抗肿瘤作用,对移植于裸鼠的人体癌瘤有显著疗效[sup][/sup]。[b]三 单抗诱发肿瘤细胞凋亡[/b][align=left] 3.1 通过免疫细胞表面抗原的交联作用而诱导恶性肿瘤细胞的凋亡[/align]用于治疗血液系统恶性肿瘤的单克隆抗体药物大多是通过免疫细胞表面抗原的交联作用诱导恶性肿瘤细胞凋亡而起作用的,如目前用的抗-CD20的单克隆抗体——美罗华。其单克隆抗体的作用机制是通过诱导CD20分子在B细胞膜上的脂筏区聚集,再在一系列激酶的作用下使脂筏信号传导区域的CD20分子亲和性增强,从而形成CD20交联形式;交联的CD20分子启动了细胞内凋亡信号的传导通路,使线粒体释放出细胞色素C,激活下游的caspase级联反应,最终导致细胞凋亡[sup][/sup]。3.2 作用于恶性肿瘤细胞膜上的生长因子及其受体而诱导细胞凋亡许多生长因子及其受体通过作用于细胞的存活途径、刺激细胞的有丝分裂、促进细胞的生长增殖来阻止细胞凋亡。与正常细胞中生长因子信号传导的严格调控相比,肿瘤细胞中的失控则导致细胞的恶性增殖,从而使恶性细胞获得“永生”。单克隆抗体通过作用于恶性肿瘤细胞膜上的生长因子及其受体可阻断存活信号传导通路,从而导致其凋亡,同时还能对化疗和放疗有正协同作用。目前主要集中在对血管内皮生长因子(VEGF)及其受体、表皮生长因子受体(EGFR)等的研究。美国FDA于2006年批准了第一个用于治疗头颈部鳞状细胞癌的单克隆抗体药物——Cetuximab,它为一种IgG1单克隆抗体,主要通过干扰癌细胞表面EGFR的生长,从而减少癌细胞进入正常组织的概率,控制癌细胞的转移,达到抗癌目的[sup][/sup]。最初想到制备针对恶性肿瘤凋亡相关分子的单克隆抗体药物时,虽然从理论上来说无疑是给人们注入了一针兴奋剂,但在实际应用中则并不然,所以在通过单克隆抗体药物诱导恶性肿瘤细胞凋亡的研究和治疗中,还有待进一步开发新的、更经济、更有效地药物。[b]四 单克隆抗体耦联物[/b]4.1 抗体与化疗药物耦联目前,国内外研究较多的与单克隆抗体耦联的化学药物有平阳霉素、柔红霉素、丝裂霉素、多柔比星(阿霉素)、顺铂以及长春碱类衍生物等。同时还可以通过脂质体靶向制剂作为化疗药靶向治疗肿瘤,利用脂质体制剂将药物导向靶标进行有选择性地杀伤癌细胞和抑制癌细胞的繁殖,以达到提高疗效和高度定向作用。目前已上市的脂质体有复方氟脲嘧多相脂质体、喜树碱多相脂质体、阿霉素脂质体和紫杉醇脂质体等。4.2 抗体导向酶耦联利用抗体与肿瘤细胞表面抗原的特异性结合,将前体药物的专一性活化酶与单抗耦联,导向输入到靶细胞部分,再注入前体药物,使其在酶的作用下转化为活性药物,进而杀伤肿瘤细胞[sup][/sup]。目前这种用作前体药物的抗癌药有苦杏仁苷、氮芥、鬼臼乙叉苷、阿霉素、丝裂霉素等。而作为活化前体药物的导向酶有碱性磷酸酶、青霉素V或G酰胺酶、羧基酶肽、胸腺嘧啶核苷酶、β葡萄苷酶等。临床研究表明,单抗耦联物对于抗药性肿瘤细胞仍显示较强的杀伤活性。对由于长期使用氨甲蝶呤而出现抗药性的成骨肉瘤细胞,单抗氨甲蝶呤耦联物仍显示较强的杀伤作用。对于具有多药抗药性(MDR)的肿瘤细胞,抗P-170糖蛋白单抗构成的免疫毒素可显示选择性杀伤作用[sup][/sup]。这说明,单抗药物有可能用于克服肿瘤细胞抗药性。[b]五 单克隆抗体靶向药物[/b]单抗靶向药物是利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物的疗效,降低药物对循环系统及其他部位的毒性。研究表明,单抗靶向药物具有很好的疗效,在免疫偶联物对移植于裸鼠的相应人体肿瘤生长有抑制作用。免疫偶联物与相应的游离物比较,具有更高更好的疗效和较低的细胞毒性[sup][/sup]。单克隆抗体体积小,能更有效地透入肿瘤;分子小、消除快、累积毒性小;所携带的弹头脱离后,可较快被清除 循环中免疫靶向结合物对靶细胞的竞争作用小;半衰期短;穿透性好;能穿过血脑屏障[sup][/sup],因而还可以作为新一代靶向载体。与化学药物、毒素、放射性核素、生物因子、基因、分化诱导剂、光敏剂、酶等物质构成单克隆抗体靶向药物,把杀伤肿瘤细胞的活性物质特异的输送到肿瘤部位,利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物疗效,降低药物对循环系统及其他部位的毒性。近年来,随着医学、药学和生物工程学及技术的进步,临床对肿瘤的根治和对癌细胞的攻击锁定于表皮生长因子和血管内皮生长因子等靶位,使药物治疗的切入点由细胞水平提升到分子和抗体水平,从而提高了肿瘤综合治疗的效果。[align=center]六 人源化单克隆抗体[/align]单克隆抗体是近年竞相开发的品种,自1997年第1个单克隆抗体rituximab通过食品与药物管理局(FDA)批准应用于临床以来,目前已经上市的单克隆抗体靶向药物的疗效令人瞩目,在抗肿瘤、类风湿性关节炎和自身免疫系统缺陷治疗领域得到了有力的推广,其以独特的作用优势,在肿瘤的治疗中不但能够选择性杀伤癌细胞,且在体内表现出特异的分布特性,具有高效、低毒的特点,从而在生物技术产品领域中占据了1/3的市场[sup][/sup]。目前用于治疗肿瘤的单克隆抗体药已有多个,包括伊珠单抗奥加米星、帕尼单抗、曲妥珠单抗等。伊珠单抗奥加米星又名CMC-544,是以人源化抗CD22的抗体伊珠单抗与 CalichDMH偶联形成的ADC药物,用来治疗复发性或难治性B细胞非霍奇金淋巴瘤(B cell-NHL)和急性淋巴细胞白血病(ALL),目前已经进入临床 III期试验[sup][/sup]。帕尼单抗是一种IgG2单克隆抗体完全人源化可以与EGFR高度特异性地结合,进而阻断配体诱导的信号激活,从而抑制肿瘤生长。有临床研究选择既往未治疗过的ⅢB或Ⅳ期非小细胞肺癌患者比较卡铂(AUC=6,每3周),加紫杉醇(200mg/m21次/3周) 联合或不联合帕尼单抗(2.5 mg/m2,1次/周) 化疗的疗效及其安全性。研究结果显示,单纯化疗组与帕尼单抗联合化疗组之间在PFS(5.3个月对比4.2个月、P=0.55)和总生存( Overall survival,OS)(8.0个月对比8.5个月,P =0.81)上均无显著差异。结果提示帕尼单抗联合一线化疗方案可能对晚期非小细胞肺癌无明显疗效[sup][/sup]。曲妥珠单抗是一种抗Her2的单克隆抗体,他可以和肿瘤细胞的HER2/neu特异性地结合,从而阻断细胞内生长信号的转导,同时曲妥珠单抗还可以诱导体内巨噬细胞以及自然杀伤细胞攻击肿瘤细胞,以达到抑制和杀伤肿瘤细胞的目的。比较用或不用曲妥珠单抗联合一线化疗方案用以治疗ⅡB/Ⅲ期HER2/neu阳性的 NSCLC患者差异的两项大型的随机Ⅱ期临床试验,其结果显示两个试验结论相似,曲妥珠单抗不能提高化疗的疗效,但也不加重化疗的不良反应。试验中HER2/neu值为3+的患者对曲妥珠单抗治疗的反应性较好,提示曲妥珠单抗对这一较少见类型的NSCLC效果要更好[sup][/sup]。在临床治疗中使用鼠派生单抗的主要障碍之一是产生人抗鼠抗体(HAMA)反应,通过基因工程技术制备嵌合抗体的I-IPdVIA反应率较鼠源性单抗低,但完全的人源抗体才是单抗药物的发展目标。噬茵体抗体库技术和转基因小鼠技术是制备完全人源单抗的两种方法[sup][/sup]。因此,只有不断地完善单克隆抗体人源化的技术,才能更好地将完全人源化的单克隆抗体用于肿瘤分子靶向治疗中,从而使医学界迈向更高的台阶。[b]七 问题与对策[/b]在限制单克隆抗体临床治疗效果的因素有:(l)循环免疫复合物导致的肝肾功能损害。(2)可溶性肿瘤抗原释放造成的体液中的封闭作用。(3)异种蛋白反应。(4)特异性还不够专一,引起了正常细胞的伤害。(5)天然免疫功能低下(如补体介异的细胞毒,网状内皮系统清除和ADCC作用等)。(6)主要的问题还在这种免疫疗法会导致靶细胞(肿瘤细胞)上抗原的转换。为了解决这些问题,今后的研究应着重:(1)制备对肿瘤抗原有高度特异性的单克隆抗体。(2)选择不易诱导抗原转换的单克隆抗体。(3)研究副作用较少,既安全疗效又高的偶联制剂。单抗(Mab)药物存在的一个最关键问题就是人抗鼠抗体反应(HAMA)。由于用于临床研究的Mab药物一般使用鼠源Mab,这不可避免地会引起HAMA反应,所以尽量避免HAMA反应这一副作用才是Mab药物能否真正适合治疗肿瘤性疾病的重点[sup][/sup]。近些年来,Mab药物的研究主要是向减轻宿主对外源抗体的排斥,促进抗体人源化,改变抗体的氨基酸序列而增加或降低该抗体的生物学效应,加抗体的亲和力,制备双特异性抗体,改造抗体重链恒定区以增强抗体功能,以及寻找新的分子靶点(相对特异的肿瘤抗原)等方向发展[sup][/sup]。Mab药物的不断更新,必将为全球的肿瘤患者带来更大的希望。[align=center]八 总结与展望[/align]目前肿瘤治疗中使用最广泛的仍是化疗以及放射性疗法,其毒副作用较大。随着基因工程技术和DNA重组技术的兴起,利用单克隆抗体治疗肿瘤已经日渐取代副作用较大的传统疗法而成为新的发展趋向。所以,如何研制更多的单克隆抗体以及怎样更好的利用单克隆抗体治疗肿瘤,将成为肿瘤治疗研究中的又一艰巨任务。同时,生物技术以及抗肿瘤化学药物的发展也必将推动单抗药物的发展与进步,单克隆抗体药物将在各种肿瘤的治疗中发挥越来越重要的作用。在未来10年内,单克隆抗体药将成为国内、外生物药品发展的主旋律。此外,利用与肿瘤细胞相关抗原的特异结合力,相应的单克隆抗体可以用于肿瘤早期诊断和预后判定。例如用放射标记抗体能够确定肿瘤存在的位置,扩散的部位和范围,以便确定手术时机和化疗方案。通过测定抗体结合白血病细胞的增减,可以检查白血病的化疗效果[sup][/sup]。利用单克隆抗体检测某些癌的特异性产物,如前列腺癌产生的酸性磷酸酶,绒毛膜上皮癌产生的促性腺激素,结肠癌产生的癌胚抗原及肝癌产生的甲胎蛋白等,有助于癌肿的早期诊断[sup][/sup]。单克隆抗体在肿瘤的治疗中的作用功不可没,但同时也面临着巨大的挑战,例如如何选择优势人群、进一步提高疗效、降低不良反应的发生都是需要进一步解决的。如贝伐单抗的突出不良反应是出血,在NCCN指南中特别指出贝伐单抗仅适用非鳞癌的[sup][/sup],既往无咯血史的患者,限制了贝伐单抗的临床应用。而其他大部分单克隆抗体均需与其他化疗药物联用,单独应用的疗效仍有限,选择合适的指标以及合适人群应用单克隆抗体仍任重而道远。[b]参考文献[/b] Adams GP, Weiner LM.Monoclonalantibody therapy of cancer .Nat Biotechnol,2005,23(9):1147~1148 甄永苏.抗肿瘤抗生素和单克隆抗体药物的研究进展.中国抗生素杂志,2002,27(1):1~5 Sievers E L, Larson R A, Stadtmauer E A, [i]et al[/i].Effica-cy and safety ofgemtuzumab ozogamicin in patients withCD33-positive acute myeloid leukemia infirst relapse .Clin Oncol,2001,19(21):3244~3246 Kamiya K, Konno H, Tanaka T, [i]et al[/i].Antitumor effect on humangastric cancer and induction of apoptosis by vascular endothelial growth factorneutralizing antibody .Jpn J Cancer Res,1999,4(21):794~798 邹学,李俊,尹庆春.单克隆抗体药物诱发肿瘤细胞凋亡的研究进展.总装备部医学学报,2008,10(2):115~117 Rao AV, Schmader K.Monoclonalantibodies as targeted therapy in hematologic malignancies in older adults .Am J GeriatrPharmacother,2007,5(3):247~250 杨海东,罗傲雪,范益军.单克隆抗体在治疗肿瘤中的研究进展.时珍国医国药,2007,18(11):2685~2686 甄红英,薛玉川,甄永苏.抗肿瘤抗生素C1027抑制血管生成及其抗肿瘤转移作用.中华医学杂志,1997,77(21):657~660 刘霆.抗肿瘤单克隆抗体靶向药物的研究进展.国外医学生理、病理科学与临床分册,2003,23(3):254~257 Plw a JL,Britta E,Jayne L,[i]et al[/i].Targeting rat anti-mouse transferrinreceptor monoclonal antibody through blood-brain barrier in mouse .pharmacology andexperiment therapeu-ties,2000,4(21):1048~1057 刘德忠,张石革.分子和抗体靶向抗肿瘤药的研究进展.中国药房,2007,18(26):2067~2068 丰雪,龙亚一,廖翰.抗肿瘤抗体-药物偶联物的临床研究进展.现代生物医学进展,2013,16(21):3164~3168 江山,杨小琼.晚期非小细胞肺癌单克隆抗体治疗的研究进展.吉林医学,2013,34(35):7482~7483 SpicerJ,Harper P.Targetedtherapies for non-small cell lung cancer .In t J C l in Pract,2005,59(9):1055~1057 彭建柳,杨丽华.人源化单克隆抗体用于肿瘤分子靶向治疗的研究进展.现代医院,2009,9(5):8~11 王飞,董军,黄强等.转基因完全人抗体的制备及其抗肿瘤作用研究.中华神经外科疾病研究杂志,2002,1(1):90~91 Kim J A.Targeted therapies for thetreatment of cancer .Am J Surg,2003,186(9):264~269 侯盛,郭亚军.单克隆抗体在肿瘤治疗中的应用.中国处方药,2007,4(61):53~56 清水惠司.抗肿瘤用药的应用及进展.临床免疫,2009,13(11):912~915 沈倍奋.抗体药物研究进展.第二军医大学学报,2002,23(10):1047~1049
[font=宋体][font=宋体]单克隆抗体是由单一[/font][font=Calibri]B[/font][font=宋体]细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体,称为单克隆抗体。通常采用杂交瘤技术来制备,杂交瘤[/font][font=Calibri](hybridoma)[/font][font=宋体]抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的致敏[/font][font=Calibri]B[/font][font=宋体]细胞和具有无限繁殖能力的骨髓瘤细胞融合为[/font][font=Calibri]B[/font][font=宋体]细胞杂交瘤。[b]下面为大家讲解[url=https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-production]制备单克隆抗体[/url]药物的工艺流程步骤[/b]:[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、抗原提纯与动物免疫[/font][/font][font=宋体] [/font][font=宋体][font=宋体]对抗原的要求是纯度越高越好,尤其是初次免疫所用的抗原。如为细胞抗原,可取[/font][font=Calibri]1[/font][font=宋体]×[/font][font=Calibri]107[/font][font=宋体]个细胞作腹腔免疫。可溶性抗原需加完全福氏佐剂并经充分乳化,如为聚丙烯酰胺电泳纯化的抗原,可将抗原所在的电泳条带切下,研磨后直接用以动物免疫。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]选择与所用骨髓瘤细胞同源的[/font][font=Calibri]BALB/c[/font][font=宋体]健康小鼠,鼠龄在[/font][font=Calibri]8[/font][font=宋体]~[/font][font=Calibri]12[/font][font=宋体]周,雌雄不限。为避免小鼠反应而不佳或免疫过程中死亡,可同时免疫[/font][font=Calibri]3[/font][font=宋体]~[/font][font=Calibri]4[/font][font=宋体]只小鼠。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫过程和方法与多克隆抗血清制备基本相同,因动物、抗原形式、免疫途径不同而异,以获得高效价抗体为最终目的。免疫间隔一般[/font][font=Calibri]2[/font][font=宋体]~[/font][font=Calibri]3[/font][font=宋体]周。一般被免疫动物的血清抗体效价越高,融合后细胞产生高效价特异抗体的可能性越大,而且单克隆抗体的质量(如抗体的浓度和亲和力)也与免疫过程中小鼠血清抗体的效价和亲和力密切相关。末次免疫后[/font][font=Calibri]3[/font][font=宋体]~[/font][font=Calibri]4[/font][font=宋体]天,分离脾细胞融合。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、骨髓瘤细胞及饲养细胞的制备[/font][/font][font=宋体] [/font][font=宋体][font=宋体]选择瘤细胞株的最重要的一点是与待融合的[/font][font=Calibri]B[/font][font=宋体]细胞同源。如待融合的是脾细胞,各种骨髓瘤细胞株均可应用,但应用最多的是[/font][font=Calibri]Sp2/0[/font][font=宋体]细胞株。该细胞株生长及融合效率均佳,此外,该细胞株本身不分泌任何免疫球蛋白重链或轻链。细胞的最高生长刻度为[/font][font=Calibri]9[/font][font=宋体]×[/font][font=Calibri]105/ml[/font][font=宋体],倍增时间通常为[/font][font=Calibri]10[/font][font=宋体]~[/font][font=Calibri]15h[/font][font=宋体]。融合细胞应选择处于对数生长期、细胞形态和活性佳的细胞(活性应大于[/font][font=Calibri]95[/font][font=宋体]%)。骨髓瘤细胞株在融合前应先用含[/font][font=Calibri]8-[/font][font=宋体]氮鸟嘌呤的培养基作适应培养,在细胞融合的前一天用新鲜培养基调细胞浓度为[/font][font=Calibri]2 [/font][font=宋体]×[/font][font=Calibri]105/ml[/font][font=宋体],次日一般即为对数生长期细胞。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]在体外培养条件下,细胞的生长依赖适当的细胞密度,因而,在培养融合细胞或细胞克隆化培养时,还需加入其他饲养细胞([/font][font=Calibri]feeder cell[/font][font=宋体])。常用的饲养细胞为小鼠的腹腔细胞,制备方法为用冷冻果糖液注入小鼠腹腔,轻揉腹部数次,吸出后的液体中即含小鼠腹腔细胞,其中在巨噬细胞和其他细胞。亦有用小鼠的脾细胞、大鼠或豚鼠的腹腔细胞作为饲养细胞的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]在制备饲养细胞时,切忌针头刺破动物的消化器官,否则所获细胞会有严重污染。饲养细胞调至[/font][font=Calibri]1[/font][font=宋体]×[/font][font=Calibri]105/ml[/font][font=宋体],提前一天或当天置板孔中培养。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、细胞融合[/font][/font][font=宋体] [/font][font=宋体][font=宋体]细胞融合是杂交瘤技术的中心环节,基本步骤是将两种细胞混合后加入[/font][font=Calibri]PEG[/font][font=宋体]使细胞彼此融合。其后吧培养液稀释[/font][font=Calibri]PEG[/font][font=宋体],消除[/font][font=Calibri]PEG[/font][font=宋体]的作用。将融合后的细胞适当稀释,分置培养板孔中培养。融合过程中有几个问题应特别注意。①细胞比例:骨髓瘤细胞与脾细胞的比值可从[/font][font=Calibri]1:2[/font][font=宋体]到[/font][font=Calibri]1:10[/font][font=宋体]不等,常用[/font][font=Calibri]1:4[/font][font=宋体]的比例。应保证两种细胞在融合前都具有较高活性。②反应时间:在两种细胞的混合细胞悬液中,第[/font][font=Calibri]1min[/font][font=宋体]滴加[/font][font=Calibri]4.5ml[/font][font=宋体]培养液;间隔[/font][font=Calibri]2min[/font][font=宋体]滴加[/font][font=Calibri]5ml[/font][font=宋体]培养液,尔后加培养液[/font][font=Calibri]50ml[/font][font=宋体]。③培养液的成分:对融合细胞,良好的培养液尤其重要,其中的小牛血清、各种离子和营养成分均需严格配制。如融合效率降低,应随时核查培养基情况。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、有限稀释法[/font][/font][font=宋体] [/font][font=宋体][font=宋体]筛选阳性株一般选用的骨髓瘤细胞为[/font][font=Calibri]HAT[/font][font=宋体]敏感细胞株,所以只有融合的细胞才能待续存活一周以上。融合细胞呈克隆生长,经有限稀释后(一般稀释至[/font][font=Calibri]0.8[/font][font=宋体]个细胞[/font][font=Calibri]/[/font][font=宋体]孔),按[/font][font=Calibri]Poisson[/font][font=宋体]法计算,应有[/font][font=Calibri]36[/font][font=宋体]%的孔为[/font][font=Calibri]1[/font][font=宋体]个细胞[/font][font=Calibri]/[/font][font=宋体]孔。细胞培养至覆盖[/font][font=Calibri]0[/font][font=宋体]%~[/font][font=Calibri]20[/font][font=宋体]%孔底时,吸取培养上清用[/font][font=Calibri]ELISA[/font][font=宋体]检测抗体含量。首先依抗体的分泌情况筛选出高抗体分泌孔,将孔中细胞再行克隆化,尔后进行抗原特异的[/font][font=Calibri]ELISA[/font][font=宋体]测定,选高分泌特异性细胞株扩大培养或冻存。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、单克隆抗体的制备和冻存[/font][/font][font=宋体] [/font][font=宋体][font=宋体]筛选出的阳性细胞株应及早进行抗体制备,因为融合细胞随培养时间延长,发生污染、染包体丢失和细胞死亡的机率增加。抗体制备有两种方法。一是增量培养法,即将杂交瘤细胞在体外培养,在培养液中分离单克隆抗体。该法需用特殊的仪器设备,一般应用无血清培养基,以利于单克隆抗体的浓缩和纯化。最普遍采用的是小鼠腹腔接种法。选用[/font][font=Calibri]BALB/c[/font][font=宋体]小鼠或其亲代小鼠,先用降植烷或液体石蜡行小鼠腹腔注射,一周后将杂交瘤细胞接种到小鼠腹腔中去。通常在接种一周后即有明显的腹水产生,每只小鼠可收集[/font][font=Calibri]5[/font][font=宋体]~[/font][font=Calibri]10ml[/font][font=宋体]的腹水,有时甚至超过[/font][font=Calibri]40ml[/font][font=宋体]。该法制备的腹水抗体含量高,每毫升可达数毫克甚至数十毫克水平。此外,腹水中的杂蛋白也较少,便于抗体的纯化。接种细胞的数量应适当,一般为[/font][font=Calibri]5[/font][font=宋体]×[/font][font=Calibri]105/[/font][font=宋体]鼠,可根据腹水生长情况适当增减。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]选出的阳性细胞株应及早冻存。冻存的温度越低越好,冻存于液氮的细胞株活性仅有轻微的降低,而冻存在-[/font][font=Calibri]70[/font][font=宋体]℃冰箱则活性改变较快。细胞不同于菌种,冻存过程中需格外小心。二甲亚砜([/font][font=Calibri]DMSO[/font][font=宋体])是普遍应用的冻存保护剂。冻存细胞复苏后的活性多在[/font][font=Calibri]50[/font][font=宋体]%~[/font][font=Calibri]95[/font][font=宋体]%之间。如果低于[/font][font=Calibri]50[/font][font=宋体]%,则说明冻存复苏过程有问题[/font][font=Calibri].[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、单克隆抗体的纯化[/font][/font][font=宋体] [/font][font=宋体][font=宋体]单克隆抗体的纯化方法同多克隆抗体的纯化,腹水特异性抗体的浓度较抗血清中的多克隆抗体高,纯化效果好。按所要求的纯度不同采用相应的纯化方法。一般采用盐析、凝胶过滤和离子交换层析等步骤达到纯化目的,也有采用较简单的酸沉淀方法。目前最有效的单克隆抗体纯化方法为亲和纯化法,多用葡萄球菌[/font][font=Calibri]A[/font][font=宋体]蛋白或抗小鼠球蛋白抗体与载体(最常用[/font][font=Calibri]Sepharose[/font][font=宋体])交联,制备亲和层析柱将抗体结合后洗脱,回收率可达[/font][font=Calibri]90[/font][font=宋体]%以上。蛋白可与[/font][font=Calibri]IgG1[/font][font=宋体]、[/font][font=Calibri]IgG2a[/font][font=宋体]、[/font][font=Calibri]IgG2b[/font][font=宋体]和[/font][font=Calibri]IgG3[/font][font=宋体]结合,同时还结合少量的[/font][font=Calibri]IgM[/font][font=宋体]。洗脱液中的抗体浓度可用紫外光吸收法粗测,小鼠[/font][font=Calibri]IgG[/font][font=宋体]单克隆抗体溶液在[/font][font=Calibri]A280nm[/font][font=宋体]时,[/font][font=Calibri]1.44[/font][font=宋体](吸光单位)相当于[/font][font=Calibri]1mg/ml[/font][font=宋体]。经低[/font][font=Calibri]pH[/font][font=宋体]洗脱后在收集管内预置中和液或速加中和液对保持纯化抗体的活性至关重要。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[url=https://cn.sinobiological.com/resource/antibody-technical/mab-purification][b]单克隆抗体纯化[/b][/url][/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/mab-purification[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font]
[align=center]抗肿瘤单克隆抗体药物的研究进展[/align][align=center] [/align][align=center]摘 要[/align][align=center] [/align] 通过淋巴细胞杂交瘤技术或基因工程技术制备单克隆抗体药物,已经成为生物制药领域的一个重要方面,特别是对抗肿瘤单克隆抗体药物的研究已获得了重要进展。多年来,许多研究证实了抗肿瘤单克隆抗体药物的作用,为其应用于肿瘤治疗提供了重要依据。这类药物的特异性强,疗效显著。本文主要就近年来抗肿瘤单克隆抗体药物的研究进展进行了综述,并对抗肿瘤单克隆抗体药物的发展前景进行了展望。[align=left] [/align][align=left]关键词:抗肿瘤;单克隆抗体;研究进展[/align][align=center] [/align][align=center] [/align][b]一 引言[/b]抗肿瘤单抗药物因与烷化剂、抗代谢药、抗肿瘤抗生素、铂类配合物、植物药等抗肿瘤药物相比,具有高效价、高特异性、血清交叉反应少等特点与优点,在肿瘤治疗中起着不可替代的作用。单抗药物是当前生物技术药物领域甚为活跃的部分。针对特定的分子靶点(抗原),单抗有高度特异性。针对各种不同的抗原,可以制备为数众多的、各不相同的单抗;因此,作为药物来源,单抗又具有高度多样性。由于其特异性和多样性,研制单抗药物有巨大的潜力。单克隆抗体药物治疗恶性瘤主要机制有两种[sup][/sup]:一是利用单克隆抗体本身来阻断癌细胞生长的信号,单克隆抗体在癌细胞膜外与生长因子竞争结合受体,阻断信号传递过程,从而阻止癌细胞的生长和扩散,诱导细胞凋亡或者间接激活宿主的抗肿瘤免疫反应;二是利用单克隆抗体作为药物载体的靶向治疗,如将有细胞毒性的药物或有放射性的药物靶向性的运送到肿瘤细胞,从而杀伤肿瘤细胞。目前,国际上与肿瘤治疗相关的抗体研究主要集中在将抗体与耦联物作用后直接杀伤肿瘤细胞,利用抗体促进肿瘤细胞凋亡和抑制肿瘤血管生成等方面。此外,研究表明静脉内注射抗肿瘤单抗,在肿瘤部位的浓度较高,显示特异性定位;单抗与药物的偶联物通常仍保留原来单抗的分布特征,在靶肿瘤的浓度较高[sup][/sup]。[align=center]二 单克隆抗体药物作用靶点[/align]特定受体或特定的基因表达蛋白可能作为单抗药物的靶点。Rituxan是以B细胞的CD20分子作为靶点的人鼠嵌合抗体,对非霍奇金氏B细胞淋巴瘤有疗效,是第一个获美国FDA批准用于治疗恶性肿瘤的单抗。Herceptin是抗HER-2/neu癌基因编码蛋白的单抗,临床研究对乳腺癌有效,与化疗药物联合有更显著的疗效。Mylotarg是由抗CD33单抗与calicheamicin构成的偶联物,已获批准用于治疗急性复发性髓性白血病[sup][/sup]。表皮细胞生长因子受体(EGFr)在人的鳞癌、乳腺癌和脑胶质瘤等均有较高的表达。有报道,抗EGFr单抗与长春碱衍生物的偶联物在裸鼠体内试验,显示良好的抗癌效果。抗EGFr的人鼠嵌合抗体已进入临床研究。血管内皮生长因子(VEGF)在血管生成中有重要作用。据报道,抗VEGF的中和性单抗具有广谱的抗肿瘤作用,对移植于裸鼠的人体癌瘤有显著疗效[sup][/sup]。[b]三 单抗诱发肿瘤细胞凋亡[/b][align=left] 3.1 通过免疫细胞表面抗原的交联作用而诱导恶性肿瘤细胞的凋亡[/align]用于治疗血液系统恶性肿瘤的单克隆抗体药物大多是通过免疫细胞表面抗原的交联作用诱导恶性肿瘤细胞凋亡而起作用的,如目前用的抗-CD20的单克隆抗体——美罗华。其单克隆抗体的作用机制是通过诱导CD20分子在B细胞膜上的脂筏区聚集,再在一系列激酶的作用下使脂筏信号传导区域的CD20分子亲和性增强,从而形成CD20交联形式;交联的CD20分子启动了细胞内凋亡信号的传导通路,使线粒体释放出细胞色素C,激活下游的caspase级联反应,最终导致细胞凋亡[sup][/sup]。3.2 作用于恶性肿瘤细胞膜上的生长因子及其受体而诱导细胞凋亡许多生长因子及其受体通过作用于细胞的存活途径、刺激细胞的有丝分裂、促进细胞的生长增殖来阻止细胞凋亡。与正常细胞中生长因子信号传导的严格调控相比,肿瘤细胞中的失控则导致细胞的恶性增殖,从而使恶性细胞获得“永生”。单克隆抗体通过作用于恶性肿瘤细胞膜上的生长因子及其受体可阻断存活信号传导通路,从而导致其凋亡,同时还能对化疗和放疗有正协同作用。目前主要集中在对血管内皮生长因子(VEGF)及其受体、表皮生长因子受体(EGFR)等的研究。美国FDA于2006年批准了第一个用于治疗头颈部鳞状细胞癌的单克隆抗体药物——Cetuximab,它为一种IgG1单克隆抗体,主要通过干扰癌细胞表面EGFR的生长,从而减少癌细胞进入正常组织的概率,控制癌细胞的转移,达到抗癌目的[sup][/sup]。最初想到制备针对恶性肿瘤凋亡相关分子的单克隆抗体药物时,虽然从理论上来说无疑是给人们注入了一针兴奋剂,但在实际应用中则并不然,所以在通过单克隆抗体药物诱导恶性肿瘤细胞凋亡的研究和治疗中,还有待进一步开发新的、更经济、更有效地药物。[b]四 单克隆抗体耦联物[/b]4.1 抗体与化疗药物耦联目前,国内外研究较多的与单克隆抗体耦联的化学药物有平阳霉素、柔红霉素、丝裂霉素、多柔比星(阿霉素)、顺铂以及长春碱类衍生物等。同时还可以通过脂质体靶向制剂作为化疗药靶向治疗肿瘤,利用脂质体制剂将药物导向靶标进行有选择性地杀伤癌细胞和抑制癌细胞的繁殖,以达到提高疗效和高度定向作用。目前已上市的脂质体有复方氟脲嘧多相脂质体、喜树碱多相脂质体、阿霉素脂质体和紫杉醇脂质体等。4.2 抗体导向酶耦联利用抗体与肿瘤细胞表面抗原的特异性结合,将前体药物的专一性活化酶与单抗耦联,导向输入到靶细胞部分,再注入前体药物,使其在酶的作用下转化为活性药物,进而杀伤肿瘤细胞[sup][/sup]。目前这种用作前体药物的抗癌药有苦杏仁苷、氮芥、鬼臼乙叉苷、阿霉素、丝裂霉素等。而作为活化前体药物的导向酶有碱性磷酸酶、青霉素V或G酰胺酶、羧基酶肽、胸腺嘧啶核苷酶、β葡萄苷酶等。临床研究表明,单抗耦联物对于抗药性肿瘤细胞仍显示较强的杀伤活性。对由于长期使用氨甲蝶呤而出现抗药性的成骨肉瘤细胞,单抗氨甲蝶呤耦联物仍显示较强的杀伤作用。对于具有多药抗药性(MDR)的肿瘤细胞,抗P-170糖蛋白单抗构成的免疫毒素可显示选择性杀伤作用[sup][/sup]。这说明,单抗药物有可能用于克服肿瘤细胞抗药性。[b]五 单克隆抗体靶向药物[/b]单抗靶向药物是利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物的疗效,降低药物对循环系统及其他部位的毒性。研究表明,单抗靶向药物具有很好的疗效,在免疫偶联物对移植于裸鼠的相应人体肿瘤生长有抑制作用。免疫偶联物与相应的游离物比较,具有更高更好的疗效和较低的细胞毒性[sup][/sup]。单克隆抗体体积小,能更有效地透入肿瘤;分子小、消除快、累积毒性小;所携带的弹头脱离后,可较快被清除 循环中免疫靶向结合物对靶细胞的竞争作用小;半衰期短;穿透性好;能穿过血脑屏障[sup][/sup],因而还可以作为新一代靶向载体。与化学药物、毒素、放射性核素、生物因子、基因、分化诱导剂、光敏剂、酶等物质构成单克隆抗体靶向药物,把杀伤肿瘤细胞的活性物质特异的输送到肿瘤部位,利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物疗效,降低药物对循环系统及其他部位的毒性。近年来,随着医学、药学和生物工程学及技术的进步,临床对肿瘤的根治和对癌细胞的攻击锁定于表皮生长因子和血管内皮生长因子等靶位,使药物治疗的切入点由细胞水平提升到分子和抗体水平,从而提高了肿瘤综合治疗的效果。[align=center]六 人源化单克隆抗体[/align]单克隆抗体是近年竞相开发的品种,自1997年第1个单克隆抗体rituximab通过食品与药物管理局(FDA)批准应用于临床以来,目前已经上市的单克隆抗体靶向药物的疗效令人瞩目,在抗肿瘤、类风湿性关节炎和自身免疫系统缺陷治疗领域得到了有力的推广,其以独特的作用优势,在肿瘤的治疗中不但能够选择性杀伤癌细胞,且在体内表现出特异的分布特性,具有高效、低毒的特点,从而在生物技术产品领域中占据了1/3的市场[sup][/sup]。目前用于治疗肿瘤的单克隆抗体药已有多个,包括伊珠单抗奥加米星、帕尼单抗、曲妥珠单抗等。伊珠单抗奥加米星又名CMC-544,是以人源化抗CD22的抗体伊珠单抗与 CalichDMH偶联形成的ADC药物,用来治疗复发性或难治性B细胞非霍奇金淋巴瘤(B cell-NHL)和急性淋巴细胞白血病(ALL),目前已经进入临床 III期试验[sup][/sup]。帕尼单抗是一种IgG2单克隆抗体完全人源化可以与EGFR高度特异性地结合,进而阻断配体诱导的信号激活,从而抑制肿瘤生长。有临床研究选择既往未治疗过的ⅢB或Ⅳ期非小细胞肺癌患者比较卡铂(AUC=6,每3周),加紫杉醇(200mg/m21次/3周) 联合或不联合帕尼单抗(2.5 mg/m2,1次/周) 化疗的疗效及其安全性。研究结果显示,单纯化疗组与帕尼单抗联合化疗组之间在PFS(5.3个月对比4.2个月、P=0.55)和总生存( Overall survival,OS)(8.0个月对比8.5个月,P =0.81)上均无显著差异。结果提示帕尼单抗联合一线化疗方案可能对晚期非小细胞肺癌无明显疗效[sup][/sup]。曲妥珠单抗是一种抗Her2的单克隆抗体,他可以和肿瘤细胞的HER2/neu特异性地结合,从而阻断细胞内生长信号的转导,同时曲妥珠单抗还可以诱导体内巨噬细胞以及自然杀伤细胞攻击肿瘤细胞,以达到抑制和杀伤肿瘤细胞的目的。比较用或不用曲妥珠单抗联合一线化疗方案用以治疗ⅡB/Ⅲ期HER2/neu阳性的 NSCLC患者差异的两项大型的随机Ⅱ期临床试验,其结果显示两个试验结论相似,曲妥珠单抗不能提高化疗的疗效,但也不加重化疗的不良反应。试验中HER2/neu值为3+的患者对曲妥珠单抗治疗的反应性较好,提示曲妥珠单抗对这一较少见类型的NSCLC效果要更好[sup][/sup]。在临床治疗中使用鼠派生单抗的主要障碍之一是产生人抗鼠抗体(HAMA)反应,通过基因工程技术制备嵌合抗体的I-IPdVIA反应率较鼠源性单抗低,但完全的人源抗体才是单抗药物的发展目标。噬茵体抗体库技术和转基因小鼠技术是制备完全人源单抗的两种方法[sup][/sup]。因此,只有不断地完善单克隆抗体人源化的技术,才能更好地将完全人源化的单克隆抗体用于肿瘤分子靶向治疗中,从而使医学界迈向更高的台阶。[b]七 问题与对策[/b]在限制单克隆抗体临床治疗效果的因素有:(l)循环免疫复合物导致的肝肾功能损害。(2)可溶性肿瘤抗原释放造成的体液中的封闭作用。(3)异种蛋白反应。(4)特异性还不够专一,引起了正常细胞的伤害。(5)天然免疫功能低下(如补体介异的细胞毒,网状内皮系统清除和ADCC作用等)。(6)主要的问题还在这种免疫疗法会导致靶细胞(肿瘤细胞)上抗原的转换。为了解决这些问题,今后的研究应着重:(1)制备对肿瘤抗原有高度特异性的单克隆抗体。(2)选择不易诱导抗原转换的单克隆抗体。(3)研究副作用较少,既安全疗效又高的偶联制剂。单抗(Mab)药物存在的一个最关键问题就是人抗鼠抗体反应(HAMA)。由于用于临床研究的Mab药物一般使用鼠源Mab,这不可避免地会引起HAMA反应,所以尽量避免HAMA反应这一副作用才是Mab药物能否真正适合治疗肿瘤性疾病的重点[sup][/sup]。近些年来,Mab药物的研究主要是向减轻宿主对外源抗体的排斥,促进抗体人源化,改变抗体的氨基酸序列而增加或降低该抗体的生物学效应,加抗体的亲和力,制备双特异性抗体,改造抗体重链恒定区以增强抗体功能,以及寻找新的分子靶点(相对特异的肿瘤抗原)等方向发展[sup][/sup]。Mab药物的不断更新,必将为全球的肿瘤患者带来更大的希望。[align=center]八 总结与展望[/align]目前肿瘤治疗中使用最广泛的仍是化疗以及放射性疗法,其毒副作用较大。随着基因工程技术和DNA重组技术的兴起,利用单克隆抗体治疗肿瘤已经日渐取代副作用较大的传统疗法而成为新的发展趋向。所以,如何研制更多的单克隆抗体以及怎样更好的利用单克隆抗体治疗肿瘤,将成为肿瘤治疗研究中的又一艰巨任务。同时,生物技术以及抗肿瘤化学药物的发展也必将推动单抗药物的发展与进步,单克隆抗体药物将在各种肿瘤的治疗中发挥越来越重要的作用。在未来10年内,单克隆抗体药将成为国内、外生物药品发展的主旋律。此外,利用与肿瘤细胞相关抗原的特异结合力,相应的单克隆抗体可以用于肿瘤早期诊断和预后判定。例如用放射标记抗体能够确定肿瘤存在的位置,扩散的部位和范围,以便确定手术时机和化疗方案。通过测定抗体结合白血病细胞的增减,可以检查白血病的化疗效果[sup][/sup]。利用单克隆抗体检测某些癌的特异性产物,如前列腺癌产生的酸性磷酸酶,绒毛膜上皮癌产生的促性腺激素,结肠癌产生的癌胚抗原及肝癌产生的甲胎蛋白等,有助于癌肿的早期诊断[sup][/sup]。单克隆抗体在肿瘤的治疗中的作用功不可没,但同时也面临着巨大的挑战,例如如何选择优势人群、进一步提高疗效、降低不良反应的发生都是需要进一步解决的。如贝伐单抗的突出不良反应是出血,在NCCN指南中特别指出贝伐单抗仅适用非鳞癌的[sup][/sup],既往无咯血史的患者,限制了贝伐单抗的临床应用。而其他大部分单克隆抗体均需与其他化疗药物联用,单独应用的疗效仍有限,选择合适的指标以及合适人群应用单克隆抗体仍任重而道远。[b]参考文献[/b] Adams GP, Weiner LM.Monoclonalantibody therapy of cancer .Nat Biotechnol,2005,23(9):1147~1148 甄永苏.抗肿瘤抗生素和单克隆抗体药物的研究进展.中国抗生素杂志,2002,27(1):1~5 Sievers E L, Larson R A, Stadtmauer E A, [i]et al[/i].Effica-cy and safety ofgemtuzumab ozogamicin in patients withCD33-positive acute myeloid leukemia infirst relapse .Clin Oncol,2001,19(21):3244~3246 Kamiya K, Konno H, Tanaka T, [i]et al[/i].Antitumor effect on humangastric cancer and induction of apoptosis by vascular endothelial growth factorneutralizing antibody .Jpn J Cancer Res,1999,4(21):794~798 邹学,李俊,尹庆春.单克隆抗体药物诱发肿瘤细胞凋亡的研究进展.总装备部医学学报,2008,10(2):115~117 Rao AV, Schmader K.Monoclonalantibodies as targeted therapy in hematologic malignancies in older adults .Am J GeriatrPharmacother,2007,5(3):247~250 杨海东,罗傲雪,范益军.单克隆抗体在治疗肿瘤中的研究进展.时珍国医国药,2007,18(11):2685~2686 甄红英,薛玉川,甄永苏.抗肿瘤抗生素C1027抑制血管生成及其抗肿瘤转移作用.中华医学杂志,1997,77(21):657~660 刘霆.抗肿瘤单克隆抗体靶向药物的研究进展.国外医学生理、病理科学与临床分册,2003,23(3):254~257 Plw a JL,Britta E,Jayne L,[i]et al[/i].Targeting rat anti-mouse transferrinreceptor monoclonal antibody through blood-brain barrier in mouse .pharmacology andexperiment therapeu-ties,2000,4(21):1048~1057 刘德忠,张石革.分子和抗体靶向抗肿瘤药的研究进展.中国药房,2007,18(26):2067~2068 丰雪,龙亚一,廖翰.抗肿瘤抗体-药物偶联物的临床研究进展.现代生物医学进展,2013,16(21):3164~3168 江山,杨小琼.晚期非小细胞肺癌单克隆抗体治疗的研究进展.吉林医学,2013,34(35):7482~7483 SpicerJ,Harper P.Targetedtherapies for non-small cell lung cancer .In t J C l in Pract,2005,59(9):1055~1057 彭建柳,杨丽华.人源化单克隆抗体用于肿瘤分子靶向治疗的研究进展.现代医院,2009,9(5):8~11 王飞,董军,黄强等.转基因完全人抗体的制备及其抗肿瘤作用研究.中华神经外科疾病研究杂志,2002,1(1):90~91 Kim J A.Targeted therapies for thetreatment of cancer .Am J Surg,2003,186(9):264~269 侯盛,郭亚军.单克隆抗体在肿瘤治疗中的应用.中国处方药,2007,4(61):53~56 清水惠司.抗肿瘤用药的应用及进展.临床免疫,2009,13(11):912~915 沈倍奋.抗体药物研究进展.第二军医大学学报,2002,23(10):1047~1049
显微镜下西达本胺抑制SCLC H446 细胞克隆 - 2
显微镜下西达本胺抑制SCLC H526 细胞克隆3)
[font='calibri'][size=13px]单克隆抗体的制备过程及原理是什么?[/size][/font][font='宋体'][size=13px]义翘神州是一家抗体试剂和定制抗体的领先供应商,目前已成功交付了数以万计的抗体项目,客户涵盖科研院校、生物制药公司、诊断公司和其他生物技术公司等。[/size][/font][font='宋体'][size=13px]针对定制单克隆抗体,义翘神州提供了一套全面的解决方案。我们将与您通力合作,完成从抗原设计、纯化和抗体验证的完整过程。义翘神州拥有包括杂交瘤、噬菌体抗体库和单B细胞在内的抗体发现平台, 我们可根据您感兴趣的靶点、抗体应用和时间表等,来选择最合适的技术平台。 此外,义翘神州还提供ELISA、WB、流式细胞术、IHC、基于细胞的筛选、亲和力检测等多种表征和筛选技术,确保最终鉴定到最佳的抗体,以满足研究、诊断和治疗领域等应用。[/size][/font][font='宋体'][size=13px]单克隆抗体的制备原理:[/size][/font][font='宋体'][size=13px]单克隆抗体(MAb)是针专一的抗原决定簇产生的抗体,单克隆技术又名杂交瘤技术起源于1975年,由G.K?hler和Milstein创立。主要原理是利用产生抗体的B细胞与肿瘤细胞杂交融合成杂交瘤细胞,生产抗体。[/size][/font][font='宋体'][size=13px]单克隆抗体的制备过程:[/size][/font][font='宋体'][size=13px]1、免疫动物 免疫动物是用目的抗原免疫小鼠,使小鼠产生致敏B淋巴细胞的 过程。[/size][/font][font='宋体'][size=13px]2、细胞融合 采用眼球摘除放血法处死小鼠,无菌操作取出脾脏,在平皿内挤压研磨,制备脾细胞悬液。[/size][/font][font='宋体'][size=13px]3、选择性培养 选择性培养的目的是筛选融合的杂交瘤细胞,一般采用HAT选择性培养基。[/size][/font][font='宋体'][size=13px]4、杂交瘤阳性克隆的筛选与克隆化 在HAT培养基中生长的杂交瘤细胞,只有少数是分泌预定特异性单克隆抗体的细胞,因此,必须进行筛选和克隆化。[/size][/font][font='宋体'][size=13px]5、单克隆抗体的大量制备 单克隆抗体的大量制备重要采用动物体内诱生法和体外培养法。[/size][/font][font='宋体'][size=13px][url=https://cn.sinobiological.com/services/monoclonal-antibody-production-services][b]单克隆抗体定制服务[/b][/url]推荐:https://cn.sinobiological.com/services/monoclonal-antibody-production-services[/size][/font]
显微镜下西达本胺抑制SCLC H69 细胞克隆
[size=18px]流式细胞术[/size][size=18px]及平板克隆[/size][size=16px]([/size][size=16px]1[/size][size=16px])铺板[/size][size=16px] [/size][size=16px]取[/size][size=16px]对数生长期[/size][size=16px] H446[/size][size=16px]、[/size][size=16px]H[/size][size=16px]69[/size][size=16px]、[/size][size=16px]H[/size][size=16px]526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞,[/size][size=16px]计数,分别接种等量细胞至[/size][size=16px]6[/size][size=16px]孔板,[/size][size=16px]“[/size][size=16px]十字形[/size][size=16px]”[/size][size=16px]晃动,使细胞分布均匀,[/size][size=16px]继续[/size][size=16px]培养。[/size][size=16px] [/size][size=16px]([/size][size=16px]2[/size][size=16px])药物处理[/size][size=16px] [/size][size=16px]待细胞融合率约[/size][size=16px]80%[/size][size=16px],[/size][size=16px]加入[/size][size=16px]不同浓度([/size][size=16px]0[/size][size=16px]、[/size][size=16px]IC20[/size][size=16px]、[/size][size=16px]IC50[/size][size=16px])[/size][size=16px]西达本胺处理[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]。每组均设置[/size][size=16px]D[/size][size=16px]MSO[/size][size=16px]对照组。继续培养[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后采用[/size][size=16px]Annexin V-FITC /PI[/size][size=16px]双染法对细胞进行染色。[/size][size=16px]([/size][size=16px]3[/size][size=16px])准备:[/size][size=16px]冰[/size][size=16px]PBS[/size][size=16px]、流式细胞术专用试管、凋亡试剂盒([/size][size=16px]10[/size][font='arial'][size=16px]×[/size][/font][size=16px] [/size][size=16px]Annexin V[/size][size=16px]结合缓冲液用[/size][size=16px]DD[/size][size=16px]水稀释[/size][size=16px]1[/size][font='arial'][size=16px]×[/size][/font][size=16px])[/size][size=16px]([/size][size=16px]4[/size][size=16px])对照组的设置:阴性对照([/size][size=16px]未染色细胞[/size][size=16px])、[/size][size=16px]FITC Annexin V[/size][size=16px]([/size][size=16px]无[/size][size=16px]PI[/size][size=16px])单[/size][size=16px]染细胞[/size][size=16px]、[/size][size=16px]PI[/size][size=16px]单[/size][size=16px]染[/size][size=16px]([/size][size=16px]不含[/size][size=16px]FITC Annexin V[/size][size=16px])细胞。[/size][size=16px]([/size][size=16px]5[/size][size=16px])染色:[/size][size=16px]a[/size][size=16px].[/size][size=16px]将细胞[/size][size=16px]用冷[/size][size=16px]PBS[/size][size=16px]洗涤[/size][size=16px]3[/size][size=16px]次,然后[/size][size=16px]重悬细胞[/size][size=16px]在[/size][size=16px]密[/size][size=16px]度为[/size][size=16px]1.5[/size][font='arial'][size=16px]×[/size][/font][size=16px]10[/size][font='times new roman'][size=16px]6[/size][/font][size=16px]/[/size][size=16px]mL[/size][size=16px]的[/size][size=16px]1[/size][font='arial'][size=16px]×[/size][/font][size=16px]结合缓冲液中。[/size][size=16px]b[/size][size=16px].[/size][size=16px]将[/size][size=16px]100[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L[/size][size=16px]的溶液[/size][size=16px](1×10[/size][font='times new roman'][size=16px]5[/size][/font][size=16px]个细胞[/size][size=16px])[/size][size=16px]转移到[/size][size=16px]5[/size][size=16px] mL[/size][size=16px]培养管中。[/size][size=16px]c[/size][size=16px].[/size][size=16px]加入[/size][size=16px]1[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L [/size][size=16px]FITC Annexin V[/size][size=16px]和[/size][size=16px]1[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L[/size][size=16px] PI[/size][size=16px]。[/size][size=16px]d[/size][size=16px].[/size][size=16px]轻轻[/size][size=16px]拍打[/size][size=16px]细胞,[/size][size=16px]避光、室温[/size][size=16px] [/size][size=16px](25°C)[/size][size=16px] [/size][size=16px]孵育[/size][size=16px]15[/size][size=16px] min[/size][size=16px]。[/size][size=16px]e[/size][size=16px].[/size][size=16px]向每管中加入[/size][size=16px]400[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L[/size][size=16px]的[/size][size=16px]1[/size][font='arial'][size=16px]×[/size][/font][size=16px] [/size][size=16px]Annexin V[/size][size=16px]。[/size][size=16px]1[/size][size=16px] h[/size][size=16px]内进行流式细胞仪分析。[/size][size=18px]克隆形成实验[/size][size=16px]H446[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]采用平板克隆实验,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]采用软琼脂克隆实验。[/size][size=16px]用公式[/size][size=16px]克隆形成率[/size][size=16px]=[/size][size=16px]克隆形成数[/size][size=16px]/[/size][size=16px]接种细胞数[/size][font='arial'][size=16px]×[/size][/font][size=16px]100[/size][size=16px]%[/size][size=16px]计算克隆形成率。[/size][size=16px]([/size][size=16px]1[/size][size=16px])铺板[/size][size=16px] [/size][size=16px]取[/size][size=16px]对数生长期[/size][size=16px] H446[/size][size=16px]、[/size][size=16px]H[/size][size=16px]69[/size][size=16px]、[/size][size=16px]H[/size][size=16px]526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞,[/size][size=16px]计数,分别接种等量细胞至[/size][size=16px]6[/size][size=16px]孔板,[/size][size=16px]“[/size][size=16px]十字形[/size][size=16px]”[/size][size=16px]晃动使细胞分布均匀,[/size][size=16px]继续培养[/size][size=16px]。[/size][size=16px] [/size][size=16px]([/size][size=16px]2[/size][size=16px])药物处理[/size][size=16px] [/size][size=16px]待细胞融合率约[/size][size=16px]80[/size][size=16px] [/size][size=16px]%[/size][size=16px],[/size][size=16px]用[/size][size=16px]不同浓度([/size][size=16px]0[/size][size=16px]、[/size][size=16px]IC20[/size][size=16px]、[/size][size=16px]IC50[/size][size=16px])[/size][size=16px]西达本胺处理细胞[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后进行克隆形成实验。每组均设置[/size][size=16px]D[/size][size=16px]MSO[/size][size=16px]对照组。[/size][size=16px]([/size][size=16px]3[/size][size=16px])平板克隆形成实验[/size][size=16px]此方法[/size][size=16px]适用于贴壁生长的细胞[/size][size=16px]。[/size][size=16px]a[/size][size=16px].[/size][size=16px]西达本胺处理[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后[/size][size=16px]的[/size][size=16px]H[/size][size=16px]446[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞,用胰酶消化[/size][size=16px]并计数。[/size][size=16px] [/size][font='times new roman'][size=16px]b.[/size][/font][font='times new roman'][size=16px]接种细胞:将细胞接种于[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板中,[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]446[/size][/font][font='times new roman'][size=16px]接种密度为[/size][/font][font='times new roman'][size=16px]4[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]0[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔,[/size][/font][font='times new roman'][size=16px]D[/size][/font][font='times new roman'][size=16px]MS114[/size][/font][font='times new roman'][size=16px]接种密度[/size][/font][font='times new roman'][size=16px]500[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔,注意一定让[/size][/font][font='times new roman'][size=16px]细胞均匀[/size][/font][font='times new roman'][size=16px]分布[/size][/font][font='times new roman'][size=16px]。于[/size][/font][font='times new roman'][size=16px] 37℃[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]5% CO2 [/size][/font][font='times new roman'][size=16px]静置培养[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]周(终止培养时间以不于[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]周而且克隆之间不发生融合为标准)。[/size][/font][font='times new roman'][size=16px]c[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]出现肉眼可见的克隆时,终止培养。弃去[/size][/font][font='times new roman'][size=16px]旧培养基[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px][color=#4472c4] [/color][/size][/font][font='times new roman'][size=16px]用[/size][/font][font='times new roman'][size=16px]PBS [/size][/font][font='times new roman'][size=16px]清[/size][/font][font='times new roman'][size=16px]洗[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]次[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]4%[/size][/font][font='times new roman'][size=16px]多聚甲醛[/size][/font][font='times new roman'][size=16px]固定液[/size][/font][font='times new roman'][size=16px]固定[/size][/font][font='times new roman'][size=16px] 20[/size][/font][font='times new roman'][size=16px] min[/size][/font][font='times new roman'][size=16px],随后[/size][/font][font='times new roman'][size=16px]去除固定液,加适量结晶紫染色[/size][/font][font='times new roman'][size=16px]30[/size][/font][font='times new roman'][size=16px] min[/size][/font][font='times new roman'][size=16px],用[/size][/font][font='times new roman'][size=16px]蒸馏水[/size][/font][font='times new roman'][size=16px]洗去[/size][/font][font='times new roman'][size=16px]结晶紫[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]晾干,用扫描仪扫描成图片。[/size][/font][font='times new roman'][size=16px]d[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]在低倍镜[/size][/font][font='times new roman'][size=16px]下[/size][/font][font='times new roman'][size=16px]计数大于[/size][/font][font='times new roman'][size=16px]50[/size][/font][font='times new roman'][size=16px]个细胞的克隆数。[/size][/font][font='times new roman'][size=16px]e.[/size][/font][font='times new roman'][size=16px]计算克隆形成率。[/size][/font][size=16px]([/size][size=16px]4[/size][size=16px])[/size][size=16px]软琼脂[/size][size=16px]克隆形成实验[/size][font='times new roman'][size=16px]适用于悬浮生长的细胞以及繁殖较快的贴壁细胞。[/size][/font][font='times new roman'][size=16px]a[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]配胶液:[/size][/font][font='times new roman'][size=16px]用蒸馏水[/size][/font][font='times new roman'][size=16px]和琼脂糖粉配制浓度为[/size][/font][font='times new roman'][size=16px]0.6%[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]0.3%[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]琼脂糖液,高压灭菌[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]置于[/size][/font][font='times new roman'][size=16px]42[/size][/font][font='times new roman'][size=16px]℃[/size][/font][font='times new roman'][size=16px]水浴锅中,目的是为了使其保持融化状态。[/size][/font][font='times new roman'][size=16px]b[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]配制含[/size][/font][font='times new roman'][size=16px]20%[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]FBS[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]双抗的[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1640[/size][/font][font='times new roman'][size=16px]培养基,用[/size][/font][font='times new roman'][size=16px]0.22[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]m[/size][/font][font='times new roman'][size=16px]的滤器过滤除菌。[/size][/font][font='times new roman'][size=16px]c[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]铺下层胶:[/size][/font][font='times new roman'][size=16px]将[/size][/font][font='times new roman'][size=16px]0.6%[/size][/font][font='times new roman'][size=16px]的琼脂糖胶[/size][/font][font='times new roman'][size=16px]液[/size][/font][font='times new roman'][size=16px]与[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1640[/size][/font][font='times new roman'][size=16px]培养基[/size][/font][font='times new roman'][size=16px]等体积[/size][/font][font='times new roman'][size=16px]混合,[/size][/font][font='times new roman'][size=16px]以[/size][/font][font='times new roman'][size=16px]每孔[/size][/font][font='times new roman'][size=16px]1.5[/size][/font][font='times new roman'][size=16px] mL[/size][/font][font='times new roman'][size=16px]加[/size][/font][font='times new roman'][size=16px]至[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板中,室温[/size][/font][font='times new roman'][size=16px]等其[/size][/font][font='times new roman'][size=16px]凝固。[/size][/font][font='times new roman'][size=16px]d.[/size][/font][font='times new roman'][size=16px]细胞计数:将细胞用[/size][/font][font='times new roman'][size=16px]PBS[/size][/font][font='times new roman'][size=16px]洗一遍,离心,加入新的培养基混匀稀释,[/size][/font][font='times new roman'][size=16px]计数。[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]69[/size][/font][font='times new roman'][size=16px]以[/size][/font][font='times new roman'][size=16px]8[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]0[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔铺入[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板,[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]526[/size][/font][font='times new roman'][size=16px]以[/size][/font][font='times new roman'][size=16px]5[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]0[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔铺入[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板。[/size][/font][font='times new roman'][size=16px]e.[/size][/font][font='times new roman'][size=16px]铺上层胶:[/size][/font][font='times new roman'][size=16px]将[/size][/font][font='times new roman'][size=16px]0.3%[/size][/font][font='times new roman'][size=16px]的琼脂糖胶[/size][/font][font='times new roman'][size=16px]液[/size][/font][font='times new roman'][size=16px]与[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]培养基[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]:[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]混合,加入[/size][/font][font='times new roman'][size=16px]100[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]μ[/size][/font][font='times new roman'][size=16px]L[/size][/font][font='times new roman'][size=16px]细胞悬液[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]混匀后,每孔加入[/size][/font][font='times new roman'][size=16px]1.5[/size][/font][font='times new roman'][size=16px] mL[/size][/font][font='times new roman'][size=16px]混合液[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]f.[/size][/font][font='times new roman'][size=16px]放入[/size][/font][font='times new roman'][size=16px]37℃[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]5%CO[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]培养箱培养,约[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]-3[/size][/font][font='times new roman'][size=16px]周后[/size][/font][font='times new roman'][size=16px]终止培养[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]g.[/size][/font][font='times new roman'][size=16px]计数比较对照组与实验组的细胞数量,计算克隆形成率。[/size][/font]
[font=宋体][font=宋体]单克隆抗体([/font][font=Calibri]Monoclonal antibodies[/font][font=宋体],[/font][font=Calibri]mAb[/font][font=宋体])是由[/font][font=Calibri]B[/font][font=宋体]细胞产生,并能特异性靶向抗原的免疫球蛋白。单克隆抗体不仅是生物化学、分子生物学和医学研究中必不可少的工具,其在临床治疗上的应用也以革命性的速度改进了多种疑难杂症的治疗方法。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1975[/font][font=宋体]年[/font][font=Calibri]Khler[/font][font=宋体]和[/font][font=Calibri]Milstein[/font][font=宋体]提出的杂交瘤技术([/font][font=Calibri]Hybridoma technology[/font][font=宋体]),使得大量获得单克隆抗体成为可能,为基础研究及其临床应用提供了无限潜力。其他科学和技术进步也促进了单克隆抗体的发展、丰富了单克隆抗体的制备方法。 经过近[/font][font=Calibri]50[/font][font=宋体]年的发展,单克隆抗体制备方法不再局限于免疫小鼠的淋巴细胞术,噬菌体展示技术([/font][font=Calibri]Phage display[/font][font=宋体])、人源抗体转基因小鼠([/font][font=Calibri]Human antibody-producing mice[/font][font=宋体])和单[/font][font=Calibri]B[/font][font=宋体]细胞抗体技术([/font][font=Calibri]Single B cell antibody technology[/font][font=宋体])也都陆续登上舞台。这些方法虽然有各自的局限性,但都已广泛应用于单克隆抗体筛选。同时,这些技术都不完全是独立存在的,如果能充分利用各技术的优点,采用灵活的方法将各技术优化组合就能更加高效、快速地进行抗体开发。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]一、杂交瘤技术[/font][font=宋体] [/font][font=宋体][font=宋体]杂交瘤技术是一种将[/font][font=Calibri]B[/font][font=宋体]细胞与骨髓瘤细胞融合生产小鼠单克隆抗体的传统方法,是目前应用最广泛的单克隆生产技术。在这种技术中,首先收集免疫小鼠的[/font][font=Calibri]B[/font][font=宋体]淋巴细胞,并将其与[/font][font=Calibri]BALB/c[/font][font=宋体]小鼠骨髓瘤细胞融合,从而形成永生化的杂交瘤细胞。然后筛选杂交瘤细胞,鉴定出能生产特异性抗体的单克隆细胞株。十几年后,[/font][font=Calibri]1988[/font][font=宋体]年,兔单克隆抗体制备方法首次被《[/font][font=Calibri]Science[/font][font=宋体]》杂志报道 [/font][font=Calibri][1][/font][font=宋体]。该研究使用小鼠[/font][font=Calibri]-[/font][font=宋体]兔异种杂交瘤方法生产兔单克隆抗体,但鼠[/font][font=Calibri]-[/font][font=宋体]兔异种杂交瘤细胞分泌抗体的效率较低、不稳定,且无法长时间分泌抗体。时间进展到[/font][font=Calibri]90[/font][font=宋体]年代中期,[/font][font=Calibri]1995[/font][font=宋体]年,《[/font][font=Calibri]PNAS[/font][font=宋体]》报道了能稳定生产兔单抗的兔[/font][font=Calibri]-[/font][font=宋体]兔杂交瘤细胞。但兔杂交瘤细胞也被证明不如常规鼠杂交瘤细胞稳定,这大大阻碍了其实验室水平的广泛使用。并且,由于融合和转化效率低下,使用兔杂交瘤细胞生产单克隆抗体在应用推广中受到了极大的限制。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]经过多年发展及应用,杂交瘤技术作为一种成熟的产生鼠单克隆抗体的方法已被广泛应用于多种抗体的生产。然而,由于缺乏合适的骨髓瘤融合伴侣,杂交瘤技术一直局限于免疫啮齿动物。[/font][font=Calibri]20[/font][font=宋体]世纪[/font][font=Calibri]80[/font][font=宋体]年代,《[/font][font=Calibri]PNAS[/font][font=宋体]》报道了一种应用人杂交瘤技术生产治疗用抗体的文章 [/font][font=Calibri][3][/font][font=宋体]。利用该方法可以在无额外修饰的情况下产生天然的人源抗体,并用于临床治疗。随着融合伴侣和电融合技术的发展,人杂交瘤细胞融合成功率逐步增加,这将在未来促进治疗性抗体的开发。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]二、噬菌体展示技术[/font][font=宋体] [/font][font=宋体][font=Calibri]1990[/font][font=宋体]年开始,噬菌体展示技术被视为一种新的产生单克隆抗体的方法。这种方法是从淋巴细胞中收获抗体可变区基因([/font][font=Calibri]V gene[/font][font=宋体])全集,克隆[/font][font=Calibri]VHs[/font][font=宋体]和[/font][font=Calibri]VLs[/font][font=宋体]的组合并与外壳蛋白融合后表达于丝状噬菌体表面,然后筛选表达特异性抗体的噬菌体。与受限于啮齿动物的杂交瘤技术相比,噬菌体展示技术已经成功用于任何已知免疫球蛋白基因的物种中筛选和分离单克隆抗体。[/font][font=Calibri]2000[/font][font=宋体]年,[/font][font=Calibri]Rader[/font][font=宋体]等人首次介绍了应用噬菌体展示技术生产兔单克隆抗体的全过程。在这篇文章中,[/font][font=Calibri]Rader[/font][font=宋体]等人用噬菌体展示技术筛选和人源化的人[/font][font=Calibri]A33[/font][font=宋体]兔抗体,不仅对人[/font][font=Calibri]A33[/font][font=宋体]抗原有高特异性,且保留高亲和力。目前,噬菌体展示技术因为其高效、简便及体外控制在原核或真核系统中原则参数的能力正逐步成为生产治疗用抗体的重要技术平台。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]随着我们对抗体结构、功能和序列多样性研究的不断深入,除了原有的抗体库外,一种新的合成抗体库技术也在不断发展。例如,[/font][font=Calibri]HuCAL&Ylanthia[/font][font=宋体]文库中,为了使筛选出的人源抗体能更好的进行分子识别,将精确设计的序列插入抗原结合位点,并优化设计多种可变重链、轻链框架区域 [/font][font=Calibri][7-10][/font][font=宋体]。随着文库设计和筛选方法的不断进步,合成抗体文库将成为快速生产具有高特异性和高亲和力单克隆抗体不可或缺的工具。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]三、人源抗体转基因小鼠[/font][font=宋体] [/font][font=宋体][font=Calibri]1985[/font][font=宋体]年,[/font][font=Calibri]Alt[/font][font=宋体]等人首次提出将人抗体基因引入小鼠种系并使用转基因小鼠中产生人抗体的想法 [/font][font=Calibri][11,12][/font][font=宋体]。随着基因编辑技术的进步,使用人源抗体转基因小鼠生产人源化抗体已不再是天方夜谭。与其他技术相比,使用人源抗体转基因小鼠有许多优势,如无需人源化、具有更多的生物多样性,且由于体内成熟具有天然的亲和力。但是,人免疫球蛋白体量庞大对转基因小鼠抗体生产是一个巨大的挑战。为了克服这些困难,研究人员们通过使用不同策略已成功地获得转基因动物表达的人源抗体库,如全人源抗体小鼠和嵌合人源抗体小鼠等。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]四、单[/font][font=Calibri]B[/font][font=宋体]细胞抗体技术[/font][/font][font=宋体] [/font][font=宋体][font=宋体]虽然杂交瘤技术和噬菌体展示技术已经在单克隆抗体生产中广泛应用,但它们依然存在较难克服的缺点制约着抗体生产过程。近些年,为了克服杂交瘤技术细胞融合效率低,噬菌体展示技术导致重链、轻链的天然同源配对丢失等问题,单[/font][font=Calibri]B[/font][font=宋体]细胞抗体技术正被逐步开发和应用。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]简单来说,单[/font][font=Calibri]B[/font][font=宋体]细胞抗体技术包含以下几个步骤:[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]a.[/font][font=宋体]从外周血或免疫器官中初步提取淋巴细胞;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]b.[/font][font=宋体]使用磁性活化细胞分选([/font][font=Calibri]MACS[/font][font=宋体])或荧光活化细胞分选([/font][font=Calibri]FACS[/font][font=宋体])技术鉴定和分离出特定的[/font][font=Calibri]B[/font][font=宋体]细胞;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]c.[/font][font=宋体]将分离出的[/font][font=Calibri]B[/font][font=宋体]细胞进行单细胞培养;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]d.[/font][font=宋体]使用逆转录聚合酶链式反应([/font][font=Calibri]RT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体])和抗体特异性引物鉴定单[/font][font=Calibri]B[/font][font=宋体]细胞分泌抗体的特异性;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]e.[/font][font=宋体]扩增特异抗体基因;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]f.[/font][font=宋体]将抗体基因克隆到表达载体中,并在细菌或细胞系统中表达;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]g.[/font][font=宋体]纯化表达产生的抗体,并用[/font][font=Calibri]ELISA[/font][font=宋体]等方法进行评估。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]单[/font][font=Calibri]B[/font][font=宋体]细胞抗体技术现在已广泛用于人和小鼠单克隆抗体生产,如一些治疗性中和单抗,可用于治疗多种疾病,包括癌症、自身免疫性疾病和传染性疾病亡[/font][/font][font=宋体] [/font][font=宋体][font=宋体]总结[/font][font=Calibri]4[/font][font=宋体]种方式制备单克隆抗体的优缺点[/font][/font][font=宋体] [/font][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/hybridoma-technology][b]杂交瘤技术[/b][/url]:[/font][font=宋体]优势:技术成熟、研发成本低[/font][font=宋体]劣势:周期长、融合率低、需要进行人源化[/font][font=宋体] [/font][font=宋体]人源抗体转基因小鼠:[/font][font=宋体]优势:[/font][font=宋体]①可用杂交瘤技术获得人源抗体[/font][font=宋体]②良好的免疫原性[/font][font=宋体]③亲和力高[/font][font=宋体] [/font][font=宋体]劣势:[/font][font=宋体]①存在免疫耐受[/font][font=宋体]②依然有鼠抗产生[/font][font=宋体]③难以免疫毒性抗原[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/phage-display-antibody][b]噬菌体展示技术[/b][/url]:[/font][font=宋体]优势:[/font][font=宋体]①基因来源灵活[/font][font=宋体]②随机库可以避免免疫耐受[/font][font=宋体]③可以灵活,特异得调整设计方案[/font][font=宋体]④可长时间保存[/font][font=宋体] [/font][font=宋体]劣势:[/font][font=宋体]①重链轻链非天然配对[/font][font=宋体]②展示效率具有偏好性[/font][font=宋体]③需要再次进行功能验证[/font][font=宋体] [/font][font=宋体][font=宋体]单[/font][font=Calibri]B[/font][font=宋体]细胞抗体技术:[/font][/font][font=宋体]优势:[/font][font=宋体]①无需杂交瘤融合[/font][font=宋体]②制备周期短[/font][font=宋体]③重链、轻链天然配对[/font][font=宋体]④无需合成基因[/font][font=宋体]⑤可直接获得各物种抗体[/font][font=宋体] [/font][font=宋体]劣势:[/font][font=宋体]①需要新鲜样本[/font][font=宋体]②抗原特异性细胞比例低[/font][font=宋体]③操作环境要求严格[/font][font=宋体] [/font][font=宋体][font=宋体]目前义翘神州提供[url=https://cn.sinobiological.com/services/monoclonal-antibody-production-services][b]单克隆抗体制备服务[/b][/url],同时拥有流式单[/font][font=Calibri]B[/font][font=宋体]细胞分选平台、噬菌体抗体库技术平台、杂交瘤开发平台…… 可供大家选择,有需求或者了解具体详情可以查看[/font][font=Calibri]https://cn.sinobiological.com/services/monoclonal-antibody-production-services[/font][/font][font=Calibri] [/font]
[font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/hybridoma-technology][b]杂交瘤技术[/b][/url]是一种将[/font][font=Calibri]B[/font][font=宋体]淋巴细胞与骨髓瘤细胞融合生产单克隆抗体的传统方法。该技术通过将动物脾细胞与骨髓瘤细胞融合,产生永生化杂交瘤细胞系,然后筛选其上清液中的抗原特异性克隆,并进一步循环亚克隆以产生严格的单克隆抗体。[/font][/font][font=宋体][font=宋体][b]利用杂交瘤技术制备单克隆抗体通常操作流程为[/b]:抗原制备、抗原免疫动物、杂交瘤细胞制备、融合细胞的筛选、培养杂交瘤细胞制备抗体。(详细实验流程:杂交瘤单克隆抗体制备[/font][font=Calibri]SOP[/font][font=宋体])在单克隆抗体制备过程中,常常会遇到细胞污染,细胞融合后不生长、亚克隆后的细胞株不分泌抗体以及细胞难以克隆等问题,本文将详细分析以上常见问题的产生原因以及解决该问题的方法。[/font][/font][font=宋体] [/font][font=宋体]一、微生物污染[/font][font=宋体] [/font][font=宋体][font=宋体]①细菌、真菌污染主要是由于实验人员操作不当或者消毒不到位引起的。人身上可能携带各种孢子,如果操作不当,或者是未能及时到位的消杀,就有可能会引入污染。除此之外,还须注意平时使用的一些消毒剂,比如[/font][font=Calibri]84[/font][font=宋体]消毒液或者[/font][font=Calibri]75%[/font][font=宋体]酒精,要确认它的纯度以及质量。如果是因为这些问题导致的消毒不到位,是非常不容易发现的。[/font][/font][font=宋体][font=宋体]②支原体污染则可能由血清制品、关键试剂材料或实验人员带入。正常的[/font][font=Calibri]SP2/0[/font][font=宋体]细胞圆润透亮,当被支原体污染后,短期内细胞没有明显的变化,当污染严重后,细胞生长会变得极为缓慢,生长周期变长,细胞形态多样。可通过加入商品化的清除支原体试剂,或者通过将污染的杂交瘤细胞注射进小鼠腹腔,待产生实体瘤后或产生腹水后,无菌分离重新获得杂交瘤细胞。[/font][/font][font=宋体]③原生生物污染主要是大家比较头疼的黑胶虫,污染后会陆续出现多少不等的小黑点。[/font][font=宋体] [/font][font=宋体]二、融合后细胞不生长[/font][font=宋体][font=宋体]①融合后细胞不生长可能是因为融合试剂有毒性,部分毒性试剂作用时间过长引起的。如[/font][font=Calibri]PEG[/font][font=宋体]在[/font][font=Calibri]10%~60%[/font][font=宋体]都可以进行融合,但浓度越高毒性越大。[/font][/font][font=宋体]②也有可能是使用血清质量比较差,推荐使用胎牛血清。[/font][font=宋体][font=宋体]③还有可能是因为添加的[/font][font=Calibri]HAT[/font][font=宋体]试剂中氨基喋呤([/font][font=Calibri]A[/font][font=宋体])含量过高或[/font][font=Calibri]HT[/font][font=宋体](次黄嘌呤和胸腺嘧啶核苷)含量过低。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]三、杂交瘤细胞不分泌抗体或者停止分泌抗体[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、杂交瘤细胞不分泌抗体,可能的原因有以下几种:[/font][/font][font=宋体][font=Calibri]a.[/font][font=宋体]抗原免疫原性弱,免疫效果不好,可以通过多方案检测血清效价进行进一步评估;[/font][/font][font=宋体][font=Calibri]b.[/font][font=宋体]操作过程中脾细胞损伤较多,抗原特异性淋巴母细胞大量死亡;[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体]、杂交瘤细胞前期有抗体分泌,后期在克隆化过程中抗体分泌量减少或停止分泌抗体,可能的原因有以下几种:[/font][/font][font=宋体][font=Calibri]a.HAT[/font][font=宋体]试剂中氨基喋呤([/font][font=Calibri]A[/font][font=宋体])失效,骨髓瘤细胞增殖抑制杂交瘤细胞的生长;[/font][/font][font=宋体][font=Calibri]b.[/font][font=宋体]未及时克隆,不分泌抗体的杂交瘤大量生长挤占生存空间;[/font][/font][font=宋体][font=Calibri]c.[/font][font=宋体]骨髓瘤细胞返祖化,抵抗氨基喋呤([/font][font=Calibri]A[/font][font=宋体])的选择;[/font][/font][font=宋体][font=Calibri]d.[/font][font=宋体]梁色体丢失(突变)[/font][font=Calibri] [/font][/font][font=宋体][font=Calibri]e.[/font][font=宋体]支原体污染。[/font][/font][font=宋体]解决方法有三种:第一,及时进行细胞建库;第二,高频次检查细胞状态和是否污染;第三,定期进行抗原筛选。[/font][font=宋体] [/font][font=宋体]四、杂交瘤细胞难以克隆化[/font][font=宋体] [/font][font=宋体]一旦确认有分泌抗体的杂交瘤细胞,就应尽快进行克隆化。克隆化的目的是为了获得单一细胞系的群体,反复克隆化后可获得稳定的杂交瘤细胞株。杂交瘤细胞若难以克隆化,可以尝试以下解决方法:[/font][font=宋体] [/font][font=宋体]①使用已有杂交瘤细胞株对血清进行筛选,确定最佳批次的血清和使用浓度;[/font][font=宋体][font=宋体]②融合后第一次克隆(一亚)仍需采用含[/font][font=Calibri]HT[/font][font=宋体]的条件培养;[/font][/font][font=宋体][font=宋体]③在培养体系中加入白细胞介素[/font][font=Calibri]6[/font][font=宋体]([/font][font=Calibri]IL6[/font][font=宋体]),一般商品化的杂交瘤因子都含有[/font][font=Calibri]IL6[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]义翘神州提供杂交瘤测序服务和杂交瘤细胞培养及抗体生产服务,具体关于杂交瘤相关问题详情可以参看[/font][font=宋体][font=宋体]杂交瘤技术:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/hybridoma-technology[/font][/font][font=宋体][font=宋体]杂交瘤细胞培养及抗体生产服务:[/font][font=Calibri]https://cn.sinobiological.com/services/hybridoma-culture-antibody-production-service[/font][/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/services/hybridoma-sequencing-service][b]杂交瘤测序服务[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/services/hybridoma-sequencing-service[/font][/font]
十二. 流式细胞术在血液学中的应用 白血病免疫分型其临床意义 目前公认的系列特异性指标是:T淋巴细胞系--胞浆CD3(cCD3),B淋巴细胞系-- cCD22或cCD79,髓系---MPO 或cCD13,一般可先用他们区分细胞系列后再进一步分析某一系列亚型和分化阶段。1. ALL的免疫学分型1986年前分为普通型ALL(cALL)、未分化细胞ALL (Null-ALL)、T细胞ALL( T-ALL) 、前B细胞ALL (PreB-ALL)、B细胞ALL (B-ALL)五型;1986-1994年分为两大类九型(非T-ALL六型,T-ALL三型),九十年代后期有人按临床实用性一般分为B祖细胞ALL、前B细胞ALL、B细胞ALL、T细胞ALL四型。表12.1-表12.4列出ALL的五型、九型( B[color=blac
[size=3]近日,记者在内蒙古自治区鄂托克旗召开的“转基因克隆绒山羊培育成果通报会”上获悉,不久前,位于鄂托克旗的“内蒙古白绒山羊种羊场”诞生了目前国际上规模最大的一批转基因克隆绒山羊,这标志着中国绒山羊现代生物育种技术又有了新的突破。 这项研究为国家转基因生物新品种培育重大专项课题,由内蒙古大学生命科学学院实验动物研究中心研究员刘东军带领的研究团队,在中国工程院院士旭日干的指导下取得的一项具有国际先进水平的科研成果。 此研究团队成功构建了对绒毛生长有促进作用的转胰岛素样生长因子Ⅰ(IGF-Ⅰ)基因载体,利用该载体成功转染了绒山羊胎儿成纤维细胞,建立起转基因细胞系。再利用转基因细胞进行体细胞克隆,从而获得的转基因绒山羊。 2009年9月至10月,这个研究团队在位于鄂托克旗草原上的内蒙古白绒山羊种羊场开展绒山羊转基因克隆胚胎的生产和移植工作。今年2月至3月陆续获得羔羊17只,其中转基因克隆羔羊14只、体细胞克隆羔羊3只。 [/size]
[font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-production][b]单克隆抗体[/b][/url]([/font][font=Calibri]mAb[/font][font=宋体])源于单一[/font][font=Calibri]B[/font][font=宋体]细胞克隆,具有高度的均一性和特异性,仅针对某一特定抗原表位。在生物医学研究、疾病诊断以及某些疾病治疗(如传染病和癌症)中单克隆抗体发挥着至关重要的作用。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]目前,制备单克隆抗体的主流技术包括[url=https://cn.sinobiological.com/resource/antibody-technical/hybridoma-technology][b]杂交瘤技术[/b][/url]、[url=https://cn.sinobiological.com/resource/antibody-technical/phage-display-antibody][b]噬菌体抗体库技术[/b][/url]和[url=https://cn.sinobiological.com/resource/antibody-technical/single-b-cell-technology][b]单个[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/resource/antibody-technical/single-b-cell-technology][b]B[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/single-b-cell-technology][b]细胞技术[/b][/url]。杂交瘤技术通过融合免疫小鼠的[/font][font=Calibri]B[/font][font=宋体]细胞与骨髓瘤细胞,筛选出能够特异性分泌抗体的杂交瘤细胞,进而生产并纯化得到单克隆抗体。噬菌体抗体库技术则利用基因工程技术,将抗体基因与噬菌体基因相连接,使抗体以融合蛋白的形式呈现在噬菌体表面,通过与靶蛋白的结合,筛选出具有特定亲和力的噬菌体展示抗体。而单个[/font][font=Calibri]B[/font][font=宋体]细胞技术则基于每个[/font][font=Calibri]B[/font][font=宋体]细胞仅含有一对功能性的重链和轻链,每个[/font][font=Calibri]B[/font][font=宋体]细胞仅产生一种特异性抗体的特性,直接从单个[/font][font=Calibri]B[/font][font=宋体]细胞中扩增抗体基因,从而获得单克隆抗体。[/font][/font][font=宋体] [/font][b][font=宋体]制备单克隆抗体的基本流程:[/font][/b][font=宋体][font=Calibri]1[/font][font=宋体])抗原制备[/font][/font][font=宋体][font=宋体]一般来说,抗原可以是蛋白(天然蛋白或重组蛋白)、多肽、小分子等。依据需求选择和制备合适的免疫原对于抗体开发至关重要。义翘神州在蛋白抗原、多肽抗原制备积累了丰富的经验,可提供专业的抗原制备服务。另外,义翘神州还成功制备出[/font][font=Calibri]6000[/font][font=宋体]多种重组蛋白产品,可作为抗原用于动物免疫和抗体筛选,欢迎订购。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体])动物免疫[/font][/font][font=宋体][font=宋体]通常选用[/font][font=Calibri]Balb/c[/font][font=宋体]小鼠作为免疫动物,根据抗原的特性制定免疫方案,包括免疫抗原纯度、抗原量、免疫方法和途径等。[/font][/font][font=宋体] [/font][font=宋体]免疫方法一般有常规免疫法、脾内一次性免疫法、短程免疫法和体外免疫法等,免疫途径主要有皮下注射、腹腔注射和静脉注射。脾内一次性免疫法具有用量少、免疫程序短、不加佐剂且所得单克隆抗体的特异性较高等特点。[/font][font=宋体] [/font][font=宋体][font=宋体]常规免疫周期如下:第一次免疫(抗原[/font][font=Calibri]+[/font][font=宋体]弗氏完全佐剂,皮下注射)、第二次免疫(抗原[/font][font=Calibri]+[/font][font=宋体]弗氏不完全佐剂,皮下注射)、第三次免疫(抗原[/font][font=Calibri]+[/font][font=宋体]不加佐剂,皮下或静脉注射)、第四次免疫(抗原[/font][font=Calibri]+[/font][font=宋体]不加佐剂,静脉注射)。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体])细胞融合[/font][/font][font=宋体]细胞融合前准备:[/font][font=宋体][font=宋体]脾淋巴细胞制备:取已经免疫的[/font][font=Calibri]Balb/c[/font][font=宋体]小鼠的脾脏,制备淋巴细胞,通常每只小鼠可得[/font][font=Calibri]1x10^8-2.5x10^8[/font][font=宋体]个脾细胞;同时摘除眼球采血,并分离血清作为抗体检测时的阳性对照血清。[/font][/font][font=宋体][font=宋体]骨髓瘤细胞制备:骨髓瘤细胞应该和免疫动物属于同一品系,便于细胞融合以及产生大量[/font][font=Calibri]Ab[/font][font=宋体]。融合前骨髓瘤细胞维持的方式,对成功得到杂交瘤非常重要。目的是使骨髓瘤细胞处于对数生长的时间尽可能长,融合前不能少于[/font][font=Calibri]1[/font][font=宋体]周;冻存的细胞在复苏后要生长[/font][font=Calibri]2[/font][font=宋体]周才能处于适合于融合的状态。[/font][/font][font=宋体]饲养细胞:常用的饲养细胞有胸腺细胞、正常脾细胞和腹腔巨噬细胞。饲养细胞促进杂交瘤细胞增殖的机制可能是释放非种属特异性的生长刺激因子,为杂交瘤细胞提供必要的生长条件;也可能是满足新生杂交瘤细胞对细胞密度的依赖性。[/font][font=宋体] [/font][font=宋体][font=宋体]细胞融合:细胞融合方法有病毒介导的细胞融合、聚乙二醇([/font][font=Calibri]PEG[/font][font=宋体])介导细胞融合、电融合。[/font][font=Calibri]PEG[/font][font=宋体]融合相邻骨髓瘤和[/font][font=Calibri]/[/font][font=宋体]或抗体分泌细胞的质膜,形成具有两个或更多核的单细胞。异核体保留这些核,直到核膜在有丝分裂前溶解。电融合通过施加脉冲电场连接相邻细胞的膜。电融合比[/font][font=Calibri]PEG[/font][font=宋体]更加有效,结果具有重现性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体])杂交瘤筛选以及单克隆鉴定[/font][/font][font=宋体][font=宋体]骨髓瘤细胞和脾细胞融合之后,由于细胞融合是随机的,因此要利用[/font][font=Calibri]HAT[/font][font=宋体]培养基筛选杂交瘤细胞。骨髓瘤细胞缺乏次黄嘌呤-鸟嘌呤磷酸核糖基转移酶([/font][font=Calibri]HGPRT[/font][font=宋体]),对氨蝶呤钠敏感,在[/font][font=Calibri]HAT[/font][font=宋体]选择培养液中不能生长;免疫脾细胞虽然有[/font][font=Calibri]HGPRT[/font][font=宋体],但不能在体外无限繁殖。因此只有融合的杂交瘤细胞,才能在[/font][font=Calibri]HAT[/font][font=宋体]选择培养液中无限繁殖。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]得到融合的杂交瘤细胞后,需要进一步筛选特异性抗体。将融合的细胞进行充分有限稀释,使分配到培养板的每一孔中的细胞数在[/font][font=Calibri]0[/font][font=宋体]至数个细胞之间([/font][font=Calibri]30%[/font][font=宋体]的孔为[/font][font=Calibri]0[/font][font=宋体]才能保证每个孔中是单个细胞),培养后取上清液用[/font][font=Calibri]ELISA[/font][font=宋体]法选出抗体高分泌性的细胞,这一过程常被称作克隆化。将这些阳性细胞再进行克隆化,应用特异性抗原包被的[/font][font=Calibri]ELISA[/font][font=宋体]找出针对目标抗原的抗体阳性细胞株,增殖后进行冻存、体外培养或动物腹水培养。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体])单克隆抗体大量制备[/font][/font][font=宋体]利用杂交瘤细胞大规模制备单克隆抗体主要有两种方式:体外培养法和腹水制备法。[/font][font=宋体] [/font][font=宋体][font=宋体]体外培养可以采用单层细胞培养的形式,也可以采用悬浮培养的形式。单层细胞培养法是各个实验室最常用的,是将杂交瘤细胞加入培养瓶中,用完全培养基培养,细胞浓度以[/font][font=Calibri]1.0X10^6~2.0X10^6[/font][font=宋体]个[/font][font=Calibri]/mL[/font][font=宋体]为宜,然后收集培养上清液。如果想在体外高效率地大量制备单克隆抗体,就必须高密度培养杂交瘤细胞,充分利用培养基的立体空间。单位体积内细胞数量越多,产生的单克隆抗体就越多,浓度就越高,产量就越大。义翘神州提供杂交瘤体外培养抗体生产服务,成功率[/font][font=Calibri]99%[/font][font=宋体],可采用低血清或无血清培养基进行高密度悬浮培养,生产规模从毫克级到克级不等,满足客户的不同需求。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]腹水制备法是通过将杂交瘤细胞接种于小鼠腹腔内,并产生腹水,可得到大量的腹水单抗。这种方式能够在相对短的时间内获得大量高浓度的抗体,而且成本低、操作相对简单以及不需要复杂的培养条件。然而,这种方法也有一些限制,比如腹水中常混有小鼠的各种杂蛋白(包括[/font][font=Calibri]Ig[/font][font=宋体]),因此在很多情况下要提纯后才能使用,而且还有污染动物病毒的危险。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]单克隆抗体技术:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-technology[/font][/font][font=宋体] [/font][font=宋体][font=宋体]杂交瘤技术:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/hybridoma-technology[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]