阿德福韦酯是由美国Gilead Science公司开发的新型核苷类抗乙型病毒性肝炎药物,已在国外进行了Ⅱ、Ⅲ期临床试验。国外的临床研究资料表明,阿德福韦能有效地抑制HBV DNA的复制,使HBV DNA滴度迅速降低,而且在出现拉米夫定耐药的患者中阿德福韦能继续有效地抑制变异株。我国药品监督管理局于2000年12月批准该药在中国进行临床试验,目前,Ⅰ期临床试验已结束,Ⅱ期临床试验也已在2002年12月正式启动。 一、作用机制 阿德福韦酯是腺嘌呤磷酸酯化合物阿德福韦的前药,其分子式为C20H32N5O8P,分子量为501.48。口服后,在体内转化为阿德福韦发挥抗病毒作用。阿德福韦是单磷酸腺苷的核苷酸类似物,在体内通过细胞激酶作用被磷酸化为具有活性作用的二磷酸阿德福韦,二磷酸阿德福韦抑制HBV DNA多聚酶或逆转录酶作用机制包括:(1)竞争脱氧腺苷三磷酸底物;(2)终止病毒DNA链延长。二磷酸阿德福韦对HBV DNA多聚酶的抑制常数为0.1mmol/L;对人类DNA多聚酶α和γ的抑制作用较弱,其抑制常数分别为1.18mmol/L和0.97mmol/L,因此,治疗剂量对正常细胞没有毒性。 二、药效和毒理 在体外实验中,阿德福韦抑制HBV转染人肝细胞瘤细胞株HepG2和HB611细胞病毒复制的半数抑制浓度(IC50)分别为0.2~2.5mmol/L和0.2~1.2mmol/L。二磷酸阿德福韦在细胞内的T1/2为30h,故作用较持久,可以每天给药一次。 拉米夫定耐药株涉及HBV DNA聚合酶M552V、M552I、L528M、L552M/M552V位点的突变。在体外实验中发现这些突变体对阿德福韦仍敏感,与野生株比较,它们的抑制常数增加了不到2.2倍,而拉米夫定对变异株的抑制常数则增加了8~25倍。这些资料表明,阿德福韦可以治疗对拉米夫定耐药的HBV,而且与拉米夫定联合治疗可以有效控制对拉米夫定的耐药。同时,体外实验也发现阿德福韦对泛昔洛韦耐药株也较敏感。 在体内实验中,发现阿德福韦能有效地抑制鸭乙型肝炎病毒和土拨鼠肝炎病毒(WHV)的复制。给予慢性感染WHV的成年土拨鼠每日口服5mg/kg、15mg/kg的阿德福韦或安慰剂治疗12周,治疗后5mg/kg剂量组WHV DNA水平减少了260倍,而15mg/kg剂量组则下降了1000倍以上。 四、国外临床研究进展 阿德福韦已在美国、欧洲、澳大利亚及东南亚进行了Ⅱ、Ⅲ期临床试验。临床试验涉及HBeAg阳性和考虑有前C区变异的HBeAg阴性的慢性乙型肝炎患者、对拉米夫定耐药的代偿性肝病患者、合并人类免疫缺陷病毒感染的拉米夫定耐药患者、肝移植前或移植后对拉米夫定耐药的失代偿性肝病患者。 早期进行的针对HBeAg阳性、ALT异常或正常的二项双盲、安慰剂对照的Ⅱ期临床试验,疗程为12周,并随访24周。ALT异常临床研究的患者,接受剂量为5mg/d、30mg/d和60mg/d。治疗12周后,5mg剂量组血清HBV DNA较基线下降1 Log10,30mg和60mg剂量组血清HBV DNA下降3~4 Log10,而安慰剂组无显著变化;36周后,30mg和60mg剂量组HBeAg转阴率为27%,HBeAg血清转化率为20%,血清转化率增高与基线时ALT水平呈正相关。ALT正常的临床研究患者,接受剂量为30mg/d。治疗12周后,30mg剂量组血清HBV DNA较基线下降3Log10,而安慰剂组无显著变化。所有接受治疗的患者在治疗12周后进行基因检测,没有发现与阿德福韦耐药有关的变异产生。在这二项研究中,30mg和60mg剂量组均出现部分患者的肾功能损害,表现为尿素氮和肌酐的升高,出现肾功能损害的比例与剂量呈正相关,故在以后的延续试验中以10mg剂量组而代替60mg剂量组。 在一项随机、双盲、安慰剂对照的临床试验中,共有515例HBeAg阳性的患者进入研究。在前48周,患者被随机分入阿德福韦30mg组(173例)、阿德福韦10mg组(172例)或安慰剂组(170例)。48周后,30mg组接受安慰剂治疗至96周,安慰剂组接受阿德福韦10mg治疗至96周,10mg组则再次随机按1:1接受安慰剂或继续阿德福韦10mg治疗至96周。所有患者在第一次随机前6月内接受第一次肝活检,在治疗48周、96周后接受第二、三次肝活检。所有患者治疗96周后随访24周。治疗48周后,10mg组和30mg组组织学改善率(组织学改善定义为Knodell坏死炎症计分下降32分,且Knodell肝纤维化计分无恶化)分别为53%和59%,显著高于安慰剂组25%;10mg组和30mg组治疗后血清HBV DNA较基线时下降3.52 Log10和4.76 Log10,安慰剂组为0.55 Log10;10mg组HBeAg阴转率为24%,HBeAg血清转化率为12%,显著高于安慰剂组的6%和11%;10mg组ALT复常率为48%,安慰剂组则为16%。研究中,发现基线ALT水平与肝组织学改善和HBeAg血清转化呈正相关。另一项随机、双盲、安慰剂对照的临床试验,共有185例考虑有前C区变异的HBeAg阴性的患者按2:1比例进入阿德福韦10mg组或安慰剂组。治疗48周后,10mg组组织学改善率为64%,显著高于安慰剂组33%;10mg组治疗后血清HBV DNA较基线时下降3.91 Log10,51%患者HBV DNA转阴,安慰剂组HBV DNA较基线时下降1.35 Log10,没有患者HBV DNA转阴;10mg组ALT复常率为72%,著高于安慰剂组29%。目前本项研究仍在进行中。 五、耐药和病毒变异 阿德福韦较少产生耐药的分子学基础包括:(1)阿德福韦与自然底物dATP在结构上非常相像;(2)阿德福韦具有灵活的开链连接;(3)具有磷酸键。 629例患者在治疗48周后接受了病毒变异的检测,结果未发现产生阿德福韦耐药的病毒变异。2003年美国肝病年会上,Gilead公司报道,238例患者在治疗96周时有4例发现N236T位点的变异,发生率为1.7%,并证实N236T变异与阿德福韦耐药有关。另一可能与阿德福韦耐药有关的A181V位点突变,96周时的发生率为0.8%。另外一项研究是早期进行的针对HBeAg阳性、ALT异常或正常的二项双盲、安慰剂对照研究的延续。患者在治疗中没有出现血清转化,也没有出现与治疗相关的毒性反应,患者自愿继续接受治疗。剂量开始为30mg/d,后改为10mg/d。在长达136周的观察中,阿德福韦对野生株和前C区变异的慢性乙型肝炎具有持续的抗病毒作用,而且没有发现与阿德福韦耐药相关的病毒变异。 七、国内的研究状况 我国食物药品监督管理局于2000年12月批准该药在中国进行Ⅰ期临床试验。2001年6月~9月进行Ⅰ期临床试验,Ⅰ期临床试验包括3个研究方案:(1)在健康中国男性志愿者中,对单次口服阿德福韦片剂的安全性和耐受性进行评估的一项Ⅰ期、单中心、随机、双盲、安慰剂对照的研究;(2)在健康中国男性志愿者中,对阿德福韦片剂的药代动力学进行评估的一项Ⅰ期、单中心、开放、拉丁方设计的研究;(3)在健康中国志愿者中,就连续6d,1次/d,口服阿德福韦片剂的安全性、耐受性和药代动力学进行评估的一项Ⅰ期、单中心、随机、双盲、安慰剂对照的研究。I期研究结果显示在健康中国志愿者中口服阿德福韦片剂的安全性、耐受性良好;10mg剂量下,未观察到肾功能损害;药代动力学参数与国外研究结果相似。2002年10月国家药品监督管理局批准该药在中国进行Ⅱ期临床试验。Ⅱ期临床试验在中国的总病例数为480例,均为HBeAg阳性、HBV DNA阳性、ALT增高的患者。全国有12个中心参与。目前,Ⅱ期临床试验已在2002年12月正式启动,2003年2月底已完成最后一例患者入组。
长风破浪会有时,直挂云帆济沧海。出处 《 行路难》【唐】李白金樽清酒斗十千,玉盘珍羞直万钱。停杯投箸不能食,拔剑四顾心茫然。欲渡黄河冰塞川,将登太行雪满山。闲来垂钓碧溪上,忽复乘舟梦日边。行路难,行路难,多歧路,今安在。长风破浪会有时,直挂云帆济沧海。试验方法与步骤:精密称取本品内容物细粉适量(约相当于阿德福韦酯20mg),置20ml量瓶中,加4ml乙腈,振摇使溶解,并用0.05mol/L的磷酸二氢钾溶液稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取供试品溶液1ml,置200ml量瓶中,加溶剂稀释至刻度,摇匀,作为对照溶液。照高效液相色谱法(中国药典2010年版二部附录 V D)测定,用十八烷基硅烷键合硅胶为填充剂;流动相A为0.05mol/L的磷酸二氢钾溶液,流动相B为乙腈;流速为每分钟1.0ml,按下表进行线性梯度洗脱;检测波长为216nm,分别取阿德福韦对照品、阿德福韦单酯对照品和阿德福韦酯对照品适量,用溶剂溶解并定量稀释制成每1ml中约含阿德福韦5μg、阿德福韦单酯20μg和阿德福韦酯10μg的混合对照品溶液,取10μl注入液相色谱仪,记录色谱图,阿德福韦酯峰的保留时间约为15分钟,理论板数按阿德福韦酯峰计算应不低于10000,阿德福韦、阿德福韦单酯和阿德福韦酯三者之间的分离度应符合规定。取对照溶液10μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%,立即精密量取供试品溶液、对照溶液和混合对照品溶液各10μl,分别注入液相色谱仪,记录色谱图。供试品溶液色谱图如有杂质峰,除溶剂峰外,阿德福韦按外标法以峰面积计算,不得过0.5%;阿德福韦单酯按外标法以峰面积计算,不得过2.0%;其他单个杂质峰面积不得大于对照溶液主峰面积(0.5%);其他各杂质峰面积的和不得大于对照溶液主峰面积的4倍(2.0%)。时间(分钟)流动相A(%)流动相B(%)0802018020106040256040303565403565458020508020色谱柱信息:Ultimate xB-C18 4.6*250 PN:00201-31043 SN:211202195典型色谱图:h

液相色谱-质谱-质谱联用法测定猕猴血浆中阿德福韦赵丽艳,陈笑艳,张勇,杨汉煜,钟大放(沈阳药科大学药物代谢与药代动力学实验室,辽宁沈阳)摘要:目的建立测定猕猴血浆中阿德福韦的液相色谱,质谱,质谱联用法。方法取血浆样品0.25ml 经甲醇沉淀蛋白后,以甲醇,水,甲酸(20:80:1)为流动相,用DiamonsilC18柱分离,通过电喷雾离子化四极杆串联质谱,以选择离子反应监测方式进行检测。用于定量分析的离子反应分别为m/z274-m/z162(阿德福韦)和m/z288-m/z276。结果阿德福韦线性范围为0.02-4.00mg/l,最低定量限为20ug/L,日内、日间精密度RSD小于5.8%,准确度(RE)在+-4.5%范围内。在临床前药代动力学研究中,应用此法测试了3只猕猴p0 给予阿德福韦地匹福酯后血浆中阿德福韦的浓度。结论 该法操作简便,准确,适用于临床前药代动力学研究。关键词:阿德福韦;阿德福韦地匹福酯;液相色谱,质谱,质谱联用法;血浆药物浓度http://ng1.17img.cn/bbsfiles/images/2012/07/201207241326_379369_2355529_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/07/201207241327_379370_2355529_3.jpg
阿伐那非杂质是阿伐那非的同分异构体或相关化合物,其纯度、含量和杂质情况对阿伐那非的药效和安全性有重要影响。在药物研发和生产过程中,需要使用标准品来检测和鉴定阿伐那非及其杂质的性质和含量。COTO标准品是一种高纯度的标准物质,用于测定阿伐那非及其杂质的纯度、含量和化学性质。通过与COTO标准品进行对比和分析,可以确定阿伐那非及其杂质的结构、组成和含量,从而保证阿伐那非的质量和安全性。在药物研发和生产过程中,COTO标准品的使用非常重要。它可以提供可靠的参照物,用于质量控制、药物分析和化学计量学研究。通过使用COTO标准品,可以确保阿伐那非及其杂质的准确性和可靠性,为药物的安全性和有效性提供保障。总的来说,COTO标准品在阿伐那非杂质的研究和控制中具有重要作用。通过使用COTO标准品,可以更好地了解阿伐那非及其杂质的性质和含量,从而确保药物的安全和有效性。同时,也需要加强生产过程中的管理和监督,加强质量标准和监管措施的执行力度,确保药物质量和安全。

[font=宋体] 阿戈美拉汀杂质是在阿戈美拉汀的生产或保存过程中产生的非目标化合物。这些杂质可能会影响阿戈美拉汀的纯度和药效。阿戈美拉汀[/font][font=宋体]在临床上[/font][font=宋体][font=宋体]是一种治疗抑郁症的药物,属于褪黑素受体激动剂和[/font][font=Calibri]5-[/font][font=宋体]羟色胺受体拮抗剂。[/font][/font][font=宋体][font=宋体] 阿戈美拉汀杂质有多种类型,每一种都具有不同的化学特性,如[/font][font=Calibri]CAS[/font][font=宋体]号、分子式、分子量等。例如,阿戈美拉汀杂质[/font][font=Calibri]7-Desmethyl-3-hydroxyagomelatine[/font][font=宋体]([/font][font=Calibri]3-Hydroxy-7-desmethyl agomelatine[/font][font=宋体])是[/font][font=Calibri]Agomelatine[/font][font=宋体]的代谢产物,其[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]166526-99-4[/font][font=宋体],纯度为[/font][font=Calibri]98%[/font][font=宋体],具有特定的化学结构和性质。另一种阿戈美拉汀杂质是[/font][font=Calibri]AgoMelatine DiMer Urea[/font][font=宋体],其[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]185421-27-6[/font][font=宋体]。[/font][font=Calibri]CATO[/font][font=宋体]标准品提供的阿戈美拉汀全套的杂质[/font][/font][font=宋体],[/font][font=宋体]这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分[/font][font=宋体]。[img=,606,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402182106267012_9724_6381607_3.png!w606x514.jpg[/img][/font][font=宋体][color=#05073b][back=#fdfdfe] 广州[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]佳途科技[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]股份有限公司[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]深知药物研发与质量控制的重要性[/back][/color][/font][font=宋体][font=宋体],[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供阿戈美拉汀全套[/font][/font][font=宋体]的[/font][font=宋体]杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展[/font][font=宋体],[/font][font=宋体]以满足客户在药物研发和质量控制方面的需求。[/font]
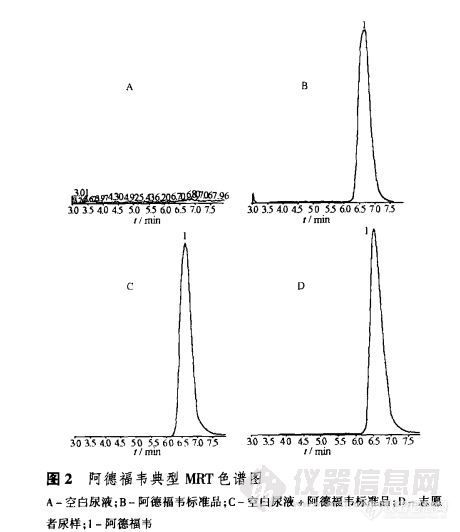
【作者】 王海生; 孙德清; 王本杰; 郭瑞臣; 【Author】 WANG Hai-sheng~1, SUN De-qing~1, WANG Ben-jie~2, GUO Rui-chen~2. (1. Department of Pharmacy, Second Hospital of Shandong University, Jinan 250033, China; 2. Institute of Clinical Pharmacology, Qilu Hospital of Shandong University, Jinan 250012, China) 【机构】 山东大学第二医院药剂科; 山东大学齐鲁医院临床药理研究所; 山东大学齐鲁医院临床药理研究所 山东 济南 250033; 山东 济南 250033; 山东 济南 250012; 山东 济南 250012; 【摘要】 目的建立测定人尿液中阿德福韦的LC-MS/MS,进行阿德福韦酯po给药排泄动力学研究。方法志愿者尿样经离心、稀释后直接进样,色谱柱为Diamonsil C18柱(4.6mm×250mm,5μm),流动相为甲醇-水-甲酸(20:80:0.1),流速0.6mL·min-1,采用电喷雾离子化四极杆串联质谱,多反应监测方式测定样品浓度,监测离子对为m/z274→m/z162。结果在0.05~8.0 mg·L-1内线性关系良好(r=0.9978,n=5),最低定量限为0.05mg·L-1。低、中、高浓度质控样品的日内、日间精密度小于10%,方法回收率96.3%~99.3%。志愿者分别服用10,20,40mg阿德福韦酯,尿中阿德福韦排泄率分别为(34±4)%,(36±10)%和(35±14)%,排泄速率常数ke分别为(0.055±0.028),(0.066±0.016)和(0.06±0.04)h-1。结论该方法符合生物样品分析要求,可用于阿德福韦尿液浓度的测定,阿德福韦排泄率ke中国人与国外文献报道一致。 【关键词】 阿德福韦; 气相色谱[font
近日,韩国发布G/SPS/N/KOR/351号通报,韩国农林食品渔业部拟对畜产品加工标准与成分规范进行修订。此次修订理由有:A.为了强化未杀毒液卵的卫生管理,现行的微生物标准规格仅适用于杀菌液卵,修订后将扩大到适用未杀菌液卵;B.将蛋加工品中未杀菌产品的共同标准及规格与Codex等国际标准进行接轨,以强化未杀菌产品的卫生管理。此通报的生效日期待定,通报评议截止日期为2010年2月2日。 其修订内容为蛋类品微生物标准(所有细菌、大肠菌、沙门氏菌)。具体如下: A.蛋加工品(全卵液、卵黄液、卵白液、全卵粉、卵白粉、蛋加热成形产品、腌蛋、皮蛋)的各个种类成份标准 1. 细菌数标准修改为:杀菌产品每1克应为10,000以下,未杀菌产品每克应为500,000以下。 2.大肠菌群标准修改为:杀菌产品每克10以下,未杀菌产品每克必须100以下(皮蛋的情况必须为阴性)。 3.沙门氏菌标准把现行阴性(限于杀菌产品或皮蛋)修改为全部产品必须为阴性。 B.在蛋加工品的共内标准及规格中,将未杀菌液卵破卵后保存48小时以上时0℃以下保管修改为:未杀菌液卵破卵超过48小时后不可保存。
我国国家食品卫生标准的制定与批准程序 依照《食品卫生法》第十四条规定,我国的国家食品卫生标准由国务院卫生行政部门组织制定或者批准发布。国务院卫生行政部门为了保证我国食品卫生标准工作的科学化和规范化,颁布实施了《卫生部卫生标准管理办法》和《卫生部卫生标准委员会章程》,同时,专门组成了由资深专家担任主任委员的“卫生部全国食品卫生标准委员会”;并且严格按照以下程序制定与审查批准我国的食品卫生标准。 (1)立项建议——任何法人和自然人,包括企业和消费者等; (2)立项审查——卫生部全国食品卫生标准专家委员会; (3)计划——卫生部(国标委); (4)选择研制单位并组成研制协作组(相关的科研、检测、监督、企业、行业协会、非政府组织)——卫生部全国食品卫生标准专家委员会秘书处; (5)标准研制——标准研制协作组; (6)征求意见——标准研制协作组、卫生部; (7)技术审查——卫生部全国食品卫生标准专家委员会; (8)行政审查——卫生部; (9)对外通报——国标委; (10)批准发布——卫生部(1998年前),卫生部和国标委联合(2003年后)。
替诺福韦杂质是一种化学物质,它是替诺福韦的同分异构体或相关化合物。替诺福韦是一种核苷酸逆转录酶抑制剂,用于治疗HIV和乙型肝炎。COTO标准品是一种高纯度的标准物质,用于测定替诺福韦及其杂质的纯度、含量和化学性质。通过与COTO标准品进行对比和分析,可以确定替诺福韦及其杂质的结构、组成和含量,从而保证替诺福韦的质量和安全性。在药物研发和生产过程中,COTO标准品的使用非常重要。它可以提供可靠的参照物,用于质量控制、药物分析和化学计量学研究。通过使用COTO标准品,可以确保替诺福韦及其杂质的准确性和可靠性,为药物的安全性和有效性提供保障。总的来说,COTO标准品在替诺福韦杂质的研究和控制中具有重要作用。通过使用COTO标准品,可以更好地了解替诺福韦及其杂质的性质和含量,从而确保药物的安全和有效性。同时,也需要加强生产过程中的管理和监督,加强质量标准和监管措施的执行力度,确保药物质量和安全。
国卫食品函〔2013〕5号湖南省卫生厅: 你厅《关于明确风味鱼干制熟食镉限量值标准的请示》(湘卫报〔2013〕23号)收悉。经研究,现批复如下: 根据食品安全国家标准《食品中污染物限量》(GB2762-2012)第3.5项干制食品中污染物限量折算的规定,风味鱼干制熟食属于干制食品,其镉限量应当以鲜、冻鱼类的镉限量并结合其加工脱水率进行折算。 此复。 国家卫生计生委 2013年7月1日
我国食品卫生标准的组织制定与批准发布机关 依照《食品卫生法》的有关规定,我国食品卫生标准按其适用的地区范围,其组织制定与批准发布的机关主要有以下两类。 1国家食品卫生标准 所谓国家食品卫生标准,是指适用于全国范围的标准,依照《食品卫生法》第十四条规定,该类标准由国务院卫生行政部门组织制定或者批准发布。目前,我国的国家食品卫生标准由国务院卫生行政部门组织制定并会同国家标准委联合批准发布,但属于国家食品卫生标准的食物中毒诊断标准由国务院卫生行政部门组织制定并单独批准发布。 2地方食品卫生标准 所谓地方食品卫生标准,是指适用于某一地区的标准,依照《食品卫生法》,该类标准由省、自治区、直辖市人民政府制定。需要指出的是,食品卫生地方标准不仅弥补了尚无食品卫生国家标准的管理需要,而且,因为食品卫生地方标准更适应于各地的经济和社会发展水平,所以食品卫生地方标准在进一步完善和提高我国食品卫生标准的整体管理水平上具有十分重要的作用。
无特殊规定时,有效期及复标期如下:1、如无特殊情况,工作标准品的含量每半年复标一次或另取新生产的样品标定。当标准品暂不使用时,复标周期可能超过规定周期,在使用前进行复标,合格后可以继续使用。2、对于特定市场使用的工作标准品,复标可以按照当地药政局或者药典的规定的周期来进行。3 、标准品若在使用过程中发现异常或者较大变化,应停止使用该标准品,并考虑采用geng严格的包装和保存方式或缩短其复标期等措施。4、若老的基准标准品批号过期,则用此批基准标准品标定过的相应的工作标准品应按照新批号基准标准品进行重新标定,用此批标准品配制的储备溶液也应同时失效,应用新的批号基准标准品重新配制。5、基准标准品 按说明书要求,若标签或者化验单上没有指明有效期(失效期),可以到网站上查询,如USP,EP 标准品目录单,若无法查到,同本厂规定此种药品的有效期,若无法得知此批的标定日期,可以从收到标准品日期算起。6、对于省药检所,兽药检所标定的工作标准品,有效期(失效期)同该产品的有效期。标准品一般在0℃~10℃之间冷藏保存(原则上保存在15℃以下的阴凉处),但相对于产品运输时,并不是所有产品的运输温度与储存温度一致,冷冻保存的温度在0℃以下。有些产品在运输时有暂时升温的可能性,个别产品特殊要求,我们将冷藏运输。为了增加稳定性,化学对照品的包装应能防潮、避光和抗氧化。一般固体韧应分装在可重新封闭的容器内,以便于多次使用.液体或易潮解物质分装在熔封的玻璃安瓶内。易氧化的物质可充氮包装。化学对照品的保存应以提高物质稳定性为原则.尽可能在干燥、低温条件下储藏。但易吸湿潮解的样品在普通冰箱或冷库中保存会因相对湿度较高而降低其稳定性.必须置密封容器中。
1、如无特殊情况,工作标准品的含量每半年复标一次或另取新生产的样品标定。当标准品暂不使用时,复标周期可能超过规定周期,在使用前进行复标,合格后可以继续使用。2、对于特定市场使用的工作标准品,复标可以按照当地药政局或者药典的规定的周期来进行。 3 、标准品若在使用过程中发现异常或者较大变化,应停止使用该标准品,并考虑采用更严格的包装和保存方式或缩短其复标期等措施。 4、若老的基准标准品批号过期,则用此批基准标准品标定过的相应的工作标准品应按照新批号基准标准品进行重新标定,用此批标准品配制的储备溶液也应同时失效,应用新的批号基准标准品重新配制。5、基准标准品 按说明书要求,若标签或者化验单上没有指明有效期(失效期),可以到网站上查询,如USP,EP 标准品目录单,若无法查到,同本厂规定此种药品的有效期,若无法得知此批的标定日期,可以从收到标准品日期算起。 6、对于省药检所,兽药检所标定的工作标准品,有效期(失效期)同该产品的有效期。
GB19300-2003《烘炒食品卫生标准》第1号修改单本修改单业经国家标准化管理委员会于2008年1月17日以国标委农函[2008]10号文批准,自批准之日起实施。 --------------------------------------------------------------------- GB19300-2003《烘炒食品卫生标准》的修改如下:将3.3理化指标中的“过氧化值/(g/100g脂肪)”指标由“≤0.38”修改为“≤0.50”。
如今要开展项目,找以下标准,是卫生部指定的[color=#f10b00][size=3][font=FangSong_GB2312]乳与乳制品中动物水解蛋白鉴定-L(-)-羟脯氨酸含量测定[/font][/size]([color=#000000]食品中可能违法添加的非食用物质名单(第二批)中规定由检测方法由[color=#f10b00]中国检验检疫科学院食品安全[/color]所提供[/color])[/color]

阿伏加德罗常数是一个将微观世界与宏观世界关联起来的基本物理常数。准确测量阿伏加德罗常数对国际基本单位--千克和摩尔的重新定义起着举足轻重的作用,同时对于在原子、分子和量子水平上研究和解决计量基标准问题十分关键。目前,国际上阿伏加德罗常数的测定主要是根据完整晶格单晶硅的摩尔体积和单个硅原子的体积之比,通过准确测量单晶硅球的密度,单晶硅摩尔质量和晶格常数来实现。 近日,由中国计量科学研究院联合清华大学等国家重点科研机构开展的“十一五”科技支撑计划重点项目“阿伏加德罗常数测量关键技术研究”课题通过了国家质检总局组织的专家验收。该课题组经过4年的研究,建立了一套固体密度基准装置,该装置测量硅球直径的准确度(优于0.9nm)达到国际先进水平;通过构建新的装置和优化工艺流程,使得自然丰度单晶硅摩尔质量测量不确定度达到了 8×10-8,是目前国际上最高测量水平。该项目研究成果为我国建立摩尔计量基准奠定了重要基础,为我国在基本物理常数研究方面争得了国际话语权。http://ng1.17img.cn/bbsfiles/images/2011/05/201105162122_294480_1638489_3.jpg
Pirimiphos-methyl-N-desethyl 安谱标准品网页http://www.instrument.com.cn/reagent/P1174340.htmPirimiphos-methyl-N-desethyl,CAS#:,纯品,0.1gPirimiphos-methyl CAS:29232-93-7
昨天从中国商业联合会获悉,经国家标准化管理委员会批准,全国肉禽蛋制品标准化技术委员会日前正式成立,秘书处设在中商联。据了解,标委会主要职责是,负责禽畜肉制品门类(腌腊制品类、酱卤制品类、熏烧制品类、干制品类、油炸制品类)和蛋制品门类(再制蛋类、蛋粉类、冰全蛋类、蛋黄类)等领域的国家标准制订工作,包括制修订产品质量标准、检测标准、基础标准等。 全国肉禽蛋制品标委会秘书长张丽君介绍,该标委会已制订出肉禽蛋制品标准体系框架草案,将在近几年组织制修订《肉禽蛋制品检测方法》等30多项标准以及《肉与肉制品术语》、《肉松》、《肉干》、《中式香肠》、《酱卤肉制品》等国家标准;建立肉制品安全体系的《肉与肉制品的射频识别码(RFID)追溯技术要求》国家标准和计划立项《肉禽蛋制品分类》标准。
阿佛加德罗常数[em09511]12克C-12含有的碳原子个数称为阿伏加德罗常数,用NA表示,单位是个/摩。1摩尔任何物质均含NA个微粒。NA的近似数值为6.02205×10^23,可通过单分子膜法、电解法等测出。 阿伏加德罗常数(符号:NA)是物理学和化学中的一个重要常量。它的数值为: 一般计算时取6.02×10^23或6.022×10^23。它的正式的定义是0.012千克碳12中包含的碳12的原子的数量。历史上,将碳12选为参考物质是因为它的原子量可以测量的相当精确。 阿伏加德罗常数因意大利化学家阿伏加德罗(Avogadro A)得名。现在此常量与物质的量紧密相关,摩尔作为物质的量的国际单位制基本单位,被定义为所含的基本单元数为阿伏加德罗常数(NA)。其中基本单元可以是任何一种物质(如分子、原子或离子)。[color=#DC143C] NA的历史[/color] 早在17-18世纪,西方的科学家就已经对6.02×10^23这个数字有了初步的认识。他们发现,1个氢原子的质量等于1克的6.02×10^23分之1。但是直到19世纪中叶,“阿伏加德罗常数”的概念才正式由法国科学家让贝汉(Jean Baptiste Perrin)提出,而在1865年,NA的值才首次通过科学的方法测定出,测定者是德国人约翰洛施米特(Johann Josef Loschmidt)。因此此常数在一些国家(主要是说德语的国家)也叫洛施米特常数。 [color=#00008B]NA的定义[/color] 正如先前所提及,阿伏加德罗常数可以适用于任何物质,而不限于分子、原子或离子。因此,化学上利用这个数值来定义原子量或分子量。根据定义,阿伏加德罗数是组成与物质质量(用克表示)相等必要的原子或分子的数量。例如,铁的原子量是55.845原子量单位,所以阿伏加德罗数的铁原子(一摩尔的铁原子)的质量是55.845克。反过来说,55.845克的铁内有阿伏加德罗数的铁原子。所以阿伏加德罗数是克和原子量的转换系数:[color=#DC143C] NA的测量[/color] 由于现在已经知道m=nM/NA,因此只要有物质的式量和质量,NA的测量就并非难事。但由于NA在化学中极为重要,所以必须要测量它的精确值。现在一般精确的测量方法是通过测量晶体(如晶体硅)的晶胞参数求得。由多国实验室组成的国际阿伏加德罗协作组织采用测量1个重1千克、几乎完全由硅-28组成的晶体球的体积、晶胞参数等物理量的方法来精确地测定该值,以便用NA来重新定义千克。 NA与其它常量的关系 阿伏加德罗常数常作为其他常量之间的纽带。如: R = NA × k R是气体常数,k是玻耳兹曼常数; F = NA × e F是法拉第常数,e是元电荷。
日前,由中焙糖协蜜饯专业委员会组织的国标《蜜饯 山楂制品》标准审定会在北京召开。卫生部卫生监督中心处长谷京宇、国家食品安全风险中心副研究员张俭波、国家食品质量安全监督检验中心主任曹红、中国食品发酵工业研究院主任元晓梅、国标委标准审查部副主任王长林、全国食品标委会副秘书长杨晓明、标准出版社副社长白德美、中国焙烤食品糖制品工业协会理事长朱念琳、副秘书长张九魁等领导到会。 专家组由谷京宇担任组长并主持审定会。会上,专家组对国标《蜜饯 山楂制品》标准逐条进行了认真讨论和审定,并提出了4 条修改意见。到会专家一致认为国标《蜜饯 山楂制品》标准属于产品质量标准,会后,由起草组将标准文本按要求修改后形成报批稿上报。专家组认为,起草工作组在制标过程中广泛收集了国内相关标准资料,深入调查研究了蜜饯行业山楂制品现状的基本情况,在广泛调研和验证基础上全面考虑、结合实际,多渠道听取各方面意见,起草工作细致严谨,基础工作扎实,提供的资料完整,制标依据充分,符合制标程序,文本编写规范,符合制标条件,该标准通过审定符合条件可以上报。 同时,参加会议的还有国标《蜜饯 山楂制品》标准起草小组成员国家蔬菜质量监督技术中心主任许军、来自河北怡达食品集团有限公司的王树林、来自北京御食园食品股份有限公司的董立军、天喔(福建)食品有限公司厂长周志民、来自北京康贝尔食品有限公司的孙玉平、中国焙烤食品糖制品工业协会副秘书长赵燕萍、张斌等。
[color=#DC143C]阿伏加德罗定律Avogadro's hypothesis[/color] 定义:[color=#00008B]同温同压同体积的气体含有相同的分子数。[/color] 推论: (1)同温同压下,V1/V2=n1/n2 (2)同温同体积时,p1/p2=n1/n2=N1/N2 (3)同温同压等质量时,V1/V2=M2/M1 (4)同温同压同体积时,M1/M2=ρ1/ρ2 同温同压下,相同体积的任何气体含有相同的分子数,称为阿伏加德罗定律。气体的体积是指所含分子占据的空间,通常条件下,气体分子间的平均距离约为分子直径的10倍,因此,当气体所含分子数确定后,气体的体积主要决定于分子间的平均距离而不是分子本身的大小。分子间的平均距离又决定于外界的温度和压强,当温度、压强相同时,任何气体分子间的平均距离几乎相等(气体分子间的作用微弱,可忽略),故定律成立。该定律在有气体参加的化学反应、推断未知气体的分子式等方面有广泛的应用。 阿伏加德罗定律认为:在同温同压下,相同体积的气体含有相同数目的分子。1811年由意大利化学家阿伏加德罗提出假说,后来被科学界所承认。这一定律揭示了气体反应的体积关系,用以说明气体分子的组成,为气体密度法测定气态物质的分子量提供了依据。对于原子分子说的建立,也起了一定的积极作用。
各有关单位: 根据《食品安全法》和《新资源食品管理办法》的规定,经新资源食品评审专家委员会审核,拟批准蛋白核小球藻、当归、乌药叶、辣木叶为新资源食品,拟变更新资源食品蔗糖聚酯相关信息,拟公布梨果仙人掌(米邦塔品种,Opuntia ficus-indica(Linn.)Mill)为普通食品。现公开征求意见,截止时间为2012年9月10日,请将意见反馈至卫生部卫生监督中心。 传真:010-84088654 邮箱:zhangxx3961@yahoo.com.cn 附件: 1.蛋白核小球藻等4种拟批准的新资源食品 2.蔗糖聚酯 卫生部办公厅 2012年8月14日 附件1蛋白核小球藻等4种拟批准的新资源食品 一、蛋白核小球藻中文名称蛋白核小球藻拉丁名称Chlorella pyrenoidesa基本信息种属:绿藻目、小球藻属生产工艺简述人工养殖的蛋白核小球藻经离心、洗涤、分离、干燥等工艺制成。食用量≤20克/天质量要求性状深绿至黑绿色粉末蛋白质/(g/100g)≥ 58水分/(g/100g)≤ 5灰分/(g/100g)≤ 5其他需要说明的情况1. 使用范围不包括婴幼儿食品。2. 卫生安全指标应符合我国相关标准。 二、当归 中文名称当归拉丁名称Angelica Sinensis 基本信息来源:伞形科植物当归(Angelica sinensis (Oliv.) Diels)食用部位:根食用量≤6.7克/天使用范围仅限用于香辛料其他需要说明的情况1.婴幼儿及孕妇不宜食用,标签、说明书中应当标注不适宜人群。2.卫生安全指标应符合我国相关标准。 三、乌药 中文名称乌药叶拉丁名称Linderae aggregate leaf基本信息来源:樟科植物乌药( Linderae aggregate )食用部位:嫩叶食用量≤5克/天其他需要说明的情况1.婴幼儿、儿童、孕期及哺乳期妇女不宜食用,标签、说明书中应当标注不适宜人群。2.卫生安全指标应符合我国相关标准。 四、辣木叶 中文名称辣木叶拉丁名称Moringa oleifera leaf基本信息来源:辣木(拉丁学名Moringa oleifera)食用部位:带柄的羽状复叶其他需要说明的情况卫生安全指标应符合我国相关标准。 附件2蔗糖聚酯中文名称蔗糖聚酯英文名称Sucrose Ployesters主要成分蔗糖聚酯(6、7、8酯)基本信息来源:大豆油结构式:http://file1.foodmate.net/fil
国家食药监总局药品审评中心(CDE)发布公告,拟聘用各类药品审评员20人。业内人士预计,增加药品审评员人数后,CDE药品审评进度过慢的现状有望被改善。公告显示,此次审评员招聘岗位包括:化药药学审评员、化药临床审评员、药理毒理审评员、生物制品药学审评员和中药临床审评员。五个岗位合计招聘20人,其中化药药学审评员招聘人数高达10人。值得一提的是,CDE药品审批速度过慢的现状一直以来饱受行业诟病。华海药业(600521.SH)总经理陈保华曾多次呼吁,希望CDE增加编制、合理提高收费标准、优先审评质量标准较高药物。华东医药(000963.SZ)公司人士也在电话会议上坦言,公司多个药品都在排队待审评状态,希望CDE能够加快审评速度。公开资料显示,近年来国内企业年申报的新药数量已上万,但CDE的人员编制从2000年至今一直保持在120人左右,审批人员人数不足是影响药品审评进度的主要原因。(by 浮米网)
http://www.greenherbs.com.cn/bbs/dispbbs.asp?boardid=2&Id=7651724918 唑吡坦杂质A CIV Zolpidem Related Compound A CIV 对照品/标准品1724907 酒石酸唑吡坦 CIV Zolpidem Tartrate CIV 对照品/标准品1724893 唑吡坦 CIV Zolpidem CIV 对照品/标准品1724805 盐酸唑拉西泮 Zolazepam Hydrochloride 对照品/标准品1724769 硫酸锌 Zinc Sulfate 对照品/标准品1724747 氧化锌 Zinc Oxide 对照品/标准品1724689 齐留通杂质C Zileuton Related Compound C 对照品/标准品1724678 齐留通杂质B Zileuton Related Compound B 对照品/标准品1724667 齐留通杂质 A Zileuton Related Compound A 对照品/标准品1724656 齐留通 Zileuton 对照品/标准品1724532 齐多夫定杂质C(胸腺嘧啶) Zidovudine Related Compound C (thymine) 对照品/标准品1724521 齐多夫定杂质B Zidovudine Related Compound B 对照品/标准品1724500 齐多夫定 Zidovudine 对照品/标准品1724317 扎西他滨杂质A Zalcitabine Related Compound A 对照品/标准品1724306 扎西他滨 Zalcitabine 对照品/标准品1724000 盐酸育亨宾 Yohimbine Hydrochloride 对照品/标准品1722005 木糖 Xylose 对照品/标准品1721002 盐酸赛洛唑啉 Xylometazoline Hydrochloride 对照品/标准品1720600 木糖醇 Xylitol 对照品/标准品1720429 盐酸赛拉嗪 Xylazine Hydrochloride 对照品/标准品1720407 赛拉嗪 Xylazine 对照品/标准品1720203 呫吨酮 Xanthone 对照品/标准品1720000 呫吨酸 Xanthanoic Acid 对照品/标准品1719102 华法林杂质 A Warfarin Related Compound A 对照品/标准品1719000 华法林 Warfarin 对照品/标准品1717708 牡荆素(牡荆甙) Vitexin 对照品/标准品1717504 含量测定系统适用性用维生素D Vitamin D Assay System Suitability 对照品/标准品1716002 维生素A Vitamin A 对照品/标准品1715000 硫酸紫霉素 Viomycin Sulfate 对照品/标准品1714528 长春瑞滨杂质A Vinorelbine Related Compound A 对照品/标准品1714506 酒石酸长春瑞滨 Vinorelbine Tartrate 对照品/标准品1714007 硫酸长春新碱 Vincristine Sulfate 对照品/标准品1713004 硫酸长春碱 Vinblastine Sulfate 对照品/标准品1711508 阿糖腺苷 Vidarabine 对照品/标准品1711472 维替泊芬杂质A Verteporfin Related Compound A 对照品/标准品1711461 维替泊芬 Verteporfin 对照品/标准品1711440 维拉帕米杂质F Verapamil Related Compound F 对照品/标准品1711439 维拉帕米杂质E Verapamil Related Compound E 对照品/标准品1711428 维拉帕米杂质D Verapamil Related Compound D 对照品/标准品1711406 维拉帕米杂质B Verapamil Related Compound B 对照品/标准品1711304 维拉帕米杂质A Verapamil Related Compound A 对照品/标准品1711224 维库溴铵杂质F Vecuronium Bromide Related Compound F 对照品/标准品1711202 盐酸维拉帕米 Verapamil Hydrochloride 对照品/标准品1711188 维库溴铵杂质C Vecuronium Bromide Related Compound C 对照品/标准品1711177 维库溴铵杂质B Vecuronium Bromide Related Compound B 对照品/标准品1711166 维库溴铵杂质A Vecuronium Bromide Related Compound A 对照品/标准品1711155 维库溴铵 Vecuronium Bromide 对照品/标准品1711133 赖氨加压素 Lypressin 对照品/标准品1711100 加压素 Vasopressin 对照品/标准品1711009 香草醛熔点标准品 Vanillin Melting Point Standard 对照品/标准品1710006 香草醛 Vanillin 对照品/标准品1709018 Vancomycin B with Monodechlorovancomycin 对照品/标准品1709007 盐酸万古霉素 Vancomycin Hydrochloride 对照品/标准品1708795 缬沙坦杂质 C Valsartan Related Compound C 对照品/标准品1708784 缬沙坦杂质 B Valsartan Related Compound B 对照品/标准品1708773 缬沙坦杂质 A Valsartan Related Compound A 对照品/标准品1708762 缬沙坦 Valsartan 对照品/标准品1708751 戊柔比星分离度用混合物 Valrubicin Resolution Mixture 对照品/标准品1708730 戊柔比星 Valrubicin 对照品/标准品1708729 丙戊酸杂质A Valproic Acid Related Compound A 对照品/标准品1708718 丙戊酸杂质 B Valproic Acid Related Compound B 对照品/标准品1708707 丙戊酸 Valproic Acid 对照品/标准品1708503 L- 缬氨酸 L-Valine 对照品/标准品1708015 D-缬更昔洛韦 D-Valganciclovir 对照品/标准品1708004 缬更昔洛韦盐酸盐 Valganciclovir Hydrochloride 对照品/标准品1707908 缬草烯酸 Valerenic Acid 对照品/标准品1707894 万乃洛韦杂质G Valacyclovir Related Compound G 对照品/标准品1707883 万乃洛韦杂质F Valacyclovir Related Compound F 对照品/标准品1707872 万乃洛韦杂质E Valacyclovir Related Compound E 对照品/标准品1707861 万乃洛韦杂质D Valacyclovir Related Compound D 对照品/标准品1707855 万乃洛韦杂质C Valacyclovir Related Compound C 对照品/标准品1707839 盐酸万乃洛韦 Valacyclovir Hydrochloride 对照品/标准品1707806 熊去氧胆酸 Ursodiol 对照品/标准品1706701 C13尿素 Urea C 13 对照品/标准品1706698 尿素 Urea 对照品/标准品1706009 乌拉莫司汀 Uracil Mustard 对照品/标准品1705800 阿糖尿苷 Uracil Arabinoside 对照品/标准品1705505 十一烯酸 Undecylenic Acid 对照品/标准品1705323 泛癸利酮杂质A Ubidecarenone Related Compound A 对照品/标准品1705312 系统适用性试验用泛癸利酮 Ubidecarenone for System Suitability 对照品/标准品1705301 泛癸利酮 Ubidecarenone 对照品/标准品1705006 L- 酪氨酸 L-Tyrosine 对照品/标准品1704003 泰洛沙泊 Tyloxapol 对照品/标准品1703850 酒石酸泰洛星 Tylosin Tartrate 对照品/标准品1703805 泰洛星 Tylosin 对照品/标准品1702008 氯筒箭毒碱 Tuboc
卫办监督函〔2013〕359号各有关单位: 根据《食品安全法》和《食品安全国家标准管理办法》规定,我委在向社会公开征求意见的基础上制定了《2013年食品安全国家标准项目计划》,现印发给你们,请认真组织落实。有关工作要求如下: 一、填报项目委托协议书,及时落实食品安全国家标准项目计划 2013年食品安全国家标准计划项目承担单位应当填写《2013年食品安全国家标准制(修)订项目委托协议书》(可从卫生计生委网站http://www.moh.gov.cn下载),打印后由承担单位负责人签字并加盖单位公章(一式五份),于2013年5月20日前报送食品安全国家标准审评委员会秘书处(以下简称秘书处)。逾期未提交协议书的,视为自动放弃标准起草单位和起草人资格。秘书处对协议书进行审核后,于2013年5月31日前报送我委。 二、加强日常管理,确保食品安全国家标准项目及相关经费按时保质执行 (一)项目承担单位和项目负责人要加强食品安全国家标准制定、修订工作的管理,保证项目质量和进度,请于2013年12月30日前向秘书处提交工作中期进展报告和经费使用情况报告,于2014年6月30日前完成任务,向秘书处提交送审材料和经费决算报告。经费决算报告由财务负责人和单位负责人签字并加盖公章。 (二)未按期完成任务提交送审材料的,项目承担单位和项目负责人应当提交说明,并附经费使用情况报告,加盖单位公章后报秘书处。我委将视情况予以通报批评,并根据国家有关财经法规制度,对已拨付的项目经费采取追回等必要的处理措施。 (三)相关省(区、市)卫生厅(局、卫生计生委)、有关单位要支持并督促下属单位承担的项目工作,秘书处要督促检查项目执行情况,确保项 目计划整体进度。2013年食品安全国家标准项目计划序号项目名称制定/修订建议承担单位食品产品1藻类制品修订浙江省疾病预防控制中心中国水产科学研究院微生物检验方法2食品微生物检验采样与检样处理规程修订国家食品安全风险评估中心理化检验方法3食品中B族和G族黄曲霉毒素的测定修订浙江省疾病预防控制中心4食品中M族黄曲霉毒素的测定修订浙江省疾病预防控制中心食品添加剂质量规格5食品添加剂 4-己基间苯二酚制定中海油天津化工研究院6食品添加剂 冰结构蛋白制定中国食品添加剂和配料协会7食品添加剂 刺梧桐胶制定中国食品发酵工业研究院上海市质量监督检验技术研究院8食品添加剂 甲基纤维素制定中国食品发酵工业研究院9食品添加剂 偏酒石酸制定天津科技大学10食品添加剂 植酸钠制定江西出入境检验检疫局11食品添加剂 羟基硬脂精制定中国食品发酵工业研究院上海市食品添加剂行业协会12食品添加剂 海藻酸钠修订黄海水产研究所中国海藻工业协会13食品添加剂 36项香料标准包括:橙苷(柚皮甙提取物)、橙皮素、丁香花蕾油、根皮素、黄芥末提取物、可可酊、葡萄籽提取物、大蒜油、白兰花油、白兰叶油、红茶酊、玫瑰净油、杭白菊油、罗汉果酊、小花茉莉净油、树兰油、桂花净油、绿茶酊、椒样薄荷油、茶树油、香茅醛(合成)、香茅(精)油、麦芽酚、覆盆子酮(悬钩子酮)、丙酸苄酯、丁酸丁酯、异戊酸乙酯、苯甲酸乙酯、苯甲酸苄酯、2-甲基吡嗪、2,3-二甲基吡嗪、2,3,5-三甲基吡嗪、5-羟乙基-4-甲基噻唑、2-乙酰基噻唑、2,3,5,6-四甲基吡嗪、乙基香兰素制定国家食品安全风险评估中心上海香料研究所营养强化剂质量规格14维生素E琥珀酸钙制定广东出入境检验检疫局检验检疫技术中心15硝酸硫胺素制定景德镇出入境检验检疫局16维生素C磷酸酯镁制定中国食品添加剂和配料协会17生物素制定中国食品发酵工业研究院18氯化胆碱制定中国食品添加剂和配料协会中国食品发酵工业研究院19葡萄糖酸亚铁制定江西省疾病预防控制中心20焦磷酸铁制定上海市质量监督检验技术研究院21柠檬酸亚铁制定中国食品添加剂和配料协会中国食品发酵工业研究院22柠檬酸铁铵制定广西出入境检验检疫局检验检疫技术中心23柠檬酸苹果酸钙制定天津出入境检验检疫局动植物与食品检测中心24骨粉(超细鲜骨粉)制定江苏省疾病预防控制中心天津科技大学25乳酸锌制定江西省疾病预防控制中心26碳酸锌制定中国食品添加剂和配料协会中国食品发酵工业研究院27亚硒酸钠制定张家港市产品质量监督检验所28硒蛋白制定湖北省疾病预防控制中心29富硒食用菌粉制定中国食品发酵工业研究院中国食品添加剂和配料协会30[/
[size=3][b]国家药品标准包括的类别探讨[/b][/size]国家药品标准包括:1)中国药典2000年版、2005年版;中国药典2002、2004年增补本; 中国药典2005年版勘误; 2006年、2009年增补本; 2)卫生部中药成方制剂一至二十册、二十一册(中药保密品种); 3)卫生部化学、生化、抗生素药品第一分册;4)卫生部药品标准(二部)一册至六册;6)卫生部药品标准藏药第一册、蒙药分册、维吾尔药分册; 7)卫生部新药转正标准1至75册; 8) 国家药品标准化学药品地标升国标一至十六册;国家药品标准化学药品地标升国标一至十六册勘误;9)国家中成药标准汇编内科心系分册、内科肝胆分册、内科脾胃分册、内科气血津液分册、内科肺系(一)、(二)分册、内科肾系分册、外科妇科分册、骨伤科分册、口腔肿瘤儿科分册、眼科耳鼻喉皮肤科分册、经络肢体脑系分册;10)国家药监局和国家药典委员会颁布的新药批件及修订批件;11) 进口药品复核标准汇编;12)进口药品单页标准不知除此之外还有什么标准吗,望补充
GB/T 11858-2008 伏特加(俄得克)2008-10-19发布,2009-06-01实施,代替GB/T 11858-2000《俄得克(伏特加)》。这份标准把总酯和总醛两个检测项目的指标对应反了,幸好在实施的前夕发布了它的第1号修改单。GB/T 11858-2008《伏特加(俄得克)》国家标准第1号修改单于2009年5月27日以国标委农函[2009]33号文批准,自2009年6月1日起实施。关于批准GB/T 11858-2008《伏特加(俄得克)》国家标准第1号修改单的复函中国轻工业联合会: 你单位《关于报送GB/T 11858-2008〈伏特加(俄得克)〉第一号修改单的函》(中轻联综发[2009]104号)收悉。经研究,批准GB/T 11858-2008《伏特加(俄得克)》国家标准第1号修改单,于2009年6月1日起实施,并在《中国标准化》2009年第7期上公布。 修改单见附件。 附件:GB/T 11858-2008《伏特加(俄得克)》国家标准第1号修改单.doc[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=153619]GB/T 11858-2008《伏特加(俄得克)》国家标准第1号修改单[/url]资料中心下载GB/T 11858-2008[url]http://www.instrument.com.cn/download/shtml/093982.shtml[/url]
各有关单位: 根据《食品安全法》和《食品安全国家标准管理办法》规定,为做好食品安全国家标准清理完善工作,我部向社会公开征求2011年度食品安全国家标准项目计划(第二批),并根据反馈意见情况拟定了《2011年食品安全国家标准制(修)订项目计划(第二批)》。现印发给你们,请认真组织落实。有关工作要求如下: 一、填报项目委托协议书,及时落实食品安全国家标准制(修)订计划 食品安全国家标准制(修)订计划项目承担单位应当填写2011年食品安全国家标准制(修)订项目委托协议书(项目委托协议书可从卫生部网站http://www.moh.gov.cn下载)。请将协议书填写打印后由承担单位负责人签字并加盖单位公章(一式五份),于2011年11月3日前报送食品安全国家标准审评委员会秘书处(以下简称秘书处)。逾期未提交协议书的,视为自动放弃标准起草单位和起草人资格。秘书处对协议书进行审核后,于2011年11月10日前报送我部监督局。 二、加强日常管理,确保食品安全国家标准制(修)订项目及相关经费按时、保质执行 (一)项目承担单位和项目负责人要高度重视食品安全国家标准制(修)订工作,纳入本单位重要工作日程,保证项目质量和进度,并于2012年10月31日前完成任务,向秘书处提交送审材料和经费决算报告。经费决算报告由财务负责人和单位负责人签字并加盖公章。 (二)未按期提交送审材料的,项目承担单位和项目负责人应当提交原因说明,并附经费使用情况报告,加盖单位公章后报秘书处。我部将视情况予以通报批评,并根据国家有关财经法规制度,对已拨付的项目经费采取“追回”等必要的处理措施。 (三)为保障标准制(修)订项目的顺利实施,请相关省市卫生厅(局)、有关单位对下属单位承担的标准制(修)订项目给予充分重视,支持并督促相关工作。请秘书处督促检查项目执行情况,确保项目计划整体进度。 附件:1. http://www.foodmate.net/member/fckeditor/editor/images/ext/doc.gif 2011年度食品安全国家标准制(修)订项目计划(第二批).doc 2. http://www.foodmate.net/member/fckeditor/editor/images/ext/doc.gif 2011年食品安全国家标准制(修)订项目委托协议书.doc 3. http://www.foodmate.net/member/fckeditor/editor/images/ext/pdf.gif 国家标准制修订经费管理办法.pdf 二○一一年十月二十六日
2012年 第19号 根据《中华人民共和国食品安全法》和《新资源食品管理办法》有关规定,现批准蛋白核小球藻、乌药叶、辣木叶为新资源食品,变更新资源食品蔗糖聚酯的食用量,公布梨果仙人掌(Opuntia ficus-indica(Linn.)Mill,米邦塔品种)为普通食品。生产经营上述食品应当符合有关法律、法规、标准规定。 特此公告。 附件: http://www.foodmate.net/member/fckeditor/editor/images/ext/doc.gif 蛋白核小球藻等4种新资源食品.doc 卫生部 2012年11月12日
[center]药品标准与药品批准文号综述[/center]1 国家药品标准1.1 建国以来,卫生部和SDA颁布的国家药品标准《中华人民共和国药典》 (以下简称中国药典)有1953年版、1963年版、1977年版、1985年版、 1990年版、1995年版、2000年版和2005年版, 1985年版以后的各版《中国药典》都颁布有增补本。1.2 卫生部颁布的国家药品标准有1963年版抗菌素部颁标准,以后数年大多颁布的是单行本的部颁药品标准。 1.3 1989年5月31日,卫生部发布《关于颁布第一批“乙肝扶正胶囊”等一百七十种中成药“卫生部药品标准”的通知》[卫药发(89)第28号],即《部颁标准“中药成方制剂” (第一册)》,该《通知》规定:《部颁标准“中药成方制剂”(第一册)》从1991年1月1日起开始执行,升为部颁标准后的同品种原地方药品标准即停止使用。从此以后,卫生部共颁布了中成药部颁标准1~20册、化学药品部颁标准1~6册。这些药品标准目前正在使用。 1.4 1998年SDA和2003年SFDA成立后,共颁布了局颁中药标准1—14册、化学药品标准1~16册、局颁新药转正标准1~45册。这些药品标准目前正在使用。 2 地方药品标准 2.1 1978年7月30日,国务院颁布《药政管理条例》(试行)(国发[1978]154号),该《条例》第十九条规定:“药品标准是国家对药品质量规格和检验方法所作的技术规定,必须遵照执行。药品标准分为三类:第一类:国家标准,即中华人民共和国药典(简称《中国药典》);第二类:卫生部颁发的药品标准(简称部颁标准);第三类:,地方标准,即各省、市、自治区卫生局审批的药品标准”。地方药品标准的法律地位首次以法规的形式予以明确规定,与中国药典、部颁标准一样作为药品生产、经营、使用、检验和药品监督管理部门共同遵循的法定依据。 2.2 1980年9月10日,卫生部颁布《药品标准工作管理办法》,该《办法》对中国药典、部颁标准、地方药品标准各自应收载的药品范围作了具体的划分。之后,各省级卫生厅(局)相继发布地方药品标准。 2.3 1984年9月20日,全国人大常委会六届七次会议通过的1985年7月1日实施的《中华人民共和国药品管理法》(以下简称《药品管理法》)第二十三条规定:“药品必须符合国家标准和省、自治区、直辖市药品标准。”地方药品标准又由国家以法律的形式确定其法律地位。2.4 1986年,卫生部开始进行地方药品标准的再评价工作,对中西药地方药品标准分期分批地开展整顿,拟逐步形成以国家药品标准为主体的药品标准。整顿的主要原因是各省之间制定的地方药品标准的技术规定差距较大,地方药品标准过多过滥。整顿的内容主要为同方异名、同名异方、药品组方不合理、药品疗效不确切等问题。 2.5 1994年8月17日,卫生部发布《关于中成药整顿工作有关问题的通知》[卫药发(1994)第 30号],该《通知》第二条规定: “根据我部卫药字(90)第?号文件精神,全面推行中成药国家标准,加速省(区、市)标准逐步过渡到国家药品标准的进程,争取1995年上半年完成中成药整顿全部品种的医学审查工作,1996年完成药学审查和部颁标准的颁布工作”。 2.6 1995年10月6日,卫生部发布《关于中成药国家标准问题的通知》 [卫药发(1995)第69号],该《通知》第1条规定: “根据卫药发 (1994)第30号文‘1996年完成药学审查和部颁标准的颁布工作’和卫药字(90)第7号文‘对治疗性中成药在1996年以后将全部实行国家药品标准的做法’的要求,请各地和药典会加快部颁标准的起草和审核工作,以使中成药品种由地方标准过渡到国家标准顺利进行”。第3条规定:“凡国家已颁布的中药品种质量标准,任何单位和个人必须坚决执行,同时原质量标准废止。如发现不按国标生产,或在流通和使用时发现与国标不符的药品,一律按《药品管理法》有关规定以劣药论处”。2.7 2001年2月16日,SDA发布《关于强化中成药国家标准管理工作的通知》(国药监注[2001] 83号),该《通知》就解决中成药地方标准的基本原则、方法和要求作了具体规定,并规定从2003年1月1日起,地方药品标准品种不得在市场上流通。 2.8 2001年2月28日,全国人大常委会九届二十次会议通过的2001年12月1日实施的《药品管理法》(修订)第三十二条规定:“药品必须符合国家标准”。“国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准”。明确地取消了地方药品标准。 2.9 2001年11月30日,SDA发布《关于有关地方药品标准执行问题的公告》 (国药管注[2001] 522号),《公告》的事项是《国务院办公厅关于施行(药品管理法有关药品标准延期执行问题的复函》(国办函[2001]68号):“从2001年12月1日起至2002年11月30日,国家药品监督管理局应当对《药品管理法》修订前各省、自治区、直辖市药品监督管理部门按照当时实行的地方药品标准批准生产的药品品种,逐个进行审查,经审查,对符合《中华人民共和国药品管理法》有关规定的,纳入国家药品标准,可以继续生产;对不符合规定的,立即停止该品种的生产并撤销其批准文号”。 2.10 按照地方标准生产药品的使用期限 2.10.1 2001年3月25日,SDA印发《关于妥善处理地方标准品种问题的通知》(国药监注(20013 96号),该《通知》规定:“(一)未纳入国家药品标准管理的地方药品标准品种应立即停止生产、销售和使用。(二)已纳入国家药品标准管理的原地方药品标准品种,有关药品生产企业应按我局颁布的国家药品标准组织生产;尚未换发批准文号的,可以使用原地方批准文号。按照国家药品标准生产的药品,可以在药品的有效期内流通和使用。(三)已纳入国家药品标准管理的原地方药晶标准品种,按照原地方药品标准生产的药品,可流通和使用至 2003年12月31日”。 2.10.2 SDA和SFDA2003年底以前共公布了三批停止使用的化学药品地标品种,规定被停止使用的化学药品标准从发文之日起,不再具有法律效力。在此之前生产并在市场上流通的品种,由生产企业在6个月内自行收回销毁。