求助硫酸特布他林雾化溶液原研在国内上市的说明书和进口标准!!!谢谢!!!!!!
请问各位老师做水样中的总磷含量是用什么标准溶液,是磷标准物质、磷酸二氢根标准物质还是磷酸盐磷标准物质?http://simg.instrument.com.cn/bbs/images/brow/em09512.gif
特征形态液态 基体异辛烷主要分析方法气相色谱法,重量容量法规格1 mL/瓶用 途作为量值传递的标准,用于气相色谱-质谱仪(GC-MS)的校准和检定、分析方法评价,以及质量控制等方面。保存条件保存于干燥、洁净、避光的环境中使用注意事项最小取样量为1mL。六氯苯属于有害物质,使用时应注意防护,避免吸入或与皮肤接触,使用后剩余的溶液应进行专门的集中处理。
辛硫磷标品为液体如何称量配制标准溶液?请问你们碰到这种情况怎么办的??
看到有人讨论用EDTA基准物质配制EDTA溶液需不需要标定,仔细读了GB/T 601-2002化学试剂标准滴定溶液的配制,觉得是不需要标定的。在4.15 乙二胺四乙酸二钠标准滴定溶液 配制里面写的是定量称取乙二胺四乙酸二钠加水加热溶解配制成需要的浓度就可以了在接下来的4.16 氧化锌标准滴定溶液 的标定中用的是“称取1.4g经硝酸镁饱和溶液恒湿器中放置7d后的工作基准试剂乙二胺四乙酸二钠,溶于100ml热水中,加10ml氨-氯化铵缓冲溶液甲(pH=10),用配制好的氯化锌溶液滴定”。乙二胺四乙酸二钠基准试剂的说明书上也写明配制条件:硝酸镁饱和溶液恒湿器中放置既然乙二胺四乙酸二钠基准试剂可以用来标定氯化锌,那么用基准配制的个人认为就可以不再标定了。
一、哪些标准物质/标准溶液需进行期间核查? 原则上,所有具备一定储存期限(即非现配现用)的标准物质/标准溶液均应进行期间核查。但由于实际操作难度较大,且相关法规文件未有硬性规定,很多实验室会根据标准物质/标准溶液的储存期限、稳定程度等因素,确定需进行期间核查的标准物质/标准溶液清单以及相应的核查频次。一般建议储存期在3个月以上的标准物质/标准溶液,在其有效期的中间时间点应至少进行1次期间核查(针对性质不稳定的标准物质/标准溶液,可适当增加核查频次),如发现其外观、储存条件发生变化或怀疑其导致检验检测结果异常等情况,应立即组织人员进行技术核查。
[b]‘有奖问答’选择题:[/b]下列物质中,能用NaOH标准滴定溶液直接滴定的是( ) (A)苯酚[sub] [/sub](B)Na[sub]2[/sub]HPO[sub]4[/sub] (C)邻苯二甲酸氢钾 (D)NH[sub]4[/sub]HCO[sub]3[/sub]
????原则上,所有具备一定储存期限(即非现配现用)的标准物质/标准溶液均应进行期间核查。但由于实际操作难度较大,且相关法规文件未有硬性规定,很多实验室会根据标准物质/标准溶液的储存期限、稳定程度等因素,确定需进行期间核查的标准物质/标准溶液清单以及相应的核查频次。一般建议储存期在3个月以上的标准物质/标准溶液,在其有效期的中间时间点应至少进行1次期间核查(针对性质不稳定的标准物质/标准溶液,可适当增加核查频次),如发现其外观、储存条件发生变化或怀疑其导致检验检测结果异常等情况,应立即组织人员进行技术核查。
由于工作多人少,最近想要购买现成的标准滴定溶液,如硫氰酸钾标准滴定溶液,EDTA等等,但不知道购买的标准滴定溶液是否可靠,有效期有多长?是否有标准物质证书?如果有使用过的老师请给点建议。谢谢!
1标准溶液的配制方法及基准物质标准溶液是指已知准确浓度的溶液,它是滴定分析中进行定量计算的依据之一。不论采用何种滴定方法,都离不开标准溶液。因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。配制标准溶液的方法一般有以下两种:1.1直接配制法用分析天平 准确地称取一定量的物质,溶于适量水后定量转入容量瓶 中,稀释至标线,定容并摇匀。根据溶质的质量和容量瓶 的体积计算该溶液的准确浓度。能用于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是用来确定某一溶液准确浓度的标准物质。作为基准物质必须符合下列要求:(1) 试剂必须具有足够高的纯度,一般要求其纯度在99.9%以上,所含的杂质应不影响滴定反应的准确度。(2)物质的实际组成与它的化学式完全相符,若含有结晶水(如硼砂Na2B4O7.10H2O),其结晶水的数目也应与化学式完全相符。(3) 试剂应该稳定。例如,不易吸收空气中的水分和二氧化碳,不易被空气氧化,加热干燥时不易分解等。(4)试剂最好有较大的摩尔质量,这样可以减少称量误差。常用的基准物质有纯金属和某些纯化合物,如Cu, Zn, Al, Fe和K2Cr2O7 ,Na2CO3 , MgO , KBrO3 等,它们的含量一般在99.9%以上,甚至可达99.99% 。应注意,有些高纯试剂和光谱纯试剂虽然纯度很高,但只能说明其中杂质含量很低。由于可能含有组成不定的水分和气体杂质,使其组成与化学式不一定准确相符,致使主要成分的含量可能达不到99.9%,这时就不能用作基准物质。一些常用的基准物质及其应用范围列于表2.1中。表2.1 常用基准物质的干燥条件和应用基准物质干燥后的组成干燥条件℃标定对象名称化学式碳酸氢钠NaHCO3Na2CO3270─300酸十水合碳酸钠Na2CO3·10H2ONa2CO3·10H2O270─300酸硼砂Na2B4O7·10H2ONa2B4O7·10H2O放在装有NaCl和蔗糖饱和溶液的密闭器皿中酸二水合草酸H2C2O4·2H2OH2C2O4·2H2O室温空气干燥碱或KMnO4邻苯二甲酸氢钾KHC8H4O4KHC8H4O4110─120碱重铬酸钾K2Cr2O7K2Cr2O7140─150还原剂溴酸钾KBrO3KBrO3130还原剂草酸钠Na2C2O4Na2C2O4130KMnO4碳酸钙CaCO3CaCO3110EDTA锌ZnZn室温干燥器中保存EDTA氯化钠NaClNaCl500─600AgNO3硝酸银AgNO3AgNO3220─250氯化物1.2 间接配制法(标定法)需要用来配制标准溶液的许多试剂不能完全符合上述基准物质必备的条件,例如:NaOH极易吸收空气中的二氧化碳和水分,纯度不高;市售盐酸中HCl的准确含量难以确定,且易挥发;KMnO4和Na2S2O3等均不易提纯,且见光分解,在空气中不稳定等。因此这类试剂不能用直接法配制标准溶液,只能用间接法配制,即先配制成接近于所需浓度的溶液,然后用基准物质(或另一种物质的标准溶液)来测定其准确浓度。这种确定其准确浓度的操作称为标定。例如欲配制0.1mol.L-1HCl标准溶液,先用一定量的浓HCl加水稀释,配制成浓度约为0.1mol?L-1的稀溶液,然后用该溶液滴定经准确称量的无水Na2CO3 基准物质,直至两者定量反应完全,再根据滴定中消耗HCl溶液的体积和无水Na2CO3 的质量,计算出HCl溶液的准确浓度。大多数标准溶液的准确浓度是通过标定的方法确定的。在常量组分的测定中,标准溶液的浓度大致范围为0.01 mol.L-1至1 mol.L-1,通常根据待测组分含量的高低来选择标准溶液浓度的大小。为了提高标定的准确度,标定时应注意以下几点:⑴ 标定应平行测定3- 4次,至少重复三次,并要求测定结果的相对偏差不大于0.2% 。⑵ 为了减少测量误差 ,称取基准物质的量不应太少,最少应称取0.2g以上;同样滴定到终点时消耗标准溶液的体积也不能太小,最好在于20mL以上。⑶ 配制和标定溶液时使用的量器,如滴定管 ,容量瓶和移液管 等,在必要时应校正其体积,并考虑温度的影响。⑷ 标定好的标准溶液应该妥善保存,避免因水分蒸发而使溶液浓度发生变化;有些不够稳定,如见光易分解的AgNO3和 KMnO4等标准溶液应贮存于棕色瓶中,并置于暗处保存;能吸收空气中二氧化碳并对玻璃有腐蚀作用的强碱溶液,最好装在塑料瓶 中,并在瓶口处装一碱石灰管,以吸收空气中的二氧化碳和水。对不稳定的标准溶液,久置后,在使用前还需重新标定其浓度。2 标准溶液浓度表示方法2.1 物质的量浓度(c,简称浓度)物质的量浓度是指单位体积溶液中含溶质B的物质的量,以符号cB表示。即cB =nB /VB (2.1)因 nB = mB/MB (2.2)所以 mB=cBVBMB (2.3)式 (2-1)中,B代表溶质的化学式,nB为溶质B的物质的量,它的SI单位是mol,VB表示溶液的体积,其SI单位是m3;所以物质的量浓度cB的SI单位是mol.m-3,在分析化学中常用的单位为mol.L-1或mol.dm-3 。在式(2-2)中,mB是物质B的质量,常用单位
关于做涂料有害物质的一些疑问各位大侠,小弟刚接触气相,对于做室内环境涂料有害物分析这一块所用内标法需要配置标准物质溶液,请问各位对于配置好的标准物质混合溶液的保存有什么好的方法吗?用什么盛放?怎么才能有良好的密封?PS:前几次做都是每次临时配置的标物混合溶液,这样不但对色谱纯的标准物质浪费大,而且每次都需要临时配置也很繁琐。
下列物质中,能用NaOH标准滴定溶液直接滴定的是( )。 (A)苯酚(B)Na2HPO4 (C)邻苯二甲酸氢钾 (D)NH4HCO3
[color=#444444]应用安捷伦1260高效液相色谱(荧光检测器)测定计量院给的硫酸奎宁高氯酸溶液标准物质,流动相选用的85%甲醇水溶液,流速1.0ml/min,激发波长为345nm,发射波长为455nm,为什么检测不到信号呢?[/color]
买8大重金属标准溶液,国家标准物质中心的,销售商说介质是不可以改变的,固定的,所以出现有的元素是盐酸,硝酸还有硫酸作为介质。后来买美国进口的,他们的标准溶液可以统一介质的,究竟为什么呢?是我们国产的技术问题还是根本就可以改变介质的
谁了解 GBW(E)080228 二氧化硫(水溶液)成分分析标准物质 20ml/瓶 ”产品,是二氧化硫气体溶解于水的产品吗?产品中除了有二氧化硫、水以外,是否还有其他成分?
各位伙伴们,有谁知道GBW08630硫化物溶液标准物质标称值是多少?
海洋沉积物中含有大量的生物硅,成分为无定性的二氧化硅(SiO2),现用碳酸钠提取其中的生物硅,使其转化为硅酸钠溶液,然后应用ICP-OES测试该溶液中的Si,因此我需要购买能用作硅的标准溶液或标准物质,最好是硅酸钠标准物质或溶液,或者硅酸盐标准溶液,但其中要求主要阳离子为钠离子(Na+)。 那位大哥知道用什么标准物质或溶液?可站内联系与我联系:zhfxiong@163.com. 谢谢!
购买了计量科学研究院的水中甲醛溶液标准物质(BW3450),证书上特性量值栏给出的标准值是11.0mg/mL,包装栏写的是本标准物质采用玻璃安瓿瓶包装,2mL/支。请教大家一下,我想配制一定浓度的甲醛标准溶液,有2种方案,方案一是:将标液物质在室温下平衡,然后打开安瓿瓶,用已经检定的移液管或是[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url][/color][/url]移取,在确保准确吸取的条件下尽量多吸取一定体积的V(mL),记下该体积,转移到容量瓶中,比如是检定合格的25mL棕色容量瓶,加水稀释定容,计算甲醛的溶液浓度=(11.0mg/mL*VmL)/25mL即得。方案二:将标液物质在室温下平衡,然后打开安瓿瓶,将安瓿瓶中的甲醛标准溶液全部转移到检定合格的25mL棕色容量瓶,用少量水洗涤安瓿瓶5次以上,将每次洗涤的溶液也转移到容量瓶中,加水稀释,定容至刻度,计算甲醛溶液浓度=(11.0mg/mL*2mL)/25mL即可。请问大家觉得那种方法正确??平时大家是怎么配制的?另外我发现证书上特性量值栏(和标明的标准值11.0mg/mL同一栏)相对扩展不确定度(%)(K=2)为3,这个不确定度应该是浓度的不确定度吧,没有包括2mL体积在内吧? 既然不包括2mL这个体积在内,那么配制标液的时候我觉得还是用第一种方案好。以第一种方案可以用移液管引入的不确定度、甲醛标准溶液物质的不确定度和容量瓶等引入的不确定度合成最后配制成甲醛标液的不确定度~~~~
帮帮我吧!淀粉中总氮含量的测定计算公式的问题2NH3+4H3BO3=(NH4)2B4O7+5H2O如果用硫酸滴定:(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3 盐酸滴定: (NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3GB22427.10-2008中是用硫酸标准溶液滴定的,计算公式如下: 1.401×c×(V1-V0) X= -------------------------------------- m X表示样品氮含量(g/100g)c表示标准硫酸溶液浓度,单位为(mol/L)V1表示样品测定耗用硫酸标准溶液的体积(ml)V0表示空白测定耗用硫酸标准溶液的体积(ml)m表示样品的质量(g)我对这个公式的疑问是,我觉得应该在分子上乘以2才对。因为从化学式中可以看出消耗1mol的硫酸可以平衡2mol的N。如果是用盐酸滴定的话,就不用乘以2了,因为1mol盐酸平衡1mol的N。我觉得应该是我错了,因为这标准用了这么多年,但是我不知道错在哪里?!
[align=center][color=#333333][b][size=24px]标准滴定溶液配制与标定的要求与注意事项[/size][/b][/color][/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]化工室:魏巧娟[/align][color=#333333]标准溶液在化学分析试验中具有举足轻重的作用,化学试剂的正确性和准确度直接影响着检验的最终结果,所以正确制备标准滴定溶液就显得尤为重要。标准溶液在滴定分析中常用作滴定剂。在其他的分析方法中用标准溶液绘制工作曲线或作计算标准。配制方法有两种,一种是直接法,即准确称量基准物质,溶解后定容至一定体积;另一种是标定法,即先配制成近似需要的浓度,再用基准物质或用标准溶液来进行标定。已知准确浓度的溶液,在容量分析中用作滴定剂,以滴定被测物质。如果试剂符合基准物质的要求 (组成与化学式相符、纯度高、稳定),可以直接配制标准溶液,即准确称出适量的基准物质,溶解后配制在一定体积的容量瓶内。可由下式计算应称取的基准物质的重量W:W=ΜV基准物质的摩尔质量。式中Μ和V分别为所需配制的溶液的摩尔浓度和体积。利用上式可计算出标准溶液的浓度。如果试剂不符合基准物质的要求,则先配成近似于所需浓度的溶液,然后再用基准物质准确地测定其浓度,这个过程称为溶液的标定。[/color][color=#333333]然而在其制备与标定过程中却有很多方面容易被忽视。其中GB/T 601-2016《化学试剂 标准滴定溶液的制备》标准中明确规定了标准滴定溶液在配制与标定时的要求要注意以下方面:[/color][color=#333333]除另有规定外,实验室用水应符合6682中三级水的规格。[/color][color=#333333]制备标准溶液的浓度,除高氯酸外,均指20℃的浓度。在标准滴定溶液的标定、直接制备和使用时若有温度差异,应按附录A进行补正。标准滴定溶液的标定、直接制备和使用时所用分析天平、砝码、滴定管、容量瓶、单标吸管等均须定期校正。[/color][color=#333333]3.在标定和使用标准滴定溶液时,滴定速度一般应保持在6 mL/min~8mL/min。[/color][color=#333333]4.称量工作基准试剂的质量数值小于等于0.5g时,按精确至0.01mg称量,数值大于0.5g时按精确至0.1mg称量。[/color][color=#333333]5.制备标准滴定浓度值应在规定浓度值的士5%的范围内。[/color][color=#333333]6.标定标准滴定溶液浓度时,须应两入进行实验,分别各做四平行,每人四平行测定结果极差的相对值不得大于0.15%,两人共八平行测定结果极差的相对值不得大于0.18%。取八平行测定结果的平均值为测定结果。在运算过程式中保留五位有效数字,浓度值报出结果取四位有效数字。[/color][color=#333333]7.本标准中标准滴定溶液浓度平均值的扩展不确定度一般不应大标准滴定溶液的浓度小于等于0.02moL时,应于临用前将浓度高的标准滴定溶液用煮沸并冷至却的水稀释,必要时重新标。[/color][color=#333333]同时在配制不同性质的不同标准滴定溶液在配制过程、贮存、标签的填写等也要注意以下方面:[/color][color=#333333]溶液要用带塞的试剂瓶盛装 见光易分解的溶液要装于棕色瓶中 挥发性试剂(如,有机试剂)配制的溶液,瓶塞要严密 见空气易变质及放出腐蚀性气体的溶液也要盖紧,长期存放要用蜡封住 浓碱溶液应用塑料瓶装,如装在玻璃瓶中,要用橡皮塞塞紧,不能用玻璃磨口塞。[/color][color=#333333]2.每瓶试剂瓶必须有标明名称、规格、浓度和配制日期的标签。[/color][color=#333333]3.配制硫酸、磷酸、硝酸、盐酸等溶液时,都应把酸倒入水中。对于溶解时放热较多的试剂,不可在试剂瓶中配制,以免炸裂。配制硫酸溶液时,应将浓硫酸分为小份慢慢倒入水中,边加边搅拌,必要时以冷水冷却烧杯外壁。[/color][color=#333333]4.有机溶剂配制溶液(如,配制指示剂溶液时),有时有机物溶解较慢,应不时搅拌,可以再热水浴中温热溶液,不可以直接加热,易燃溶剂使用时要远离明火。几乎所有的有机溶剂都有毒,应在通风柜内操作。应避免有机溶剂不必要的蒸发,烧杯应加盖。[/color][color=#333333]5.要熟悉一些常用溶液的配制方法。如碘溶液应将碘溶于较浓的KI水溶液中,才可稀释。配制易水解的盐类的水溶液应先加酸溶解后,再以一定浓度的稀酸稀释,如,配制SnCl[/color][size=undefined][color=#333333]2[/color][/size][color=#333333]溶液时,如果操作不当已发生水解,加相当多的酸仍难溶解沉淀。[/color][color=#333333]6.标准溶液不能用手接触腐蚀性及有剧毒的溶液。剧毒废液应作解毒处理,不可直接倒入下水道。[/color][color=#333333]实验室应该专人进行配制与标定溶液,同时及时填写配制与标定记录,标准溶液的有效期除另有规定外,一般标准贮备液为六个月,浊度标准贮备液,在冷处避光保存条件下,可在两个月内使用,用前摇匀,超过期限的标准溶液应重新配制。所使用的标准溶液应按规定浓度,临用前用贮备液稀释而得。标准溶液应由专人管理,统一分发。[/color][color=#333333]领发双方核对品名、批号、浓度、配制日期、使用期和标签后,在标准溶液领发记录上签字。如样品不符合规定或在限度边缘时,应重新配制标准溶液再进行复查。使用过程中发现标准溶液岀现混浊、沉淀等异常情况或超过使用期限的,应立即停用。[/color]
硫代硫酸钠标准滴定溶液的标定,用硫代硫酸钠标准滴定溶液测定食盐中碘离子含量。有谁做过啊?怎么做有那些标准参考?做的过程中要注意那些事项.如果有的发一份给我谢谢:308775746@qq.com
请教各位“标准液、标准溶液、滴定液”的区别?我一直拎不清它们的关系。事先搜索了一下帖子,没找到相关内容!1.标准溶液是不是指譬如氯化物检查法中的标准氯化钠溶液、硫酸盐检查法中的标准硫酸钾溶液等等?2.在网站上曾查到一篇分析化学讲义,里面说“标准液是已知浓度的滴定液”,是这样子的吗?
[align=center][b]标准溶液的分类及管理介绍[/b][/align]1[b]标准溶液的分类[/b]当我们以化学分析法或仪器分析法进行分析测定时,往往需要配置标准溶液。标准溶液就是已知其主体成分或其他特性量值的溶液。按照用途的不同,又分为滴定分析用标准溶液、杂质测定用标准溶液和pH测量用标准溶液。[b]1、标准滴定溶液[/b]滴定分析用标准溶液主要用于测定试样中主体成分或常量成分,有两种配制方法:一是用一级或二级标准物质(又称“基准试剂”)直接配制;二是用分析纯以上规格的试剂配成接近所需浓度的溶液,再用标准物质进行测定(称为“标定”)。GB601-88《滴定分析用标准溶液的制备》是我国唯一的标准方法。标准滴定溶液用物质的量浓度表示,符号为c(B),单位为molL-1,意指每升溶液中含有的滴定剂B为基本单元的物质的量(mol)。例如,某硫酸标准滴定溶液浓度为c(1/2H2SO4)=0.1000molL-1,又如,c(1/5KMnO4)=0.1021molL-1。[b]2、杂质测定用标准溶液[/b]杂质测定用标准溶液又称仪器分析用标准溶液,GB602-88《杂质测定用标准溶液的制备》给出了83种杂质标准溶液的制备方法。该种溶液所含的元素、离子、化合物或基团的量,以每毫升含有多少毫克表示。该标准规定的多数标准溶液浓度为0.1mgmL-1,少数是1mgmL-1,仅一种是10mgmL-1。规定浓度下溶液比较稳定,可称为贮备液,当需要使用更低浓度时可按要求稀释,制成标准系列溶液。[b]3、pH测量用标准溶液[/b]当用pH计测量溶液的酸度时,必须先用pH标准溶液对pH计进行校准。[align=left]2[b]标准溶液的管理[/b][/align]1、标准溶液的制备和标定、使用管理,由检验室设专人负责。2、标准溶液的制备必须严格按GB/T601-2002滴定分析(容量分析)用标准溶液的制备规定进行,专人配制和标定,且不得少于两人,标定时应详细记录标定过程。3、标准溶液实行标志管理,制备好的标准溶液应在标签上注明名称、浓度、基准物质名称、配制人、配制日期、标定人、标定日期、保存时间,并合理放置,由专人妥善保管。4、标准溶液的配制人和标定人要填写“标准溶液的制备与标定原始记录”。配制好的标准溶液由室主任批准后,方可使用。5、标准溶液在检验室内应单独放置,并保证室内环境条件符合要求;标定好的标准溶液在常温下的保存时间不得超过两个月;超过期限的标准溶液由配制人员重新标定,作好相应的记录和标签。6、检验人员使用标准溶液发现异常时,应及时向室主任反映,做好相应处理。转载于《分析测试百科网》
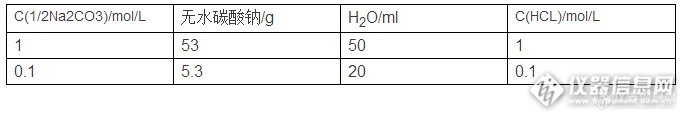
标准溶液是援引美国加联数据库定义已知准确浓度的溶液。在滴定分析中常用作滴定剂。在其他的分析方法中用标准溶液绘制工作曲线或作计算标准。如果试剂符合基准物质的要求 (组成与化学式相符、纯度高、稳定),可以直接配制标准溶液,即准确称出适量的基准物质,溶解后配制在一定体积的容量瓶内。如果试剂不符合基准物质的要求,则先配成近似于所需浓度的溶液,然后再用基准物质准确地测定其浓度,这个过程称为溶液的标定。标准溶液的配制方法直接配制法:用基准物质(如K2Cr2O7)来直接配制标准溶液。因为这些基准物质能够符合基准物质条件,容易得到。此法溶液浓度由计算而得,浓度不必标定。间接配制法:不能得到符合基准物条件的物质(如NaOH 、HCl ),先配制近似浓度的标准溶液,再用基准物质或另一种已知浓度的标准溶液来标定它的浓度。这种配制方法比较费事,但大多数标准溶液都是这样配制的。溴酸钾标准溶液的配制与标定配制:c(1/6KBrO3)=0.1mol/l称取3g溴酸钾,溶于1000ml水中,摇匀标定方法及计算同溴标准溶液的标定及计算碘标准溶液的配制与标定配制:c(1/2I2)=0.1mol/l称取13g碘及25g碘化钾,溶于100ml水中,稀释至1000ml,摇匀,保存于棕色具塞瓶中。标定:称取0.15g预先在硫酸干燥器中干燥至恒重的基准三氧化二砷,称准至0.0001g。置于碘量瓶中,加4ml氢氧化钠溶液溶解,加50ml水,加2滴酚酞指示剂,用硫酸溶液中和,加3g碳酸氢钠及3ml5g/l淀粉指示剂,用配好的碘溶液c(1/2I2)=0.1mol/l滴定至溶液呈浅蓝色。同时作空白试验。硫酸标准溶液配制与标定配制:量取规定体积的硫酸,缓缓注入1000mL水中,冷却,摇匀。http://ng1.17img.cn/bbsfiles/images/2015/12/201512091856_577092_2961690_3.jpg标定:称取上述规定定量的于270-300℃灼烧至恒重的基准无水碳酸钠,称准至0.0001g。溶于50ml水中,加10滴溴甲酚绿-甲基红混合指示剂,用配好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同样做空白试验,计算:C(1/2H2SO4)=m/V1--------硫酸之用量,mlV2--------空白试验硫酸之用量,ml0.05299-------于1.0000ml硫酸标准溶液相当的以克表示的无水碳酸钠的质量比较方法:量取30.00-35.00ml上述规定浓度的氢氧化钠标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。计算:C(1/2H2SO4)=v1*c1/vV1--------氢氧化钠标准溶液之用量,mlV----------硫酸之用量,mlC1----------氢氧化钠标准溶液之物质的量浓度,mol/l氢氧化钠标准溶液的配制与标定配制:称取100g氢氧化钠,溶于100ml水中,摇匀,注入聚乙烯容器,密闭放置至溶液清亮,用塑料管虹吸下述规定体积的上层清液,注入1000ml无二氧化碳的水中,摇匀,http://ng1.17img.cn/bbsfiles/images/2015/12/201512091856_577093_2961690_3.jpg标定:称取上述规定的量于105-110℃烘至恒重的基准邻苯二甲酸氢钾,称准至0.0001g。溶于上述规定体积的无二氧化碳的水中,加2滴酚酞指示剂(10g/l),用配好的氢氧化钠溶液滴定至粉红色,同样作空白试验,计算:C(NaOH)=m/V0------空白试验氢氧化钠溶液之用量,mlV1------氢氧化钠溶液之用量,ml0.2042-----于1.00ml氢氧化钠标准溶液相当的以克表示的邻苯二甲酸氢钾的质量比较方法:量取30.00-35.00ml上述规定浓度的盐酸标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。计算:C(NaOH)=v1*c1/vV1--------盐酸标准溶液之用量,mlV----------氢氧化钠溶液之用量,mlC1----------盐酸标准溶液之物质的量浓度,mol/l盐酸标准溶液的配制与标定配制:量取下述规定体积的盐酸,注入1000ml水中,摇匀http://ng1.17img.cn/bbsfiles/images/2015/12/201512091857_577094_2961690_3.jpg标定:称取上述规定定量的于270-300℃灼烧至恒重的基准无水碳酸钠,称准至0.0001g。溶于50ml水中,加10滴溴甲酚绿-甲基红混合指示剂,用配好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同样做空白试验,计算:C(HCL)=m/V1--------盐酸之用量,mlV2--------空白试验盐酸之用量,ml0.05299-------于1.0000ml盐酸标准溶液相当的以克表示的无水碳酸钠的质量比较方法:量取30.00-35.00ml上述规定浓度的氢氧化钠标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。计算:C(NaOH)=v1*c1/vV1--------氢氧化钠标准溶液之用量,mlV----------盐酸溶液之用量,mlC1--------氢氧化钠标准溶液之物质的量浓度,mol/l碳酸钠标准溶液的配制与标定配制:称取下述规定量的无水碳酸钠溶于1000ml水中,摇匀http://ng1.17img.cn/bbsfiles/images/2015/12/201512091904_577095_2961690_3.jpg标定:量取30.00-35.00ml上述配好的碳酸钠溶液,加上述规定量的水,加10滴溴甲酚绿-甲基红混合指示剂,用上规定浓度的盐酸标准溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。、计算:C(1/2Na2CO3)=v1*c1/vV1--------盐酸标准溶液之用量,mlV----------碳酸钠溶液之用量,mlC1--------盐酸标准溶液之物质的量浓度,mol/l重铬酸钾标准溶液的配制与标定配制:C(1/6K2Cr2O7)=0.1mol/l称取5g重铬酸钾,溶于1000ml水中,摇匀标定:量取30.00-35.00ml配制好的重铬酸钾溶液,置于碘量瓶中,加2g碘化钾及20ml20%硫酸溶液,摇匀,于暗处放置10min。加150ml水,用硫代硫酸钠标准溶液滴定,近终点时加3ml淀粉指示剂(5g/l),继续滴定至溶液由蓝色变为亮绿色。同时作空白试验。计算:C(1/6K2Cr2O7)=(V1
滴定分析中硫代硫酸钠标准溶液用棕色滴定管还是用白色滴定管?
[font=宋体]1. [/font][font=宋体]标准溶液[/font] [font=宋体]可以追溯基质的为标准溶液,一般经过权威机构认证的;[/font] [font=宋体][font=宋体]标准溶液一般是被测物质和纯水配制而成,我们一般用标准溶液作标准做标准曲线。做出一条有斜率、截距和[/font][font=Times New Roman]r[/font][font=宋体]>[/font][font=Times New Roman]0.999[/font][font=宋体]的标准曲线后,可以初步判断仪器对被测物质响应。[/font][/font] [font=宋体]2. [/font][font=宋体]标准品[/font] [font=宋体]标准品内含基质,经过权威机构认证的;[/font] [font=宋体]标准品一般为粉、剂和液体等,像奶样一般会做成冻干粉,液体奶样可能会脂肪上浮,里面的物质不均匀;我们用标准品来测定仪器的准确性。标准品不用稀释,直接取样测量。[/font] [font=宋体]3. [/font][font=宋体]质控品[/font] [font=宋体]质控品是我们用另外一个我们认为准的仪器测出的有值的样品,非权威机构认证。[/font] [font=宋体]在绘制完标准曲线后,进行标准品测定,但是标准品很贵,我们可以选择用质控品去测量;[/font] [font=宋体]4. [/font][font=宋体]样品[/font] [font=宋体]在完成标准品(或者质控品)测量后,开始测量样品。[/font] [font=宋体]在完整的仪器验证过程中,第一步就是先绘制标准曲线,第二步用质控品测量,第三步就去测加标回收率。[/font] [font=宋体][font=宋体]就算加标回收率是[/font][font=Times New Roman]100%[/font][font=宋体],在样品实际测量中也会有差别。在加标回收实验中,加标倍数一般是样品测定值的[/font][font=Times New Roman]0.5-2[/font][font=宋体]倍,取的样品测定值要在整个标准曲线中间,这样我们测出的加标回收率才会准确。[/font][/font] [font=宋体]培训总结[/font] [font=宋体]标准溶液和标准品的区别在于标准溶液是被测组分和纯水这两种物质;标准品是含基质的、有值的被测组分组成。[/font]
我现在在做某物质的[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]残留溶剂,标准规定乙酸丁酯≤1000ppm,我配置对照品溶液时可以配置的比标准规定的低吗(比如对照品溶液配成500ppm)?样品中乙酸丁酯的残留大概是80ppm
问个比较弱智的问题哈:买回来的磷标准溶液,我看都是用水作为基体的,是不是磷在水介质里才是稳定的?请问磷的标准溶液能否用硝酸或盐酸作为基体呢?什么原因呢?希望有人帮我解答一下,非常感谢!
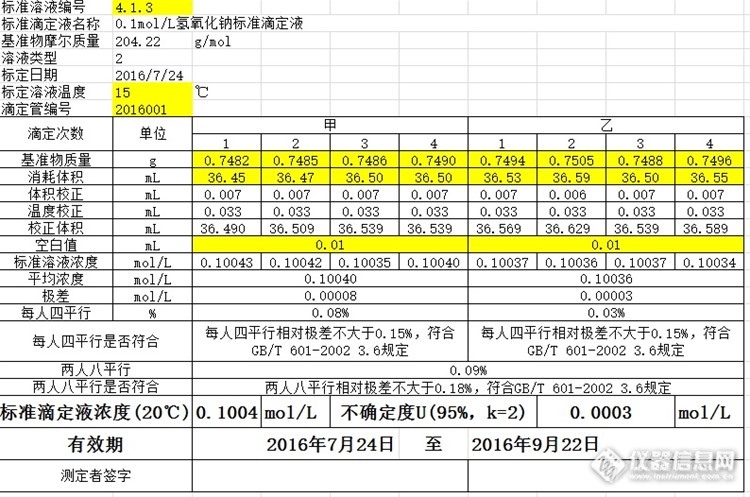
1 引子滴定分析是分析化学的基础实验,其中包括称量、溶解、定容、转移、稀释、过滤等操作。可以这样说,如果没有好的滴定操作基础,就不可能操作好仪器分析。滴定分析应参考《化学试剂 标准滴定溶液的制备》GB/T 601-2002。传统的计算过程使用白纸、科学计算器,每一种标准滴定溶液分别有不同的计算表格,记录和数据处理费时费力,而且如果操作者不熟练非常容易出现错误。如果还要考虑标定过程的不确定度,计算A类不确定度、B类不确定度和合成不确定度,估计大部分的老师傅也会犯晕。因此,我冒出了这样的一个想法:“这都是信息化时代了,电脑、手机等软件非常普及,可不可以开发一个Excel计算模板,涵盖所有的标准滴定溶液标定记录计算呢?“于是便有了这个”万能Excel模板——标准滴定溶液标定记录计算“。简化计算,让工作高效起来!2 模板建立过程2.1 建立“标准滴定溶液数据库”标准滴定溶液数据库包括《化学试剂 标准滴定溶液的制备》GB/T 601-2002中所有使用基准物质标定的标准滴定溶液。同时,定义各种标准溶液的溶液类型,该编号与“溶液温度补正值数据库”关联。该数据库还包括各自标准滴定溶液使用基准物质的摩尔质量、摩尔质量不确定度、基准物质纯度不确定度。摩尔质量不确定度来源于IUPAC 2013相对原子量计算所得。基准物纯度不确定度分别根据各基准物质的国家标准标示含量范围值。完成后如下: 编号标准溶液名称基准物摩尔质量 g/mol溶液类型摩尔质量不确定度U(95%,k=2)基准物纯度不确定度U(95%,k=2)4.1.11mol/L氢氧化钠标准滴定液204.2260.0040%0.03%4.1.20.5mol/L氢氧化钠标准滴定液204.2250.0040%0.03%4.1.30.1mol/L氢氧化钠标准滴定液204.2220.0040%0.03%4.2.11mol/L盐酸标准滴定液52.99440.0014%0.05%4.2.20.5mol/L盐酸标准滴定液52.99430.0014%0.05%4.2.30.1mol/L盐酸标准滴定液52.99420.0014%0.05%4.3.11mol/L硫酸标准滴定液52.99460.0014%0.05%4.3.20.5mol/L硫酸标准滴定液52.99450.0014%0.05%4.3.30.1mol/L硫酸标准滴定液52.99420.0014%0.05%4.6.10.1mol/L硫代硫酸钠标准滴定溶液49.03120.0010%0.02%4.7.10.1mol/L碘标准滴定溶液49.46020.0006%0.05%4.12.10.1mol/L高锰酸钾标准滴定溶液66.99920.0019%0.05%4.14.10.1mol/L硫酸铈标准滴定溶液66.99920.0019%0.05%4.15.10.1mol/LEDTA标准滴定液81.37920.0246%0.05%4.15.20.05mol/LEDTA标准滴定液81.37910.0246%0.05%4.15.30.01mol/LEDTA标准滴定液81.37910.0246%0.05%4.21.10.1mol/L硝酸银标准滴定液58.44120.0094%0.05%4.22.10.5mol/L亚硝酸钠标准滴定液173.1930.0061%0.10%4.22.20.1mol/L亚硝酸钠标准滴定液173.1920.0061%0.10%4.23.10.1mol/L高氯酸标准滴定液204.2290.0040%0.03%4.24.10.1mol/L氢氧化钾乙醇标准滴定液204.2280.0040%0.03%备注:1)本表格包含GB/T 601-2002使用基准物质标定的标准滴定溶液。2)摩尔质量不确定度来源于IUPAC 2013相对原子量计算所得。3)基准物纯度不确定度分别根据各基准物质的国家标准标示含量范围值。2.2 建立“溶液温度补正值数据库”本数据库来源于GB/T 601-2002,顺序一样,只不过对溶液进行编号,该编号与“标准滴定溶液数据库”关联。如下: 溶液类型123456789温度: ℃水及0.05mol/L以下的各种水溶液0.1mol/L及0.2mol/L各种水溶液盐酸溶液0.5mol/L盐酸溶液1mol/L硫酸0.5mol/L 氢氧化钠溶液0.5mol/L硫酸1mol/L 氢氧化钠溶液1mol/L碳酸钠溶液1mol/L氢氧化钾乙醇液0.1mol/L0.1mol/L高氯酸标准滴定液51.381.701.902.302.403.603.3016.7861.381.701.902.202.303.403.2015.6471.361.601.802.202.203.203.0014.518[td
NaOH标准溶液的标定一、基本操作1.碱式滴定管的使用 a.包括使用前的准备:试漏、清洗b.标准溶液的装入:润洗、标准液的装入、排气泡、调节液面、记录初读数。c.滴定管的读数:2.滴定操作:左的拇指在前、食指在后,其余三指夹住出口管。用拇指与食指的指尖捏挤玻璃珠周围右侧的乳胶管,溶液即可流出。半滴的滴法二、标定实验(采用邻苯二甲酸氢钾KHC8H4O4为基准物进行标定)一)实验原理 NaOH溶液采用间接配制法配制,采用基准物质进行标定。常用标定NaOH溶液的基准物有:邻苯二甲酸氢钾(KHP)、草酸。本实验采用邻苯二甲酸氢钾(KHP)作为基准物质标定NaOH溶液。其标定反应为:KHP + NaOH = KNaP + H2O反应产物KHP为二元弱碱,在溶液中显弱碱性,可选用酚酞作指示剂。滴定终点颜色变化:无 微红(半分钟不褪色)二)实验步骤准确称取邻苯二甲酸氢钾0.4~0.5g于锥形瓶中,加20-30mL水,温热使之溶解,冷却后加1-2滴酚酞,用0.10mol·L-1NaOH溶液滴定至溶液呈微红色,半分钟不褪色,即为终点。平行标定三份。