国家药监局公布《指南》 将严控化妆品中风险物质
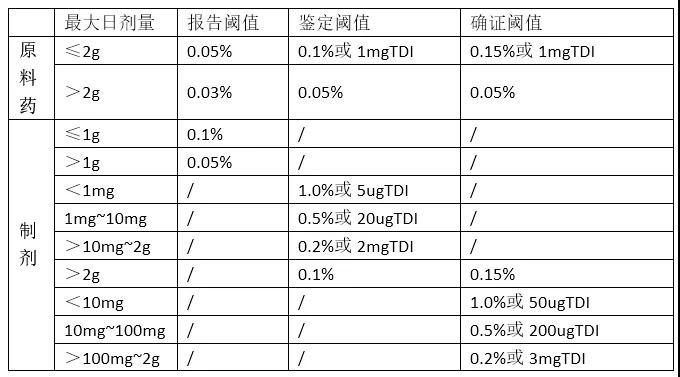
“霸王二噁烷”、“章光101致癌门”等化妆品风波接连发生,为有效控制化妆品中可能存在的安全性问题,日前国家药监局公布了《化妆品中可能存在的安全性风险物质风险评估指南》(以下简称《指南》),其中要求,要明确该安全性风险物质对人体健康造成危害的概率及范围。专家分析,该指南从技术上要求企业在安全性风险物质评估中,提供更多更明确的证明资料,以进一步保障消费使用者的健康安全。 明确安全值范围 《指南》指出,化妆品中可能存在的安全性风险物质是指由化妆品原料带入、生产过程中产生或带入的,可能对人体健康造成潜在危害的物质。例如二噁烷作为杂质可被带入化妆品中,如果过量,可对健康造成潜在危害。 “霸王”洗发水风波中,国家药监局公布,日常消费品中(食品和药品除外),二噁烷在30ppm的理想限值范围内不会危害健康,《指南》也对这样的安全值范围标示进行了明确。在可能有安全性风险物质的风险特征描述中《指南》要求,要对具有阈值(也就是“临界值”)的物质,计算安全边际 对于没有阈值的物质(如无阈值的致癌物),应确定暴露量与实际安全剂量之间的差异。关于毒理学相关资料,《指南》要求明确,配方中含有植物来源原料的,应当说明可能含有农药残留的情况。 风险评估包括婴幼儿、孕妇 《指南》在风险评估基本程序中指出,一般可通过申报化妆品的产品类型和使用方法,结合化妆品中可能存在的安全性风险物质的含量或检出量,在充分考虑可能的化妆品使用人群(包括特殊人群,如婴幼儿、孕妇等)的基础上,定性和定量评价化妆品中可能存在的安全性风险物质对人体可能的暴露剂量。 此外,分析评价该物质的毒性反应与暴露之间的关系时,对有阈值的化学物质,确定“未观察到有害作用的剂量水平(NOAEL)”或“观察到有害作用的最低剂量水平(LOAEL)”。对于无阈值的致癌物,可根据试验数据用合适的剂量反应关系外推模型来确定该物质的实际安全剂量(VSD)。 专家:规定过于细化难操作,企业要自律 “霸王”风波中,不少媒体大众质疑,二噁烷这个被美国列为致癌物质的毒物,为何没在我国的任何一部化妆品相关法律法规中做出限量标准,国家药监局在澄清“霸王”产品二噁烷含量是否在安全范围内时,还需借用美国、澳大利亚的限量标准做评估。与此同时,对3月已出征求意见稿的《化妆品中可能存在安全性风险物质的评审原则》,何时可正式公布充满期待。 原卫生部化妆品卫生标准委员会委员、华南师范大学教授裘炳毅告诉记者,此次《指南》的公布有利于百姓消费安全,但大家也要了解,对于化妆品中可能存在安全性风险物质评估的规范,规定太细致太具体,有难度。光化妆品禁用物质就有1000多种,再添加风险物质,检测技术难实现。而且按照国家有关法规,日化产品能上市,首要条件是安全,其次是产品作用。在此情况下,除了政府进一步完善监管制度,企业也要加强自律。