我配制的恩诺沙星标准溶液,荧光检测器分析后总出现环丙沙星的峰,是买的标准品不纯(Dr公司)还是我配制时有污染,请老师指教。

2010 版中国药典 VIII R 规定TOC分析仪是要定期进行系统适用性测试,GE为客户提供即开即用的液体系统适用性标准品,省心省力。8月15日-9月15日,GE携全国代理商惠馈客户,优惠活动如下:如果了解更多有关TOC的系统适用性测试知识,可以点击此处http://ng1.17img.cn/bbsfiles/images/2012/08/201208221014_385307_2359237_3.jpg
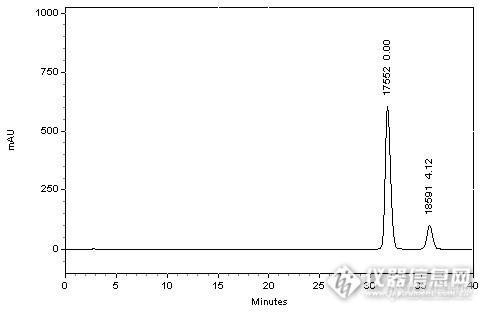
http://ng1.17img.cn/bbsfiles/images/2014/09/201409171441_514220_2222981_3.jpg*注:峰上标由下至上依次为理论塔板数和分离度。 HPLC Conditions :色谱柱:CAPCELL PAK C18 MGII S5; 4.6mm i.d.×250mm 流动相:三乙胺磷酸溶液【三乙胺溶液(1→100),用磷酸调节pH至4.3】/乙腈=87/13流速: 1000µL / min温度: 30°C检测: UV 325nm进样量: 10 µL分析结果与讨论 本实验依据国家标准分离加替沙星与N-甲基加替沙星,实验中分别尝试了不同规格的CAPCELL PAK C18 系列MG、MGII、AQ色谱柱,发现MGII色谱柱可得到最好分离结果。实验结果如上图所示,使用MGII色谱柱进行分析时,加替沙星峰理论塔板数达到17552,且加替沙星与N-甲基加替沙星峰分离度为4.12,已达到2013年所起草国家标准征求意见稿的分离度大于4的要求。
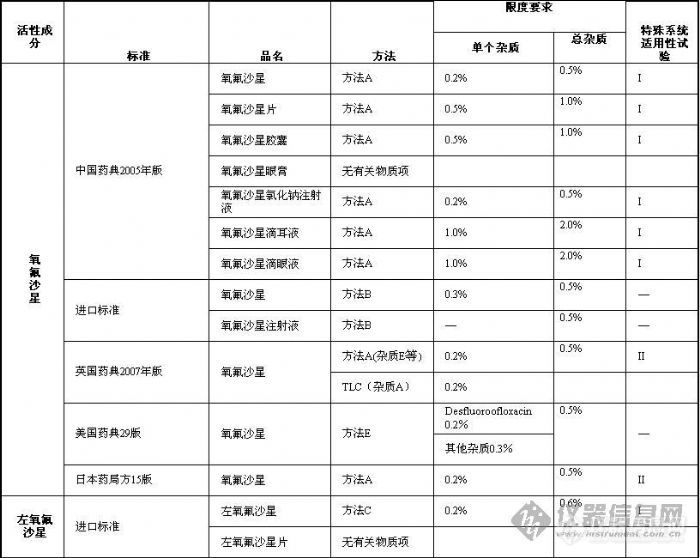
作者 张立雯 成海平 正文内容 【摘要】本文总结了国家标准中氧氟沙星、左氧氟沙星、盐酸左氧氟沙星、乳酸左氧氟沙星、甲磺酸左氧氟沙星系列药物的有关物质控制方法,分析了该类药物注册申报中有关物质控制存在的问题,希望能为研发者提供帮助。 【关键词】氧氟沙星、左氧氟沙星、有关物质一、概况 氧氟沙星(Ofloxacin)为合成的第三代广谱氟喹诺酮类抗菌药,对大多数革兰氏阳性菌和革兰氏阴性菌均有明显的抑制作用。临床上主要用于敏感菌所致的呼吸系统感染、泌尿生殖系统感染。氧氟沙星由日本第一制药株式会社研发,于1985年在日本、德国上市,制剂为口服片剂、注射剂等。目前国内已上市的氧氟沙星制剂有片剂、胶囊剂、颗粒剂、缓释制剂、小针、葡萄糖注射液和氯化钠注射液等。 左氧氟沙星(Levofloxacin)为氧氟沙星的左旋体,具有抗菌谱广、抗菌作用强的特点。日本第一制药株式会社于1993年在日本上市销售左氧氟沙星原料及片剂,并现已在英国、美国等多国上市。目前国内上市的左氧氟沙星制剂主要有片剂、小针、葡萄糖注射液和滴眼剂等。另外,国内已批准上市的左氧氟沙星还有其盐酸盐、乳酸盐和甲磺酸盐,三种加酸根的左氧氟沙星均有片剂、胶囊剂、注射制剂等多种剂型上市。二、国家标准中有关物质控制方法比较 氧氟沙星系列药物的有关物质测定国家标准大多采用HPLC法,列表比较见表1。 表1 氧氟沙星系列药物的有关物质测定方法与限度的比较 这些方法有很多相似的地方,如均采用ODS柱,色谱条件与含量测定色谱条件相同,按照主成分自身稀释对照法定量等。但也有一些不同的地方值得关注,作者从以下三个方面来对这些国家标准方法的不同之处进行比较。1、流动相 按照流动相的不同,作者将有关物质测定方法分为六种,具体如下: 方法A:醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH至 2.2)-乙腈(85∶15)为流动相,在294nm下检测; 方法B:略; 方法C:略; 方法D:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至 1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(3∶1)为流动相,在293nm下检测; 方法E:磷酸缓冲溶液(溶解27.2磷酸二氢钾在1000ml水中,用磷酸调节pH至2.4)-乙腈(90∶10)为流动相,在294nm下检测; 方法F:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至 1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(65∶35)为流动相,在230nm下检测。 六种流动相的共同特点是:组成均是酸性缓冲溶液加有机溶剂(甲醇或乙腈)。方法A、B、E未加表面活性剂,方法C、D加有表面活性剂己烷磺酸钠。除方法F在230nm下检测外,其他方法均在294或293nm下检测。2、主要杂质 英国药典收载了氧氟沙星杂质A、B、C、D、E、F共6个已知杂质,依次分别为去哌嗪环、去羧基、去氟、氟取代位置不同、去甲基以及氮氧化的化合物物。英国药典氧氟沙星原料药采用TLC法控制杂质A,采用HPLC法控制其他已知和未知杂质。美国药典重点关注了杂质desfluoroofloxacin,日本药局方重点关注了ofloxacin demethyl substance,均与英国药典的杂质E相同,是氧氟沙星的去甲基化合物,该化合物为氧氟沙星的主要降解产物,光照下极易产生。美国药典给出了desfluoroofloxacin的相应因子为1.13。中国药典没有明确已知杂质,但有关物质检查时采用以下光照降解法进行特殊系统适用性试验,光照试验中产生的杂质即为氧氟沙星、左氧氟沙星的主要杂质。 美国药典中desfluoroofloxacin按加校正因子的主成分自身稀释对照法定量,美国药典氧氟沙星其他杂质和其他国家标准中氧氟沙星或左氧氟沙星所有杂质按不加校正因子的主成分自身稀释对照法定量。有关物质限度的要求详见表1。3、特殊系统适用性试验 氧氟沙星、左氧氟沙星及其盐的含量测定和有关物质检查方法的系统适用性试验除通常的进样精密度、记录时间、理论塔板数等的要求外尚有一项较为特殊的系统适用性试验,其他标准方法采用I法,日本药局方采用II法,详述如下: 特殊系统适用性试验I(光照降解法):取供试品溶液于无色试管中,用日光灯(2500lux或3500lux)或紫外灯(254nm)照射1小时或3小时或4小时,取此液注入液相色谱仪,记录色谱图,相对保留时间约为主峰1.2处应能检测出色谱峰。 特殊系统适用性试验II(杂质对照品法):氧氟沙星和杂质E(ofloxacin impurity E CRS,英国药典)或氧氟沙星的去甲基物(ofloxacin demethyl substance)分离度不得低于2.0或2.5。 由于缺少杂质对照品,国内氧氟沙星系列药物的有关物质测定系统试验常常是采用光照降解法。也正是因为缺少杂质对照品,系统适用性试验才显得尤为重要,是考察系统分离能力的重要指标。 另外,左氧氟沙星及其盐的原料和制剂均需检查右旋异构体,方法基本相同,均是采用硫酸铜-L异亮氨酸溶液-甲醇或硫酸铜-D苯丙氨酸溶液-甲醇为手性流动相检测,限度要求不得过0.8%或1.0%。在此就不详加讨论。三、注册申报中存在问题与探讨1、不重视系统适用性试验 氧氟沙星系列药物的特殊系统适用性试验常常被忽视,其实却非常重要。若不做该项试验,就不能保证所采用的系统能将最难分离的相对保留时间1.2倍的色谱峰分离出来,就有可能得到错误的结果。 审评中曾发现申报盐酸左氧氟沙星注射液的某厂家自测盐酸左氧氟沙星含量较药检所检验结果高约5%(含量测定色谱条件与有关物质检查一致)。仔细审查其图谱,发现未按盐酸左氧氟沙星注射液的已有国家标准用光照降解法进行系统适用性试验,且色谱峰明显拖尾。其测定结果偏高很可能是紧随主峰之后的杂质峰包裹进了主峰。 申请人往往会留意进样精密度、理论塔板数这样的常规系统适用性试验,却常常忽略了光照降解系统适用性试验,此种现象在申报资料中占很大比例。究其原因,是试验人员没有理解到此项系统适用性试验的目的和重要性,希望提醒申请人提高对系统适用性试验的重视程度。2、没有杂质个数与含量的详细对比 申报资料中杂质对比研究通常的做法就是按照国家标准方法检验一下自制品和已上市对照药品,若都在标准规定范围内,就认为自制品与已上市药品质量相当。其实这样的做法是对杂质对比的目的和比什么不甚明了的表现。杂质对比一方面要了解自己的产品与已上市品杂质有哪些不同,另一方面要了解制剂过程中有没有新产生的杂质,若有新产生的杂质,应加以控制。所以比较就要落到列表对比杂质的个数与含量上,泛泛地比较杂质总量是不足以说明问题的。 例如,申报盐酸左氧氟沙星、乳酸左氧氟沙星的注射剂采用方法D测定的较为多见。在该色谱条件下,相对保留时间为0.23、0.43、1.2左右的杂质峰较常见,其中相对保留时间为1.2的色谱峰是稳定试验中含量有所增加的主要杂质。 另外,统计杂质的个数时要注意“忽略限度”。英国药典氧氟沙星有关物质项下明确规定:Disregard any peak with an area less than 0.1 times the area of the principal peak in the chromatogram obtained with reference solution (a),即忽略面积小于对照溶液主峰面积0.1倍的色谱峰(0.02%)。中国药典没有这么详细的规定,但从实际操作来看,为增强方法的严谨性和数据的可比性,建议申请人在统计杂质个数时应明确忽略限度。3、强力破坏试验降解程度不合适 有关物质检查方法学验证的重要项目就是通过强力破坏试验考察方法的专属性,但强力破坏试验破坏程度的掌握不尽合理。较容易出现的情况是破坏太轻微,酸、碱、氧化、光照破坏均几乎未产生可检测的杂质,这样就无法判断所采用的色谱条件分离能力是否符合要求,破坏试验失去意义。另一种极端是破坏过度,主峰降解了大半,产生大量重叠的杂质色谱峰,这样很难找到合适的色谱条件将所有的降解产物分离。个人认为,适度的破坏应是采用比贮藏中可能遇到的最强条件稍强烈的条件降解,产生比贮藏中可能产生的稍多杂质,若所选色谱条件能将这些杂质都分离,就是专属性符合要求的。 以上问题是氧氟沙星系列药物审评中经常遇到的问题,希望能为研发者提供帮助,共同努力提高我国仿制药的研发水平。 [img]http://ng1.17img.cn/bbsfiles/images/2009/07/200907202227_160694_1612824_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/07/200907202231_160696_1612824_3.jpg[/img]
关于液相系统适用性的问题,由于系统适用性需要用到杂质标准品,但如果一直使用杂质标准品,费用又很高。如果公司自己制作内部标准品,有没有这样的科研力量。如何解决?
阿奇霉素系统适用性标准图谱谁有?中检所出对照了,可是没标准图谱
系统适用性试验中所配制的标准溶液,用来定性用的,各位色谱友,你们的系统适应性溶液存放多久呀?要不要做验证
恩诺沙星标准品是带硫酸盐的,带了盐的目标物最后的离子跟恩诺沙星本体的离子是一样的么
[b]高效液相色谱系统适用性试验设计的变化趋势[/b][i]周晓源,李雪茹[/i]高效液相色谱法(HPLC 法)是药物分析中常用的一种定性、定量色谱分析方法。具有较强的专属性,相对较高的检测灵敏度和良好的量化功能。2005版《中国药典》使用 HPLC 法的品种中,色谱系统适用性试验设计有了较大的变化:指标更加细致、周到,检测更重实效,色谱系统适用性的试验用溶液的制备方法也呈现多样化,体现出一些变化趋势。 1. 色谱系统适用性试验的设计与实验目的更加匹配 系统适用性试验的严格细腻程度取决于实验目的。首先应考虑色谱系统被用于何种实验,根据实验目的来设计系统适用性试验。如果一个 HPLC 方法仅用于定性鉴别,就其色谱系统的适用性试验而言可以相对简单宽松,只要可以确保被测成分峰与其他色谱峰有一定的分离度,具有适宜的出峰时间即可达到实验目的。 如果用于定量分析(如含量测定),则除要保证被测成分峰具有适宜的出峰时间外,还需检验系统是否能够保证被测成分峰与其他色谱峰完全分离,分离度一般应在1.5以上,同时还应测试被测成分峰峰面积的重复性是否良好,对照品溶液连续进样5针的峰面积相对标准偏差应不大于2%,被测成分峰的峰型也应基本对称,以保证分离效果和测量精度。对于小峰(如占总面积10%以下的色谱峰)峰面积的定量,或用峰高法定量时,就应对拖尾因子或对称因子加以严格的规定,一般来说,拖尾因子应在 0.95~1.05之间,因为峰的对称性对测量结果影响较大。 如果检查某种药品的有关物质,且还需要分别检查单个杂质和杂质总量,那么系统适用性试验还应有一个重点,就是要有常见杂质难分离物质对分离度的测定指标。此外系统的检测灵敏度试验也就相对比较重要。如盐酸二甲双胍的有关物质检查项下要求: 盐酸二甲双胍与双氰胺的分离度应大于1.5,检测灵敏度要求调节双氰胺峰高为满量程的10%。 如 果色谱系统是一个梯度洗脱系统,有时一个难分离物质对分离度的测试也不能完全达到实验目的。如果在梯度变化的前后均有需要检测的杂质,分离度的测定指标一般应根据需要在梯度变化之前和之后都可加以制订。在梯度洗脱系统中某个成分峰的保留时间也经常用来做系统适用性检测的指标,给出吐峰时间范围,如头孢地尼,主成分头孢地尼峰的保留时间要求22分钟,E-异构体峰保留时间约为33分钟,理论板数按头孢地尼峰计算应不低于 7000。 在2000年版《中国药典》中,有些标准色谱系统适用性试验的要求就与其色谱系统的实验目的不完全匹配。如有些品种含量测定与有关物质共用一套色谱系统,且有关物质还需要分别检查单个杂质和杂质总量,但系统适用性试验指标仅有一个理论板数的要求,或对分离度的设计为“被测成分峰与相邻杂质峰间的分离度应符合规定”这样一个对系统性能缓冲空间很大的一个指标要求。在2005年版《中国药典》中,这种实属很虚的指标开始减少。如2000年版头孢曲松反式异构体(光降解产物)峰的保留时间应为头孢曲松峰保留时间的1.3倍,两峰之间的分离度应不小于3.0,理论板数按头孢曲松峰计算应不低于1500,2005年版修订为头孢曲松峰和头孢曲松反式异构体峰间的分离度应不小于6.0。2.系统适用性试验用溶液的制备更加注重方便性、实用性和可操作性系统适用性试验用溶液的配制方法,最简单的莫过于用主成分对照品与杂质对照品混合配制,但有些杂质对照品不能得到,如性质不稳定或与主成分理化性质太接近,分离提取技术要求太高,成本太大等,但这些杂质峰恰恰又是与主成分峰最难分离的色谱峰,且较常存在于 药 品中需要检查的,在2005年版《中国药典》中,这一问题得到了较好的解决。如喹诺酮类药物中较常出现光降解产物,而此光降解产物是引起这类药物不良反应的主要因素,所以需要在有关物质检查中做为重点检测的杂质之一。 因 此 ,在2005年 版 《 中 国 药 典 》中,这些药物系统适用性试验用溶液的制备就通 过把对照 品溶液进行 光 照 处理,得到能产生明显光降解产物色谱峰的溶液。 3.实验过程、操作步骤趋于严谨规范 色谱系统适用性试验设计、规定的完备、灵敏度检测试验的规范,溶剂的选择、溶解制备方式等各方面均体现出对实验目的的理解更加明确,对实验细节考虑更加严谨周到,标准的书写格式均更 加规范 、统 一 ,如2005年 版《中 国 药典》收载的 β-内酰胺类抗生素中检查高分子聚合物的品种将原来收载的8个品种的色谱条件与系统适用性试验均修订与新增 13个品种项下书写格式相同,系统适用性试验统一为理论板数以蓝色葡聚糖2000峰计算均不低于……。拖尾因子均应小于2.0,在两种流动相系统中蓝色葡聚糖 2000峰保留时间比值均应在0.93~1.07之间,对照品溶液主峰与供试品溶液中聚合物峰与相应色谱系统中蓝色葡聚糖 2000峰保留时间的比值均应在0.93~1.07之间。
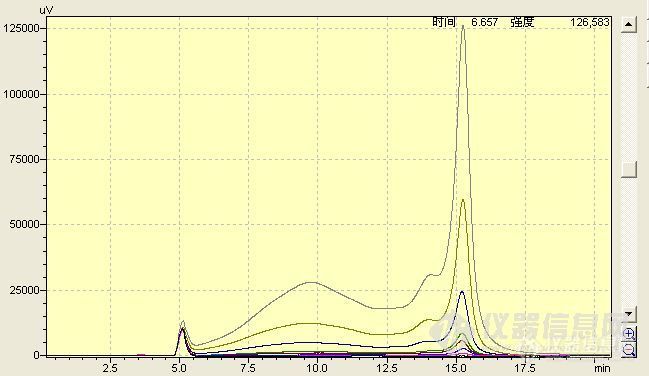
今天按照 农业部公告第236号《动物性食品中恩诺沙星和环丙沙星残留检测方法-高效液相色谱法》 检测恩诺沙星仪器 岛津LC-20AT 色谱条件如下色谱柱:岛津 Inertsil ODS-SP C18250mm×4.6mm(i.d),粒径5μm,流动相:0.05mol/L磷酸溶液/三乙胺--乙睛(82+18)流速:0.8mL/min检测波长:激发波长280nm;发射波长450nm进样量:20μL温度:室温做出来的恩诺沙星的标准的峰很不好看不知道是什么原因标1 0ug/mL 即乙腈http://ng1.17img.cn/bbsfiles/images/2012/02/201202091619_348574_1770829_3.jpg标2 0.00288ug/mLhttp://ng1.17img.cn/bbsfiles/images/2012/02/201202091620_348575_1770829_3.jpg标7 0.144ug/mLhttp://ng1.17img.cn/bbsfiles/images/2012/02/201202091621_348576_1770829_3.jpg标8 0.288ug/mLhttp://ng1.17img.cn/bbsfiles/images/2012/02/201202091622_348577_1770829_3.jpg标准比较http://ng1.17img.cn/bbsfiles/images/2012/02/201202091623_348578_1770829_3.jpg
在做薄层色谱分析时需做系统适用性试验,那么对于已知杂质的薄层分析系统适用性试验该如何做?已知杂质的限度是0.2%,系统适用性试验:1.将杂质与供试品按照0.2%:1制成混合溶液进行系统展开2.将杂质与供试品按照0.2%:0.2%制成混合溶液进行系统展开上述两种系统适用性试验应选择哪种?选择1很容易出现杂质被包裹现象,两种系统适用性试验分离度都能满足要求。求指点~~
HPLC测定时需要做系统适用性,那么这个系统适用性到底该用供试品溶液做还是用对照溶液做?
请教各位前辈:1.听说有个ZN1009-2004标准,能检测水产品中,哪位前辈有,能否给我邮一份?2.有其他能同时前处理和检测水产品中恩诺沙星、环丙沙星、诺氟沙星、氧氟沙星的方法吗?QQ:3733818E-mail:yardin@126.com谢了先!!
恩诺沙星和环丙沙星的检测,做回收总是大于质控范围,按标准做的,有哪些方面不注意导致的?望老师不吝赐教
酶联反应试剂盒上机用酶标仪检测恩诺沙星时,样品的吸光值比0标准品的吸光值还高,这是什么原因
向大家请教关于系统适用性实验的问题:同一样本中有A(A为样本),B(杂质)两种成分,且需要同时测定A,B两种物质的含量,那么在进行系统适用性实验时,是否可以用A和B的混合对照品,连续进样5针,分别计算A和B的RSD???
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂(5~10μm);0.2mol/L硫酸盐缓冲液(取无水硫酸钠28.4g,加水溶解后,加磷酸2.7ml、水800ml,用乙醇胺调节pH值至2.3,加水至1000ml)-乙腈(74:26,或适宜比例)为流动相;柱温为40℃;检测波长为214nm。取重组人胰岛素对照品,用0.01mol/L盐酸溶液制成每1ml中含1mg的溶液,室温放置至少24小时后,取2ul注入液相色谱仪,胰岛素峰和A21脱氨胰岛素峰的分离度应不小于1.8,拖尾因子不大于1.8。请问我在工作中做系统适用性实验时,是进上文中的1mg/ml的放置24小时的溶液5针,以其做系统实用性试验;还是进上文中的1mg/ml的放置24小时的溶液1针,再进对照品5针,以5针对照品作为系统适用性试验,而一开始进的只看一下分离度?
测甘油杂质需要做一个系统适用性,其中用到甘油浓度为400mg/ml,请问必须要对照品吗,用分析纯可以吗
做系统适用性时,到底该用对照品还是供试品啊,看到很多说法都不一样......

[img=,480,596]https://ng1.17img.cn/bbsfiles/images/2018/09/201809260906045200_3378_2449119_3.png!w480x596.jpg[/img]请教各位同仁: 上述是盐酸雷尼替丁含量测定方法,其中划红线的是系统试液。可见系统适用性试液是用氢氧化钠进行破坏的溶液,因该物质极易被氢氧化钠破坏,故在进样5针后,其重复性不满足要求。故在进样过程中,只测试一针。 [b] 疑问:[/b]1.测试一针是合理的,但是否还要用对照品溶液连续测试5针来验证系统适用性?2.盐酸雷尼替丁的有关物质方法同含量测定,采用的是自身对照法,请问测试有关物质与含量不是同一天,请问有关物质方法中系统适用性试验如何测试?是继续用破坏性试液测试1针,还是用什么测试5针?目前有没有对有关物质方法中系统适用性试验测试要求?3.请问有关物质测试中,是对照溶液和供试品溶液各进1针,各配1个样?还是双样双针?单样双针?希望有比较权威的解答!感谢各位
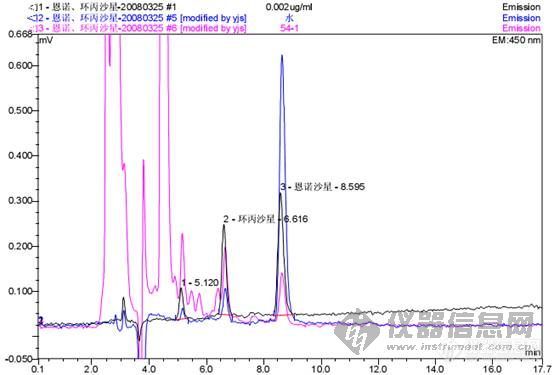
[img]http://ng1.17img.cn/bbsfiles/images/2008/03/200803282113_83012_1626406_3.jpg[/img]图中:黑色的是标准品;蓝色的是水;粉红的是空白样品最近在搞恩诺沙星、环丙沙星这个东西,方法是农业部公告第236号文件里的。可是怎么做都是这个样子,在标准品保留时间处空白样品也有峰出现,进纯净水、甲醇在这个位置都有峰出现,这是什么原因呢?是本来就有影响还是本人做的不好?请各位专家提提意见,说说你们的做法,最好能传个图上来俺看看!感谢!!!
查了半天,就查到一个河北省的地方标准检测饲料中的恩诺沙星的做法,是液质的方法,不知道有谁做过这个项目没?请教一下
农业部235号里有恩诺沙星的限量,没有环丙沙星的限量,实验中恩诺沙星是以恩诺沙星和环丙沙星之和计的,检测是测的两个沙星的和,限量直接写恩诺沙星的限量吗
大家在做方法验证的时候,系统实用性溶液怎么配的,浓度多大,遵循什么原则。例如我有个产品活性成分含量大约50%,HPLC就出这一个峰,系统适用性溶液怎么配呢,是不是配置50%的对照品溶液,还是多大浓度的啊!谢谢
[color=#444444]大家好,我想问个问题,在食品检测恩诺沙星时,报告判定时是以恩诺沙星和环丙沙星之和计,这是为什么?跟检测样品有关还是什么原因?请大神赐教![/color]
在高效液相色谱法系统适用性试验中,有常用的四个参数:分离度、柱效、重复性和拖尾因子,其中分离度和柱效是二个最重要、也更具有实用意义的参数。分离度是判断两物质在一个方法中分离的程度,虽然与柱效相关,但在衡量系统适用性时,首先强调的应该是分离度,只有当色谱图中仅有一个色谱峰或测定微量成分时,规定柱效才有其特殊重要性。由于我们国家药典对使用的色谱柱只有原则上要求,因此,在药品质量标准中制定杂质(尤其是特定杂质)检查方法时,其系统适用性试验中尽可能列入分离度用溶液和要求,显得非常重要。但我们国家的许多药品标准,往往忽略这一点,有时柱效定的也不合理,以致于造成试验判断上的误差和困难。中国药典中规定了某些色谱条件可在一定范围内调节,但无具体内容,为保证系统适用性,参照国外药典,建议某些条件的调节范围如下,供试验人员参考。(1)柱长(-50%到+100%),柱内径(±25%);(2)填料粒径(-50%);(3)流速(±5%);(4)流动相的PH值(±0.5PH单位);(5)缓冲盐浓度(相对浓度±30%,绝对浓度±2%);(6)进样体积可减小至可接受的定量精度;(7)柱温(±10℃)。由于各色谱条件对分离效果具有累积效应,故同时调节多项条件应予避免。
在高效液相色谱法系统适用性试验中,有常用的四个参数:分离度、柱效、重复性和拖尾因子,其中分离度和柱效是二个最重要、也更具有实用意义的参数。分离度是判断两物质在一个方法中分离的程度,虽然与柱效相关,但在衡量系统适用性时,首先强调的应该是分离度,只有当色谱图中仅有一个色谱峰或测定微量成分时,规定柱效才有其特殊重要性。由于我们国家药典对使用的色谱柱只有原则上要求,因此,在药品质量标准中制定杂质(尤其是特定杂质)检查方法时,其系统适用性试验中尽可能列入分离度用溶液和要求,显得非常重要。但我们国家的许多药品标准,往往忽略这一点,有时柱效定的也不合理,以致于造成试验判断上的误差和困难。中国药典中规定了某些色谱条件可在一定范围内调节,但无具体内容,为保证系统适用性,参照国外药典,建议某些条件的调节范围如下,供试验人员参考。(1)柱长(-50%到+100%),柱内径(±25%);(2)填料粒径(-50%);(3)流速(±5%);(4)流动相的PH值(±0.5PH单位);(5)缓冲盐浓度(相对浓度±30%,绝对浓度±2%);(6)进样体积可减小至可接受的定量精度;(7)柱温(±10℃)。由于各色谱条件对分离效果具有累积效应,故同时调节多项条件应予避免。http://www.zjyj.org.cn/jykjdetial.asp?id=269

http://ng1.17img.cn/bbsfiles/images/2012/03/201203081038_353205_1638724_3.jpg上文中的阿莫西林系统适用性对照品就是含量测定用的对照品吗?
本人饲料行业,液相做中间产物的时候,系统适用性可以改为每周做一次,其余天数只走回针考察吗ps:液相不是不停运行的、对照品有效期为一周
2010版 诺氟沙星的有关物质有谁做过,杂质A都做的怎么样,如果含杂质A算A的浓度含量吗