最近在做公司产品含药量的释放情况,释放液是加了牛血清白蛋白的PBS液,释放后产品从释放液中取出,注射用水洗净后晾干。产品上残留药品再用乙酸乙酯超声洗脱,用UV测定乙酸乙酯中的药品浓度。因最近新换了牛血清白蛋白,后来实验数据与前比似乎有点偏低,怀疑产品上牛血清白蛋白没洗干净,对UV吸收有影响?牛血清白蛋白对UV吸光度值有什么影响呢?哪里有供应质量稳定的牛血清白蛋白?
请问用高效液相色谱法检测牛血清白蛋白标准品(BSA),用什么柱子比较好?
有谁知道如何用牛血清白蛋白配制空白血浆?文献报道如下:Reconstituted plasma was prepared by dissolving 0.8 g of NaCl, 0.02 g of NaCl, 0.02 g of KH2PO4, 0.11 g Na2HPO4 and 4 g of bovine albumin (Sigma, St. Louis, MO, USA) in 100 ml of water.但是0.8 g of NaCl, 0.02 g of NaCl肯定有一个是重复的,哪位大侠知道如何配制啊
如果说一个人一次献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献的血——转基因水稻胚乳可提取血清白蛋白——转基因水稻胚乳可提取血清白蛋白2012年09月01日 来源: 中国科技网 关注转基因 白蛋白供应紧张一直困扰着人类。我国每年需求150—160吨,全球每年需求量则高达500吨,由于血浆来源紧张,我国目前从血浆中提取量仅可供应1/3,其中2/3依赖进口。 2011年10月31日,武汉大学生命科学学院教授杨代常撰写的论文《利用转基因水稻规模化生产重组人血清白蛋白》在《美国科学院院报》发表,吸引了世界的目光。 文章用翔实的科学数据证明,植物来源的重组人血清白蛋白与临床使用的血浆来源血清白蛋白,无论是在生理生化性质,还是功能用途等方面,都具有高度的等同性。 为何这项研究引发种种关注?稻米血清白蛋白是否会危及生态及人身安全?其何时能用于临床治疗?……带着这些问题,记者采访了杨代常和他的团队。 “借腹生子”:从水稻胚乳中提取血清白蛋白 植物种子生物反应器,是将植物种子作为一个蛋白质“生产车间”,利用植物作为合成蛋白质的“机器”来合成人类所需的蛋白质。“通俗地解释,便是‘借腹生子’。”杨代常说。 国外从1989年已开始利用DNA重组技术生产血清白蛋白,但由于血清白蛋白产量低、纯化工艺复杂、生产成本远高于市场成本,始终无法进入市场。 杨代常带领研究团队,从水稻基因组数据入手,根据水稻种子储藏蛋白与血清白蛋白的生化性质差异,设计出从提取到纯化的一整套工艺方案,最大限度地提取血清白蛋白,最低限度去除种子的内源蛋白,成为一项原始创新的科研成果。 “具体来说,是由表达元件组成的载体,通过遗传工程整合到水稻基因组内,在种子特异性调控元件的指导下,水稻种子在成熟过程中也不断地合成和积累人血清白蛋白,然后通过规模化种植获得原料,再经过提取、纯化等步骤获得高纯度的血清白蛋白。”杨代常介绍,目前大约每亩水稻可以产生1.5—2公斤血清白蛋白,如果说一个人一次能献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献血。 “天然屏蔽”:可杜绝肝炎、艾滋病毒等风险 植物源重组血清白蛋白优势明显,它来源于非动物,避免了各种病毒和病原菌的污染,并由于不受血浆供应限制,可无限量供应。但是转基因农业作物安全性向来争议不断,植物源血清白蛋白有望未来直接应用于人体中,有人担心会危及生态及人身安全。 对此,杨代常解释,首先,就人血清白蛋白本身安全性而言,血清白蛋白本就是人体的蛋白质,占血浆中蛋白的30%,是一种安全的蛋白质。目前,根据获取的数据,植物来源的人血清白蛋白从生物活性、分子结构和理化性质与血浆来源的人血清白蛋白完全一致,从水稻胚乳中提取的血清白蛋白可杜绝携带如肝炎病毒、艾滋病毒等风险。研究发现,人体对植物蛋白的耐受能力大于对细菌和酵母的耐受能力。从安全性考虑,已建立高纯度符合医药级别纯度的血清白蛋白。其次,就转基因生物安全而言,由于采取地理和时间双重隔离方法,要求比美国更为严格。第三,为杜绝进入食物链,在研究中采取了专用收割机、烘干机、稻米加工设备以及专用仓库等措施,建立了严格的监管规范,能做到可管可控和可追溯。 未来预期:进入临床需4至5年 从2005年始,杨代常自主研发的水稻胚乳细胞蛋白质高效表达技术平台,填补了国际上此项技术规模化生产的空白,已获美、日、欧盟以及我国的多项专利。 杨代常说,目前,植物源重组血清白蛋白的质量已达到非临床应用标准,可替代血源人血白蛋白用于细胞培养基添加剂,成为细胞培养中血浆来源的血清白蛋白的替代品;可减少培养基中胎牛血清的使用量;还可用于高纯试剂、细胞冷冻保护剂、医疗器械包埋剂、药物载体、化妆品组分、体外诊断等。 国外已在疫苗及生物医药产品的细胞培养的稳定剂上使用。我国按照国家药监局的要求,要通过临床研究后才能进入临床应用。 通过治疗大鼠肝硬化腹水对比,进行植物源重组血清白蛋白的药效研究,发现大鼠肝硬化腹水的治疗效果在降低腹围、增加尿量和尿蛋白量等指标优于血浆来源的血清白蛋白。 “植物源重组血清白蛋白正在进行临床前研究,已完成大部分的药学研究,预计在2013年上半年可望完成临床前研究;预计进入临床研究至少需要2年时间,进入临床应用至少需要4—5年或更长的时间,这取决于临床研究的结果与进度以及国家的法规。”杨代常说。 从实验室走向产业化 去年年初,杨代常带着多年的研发成果,入驻武汉东湖国家自主创新示范区光谷生物城,一年内实现了项目产业化。 “这一过程我们走得很艰难。”杨代常说,为了让投资者更有信心,他在商业模式上从长中短期产品计划入手,将技术做好做精。在科技部转基因重大专项、国家863计划和武汉东湖国家自主创新示范区光谷生物城的支持下,加速了项目产业化进程。 “我国生物产业要走在世界前列,在心理上要打破‘奴性’思维,在政策上要突破传统观念,要敢做别人不能做或不敢做的事情。”杨代常说,“现在一谈到转基因,很多人就‘谈虎色变’。实际上,理解上存在很多误区。转基因技术是通过遗传工程的手段,将人类需要的基因(一段DNA片段)导入到植物或任何一种生物的一项高科技技术,是人类由必然王国走向自由王国的必由之路。” 近日,杨代常的科研团队又传出喜讯,在水稻中“种”出了“人抗胰蛋白酶”。目前,重组抗胰蛋白酶与重组血清白蛋白一样,有效地避免人血液中病毒病原菌感染的风险,但需要进行一系列的免疫原性、急性、毒性等相关实验和临床研究后,方能应用于临床。 杨代常透露,未来,其团队研发重心将着重原创性技术研究,建立单克隆抗体的表达平台,使我国的单克隆抗体药物的价格降到5万元左右,重组血清白蛋白进入临床应用。(记者 马爱平) 《科技日报》(2012-09-01 三版)
想通过HPLC建立牛血清白蛋白(BSA)的标准曲线,分别用了甲醇和水 1:1、乙腈和水 1:3, 两种流动相,但是出现奇怪的现象是两种情况出峰时间基本相同,都是在3min左右出的峰,峰高很低都是0.004左右,是不是流动相有问题,还是其他什么原因? 用的柱子是waters 4.6*250mm ODS2请高人指点。
[font=宋体][font=宋体]重组人血清白蛋白([/font][font=Calibri]Recombinant Human Serum Albumin[/font][font=宋体],简称[/font][font=Calibri]rHSA[/font][font=宋体])是一种通过基因工程技术合成的白蛋白。其结构和功能与天然人血清白蛋白相似,因此可以作为血浆替代物,适用于临床治疗、细胞培养和生物技术领域的研究等。[/font][/font][font=宋体][font=宋体]人血清白蛋白是一种由[/font][font=Calibri]585[/font][font=宋体]个氨基酸组成的单链蛋白质,分子量为[/font][font=Calibri]66.5kDa[/font][font=宋体],含有[/font][font=Calibri]17[/font][font=宋体]个二硫键和一个自由半胱氨酸。人血清白蛋白的结构包括三个结构上相似的功能域,而每个功能域又可分为包含两个相似的α[/font][font=Calibri]-[/font][font=宋体]螺旋结构的亚域,形成了一个心型分子。[/font][/font][b][font=宋体]人血清白蛋白在人体内负责许多细胞功能,如:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]维持胶体渗透压,调节体液平衡[/font][/font][font=宋体][font=Calibri]2. [/font][font=宋体]结合和运输脂肪酸,胆红素和药物等各种物质[/font][/font][font=宋体][font=Calibri]3. [/font][font=宋体]通过清除自由基和活性氧作为抗氧化剂[/font][/font][font=宋体][font=Calibri]4. [/font][font=宋体]调节血液的[/font][font=Calibri]pH[/font][font=宋体]值和缓冲能力[/font][/font][font=宋体][font=Calibri]5. [/font][font=宋体]调节免疫反应和炎症[/font][/font][font=宋体][font=Calibri]6. [/font][font=宋体]提供配体代谢修饰,使潜在的毒素无害等[/font][/font][font=宋体] [/font][b][font=宋体]人血清白蛋白的用途与重要性[/font][/b][font=宋体] [/font][font=宋体]人血清白蛋白在医学领域的应用广泛,涉及治疗多种疾病和病症。其用途包括但不限于:[/font][font=宋体] [/font][font=宋体]治疗多种疾病:血容量不足、休克、烧伤、手术失血、外伤、出血、体外循环、急性呼吸窘迫综合征等。[/font][font=宋体]支持肝功能:急性与慢性肝病的治疗中,人血清白蛋白有助于肝功能恢复。[/font][font=宋体]营养支持:为患者提供必要的营养。[/font][font=宋体]蛋白质与肽的半衰期延长:有助于药物研发中延长蛋白质和肽的活性时间。[/font][font=宋体]细胞培养中的应用:在细胞培养中,人血清白蛋白的作用包括限制细胞聚集、保护蛋白质免于降解、结合与运输代谢物以及增加疏水分子溶解度。它还能增强培养中细胞的生长和活力,提高重组蛋白的产量和质量。[/font][font=宋体]生物反应器中的用途:在生物反应器中,人血清白蛋白用于减轻物理冲击和剪切,保护细胞。[/font][font=宋体]全球需求增长:随着其在生物学领域的广泛应用,全球对人血清白蛋白的需求逐年增加。[/font][font=宋体]人血清白蛋白的供应挑战与重组人血清白蛋白的发展[/font][font=宋体] [/font][b][font=宋体]由于人血清白蛋白的多种重要用途,其全球需求持续增长,但供应却面临挑战:[/font][/b][font=宋体] [/font][font=宋体]供应有限:传统上,人血清白蛋白是通过人类血浆分馏生产的,受限于血浆供应。[/font][font=宋体]原材料的不一致性:这可能影响患者安全、治疗效果,并存在潜在的血液来源病原体污染风险。[/font][font=宋体][font=宋体]重组人血清白蛋白的兴起:鉴于上述挑战,科学家们努力开发重组人血清白蛋白([/font][font=Calibri]Recombinant Human Serum Albumin, rHSA[/font][font=宋体])。多个宿主生物(如大肠杆菌、酵母等)被尝试用于生产重组蛋白,最终基于毕赤酵母和水稻的表达系统成为主要选择。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达纯化服务[/b][/url],[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-productio][b]重组蛋白生产[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
荧光光谱研究阿司匹林键联金属卟啉与牛血清白蛋白的相互作用
由武汉大学生命科学院教授、武汉禾元生物科技有限公司董事长杨代常领衔的研发团队从2006年开始进行植物源替代血浆来源的医药蛋白的研究与开发,现已取得突破性进展并已跨入规模化生产的阶段,填补了国际上此项技术空白。相关论文“Large-scale production of functional human serum albumin from transgenic rice seeds ”(利用转基因水稻规模化生产重组人血清白蛋白)于2011年10月31日在线发表于《美国科学院院报》( PNAS ) 。该论文在线之际,受到国外Scientist , Nature news , The Australian , Thomson Reuters, Fox News , Agence France Presse (AFP法新社) 等美国、英国、俄罗斯、德国、巴西、印度各专业杂志及媒体的广泛关注和报道。该研究表明由转基因水稻种子生产的重组人血清白蛋白(OsrHSA)在生理生化性质、物理结构,生物学功能、免疫原性与血浆来源的人血清白蛋白一致;并建立了大规模生产重组人血清白蛋白的生产工艺,获得了高纯度和高产量重组人血清白蛋白产品。利用大量数据证明了转基因水稻种子可取代现有基于发酵的表达技术来生产重组蛋白质是经济有效的。正如PNAS 审稿人对该文章的评价:“这篇文章解决了在科学上振奋人心、在经济上都非常重要的议题--即用转基因植物生产血浆产品或其他蛋白产品的技术平台,可代替其他基于发酵的表达技术,其重要性也不言而喻……这篇文章近乎完美地证实了植物生产的医药蛋白和批准临床使用的血浆来源医药蛋白是完全相同的,并提供了翔实数据证明植物系统规模化容易和成本优势。”目前,人血清白蛋白(human serum albumin)广泛应用于临床治疗和细胞培养领域。常见的人血清白蛋白大多数从人的血浆中提取,这样的生产方式不仅受到血浆供应的限制,而且还具有携带病毒传播的高风险性。国际上以重组人血白蛋白替代血源产品的应用已成为趋势,国内市场需求也逐年扩大,2010年已达150吨。尽管市场广阔,但高纯度重组人血白蛋白的规模化生产技术和质量控制技术却是世界性难题。武汉禾元历经多年的技术攻关,利用水稻胚乳表达技术平台,研发出国际先进水平的重组人血白蛋白产品生产技术,并成功实现重组人血白蛋白规模化和产业化,完全摆脱了相关制约,具有纯度更高、无动物组分、安全、高效、绿色环保、廉价、无限量供应等优势。随着植物源重组人血清白蛋白的发展,我国人血清白蛋白日益紧张的局面必将得到缓解。详细论文,请点击下载:http://www.oryzogen.com/category/22/2011-11-01/93315359.html注:《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America, 缩写 PNAS,ISSN:0027-8424)是被引用次数最多的综合学科文献之一。它是美国科学院的院刊。自1914年创刊至今,PNAS提供具有高水平的前沿研究报告、学术评论、学科回顾及前瞻、学术论文以及美国国家科学学会学术动态的报道和出版。PNAS收录的文献涵盖生物、物理和社会科学,2008年的影响因子为9.38,2009年影响因子为9.432, 2010年影响因子为9.771。在SCI综合科学类排名第三位,因而已成为全球科研人不可缺少的科研资料。
[color=#444444]实验需要定量牛血清白蛋白(BSA)和溶菌酶(LYZ)混合溶液中各自的含量是多少,用的是安捷伦1260高效液相,色谱柱C-18,25cm,300A,流动相A 0.1%三氟乙酸水溶液。流动相B 0.1%三氟乙酸乙腈溶液,但是怎么走梯度都分不开啊,总是在间隔不到1分中出峰。求大神指点[/color]
[size=4]我正在做一种生物碱与[/size][size=3][font=宋体]牛血清白蛋白(BSA)结合作用的荧光光谱研究,需要求算[/font][/size][size=3][font=宋体]生物碱分子的紫外光谱与牛血清白蛋白(BSA)[/font][/size][size=3][font=宋体]荧光发射光谱的重叠积分,以便求算药物分子与BSA结合的距离,文献上说明可以采用矩形分割法求出两光谱重叠区域的积分值,但用何软件如何求算我还不会。肯请此间高人出手指点,不胜感激!最好能将方法发到我的邮箱[email]zhongming2613@163.com[/email] 谢谢![img]http://ng1.17img.cn/bbsfiles/images/2010/03/201003121811_205351_1889038_3.gif[/img][/font][/size]
【百度百科】牛血清白蛋白(BSA),又称第五组分,是牛血清中的一种球蛋白,包含583个氨基酸残基,分子量为66.430 kDa,等电点为4.7。牛血清白蛋白在生化实验中有广泛的应用,例如在western blot中作为Blocking agent。CAS:9048-46-8希望知道的板油介绍一下
稀土离子铈(Ⅳ)[color=red]分子荧光[/color]光谱法测定血清白蛋白的含量
β-乳球蛋白属于乳白蛋白还是属于乳球蛋白里面的一种成分?最近看到有两种版本,其一,说是属于乳白蛋白里面的一种成分,乳白蛋白包括α-乳白蛋白、β-乳球蛋白和血清白蛋白。乳球蛋白即免疫球蛋白。其二,乳白蛋白包括α-乳白蛋白和血清白蛋白,乳球蛋白包括β-乳球蛋白和免疫球蛋白。现在不知道哪种说法对,请各位指教!!!谢谢!!!
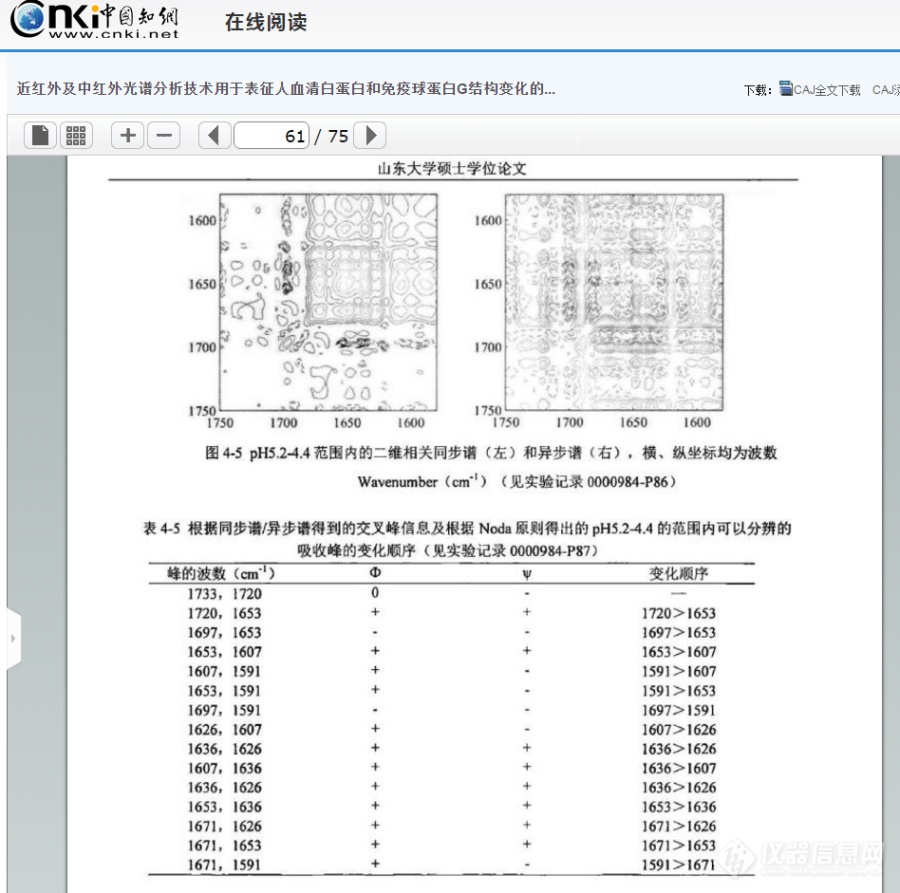
被举报贴链接:https://bbs.instrument.com.cn/topic/7288287。原文链接:http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201901&filename=1019008793.nh&uid=WEEvREdxOWJmbC9oM1NjYkZCbDdrdVdEWGlFakhvQjlCWXJackV1UTlvMUY=$R1yZ0H6jyaa0en3RxVUd8df-oHi7XMMDo7mtKT6mSmEvTuk11l2gFA!!&v=MDkxMjhGdGJGckpFYlBJUjhlWDFMdXhZUzdEaDFUM3FUcldNMUZyQ1VSTE9mYitScEZ5emxVcnJJVkYyNkY3TzQ=[color=#333333]王燕波. 近红外及中红外光谱分析技术用于表征人血清白蛋白和免疫球蛋白G结构变化的研究.山东大学,2018[/color][color=#333333]硕士论文第四章,完全一样[/color][color=#333333][img=,690,684]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261510581138_2462_2204387_3.png!w690x684.jpg[/img][/color]
体积排阻色谱分离蛋白质,分子量范围100万~1万,其中有分子量47000的组份,要分析分子量68000的杂蛋白含量,采用TSK4000SW,长度为60厘米的色谱柱,分离分子量68000与47000的2个组份,分离度在0.9~1.0左右,分离度达不到1.5,有什么方法解决?
各位大神,最近在册牛血清蛋白标准曲线,资料上显示说,牛血清蛋白与考马斯亮蓝结合之后在595 nm处显示最大吸收,可是为什么我用紫外扫谱发现在578 nm处才是最大吸收,但是测出来的不同浓度的吸光度线性关系也不好,排出紫外检测器的问题,到底是什么原因呢????
2 hours before use. (将重悬液在4 ℃ 静置2小时以上)第 3 步:该重悬液在 2-8 ℃ 最长可保存 1 周。用说明书上推荐的溶液将细胞因子或重组蛋白重悬到推荐的浓度后,细胞因子或重组蛋白可放置在2-8 ℃ ,即冰箱的冷藏室。在这种条件下,细胞因子或重组蛋白的活性最长可保持1周。这对一个周期为5-7天的实验,如DC(树突状细胞)的诱导成熟是足够的。在此期间,只要每次从冰箱里吸取一定量的细胞因子或重组蛋白溶液加入到培养体系内即可。其实,说明书上推荐的浓度对于一般的实验来讲是比较高的。所以用户通常会将该溶液进一步稀释后再放在4 ℃ 保存,待1周内用完。如进行稀释,必须遵照下面第4步的方法,即需用含载体蛋白的溶液进行稀释,否则稀释后的细胞因子或重组蛋白很容易会粘附在管壁或瓶壁上,使得溶液中的细胞因子或重组蛋白的浓度下降,细胞因子或重组蛋白的总活性则大为减弱。第 4 步:如要长期保存,则需用含载体蛋白 ( 如 0.1% BSA ,或 10% FBS ,或 5% HSA) 的溶液进一步稀释,然后分装冻存于 -20 ℃ 至 -80 ℃ 。如果一个实验周期长于一周,或配制的细胞因子或重组蛋白一次用不完,我们就需对细胞因子或重组蛋白进行长期保存。方法是:将已重悬的细胞因子或蛋白用含载体蛋白,如0.1% BSA(牛血清白蛋白),10% FBS(胎牛血清),5% HSA(人血清白蛋白)的溶液将重悬液进一步稀释,然后分装冻存于-20 ℃ 至-80 ℃ ,即常规冰箱的冷冻室或超低温冰箱中。问:经常有人会在细胞因子或重组蛋白冻干粉用推荐的溶液重悬后直接分装冻存于-20 ℃ 至-80 ℃ ,这样可以吗? 答:不行。我们知道,塑料管壁对多数蛋白均有很好的吸附作用,也就是说溶液中的蛋白很容易粘附在管壁。粘附后,蛋白是很难与管壁分离的。做过ELISA实验的人都知道,ELISA的包被抗体(Capture antibody)就是通过这种粘附作用包被到酶标板上的。载体蛋白,如1% BSA,10% FBS (胎牛血清)和5% HSA等的主要作用是预先封
大家好,请教各位一个问题: 文献报道,考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm波长下有最大光吸收。其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。 但我按照文献配制的G-250(0.1mg/mL)是紫色的,用紫外光谱检测时超出量程,所以用二次水稀释一倍,检测其最大吸光度值,不在488nm,将其和一定浓度的牛血清白蛋白结合,发现其颜色并未变成青色,吸光度也不在595nm,而是随着蛋白浓度的增加红移。实验现象与文献完全不同,不知道是哪里出错了,请教各位! 很着急,请知情人解答疑惑,万分感谢!
一些蛋白质的分子量与Stokes半径:蛋白质 分子量(kD)Stokes半径(nm)乳清蛋白 12.4 2.01核糖核酸酶 13.7 1.92肌红蛋白 17.0 2.00大豆胰蛋白酶抑制剂 21.5 2.26碳酸酐酶 31.0 2.35辣根过氧化物歧化酶 40 3.00卵清蛋白 45 2.80血红蛋白(人)64.5 3.08牛血清白蛋白 70 3.65酵母醇脱氢酶 150 4.55血浆铜蓝蛋白 151 4.73谷氨酸脱氢酶 258 6.00甲状腺球蛋白 670 8.25芜菁花叶病毒 3500 ~12.0
各位前辈,大虾,小弟先***!我第一次做这种实验,目的是想把一种极低浓度的蛋白溶液中的蛋白浓度测出来。查了资料,认为folin-酚法比较适合。文献报道说该法的检查限最低能到5 μg/ml。按照中国药典第三部lowry法测蛋白含量,我拿牛血清白蛋白标准品配了一个50 μg/ml的浓度和5 μg/ml的浓度。50 μg/ml的浓度的样品,能显出蓝色,但不深。5 μg/ml的浓度基本都不显示,跟空白一样。可见光检测,5 μg/ml的浓度与空白的吸收值基本一致。且为负值。问题:1、请问该法,在5 μg/ml的浓度时,是否还能显出蓝色,至少肉眼能分辨出来。2、50 μg/ml的浓度时,显出的颜色淡还是深,可见光吸收大概是多少?3、我的操作可能出现哪些问题,影响实验结果。谢谢,前辈、大虾、学长们啦!小弟贵球!!!!!
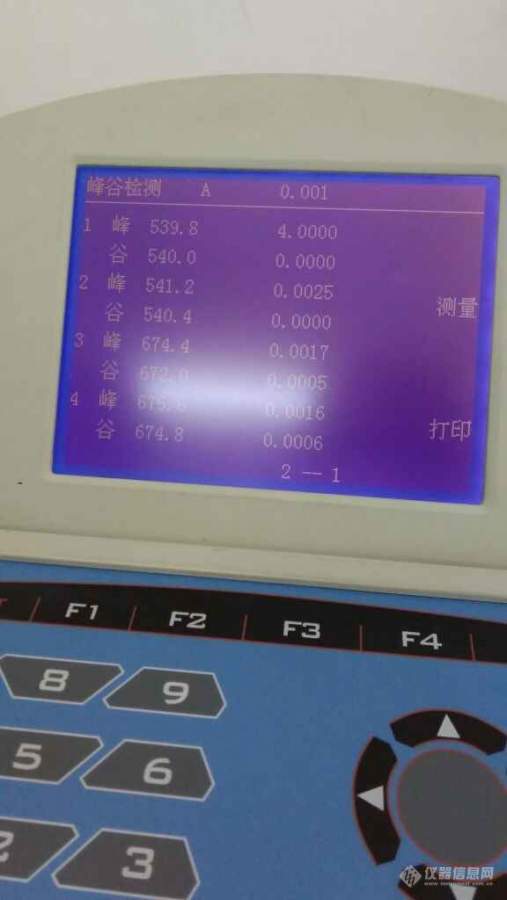
[color=#444444]配置1mg/mL牛血清蛋白溶液,用去离子水和。BSA配的,然后紫外扫光谱峰值是539左右,网上查的是277nm左右,哪里有问题呢,扫光谱峰值和配置溶液浓度有关系吗[/color][color=#444444][img=,507,900]https://ng1.17img.cn/bbsfiles/images/2019/08/201908201019285247_8917_1827556_3.jpg!w507x900.jpg[/img][img=,507,900]https://ng1.17img.cn/bbsfiles/images/2019/08/201908201019276355_7390_1827556_3.jpg!w507x900.jpg[/img][/color]
各位前辈,大虾,小弟先***!我第一次做这种实验,目的是想把一种极低浓度的蛋白溶液中的蛋白浓度测出来。查了资料,认为folin-酚法比较适合。文献报道说该法的检查限最低能到5 μg/ml。按照中国药典第三部lowry法测蛋白含量,我拿牛血清白蛋白标准品配了一个50 μg/ml的浓度和5 μg/ml的浓度。50 μg/ml的浓度的样品,能显出蓝色,但不深。5 μg/ml的浓度基本都不显示,跟空白一样。可见光检测,5 μg/ml的浓度与空白的吸收值基本一致。且为负值。问题:1、请问该法,在5 μg/ml的浓度时,是否还能显出蓝色,至少肉眼能分辨出来。2、50 μg/ml的浓度时,显出的颜色淡还是深,可见光吸收大概是多少?3、我的操作可能出现哪些问题,影响实验结果。谢谢,前辈、大虾、学长们啦!小弟贵球!!!!!
牛血清里的球蛋白有商品化的试剂卖吗?
[size=24px]我们主要用maldi-tof研发试剂盒,在验证实验时,有个问题就是无法做正确度或者准确度实验,在查看JJF [font='Times New Roman']1528-2015 [/font][font='Times New Roman'][font=宋体]《飞行时间质谱[/font][/font][font='Times New Roman'][font=宋体]校准规范[/font][/font][/size][font=宋体][size=24px]》时,发现用到蛋白质相对分子质量标准物质和[font='Times New Roman']肽类相对分子质量标准物质,然后有个想法就是标准物质是否可以用于验证实验进行正确度或者准确度实验。[/font][/size][/font]
[center]如何区分分子量、分子质量和相对分子质量 与原子的质量计量一样,分子的质量计量也先后存在3个量名称:相对分子质量、分子质量和分子量。众所周知,分子的质量为组成分子的各原子的质量之和。在日常专业工作中,不论是单质还是化合物,它们的分子质量都是根据各元素原子的个数和各元素的“相对原子质量”(由元素周期表上查到)计算得到。既然元素的相对原子质量是一个单位为“1”的相对质量,那么由此计算得到的分子质量必然也是一个单位为“1”的相对质量。对于某些结构复杂的生物大分子,往往都是通过电泳、离心或色谱分析等方法测得其近似分子质量,因而更是一个相对概念的量值。所以,我们过去长期习惯使用着的“分子量”实际上都是相对的分子质量。因此,国标指出“以前称为分子量”的即是“相对分子质量”(relative molecular mass),并将后者定义为“物质的分子或特定单元的平均质量与核素12C原子质量的1/12之比”。相对分子质量是两个质量之比,也在计算表达形式上进一步明确了“相对”的含义。对于定义中的“特定单元”,主要是指空气等组成成分基本不变的特殊混合物,它们的相对质量可根据其组成成分(N2,O2,CO2,Ar等)的相对分子质量和其在空气中的体积分数计算其平均质量,然后与12C原子质量的1/12相比即可获得。相对分子质量的量符号为Mr.,单位为“1”。 对于过去长期使用的“分子量”,其英文为molecular weight,确切原意为“分子重量”。它既不是质量概念,又没有相对的含意,因而也是一个不够准确和不够科学的量名称。根据国标规定,“分子量”应停止使用,凡过去使用“分子量”的场合都应换以使用“相对分子质量”。另外,过去一直以“Dalton”、“D”和“kD”作为分子量的单位,后来也曾有人提出以“u”作为分子量的单位,这些都是不恰当的用法。相对分子质量的单位只能是“1”,而不是“Dalton”,“D”,“kD”或“u”。 至于分子质量,国标中仅给出了一个量符号m,其单位为“kg”和“u”。从理论上说,分子质量应是一个与“原子质量”对应的绝对意义的质量。但在现实中,这样的“分子质量”几乎是不可能得到的,而且在实际工作中也不可能接触和使用它。因此,我们可以不必花费精力去研究它。[/center]

http://ng1.17img.cn/bbsfiles/images/2011/11/201111151115_330562_1609805_3.jpg中国武汉大学的科学家们开发出一种特殊的转基因水稻,有望实现人血清白蛋白的大规模生产
与原子的质量计量一样,分子的质量计量也先后存在3个量名称:相对分子质量、分子质量和分子量。众所周知,分子的质量为组成分子的各原子的质量之合。在日常专业工作中,不论是单质还是化合物,它们的分子质量都是根据各元素原子的个数和各元素的“相对原子质量”(由元素周期表上查到)计算得到。既然元素的相对原子质量是一个单位为“1”的相对质量,那么由此计算得到的分子质量必然也是一个单位为“1”的相对质量。对于某些结构复杂的生物大分子,往往都是通过电泳、离心或色谱分析等方法测得其近似分子质量,因而更是一个相对概念的量值。所以,我们过去长期习惯使用着的“分子量”实际上都是相对的分子质量。因此,国标指出“以前称为分子量”的即是“相对分子质量”(relative molecular mass),并将后者定义为“物质的分子或特定单元的平均质量与核素12C原子质量的1/12之比”。相对分子质量是两个质量之比,也在计算表达形式上进一步明确了“相对”的含义。对于定义中的“特定单元”,主要是指空气等组成成分基本不变的特殊混合物,它们的相对质量可根据其组成成分(N2,O2,CO2,Ar等)的相对分子质量和其在空气中的体积分数计算其平均质量,然后与 12C原子质量的1/12相比即可获得。相对分子质量的量符号为Mr,单位为“1”。 对于过去长期使用的“分子量”,其英文为molecular weight,确切原意为“分子重量”。它既不是质量概念,又没有相对的含意,因而也是一个不够准确和不够科学的量名称。根据国标规定,“分子量”应停止使用,凡过去使用“分子量”的场合都应换以使用“相对分子质量”。另外,过去一直以“Dalton”、“D”和“kD”作为分子量的单位,后来也曾有人提出以“u”作为分子量的单位,这些都是不恰当的用法。相对分子质量的单位只能是“1”,而不是“Dalton”,“D”,“kD”或“u”。 至于分子质量,国标中仅给出了一个量符号m,其单位为“kg”和“u”。从理论上说,分子质量应是一个与“原子质量”对应的绝对意义的质量。但在现实中,这样的“分子质量”几乎是不可能得到的,而且在实际工作中也不可能接触和使用它。
欲建立中药中某一活性成分的荧光检测方法。由于此活性成分结构中无共扼双键,仅在紫外末端有吸收,这样建立紫外分析方法就有点难度了。现在看文献发现此活性物质可以和牛血清白蛋白结合,结合后形成的复合物的荧光强度和活性成分浓度成比例这样是不是可以用牛血清白蛋白结合荧光光度计建立分析方法了?谢谢
谁有三羟甲基氨基甲烷、人血白蛋白的质量标准啊,最好是国家标准PDF。谢谢
我用葡聚糖凝胶过滤后,柱子上前后两个色带很明显,中间还有空白色带,可是收集的前面的大分子的色带上毛细管电泳,还是有小分子的色带,这现象正常吗?我是新手,请各位指教!另外,前面收集的牛血清白蛋白的溶液怎么测它的浓度?文献很多说是用紫外测其吸收,可是我不知道牛血清白蛋白的摩尔吸光系数啊?谁知道啊?在280nm处的。