食品添加剂:亚硫酸盐,主要成分是亚硫酸钠,如果配制100ml 浓度为5ppm的水溶液,怎么配制呢?请各位及时指点!
PE和过硫酸盐溶液在酸性条件下经紫外照射会发生反应吗?多谢各位大虾指点!
[align=center]农药残留硫丹的检测:是购买标准品:SB05-048-2008 正己烷中硫丹溶液标准样品;还是要购买:[/align][align=center]GSB05-1853-2008 苯中α-硫丹溶液标准样品[/align][align=center]GSB05-1854-2008 正己烷中β-硫丹溶液标准样品[/align][align=center]SB05-216-2008 环己烷中硫丹硫酸盐溶液标准样品[/align][align=center]我看GB2763-2016这个标准是α-硫丹、β-硫丹、硫丹硫酸盐这三个物质之各的,那SB05-048-2008 正己烷中硫丹溶液标准样品,这个硫丹是什么?就是三个硫丹的混标吗?[/align]
使用混标测试土壤中硫丹I、硫丹硫酸盐,标样是否会发生价键变化导致色谱峰的个数差异,造成含量不同?
各位大神:土壤中水溶性硫酸盐和酸溶性硫酸盐方法确认,谁有 日常样品测定数据呢?麻烦发来参考一下,谢谢
水质 硫酸盐的测定 火焰[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法Water quality-Determination of sulphate-Flame atomic absorption spectrophotometric methodGB 13196—911 主题内容与适用范围1.1 本标准规定了间接测定水中可溶性硫酸盐的火焰[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法。 1.2 本标准适用于地表水、地下水及饮用水可溶性硫酸盐的测定。1.3 本标准的最低检出浓度为0.4mg/L,测定上限当取样量为10mL时,是30mg/L。当取样虽为1mL时,则是300mg/L。水样适当稀释,测定范围还可以扩大。1.4 Pb2+和PO43-对测定产生于扰,但10μg以下的Pb2+或PO43-可允许存在。2 原理在水-乙醇的氨性介质中,硫酸盐与铬酸钡悬浊液反应。反应式如下:SO42-+BaCrO4→BaSO4↓+CrO42-用[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法测定反应释放出的铬酸根,即可间接算出硫酸盐的含量。所用火焰。为空气-乙炔富燃性黄色火焰,测定波长为359.3nm。3 试剂除非另有说明,分析时均使用符合国家标准或专业标准分析纯试剂,去离子水或同等纯度的水。3.1 盐酸(HCl):ρ=1.19g/mL。3.2 冰乙酸(CH3COOH):ρ=1.05g/mL。3.3 氢氧化铵(NH4OH):ρ=0.880g/mL。3.4 无水乙醇(CH3CH2OH)。3.5 氢氧化铵溶液:1+1。用氢氧化铵(3.3)配制。临用时现配。3.6 混合酸溶液:盐酸(3.1)0.42mL,冰乙酸(3.2)14.7mL混合,用水稀释至200mL。3.7 钙溶液:1mg/mL。称0.28g氯化钙(CaCl2)溶于100mL水中,摇匀。3.8 铬酸钡悬浊液:称0.5g铬酸钡(BaCrO4)溶于200mL。混合酸溶液(3.6)中,贮于聚乙烯瓶中。用前振摇。3.9 硫酸盐标准溶液,SO42-:100mg/L。准确称取无水硫酸纳(Na2SO4,在105℃烘2h)0.0740g,用适量水溶解,转入500mL容量瓶中,用水稀释至标线,摇匀。4 仪器一般实验室仪器和4.1 [url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度计。4.2 铬空心阴极灯。4.3 乙炔的供气装置。4.4 空气压缩机,加除油、水及杂质装置。4.5 过滤器,见下图。过滤装置图1-抽滤瓶;2—10mL比色管;3-带砂芯的玻璃过滤器;4-比色管塞;5-胶盖;6-0.45μm滤膜;7-接抽气泵5 采样及样品水样采集后,立即用0.45μm滤膜抽滤除去悬浮物,贮存于聚乙烯瓶中。6 步骤6.1 试料取10mL水样置于25mL比色管中,如硫酸根含量大于30mg/L,可适量少取样品,然后加水至10mL。6.2 测定6.2.1 前处理:在试料(6.1)中,依次加入铬酸钡悬浊液(3.7)2mL,氢氧化铵溶液(3.5)1mL,钙溶液(3.6)1mL,无水乙醇(3.4)8mL,加水至标线,摇匀。放置30min后,用0.45μm滤膜抽滤(装置见图1)于10mL干燥比色管中,备测。6.2.2 测定:遵照仪器使用说明书调节仪器至最佳工作条件,测定滤液的吸光度。6.3 校准曲线的绘制在一组25mL比包管中,加入硫酸盐标准溶液0,0.50,1.00,1.50,2.00,2.50,3.00mL,然后按步骤(6.2.1)进行前处理,并按(6.2.2)中的条件测定其吸光度。用减去空白的吸光度与相对应的硫酸盐浓度(mg/L)绘制校准曲线。7 分析结果的表述7.1 硫酸盐含量,由下式给出:式中:c——试样中硫酸盐的浓度,mg/L;c/——由样准曲线上查得的浓度,mg/L;V——所取试样的体积,mL;25——比色管的体积,mL。7.2 硫酸盐含量,用回归方程计算。8 精密度和准确度八个实验室测定了三个不同浓度水平的统一样品,硫酸盐含量分别为:4.83,10.5,25.7mg/L。8.1 重复性重复性相对标准倡差分别为:3.69%、3.65%和2.65%。8.2 再现性再现性相对标准偏差分别为:7.98%、3.84%和4.07%。8.3 准确度相对误差分别为:+1.45%、-2.86%和-1.56%。附加说明:本标准由国家环境保护局科技标准司标准处提出。本标准由中国环境监测总站负责起草。本标准主要起草人刘京、魏复盛。本标准委托中国环境监测总站负责解释。
亚硫酸盐 (Sulfites或SulfitingAgents)为使用多年之合法食品添加物,不仅是非常有效的酵素抑制剂、漂白剂、抗氧化剂、还原剂及防腐剂,且价格便宜。亚硫酸盐最早被使用之纪录是在罗马帝国时代,当时是被用於葡萄酒容器之消毒杀菌。 此外,许多食品均含有天然存在之亚硫酸盐,尤其是在各种醱酵食品中。亚硫酸盐具有杀菌功效及强还原力,可将食品的著色物还原漂白,并可抑制氧化作用,防止酵素与非酵素褐变反应。合法添加於食品之亚硫酸盐包括:亚硫酸钠 (Sodium Sulfite,Na2SO3)、亚硫酸钾 (Potassium Sulfite, K2SO3)、亚硫酸氢钠 (Sodium Bisulfite,NaHSO3)、亚硫酸氢钾 (Potassium Bisulfite, KHSO3)、偏重亚硫酸氢钠 (SodiumMetabisulfite, Na2S2O5)、偏重亚硫酸氢钾 (Potassium Metabisulfite, K2S2O5)、低亚硫酸钠(Sodium Hydrosulfite,Na2S2O4)。亚硫酸盐广泛使用於脱水蔬菜、脱水水果、动物胶、糖蜜、糖飴、糖渍果实、虾类、贝类、水果酒、淀粉等產品中,常见市售添加亚硫酸盐的產品则包括:金枣、凤梨乾、脱水香蕉、葡萄乾、杏乾、柿饼、脱水金针、洋菇、笋乾、榨菜、绿豆芽、枸杞等。 二氧化硫是酚氧化酶的化学性抑制剂,同时也会与羰基化合物作用,所以当此类化合物存在时,必须加入过量之二氧化硫与其作用,方能将酚氧化酶之活性去除。以二氧化硫抑制酚氧化酶為一不可逆反应,将过量之二氧化硫去除时(如:漂水过程),酚氧化酶之活性亦无法恢复。但採用漂水过程时,应特别注意可溶性物质之流失,以免影响成品率。 产品内部若有空气存在,少量之氧气亦可造成褐变。因此,使用二氧化硫作為抑制剂时,必须考量二氧化硫之渗透。游离态 (自由态) 之二氧化硫(Free Sulfite) 较亚硫酸盐溶剂所形成之二氧化硫溶液更具有渗透性,亦可使用真空所产生之内外压差将二氧化硫强制渗透进入产品内部。 二氧化硫易溶於水而生成H2SO3,且一旦与硷作用则会转变為SO32-、HSO3-、S2O52-。这些无机亚硫酸盐离子在水溶液中会形成平衡状态,其个别存在之浓度则视pH值而定 (Green, 1976; Joslyn and Braverman, 1954)。其简单化学变化方程式如下: 一般食品之pH范围在3~7左右,大部份之亚硫酸盐是以HSO3-状态存在。唯有在很低之pH值下,SO2才会生成。pH值会影响食品内游离态与结合态 (Combined Sulfites)之亚硫酸盐之比例变化,游离态之亚硫酸盐随pH值降低而增加,若能控制pH值就可以控制食品内之亚硫酸盐残存量 。 亚硫酸盐经氧化后会形成无毒之硫酸盐,而在pH值小於4之食品,其所添加之亚硫酸盐会以SO2形态挥发而散失,尤其是在加热情况下。在许多食品中,仅有一小部份所添加之亚硫酸盐是以游离态之无机亚硫酸盐形态存在。 将亚硫酸盐添加于食品中,其变化之情况系与食品之化学特性、加工方法与程度、储存状态与时间、包装材料之渗透性及亚硫酸盐之添加量等因素相关。亚硫酸盐能与食品中许多成份(还原糖、醛类化合物、酮类化合物及蛋白质等)进行稳定反应,而形成各种型式的结合态亚硫酸盐。此外,在加工处理及贮存过程中,亚硫酸盐非常容易与食品中其他成份產生反应,而形成各种亚硫酸盐之有机化合物,一旦亚硫酸盐与其他有机成份结合后,就失去其特定作用,而使得亚硫酸盐之用量随產品种类而异。 二氧化硫在酸性情况下才会產生漂白及杀菌功效,其二氧化硫含量须在4,000 ppm以上才具有防腐效果。二氧化硫浓度过低时,则无法抑制微生物生长;而当二氧化硫浓度过高时,则果胶质之分解速度加快,致使组织软化,且具有刺激性气味。 亚硫酸盐残留量明显受到食品种类 (成份特性)、加工方法及贮存条件 (温度、时间..等)之影响,因此亚硫酸盐在加工过程之用量与成品之残留量亦非常难订定一合理标準。一般蜜饯业者相信漂水过程可以大幅降低亚硫酸盐残留量,甚至完全除去亚硫酸盐。实际上,漂水过程仅能去除游离态之亚硫酸盐。
硫酸盐检测方法详解 硫酸盐在地壳中是一种丰富的组份,由于石膏、硫酸钠及某些页岩的溶出,使水中含量 甚高。硫化矿经氧化使矿山排水含硫酸盐很高,含硫有机物及排放工业废水均为硫酸盐的 来源,天然水中的浓度可由数mg/L至数千mg/L。水中的亚硫酸盐可氧化为硫酸盐,而硫酸 盐在缺氧的条件下可还原为硫化物。 饮用水中硫酸盐浓度过高,易使锅炉和热水器结垢,产生不良的水味。当硫酸盐浓度为 300-400mg/L时,多数饮用者开始察觉有味。在有镁离子或钠离子存在时,硫酸盐超过 250mg/L时有轻泻作用。根据饮用者味觉的敏感度,味觉阈为300~1000mg/L。WHO基于 味觉的考虑,饮水中硫酸盐控制浓度为400mg/L。 测定硫酸盐的方法有称量法、EDTA容量法、硫酸钡比浊法、硫酸苯肼法、亚甲蓝比色法、 络合比色法、甲基麝香草酚蓝自动比色法、难溶性钡盐比色法、[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]间接法及[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url] 法等。称量法为经典方法,手续繁琐且不能测定浓度低于lOmg/L的硫酸盐,目前在常规分 析中已较少应用。硫酸钡比浊法可测40mg/L以下的硫酸盐,但反应条件苛刻,近年来对加 入试剂的方式加以改进,获得较好精密度。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法是目前测定硫酸盐较好的方法,但设 备较昂贵,尚不能在基层水质分析室推广使用。难溶性钡盐比色法,属于这类方法的有铬酸 钡比色法、钼酸钡法、二羟甲苯醌(DHTQ)钡比色法及四氯化醌酸钡比色法。我国幅员辽阔, 各地天然水中所含硫酸盐浓度差别很大,可由数mg/L至数百mg/L,因此所选用的分析方法 应能满足多种情况的需要。 水样保存:ISO规定,硫酸盐水样在冷藏条件下可稳定7~28天。北京市卫生防疫站把 自来水及清洁地面水在4℃及30℃下保存37天,硫酸盐浓度并无明显变化,在冷藏条件所 得结果与ISO基本一致,见表17.1。 1.5.2过滤:在水质分析中,常用滤纸、玻璃砂芯滤器、古氏坩埚等过滤水样。 (1)滤纸分为定性滤纸与定量滤纸,用棉花等纤维制成。常用的有直径为5.5,7,9,12.5 及15cm等规格。 ①定性滤纸:定性滤纸含硅、铁、铅等杂质,灼烧后灰分多,供一般过滤用,不能用于常规 定量分析及微量金属分析。常用的定性滤纸分快速、中速及慢速三种。 ②定量滤纸:分为单洗及双洗两种。单洗定量滤纸已经过盐酸处理,除去铁及无机盐等 杂质,但灼烧后灰分仍较高,不适合精密分析用。双洗定量滤纸是用盐酸和氢氟酸处理过 的,除去了硅酸盐、金属等杂质,并用纯水洗净。每一小张滤纸灼烧后,灰分一般0.01mg,但因厂牌、批号不同,铅、铁等杂质的含量也有差异,用于测定微量金属,使用前还需用稀盐 酸、稀硝酸及纯水依次洗涤。定量滤纸分快速、中速、慢速三种;过去称为白带、蓝带与红带, 孔径分别为80-120,30-50和1~3μm。 滤纸的选择应根据沉淀粒度而定。过滤细微沉淀(如硫酸钡)不能用孔径大的滤纸,大 颗粒沉淀亦不能用慢速滤纸。选择滤纸大小系根据沉淀量而不依溶液体积多少,沉淀的体 积不能超过滤液容积的一半。如溶液体积大而沉淀又少时要用小滤纸。对微量分析尽可能 用较小的滤纸,以减少由滤纸沾污而引起的误差。 根据滤纸的大小选择合适的漏斗,放入的滤纸应比漏斗边缘约低1cm,不容许高出漏 斗,以免因张力作用,使沉淀溢出漏斗而损失。折叠滤纸时应避免沾污滤纸,这对微量分析 更为重要。强酸或强碱溶液不能用滤纸过滤。
对苯二胺硫酸盐、间苯二胺硫酸盐、邻苯二胺硫酸盐,用液相色谱C18柱能用吗?应配怎样的流动相? 它们的稀水溶液PH值在2-3左右。我用硫酸调流动相PH到2左右出两个峰。 又用三乙胺调PH到7多点还是两个
硫酸盐 量取8.5 ml (10g)样品,加0.2 ml无水碳酸钠溶液(50g/L),在水浴上蒸干.残渣溶于15 ml水中,加0.5 ml盐酸溶液(20%)后,按GB9728-88之规定测定,溶液所呈浊度不得大于标准比对溶液. 标准比对溶液的制备是取0.2 ml无水碳酸钠溶液(50g/L)及含下列数量的硫酸盐标准溶液: 优级纯……………………………0.01mgSO4 分析纯……………………………0.02mg SO4 化学纯……………………………0.05mg SO4. 稀释至15 ml水,与同体积试液同时同样处理
如何配制?混不匀如何解决呢?生活饮用水硫酸盐标准曲线浓度点如何选择,按方法选择?
想问下饮用水的硫酸盐做曲线的时候应该注意一些什么,我做出来的硫酸盐不成曲线,试剂和标准溶液都是从新配置的,求回复

需要测定供试品中的硫酸盐含量,下面是药典上的标准,请大家帮忙看看,然后请教几个问题:1. 过程中保持pH为11的操作如何实现?还需要用pH计指示么?如果低于10.5,还需要加入氨水?2. 这个测定的原理不清楚,看了看书还不明白,请教一下,该反应用酞紫指示剂主要指示的是什么物质的pH变化范围?3. 测定结果使用空白消耗的滴定液数-供试品消耗的滴定液数的原理是什么?氯化钡起到什么作用?4. 标准里面使用EDTA.2Na作为滴定液,为什么还写“每1ml氯化钡滴定液(0.1mol/L)相当于9.606mg的硫酸盐”?为什么不是“每1mlEDTA.2Na滴定液(0.05mol/L)相当于9.606mg的硫酸盐”?5. 我们测定过程中,紫色始终不消退,是何原因?而即使很早加入乙醇(刚开始滴定1~2ml),溶液立刻由紫色变为无色,没有中间蓝紫色的过程,请问可能是什么原因?6. 加入的乙醇作用是什么呢?非常感谢![img]http://ng1.17img.cn/bbsfiles/images/2008/08/200808301456_106457_1621520_3.jpg[/img]
国标分析中,工业用合成盐酸里硫酸盐含量测定采取的是硫酸钡比浊法,其中需要将试样加热蒸发至分解,只留下少许的残渣,然后再加入盐酸标准溶液溶解残渣。现在想问:加热分解试样的目的是什么?是不是为了去除盐酸,使之挥发?(因为其酸度较高)还有有其他的因素?
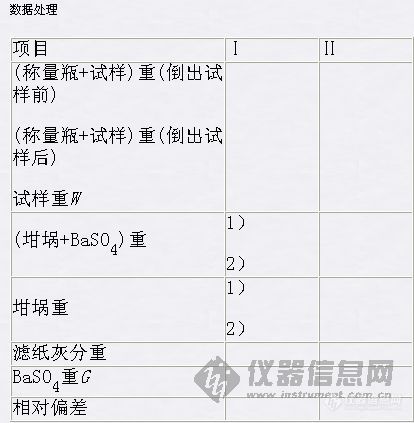
可溶性硫酸盐中硫的测定目的原理实验目的 1. 了解晶形沉淀的沉淀条件、原理和沉淀方法;2. 练习沉淀的过滤、洗涤和灼烧的操作技术;3. 测定可溶性硫酸盐中硫的含量,并用换算因数计算测定结果。实验原理测定硫酸根所用的经典方法,都是用Ba2+离子将SO42-离子沉淀为BaSO4沉淀经过滤、洗涤和灼烧后,以BaSO4形式称量,从而求得S或SO42-离子含量,但费时较多。用各种滴定分析方法进行测定,准确度均不及重量法,精密度也不太好。多年来,分析工作者对重量法测定SO42-离子曾作过不少改进,克服了烦琐、费时的缺点,因此重量法仍为一种较准确而重要的标准方法。BaSO4的溶解度很小Ksp = 8.7×10-11,100ml溶液中在25℃时仅溶解0.25mg,在过量沉淀剂存在下,溶解度更小,一般可以忽略不计。BaSO4性质非常稳定,干燥后的组成与分子式符合。但是BaSO4沉淀初生成时,一般形成细小的晶体,过滤时易穿过滤纸,引起沉淀的损失,因此进行沉淀时,必须注意创造和控制有利于形成较大晶体的条件。为了防止生成BaCO3、Ba3(PO4)2(或BaHPO4)及Ba(OH)2等沉淀,应在酸性溶液中进行沉淀。同时适当提高酸度,增加BaSO4的溶解度,以降低其相对过饱和度,有利于获得颗粒较大的纯净而易于过滤的沉淀,一般在0.05mol/L左右HCl溶液中进行沉淀。溶液中也不允许有酸不溶物和易被吸附的离子(如Fe3+、NO3-等离子)存在,否则应预先予以分离或掩蔽。Pb2+、Sr2+ 离子干扰测定。应用玻璃砂芯坩埚抽滤BaSO4沉淀,然后烘干、称重,这样可缩短分析时间,其准确度比灼烧法稍差,但可用于工业生产的快速分析。用BaSO4重量法测定SO42-离子这一方法应用很广。磷肥、萃取磷酸、水泥以及有机物中硫含量等都可用此法分析。仪器药品瓷坩埚2只,坩埚钳1把。2mol/dm3 1% HCl溶液,10% BaCl2溶液,0.1mol/ dm3AgNO3溶液,6mol/ dm3溶液,定性滤纸 (7-9cm)1张,定量滤纸。过程步骤 准确称取在100-120℃干燥过的试样0.2-0.3g ,(有些水合盐类试样不能放放烘箱中干燥。本实验可用无水芒硝Na2SO4作试样。)置于400ml烧杯中,用水25ml溶解,(若有水不溶残渣,应该将它过滤除去,并用稀盐酸洗涤残渣数次,再用水洗至不含Cl-离子为止。)加入2mol/dm3HCl溶液5ml,用水稀释至约200ml。加热至沸,在不断搅拌下逐滴滴加5-6mL10%热BaCl2溶液。为了控制晶形沉淀的条件,除试液应稀释和加热外,沉淀剂BaCl2溶液也可先加水适当稀释并加热。试样中若含有Fe3+离子等干扰离子,在加BaCl2溶液沉淀之前,可加入1%EDTA溶液5ml加以掩蔽。静置1-2min让沉淀沉降,然后在上层清液中加1-2滴BaCl2溶液,检查沉淀是否完全。此时若无沉淀或浑浊产生,表示沉淀已经完全,否则应再加1-2ml BaCl2稀溶液,直至沉淀完全。然后将溶液微沸10min,在约90℃保温陈化约1h。冷至室温,用慢速定量滤纸过滤,再用热蒸馏水洗涤沉淀至无Cl-离子为止。检查洗液中有无Cl-离子的方法是加硝酸酸化了的AgNO3溶液,若无白色浑浊产生,表示Cl-离子已洗尽。将沉淀和滤纸移入已在800—850℃灼烧至恒重的瓷坩埚中,烘干、灰化后,再在800—850℃下灼烧至恒重。坩埚放入电炉前,应用滤纸吸去其底部和周围的水,以免坩埚因骤热而炸裂。沉淀在灼烧时,若空气不充足,则BaSO4易被滤纸的碳还原为BaS,将使结果偏低,此时可将沉淀用浓H2SO4润湿,仔细升温,灼烧,使其重新转变BaSO4。根据所得BaSO4质量,计算试样中含硫(或SO3)的百分率。 [img]http://ng1.17img.cn/bbsfiles/images/2007/03/200703211338_45787_1632583_3.jpg[/img]分析思考1 重量法所称试样重量应根据什么原则计算?加10%BaCl2溶液5-6ml沉淀剂用量应该怎样计算?如果用H2SO4沉淀Ba2+离子,H2SO4用量应如何计算?2 为什么试液和沉淀剂都要预先稀释,而且试液要预先加热? 3 加入沉淀剂后,沉淀是否完全,应如何检查?沉淀完毕后,为什么要保温放置一段时间后才进行过滤?4 洗涤至无Cl-离子的目的和检查Cl-离子的方法如何?为什么要控制在一定酸度的盐酸介质中进行沉淀?5 用倾泻法过滤有什么优点?6 什么叫恒重?怎样才能把灼烧后的沉淀称准?7 用SO3表示硫酸根的含量(百分率),应如何计算?
求硫酸盐标准溶液的标定方法。最近在做方法验证,需要用到这个标准溶液滴定。但是找不到标定的方式。
谁知道土壤中硫酸盐的含量是多少,或者是谁做过土壤中的水溶性硫酸盐和酸溶性硫酸盐,能告诉一下数值吗?
做了好几次饮用水的硫酸盐标准曲线,在加入硫酸盐标准溶液,3ml,4ml,6ml,8ml,10ml的吸光值都差不多是0.1左右,不知道,问题出来在哪。,就低溶度的有呈现线性相关,刚刚又做了一下,10ml的吸光值为0.1964,8ml的为 0.0744,崩溃
科里有六支硫酸盐单标的标准样品,是为了计量认证练习而在环保部标样研究所买的,以前都是使用无机盐ABC混合标样的。前段,同事想做下这个项目的练习,刚一加了指示剂还没滴定就变颜色了,仔细看了一下说明书,原来只可以用比色法,这也怪我了,没仔细看说明书,在购买之前,没有问仔细,可是如果想生产这种单标的标准物质,为什么不能多考虑一下呢,因为某种项目的分析方法并不只有一种啊。
按照空气和废气监测分析方法(第四版增补版)中的碱片-[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定硫酸盐化速率,计算公式硫酸盐化速率=(W-1/2W0)*0.0833/S.n公式中的这个W0是表示空白溶液中硫酸根离子含量,实验过程是测定了两个空白,那么这个W0是代表两个空白的平均值,还是两个空白的总和呢?
大家好,我在做总磷测试时,需要配置钼酸盐溶液,但是我按照要求配了五六次还是不成功,请大帮我分析分析,我的目前的配置操作步骤如下: 1、取13g钼酸铵溶解到100ml 2、取0.35g酒石酸锑钾溶解到100ml 3、取300ml分析纯硫酸放冰箱冰泠 4、把冰冷的硫酸拿出,将钼酸铵溶液缓慢搅拌加入硫酸中,然后再加酒石酸锑钾溶解,混匀后放冰箱冷藏,但是没过一会儿我再去看就发现变淡蓝色了。 这是怎么回事呢,请大家赐教,谢谢!
DPD(对氨基-N-N-二乙基苯胺硫酸盐)试剂氧化了,配的溶液都是红的。是因为见光还是夏天温度太高了

做过离子色谱的同志们都知道,这个项目比较简单,只要仪器调试的好,基本上不用费太大劲就能做得很好。相对其他项目来水准确度也比较高,这是我参加工作来第一个独立检测的大仪器(以前用的仪器基本就是分光)。感觉只要在配置标准曲线时认真点,其他的影响因素不是很大,相关系数做到三个9以上很容易,有时候还能做到四个9。1.方法标准:GB/T5750.10-2006 3.2离子色谱法2.试剂以及仪器条件2.1 淋洗液(浓缩液100倍:):碳酸钠(优级纯)4.77g+碳酸氢钠(优级纯)0.672g溶于100mL纯水中。2.2 淋洗液使用液(0.8mMNa2CO3+4.5mMNaHCO3):2.1溶液稀释100倍。2.3 氟化物、氯化物、硝酸盐、硫酸盐标准溶液(1000mg/L)。2.4 色谱仪:戴安 ICS-90http://ng1.17img.cn/bbsfiles/images/2013/09/201309231557_466557_2397801_3.jpg2.5 色谱柱:AS23分析柱+AG23保护柱(配有柱温箱)http://ng1.17img.cn/bbsfiles/images/2013/09/201309231607_466563_2397801_3.jpg2.6 检测器:ASRS3002.7 流速:1.2mL/min2.8 定量环:10μL3.分析步骤3.1 开机后,走基线至稳定约为40~60min3.2 按照如下方法标准曲线系列,混标,氯化物和硫酸盐的使用液为1000mg/L,氟化物和硝酸盐的使用液为100mg/L,纯水定容体积100mL。http://ng1.17img.cn/bbsfiles/images/2013/09/201309231535_466535_2397801_3.jpg下图为配制标准曲线的所有东西。从左到右,1.是定容后的标准溶液存放的容器;2.两个棕色100mL的容量瓶是加标用的;3.中间5个容量瓶是配制混合标准曲线的100mL容量瓶;4.两个白色小塑料瓶是放淋洗液浓缩液的;5.右边两套是存放氟化物和硝酸盐-氮中间液的容量瓶以及和标液一样的存放储备液的瓶子;6.是所有要用到的移液管、刻度吸管;7.是四个离子的标准溶液各一支。http://ng1.17img.cn/bbsfiles/images/2013/09/201309231553_466555_2397801_3.jpg注:1.在做加标回收率试验的时候,一定要两个项目一起,分开做,四个一起加到水样中是绝对不行滴~我现在做就是氯化物和硫酸盐一起加,氟化物和硝酸盐-氮一起加。 2.关于有效数字的问题,我们目前的水样中氟化物和硝酸盐-氮含量较低,所以保留小数点后两位;氯化物和硫酸盐含量一般在10.0mg/L以上,所以保留小数点后一位,这样差不多都是三位有效数字。
在我配置的溶液中,主要含有磷酸二氢钾、硝酸钾、六水氯化镁三种物质,然后采用[b][color=#33cc00]铬酸钡光度法[/color][/b]进行测定硫酸盐含量:[b][color=#ff0000]实验1[/color][/b]:①先加入硝酸钾,②再加入六水氯化镁、③最后加入磷酸二氢钾发现过滤后溶液①②显色为无色,而③是黄色(即有一定的吸光度)[b][color=#ff0000]实验2[/color][/b]:①先加入磷酸二氢钾,②再加入六水氯化镁、③最后加入硝酸钾发现过滤后溶液①显色为黄色,而②③也都是黄色[b]这是不是说明磷酸二氢钾也会干扰硫酸盐的测定呢?但是标准上并无说明啊[b]?[/b]只说了碳酸盐会干扰。[/b]求助!谢谢大佬们!
[font=&][color=#333333]硫酸盐水质检测方法主要包括以下步骤,这些方法通常基于硫酸根离子与氯化钡在酸性条件下反应生成硫酸钡沉淀的原理进行:[/color][/font][font=&][color=#333333]一、检测原理[/color][/font][font=&][color=#333333]在酸性溶液中,氯化钡与硫酸根离子定量地产生硫酸钡沉淀。通过测量生成的硫酸钡沉淀的质量,可以计算出水样中硫酸根离子的含量,从而确定硫酸盐的含量。[/color][/font][font=&][color=#333333]二、所需仪器与试剂[/color][/font][font=&][color=#333333]仪器:[/color][/font][font=&][color=#333333]恒温水浴[/color][/font][font=&][color=#333333]高温炉(0-1000℃)[/color][/font][font=&][color=#333333]干燥箱[/color][/font][font=&][color=#333333]瓷坩埚[/color][/font][font=&][color=#333333]分析天平[/color][/font][font=&][color=#333333]坩埚式过滤器(孔径5-15μm)[/color][/font][font=&][color=#333333]试剂:[/color][/font][font=&][color=#333333]盐酸溶液(1+1)[/color][/font][font=&][color=#333333]硝酸[/color][/font][font=&][color=#333333]甲基橙指示剂(1g/L)[/color][/font][font=&][color=#333333]氯化钡溶液(100g/L)[/color][/font][font=&][color=#333333]硝酸银溶液(用于检验氯离子是否除尽)[/color][/font][font=&][color=#333333]三、检测步骤[/color][/font][font=&][color=#333333]取样与预处理:[/color][/font][font=&][color=#333333]准确量取经慢速定量滤纸过滤后的水样100200mL(含硫酸根离子约1040mg)于烧杯内。[/color][/font][font=&][color=#333333]加入几滴甲基橙指示剂,滴加盐酸(1+1)使水样溶液变红后,再过量2mL,加三级试剂水至200mL。[/color][/font][font=&][color=#333333]沉淀生成:[/color][/font][font=&][color=#333333]煮沸水样5min,以去除水中的二氧化碳等干扰物质。[/color][/font][font=&][color=#333333]在不断搅拌下,徐徐滴加10mL约80℃的氯化钡溶液,直至溶液上部澄清液不再出现白色浑浊,说明硫酸盐已沉淀完全。再多加2mL氯化钡溶液以确保沉淀完全。[/color][/font][font=&][color=#333333]将烧杯放在80~90℃水浴中,加热2h,使沉淀陈化,便于后续过滤。[/color][/font][font=&][color=#333333]过滤与洗涤:[/color][/font][font=&][color=#333333]用已于105℃干燥至恒重的坩埚式过滤器过滤沉淀,用热的三级试剂水洗涤烧杯和沉淀,直至滤液加一滴硝酸银溶液不产生浑浊为止(确保氯离子已除尽)。[/color][/font][font=&][color=#333333]干燥与称重:[/color][/font][font=&][color=#333333]将坩埚式过滤器在105℃干燥0.5h,如此反复操作,直至恒重(两次称量之差不超过0.4mg)。[/color][/font][font=&][color=#333333]准确称量沉淀的质量(m4),用于后续计算。[/color][/font][font=&][color=#333333]结果计算:[/color][/font][font=&][color=#333333]根据公式p=[(m-m0)M1/VM2]×10^6(其中m为沉淀质量,m0为坩埚质量,M1为硫酸钡的摩尔质量,V为水样体积,M2为硫酸根的摩尔质量)计算出水样中硫酸盐的含量(以质量分数%表示)。[/color][/font][font=&][color=#333333]四、注意事项[/color][/font][font=&][color=#333333]酸度控制:保持溶液适当的酸度是防止其他沉淀生成的关键。通常,溶液的pH值应控制在1左右。[/color][/font][font=&][color=#333333]沉淀完全性:确保硫酸盐完全沉淀是准确测量的前提。可通过观察溶液是否澄清和过量加入氯化钡来验证。[/color][/font][font=&][color=#333333]洗涤彻底性:洗涤过程中应确保沉淀表面无残留物,以免影响称量结果。[/color][/font][font=&][color=#333333]灰化与灼烧:灰化过程中不得出现火焰,灼烧时温度不得高于900℃,以防沉淀分解。[/color][/font][font=&][color=#333333]干扰因素:注意水样中可能存在的磷酸盐、聚磷酸盐、悬浮物、硝酸盐、亚硫酸盐和二氧化硅等干扰因素,必要时采用适当的方法进行消除或校正。[/color][/font]
最近监测了一个矸石山的监测井,溶解性总固体2680,硫酸盐3520,硫酸盐是用离子色谱做的,不知道是什么原因?请各位老师解惑 ~~
[font=&][color=#333333]硫酸盐: 取本品0.5g,依法检查([/color][/font][font=&][color=#333333]中国药典2000年版二部附录VIII B[/color][/font][font=&][color=#333333]),与标准硫酸钾溶液1.5ml制成的对照液比较,不得更浓(0.029%)。步骤:称取0.5g样品用水溶解至约40ml,转移至50ml比色管中,加入稀盐酸2ml,摇匀。 对照:取1.5ml标准硫酸钾溶液于50ml比色管中,加水约40ml,摇匀。分别于对照和样品中加入25%氯化钡5ml,加水定容至刻度,放置10分钟。从上向下观察在此试验中遇到一些问题想请教一个各位,①有时在添加稀盐酸的时候会出现少量的絮状物,同样操作有时候却没有,是什么情况。②在加入氯化钡之后样品会出现大量的絮状物又是是什么原因?③在前两个问题不存在的情况下,样品定容完没有絮状物,但是与对照进行对比的时候不如对照清澈,比对照颜色浓。是对照的问题还是样品本身含量就高?如果是对照的问题有没有其他的溶液可以代替硫酸钾做对照?求大佬告知[/color][/font]
测总磷用的钼酸盐溶液,在钼酸铵溶液倒入硫酸溶液后,溶液变黄色透明,这是为什么?一般来说不应该是无色透明的吗?
盐酸副玫瑰苯胺比色法测定亚硫酸盐方法的要点及改进 盐酸副玫瑰苯胺比色法测定食品中的亚硫酸盐残留量是食品卫生理化国标检验方法中的第一法( GB/ T5009. 34 -1996) ,它灵敏、准确,但是它对于水不溶性样品检测时间太长,同时方法未给出关键试剂盐酸副玫瑰苯胺溶液中盐酸浓度范围等,给实际操作带来很大的不便。相据笔者的摸索及实践经验,进行了改进。现报告如下:1 水不溶性固体样品的前处理前处理时间按标准规定水不溶性的固体样品粉碎研磨浸泡至少4h 后才能过滤测定(以使二氧化硫完全被吸收) ,整个实验过程最短也要5h 以上,如果能将水不溶性的固体样品的前处理方法加以改进,实验时间将会大大缩短。笔者用振荡法或超声波法对几种水不溶性固体样品进行不同时间的处理,同时与浸泡法进行了对比,结果见表1。表1 不同前处理方法测定亚硫酸盐残留量(以SO2 计,g/ kg) 结果对比样品名称浸泡5h 超声40min 振荡50min话梅1. 27 1. 28 1. 29情人梅1. 71 1. 75 1. 72话梅肉0. 67 0. 65 0. 69山楂糕0. 12 0. 13 0. 11冬瓜蜜饯0. 77 0. 79 0. 75银耳6. 02 6. 00 5. 95竹笋4. 23 4. 18 4. 20竹荪9. 29 9. 34 9. 32干辣椒0. 080 0. 078 0. 069 对表1 中数字进行统计学处理,浸泡5h 与超声40min 两方法之间经t 检验, P 0. 05 ,两法测定的结果无显著性差异 同时浸泡5h 与振荡50min 两方法之间经t 检验, P 0. 05 ,两法结果也无显著性差异。所以,对于水不溶性的固体样品,可以用超声法(40min) 、或振荡法(50min) 来代替浸泡法进行样品前处理。2 实验关键试剂盐酸副玫瑰苯胺比色法涉及的试剂有多种,其中盐酸副玫瑰苯胺和二氧化硫标准是两个最关键的试剂。2. 1 二氧化硫标准液 二氧化硫标准液容易氧化变质,经实验,新标定的1. 142mg/ ml 二氧化硫标准溶液避光存放冰箱的条件下,可稳定一个月,一个月后必须重新标定。实验结果见表2。表2 二氧化硫标准贮备液存放时间对吸光度值的影响时间1μgSO2标准吸光度2μgSO2标准吸光度4μgSO2标准吸光度一个月前配制0. 002 0. 030 0. 076新配制0. 034 0. 067 0. 1412. 2 盐酸副玫瑰苯胺溶液 盐酸副玫瑰苯胺溶液中的盐酸浓度对实验结果影响非常大,酸度大,比色颜色浅,灵敏度低 酸度低,比色颜色深,灵敏度高,同时空白值也高。但标准方法中未给出调节盐酸副玫瑰苯胺溶液颜色的盐酸用量范围,仅仅指出用肉眼观察颜色变化(由红变黄) ,在实际操作中笔者曾几次因显色剂酸度问题导致实验失败。所以有必要找到一个合适的盐酸副玫瑰苯胺溶液盐酸酸度范围,使实验空白值低、灵敏度又满足要求,为此笔者进行了不同盐酸浓度下标准和空白吸光度值的对比实验,结果见表3 和图1。表3 盐酸副玫瑰苯胺溶液中盐酸的浓度与吸光度的关系盐酸浓度(mol/ L)显色剂颜色空白吸光度4.μgSO2标准吸光度减空白后吸光度0. 20 浅黄色0. 298 0. 459 0. 1610. 30 黄色0. 338 0. 372 0. 0340. 40 黄色0. 251 0. 303 0. 0520. 50 黄色0. 089 0. 254 0. 1650. 60 黄色0. 076 0. 230 0. 1540. 70 黄色0. 062 0. 202 0. 1400. 80 黄色0. 054 0. 186 0. 1320. 90 黄色0. 046 0. 168 0. 1221. 00 黄色0. 043 0. 158 0. 115 注:表2 中盐酸的浓度是指加到盐酸副玫瑰苯胺溶液中盐酸的用量换算之后的浓度。图1 中标准吸光度为减去空白吸光度后的值。图1 不同酸度的盐酸副玫瑰苯胺溶液对空白和标准吸光度值测定的影响0 6 7 中国卫生检验杂志2003 年12 月第13 卷第6 期 Chinese Journal of Health Laboratory Technology 20031December1131No16© 1995-2005 Tsinghua Tongfang Optical Disc Co., Ltd. All rights reserved.2. 2. 1 从图表中可以看出盐酸副玫瑰苯胺溶液中盐酸介质的浓度在0. 50mol/ L、0. 60mol/ L 时灵敏度高,但空白值也高(0.089、0. 076) ,盐酸副玫瑰苯胺溶液中盐酸介质的浓度在0.70mol/L - 1. 0mol/ L 之间空白吸光度较低(0. 062 - 0. 043) 并且灵敏度较高,所以配制0. 02 %的盐酸副玫瑰苯胺使用溶液时,可吸取0. 1 %盐酸副玫瑰苯胺溶液20ml 后直接加入一定量的(1/ 1) 盐酸使盐酸的浓度为0. 70mol/ L - 1. 0mol/ L 之间即可使用。实践证明使用同一个合适酸度的盐酸副玫瑰苯胺溶液,用新标定的标准溶液做标准曲线,环境条件、仪器条件相对稳定的前提下,可以使用相对较长一段时间(更换盐酸副玫瑰苯胺溶液时,再重新标定标准溶液,绘制新的标准曲线) 。2. 2. 2 0. 20mol/ L 空白及标准吸光度较0. 30mol/ L 的空白及标准吸光度高,是因为在反应体系中由于酸度的降低,盐酸副玫瑰苯胺本身结构改变颜色发生变化所致。3 标准曲线线性范围国标方法中规定标准曲线的线性范围是从0 - 4μg 二氧化硫,经过实验线性范围可延伸到10μg 二氧化硫,结果见表3。表3 盐酸副玫瑰苯胺比色法测定二氧化硫残留量标准曲线标准含量(μg) 0. 00 0. 40 0. 80 1. 20 1. 60 2. 00 3. 00 4. 00 6. 00 8. 00 10. 00吸光度值0. 000 0. 012 0. 027 0. 040 0. 061 0. 067 0. 107 0. 141 0. 222 0. 292 0. 368 线性范围的扩大对于高含量样品可减少稀释带来的误差。本文根据笔者的实际经验和摸索,对盐酸副玫瑰苯胺比色法测定食品中的亚硫酸盐残留量提出了改进意见,会给实际操作者带来一定的益处。参考文献[1 ] 中华人民共和国国家标准,食品卫生检验方法,理化部分,食品中亚硫酸盐残留量的测定方法GB/ T5009. 32 - 1996.(收稿日期:2003206230)
标样的证书丢失了,现在急求水质砷标样 GSBZ50004-88 批号:200439,水质铜 批号201125,水质硫酸盐 批号:201928 水质氨氮 批号:200576 的浓度与不确定度,另外计量认证有个水中氨氮考核,质控样浓度查到有35.2 与2.00mg/l的,求另外一个浓度,请知道的大虾告知,万分感谢!