[center]FDA批准10年来首个新型静脉注射用抗高血压药[/center]The Medicines公司8月4日宣布,美国FDA已批准其静脉注射用制剂丁酸氯维地平(clevidipine butyrate,Cleviprex)注射用乳剂在不适用或不希望使用口服制剂的情况下用于高血压的治疗。本品是10年来美国FDA批准的首个新型静脉注射用抗高血压药。 本品作为1种新型静脉注射用抗高血压药,代表了当前高血压治疗中的一大进步,其可以在危重病护理中快速、精确地控制血压。来自急诊室、手术室和重症监护室的综合资料显示,本品将成为医生控制患者血压时的重要选择手段。 本品可迅速起效,可用于精确控制血压。与现有静脉注射用抗高血压药通过肾脏和(或)肝脏代谢不同,本品在血液和组织中代谢,不在体内产生蓄积。信息来源:中国医药123网
注射用无菌粉末需要测定渗透压吗?使用时是溶解在0.9%氯化钠或5%葡萄糖中,静脉滴注。 我是这么想的:药品溶解在0.9%氯化钠或5%葡萄糖,其渗透压应该是略微变大的吧,这样还有必要做这个实验吗? 我看了下2010药典,渗透压的标准是多少啊?注射用无菌粉末都没有表明渗透压范围啊?但是我找一些注射液的标准里面就有具体的渗透压范围。
http://simg.instrument.com.cn/bbs/images/default/emyc1007.gif这是很久以前做的一个方法,拿来参加原创大赛,支持液相色谱版。由于涉及公司产品,文中部分信息隐去,请见谅。--------------------------------------------------------------------------------------------------HPLC测定注射用帕米膦酸二钠中的亚磷酸含量 注射用帕米膦酸二钠的原料帕米膦酸二钠结构稳定,对光、热等均不敏感,正常的储存条件下不易产生降解产物。亚磷酸作为帕米膦酸二钠的合成原料,属于制剂中的有关物质。我们参考相关资料,对注射用帕米膦酸二钠中的亚磷酸含量测定进行了研究。测定法:“取本品,加水制成每1ml中含帕米膦酸二钠10mg的溶液,摇匀,滤过,作为供试品溶液;另取亚磷酸适量,精密称定,加水制成每1ml中约含0.05mg的溶液,作为对照品溶液。照高效液相色谱法测定,用阴离子色谱柱;以**溶液为流动相,示差检测器检测;柱温为35℃,流速为1.0ml/min。取对照品溶液和供试品溶液各50μl注入液相色谱仪,供试品溶液的色谱图中如出现与对照品溶液相应的杂质峰,其峰面积不得大于对照品溶液主峰面积(0.5%)”仪器与试药:LC-10A液相色谱仪配示差检测器,亚磷酸对照品购自SIGMA。线性:取亚磷酸对照品0.1020g,加水溶解并稀释至100ml,分别精密量取1,2,3,4,5ml,置100ml量瓶中,加水至刻度,摇匀,制备成约含亚磷酸10,20,30,40,50mg/L的标准曲线序列,依法测定:浓度mg/L峰面积10.20799120.401559730.60[font=Times
http://simg.instrument.com.cn/bbs/images/default/emyc1007.gif支持分坛团队和化学药分析版。我公司产品注射用帕米膦酸二钠执行标准为《中国药典》2010年版二部。含量测定项下的内容为:“【含量测定】照离子色谱法(附录 V J)测定色谱条件与系统适用性试验用阴离子交换色谱柱;以3mmol/L草酸溶液为流动相,流速为每分钟1.2ml;检测器为电导检测器。理论板数按帕米瞵酸二钠峰计算不低于2000。”我们在检测中发现,含量测定色谱柱的理论塔板数下降较快。经研究,将流动相由“3mmol/L草酸溶液”改变为“**溶液”,可使柱效明显稳定。方法学验证结果显示,变更后的方法准确、可靠。可用于我公司产品注射用帕米膦酸二钠含量测定。1仪器与试药1.1仪器岛津LC-20A高效液相色谱仪,配CDD-10A VP电导检测器。所用仪器和量具均经校准或检定。1.2试药对照品帕米膦酸二钠(经160℃干燥至恒重,按干燥品计含量100.2%,按100%计。)。辅料、水为超纯水。2方法与结果2.1色谱条件色谱柱Dionex IonPac AS22阴离子交换色谱柱(4 mm ×250 mm),配保护柱(4 mm ×50 mm);流动相**溶液;检测器为电导检测器;柱温35℃;流速1.2ml/min。进样量为20μl。理论塔板数按帕米膦酸二钠峰计算应不低于2000。2.2溶液的制备2.2.1空白辅料储备液:取辅料适量,按处方配成溶液备用。2.2.2空白辅料溶液:取空白辅料储备液5ml置于50ml容量瓶中,加水定容至刻度。2.2.3对照品溶液:精密称取帕米膦酸二钠对照品约30mg,置于50ml容量瓶中,用水溶解并定容。2.2.4供试品溶液:精密称取帕米膦酸二钠对照品适量(根据不同验证项目,称取不同量),置于50ml容量瓶中,加水溶解后,加入5ml空白辅料储备液并用水定容。2.3专属性试验空白溶剂:水。取空白溶剂、空白辅料溶液、对照品溶液、供试品溶液,照2.1色谱条件,依法测定,记录色谱图。(附图略)结果显示,对照品溶液和供试品溶液的色谱图中帕米膦酸二钠峰与其他峰之间分离度良好,分离度大于1.5;空白溶剂及空白辅料溶液色谱图中在帕米膦酸二钠峰处无干扰峰。本方法有良好的专属性。2.4 线性关系及范围精密称取帕米膦酸二钠对照品14.58、24.28、30.58、36.13、45.80 mg,分别置50ml量瓶中,用水适量溶解后,加入5ml空白辅料储备液并用水定容,摇匀,制成每1ml中含帕米膦酸二钠0.2916、0.4856、0.6116、[/fon

《中国药典》2015年版四部P491"甘油(供注射用)"有如下图片内容。我们生产的注射液使用甘油(供注射用)作为辅料,注射液为最终灭菌产品,请问作为辅料的甘油,是否还需要检验无菌?我的理解是,由于产品是最终灭菌产品,作为辅料,控制微生物限度和细菌内毒素是必要的,因此不需要无菌检验,但是,也有不同意见,说因为生产的注射液属于无菌制剂,且由于其生产过程无除菌工艺,因此,图中的“无菌(供无除菌工艺的无菌制剂用)”这一项应该进行检测。如此,我认为还是矛盾,如果无菌都检测,微生物限度还有必要测吗?另外,最终灭菌的产品,有必要对其辅料检测无菌吗?谢谢!
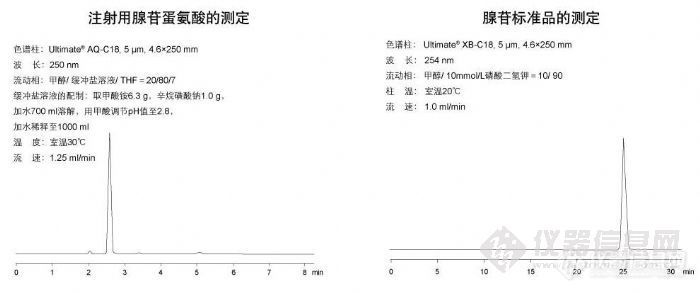
【作者中文名】苏红; 王爱民; 王永林; 兰燕宇; 何迅; 李勇军;【作者英文名】SU Hong; WANG Ai-min; WANG Yong-lin; LAN Yan-yu; HE Xun; LI Yong-jun(School of Pharmacy; Guiyang Medical College; Guiyang 550004; China);【作者单位】贵阳医学院药学院; 贵阳医学院药学院 贵州贵阳; 贵州贵阳;【摘要】目的:采用RP-HPLC建立注射用辛芍(冻干粉针)的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,80%乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,流速1.0 mL.min-1,柱温40℃,检测波长为230 nm。结果:在相同色谱条件下获得药材、中间体和制剂的各色谱峰分离较好,建立了注射用辛芍的HPLC对照指纹图谱,标注了制剂中的8个共有指纹峰,制剂与药材、中间体的指纹图谱有良好的相关性,10批样品相似度大于0.97,达到指纹图谱的技术要求。结论:该方法准确、重复性好,可作为注射用辛芍(冻干粉针)质量控制的重要依据之一。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131742_383598_2379123_3.jpg
谁做过注射用左卡呢汀?我们做有关物质时在主峰后面约2分多的位置上经常会有一个小峰,有它在有关物质就不合格。这个小峰时而出现,时而不出现。曾经做过原料、辅料的对比。辅料没有峰,同样的检测条件,原料也有一个类似的峰,但原料检验是合格的(用原料的质量标准检验)。恳请高人帮忙指导!
有关注射用水的条款讨论2007版GMP认证检查评定标准第*3402内容如下:注射用水的制备、储存和分配应能防止微生物的滋生和污染,储罐的通气口应安装不脱落纤维的疏水性除菌滤器,储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环。生物制品生产用注射用水应在制备后6小时内使用;制备后4小时内灭菌72小时内使用。有人认为生物制品生产用注射用水只要满足:制备后6小时内使用;制备后4小时内灭菌72小时内使用。就可以了我认为生物制品生产用注射用水既要满足:储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环;又要满足:在制备后6小时内使用;制备后4小时内灭菌72小时内使用。大家怎样理解啊?请参与!
药友制药紧急召回炎琥宁 10余名婴幼儿用后休克 中国消费者报http://i1.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_oozdma.jpg 图1为重庆药友制药有限公司生产的注射用炎琥宁。洪敬谱/摄 http://i2.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_aZmg7E.jpg 图2为幼儿正在医院抢救的情景。资料图片 本报合肥讯(记者洪敬谱)9月初,安徽省合肥市10余名婴幼儿因为感冒发烧在安徽医科大学第一附属医院(以下简称安医大第一医院)治疗后,普遍出现休克状况。经医院积极救治,这些孩子目前病情稳定。9月11日中午,合肥市药品不良反应监测中心致电本报记者称,目前正在对这些婴幼儿使用的注射用炎琥宁进行检测,会及时向本报公布检测结果。目前,重庆药友制药有限责任公司已将该省内使用的生产批号为12102863、规格为80mg的注射用炎琥宁全部召回。 9月9日晚上,合肥市民刁先生等10多位婴幼儿家长向本报记者反映称,自己的孩子在安医大第一医院看病输液,之后出现休克情况,家长们怀疑使用的药品存在安全问题。
注射用头孢西丁钠生产工艺验证方案[~74687~]
作者:鲁瑞娟; 薛静; 曹晓云;天津市药品检验所; 中美天津史克制药有限公司; 天津市药品检验所 天津;摘要:目的:采用高效液相色谱法测定注射用头孢他啶的有关物质。方法:迪马钻石柱C18色谱柱(4.6 mm×150mm,5μm),流动相为三乙胺醋酸溶液-水-乙腈(12∶924∶70),用1 mol/L醋酸溶液调节pH值至5.0,检测波长为254 nm,以主成分自身对照外标法进行结果计算。结果:头孢他啶0~0.3μg范围内呈良好的线性关系,r=0.999 7,最低检出量为0.005μg。结论:本法检测注射用头孢他啶中有关物质的含量,简便、快速,结果准确。
本人急需注射用头孢他啶(Ceftazidime)和注射用头孢米诺钠(Cefminox sodium)EP6.0的标准,复印件也行,谢谢!
最近做项目时接触到某注射用冻干粉针的组分问题,想请教大家一下。在做液相组分时,原料的某一个组分的检测结果是89.5%,而对其生产的注射用冻干粉针进行液相组分检测时,该组分的含量是87.7%。这个过程中原料和成品的组分含量是不是不应该相差这么大?会是什么原因导致有这样的差距呢?原料和成品的组分检测是由不同人在不同仪器不同色谱柱上完成的。请教大家~多多指教!

小小的一个注射用水,其检测项目多达11项!包括性状、pH值、氨、硝酸盐、亚硝酸盐、电导率、总有机碳、不挥发物、重金属、细菌内毒素和微生物限度等。今天,就说说我曾经在检测总有机碳时遇到的问题。总有机碳,Total Organic Carbon,简称TOC,是以碳的含量表示水体中有机物质总量的综合指标,可以很直接地用来表示有机物的总量。测量这个,必须用到TOC检测仪。http://ng1.17img.cn/bbsfiles/images/2013/12/201312250009_484402_1609327_3.jpg其基本原理是:先把水中有机物的碳氧化成二氧化碳,消除干扰因素后由二氧化碳检测器测定,再由数据处理把二氧化碳气体含量转换成水中有机物的浓度。测TOC,需要配置蔗糖对照品溶液和1,4-对苯醌对照品溶液,分别对应于易氧化的有机物和难氧化的有机物,来对仪器做系统适用性验证。当年刚入手做,即便是系统适用性验证合格,做注射用水样品的时候,还是得不到稳定的值,一次测量和一次测量的差异很大,甚至有的时候得到的测量值还大于rs-rw的差值。一个过来人告诉我,测量样品的时候,最好可以找个保鲜膜盖住瓶口,这个测的的数据会稳定一些。一试,真的是还行!原来是空气中的二氧化碳会对测量结果产生影响,最好是一个密闭的容器。后来者可以据此少走一些弯路。http://ng1.17img.cn/bbsfiles/images/2013/12/201312250012_484403_1609327_3.jpg最近做的几批样品的结果罗列一下:批号:131213;TOC=0.256mg/L。批号:131217;TOC=0.243mg/L。批号:131220;TOC=0.279mg/L。

本季度最后一题啦,明天发布新的活动,4月5日正式开始哦问题:注射用生长抑素使用了哪几款迪马液相色谱柱?答案:Diamonsil C18(2)、DiamonsilC18、PlatisilODS、LeapsilC18【活动奖励】幸运奖(2钻石币):抽奖软件,当天随机抽取3个回答正确的版友ID号(最后一个ID号,截止至下午3:00),每人奖励2个钻石币中奖名单:大川之子,纵横四海(注册ID:chuangu120)莫名其妙(注册ID:moyueqiu)捌道巴拉巴巴巴(注册ID:v3082413) http://ng1.17img.cn/bbsfiles/images/2016/03/201603311507_588753_1610895_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/03/201603311507_588754_1610895_3.png积分奖励:所有回答正确的版友奖励10个积分(幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================注射用生长抑素样品制备 制备方法有关物质衍生溶液:取生长抑素对照品约10 mg, 置20 mL量瓶中,加30%过氧化氢溶液1 mL,室温放置1小时,加水稀释至刻度,摇匀,滤过。含量测定对照品溶液:取生长抑素对照品适量,加水溶解并定量稀释制成每1 mL中含0.1 mg的溶液。分析条件(有关物质) 色谱柱Diamonsil C18(2) 150 x 4.6 mm,5 μm (Cat#:99601)流动相流动相A:磷酸溶液(磷酸11 mL,水800 mL,三乙胺调节pH值至2.3,水稀释至1000 mL)流动相B:乙腈梯度流速1.5 mL/min柱温30 ℃检测器UV 215 nm进样量50 μL分析条件(含量测定) 色谱柱Diamonsil C18(2) 150 x 4.6 mm, 5 μm (Cat#:99601)流动相磷酸溶液(取磷酸11 mL,加水800 mL,用三乙胺调节pH值至2.3,用水稀释至1000 mL):乙腈=75:25流速1.5 mL/min柱温30 ℃检测器UV 215 nm进样量20 μL色谱图有关物质衍生溶液 http://ng1.17img.cn/bbsfiles/images/2017/01/201701191701_668671_1610895_3.jpg 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数 N USP拖尾因子 分离度 1 7.872 23415461 2524270 14857.155 1.162 -- 2 8.880 1681853 224587 27122.661 1.026 4.256 含量测定对照品溶液http://ng1.17img.cn/bbsfiles/images/2017/10/2016033110035836_01_1610895_3.jpg 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数* N USP拖尾因子 分离度 1 5.293 2227963 179980 4039.560 1.026 -- *药典要求理论板数按生长抑素峰计算不低于1500本品种同时使用了DiamonsilC18、PlatisilODS、LeapsilC18三款色谱柱,在药典规定条件下进行检测,均满足药典要求。
【第十一届原创】HPLC法测定注射用头孢他啶聚合物含量1样品简介注射用头孢他啶,主要成份为头孢他啶,加适量碳酸钠做助溶剂。2.仪器设备、试剂与对照品2.1仪器设备:waters e2695高效液相色谱仪赛托利斯 CPA225D分析天平色谱柱:天津开发区色谱分析仪器有限公司葡聚糖G-10 凝胶色谱柱 400mm×14mm2.2试剂:硫酸铵(AR) 广州化学试剂厂磷酸二氢钠(AR) 广州化学试剂厂磷酸氢二钠(AR) 广州化学试剂厂碳酸钠(AR) 广州化学试剂厂2.3 对照品:头孢他啶(来源是齐鲁安替制药有限公司,批号为WST-C-8034EJ82JC,含量85.81%)蓝色葡聚糖2000(来源是Bei Jing Biodee Biotechnology Co.Ltd,批号为9004-54-01,含量100%)3.色谱条件流动相:以含3.5%硫酸铵的pH7.0的0.1mol/L磷酸盐缓冲液为流动相A,以水为流动相B,波长:254nm 流速:0.8ml/min 温度:室温洗脱方式:等度 进样体积:100ul4.样品制备4.1系统适用性溶液制备4.1.1 1.5mg/ml蓝色葡聚糖2000溶液制备:称取37.5mg蓝色葡聚糖2000至25ml容量瓶中,加水溶解并稀释至刻度,摇匀。4.1.2 系统适用性溶液制备:称取头孢他啶约0.2g 与碳酸钠20mg,置10ml量瓶中,用1.5mg/ml的蓝色葡聚糖2000溶液溶解并稀释至刻度,摇匀。4.2 对照溶液制备取头孢他啶对照品约12mg,精密称定,加水溶解并定量制成每1ml中约含0.1mg的溶液。4.3供试品溶液制备取本品,按标示量加水溶解并定量稀释制成每1ml中含20mg的溶液,照头孢他啶项下的方法测定,含头孢他啶聚合物的量不得过标示量的1.0%。4.4测定法4.4.1 量取100μl系统适用性溶液注入液相色谱仪,用流动相A进行测定,记录色谱图。高聚体的峰高与单体和高聚体之间的谷高比应大于1.5。4.4.2 量取1.5mg/ml蓝色葡聚糖2000溶液100μl注入液相色谱仪,分别以流动相A,B进行测定,记录色谱图。按蓝色葡聚糖2000峰计算理论板数均不低于500,拖尾因子均应小于2.0。在两种流动相系统中蓝色葡聚糖2000峰的保留时间比值应在0.93~1.07之间,对照溶液主峰与供试品溶液中聚合物峰与相应色谱系统中蓝色葡聚糖2000峰的保留时间的比值均应在0.93~1.07之间。4.4.3 另以流动相B为流动相,精密量取对照溶液100μl,连续进样5次,峰面积的相对标准偏差应不大于5.0%。5. 结果讨论系统适用性结果报告:流动相A中蓝色葡聚糖2000理论塔板数为1875,拖尾因子为0.93。流动相B中蓝色葡聚糖2000理论塔板数为1356,拖尾因子为0.79。在两种流动相中蓝色葡聚糖2000峰保留时间比值0.98,对照溶液主峰中聚合物峰与相应色谱系统中蓝色葡聚糖峰的保留时间比值为1.00,供试品溶液主峰中聚合物峰与相应色谱系统中蓝色葡聚糖峰的保留时间比值为1.00。系统适用性溶液以流动相A测定,记录图谱,高聚体的峰高与单体和高聚体之间的谷高比值为3.9。结果表明:葡聚糖G-10凝胶色谱柱能满足分析要求。[img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931500102_136_3170710_3.jpeg[/img][img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931501152_5601_3170710_3.jpeg[/img][img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931503923_2007_3170710_3.jpeg[/img][img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931506933_7008_3170710_3.jpeg[/img]
生物制品为什么不宜制成注射用浓溶液?浓缩成本太高?稀释液不易配制?浓缩后不易保存?到底是什么原因?
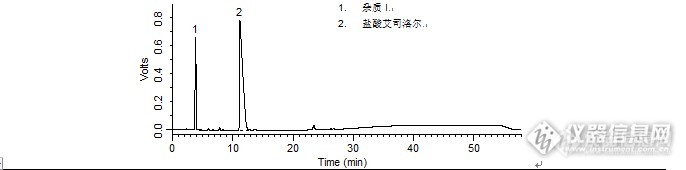
注射用腺苷蛋氨酸的测定和腺苷标准品的测定[img]http://ng1.17img.cn/bbsfiles/images/2009/11/200911021842_180183_1896702_3.jpg[/img]
大洋网3月7日报道 根据卫生部通知要求,黑龙江省卫生厅3月6日晚连夜发出内部明传电报,要求全省各级各类医疗机构立即停止使用吉林一心制药股份有限公司生产的注射用泮托拉唑钠。据悉,3月6日卫生部收到国家食品药品监督管理局通报,经吉林省食品药品监食管理局抽检,吉林一心制药股份有限公司生产的注射用泮托拉唑钠(批号为0809022、0810011、0810012、0810021、0810022)可见异物,检查不合格。国家食品药品监督管理局已于 3 月 6 日下发通知要求停止销售和使用该药品。黑龙江省卫生厅接到卫生部办公厅紧急通知后,连夜发出内部明传电报,要求各级各类医疗机构立即停止使用并封存该批号的药品,并做好相关记录,保证信息完整,可追溯。一经发现与该批药品有关的不良事件,要全力做好医疗救治工作,有效保护好患者的生命安全,并按照规定立即报告同级卫生行政部门和药监部门。目前,黑龙江省医疗机构药品不良反应监测系统尚未接到该药品发生不良事件的报告。(来源:中国广播网)
用了很久的超纯水了,换了个单位,发现在配流动性时用注射用水,电导率和cot都合格,不知是否可以,个人认为还是用超纯水好,大家说说自己的看法
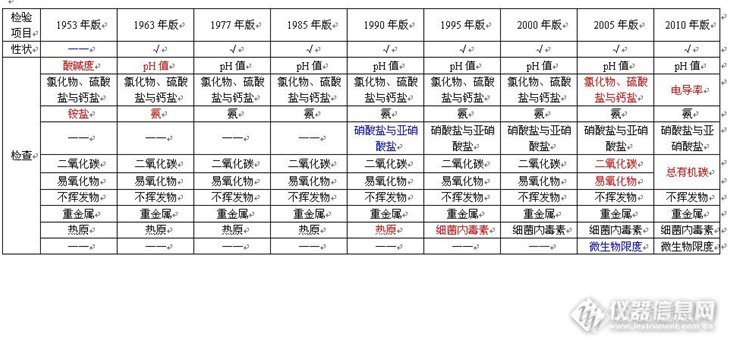
问题:注射用盐酸艾司洛尔:有关物质衍生溶液中杂质和盐酸艾司洛尔的分离度是多少?答案:10.154获奖名单:zengzhengce163(ID:zengzhengce163)WUYUWUQIU(ID:wulin321)dyd3183621(ID:dyd3183621)http://ng1.17img.cn/bbsfiles/images/2016/01/201601081731_581399_708_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/01/201601081732_581400_708_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/01/201601081732_581401_708_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/01/201601081732_581402_708_3.jpg活动奖励】幸运奖(2钻石币):抽奖软件,当天随机抽取3个回答正确的版友ID号(最后一个ID号,截止至下午3:00),每人奖励2个钻石币积分奖励:所有回答正确的版友奖励10个积分(幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。注射用盐酸艾司洛尔样品制备 制备方法含量测定对照品溶液:取盐酸艾司洛尔对照品,加水溶解并定量稀释制成每1 mL 约含50 μg 的溶液。有关物质衍生溶液:取盐酸艾司洛尔对照品约10 mg,置10 mL量瓶中,加入1 mol/L盐酸溶液1 mL,放置30分钟,加1 mol/L的氢氧化钠溶液1 mL使中和,用流动相A 稀释至刻度,摇匀。分析条件(含量测定) 色谱柱Diamonsil C18(2) 250 x 4.6 mm,5 μm (Cat#:99603)流动相乙腈:甲醇:磷酸盐缓冲液(取磷酸二氢钾3.0g,加水溶解并稀释至650 mL)=15:20:65 流速1 mL/min柱温30 ℃检测器UV 222 nm进样量20 μL 分析条件(有关物质) 色谱柱Diamonsil C18(2) 250 x 4.6 mm,5 μm (Cat#:99603)流动相流动相A :乙腈:甲醇:磷酸盐缓冲液(取磷酸二氢钾3.0 g,加水至650 mL)=15:20:65流动相B:甲醇梯度流速1 mL/min柱温30 ℃检测器UV 222 nm进样量20 μL 色谱图含量测定对照品溶液http://ng1.17img.cn/bbsfiles/images/2016/01/201601081023_581265_708_3.png 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数* N USP拖尾因子 分离度 1 9.345 677855 56730 13763.887 1.061 -- *药典要求理论板数按盐酸艾司洛尔峰计算不低于2000有关物质衍生溶液http://ng1.17img.cn/bbsfiles/images/2016/01/201601081025_581266_708_3.png 峰号 保留时间 min 峰面积 μV*s 峰高 μV 理论塔板数 N USP拖尾因子 分离度 1 3.842 6280189 655879 2747.059 0.670 -- 2 11.157 29271705
请问现在有注射用无菌粉末用卤化丁基橡胶塞(冻干用)了吗?现在我们用的标准是“YBB00052005 注射用无菌粉末用卤化丁基橡胶塞”,但里面是说明了此标准不适用于冻干橡胶塞,不过到现在都还没有找到冻干橡胶塞的标准。我查了下,在07年7月的时候有胶塞行业标准座谈会,说是“由中国医药包装协会牵头,上海食品药品包装材料测试所提供技术支持,部分胶塞厂家协助完成药用丁基橡胶塞协会标准的制订。标准制定分为产品标准和单项标准二部分:1、 产品标准包括:小容量注射液标准、冻干胶塞标准;2、 单项标准包括:外观及规格尺寸标准(含注射剂用丁基胶塞、输液用丁基胶塞、冻干用丁基胶塞、小容量注射液丁基胶塞);胶塞表面硅油含量均匀度标准;免洗胶塞标准等”那么现在标准出台了吗?座谈会见http://www.cnppa.org/index_newsInfo.jsp?id=264

10,抽取5个版友);中奖名单:大川之子,纵横四海(注册ID:chuangu120)牛一牛(注册ID:v2700892)吕梁山(注册ID:shih20j07)莫名其妙(注册ID:moyueqiu)翠湖园(注册ID:hhx050)http://ng1.17img.cn/bbsfiles/images/2017/03/201703011546_01_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2017/03/201703011546_02_1610895_3.jpg【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================注射用泮托拉唑钠有关物质的测定方法:HPLC基质:药品应用编号:102964化合物:泮托拉唑钠固定相:Platisil ODS色谱柱/前处理小柱:Platisil ODS 5u 250 x 4.6 mm样品前处理:有关物质: 取本品,加溶剂(0.001 mol/L氢氧化钠溶液-乙腈=1:1)溶解并制成每1 ml中含泮托拉唑0.4 mg的溶液,做为供试品溶液;精密量取1 ml,置100 ml量瓶中,用上述溶液稀释至客户,摇匀,做为对照溶液。色谱条件:色谱柱:Platisil C18,250×4.6 mm,5 μm (Cat#:99503) 流动相:流动相A:0.01 mol/L磷酸氢二钾溶液(用磷酸调pH至7.0) 流动相B:乙腈 T A 0 90 30 60 45 15 流速: 1.0 mL/min 柱温: 30 ℃ 检测器:UV 289 nm 进样量:20 μL文章出处:天津迪马实验室关键字:泮托拉唑钠;有关物质;铂金;Platisil C18;HPLC谱图:http://www.dikma.com.cn/Public/Uploads/images/11(21).PNGhttp://www.dikma.com.cn/Public/Uploads/images/22(1).PNGhttp://www.dikma.com.cn/Public/Uploads/images/33.PNG
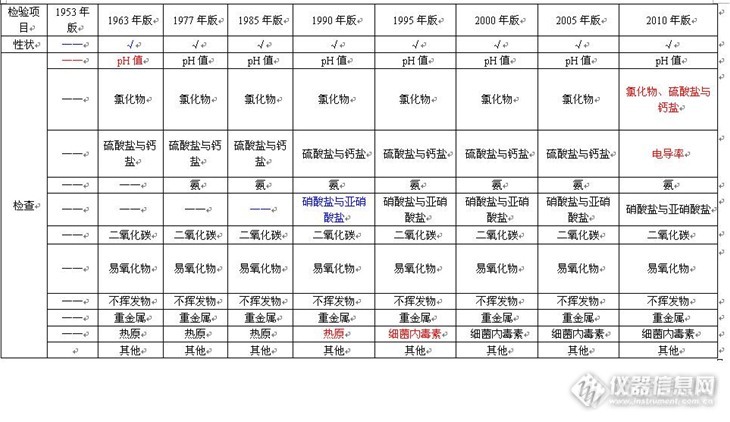
生病要打针吃药,打针需要用到灭菌药粉或注射剂。灭菌药粉就是粉末状的药物,这个且不说它。而注射剂又分为两类,一种为油性注射剂,另一种就是水针注射剂。生产水针注射剂,必须要用到注射用水。中国药典规定:注射用水必须为纯化水经蒸馏所得的水。这个注射用水,是制药企业最基础的原材料之一。不光配置药剂用的上,清洗仪器也要用。因此,我在这里说道说道和每个人都会发生联系的注射用水在中国药典中的演变历程。中国药典是制药行业的圭臬。中国药典从诞生的那一天起,就一直收录着“注射用水”这个品种,几十年走来,这个品种一直都存在,只是检验项目因为人们的认识水平的提高而发生了不少的改变。具体怎么个改变法,我想用一个表格来说明一下:http://ng1.17img.cn/bbsfiles/images/2013/12/201312262255_484901_1609327_3.jpg从表中可以看到:1. 1953年的版本,对“形状”没有专门规定,而从1963年开始,有了专业而具体的规定;2. 1953年命名为为“酸碱度”的检验项目,1963年更名为pH值,使得测狼更加科学与准确;3. 从1953年至2005年,一直沿用的是“氯化物、硫酸盐与钙盐”这个检验项目,2010年替换为电导率测量;4. 1953年为“铵盐”的检验项目,1963年改为“氨”的测定;5. 1985年之前,一直没有检验“硝酸盐与亚硝酸盐”,随着认识的提高,1985年版中国药典增加了该检验项目;6. 2010年版中国药典将以前的“二氧化碳”与“易氧化物”的检验项目,合并为“总有机碳”检验项目;7. 1953年至1990年,一直沿用的“热原”检验项目,在1995年更名为“细菌内毒素”;8. 从2005年版开始,增加了“微生物限度”检验项目。你知道检验项目进行修正的出发点和目的是什么吗?欢迎进行讨论。懒惰的人可以静等我的下回分解哦。
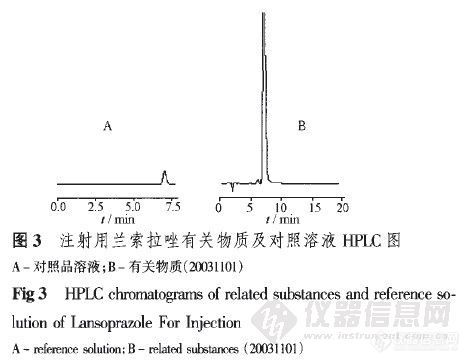
HPLC测定注射用兰索拉唑中兰索拉唑的含量和有关物质 杨艳,谢俊霞,李冰,孙英华,方金玲,刘艳,何仲贵”(沈阳药科大学药学院,沈阳110016)摘要:目的采用高效液相色谱法建立注射用兰索拉唑有关物质检查及其含量测定方法。方法Diamonsil—c18柱(4.6 l_mm×200 mm,5um),以甲醇.水一三乙胺.磷酸(640:360:5:1.5,pH为7.3)为流动相,检测波长为284Ⅲn。结果制剂中辅料对主药测定无干扰,兰索拉唑与有关物质完全分离。在10.0~400.0 mg·L一内峰面积与浓度呈良好的线性关系。精密度(RsD=0.13%)良好。平均回收率为99.6%。结论 本方法简便,迅速,准确,专属性强。关键词:高效液相色谱法;注射用兰索拉唑;含量测定;有关物质http://ng1.17img.cn/bbsfiles/images/2012/07/201207241917_379474_2355529_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/07/201207241917_379475_2355529_3.jpg
注射用水与纯化水的水质区别 如将美国药典中纯化水与注射用水的水质标准作一比较,就可看出二者的主要区别。它们的理化指标相同,但注射用水对热原及微生物的要求高于纯化水。表1.1列出了美国药典中纯化水和注射用水热原和微生物的区别。 表1.1 美国药典中纯化水与注射用水热原和微生物的区别 种 类 项 目纯化水注射用水 微生物100CFU/mL 10CFU/100mL 热原 不指定 0.25EU/mL 生产方法 蒸馏 离子交换 反渗透 其他适当的方法蒸馏 反渗透 纯化水与注射用水二者的区别还在于制水工艺,纯化水的制备工艺可以有各种选择,但各国药典对注射用水的制备工艺均有限定条件,如美国药典明确规定注射用水的制备工艺只能是蒸馏及反渗透,中国药典则规定注射用水的生产工艺必须是蒸馏。这些是各国根据本国的实际情况用以保证注射用水质量的必要条件。
打过针的同学都知道,打点滴用的是生理盐水或者葡萄糖水。而屁股针或皮下针一般都是用的灭菌注射用水。药剂或者灭菌药粉用灭菌注射用水稀释或者溶解后,才能正常使用。不然,就有可能不治病,反致命!所谓灭菌注射用水,就是灭过菌的注射用水。因为注射用水一般是用蒸馏纯化水的方法得到的。学过物理的同学都知道,水在100℃的时候就会沸腾变成水蒸气,也就是说,这种蒸馏方式得到的注射用水,最高也就经受了100℃温度的洗礼。学过生物的同学还知道,100℃的温度,对于嗜热的细菌以及耐热的芽孢来说,完全就是泡一次澡而已。要想干掉这些致命的玩意儿,必须下狠招,也就是说,必须来上更猛烈的“暴风雨”!因此,利用高压灭菌锅,利用蒸汽的压力,可以产生115℃的温度,30分钟内杀灭其中的所有生灵(相对概念上的意义哦)!这样,才能保证我们用药的安全。中国药典中规定了灭菌注射用水的检验标准。只有检验合格的灭菌注射用水才是安全的。而灭菌注射用水的检验标准,随着时代的流逝,也经历了一些变化。具体见下表:http://ng1.17img.cn/bbsfiles/images/2013/12/201312272159_485078_1609327_3.jpg其演变的历程与注射用水的历程同步。主要为以下:1. 灭菌注射用水与注射用水相比较,检验项目的设置基本一致,但是限度更低,更为苛刻;2. 1953年版没有关于灭菌注射用水的描述,可能与当时的认识水平有关;3. 1953年的版本,对“形状”没有专门规定,而从1963年开始,有了专业而具体的规定;4. 1953年命名为为“酸碱度”的检验项目,1963年更名为pH值,使得测量更加科学与准确;5. 从1953年至2005年,一直沿用的是“氯化物、硫酸盐与钙盐”这个项目名称,2010年替换为电导率测量;6. 1953年为“铵盐”的检验项目,1963年改为“氨”的测定;7. 1985年之前,一直没有检验“硝酸盐与亚硝酸盐”,随着认识的提高,1985年版中国药典增加了该检验项目;8. 2010年版中国药典将以前的“二氧化碳”与“易氧化物”的检验项目,合并为“总有机碳”检验项目;9. 1953年至1990年,一直沿用的“热原”检验项目,在1995年更名为“细菌内毒素”;10. 从2005年版开始,增加了“微生物限度”检验项目。
做注射用粉针剂装量时,去除标签有什么好方法?大多标签都贴得很严,尤其是胶很粘,不知各位有什么好办法去掉。
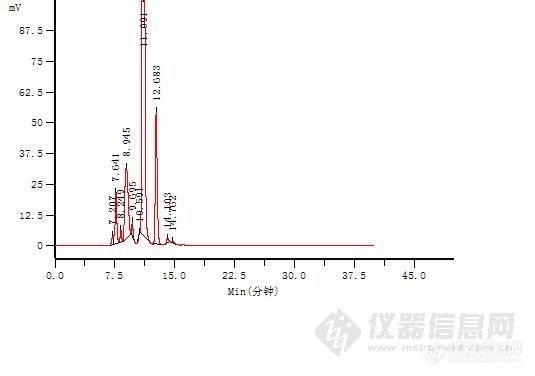
高效分子排阻色谱法测定注射用盐酸头孢替安高分子杂质头孢替安是杀菌性头孢菌素类广谱抗生素,头孢替安不但对革兰氏阳性菌有效,而且对革兰氏阴性菌。如流感嗜血杆菌,大肠杆菌、克雷白氏菌、奇异变形杆菌等的作用更强。对肠杆菌,枸橼酸杆菌、吲哚阳性变形杆菌等,也有抗菌作用头孢替安在肺中药物浓度较高,其它脏器和肌肉也有一定的浓度。临床应用于敏感菌所导致的感染,如肺炎、支气管炎、胆道感染、腹膜炎、尿路感染以及手术后或外伤引起的感染和败血症等。其基本结构同已上市的的头孢菌素类抗生素一样,头孢替安也会形成高分子聚合物,也会在临床使用中引发速发型过敏反应。对患者危害极大。已有的注射用盐酸头孢替安国家药品标准未将盐酸头孢替安高分子聚合物列为检定项目,国内的药学研究也未见头孢替安高分子聚合物的研究和报道。从临床用药安全性考虑,根据中国药典2010年版二部附录凝胶色谱原理。采用常用的葡聚糖凝胶G-10检测聚合物时由于头孢替安分子结构自身的原因,头孢替安不能完全缔合,因些我们采用高效分子排阻色谱法,以球状蛋白色谱用亲水硅胶为填充剂 TOSOH TSKgelG2000SW(7.5*300mm),测定注射用盐酸头孢替安高分子杂质1.仪器与试剂(1)仪器:岛津LC-10ATvp泵 岛津SPD-10AVP紫外可见光多波长检测器 浙大2010色谱数据工作站 色谱柱:TOSOH TSKgelG2000SW(7.5*300mm) (2)试剂: 乙腈 (色谱纯,天津市四友生物医学技术有限公司) 磷酸氢二钠(分析纯,北京化学试剂公司) 磷酸二氢钠(分析纯,北京化学试剂公司)双蒸水 (自制)2 色谱条件色谱柱:TOSOH TSKgelG2000SW(7.5*300mm)流动相:磷酸盐缓冲液(p H:6.8[/color
请问有谁知道注射用无菌粉末怎样测定渗透压摩尔浓度?谢谢